Las fosfodiesterasas de nucleótidos cíclicos (PDEs) de la subfamilia 4 (PDE4) son responsables de la hidrólisis y compartimentalización subcelular del adenosín monofosfato cíclico (AMPc), segundo mensajero que modula la funcionalidad vascular. Habíamos demostrado que la isoforma B de la PDE4 (PDE4B) se induce en el aneurisma de aorta abdominal (AAA) y que la inhibición de la actividad PDE4 mediante rolipram limita la formación de aneurismas experimentales. En este estudio hemos profundizado en los mecanismos que subyacen al efecto beneficioso del rolipram sobre el AAA.
MétodosSe ha utilizado el modelo de inducción de AAA por infusión de angiotensina II (Ang II) en ratones con apolipoproteína E ApoE-/−. La formación de aneurismas se ha evaluado mediante ultrasonografía. La expresión de enzimas implicados en el control de la homeostasis rédox se ha analizado por reacción en cadena de la polimerasa con transcriptasa reversa (RT-PCR) en tiempo real y la activación de vías de señalización mediante Western blot.
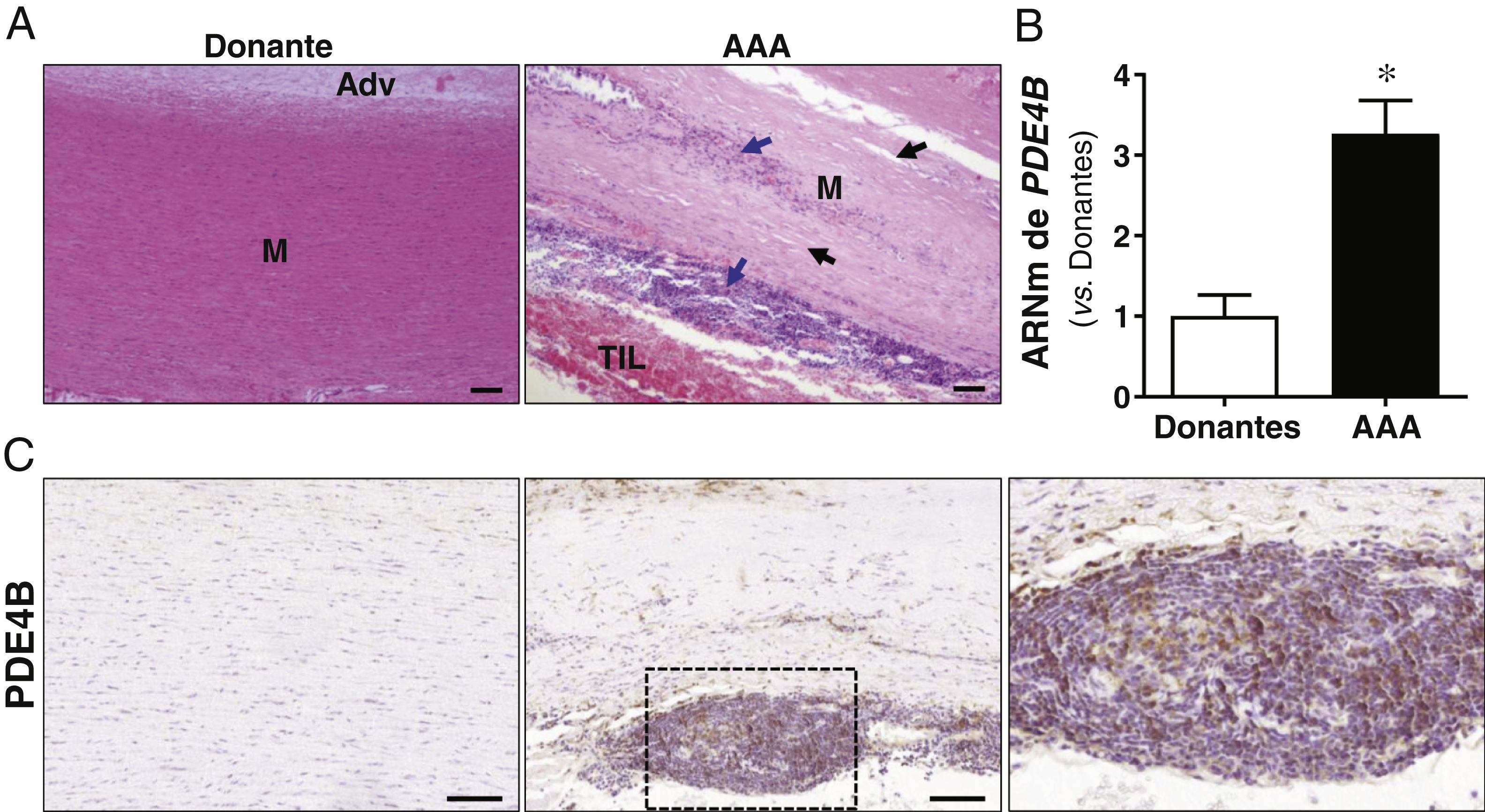
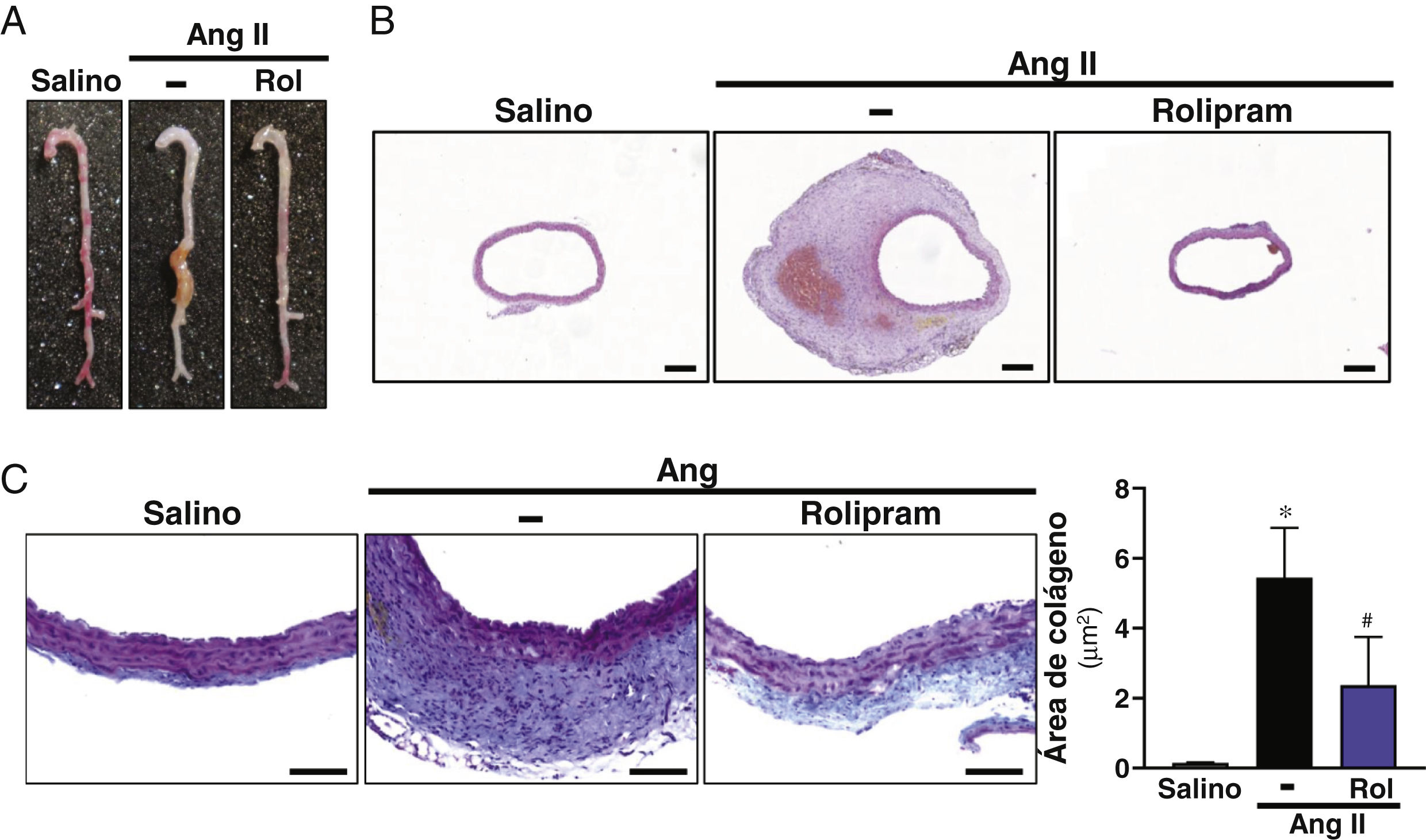
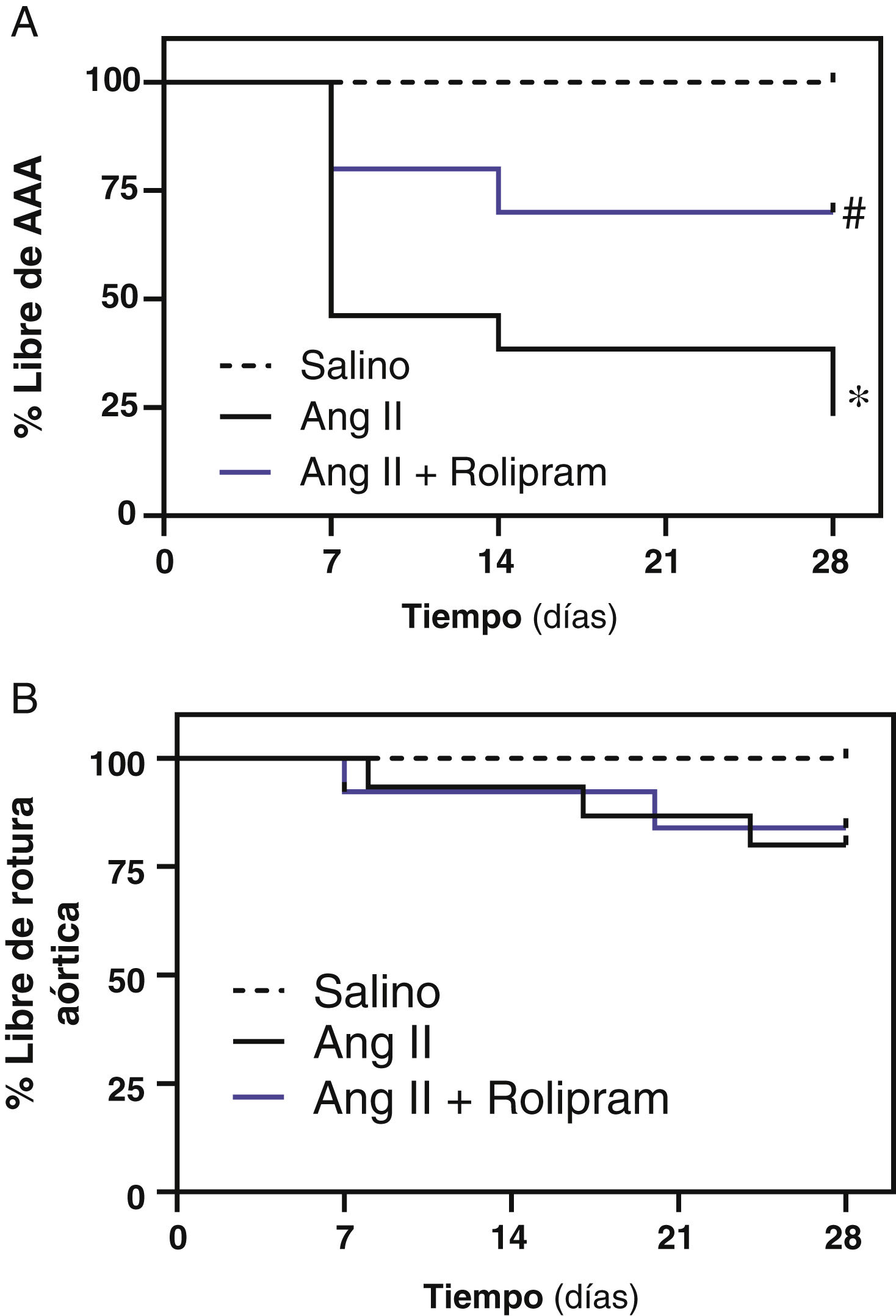
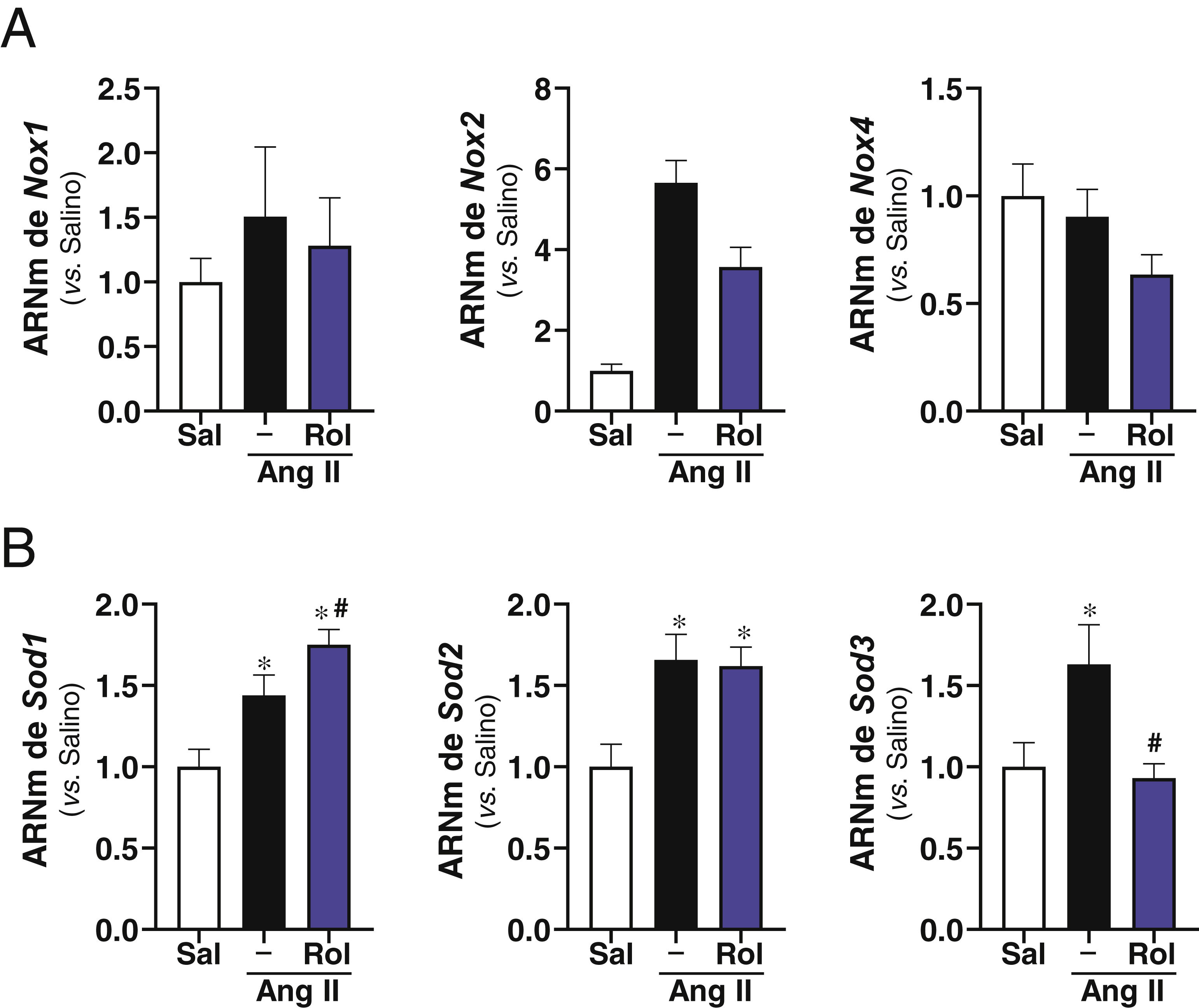
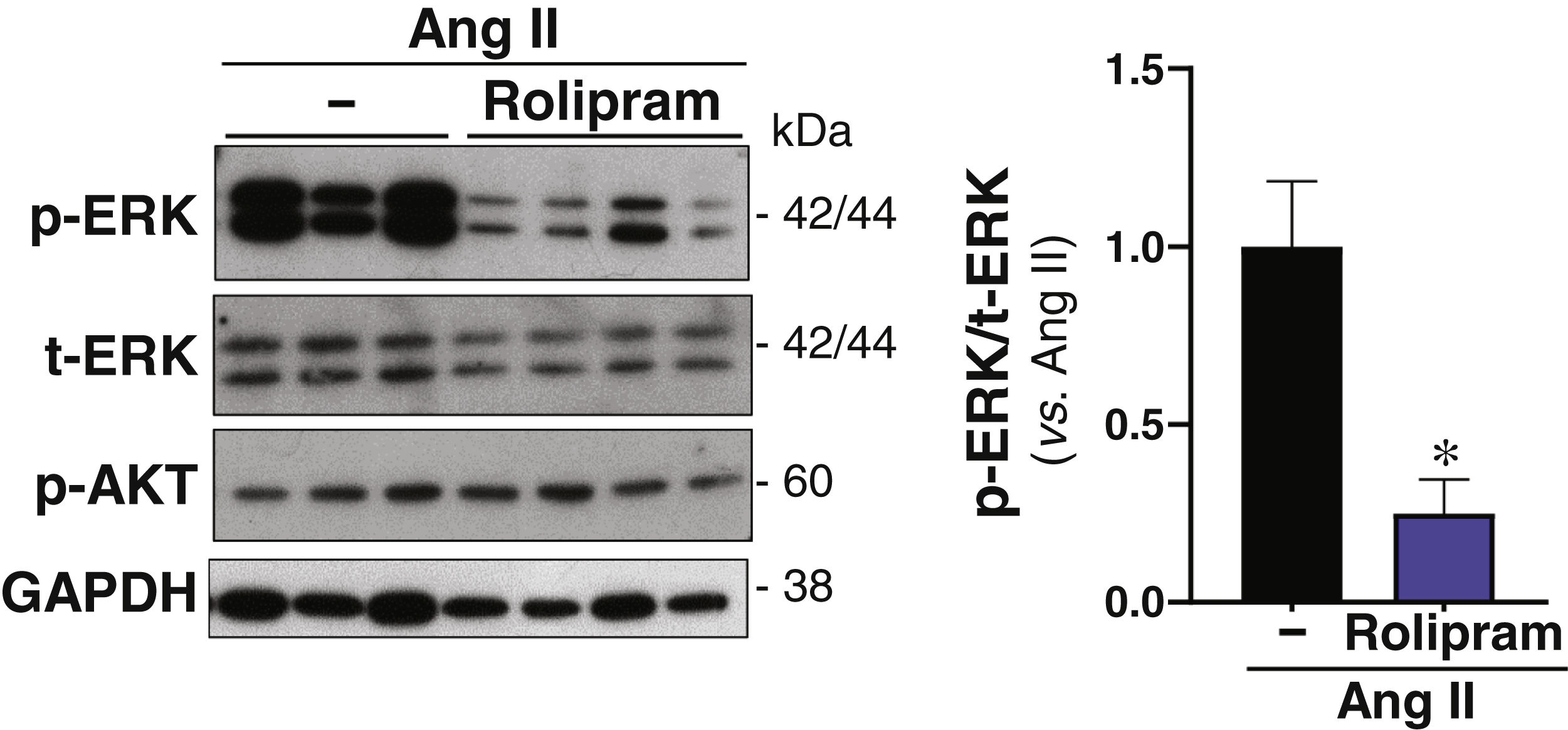
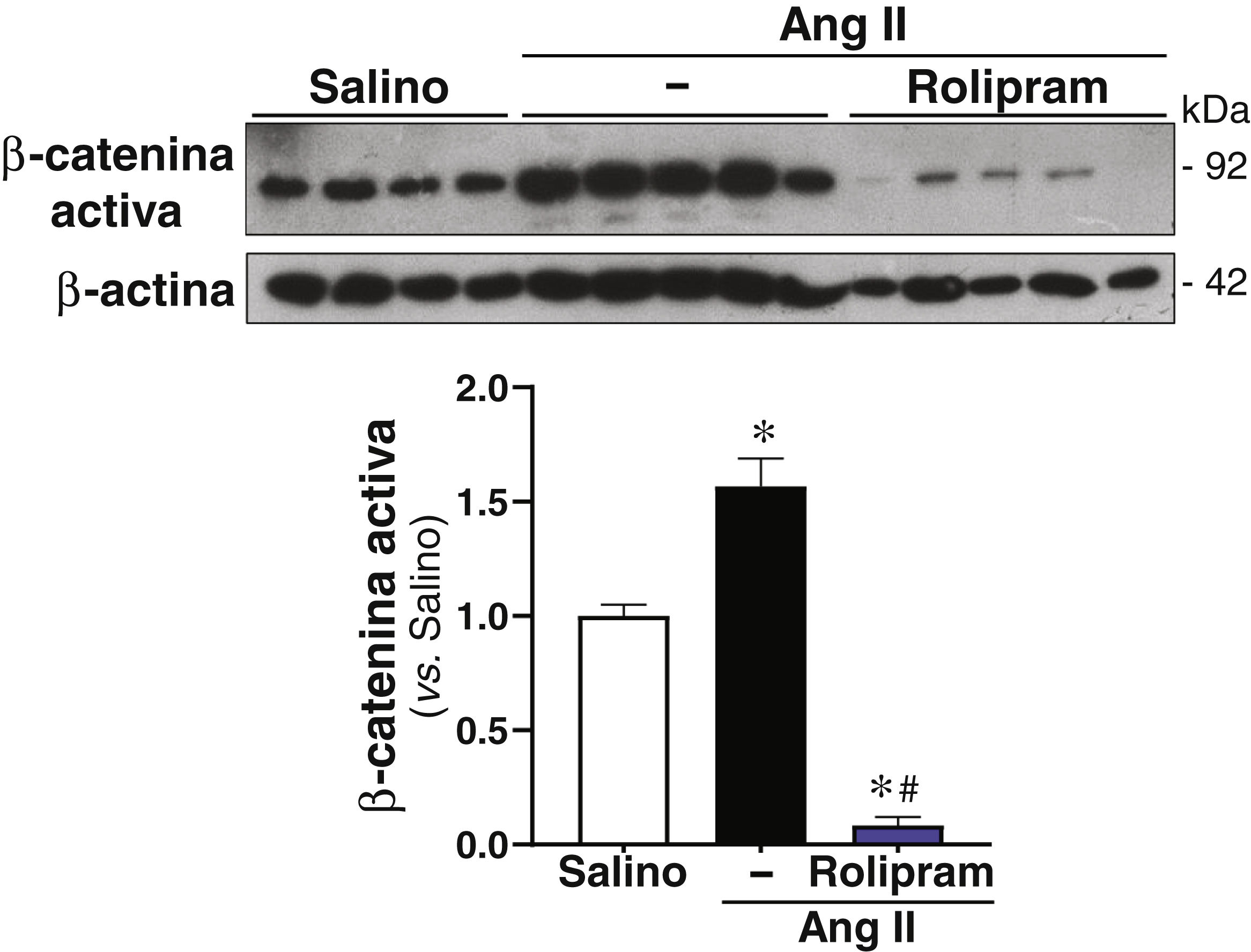
ResultadosSe ha confirmado la inducción de la PDE4B en el AAA humano en otra cohorte de pacientes. En ratones ApoE-/- infundidos con Ang II el rolipram incrementó el porcentaje de animales libres de aneurisma sin afectar al de rotura aórtica. Análisis cuantitativos determinaron que este fármaco atenuó significativamente la deposición de colágeno en la aorta. Además, el rolipram redujo el incremento en la expresión de Nox2 en respuesta a la Ang II, promovió una mayor inducción del nivel de ARNm de Sod1 y normalizó la expresión de Sod3. Asimismo, la inhibición de PDE4 disminuyó la activación de la Extracellular Signal-Regulated Kinase 1/2 (ERK1/2) y de la vía canónica de Wnt, mientras la actividad de la proteína cinasa B (AKT) no se vio alterada.
ConclusionesLa inhibición de la actividad PDE4 modula la expresión de enzimas implicados en la homeostasis rédox y afecta a vías de señalización celular implicadas en el desarrollo de la patología aneurismática.
Cyclic nucleotide phosphodiesterases (PDEs) of the PDE4 subfamily are responsible for the hydrolysis and subcellular compartmentalization of cAMP, a second messenger that modulates vascular functionality. We had shown that PDE4B is induced in abdominal aortic aneurysms (AAA) and that PDE4 inhibition by rolipram limits experimental aneurysms. In this study we have delved into the mechanisms underlying the beneficial effect of rolipram on AAA.
MethodsAAA were induced in ApoE-/− mice by angiotensin II (Ang II) infusion. Aneurysm formation was evaluated by ultrasonography. The expression of enzymes involved in rédox homeostasis was analyzed by real-time RT-PCR and the activation of signaling pathways by Western blot.
ResultsInduction of PDE4B in human AAA has been confirmed in a second cohort of patients. In Ang II-infused ApoE-/− mice, rolipram increased the percentage of animals free of aneurysms without affecting the percentage of aortic ruptures. Quantitative analyses determined that this drug significantly attenuated aortic collagen deposition. Additionally, rolipram reduced the increased Nox2 expression triggered by Ang II, exacerbated Sod1 induction, and normalized Sod3 expression. Likewise, PDE4 inhibition decreased the activation of both ERK1/2 and the canonical Wnt pathway, while AKT activity was not altered.
ConclusionsThe inhibition of PDE4 activity modulates the expression of enzymes involved in rédox homeostasis and affects cell signaling pathways involved in the development of AAA.