La parathormona (PTH) es un componente del metabolismo mineral (MM) que ha demostrado aportar valor pronóstico en los pacientes con cardiopatía isquémica crónica (CIC) y función renal preservada. Sin embargo, la influencia de la función renal en el papel pronóstico de la PTH en los pacientes con CIC aún no se ha demostrado.
ObjetivoEvaluar la influencia del filtrado glomerular renal estimado (FGRe) sobre el papel pronóstico de la PTH y otros marcadores del MM en los pacientes con CIC.
MétodosAnalizamos el valor pronóstico de distintos componentes del MM (PTH, klotho, fósforo, calcidiol y factor de crecimiento de fibroblastos-23 [FGF23]) en 964 pacientes con CIC incluidos en 5 hospitales de Madrid en función de si presentaban FGRe <60ml/min/1,73m2 (LFGR) o FGRe≥60ml/min/1,73m2 (HFGR). El objetivo primario fue la combinación de muerte con eventos isquémicos (cualquier síndrome coronario agudo, accidente cerebrovascular isquémico o accidente isquémico transitorio). El FGR se calculó mediante el método Chronic Kidney Disease Epidemiology Collaboration equation (CKD-EPI).
ResultadosLa edad era de 60,0 (52,0-72,0) años y el 76,2% de los casos eran varones, con una mediana del FGRe de 80,4 (65,3-93,1)ml/min/1,73m2. El seguimiento fue de 5,39 (2,81-6,92) años. Setecientos noventa pacientes presentaron HGFR y 174 LGFR. En pacientes con HFGR, los predictores del endpoint combinado fueron los niveles plasmáticos de calcidiol (HR=0,023 [0,94-0,99], p=0,023); FGF23 (HR=1,00 [1,00-1,003], p=0,036); colesterol no-HDL (HR=1,01 [1,00-1,01], p=0,026) y troponina de alta sensibilidad (HR=5,12 [1,67-15,59], p=0,004), junto con la edad (HR=1,03 [1,01-1,05], p=0,01), el tratamiento con estatinas (HR=0,36 [0,19-0,68], p=0,002); nitratos (HR=1,13 [1,07-2,79], p=0,027); dihidropiridinas (HR=1,71 [1,05-2,77], p=0,032); verapamilo (HR=5,71 [1,35-24,1], p=0,018) e inhibidores de la bomba de protones (HR=2,23 [1,36-3,68], p=0,002). En el subgrupo LFGR, los predictores de muerte o eventos isquémicos fueron los niveles plasmáticos de PTH (HR por cada 10 unidades de PTH=1,01 [1,02-1,11], p=0,008), el FGRe (HR=0,96 [0,94-0,99], p=0,001); la edad (HR=1,06 [1,02-1,10] p=0,003); la raza caucásica (HR=0,04 [0,004-0,355], p=0,004) y el tratamiento con insulina (HR=2,34 [1,11-4,95], p=0,026).
ConclusionesEn pacientes con CIC, la PTH es un predictor independiente de mala evolución solo en aquellos con FGRe<60ml/min/1,73m2, mientras que en los pacientes con FGRe≥60ml/min/1,73m2, el calcidiol y el FGF23 se convierten en los únicos componentes del MM que pueden predecir el pronóstico. Por lo tanto, la función renal influye en el poder predictivo de los componentes del MM en los pacientes con CIC.
Parathormone (PTH) is a component of the Mineral Metabolism (MM) system that has been shown recently to add prognostic value in pts. with stable coronary artery disease (SCAD) and average renal function. However, the influence of renal function on the prognostic role of PTH in pts. with SCAD has not been shown yet.
PurposeTo assess the influence of estimated glomerular filtration rate (eGFR) on the prognostic role of PTH and other MM markers in pts. with SCAD.
MethodsWe analyzed the prognostic value of MM markers (PTH, klotho, phosphate, calcidiol [25-hydroxyvitamin D], and fibroblast growth factor-23 [FGF23]) in 964 pts. with SCAD and eGFR<60ml/min/1.73 m2 (LGFR) vs pts. with eGFR≥60ml/min/1.73 m2 (HGFR) included in five hospitals of Madrid. The main outcome was the combination of death with ischemic events (any acute coronary syndrome, ischemic stroke or transient ischemic attack). eGFR was calculated by the Chronic Kidney Disease Epidemiology Collaboration equation (CKD-EPI).
ResultsAge was 60.0 (52.0-72.0) years, 76.2% of patients were men, and eGFR was 80.4 (65.3-93.1) ml/min/1,73 m2. Median follow-up was 5.39 (2.81-6.92) years. There were 790 pts. with HGFR and 174 with LGFR. In HGFR pts., predictors of ischemic events or death were plasma levels of calcidiol [HR=0.023 (0.94-0.99) p=0.023], FGF23 [HR=1.00 (1.00-1.003) p=0.036], non-HDL cholesterol [HR=1.01 (1.00-1.01) p=0.026] and high sensitivity troponin I [HR=5.12 (1.67-15.59) p=0.004], along with age [HR=1.03 (1.01-1.05) p=0.01], treatment with statins [HR=0.36 (0.19-0.68) p=0.002], nitrates [HR=1.13 (1.07-2.79) p=0.027], dihydropyridines [HR=1.71 (1.05-2.77) p=0.032], verapamil [HR=5.71 (1.35-24.1) p=0.018], and proton-pump inhibitors [HR=2.23 (1.36-3.68) p= 0.002]. In the LGFR subgroup, predictors of death or ischemic events were PTH plasma levels, [HR=1.01 (1.00-1.01) p=0.005], eGFR [HR=0.96 (0.94-0.99) p=0.004], age [HR=1.06 (1.02-1.10) p=0.003], caucasian race [HR=0.04 (0.004-0.380) p=0.005], and treatment with insulin [HR=2.6 (1.20-5.63) p=0.015].
ConclusionsIn pts. with SCAD, PTH is an independent predictor of poor outcomes only in those with eGFR<60ml/min/1.73 m2, while in pts. with eGFR≥60ml/min/1.73 m2 calcidiol and FGF23 become the only components of MM that may predict prognosis. Then, renal function influences the predictive power of MM markers in pts. with SCAD.
El metabolismo mineral (MM) incluye varios componentes, como el calcidiol o vitamina D, el factor de crecimiento de fibroblastos 23 (FGF23), la parathormona (PTH) y el fósforo, que pueden estar relacionados con la incidencia de enfermedades cardiovasculares. La vitamina D ha llamado la atención por su relación con el desarrollo de enfermedades cardiovasculares, ya que un déficit de vitamina D se asocia con un aumento en la incidencia de eventos cardiovasculares adversos1,2. El FGF23 es una hormona fosfatúrica que ayuda al riñón enfermo a eliminar el fósforo y disminuye los niveles excesivos de vitamina D3. Los niveles plasmáticos altos de FGF23 se han asociado con un aumento de la mortalidad, insuficiencia cardíaca e hipertrofia del ventrículo izquierdo4,5. De manera similar, un incremento de los niveles plasmáticos de PTH se relacionan con hipertensión, hipertrofia del ventrículo izquierdo y un aumento de los eventos cardiovasculares6–9. Recientemente, la forma soluble de klotho, el correceptor de FGF23, se ha asociado con efectos protectores cardiorrenales e incluso se le han atribuido propiedades antienvejecimiento10,11. A pesar de esta evidencia, no hay estudios que exploren la influencia de la función renal en el papel pronóstico de todos los componentes mencionados del MM en pacientes con cardiopatía isquémica crónica (CIC). Por lo tanto, el objetivo de este estudio es evaluar la influencia del filtrado glomerular renal estimado (FGRe) sobre el papel pronóstico de la PTH y otros marcadores del MM en los pacientes con CIC.
Material y métodosPacientesSe incluyeron en este estudio 969 pacientes con CIC, que habían sufrido un síndrome coronario agudo 6-12 meses antes. Estos pacientes formaban parte de los estudios BACS & Biomarkers in Acute Coronary Syndrome & Biomarkers in Acute Myocardial Infarction (BAMI), llevados a cabo en 5 hospitales de la Comunidad de Madrid. Los criterios de inclusión y exclusión se han definido previamente12. Entre julio de 2006 y junio de 2014, 2.740 pacientes fueron dados de alta de los hospitales con diagnóstico de síndrome coronario agudo sin elevación de ST (SCASEST) o infarto agudo de miocardio con elevación de ST (IAMCEST). Se excluyeron 1.483 pacientes por: edad mayor de 85 años (16,4%), presencia de trastornos o hábitos tóxicos que limitaban la supervivencia (29,8%), imposibilidad de realizar revascularización cardíaca (9,6%), coexistencia de otras cardiopatías significativas (5,7%), imposibilidad de realizar seguimiento (11,9%), trastornos mentales concomitantes (4,4%), inestabilidad clínica más allá del sexto día posterior al evento índice (10,9%), negativa a participar en el estudio (1,5%) e imposibilidad de los investigadores para incluirlos (9,8%). Finalmente, se incluyeron 1.257 pacientes. En el ingreso se registraron las variables clínicas y se realizó la extracción de plasma sanguíneo para su análisis.
Los pacientes tuvieron una segunda visita 6 a 12 meses después del alta hospitalaria, y se recogieron de nuevo variables clínicas y se realizó una segunda extracción de plasma. El presente trabajo es un subestudio del estudio BACS & BAMI, y reporta los datos de los hallazgos clínicos y analíticos obtenidos en el momento de esta segunda extracción de plasma, relacionándolos con los datos obtenidos durante el seguimiento posterior. De los 1.257 pacientes incluidos en la fase aguda, 284 no acudieron al hospital para la segunda extracción de plasma y 4 fueron excluidos por desarrollar un cáncer antes de esta segunda visita. Por tanto, 969 pacientes tenían muestras de plasma adecuadas para el presente análisis. La extracción de plasma y las visitas basales se realizaron entre enero de 2007 y diciembre de 2014. Las visitas finales se realizaron en junio de 2016.
Declaración de éticaEl protocolo del estudio se realizó según las directrices éticas de la Declaración de Helsinki de 1975 y fue aprobado por los comités de investigación en humanos de las instituciones participantes en este estudio: Fundación Jiménez Díaz, Hospital Fundación Alcorcón, Hospital de Fuenlabrada, Hospital Universitario Puerta de Hierro-Majadahonda y Hospital Universitario de Móstoles. Todos los pacientes firmaron el consentimiento informado.
Diseño del estudioSe registraron las variables clínicas y se extrajeron muestras de sangre venosa tras ayunas de 12h, y se recogieron en tubo de EDTA entre 6 y 12 meses después del alta hospitalaria por el evento isquémico agudo. Las muestras de sangre se centrifugaron a 2.500g/durante 10min y el plasma se almacenó a −80°C. Los pacientes fueron atendidos en su hospital según protocolos asistenciales. Al final del seguimiento se revisaron las historias clínicas y se confirmó el estado del paciente mediante contacto telefónico.
Se dividió a la población en función de si presentaban o no un FGRe<60ml/min/1,73m2 y se buscó qué variables se asociaron con mal pronóstico en cada uno de los grupos.
El objetivo primario fue la combinación de eventos isquémicos agudos (cualquier síndrome coronario agudo, accidente cerebrovascular y ataque isquémico transitorio) y mortalidad por todas las causas. El SCASEST se definió como angina de reposo que duró más de 20min en las 24h previas, o angina de clase III-IV de nueva aparición, junto con descenso transitorio del ST o inversión de la onda T en el electrocardiograma considerado diagnóstico por el cardiólogo que trataba al paciente y/o elevación de troponina. Para el diagnóstico de IAMCEST se requería un cuadro compatible con angina de más de 20min de duración y elevación de ST en 2 derivaciones adyacentes del electrocardiograma sin respuesta a la nitroglicerina y elevación de la troponina. El accidente cerebrovascular se definió como la aparición rápida de un déficit neurológico atribuible a una causa vascular focal que duraba más de 24h o con evidencia de nuevas lesiones isquémicas cerebrales en los estudios de imagen. Un accidente isquémico transitorio se definió como un accidente cerebrovascular transitorio con signos y síntomas que se resolvieron antes de las 24h sin lesiones isquémicas agudas cerebrales en las técnicas de imagen. Los eventos fueron ratificados por al menos dos investigadores del estudio, junto con un neurólogo para el diagnóstico de los eventos cerebrovasculares. Aunque se registraron todos los eventos para cada caso, los pacientes fueron excluidos del análisis de regresión de Cox después del primer evento. Así, aunque también se describe el número total de eventos, los pacientes que tuvieron más de un evento se computaron solo una vez para estos análisis.
Estudios analíticos y de biomarcadoresLas determinaciones plasmáticas se realizaron en el Laboratorio de Nefrología del Hospital Gómez Ulla y en el Laboratorio de Bioquímica de la Fundación Jiménez Díaz. Los investigadores que realizaron los estudios de laboratorio desconocían los datos clínicos. Los niveles plasmáticos de calcidiol se cuantificaron mediante inmunoanálisis quimioluminiscente (CLIA) en el analizador LIAISON® XL (LIAISON® 25OH-Vitamin D total Assay, DiaSorin, Saluggia, Italia), los niveles de FGF23 se midieron mediante un ensayo inmunoabsorbente ligado a enzimas que reconoce epítopos dentro de la porción carboxilo-terminal de FGF23 (Human FGF23, C-Term, Immutopics Inc, San Clemente, CA, EE. UU.), los niveles de klotho se cuantificaron por ELISA (kit de ensayo de alfa klotho soluble humano, Immuno-Biological Laboratories Co., Japón), la PTH intacta se analizó por un método de segunda generación automática de quimioluminiscencia (plataforma Elecsys® 2010, Roche Diagnostics, Mannheim, Alemania), el fosfato se determinó mediante un método enzimático (analizador Integra® 400, Roche Diagnostics, Mannheim, Alemania), la troponina de alta sensibilidad (TnHs) se evaluó mediante quimioluminiscencia directa (ADVIA® Centaur; Siemens, Berlín, Alemania), la porción amino terminal del pro BNP (NT-pro-BNP) se determinó por inmunoanálisis (VITROS®, Ortho Clinical Diagnostics, EE. UU.) y la proteína C reactiva de alta sensibilidad (PCR) se evaluó mediante inmunoturbidimetría mejorada con látex (ADVIA® 2400 Chemistry System, Siemens, Alemania). Las determinaciones de lípidos, glucosa y creatinina se realizaron mediante métodos estándar (ADVIA® 2400 Chemistry System, Siemens, Alemania). La proproteína convertasa subtilisina/kexina tipo 9 (PCSK9) se determinó por duplicado mediante ELISA con anticuerpos específicos anti-PCSK9 (kit ELLA®, R&D Systems). El FGRe se calculó mediante la ecuación Chronic Kidney Disease Epidemiology Collaboration equation (CKD-EPI).
Análisis estadísticoLos datos cuantitativos se muestran como mediana (rango intercuartílico) y las variables cualitativas se presentan como porcentajes. La normalidad de las variables se contrastó mediante el test de Kolmogorov-Smirnov o Shapiro-Wilk según tamaño muestral de cada variable. Para comparar los valores basales entre los 2 grupos según presentaron o no FGRe<60ml/min/1,73m2 se usó la prueba de Chi-cuadrado de Pearson o la prueba exacta de Fisher en las variables cualitativas. En el caso de las variables cuantitativas se usó la t de Student o la prueba de Mann-Whitney, según la distribución fuera normal o no respectivamente. Se dividió a la población en función de si presentaban o no un FGRe<60ml/min/1,73m2 y se realizó una regresión de Cox univariada para analizar qué variables se asociaron con el desarrollo de los diferentes desenlaces en cada uno de los grupos. Después, se realizó en ambos grupos un análisis de regresión multivariado incluyendo aquellas variables que alcanzaron una p<0,20 en los análisis univariados. Los análisis se realizaron con IBM® SPSS® Statistics for Windows, version 19.0. Armonk, NY: IBM Corp. y se consideraron significativos cuando «p» era inferior a 0,05 (2 colas).
ResultadosPacientesDe los 969 pacientes incluidos 5 se perdieron en el seguimiento, dejando 964 pacientes para el análisis. La edad era de 60,0 (52,0-72,0) años, el 76,2% de los casos eran varones y la mediana del FGRe era de 80,4 (65,3-93,1) ml/min/1,73m2. El tiempo transcurrido desde el síndrome coronario agudo previo fue de 6,5 (6,2-7,6) meses.
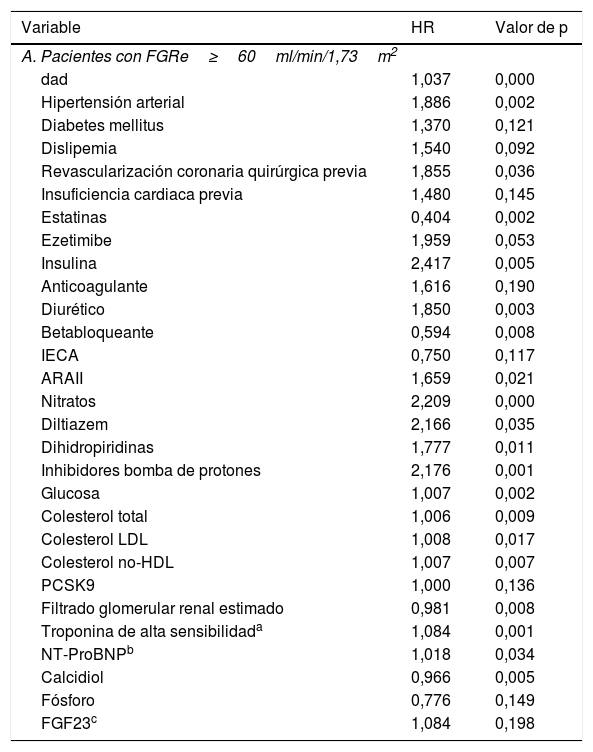
Las características basales de la población según el FGRe se detallan en la tabla 1. Los pacientes con FGRe<60ml/min/1,73m2, eran mayores, presentaban un mayor porcentaje de mujeres y mayor tasa de comorbilidades (hipertensión, diabetes, enfermedad arterial periférica, disfunción ventricular, insuficiencia cardiaca y fibrilación auricular). Analíticamente destacaban la presencia de niveles más altos de triglicéridos, PCR, troponina I de alta sensibilidad, NT-ProBNP, fósforo, FGF23 y PTH, con niveles más bajos de klotho.
Características basales de los pacientes según su función renal
| Variable | FGRe≥60ml/min/1,73m2N=790 | FGRe<60ml/min/1,73m2N=174 | Valor de p |
|---|---|---|---|
| Edad (años) | 58,0 (50,0-67,0) | 74,0 (67,0-79,0) | <0,001 |
| Sexo femenino (%) | 19,7 | 42,0 | <0,001 |
| Raza caucásica (%) | 96,3 | 98,9 | 0,088 |
| Índice de masa corporal (kg/m2) | 28,1 (25,6-30,7) | 27,6 (25,67-30,2) | 0,591 |
| Fumador (%) | 15,3 | 7,5 | 0,005 |
| Hipertensión arterial (%) | 59,5 | 85,6 | <0,001 |
| Diabetes (%) | 22,8 | 29,9 | 0,047 |
| Dislipemia (%) | 71,7 | 77,0 | 0,205 |
| Enfermedad arterial periférica (%) | 2,8 | 8,0 | 0,001 |
| Enfermedad cerebrovascular (%) | 1,6 | 8,0 | <0,001 |
| Cirugía revascularización coronaria previa (%) | 6,6 | 14,4 | 0,001 |
| Fracción eyección del ventrículo izquierdo <40 (%) | 6 | 11,8 | 0,008 |
| Insuficiencia cardiaca previa (%) | 9,4 | 21,8 | <0,001 |
| Fibrilación auricular previa (%) | 4,6 | 14,4 | <0,001 |
| Tratamiento | |||
| Aspirina (%) | 94,3 | 90,2 | 0,047 |
| Antagonistas P2Y12 (%) | 77,3 | 66,7 | 0,003 |
| Anticoagulantes (%) | 4,3 | 10,9 | 0,001 |
| Estatinas (%) | 95,7 | 90,8 | 0,008 |
| Estatinas alta potencia (%) | 58,9 | 55,7 | 0,451 |
| Ezetimibe (%) | 4,1 | 4,6 | 0,743 |
| Insulina (%) | 4,9 | 14,4 | <0,001 |
| Antidiabéticos orales (%) | 16,7 | 19,0 | 0,474 |
| IECA (%) | 63,5 | 58,0 | 0,175 |
| ARAII (%) | 14,3 | 20,1 | 0,054 |
| Antagonistas de la aldosterona (%) | 6,1 | 9,8 | 0,079 |
| Betabloqueante (%) | 78,6 | 81,0 | 0,476 |
| Diltiazem (%) | 2,8 | 2,3 | 1,000 |
| Verapamilo (%) | 0,4 | 0 | 1,000 |
| Dihidropiridina (%) | 12,0 | 21,8 | 0,001 |
| Diuréticos (%) | 15,6 | 33,3 | <0,001 |
| Nitratos (%) | 10,5 | 24,1 | <0,001 |
| Inhibidores de la bomba de protones (%) | 70,3 | 63,8 | 0,095 |
| Digoxina (%) | 0,3 | 0,6 | 0,450 |
| Suplementos de vitamina D (%) | 1,3 | 1,1 | 1,000 |
| Último síndrome coronario | |||
| IMCEST/SCASEST (%) | 50,5/49,5 | 45,4/54,6 | 0,223 |
| Método de revascularización (%) | 0,033 | ||
| • No revascularización | 13,8 | 19,0 | |
| • Stent farmacoactivo | 53,5 | 46,6 | |
| • Stent convencional | 25,7 | 23,6 | |
| • Angioplastia simple | 2,9 | 2,3 | |
| • Cirugía revascularización coronaria | 4,1 | 8,6 | |
| Revascularización incompleta (%) | |||
| Parámetros analíticos | |||
| Glucosa (mg/dl) | 100,5 (91,0-114,2) | 101,0 (92,0-119,0) | 0,323 |
| Colesterol HDL (mg/dl) | 40,0 (35,0-47,0) | 42,0 (35,0-49,2) | 0,193 |
| Colesterol LDL (mg/dl) | 77,0 (64,7-92,0) | 76,0 (62,0-93,0) | 0,568 |
| Colesterol no-HDL (mg/dl) | 100,0 (84,0-118,0) | 101,0 (86,7-118,0) | 0,567 |
| Triglicéridos (mmol/l) | 100,0 (75,0-137,0) | 110,0 (78,0-158,2) | 0,018 |
| PCSK-9 (ng/ml) | 462,8 (373,3-568,9) | 463,0 (382,2-579,1) | 0,668 |
| FGRe (ml/min/1,73m2) | 84,8 (74,6-95,4) | 49,8 (41,5-55,6) | <0,001 |
| PCR-Hs (mg/l) | 0,9 (0,3-2,7) | 2,0 (0,6-4,5) | <0,001 |
| Nt-ProBNP (ng/l) | 152,5 (82,7-312,5) | 440,5 (223,7-1067,5) | <0,001 |
| Troponina alta sensibilidad (μg/l) | 0,002 (<0,001-0,008) | 0,009 (0,002-0,02) | <0,001 |
| Fósforo (mmol/l) | 3,1 (2,8-3,5) | 3,3 (2,9-3,7) | 0,001 |
| Calcidiol (mmol/l) | 19,3 (14,5-25,3) | 17,9 (13,2-25,1) | 0,232 |
| FGF23 (RU/ml) | 74,7 (57,3-94,9) | 104,8 (73,3-610,2) | <0,001 |
| Klotho (pg/ml) | 584,5 (492,5-704,8) | 493,1 (413,6-610,1) | <0,001 |
| PTH (ng/l) | 55,6 (43,7-71,4) | 71,2 (52,2-95,7) | <0,001 |
| Eventos clínicos | |||
| Evento trombótico | 11,1 | 16,1 | 0,069 |
| Muerte | 5,7 | 17,2 | <0,001 |
Características clínicas y analíticas de los pacientes en función de su filtrado glomerular.
ARA II: antagonista de los receptores de la angiotensina II; FGF23: factor de crecimiento de fibroblastos 23; FGRe: filtrado glomerular renal estimado; HDL: high density lipoprotein; IECA: inhibidor de la enzima convertidora de la angiotensina; IMCEST: infarto de miocardio con elevación del ST; LDL: low density lipoprotein; NT-ProBNP: porción amino terminal del pro BNP; PCSK-9: proproteína convertasa subtilisina/kexina tipo 9; PTH: parathormona; SCASEST: síndrome coronario agudo sin elevación del ST.
Durante una mediana de seguimiento de 5,39 (2,81-6,92), 168 pacientes desarrollaron el objetivo primario con un total de 191 eventos. Hubo 116 pacientes que desarrollaron un evento isquémico y 75 fallecieron. Veintitrés pacientes fallecieron además de tener un evento isquémico.
En cuanto a las 75 muertes observadas durante el seguimiento, 28 fueron de origen cardiovascular, 15 por cáncer, 9 por infección, 3 por insuficiencia renal, 3 por trastornos cognitivos avanzados, 2 por pancreatitis, 2 por hemorragia gastrointestinal, 2 por exacerbación de enfermedad pulmonar, 3 por otras causas y 8 de origen desconocido.
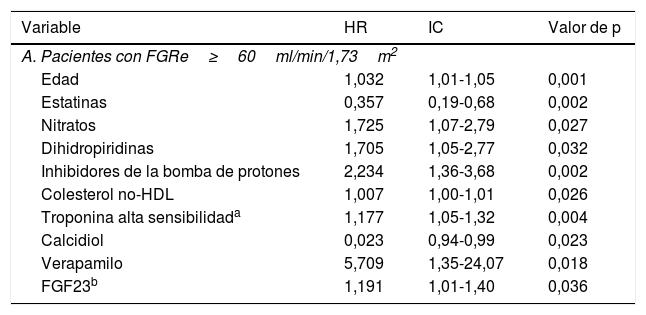
Valor pronóstico de los componentes del metabolismo mineral según el filtrado glomerular renal estimadoEn el análisis de Cox univariado en el grupo con un FGRe≥60ml/min/1,73m2 las variables que eran predictoras con una p<0,2 del desarrollo del objetivo primario fueron la edad, HTA, DM, DL, revascularización coronaria quirúrgica previa, IC previa, tratamiento con estatinas, ezetimibe, insulina, anticoagulación, diurético, BB, IECA/ARAII, nitratos, calcioantagonistas, inhibidores de la bomba de protones, y parámetros analíticos como la glucosa, colesterol total, LDL, no-HDL, PCSK9, FGRe, Tn, NT-ProBNP, calcidiol, fósforo y FGF23 (tabla 2A).
Análisis de Cox univariado cuya significación presente p<0,2 en función del FGRe
| Variable | HR | Valor de p |
|---|---|---|
| A. Pacientes con FGRe≥60ml/min/1,73m2 | ||
| dad | 1,037 | 0,000 |
| Hipertensión arterial | 1,886 | 0,002 |
| Diabetes mellitus | 1,370 | 0,121 |
| Dislipemia | 1,540 | 0,092 |
| Revascularización coronaria quirúrgica previa | 1,855 | 0,036 |
| Insuficiencia cardiaca previa | 1,480 | 0,145 |
| Estatinas | 0,404 | 0,002 |
| Ezetimibe | 1,959 | 0,053 |
| Insulina | 2,417 | 0,005 |
| Anticoagulante | 1,616 | 0,190 |
| Diurético | 1,850 | 0,003 |
| Betabloqueante | 0,594 | 0,008 |
| IECA | 0,750 | 0,117 |
| ARAII | 1,659 | 0,021 |
| Nitratos | 2,209 | 0,000 |
| Diltiazem | 2,166 | 0,035 |
| Dihidropiridinas | 1,777 | 0,011 |
| Inhibidores bomba de protones | 2,176 | 0,001 |
| Glucosa | 1,007 | 0,002 |
| Colesterol total | 1,006 | 0,009 |
| Colesterol LDL | 1,008 | 0,017 |
| Colesterol no-HDL | 1,007 | 0,007 |
| PCSK9 | 1,000 | 0,136 |
| Filtrado glomerular renal estimado | 0,981 | 0,008 |
| Troponina de alta sensibilidada | 1,084 | 0,001 |
| NT-ProBNPb | 1,018 | 0,034 |
| Calcidiol | 0,966 | 0,005 |
| Fósforo | 0,776 | 0,149 |
| FGF23c | 1,084 | 0,198 |
| B. Pacientes con FGRe<60ml/min/1,73m2 | ||
| Edad | 1,038 | 0,037 |
| Hipertensión arterial | 2,381 | 0,097 |
| Raza caucásica | 0,125 | 0,043 |
| Disfunción ventricular izquierda previa | 1,739 | 0,155 |
| Fibrilación auricular previa | 2,558 | 0,004 |
| Insuficiencia cardiaca previa | 2,147 | 0,011 |
| Estatinas | 0,359 | 0,006 |
| Insulina | 2,470 | 0,009 |
| Anticoagulante | 2,572 | 0,006 |
| Antialdosterónicos | 2,482 | 0,019 |
| Nitratos | 1,855 | 0,039 |
| Diltiazem | 3,155 | 0,055 |
| Dihidropiridinas | 1,713 | 0,075 |
| Digoxina | 28,157 | 0,002 |
| Filtrado glomerular renal estimado | 0,955 | 0,000 |
| NT-ProBNP | 1,000 | 0,000 |
| Fósforo | 1,993 | 0,003 |
| FGF23 | 1,001 | 0,000 |
| PTHd | 1,008 | 0,000 |
Variables relacionadas con el objetivo combinado (muerte o evento isquémico) con significación menor de 0,2 en el estudio univariado de Cox en la población dividida según su filtrado glomerular.
ARA II: antagonista de los receptores de la angiotensina II; FGF23: factor de crecimiento de fibroblastos 23; FGRe: filtrado glomerular renal estimado; HDL: high density lipoprotein; HR: hazard ratio; IECA: inhibidor de la enzima convertidora de la angiotensina; IMCEST: infarto de miocardio con elevación del STL; LDL: low density lipoprotein; NT-ProBNP: porción amino terminal del pro-BNP; PCSK-9: proteína convertasa subtilisina/kexina tipo 9; PTH: paratohormona; SCASEST: síndrome coronario agudo sin elevación del ST.
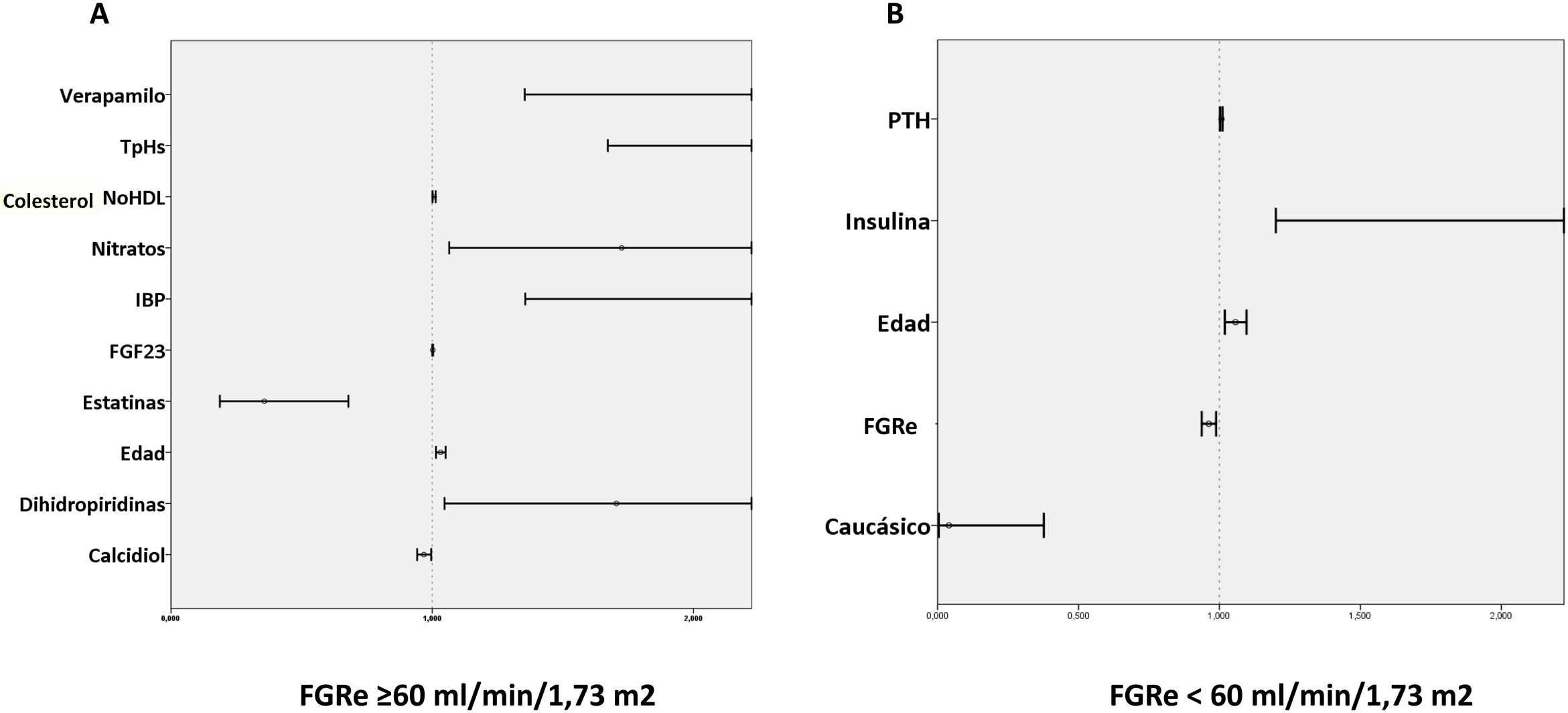
En el análisis multivariado los niveles plasmáticos de calcidiol y el tratamiento con estatinas se asociaron inversamente con el riesgo de desarrollar el objetivo primario, mientras que los niveles de colesterol no-HDL, troponina I de alta sensibilidad, la edad y el tratamiento con nitratos, dihidropiridinas, verapamilo e inhibidores de la bomba de protones se asociaron de modo directamente proporcional (tabla 3A y fig. 1A).
Análisis multivariado de Cox para la búsqueda de predictores de eventos adversos en función del FGRe
| Variable | HR | IC | Valor de p |
|---|---|---|---|
| A. Pacientes con FGRe≥60ml/min/1,73m2 | |||
| Edad | 1,032 | 1,01-1,05 | 0,001 |
| Estatinas | 0,357 | 0,19-0,68 | 0,002 |
| Nitratos | 1,725 | 1,07-2,79 | 0,027 |
| Dihidropiridinas | 1,705 | 1,05-2,77 | 0,032 |
| Inhibidores de la bomba de protones | 2,234 | 1,36-3,68 | 0,002 |
| Colesterol no-HDL | 1,007 | 1,00-1,01 | 0,026 |
| Troponina alta sensibilidada | 1,177 | 1,05-1,32 | 0,004 |
| Calcidiol | 0,023 | 0,94-0,99 | 0,023 |
| Verapamilo | 5,709 | 1,35-24,07 | 0,018 |
| FGF23b | 1,191 | 1,01-1,40 | 0,036 |
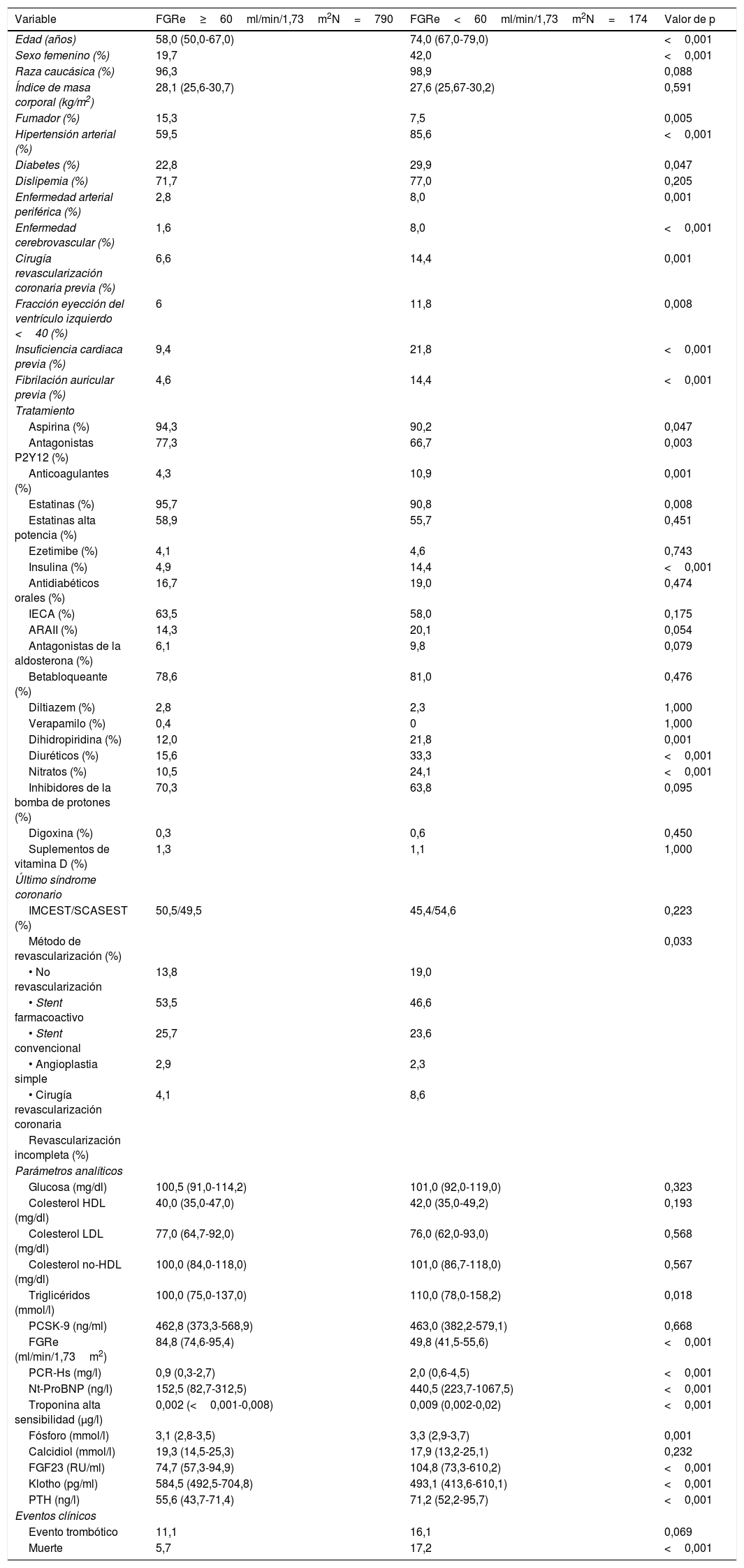
| B. Pacientes con FGRe<60ml/min/1,73m2 | |||
| Edad | 1,06 | 1,02-1,10 | 0,003 |
| Insulina | 2,34 | 1,11-4,95 | 0,026 |
| FGRe | 0,962 | 0,94,0,99 | 0,001 |
| Paratohormonac | 1,01 | 1,02-1,11 | 0,008 |
| Caucásico | 0,04 | 0,004-0,38 | 0,004 |
Variables relacionadas con el objetivo combinado (muerte o evento isquémico) con significación menor de 0,05 en el estudio multivariado de Cox en la población dividida según su filtrado glomerular.
FGF23: factor de crecimiento fibroblástico 23; FGRe: filtrado glomerular renal estimado; HDL: high density lipoprotein; HR: hazard ratio; IC: intervalo de confianza.
Predictores de evento trombótico o muerte según tengan o no FGRe<60ml/min/1,73m2. Gráfico de forest plot que muestra los predictores de eventos adversos en pacientes: A) con FGRe≥60ml/min/1,73m2 y B) con FGRe≥60ml/min/1,73m2.
FGF23: factor de crecimiento de fibroblastos 23; FGRe: filtrado glomerular renal estimado; HDL: high density lipoprotein; IBP: inhibidores de la bomba de protones; PTH: paratohormona; TpHS: troponina de alta sensibilidad.
Las variables asociadas con el desarrollo del objetivo primario en el grupo con un FGRe<60ml/min/1,73m2 fueron la edad, HTA, raza caucásica, disfunción ventricular previa, FA previa, IC previa, tratamiento con estatinas, insulina, anticoagulantes, antialdosterónicos, nitratos, calcioantagonistas, digoxina, y parámetros analíticos como el FGRe, NT-ProBNP, fósforo, FGF23 y PTH. (tabla 2B).
En el análisis multivariado los niveles plasmáticos de PTH, la edad, y el tratamiento con insulina se asociaron positivamente al desarrollo de eventos isquémicos o muerte durante el seguimiento, mientras que la raza caucásica y el FGRe lo hicieron de modo inverso (tabla 3B y fig. 1 B).
DiscusiónLas alteraciones del MM se han asociado tradicionalmente a la enfermedad renal crónica. Sin embargo, hemos descrito previamente que estas anomalías también están presentes en pacientes con enfermedad coronaria en presencia de función renal normal13. Además, estas alteraciones se asocian a un aumento de la incidencia de eventos cardiovasculares2,4,14.
El principal hallazgo del presente estudio es que los componentes del MM que pueden predecir el pronóstico de los enfermos con cardiopatía isquémica difieren según sea la función renal de los pacientes. En los pacientes que presentan FGRe≥60ml/min/1,73m2 los principales predictores de eventos adversos son el calcidiol y el FGF23. En cambio, en aquellos con FGRe<60ml/min/1,73m2 el principal predictor de mal pronóstico dentro de los diferentes componentes del MM es la PTH.
Recientemente hemos demostrado en esta misma población que la PTH es predictora de eventos cardiovasculares15. Sin embargo, el presente subanálisis demuestra que este resultado aplica a pacientes con insuficiencia renal en estadio 3 o más avanzado, pero no a los que tienen un FGRe de 60ml/min/1,73m2 o más. Por tanto, la capacidad predictiva de los componentes del MM puede variar en diferentes subgrupos de pacientes. De acuerdo con esto, hemos descrito previamente que existe una interacción entre el valor predictivo de los componentes del MM, ya que los niveles bajos de calcidiol predecían eventos cardiovasculares únicamente en presencia de niveles altos de FGF2314, pero no en casos con FGF23 bajo. Datos similares se han observado respecto a la función renal, ya que los pacientes en prediálisis con calcidiol bajo y FGF23 elevado tienen mayor probabilidad de precisar diálisis o de doblar los niveles de creatinina plasmática que los que presentan alterado solo uno de estos marcadores o tienen ambos en valores normales16.
Estos datos podrían tener relevancia a la hora de diseñar e interpretar los resultados de ensayos clínicos que investigan posibles beneficios de los aportes de vitamina D a nivel cardiovascular. En este sentido, es posible que los efectos positivos se concentren en determinados subgrupos de población determinados por la función renal y los niveles de FGF23. En este sentido, varios ensayos clínicos recientes no demostraron un efecto beneficioso del tratamiento con suplementos de vitamina D17–19, pero no conocemos si el análisis por subgrupos hubiera proporcionado resultados diferentes. Además, es importante tener en cuenta que el valor pronóstico de los diversos componentes del MM puede variar, según los objetivos clínicos que se estén analizando. Así, los niveles de calcidiol están más involucrados en la génesis y el desarrollo de aterosclerosis, habiéndose descrito que se relacionan con la calcificación vascular, la severidad de la enfermedad coronaria, y la incidencia de infarto agudo de miocardio y muerte cardiovascular2,6,15,20, por el contrario, los niveles plasmáticos de PTH se relacionan más con problemas miocárdicos. En este sentido, hemos descrito previamente que la PTH se asociaba con hipertrofia de ventrículo izquierdo en pacientes con CIC8.
Por último, este estudio tiene algunas limitaciones. En primer lugar, no se midieron los niveles de albúmina urinaria, por lo que se podrían haber infradiagnosticados estadios precoces de enfermedad renal crónica. Por otra parte, excluir pacientes sin estabilidad clínica durante los primeros días después del evento índice podría crear cierto sesgo de selección, debido a que los pacientes con estancias prolongadas probablemente tienen un peor pronóstico. Esto se refleja en la relativamente baja prevalencia de disfunción ventricular en esta población.
ConclusionesEn pacientes con CIC, la PTH es un predictor independiente de mala evolución sólo en aquellos con FGRe<60ml/min/1,73m2, mientras que en los pacientes con FGRe≥60ml/min/1,73m2, el calcidiol y el FGF23 se convierten en los únicos componentes del MM que pueden predecir el pronóstico. Por lo tanto, la función renal influye en el poder predictivo de los componentes del MM en los pacientes con CIC.
Conflicto de interesesJose Tuñón ha dado charlas para Diasorin España.
Este trabajo ha sido financiado por ayudas de la Sociedad Española de Arteriosclerosis, Instituto de Salud Carlos III (ISCIII) [PI17/01495 y P20/00923] y Ministerio de Ciencia e Innovación [RTC2019-006826-1].