El accidente cerebrovascular es la segunda causa de mortalidad después del infarto de miocardio y la principal causa de discapacidad adquirida. Los pacientes con ictus isquémico tienen un elevado riesgo de posteriores episodios vasculares, incluyendo ictus recurrente, infarto de miocardio y muerte de causa vascular. Los primeros estudios epidemiológicos mostraron una relación débil o inexistente entre la colesterolemia y el ictus. Posteriormente, los estudios de intervención con estatinas revelaron una reducción del riesgo de recurrencia de episodios cerebrovasculares. El Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL), primer ensayo clínico diseñado para analizar los efectos de la terapia con estatinas en la prevención secundaria del ictus, demostró que el tratamiento con atorvastatina 80mg/día reducía la recurrencia de ictus en pacientes con un accidente cerebrovascular isquémico reciente establecido o transitorio, con un modesto aumento en la tasa de ictus hemorrágico. Estudios posteriores han recabado los beneficios de la terapia de estatinas, con ezetimiba o inhibidores de PCSK9 tanto en la prevención primaria como secundaria del accidente cerebrovascular isquémico. Dado que el 80% de los episodios cerebrovasculares recurrentes pueden prevenirse, hemos considerado de interés realizar una revisión narrativa de los beneficios de la terapia hipolipemiante en la prevención secundaria de la enfermedad cerebrovascular isquémica.
Stroke is the second cause of death after myocardial infarction, and the main cause of acquired disability. Patients with ischaemic stroke have a higher risk of future vascular events, including recurrent stroke, myocardial infarction, and death by vascular cause. The initial epidemiological studies demonstrated a weak or non-existent relationship between cholesterolaemia and stroke. Subsequently, statin intervention trials showed a reduction in the risk of recurrence of cerebrovascular events. The Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL), the first clinical trial designed to assess effects of statin therapy in secondary stroke prevention, highlighted the reduction of stroke recurrence with atorvastatin 80mg/daily in patients with a recent ischaemic established or transient stroke, with a modest increase in the rate of haemorrhagic stroke. Successive studies have also reported the benefits of statin therapy combined with ezetimibe or PCSK9 inhibitors in primary and secondary ischaemic stroke prevention. Since 80% of recurrent cerebrovascular events could be prevented, it is considered of interest to carry out a narrative review of the benefits of lipid-lowering therapy in the secondary prevention of ischaemic cerebrovascular disease.
Los datos de la Organización Mundial de la Salud 20161,2 confirman que el accidente cerebrovascular (AVC) es la segunda causa de mortalidad después del infarto de miocardio; valga decir que, en España, según el Instituto Nacional de Estadística (INE) 2017, ya es la primera causa de mortalidad en las mujeres3. Por su parte, el Global Burden of Disease Study 20164 estimó la incidencia de AVC y riesgo de muerte por cualquier causa excluida el AVC para calcular los riesgos acumulados a lo largo de la vida del primer AVC isquémico o hemorrágico en adultos de 25 o más años de edad. El riesgo de AVC isquémico fue del 18,3% y el riesgo de AVC hemorrágico fue del 8,2%, existiendo una notable variación geográfica.
Los pacientes con ictus isquémico tienen un elevado riesgo de posteriores episodios vasculares, incluyendo el ictus recurrente, el infarto de miocardio y la muerte de causa vascular5. En este sentido, se ha descrito que los pacientes con antecedente de accidente isquémico transitorio o AVC menor presentaban durante un período de seguimiento de 5 años un riesgo sostenido de episodios cardiovasculares, aconteciendo la mitad de estos entre el segundo y quinto año6. De hecho, el riesgo del objetivo principal compuesto por AVC, síndrome coronario agudo o muerte cardiovascular fue del 12,9% y para el AVC aislado fue del 9,5%, ambos a los 5 años, aproximadamente el doble de las tasas al año del 6,2% y 5,1%, respectivamente.
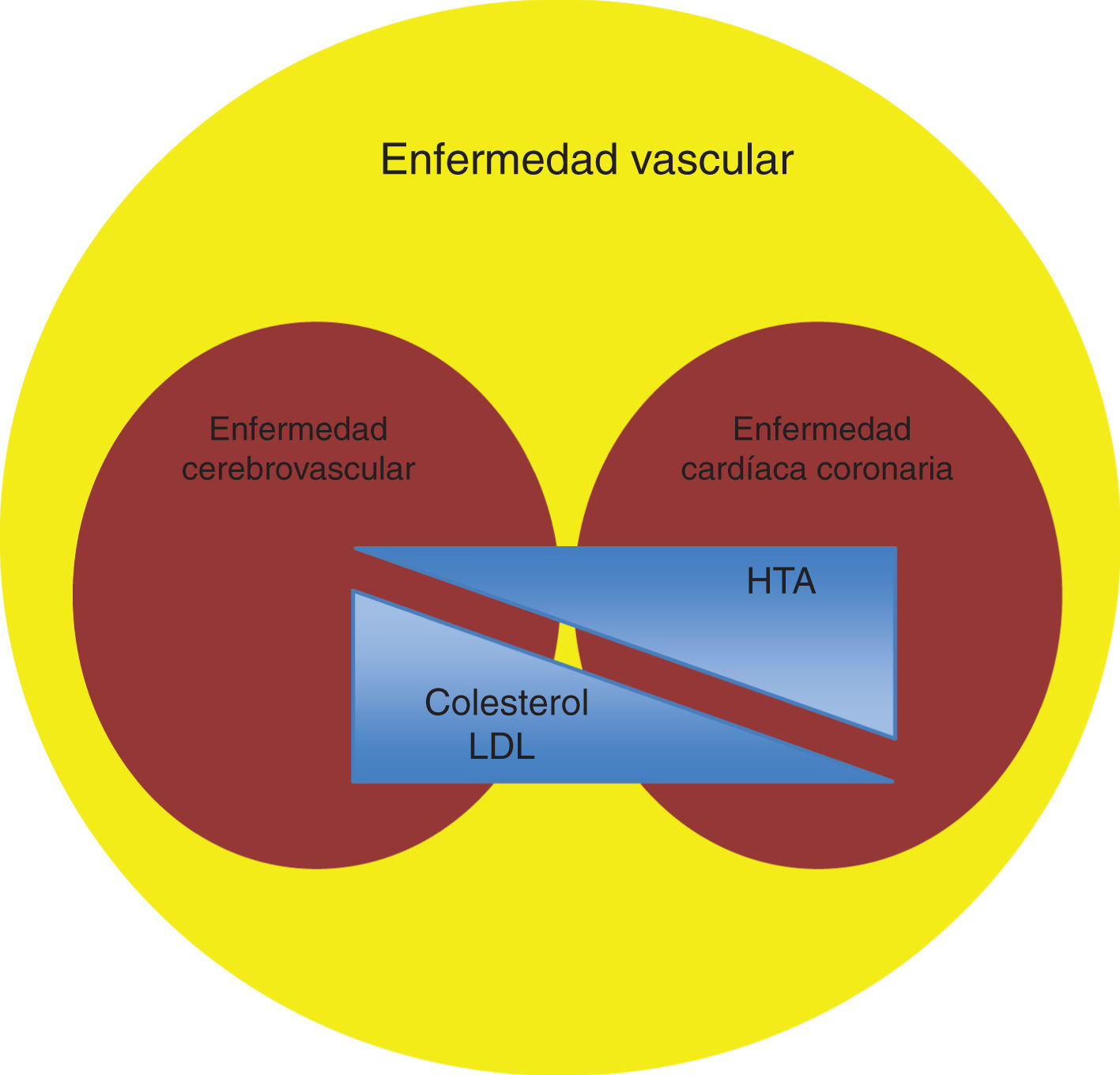
Si bien los factores de riesgo vascular son los mismos para cualquiera de las localizaciones de la enfermedad aterosclerótica, el impacto de cada uno de ellos es diferente según el territorio arterial afecto. Tradicionalmente, y a diferencia de la enfermedad cardíaca coronaria, la relación entre el colesterol plasmático y el ictus ha sido débil o inexistente, siendo en el AVC la hipertensión arterial el principal factor de riesgo7 (fig. 1). Sin embargo, evidencias clínicas más recientes han puesto de manifiesto un riesgo aumentado de enfermedad cerebrovascular con niveles elevados de colesterol unido a lipoproteínas de baja densidad (LDL), así como un descenso de dicho riesgo con el tratamiento hipolipemiante8,9. En esta línea, el metaanálisis de Amarenco y Labreuche10 describió que cada mmol/L de disminución en colesterol LDL se acompañaba de una reducción en el riesgo relativo (RRR) de ictus del 21,1% (intervalo de confianza [IC] del 95%: 6,3-33,5; p=0,009).
Junto a los datos de mortalidad, no debemos olvidar que la enfermedad cerebrovascular es la principal causa de discapacidad adquirida11, por lo que comporta sustanciales repercusiones socioeconómicas y sanitarias. Sin embargo, es importante resaltar que hasta al menos el 80% de los episodios cerebrovasculares recurrentes podrían prevenirse con las medidas terapéuticas adecuadas. Por dicho motivo, hemos considerado oportuno realizar una revisión narrativa del impacto de la terapia hipolipemiante en la prevención secundaria del AVC isquémico.
Hipercolesterolemia, enfermedad cerebrovascular y mortalidadUno de los primeros estudios epidemiológicos que analizó la relación entre la colesterolemia y la mortalidad cardiovascular fue publicado en 1989 por Iso et al.12 en el contexto del Multiple Risk Factor Intervention Trial (MRFIT) incluyendo 350.977 varones de 35 a 57 años, sin historia previa de enfermedad cardíaca coronaria. El riesgo de muerte a los 6 años de seguimiento por hemorragia intracraneal fue 3 veces superior en los varones con concentraciones de colesterol total<160mg/dL que en aquellos con niveles superiores (p=0,05). La relación inversa entre los niveles de colesterol y el riesgo de muerte por ictus hemorrágico estuvo confinada a los pacientes con presión arterial diastólica ≥90mmHg. En cuanto al ictus no hemorrágico, se observó una asociación positiva y significativa entre la concentración de colesterol y el riesgo de muerte por AVC.
Siguiendo esta misma línea, cabe destacar los hallazgos del Prospective Studies Collaboration (PSC) de 199513 que incluyó 45 cohortes prospectivas englobando 450.000 individuos con 13.387 ictus registrados y 16 años de seguimiento. Después de ajustar por nivel de enseñanza, edad, sexo, presión arterial diastólica, presencia de enfermedad cardíaca coronaria y etnia, no se documentó una asociación entre la colesterolemia y el riesgo de AVC. Sin embargo, cabe subrayar que en dicho estudio los resultados no fueron catalogados en función de los diferentes tipos de ictus (isquémico o hemorrágico), a diferencia del estudio MRFIT12.
Tratamiento hipolipemiante y reducción del riesgo de enfermedad cerebrovascularA diferencia de los hallazgos de los estudios epidemiológicos, las evidencias clínicas del efecto favorable de la reducción del colesterol LDL en la enfermedad cerebrovascular isquémica son más concluyentes. A continuación, se describirá el papel del tratamiento hipolipemiante en la prevención secundaria del ictus isquémico antes y después de la aparición de las estatinas.
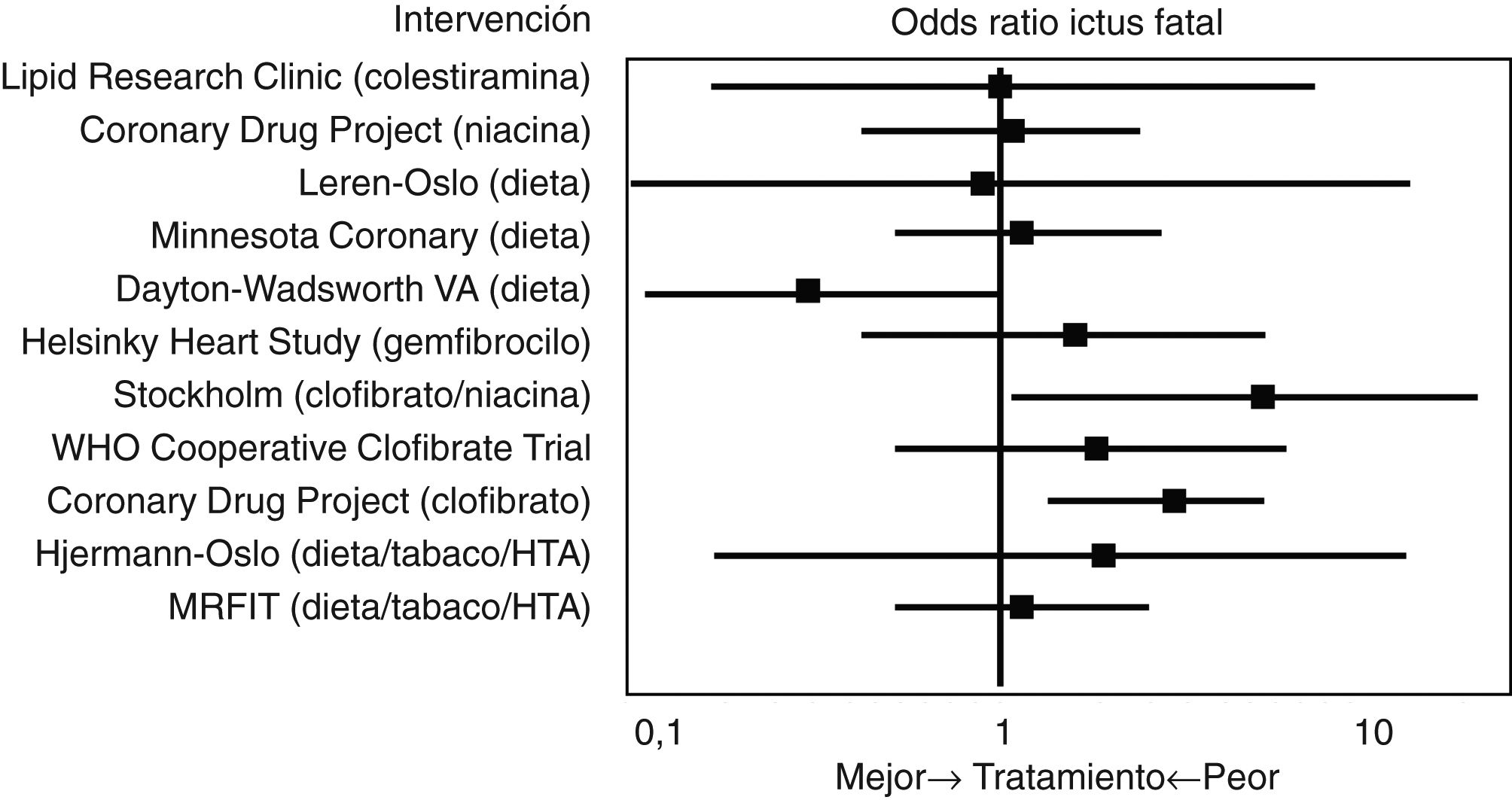
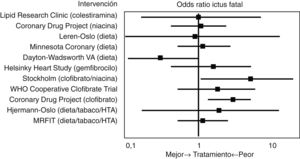
Estudios iniciales era «pre-estatinas»En 1993 Atkins et al.14 realizaron uno de los primeros metaanálisis que evaluó el efecto del tratamiento hipolipemiante antes de la introducción de las estatinas, incluyendo medidas higiénico-dietéticas, colestiramina, niacina o el clofibrato, entre otros, en el riesgo de enfermedad cerebrovascular (fig. 2). En referencia al AVC mortal, la odds ratio (OR) global asociada con las estrategias terapéuticas para reducir la concentración plasmática de colesterol fue de 1,32 (IC 95%: 0,94-1,86), y la OR para los 10 ensayos de intervención única fue de 1,34 (IC: 0,91-1,96). Entre los 8 estudios que incluyeron episodios no fatales, el índice de probabilidad de AVC no mortal para los participantes del brazo de tratamiento activo en comparación con los controles fue de 0,88 (IC: 0,70-1,11), y el índice de probabilidad de AVC totales fue de 0,98 (IC: 0,80-1,19). En los 3 ensayos con clofibrato, este fibrato aumentó significativamente el riesgo de AVC mortal (OR: 2,64; IC: 1,42-4,92) pero no el no fatal (OR: 0,87; IC: 0,61-1,26). Finalmente, el análisis de regresión logística no reveló una asociación significativa entre la magnitud de la reducción del colesterol y el riesgo de AVC fatal. Por tanto, la principal conclusión de este metaanálisis fue que el descenso de las concentraciones de colesterol con medidas higiénico-dietéticas o con tratamiento farmacológico hipolipemiante diferente a las estatinas no disminuía la morbimortalidad relacionada con la enfermedad cerebrovascular en varones de mediana edad.
Estudios de intervención con estatinasDesde la introducción de la lovastatina en 1987 como el primer inhibidor de la 3-hidroxi-3-metil-glutaril-coenzima A reductasa aprobado para uso en humanos15, las estatinas se han convertido en los fármacos hipolipemiantes más utilizados, con demostrada eficacia en prevención cardiovascular en todos los grupos de edad16–19, principalmente por la reducción de las concentraciones de colesterol LDL. En los años sucesivos, diferentes estudios han valorado el papel de las estatinas, y su consiguiente descenso de colesterol, con el riesgo de presentar un evento cerebrovascular, mostrando resultados mucho más prometedores que los obtenidos en la era «pre-estatinas». De hecho, la terapia con estatinas ha sido considerada como uno de los avances más importantes en la prevención del AVC desde la aparición de la aspirina o del tratamiento antihipertensivo20.
En la tabla 1 se exponen los principales estudios que han valorado la posible relación entre la reducción de colesterol LDL con estatinas y el riesgo de ictus o accidente isquémico transitorio. En la mayor parte de los estudios de prevención secundaria de la enfermedad cardiovascular como el Simvastatin Survival Study Group (4S)21, Cholesterol and Recurrent Event (CARE)22, y Long Term Intervention with Pravastatin in Ischemic Disease (LIPID)23, se constató una reducción significativa del riesgo de ictus en pacientes con cardiopatía isquémica, que llegó a ser del 50% en el Myocardial Ischemia Reduction with Aggressive Cholesterol Lowering (MIRACL)24 en pacientes con un síndrome coronario agudo reciente. En cambio, en el West of Scotland Coronary Prevention Study (WOSCOPS)25, estudio de prevención primaria de la enfermedad cardiovascular, se observó un descenso no significativo del 11% del riesgo de ictus durante los 5 años de seguimiento.
Reducción de ictus isquémico establecido o transitorio en los principales estudios de intervención con estatinas
| Estudio | Colesterol LDL basal (mg/dL) | Reducción colesterol LDL (%) | Reducción ictus isquémico establecido o transitorio (%) |
|---|---|---|---|
| 4S21 | 188 | 35 | 28 (p<0,01) |
| CARE22 | 139 | 28 | 32 (p<0,05) |
| LIPID23 | 150 | 25 | 19 (p<0,05) |
| WOSCOPS25 | 192 | 26 | 11 (p=NS) |
| MIRACL24 | 124 | 40 | 50 (p<0,05) |
LDL: lipoproteínas de baja densidad; NS: no significativo.
Centrándonos en la prevención secundaria de la enfermedad cerebrovascular con estatinas, el Heart Protection Study (HPS)26 fue el primer estudio en evaluar el efecto del tratamiento con simvastatina en la prevención secundaria del ictus en pacientes con enfermedad cerebrovascular previa. Se incluyeron un total de 20.536 pacientes con alto riesgo de presentar episodios vasculares con un seguimiento de 5 años. El tratamiento con simvastatina redujo significativamente el riesgo de episodios vasculares (RRR del 24%, p<0,00001) y de AVC (RRR del 27%, p<0,00001). Este mismo estudio incluyó 3.280 pacientes con AVC elegidos al azar (ninguno con accidente isquémico transitorio) y 1.822 pacientes con AVC sin enfermedad coronaria establecida. En todos los pacientes con AVC se observó una RRR de episodios cardiovasculares graves del 19%, que subió al 23% en los pacientes con AVC sin enfermedad coronaria. Sin embargo, dicho estudio no objetivó una reducción en el riesgo de AVC entre pacientes con ictus recurrente (10,4% de los pacientes en el grupo de estatinas presentaron un AVC recurrente en comparación con el 10,5% de los pacientes en el grupo placebo). Por lo tanto, en pacientes con un AVC previo, las estatinas probablemente redujeron la incidencia de episodios coronarios, pero no hubo pruebas de que las estatinas redujeran también la incidencia de ictus recurrentes.
Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL)Fruto de los hallazgos del estudio MIRACL24, se llevó a cabo el Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL)27, primer ensayo clínico diseñado para confirmar los beneficios de la terapia con estatinas en la prevención secundaria del ictus. Se incluyeron 4.731 pacientes >18 años con antecedente de ictus isquémico establecido o transitorio en los 1-6 meses previos y que no presentaran hipercolesterolemia o enfermedad cardíaca coronaria. La mayoría fueron AVC isquémicos y algunos AVC hemorrágicos. Los pacientes recibieron atorvastatina 80mg/día (n=2.365) o placebo (n=2.366), y se realizó seguimiento de casi 5 años. El objetivo primario del estudio fue valorar la incidencia de ictus mortal y no mortal. Se observó una RRR del 16% en AVC recurrentes, una RRR del 35% en episodios coronarios graves y una RRR del 20% de episodios cardiovasculares graves. La superioridad de la atorvastatina frente al placebo fue principalmente en los pacientes con ictus mortal, que experimentó una reducción del 43% (p=0,03). No sería justo dejar de mencionar aquí el aumento del 66% en el riesgo relativo de AVC hemorrágico en los pacientes asignados al azar a atorvastatina.
Al analizar con atención los resultados del estudio SPARCL, hay ciertos aspectos que merece la pena resaltar. El 25% de los pacientes que fueron asignados al brazo placebo terminaron recibiendo tratamiento con estatina en algún momento del estudio. Por lo tanto, se podría especular que los resultados obtenidos infraestiman el verdadero impacto clínico de la terapia con altas dosis de estatinas, dado que la atorvastatina fue comparada con un grupo control donde uno de cada 4 pacientes también recibía el mismo tratamiento. Por tanto, cabría plantear si los hallazgos del SPARCL infraestiman el verdadero efecto del tratamiento de la terapia intensiva con estatinas, o si infraestiman el mayor riesgo de hemorragia intracerebral por la terapia con estatinas.
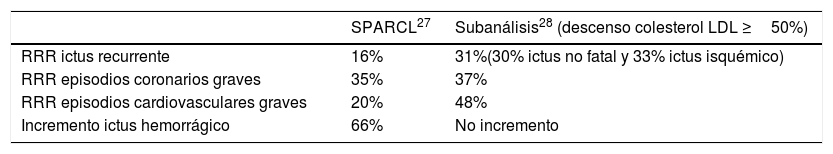
Para contestar estas preguntas, y abordar la cuestión de los beneficios y riesgos reales de la terapia con estatinas en pacientes con AVC, Amarenco et al.28 volvieron a analizar los datos, pero esta vez reclasificaron a los pacientes no según el brazo de tratamiento asignado, sino en función del nivel de reducción del colesterol LDL. Ello fue posible merced a que en los aspectos metodológicos del estudio se contemplaba la realización de 4 determinaciones seriadas por paciente y año. Los pacientes fueron catalogados en 3 categorías: sin cambio en su colesterol LDL, una disminución <50% o una disminución ≥50% del colesterol LDL, hipotetizando que este último grupo orientaría a cuál es el verdadero efecto biológico de la disminución intensa del colesterol LDL en pacientes con AVC reciente. Como era de esperar, la mayoría de los pacientes con una disminución drástica de colesterol LDL (≥50%) estaban en el grupo de atorvastatina, aunque no todos los participantes del grupo de atorvastatina tuvieron una respuesta terapéutica tan marcada. Aproximadamente, un tercio de ellos tuvo una disminución de <50% en colesterol LDL, y confirma que hubo algunas personas del grupo placebo que tomaron estatinas al constatarse una intensa reducción del colesterol LDL. Comparando los pacientes con una reducción de los niveles de colesterol LDL ≥50%, se observó que en lugar de una RRR del 16% para el AVC recurrente, se consiguió una RRR del 31% (para cualquier subtipo). Asimismo, también se obtuvieron reducciones en el riesgo de episodios coronarios graves (RRR del 37%), y una RRR del 48% en la necesidad de cualquier procedimiento de revascularización. Los principales resultados del estudio SPARCL27 así como del subanálisis28 posterior estratificando por descenso de los niveles alcanzados de colesterol LDL se detallan en la tabla 2.
Resultados del estudio SPARCL y del subanálisis posterior
| SPARCL27 | Subanálisis28 (descenso colesterol LDL ≥50%) | |
|---|---|---|
| RRR ictus recurrente | 16% | 31%(30% ictus no fatal y 33% ictus isquémico) |
| RRR episodios coronarios graves | 35% | 37% |
| RRR episodios cardiovasculares graves | 20% | 48% |
| Incremento ictus hemorrágico | 66% | No incremento |
LDL: lipoproteínas de baja densidad; RRR: reducción riesgo relativo.
La segunda pregunta que se planteó al analizar los resultados del estudio SPARCL27 fue si los resultados finales infraestiman el mayor riesgo de hemorragia intracerebral por estatinas. En este sentido, cabe destacar que en el subanálisis del SPARCL28 descrito en el apartado anterior, no se observó un aumento de AVC hemorrágicos en el grupo con reducción en las concentraciones de colesterol LDL>50%, a pesar de que el grupo de atorvastatina en el análisis original27 presentó un aumento de riesgo de AVC hemorrágico.
Estos resultados concuerdan con los descritos posteriormente por Goldstein et al.29 en 2008, donde se analizaron los factores de riesgo para la hemorragia intracerebral en el estudio SPARCL. En este caso, el sexo masculino (hazard ratio [HR]: 2,21; IC 95%: 1,20-4,09; p=0,01), la edad (HR: 1,40; IC 95%: 1,08-1,81; p=0,01) y la hemorragia intracerebral como forma de presentación (HR: 8,38; IC 95%: 3,78-18,56; p<0,001), además del control deficiente de la presión arterial, fueron los factores asociados con el riesgo de un episodio hemorrágico. Es de destacar que ningún cuartil de colesterol LDL se relacionó con un mayor riesgo de hemorragia intracerebral. Más recientemente, Gaist et al.30 confirmaron que el uso de estatinas no se asoció con un mayor riesgo de hemorragia intracraneal en pacientes con antecedentes de ictus isquémico establecido o transitorio.
En un reciente estudio de aleatorización mendeliana31, cada mmol/L de colesterol LDL genéticamente instrumentado más bajo se asoció con RRR de 0,75 (IC 95%: 0,60-0,95) para el ictus isquémico y de 1,13 (IC 95%: 0,91-1,40) para la hemorragia intracraneal. En el mismo estudio, al analizar la reducción farmacológica en colesterol LDL, se confirma que cada mmol/L de descenso se acompaña de una RRR de 0,80 (IC 95%: 0,76-0,84) para el ictus isquémico y de 1,17 (IC 95%:1,03-1,32) para hemorragia intracerebral.
En definitiva, la evidencia disponible no ha podido demostrar un verdadero incremento de riesgo de hemorragia intracraneal secundaria al tratamiento con estatinas.
Tratamiento combinadoLa actual guía conjunta 2019 de la European Society of Cardiology (ESC) y la European Atherosclerosis Society (EAS)32 para el control de la dislipemia recomienda con un grado de evidencia A el tratamiento intensivo hipolipemiante para reducir los niveles de colesterol LDL en los pacientes con un ictus isquémico establecido o transitorio. Aunque los objetivos terapéuticos en colesterol LDL se pueden alcanzar con las estatinas en monoterapia en un número considerable de casos, una proporción significativa de pacientes de alto/muy alto riesgo o con niveles elevados de colesterol LDL precisan tratamiento farmacológico adicional. En esta situación clínica, en la que a pesar de la terapia con estatina a la máxima dosis tolerada no se logra el objetivo terapéutico, se recomienda la combinación con ezetimiba y, si aun así no se consigue, la adición de un inhibidor de PCSK9.
En cuanto al tratamiento combinado con estatinas y ezetimiba, el Improved Reduction of Outcomes: Vytorin Efficacy International Trial (IMPROVE-IT)33 aportó incuestionables evidencias que refuerzan la importancia de la reducción del colesterol LDL en la prevención cardiovascular. En este sentido, hay que subrayar que la reducción adicional del colesterol LDL lograda con ezetimiba es de la misma calidad, en términos de reducción del riesgo cardiovascular, que la obtenida con las estatinas en monoterapia. Cada mmol/L (38,7mg/dL) de reducción de colesterol LDL obtenido con estatinas en monoterapia o con la combinación estatina más ezetimiba se asocia con una disminución aproximada en el RR de enfermedad cardiovascular del 20%, hallazgos en absoluta concordancia con los del Cholesterol Treatment Trialist Collaboration17. En un análisis complementario del IMPROVE-IT, Bohula et al.34 demostraron que el tratamiento de combinación simvastatina y ezetimiba en pacientes estabilizados después de un síndrome coronario agudo redujo la frecuencia de AVC isquémico, especialmente en los pacientes con un AVC previo.
Por último, disponemos de recientes evidencias referentes a los efectos beneficiosos del tratamiento con los inhibidores de PCSK9 en la prevención cardiovascular. La publicación de los resultados del estudio Further cardiovascular outcomes research with PCSK9 inhibition in subjects with elevated risk (FOURIER)35 con evolocumab y del estudio ODYSSEY outcomes: Evaluation of cardiovascular outcomes after an acute coronary syndrome during treatment with alirocumab36 apoyan la teoría del colesterol LDL cuanto más bajo mejor en los pacientes de alto/muy alto riesgo cardiovascular, y junto al IMPROVE-IT33 apuntan a la utilización de las terapias hipolipemiantes de alta intensidad37. Estos dos estudios han sido incluidos en una reciente revisión sistemática y metaanálisis efectuada por Guedeney et al.38 que documentó una RRR de AVC isquémico del 22% con tratamiento con inhibidores de PCSK9.
Los desafíosA pesar de disponer de eficaces y potentes herramientas terapéuticas, los estudios de práctica clínica en vida real muestran que los pacientes de alto/muy alto riesgo cardiovascular están infratratados e infracontrolados. Así, el registro EUROASPIRE V39 realizado en 27 países con pacientes en prevención secundaria constató que el 71% presentaba un colesterol LDL≥1,8mmol/L (70mg/dL) a pesar de que algo más del 80% de los pacientes estaban tratados con estatinas. Ello pone de relieve que el infratratamiento es una de las principales barreras a superar para mejorar el rendimiento terapéutico. De forma casi coetánea, en el registro PALM40 se describieron resultados similares. Se observó un menor uso e intensidad de estatinas en los análisis de subgrupos por edad y niveles de colesterol LDL, aunque las diferencias no fueron estadísticamente significativas en pacientes mayores y aquellos con LDL≥100mg/dL. Por otro lado, no se observaron diferencias estadísticamente significativas en el uso de estatinas y la intensidad de dicho tratamiento entre pacientes con enfermedad coronaria y AVC versus enfermedad coronaria exclusivamente. En este mismo estudio, la mediana (p25-p75) de los niveles de colesterol LDL fue de 90mg/dL (73-114), 88mg/dL (69-111) y 83mg/dL (66-107) para pacientes con enfermedad cerebrovascular exclusivamente, enfermedad cardíaca coronaria y cerebrovascular, o coronaria sola, respectivamente (p<0,001). Hay que resaltar que solo el 59,2% de los pacientes con enfermedad cerebrovascular presentaban niveles de colesterol LDL<100mg/dL, y por tanto, la mayoría de los pacientes no alcanzaban los objetivos terapéuticos.
Los avances de las plataformas analíticas de resonancia nuclear magnética y espectrometría de masas han permitido contribuciones sustanciales al campo de la metabolómica y la lipidómica en general41. Estas tecnologías emergentes se han vuelto cada vez más sofisticadas a través del desarrollo de nuevos métodos estadísticos, herramientas bioinformáticas y recursos de bases de datos. Más recientemente, se han aplicado enfoques de biología de sistemas para descifrar complejidades biológicas y clínicas con el surgimiento de modelos computacionales y matemáticos. Por lo tanto, es posible la integración de la metabolómica y la lipidómica, junto con otros datos «ómicos»42. Más allá, la fluxómica es un campo relativamente novedoso y en constante expansión que caracteriza el perfil metabólico dinámico del fenotipo celular e implica una evaluación más completa de las redes metabólicas complejas relacionadas con la enfermedad. El flujoma, conjunto de flujos metabólicos en un sistema metabólico, es una manifestación directa del fenotipo metabólico, por tanto, es clave para entender cualquier enfermedad con un fuerte componente metabólico. Sin embargo, es necesaria más investigación para desentrañar los mecanismos causales del AVC isquémico y allanar el camino para nuevos tratamientos farmacológicos, con el fin de ayudarnos a conseguir los objetivos terapéuticos marcados para nuestros pacientes.
ConclusionesLa enfermedad cerebrovascular es una de las principales causas de mortalidad en nuestra población, siendo la hipercolesterolemia uno de los factores modificables de riesgo descritos. Estudios previos han demostrado que el tratamiento hipolipemiante, tanto con estatinas como en combinación con ezetimiba o los inhibidores de PCSK9, son efectivos en la prevención secundaria del ictus isquémico, al disminuir las concentraciones de colesterol LDL. Sin embargo, la principal barrera en la práctica clínica sigue siendo la falta de consecución de los objetivos terapéuticos en colesterol LDL, fruto del infratratamiento. Se ha documentado que la planificación terapéutica previa43 mediante la utilización de las tablas actualizadas de Masana y Plana44 o la utilización de herramientas informatizadas incorporadas a la historia clínica45 facilitan de manera significativa la tasa de consecución de los objetivos terapéuticos y de esta forma realizar una prevención vascular eficaz.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesNinguno.