El alelo de riesgo (G) de la variante rs10830963 en el gen del receptor de melatonina 1 B (MTNR1B) se relaciona con la obesidad. En este trabajo evaluamos el efecto de este SNP sobre los factores de riesgo cardiovascular y la pérdida de peso secundaria a 2dietas hipocalóricas.
MétodosTrescientos sesenta y un sujetos obesos fueron asignados aleatoriamente durante 3 meses (dieta M: dieta hipocalórica alta en grasas monoinsaturadas vs. dieta P: dieta hipocalórica alta en grasas poliinsaturadas). Se midieron los parámetros antropométricos, glucemia en ayunas, proteína C reactiva, concentración de insulina, resistencia a la insulina (HOMA-IR), perfil de lípidos y los niveles de adipocitoquinas. Se evaluó el genotipo del polimorfismo del gen MTNR1B (rs10830963).
ResultadosTodos los parámetros antropométricos, la presión arterial sistólica y los niveles de leptina disminuyeron en todos los sujetos después de ambas dietas. Esta mejora de los parámetros antropométricos fue mayor en los no portadores del alelo G que en los portadores del alelo G. Tras la intervención con dieta M (CC vs. CG + GG), el colesterol total (delta: –10,4 ± 2,1mg/dl vs. –6,4 ± 1,2mg/dl: p < 0,05), colesterol LDL (delta: –7,1 ± 0,9mg/dl vs. –2,8 ± 0,8mg/dl: p < 0,05), insulina (delta: –3,0 ± 0.8 UI/l vs. –2,0 ± 1,0 UI/l: p < 0,05) y HOMA IR (delta: –3,4 ± 1,0 unidades vs. –2,9 ± 0,9 unidades: p < 0,05) mejoraron en los no portadores del alelo G. Tras la dieta P, en el grupo de sujetos sin alelo G, los niveles de insulina (delta: –2,9 ± 1,0 UI/l vs. –0,6 ± 0,2 UI/l: p < 0,05) y HOMA-IR (delta [CC vs. CG + GG]: –0,8 ± 0,2 unidades vs. –0,4 ± 0,3 unidades: p < 0,05) también disminuyeron.
ConclusionesNuestro estudio detectó una relación de la variante rs10830963 de MTNR1B con la pérdida de peso corporal y la modificación de la resistencia a la insulina inducida por 2dietas hipocalóricas diferentes. Solo la dieta hipocalórica enriquecida en grasa monoinsaturada y los no portadores del alelo G mostraron un efecto significativo sobre las lipoproteínas.
The risk allele (G) of rs10830963 in the melatonin receptor 1 B (MTNR1B) gene presents an association with obesity. We study the effect of this SNP on cardiovascular risk factors and weight loss secondary to 2hypocaloric diets.
Methods361 obese subjects were randomly allocated during 3 months (Diet M - high monounsaturated fat hypocaloric diet vs. Diet P – high polyunsaturated fat hypocaloric diet). Anthropometric parameters, fasting blood glucose, C-reactive protein (CRP), insulin concentration, insulin resistance (HOMA-IR), lipid profile and adipocytokines levels were measured. Genotype of MTNR1B gene polymorphism (rs10830963) was evaluated.
ResultsAll anthropometric parameters, systolic blood pressure and leptin levels decreased in all subjects after both diets. This improvement of anthropometric parameters was higher in non G allele carriers than G allele carriers. After dietary intervention with Diet M, (CC vs. CG + GG); total cholesterol (delta: -10.4 ± 2.1mg/dl vs. -6.4 ± 1.2mg/dl: P <.05), LDL-cholesterol (delta:-7.1 ± 0.9mg/dl vs. -2.8 ± 0.8mg/dl: P <.05), insulin (delta:-3.0 ± 0.8 UI/L vs. -2.0 ± 1.0 UI/L: P<.05) and HOMA-IR (delta:-3.4 ± 1.0 units vs. -2.9 ± 0.9 units: P<.05) improved in no G allele carriers. After Diet P, in the group of subjects without G allele CC, insulin levels (delta: -2.9 ± 1.0 UI/L vs. -0.6 ± 0.2 UI/L: P <.05) and HOMA-IR (delta (CC vs. CG + GG): -0.8 ± 0.2 units vs. -0.4 ± 0.3 units: P <.05) decreased, too.
ConclusionsOur study detected a relationship of rs10830963 MTNR1B SNP with body weight loss and insulin resistance modification induced by 2different hypocaloric. Only monounsaturated enriched hypocaloric diet and in no-G allele carriers showed a significant effect on lipoproteins.
Existen datos de que nuestro metabolismo está relacionado con el sistema circadiano1. En algunos trabajos incluso se han relacionado las alteraciones del ritmo circadiano con el sobrepeso2. Algunos estudios también han demostrado que el metabolismo energético es controlado básicamente a través de un marcapasos central en el sistema circadiano3 y que las alteraciones circadianas pueden inducir obesidad y complicaciones metabólicas asociadas a esta como son diabetes mellitus tipo 2, intolerancia a la glucosa, hiperlipidemia, hipertensión o enfermedad cardiovascular4.
La melatonina es una hormona producida por la glándula pineal que controla fundamentalmente los ritmos circadianos5. El efecto de la melatonina es realizado a través de 2receptores de membrana: el receptor de melatonina 1 (MT1, codificado por MTNR1A) y el receptor de melatonina 2 (MT2, codificado por MTNR1B). MTNR1B es el receptor más ubicuo de ambos y se encuentra en los islotes pancreáticos, el diencéfalo y los ojos (retina). Algunos polimorfismos (polimorfismo de un único nucleótido [SNP]) localizados en genes implicados en sistemas circadianos como la melatonina se han relacionado con el sobrepeso y la obesidad6. Por ejemplo, un SNP en el gen del receptor de melatonina tipo 1B (MTNR1B), se ha relacionado con la alteración del ritmo y la señal de la melatonina7. Curiosamente, esta variante genética también se ha relacionado con la diabetes mellitus tipo 28,9, dislipidemias10,11 y sobrepeso12. Por otra parte, se ha demostrado que el polimorfismo rs10830963 del gen del receptor MTNR1B interactúa con la grasa dietética y el perfil lipídico sérico13.
A pesar de estas relaciones mencionadas anteriormente, las investigaciones que estudian el efecto de este polimorfismo en la respuesta a las estrategias de pérdida de peso son escasas. Goni et al.14 han demostrado que la variante rs10830963 podría estar relacionada con la pérdida de peso inducida por una restricción calórica. Los mismos autores15 han detectado una relación de esta variante genética con la respuesta lipídica después de 2 años de dieta y pérdida de peso. También se ha detectado una interacción significativa entre los genotipos de la variante rs1083096316 y la intervención dietética sobre la aparición de diabetes mellitus gestacional, en mujeres jóvenes homocigóticas para el alelo C. Finalmente, los pacientes con obesidad tratados con una dieta hipocalórica mediterránea mostraron una respuesta diferente de los niveles de insulina y resistencia a la insulina; dichas diferencias se relacionaron con el alelo menor de este SNP17.
En este estudio, evaluamos el efecto de este SNP sobre los cambios en diferentes factores de riesgo cardiovascular y la pérdida de peso tras una dieta hipocalórica con alto contenido de grasas monoinsaturadas o una dieta hipocalórica con alto contenido de grasas poliinsaturadas en pacientes con obesidad.
Material y métodosEn este trabajo se ha reclutado a pacientes con obesidad de raza caucásica mediante un método consecutivo no probabilístico de muestreo entre los sujetos enviados por los médicos de atención primaria a las consultas de especializada. Se reclutó a 361 pacientes en la Unidad de Nutrición Clínica. Este estudio se llevó a cabo de acuerdo con las directrices establecidas en la Declaración de Helsinki, el comité local de ética aprobó todos los procedimientos y todos los sujetos dieron su consentimiento informado.
Los principales criterios de exclusión fueron: la realización de una dieta durante los 6 meses anteriores al estudio, presencia de enfermedades cardiovasculares o cerebrovasculares inestables, motivación insuficiente, así como el uso de cualquiera de los siguientes medicamentos: metformina, inhibidores de dipeptidilo tipo iv, tiazolidinediona, análogos de GLP-1, inhibidores de sGLT2, insulina, glucocorticoides, bloqueadores de los receptores de angiotensina, inhibidores de la enzima conversora de la angiotensina, medicamentos psicoactivos, estatinas y otros medicamentos lipídicos. Los criterios de inclusión fueron los siguientes: índice de masa corporal > 30kg/m2 y una edad comprendida entre 18 y 70 años.
Se recogieron muestras de sangre venosa (15ml) en tubos tratados con EDTA, tras un período de ayuno de 10 h. La glucosa basal, la proteína C reactiva (PCR), la insulina, la resistencia a la insulina (HOMA-IR), el colesterol total, el colesterol LDL, el colesterol HDL, los triglicéridos y las adipoquinas séricas (leptina, adiponectina y resistencia) se midieron al inicio del ensayo y se repitieron después de 3 meses de ambas dietas. Los parámetros antropométricos (peso, altura, circunferencia de la cintura y masa grasa por bioimpedancia), así como la presión arterial, también se midieron en ambas ocasiones. Se evaluó el genotipo del polimorfismo del gen MTNR1B (rs10830693).
Intervención dietéticaAmbas dietas hipocalóricas fueron diseñadas para proporcionar entre 400 y 500kcal/día menos que el gasto total de energía estimado individualmente. Los sujetos obesos fueron asignados aleatoriamente a una de 2dietas durante un período de 3 meses. El porcentaje de energía derivado de hidratos de carbono, grasas y proteínas en las dietas fue: dieta P (dieta hipocalórica con alto contenido de grasas poliinsaturadas, 45,7% de hidratos de carbono, 34,4% de lípidos y 19,9% de proteínas) y dieta M (dieta hipocalórica con alto contenido de grasas monoinsaturadas: 46,6% de hidratos de carbono, 34,1% de lípidos y 19,2% de proteínas). La distribución de las grasas en la dieta P fue la siguiente: 21,8% de las grasas saturadas, 55,5% de las grasas monoinsaturadas y 22,7% de las grasas poliinsaturadas (7g al día de ácidos grasos ω-6, 2g al día de ácidos grasos ω-3 y una relación ω6/ω3 de 3,5). La distribución de grasas en la dieta M fue: 21,7% de grasas saturadas, 67,5% de grasas monoinsaturadas y 10,8% de grasas poliinsaturadas. El programa de ejercicios consistía en realizar ejercicio aeróbico al menos 3 veces por semana (60 min cada una). Los registros de la ingesta dietética diaria durante 3días, incluido un día de fin de semana, se evaluaron con un programa informático (Dietosource®, Nestle Gen, Sw). Se utilizaron como referencia las tablas nacionales de composición de alimentos18. Un investigador verificó el cumplimiento de ambas dietas cada 7 días con una llamada telefónica.
AntropometríaEl peso corporal y la circunferencia de la cintura se midieron por la mañana antes del desayuno, al inicio y a los 3 meses de seguimiento. El índice de masa corporal se calculó con la formula (peso corporal en kg/[altura2 en m]). La circunferencia de la cintura se midió en el diámetro más estrecho entre el apéndice xifoideo y la cresta ilíaca. La bioimpedancia eléctrica se utilizó para medir la composición corporal con una precisión de 50g19. La presión arterial se midió 2veces después de un descanso de 10 min con un esfigmógrafo de mercurio y se promediaron ambos valores (Omrom, Los Angeles, CA, EE. UU.).
Determinaciones bioquímicasLa insulina se determinó mediante radioinmunoanálisis (RIA Diagnostic Corporation, Los Angeles, CA, EE. UU.) con una sensibilidad de 0,5 mUI/l (rango normal 0,5-30 mUI/l)20, los niveles de glucosa en plasma se midieron usando un método automatizado de glucosa oxidasa (Glucose analyser 2, Beckman Instruments, Fullerton, California, EE. UU.) y se calculó la resistencia a la insulina (HOMA-IR) usando estos valores21. Las concentraciones séricas de colesterol total y triglicéridos se determinaron mediante un ensayo colorimétrico enzimático (Technicon Instruments, Ltd., New York, N.Y., EE. UU.). El colesterol HDL se determinó enzimáticamente en el sobrenadante después de la precipitación de otras lipoproteínas con dextrano sulfato-magnesio. El colesterol LDL se calculó utilizando la fórmula de Friedewald (colesterol LDL= colesterol total – HDL colesterol – triglicéridos/5)22.
La leptina fue determinada por enzimoinmunoanálisis (ELISA) (Diagnostic Systems Laboratories, Inc., Texas, EE. UU.), con un CV% 3,5%23. La resistina fue medida por ELISA (Biovendor Laboratory, Inc. de Brno, República Checa), con un CV% 3,2%24. La adiponectina fue medida por ELISA (R&D systems, Inc., Minneapolis, EE. UU.) (DRP300), con un CV% 3,8%25. La PCR se determinó por inmunoturbimetría (Roche Diagnostics GmbH, Mannheim, Alemania), con un CV% 2,8%.
Genotipificación del polimorfismo del gen MTNR1BEl ADN genómico se extrajo de la fracción buffy coat de la sangre centrifugada mediante un kit comercial (Biorad, LA, CA, EE. UU.). Los cebadores fueron diseñados con el programa Sequenom Assay Design v4 (SEQUENOM, Inc. San Diego, California, EE. UU.). La genotipificación del polimorfismo rs10830963 se realizó mediante el análisis en tiempo real de la reacción en cadena de la polimerasa. Esta reacción en cadena de la polimerasa se llevó a cabo con 20-25 ng de ADN genómico, 0,1-0,15μl de cada uno de los oligonucleótidos de fondo para rs10830963 (primer adelante: 5′- ACGTTGGGGATGCCCCCCCCCAGTGATGCTAAGAAGAAT -3′ y viceversa 5′- ACGTGGGATGGGGCATAGGCAGAATATTCCC -3′ en un volumen final de 2μl (Termociclador Lifetecnologies, LA, CA, EE. UU.). El equilibrio de Hardy-Weinberg se calculó con una prueba estadística (chi al cuadrado). La variante del gen MTNR1B estaba en equilibrio con Hardy-Weinberg (p = 0,31).
Análisis estadísticoLa comparación de las variables categóricas se evaluó mediante la prueba de la chi al cuadrado. Las variables numéricas con distribución normal se analizaron con una prueba t de Student de 2colas. Las variables no paramétricas se analizaron con la prueba de Wilcoxon. El análisis estadístico para evaluar la interacción entre el gen y la dieta fue relizado mediante ANCOVA. El análisis estadístico se realizó para el CG y GG combinado como grupo y el genotipo CC como segundo grupo, con un modelo dominante. El tamaño de la muestra se calculó para detectar diferencias de más de 2,5kg en la pérdida de peso corporal con una potencia del 90% y una significación del 5% (n = 150 en cada grupo de dieta). Un valor p < 0,05 se consideró significativo. La versión 15.0 (SPSS 15, Illinois, EE. UU.) ha sido utilizada para realizar el análisis estadístico.
ResultadosTrescientos sesenta y un sujetos fueron incluidos en el estudio. La edad media fue de 49,1 ± 6,1 años (rango: 27-67) y el índice de masa corporal medio de 36,1 ± 4,1kg/m2 (rango: 31,0-39,3). Un total de 194 pacientes (54,0%) tenían el genotipo CC, 142 pacientes CG (39,3%) y 25 pacientes GG (6,7%). La edad fue similar en los 3genotipos (CC 49,3 ± 9,1 años vs. CG 48,9 ± 10,2 años vs. GG 48,7 ± 8,0 años: ns).
En el grupo de 177 sujetos tratados con la dieta M (91 sujetos con genotipo CC y 86 portadores del alelo G), la evaluación basal de la ingesta nutricional mostró una ingesta calórica de 2.009,1 ± 322,1kcal/día, una ingesta de hidratos de carbono de 199,2 ± 31,3g/día (43,2% de las calorías), una ingesta de grasas de 64,3 ± 12,2g/día (33,9% de las calorías) y una ingesta de proteínas de 78,1 ± 17,1g/día (23,9% de las calorías). Durante la intervención dietética, estos pacientes alcanzaron las recomendaciones teóricas de la dieta M: 1.459,2 calorías por día (45,0% de hidratos de carbono, 34,0% de lípidos y 21,0% de proteínas). La distribución de las grasas dietéticas fue la siguiente: 20,4% de grasas saturadas, 67,8% de grasas monoinsaturadas y 11,8% de grasas poliinsaturadas.
En el grupo de 184 sujetos tratados con la dieta P (104 portadores de genotipo CC y 80 portadores del alelo G), la evaluación basal de la ingesta nutricional mostró una ingesta calórica de 1.997,4 ± 623,1kcal/día, una ingesta de hidratos de carbono de 208,1 ± 60,9g/día (43,4% de las calorías), una ingesta de grasas de 82,1 ± 31,3g/día (36,3% de las calorías) y una ingesta de proteínas de 88,1 ± 32,1g/día (20,3% de las calorías). Durante la intervención, estos sujetos alcanzaron las recomendaciones teóricas de la dieta P: 1.453,9 calorías por día (45,3% de hidratos de carbono, 34,1% de lípidos y 20,8% de proteínas). La distribución de las grasas fue la siguiente: 20,6% de grasas saturadas, 53,9% de grasas monoinsaturadas y 23,5% de grasas poliinsaturadas (6,8g diarios de ácidos grasos ω-6, 1,9g diarios de ácidos grasos ω-3 y una relación ω6/ω3 de 3,6).
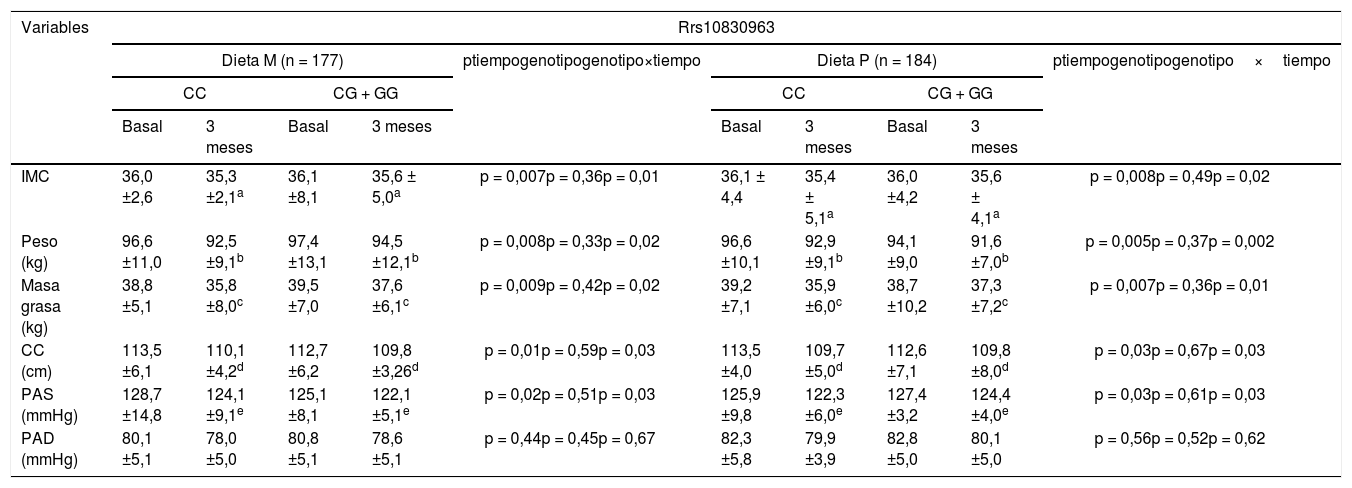
En la tabla 1 se muestran los parámetros antropométricos y las características de la presión arterial de los participantes al inicio y tras 3 meses de la intervención. En ambos genotipos, el peso corporal, el índice de masa corporal (IMC), la masa grasa, la circunferencia de la cintura y la presión arterial sistólica disminuyeron significativamente. Tras la pérdida de peso con una dieta hipocalórica rica en grasas monoinsaturadas (dieta M; CC vs. CG + GG) disminuyeron los siguientes parámetros; IMC (delta: –0,7 ± 1,1kg/m2 vs. –0,5 ± 1,2kg/m2: p < 0,05), peso (delta: –4,1 ± 0,9kg vs. –2,9 ± 0,8kg: p < 0,05), la masa grasa (delta: – 3,0 ± 0,8kg vs. –2,0 ± 1,0kg: p < 0,05) y la circunferencia de la cintura (delta: –3,4 ± 1,0cm vs. –2,9 ± 0,9cm: p < 0,05). La mejoría de estas variables fue mayor en los no portadores del alelo G. Tras la pérdida de peso con una dieta enriquecida en grasas poliinsaturadas (dieta P; CC vs. CG + GG), también disminuyeron los siguientes parámetros: IMC (delta: – 0,7 ± 1,0kg/m2 vs. –0,2 ± 1,1kg/m2: p < 0,05), peso (delta: –3,7 ± 1,0kg vs. –2,5 ± 0,9kg: p < 0,05), la masa grasa (delta: –3,3 ± 1,0kg vs. –1,4 + 0,9kg: p < 0,05) y la circunferencia de la cintura (delta: –3,8 ± 1,0cm vs. –2,6 ± 0,8cm: p < 0,05). De la misma manera, la disminución de los parámetros antropométricos fue mayor en los no portadores del alelo G. La presión arterial sistólica mejoró tras ambas dietas hipocalóricas, independientemente del genotipo (tabla 1).
Variables antropométricas (media ± DE)
| Variables | Rrs10830963 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Dieta M (n = 177) | ptiempogenotipogenotipo×tiempo | Dieta P (n = 184) | ptiempogenotipogenotipo×tiempo | |||||||
| CC | CG + GG | CC | CG + GG | |||||||
| Basal | 3 meses | Basal | 3 meses | Basal | 3 meses | Basal | 3 meses | |||
| IMC | 36,0 ±2,6 | 35,3 ±2,1a | 36,1 ±8,1 | 35,6 ± 5,0a | p = 0,007p = 0,36p = 0,01 | 36,1 ± 4,4 | 35,4 ± 5,1a | 36,0 ±4,2 | 35,6 ± 4,1a | p = 0,008p = 0,49p = 0,02 |
| Peso (kg) | 96,6 ±11,0 | 92,5 ±9,1b | 97,4 ±13,1 | 94,5 ±12,1b | p = 0,008p = 0,33p = 0,02 | 96,6 ±10,1 | 92,9 ±9,1b | 94,1 ±9,0 | 91,6 ±7,0b | p = 0,005p = 0,37p = 0,002 |
| Masa grasa (kg) | 38,8 ±5,1 | 35,8 ±8,0c | 39,5 ±7,0 | 37,6 ±6,1c | p = 0,009p = 0,42p = 0,02 | 39,2 ±7,1 | 35,9 ±6,0c | 38,7 ±10,2 | 37,3 ±7,2c | p = 0,007p = 0,36p = 0,01 |
| CC (cm) | 113,5 ±6,1 | 110,1 ±4,2d | 112,7 ±6,2 | 109,8 ±3,26d | p = 0,01p = 0,59p = 0,03 | 113,5 ±4,0 | 109,7 ±5,0d | 112,6 ±7,1 | 109,8 ±8,0d | p = 0,03p = 0,67p = 0,03 |
| PAS (mmHg) | 128,7 ±14,8 | 124,1 ±9,1e | 125,1 ±8,1 | 122,1 ±5,1e | p = 0,02p = 0,51p = 0,03 | 125,9 ±9,8 | 122,3 ±6,0e | 127,4 ±3,2 | 124,4 ±4,0e | p = 0,03p = 0,61p = 0,03 |
| PAD (mmHg) | 80,1 ±5,1 | 78,0 ±5,0 | 80,8 ±5,1 | 78,6 ±5,1 | p = 0,44p = 0,45p = 0,67 | 82,3 ±5,8 | 79,9 ±3,9 | 82,8 ±5,0 | 80,1 ±5,0 | p = 0,56p = 0,52p = 0,62 |
DE: desviación estándar;IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; CC: circunferencia de cintura.
IMC: diferencias estadísticas en cada grupo entre valores basales y 3meses. No diferencias entre grupos.
Peso: diferencias estadísticas en cada grupo entre valores basales y 3meses. No diferencias entre grupos.
Masa grasa: diferencias estadísticas en cada grupo entre valores basales y 3meses. No diferencias entre grupos.
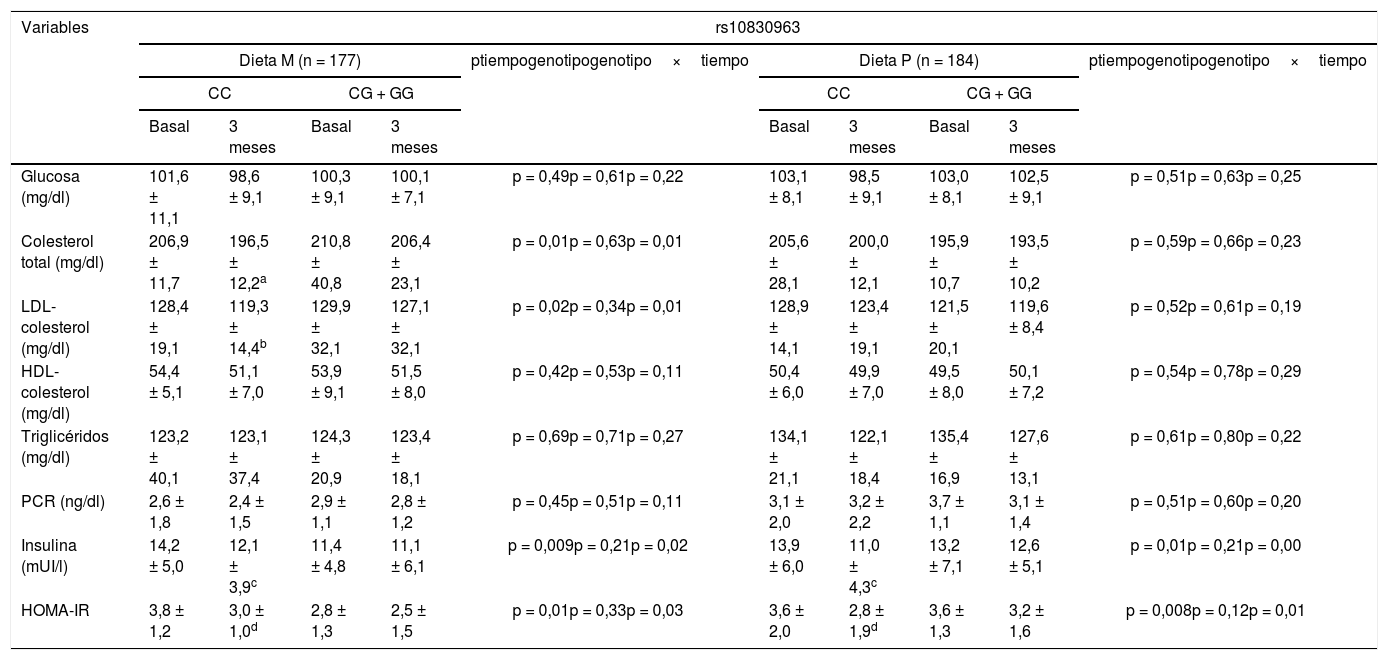
La tabla 2 muestra las variables bioquímicas. Tras la pérdida de peso con la dieta M (dieta M; CC vs. CG + GG), el colesterol total (delta: –10,4 ± 2,1mg/dl vs. –6,4 ± 1,2mg/dl: p < 0,05), colesterol LDL (delta: –7,1 ± 0,9mg/dl vs. –2,8 ± 0,8mg/dl: p < 0,05), insulina (delta: –3,0 ± 0,8 UI/l vs. –2,0 ± 1,0 UI/l: p < 0,05) y HOMA-IR (delta: –3,4 ± 1,0 unidades vs. –2,9 ± 0,9 unidades: p < 0,05) mejoraron en los no portadores del alelo G. Tras la pérdida de peso con la dieta P, en el grupo de sujetos sin alelo G, los niveles de insulina (delta [CC vs. CG + GG]: –2,9 ± 1,0 UI/l vs. –0,6 ± 0,2 UI/l: p < 0,05) y HOMA-IR (delta [CC vs. CG + GG]: –0,8 ± 0,2 unidades vs. –0,4 ± 0,3 unidades: p < 0,05) también disminuyeron. En ambas genotipificaciones tratadas con dieta P, los niveles de colesterol permanecieron sin cambios.
Variables bioquímicas (media ± DE)
| Variables | rs10830963 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Dieta M (n = 177) | ptiempogenotipogenotipo×tiempo | Dieta P (n = 184) | ptiempogenotipogenotipo×tiempo | |||||||
| CC | CG + GG | CC | CG + GG | |||||||
| Basal | 3 meses | Basal | 3 meses | Basal | 3 meses | Basal | 3 meses | |||
| Glucosa (mg/dl) | 101,6 ± 11,1 | 98,6 ± 9,1 | 100,3 ± 9,1 | 100,1 ± 7,1 | p = 0,49p = 0,61p = 0,22 | 103,1 ± 8,1 | 98,5 ± 9,1 | 103,0 ± 8,1 | 102,5 ± 9,1 | p = 0,51p = 0,63p = 0,25 |
| Colesterol total (mg/dl) | 206,9 ± 11,7 | 196,5 ± 12,2a | 210,8 ± 40,8 | 206,4 ± 23,1 | p = 0,01p = 0,63p = 0,01 | 205,6 ± 28,1 | 200,0 ± 12,1 | 195,9 ± 10,7 | 193,5 ± 10,2 | p = 0,59p = 0,66p = 0,23 |
| LDL-colesterol (mg/dl) | 128,4 ± 19,1 | 119,3 ± 14,4b | 129,9 ± 32,1 | 127,1 ± 32,1 | p = 0,02p = 0,34p = 0,01 | 128,9 ± 14,1 | 123,4 ± 19,1 | 121,5 ± 20,1 | 119,6 ± 8,4 | p = 0,52p = 0,61p = 0,19 |
| HDL-colesterol (mg/dl) | 54,4 ± 5,1 | 51,1 ± 7,0 | 53,9 ± 9,1 | 51,5 ± 8,0 | p = 0,42p = 0,53p = 0,11 | 50,4 ± 6,0 | 49,9 ± 7,0 | 49,5 ± 8,0 | 50,1 ± 7,2 | p = 0,54p = 0,78p = 0,29 |
| Triglicéridos (mg/dl) | 123,2 ± 40,1 | 123,1 ± 37,4 | 124,3 ± 20,9 | 123,4 ± 18,1 | p = 0,69p = 0,71p = 0,27 | 134,1 ± 21,1 | 122,1 ± 18,4 | 135,4 ± 16,9 | 127,6 ± 13,1 | p = 0,61p = 0,80p = 0,22 |
| PCR (ng/dl) | 2,6 ± 1,8 | 2,4 ± 1,5 | 2,9 ± 1,1 | 2,8 ± 1,2 | p = 0,45p = 0,51p = 0,11 | 3,1 ± 2,0 | 3,2 ± 2,2 | 3,7 ± 1,1 | 3,1 ± 1,4 | p = 0,51p = 0,60p = 0,20 |
| Insulina (mUI/l) | 14,2 ± 5,0 | 12,1 ± 3,9c | 11,4 ± 4,8 | 11,1 ± 6,1 | p = 0,009p = 0,21p = 0,02 | 13,9 ± 6,0 | 11,0 ± 4,3c | 13,2 ± 7,1 | 12,6 ± 5,1 | p = 0,01p = 0,21p = 0,00 |
| HOMA-IR | 3,8 ± 1,2 | 3,0 ± 1,0d | 2,8 ± 1,3 | 2,5 ± 1,5 | p = 0,01p = 0,33p = 0,03 | 3,6 ± 2,0 | 2,8 ± 1,9d | 3,6 ± 1,3 | 3,2 ± 1,6 | p = 0,008p = 0,12p = 0,01 |
LDL: low density lipoprotein; HOMA-IR: homeostasis model assessment; DE: desviación estándar; HDL: high density lipoprotein; PCR: proteína C reactiva.
Colesterol: diferencias estadísticas en cada grupo entre valores basales y 3meses. No diferencias entre grupos.
LDL-colesterol: diferencias estadísticas en cada grupo entre valores basales y 3meses. No diferencias entre grupos.
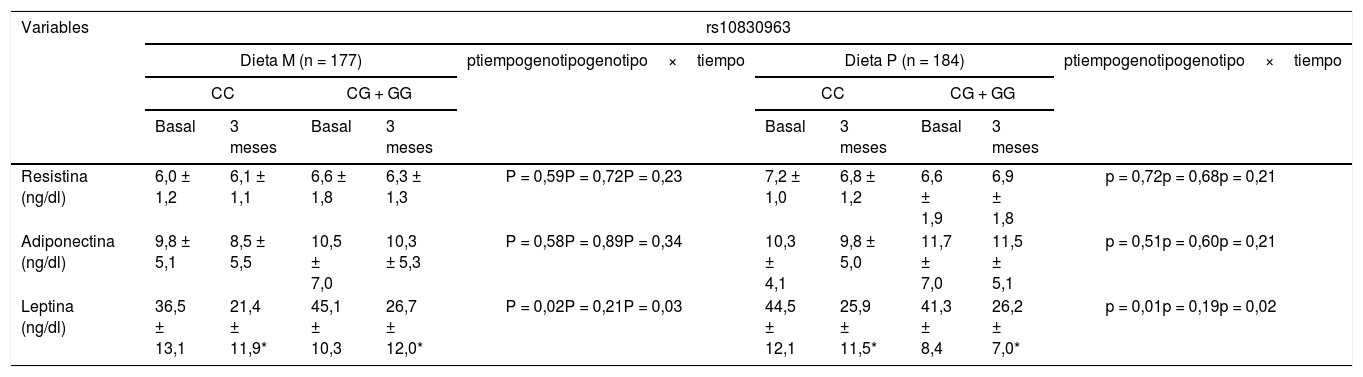
La tabla 3 muestra los niveles de adipoquinas en suero. Tras la pérdida de peso con ambas dietas (M vs. P), los no portadores del alelo G mostraron una disminución significativa en los niveles de leptina (delta: –15,1 ± 9,1: ng/ml vs. –18,6 ± 13,2 ng/ml: p > 0,05). La misma mejoría de los niveles de leptina se observó en los portadores del alelo G (delta: –19,6 ± 9,1 ng/ml vs. – 15,1 + 9,8 ng/ml: p > 0,05). El efecto sobre los niveles de leptina fue independiente de la intervención dietética. Los niveles de las adipoquinas restantes permanecieron sin cambios.
Niveles de adipocitoquinas séricas (media ± DE)
| Variables | rs10830963 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Dieta M (n = 177) | ptiempogenotipogenotipo×tiempo | Dieta P (n = 184) | ptiempogenotipogenotipo×tiempo | |||||||
| CC | CG + GG | CC | CG + GG | |||||||
| Basal | 3 meses | Basal | 3 meses | Basal | 3 meses | Basal | 3 meses | |||
| Resistina (ng/dl) | 6,0 ± 1,2 | 6,1 ± 1,1 | 6,6 ± 1,8 | 6,3 ± 1,3 | P = 0,59P = 0,72P = 0,23 | 7,2 ± 1,0 | 6,8 ± 1,2 | 6,6 ± 1,9 | 6,9 ± 1,8 | p = 0,72p = 0,68p = 0,21 |
| Adiponectina (ng/dl) | 9,8 ± 5,1 | 8,5 ± 5,5 | 10,5 ± 7,0 | 10,3 ± 5,3 | P = 0,58P = 0,89P = 0,34 | 10,3 ± 4,1 | 9,8 ± 5,0 | 11,7 ± 7,0 | 11,5 ± 5,1 | p = 0,51p = 0,60p = 0,21 |
| Leptina (ng/dl) | 36,5 ± 13,1 | 21,4 ± 11,9* | 45,1 ± 10,3 | 26,7 ± 12,0* | P = 0,02P = 0,21P = 0,03 | 44,5 ± 12,1 | 25,9 ± 11,5* | 41,3 ± 8,4 | 26,2 ± 7,0* | p = 0,01p = 0,19p = 0,02 |
En este ensayo de intervención dietética a corto plazo, detectamos una interacción significativa entre la variante rs10830963 del gen MTNR1B y la ingesta de grasa en la dieta sobre los cambios en el colesterol LDL y el colesterol total. Esta variante genética del gen MTNR1B también está relacionada con la pérdida de peso corporal y la respuesta de la resistencia a la insulina. Nuestros resultados muestran que el alelo G se asoció a una menor pérdida de peso y resistencia a la insulina secundaria a ambas dietas hipocalóricas, mientras que se observó una mayor disminución del colesterol total y del colesterol LDL después de una dieta hipocalórica enriquecida monoinsaturada en los no portadores del alelo G.
Muchos genes en determinados tejidos presentan un claro ciclo diurno26. En este contexto, el receptor MTNR1B también está implicado en los ciclos circadianos a través de la comunicación cruzada con la hormona circulante melatonina liberada por la glándula pineal y que penetra en diferentes células27. Por otra parte, el SNP rs10830963 de MTNR1B se ha asociado con la obesidad y los niveles de glucosa en ayunas en diferentes estudios transversales28,29. Además, existen pocos estudios que evalúen la relación entre una intervención dietética y esta variante genética localizada en MTNR1B14,30.
El sistema circadiano desempeña un papel importante en la coordinación de las vías metabólicas de los lípidos a través de la activación o represión de los genes implicados en el metabolismo, ya sea indirectamente o directamente mediante el control de otros factores de transcripción31. En este sentido, la melatonina es uno de los cronobióticos utilizados para sincronizar los ritmos circadianos32. En el área del metabolismo lipídico, se ha observado que la administración de melatonina puede disminuir los niveles de lípidos, tanto en estudios en humanos como en animales33. En un estudio, la administración diaria de melatonina redujo el colesterol LDL en sujetos con síndrome metabólico32 y también en pacientes diabéticos tipo 2 mal controlados con metformina34. En nuestro diseño actual, encontramos una relación entre la variante rs10830963 del gen MTNR1B y la pérdida de peso corporal relacionada con la restricción energética en sujetos obesos con ambas dietas hipocalóricas, tal como se muestra en 2estudios anteriores12,17. Los portadores del alelo G mostraron menos pérdida de peso corporal y mejoría de la insulina y HOMA-IR que los no portadores del alelo G, independientemente del tipo de dieta. Sin embargo, otros estudios35-37 no encontraron asociación entre esta variante genética del gen MTNR1B y los cambios de peso corporal después de intervenciones dietéticas prolongadas.
Los mecanismos por los cuales la variante rs10830963 afecta al metabolismo de los lípidos o la resistencia a la insulina siguen siendo desconocidos. El efecto de la grasa de la dieta grasa sobre la expresión rítmica del ARNm de los genes reloj38 o el equilibrio rítmico circadiano39 también ha sido demostrado en animales. Se podría especular que el efecto de la variante genética MTNR1B sobre la dinámica de la expresión de la melatonina podría influir en el metabolismo de las lipoproteínas. Goni et al.17 han demostrado que el consumo de grasa en la dieta modificó el efecto de la variante genética MTNR1B rs10830963 sobre los cambios en el colesterol total y en el colesterol LDL, de manera similar a nuestro estudio. Un metaanálisis también ha reportado interacciones significativas entre el genotipo MTNR1B y el consumo de grasa en los niveles de colesterol40. Existe evidencia de que una dieta elevada en grasas podría alterar los niveles de expresión de ARNm de los genes del reloj y de los genes lipogénicos controlados por el reloj circadiano. Por ejemplo, cuando los ratones eran alimentados con una dieta rica en grasas, la expresión rítmica en el tejido hepático de estos genes estaba sobreexpresada y subexpresada41.
Grotenfelt et al.30 han reportado la relación de esta variante genética con el metabolismo de la glucosa. Esta investigación mostró que entre las mujeres en riesgo de diabetes mellitus gestacional, las no portadoras del alelo G parecen beneficiarse de la intervención en el estilo de vida. El alelo de riesgo G se ha relacionado también con la disminución de la secreción de insulina en respuesta a la glucosa42 y la disminución de la sensibilidad a la insulina43. Un estudio44 observó que el alelo G de rs10830963 que conduce a un aumento del nivel de glucosa se asoció también a una reducción de la función de las células pancreáticas (HOMA-B). Por último, Sparso et al.45 demostraron en sujetos con el alelo G una reducción de la supresión de la producción de glucosa hepática durante un clamp hiperinsulinémico-euglucémico.
Nuestro estudio tiene limitaciones. En primer lugar, solo analizamos un SNP del gen MTNR1B, por lo que otros SNP podrían estar relacionados con nuestras observaciones. En segundo lugar, la intervención a corto plazo puede restringir la posibilidad de detectar diferencias a largo plazo. En tercer lugar, no medimos los niveles circulantes de melatonina en la población del estudio y esto puede producir una mala interpretación de nuestros resultados. Finalmente, nuestra muestra no era necesariamente representativa de la población en general y debería ser replicada para poder ser extendida a otros grupos étnicos.
En resumen, nuestro diseño mostró la asociación del polimorfismo MTNR1B rs10830963 con la pérdida de peso corporal inducida por 2dietas hipocalóricas diferentes y proporcionó pruebas adicionales sobre la respuesta metabólica como son la resistencia a la insulina y los niveles de insulina en ayunas.
FinanciaciónSin financiación.
Todos los pacientes firmaron un consentimiento informado y el protocolo fue aprobado por el Comite de ética local.
AutoríaD.A. de Luis escribió el artículo.
O. Izaola realizó la evaluación nutricional.
D. Primo realizó evaluación bioquímica.
R. Aller realizó análisis estadístico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.