Los nódulos tiroideos (NT) son una patología prevalente que puede generar morbilidad, en cuyo caso el tratamiento tradicional suele ser cirugía.
ObjetivoAnalizar la eficacia del tratamiento con ablación por radiofrecuencia (ARF) como alternativa terapéutica en el control combinado clínico, morfológico y funcional de los NT predominantemente sólidos, benignos y clínicamente relevantes en pacientes no subsidiarios de cirugía.
Materiales y métodosSe realizó un estudio descriptivo, retrospectivo, de serie de casos, para valorar la eficacia y seguridad del uso de ARF. A los pacientes seleccionados se les realizó una evaluación clínica, ecográfica y bioquímica previa al procedimiento; en los meses 1, 3, 6 y 12 tras el mismo y luego cada 6-12 meses según criterio médico.
ResultadosSe realizaron un total de 100 ARF, en 83 pacientes, con 85 NT de ≥ 2,5 cm con un volumen inicial (VI) de 21,48 ± 15,89 mL. Tras una media de 1,17 sesiones de ARF por NT, el volumen disminuyó progresiva y significativamente (p < 0,01 para todos los tiempos frente al valor inicial), con una tasa de reducción de volumen (TRV) respecto al VI de 54,43 ± 19,56% al mes de seguimiento, 67,69 ± 17% a los tres meses, 70,38 ± 15,46% a los seis meses, 70,67 ± 17,27% a los 12 meses y 70,24 ± 17,7% en el último seguimiento. El 88% de los pacientes seguidos > seis meses alcanzó el objetivo combinado de tasa de reducción de volumen de más de 50% del VI, normofunción tiroidea y ausencia de clínica, y en todos estos se mantuvo hasta la fecha final de seguimiento. En nueve de las 100 ARF realizadas se reportaron complicaciones agudas (en su mayoría leves y todas transitorias).
ConclusiónEstos hallazgos validan en nuestro medio la eficacia y seguridad de la ARF en NT predominantemente sólidos de gran tamaño y añaden información no descrita para posicionarla más favorablemente como alternativa terapéutica.
Thyroid nodules (TN) are a prevalent pathology that can generate morbidity, in which case the traditional treatment is usually surgery.
ObjectiveTo analyse the efficacy of radiofrequency ablation (RFA) treatment as a therapeutic alternative in the combined clinical, morphological, and functional control of predominantly solid, benign and clinically relevant TNs in patients not subsidiary to surgery.
Materials and methodsA descriptive, retrospective, case series study was carried out to assess the efficacy and safety of the use of RFA. According to medical criteria, the selected patients underwent a clinical, ultrasound, and biochemical assessment prior to the procedure and then after the procedure at 1, 3, 6, and 12 months and then every 6-12 months according to medical criteria.
ResultsA total of 100 RFA were performed on 83 patients with 85 TNs of ≥2.5 cm with an initial volume (IV) of 21.48 ±15.89 mL. After a mean of 1.17 RFA sessions per TN, the volume decreased progressively and significantly (p< 0.01 for all times compared to the initial value), with a mean volume reduction rate (VRR) in relation to the IV of 54.43 ± 19.56% at 1-month follow-up; 67.69 ± 17% at 3 months; 70.38 ± 15.46% at 6 months; 70.67 ± 17.27% at 12 months and 70.24 ± 17.7% at the last follow-up. 88% of the patients followed up >6 months achieved the combined objective of a volume reduction rate of more than 50% of the VI, thyroid normal function and absence of clinic; and in all of these, it was maintained until the final follow-up date. Acute complications (mostly mild and all transient) were reported in 9 of the 100 RFA performed.
ConclusionOur findings validate in our setting the efficacy and safety of RFA in predominantly large and solid TNs, and add undescribed information to position the technique more favourably as a therapeutic alternative.
Los nódulos tiroideos (NT) son un hallazgo clínico frecuente y en la actualidad más del 50% de la población adulta a nivel mundial tiene al menos un NT, siendo más común en mujeres y en estrecha relación con la edad1.
El 75-85% de los NT no hiperfuncionantes son benignos, predominantemente sólidos, asintomáticos y se pueden manejar con observación ecográfica y seguimiento clínico periódico. No obstante, hasta el 66% crece de manera significativa llegando a generar algún síntoma o signo compresivo2. En estos casos la cirugía era el tratamiento de elección hasta la fecha. Aunque se trata de un procedimiento seguro y disponible en la gran mayoría de centros, son diversos los inconvenientes que presenta: puede asociar complicaciones entre el 1 y 10% de los casos incluso en centros con cirujanos expertos3–6, genera hipotiroidismo en todas las tiroidectomías totales y gran parte de las hemitiroidectomías7, está sujeta a la lista de espera quirúrgica de cada centro o región, suele requerir el uso de anestesia general y hospitalización (y por ende supone un elevado coste). Asimismo, la cirugía puede no ser apropiada para pacientes con alto riesgo quirúrgico o que no deseen someterse a ella1,8.
El 5-10% de los NT predominantemente sólidos son hiperfuncionantes y el radioyodo (I131) es el tratamiento de elección en la mayor parte de ellos. Los estudios tras el tratamiento con I131 muestran una normalización de la función tiroidea en el 75-90% de los pacientes en los primeros meses y una reducción del volumen de un 35-40% de los NT en el primer año9–11. No obstante, la respuesta morfológica individual es muy difícil de predecir ya que hasta el 50% de los pacientes mantiene el tamaño del NT, un 25% continúa creciendo y menos de la mitad presenta mejoría de la sintomatología compresiva. Por otra parte, el riesgo de hipotiroidismo permanente (clínico o subclínico) tras el tratamiento con I131 se sitúa entre el 11-73%12–14. En aquellos NT con hipertiroidismo recidivante o persistente tras I131 o necesidad de rápido control, contraindicación para I131 o que asocian síntomas compresivos, la única opción de tratamiento hasta ahora ha sido también quirúrgica1,8,15,16.
Por todo esto, en las últimas dos décadas se han desarrollado y optimizado diversas técnicas radioguiadas y mínimamente invasivas que actualmente se plantean como opciones útiles en determinados NT. Una de estas alternativas es la ablación por radiofrecuencia (ARF), realizada idealmente de manera ambulatoria, con anestesia local, por un abordaje transístmico con electrodos mono o bipolares, de punta recta activa, autoenfriables y utilizando una técnica denominada «Moving shot»8,16.
La ARF puede inducir un descenso de volumen del NT rápido, significativo y sostenido en el tiempo. La tasa de reducción de volumen (TRV), ya sea en una o varias sesiones de ARF, varía entre el 51 y el 97,9% a final de seguimiento según los centros (en la mayoría un 70-80% a 6-12 meses, momento en el que se suele alcanzar la disminución máxima del mismo para sostenerse en el tiempo). Con la ARF se ha descrito que se obtiene el éxito terapéutico (ET), definido como el descenso de > 50% del volumen inicial (VI), hasta en el 91% de los NT tratados. Los resultados publicados de control sintomático y de calidad de vida son comparables a la cirugía, con una tasa de complicaciones inferior y permaneciendo eutiroideos la mayoría los pacientes que lo eran previamente8,16,17.
La variabilidad en los resultados de TRV y ET se ha atribuido a distintos factores, entre los más consistentes el VI y la composición del NT8,15,18–20. La mayoría de los trabajos publicados incluyen NT con un componente quístico significativo y/o un volumen pequeño pre-procedimiento17,19–26, favoreciendo ambos parámetros los resultados de eficacia.
A pesar de las múltiples publicaciones de ARF en NT, son escasos los estudios que han valorado la eficacia de la técnica específicamente en series de NT predominantemente sólidos (> 50%) y de gran tamaño (VI medio > 20cc), además la mayoría lo suele hacer sin especificar cuántos de los pacientes alcanzan el ET. Más aún, hasta la fecha ningún estudio ha analizado de manera conjunta la eficacia de la técnica en el control simultaneo clínico, morfológico y funcional de cada caso.
El objetivo principal de este trabajo es analizar los resultados de eficacia y seguridad a mediano-largo plazo del tratamiento con ARF (en práctica clínica habitual) en el control integral (clínico, morfológico y funcional) de los NT predominantemente sólidos, benignos, de gran tamaño y clínicamente relevantes en los pacientes tratados en nuestro centro. Igualmente analizamos las diferencias en la consecución de estos objetivos según el VI de dichos NT y la curva de aprendizaje (CA) de nuestro equipo. Por último, exploramos brevemente en la discusión la capacidad de optimización de nuestros resultados y los contextualizamos teniendo en cuenta la reproductibilidad de lo publicado dentro y fuera de nuestro medio.
MetodologíaDiseño de estudio y selección de pacientesSe realizó un estudio descriptivo, retrospectivo, de serie de casos, que analiza los resultados en los pacientes adultos con NT ≥ 2,5 cm, predominantemente sólidos, benignos y clínicamente relevantes tratados con ARF desde la introducción de la técnica en la cartera de servicios de nuestro centro (julio 2014) hasta enero 2019, según nuestro protocolo de práctica clínica habitual (tabla 1). Estos pacientes representaban la totalidad de los tratados con ARF por NT en nuestro centro al momento de inicio de la redacción de este trabajo.
Criterios de inclusión/exclusión para el tratamiento por ablación con radiofrecuencia de nódulos tiroideos benignos en nuestro centro
| Criterios de inclusión |
|---|
| 1. ≥ 18 años |
| 2. Comprensión y firma de consentimiento informado (aprobado por el comité de ética del centro) previo al procedimiento |
| 3. 1 o 2 NTs «dominantes/ diana» predominantemente sólido/s de: |
| - ≥ 2,5 cm de diámetro máximo; |
| - benigno/s (confirmado mediante dos resultados citológicos obtenidos mediante ecoPAAF e informados como tal según criterios de Bethesda); |
| - clínicamente relevante/s, bien por: |
| presentar al menos un síntoma (disnea, disfagia, disfonía, tos o sensación de cuerpo extraño) y/o signo compresivo, bien clínico (signo de pemberton-marañon positivo), radiológico (compresión extrínseca al paso del bolo alimenticio en un tránsito esófago-gastroduodenal o compresión y estrechamiento significativo de la luz traqueal en radiografía/TC de tórax) o espirométrico (patrón sugestivo de compresión de vía aérea superior extratorácica); |
| crecimiento significativo (> 50% del volumen y/o 20% de al menos dos diámetros con respecto al tamaño inicial en al menos 2 últimas ecografías consecutivas) y/o ser hiperfuncionantes (confirmados por gammagrafía tiroidea con pertecnato de Tc 99m o I123) y generar hipertiroidismo (clínico/subclínico). |
| 4. No ser candidato al/los tratamientos/s convencional/es establecido/s según las guías clínicas de consenso nacionales e internacionales vigentes (cirugía y/o tratamiento con I131, según el caso), porque cumplan alguno de los siguientes: |
| - Elevado riesgo quirúrgico |
| - El posible hipotiroidismo postratamiento generaría complicaciones o dificultaría el manejo de comorbilidades/situaciones concomitantes (por ejemplo: pacientes con trastornos psiquiátricos, deseos de fertilidad en el siguiente año, cardiopatía isquémica/insuficiencia cardíaca con FEVI deprimida, etc.) |
| - Presenten alguna comorbilidad que dificulta el tratamiento sustitutivo óptimo con levotiroxina de ser necesario (por ejemplo: gastritis crónica atrófica, infección recidivante/recurrente o persistente de por H. pylori, gastrectomizados, trastorno de malabsorción crónico, intolerancia gastrointestinal permanente o frecuente, etc.) |
| - No deseen realizarse el/los tratamiento/s convencionales |
| Criterios de exclusión |
|---|
| Evidencia de claros signos ecográficos de sospecha de malignidad en el nódulo a tratar o en cualquiera de los NTs que presente el paciente |
| PAAF compatible con malignidad en cualquiera de los NTs que presente el paciente |
| Antecedente de radioterapia cervical previa |
| Antecedentes familiares de primera línea de cáncer diferenciado de tiroides (2), carcinoma medular de tiroides o neoplasias endocrinas múltiples |
| Embarazo confirmado al momento del tratamiento |
| Portador de dispositivos implantables eléctricos |
| Coagulopatía o trombopenia moderada/grave no corregible |
| Parálisis permanente de cuerda vocal contralateral (bien por antecedente o mediante confirmación tras valoración clínica preprocedimiento) |
| Presencia de calcificaciones groseras de gran tamaño o en cascara de huevo que impidan la introducción de la aguja y/o limiten significativamente la visibilidad de la misma en una proporción significativa del nódulo |
| Presencia de crecimiento intratorácico significativo del nódulo a tratar, no abarcable desde el punto de vista técnico (ni siquiera asumiendo una posible disminución parcial del tamaño del nódulo y posible retratamiento de lo residual en una segunda sesión) |
| En el caso de los BMN que, a juicio del médico que va a realizar el procedimiento, el tratamiento de el/los nódulos diana no modifique significativamente la morbilidad generada por el mismo o el curso clínico de la misma, en general debido a la persistencia de enfermedad nodular residual relevante |
El estudio cumple con los principios básicos de la Declaración de Helsinki (2013) de la Asociación Médica Mundial. Debido al diseño del estudio (no intervencionista y retrospectivo), no se requería la obtención de consentimiento informado por parte de los pacientes incluidos dado que no son entrevistados y los datos recogidos, debidamente anonimizados, provienen de la historia clínica del paciente.
Evaluación previa al procedimientoPrevio al tratamiento se les realizó a todos los pacientes una cuidadosa historia clínica con descripción detallada de variables demográficas y clínicas, así como de hallazgos paraclínicos atribuibles al NT/bocio multinodular (BMN) o relevantes para su manejo [sexo, edad, hormona estimulante de la tiroides (TSH) pretratamiento, enfermedad tiroidea autoinmune diagnosticada pretratamiento: sí/no, hipo o hipertiroidismo pretratamiento: sí/no, NT único/BMN, localización de NT tratado, diámetro máximo inicial en mm, VI en mL, presencia de síntomas/signos compresivos pretratamiento, siguiendo los criterios definidos en los criterios de inclusión: sí/no].
Posteriormente, se realizó una ecografía de cuello y un análisis de laboratorio. En caso de que se evidenciara alguna alteración en los parámetros de función tiroidea, la ARF sólo se realizó tras tomar medidas terapéuticas farmacológicas, si éstas estaban indicadas, y confirmar la normalización de los mismos, siguiendo las recomendaciones de las guías de consenso internacionales vigentes y protocolos de práctica clínica habitual de nuestro centro. A su vez se registraron las variables del tratamiento pertinentes para el posterior análisis de los resultados [número de orden del procedimiento, indicación/es del tratamiento, duración en minutos del procedimiento, potencia máxima utilizada (en W), ablación completa: sí/no, necesidad de analgesia y/o corticoides intravenosos pre-procedimiento: sí/no, complicaciones agudas peri-procedimiento: sí(cual)/no].
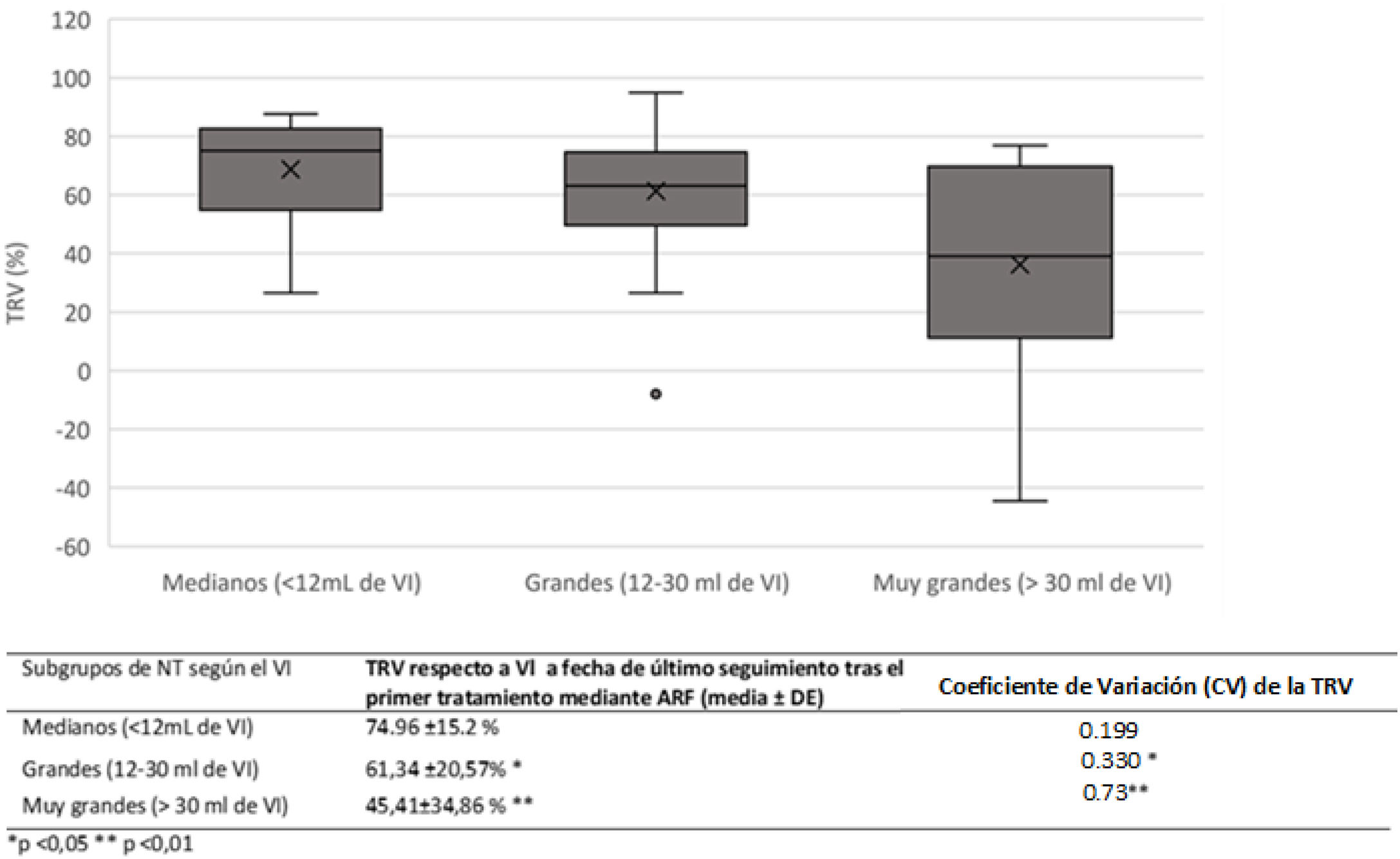
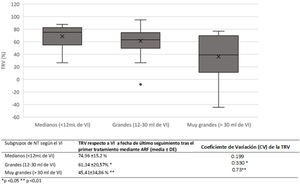
De acuerdo con lo publicado19,23,27–34 clasificamos los NT según el VI como medianos (≤ 12 mL), grandes (12-30 mL) y muy grandes (> 30 mL).
Ablación por radiofrecuenciaLos procedimientos se llevaron a cabo por dos especialistas con más de cuatro años de experiencia contrastada en procedimientos intervencionistas de patología cervical y entrenados previamente en ARF sobre NT. Fueron realizados de manera ambulatoria, con anestesia local (en los 10 primeros casos además bajo sedación consciente) y siguiendo las recomendaciones del consenso para ARF de la Sociedad Coreana de Radiología Tiroidea del 201234 refrendadas posteriormente por la mayoría de los consensos internacionales22.
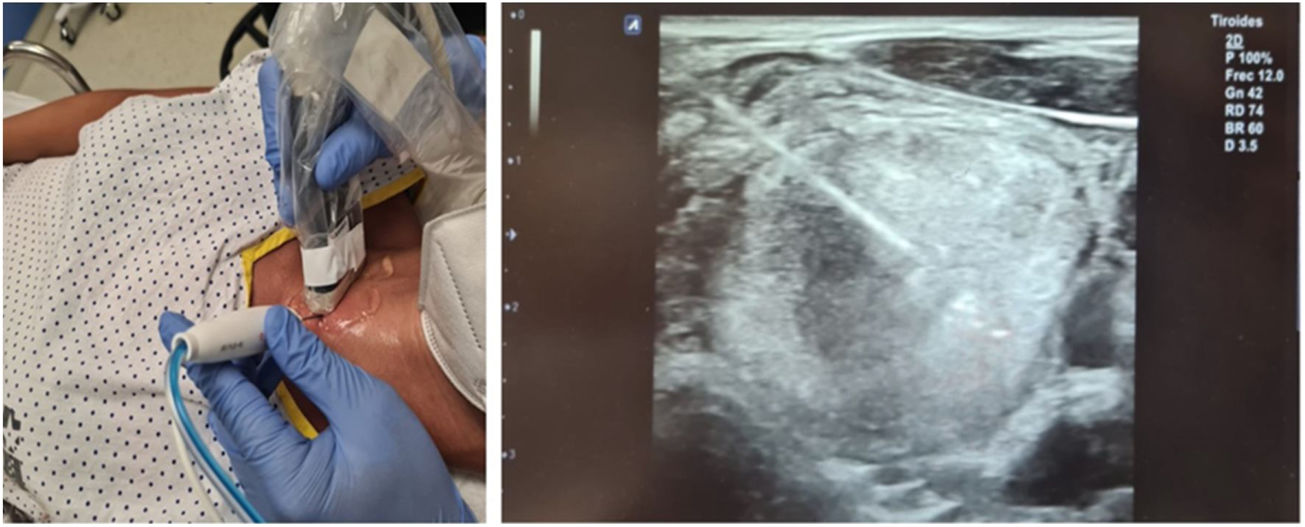
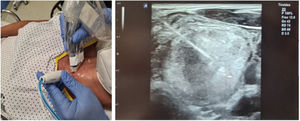
Previo a la ablación, cada paciente se colocaba en posición supino con el cuello hiperextendido y se le canalizaba un acceso venoso en el brazo. Se determinaba el punto de acceso más favorable y, con control ecográfico, se introducía anestesia (lidocaína al 2%) pericapsular y en tejido celular subcutáneo del sitio de punción (momento en el que se considera iniciado el procedimiento). Posteriormente se insertaba un electrodo monopolar, autorefrigerable, de 19G, 7 cm de largo y con una punta recta activa de 1 cm (STAR TIR RF 19-07s10f.), conectado a un generador de radiofrecuencia (Cool-tip VIVA RFSystem, StardMed) del que se originaba una corriente eléctrica alterna (pudiendo utilizar de 0–200 W de potencia, con una carga de salida máxima de 50 Ω), y simultáneamente a una bomba peristáltica de refrigerado. Una vez introducido el electrodo por un abordaje transístmico, este era desplazado por el interior de NT para ser tratado, utilizando la técnica de «Moving shot»26, hasta completar la ablación (fig. 1).
En NT de muy gran tamaño, cuando el procedimiento era prolongado o la manipulación exahustiva/laboriosa, se administraba durante la ARF una dosis única de 20 mg metilprednisolona IV para reducir el edema peritiroideo post tratamiento.
Cuidados, evaluación y seguimiento posterior al procedimientoUna vez finalizado el procedimiento, los pacientes permanecían en observación en cama aproximadamente 1 o 2 horas y se les aplicaba hielo local. Se realizaba una ecografía cervical de control para valorar la ablación completa o no del NT y la ausencia de complicaciones inmediatas. Tras confirmar la buena evolución y tolerancia oral, se les daba el alta con indicaciones de analgesia a demanda.
En el seguimiento se llevó a cabo una valoración clínica [(desaparición de síntomas/signos compresivos presentes pre-tratamiento: sí/no, síntomas/signos sugerentes de complicaciones crónicas: sí(cual)/no)], y ecográfica (tasa de reducción de volumen, consecución de éxito terapéutico: sí/no) en los meses 1, 3, 6 y 12 tras el procedimiento y posteriormente cada 6-12 meses según criterio médico. Así mismo, en los meses 1, 3 y 6 (o 12) se evaluó la función tiroidea y se constató la necesidad o no de iniciar o ajustar medicación para su control.
Se definió un objetivo combinado de control integral clínico-morfo-funcional que incluía la consecución de ET, normofunción tiroidea (mantenimiento o mejoría según el caso) sin tratamiento médico y ausencia de clínica compresiva tras la ARF y se evaluó en todas las visitas a partir de los seis meses.
Análisis estadísticoEl análisis estadístico se realizó con IBM-SPSS Statistics versión 21. Se utilizó la prueba de Kolmogorov-Smirnov para evaluar la distribución de las variables cuantitativas. Las variables cuantitativas se expresaron como media/mediana y desviación estándar (DE)/rango según el caso, y las variables cualitativas en frecuencias absolutas y relativas (porcentaje). Para comparar los valores medios de dos grupos se usó la t student o de U de Mann-Whitney según su distribución normal o no normal respectivamente. Los cambios en el seguimiento con respecto a los parámetros basales se analizaron mediante la prueba de rango con signo de Wilcoxon en variables con distribución no normal. Para probar la significación estadística de la TRV y el ET entre subtipos de NT se aplicó la prueba de análisis de la varianza (ANOVA) de un factor para muestras relacionadas. Para comparar el grado de variación entre subgrupos, se utilizó el coeficiente de variación (SD relativo). Se consideraron valores estadísticamente significativos cuando p < 0,05.
ResultadosDescriptivosDurante el período de estudio se evaluaron un total de 702 pacientes nuevos en la consulta de NT. De estos realizamos un total de 100 ARF (a 83 pacientes con 85 NT con un VI de 21,48 ± 15,89 mL), con una media de 1,17 sesiones de ARF por NT (rango 1-2). 70 NT (82,36%) recibieron un único tratamiento, mientras que otros 15 NT (17,64%) requirieron una segunda sesión de ARF a lo largo del seguimiento (tras una media de 17,3 ± 8,19 meses del tratamiento inicial; rango: 2,5-34,3 meses). Las características generales de los pacientes, NT y procedimientos se muestran en la tabla 2.
Características generales de los pacientes/nódulos tiroideos tratados y procedimientos realizados
| Pacientes tratados | 83 |
|---|---|
| Sexo M/F | 17/66 |
| Edad en años (media ± DE, rango) | 46,5 ± 13,27, 20,6-88,4 |
| TSHa pretratamiento (media ± DE; mediana, rango) en mUI/L | 1,62 ± 0,98; 1,47; 0,01-4,54 |
| Número de pacientes con enfermedad tiroidea autoinmune | 112 hipotiroideos (en tratamiento con LT4) |
| Número de pacientes con hipertiroidismo | 8 (3 con hipertiroidismo franco y 5 hipertiroidismo subclínico)* |
| Nódulos tiroideos (NT) tratadosg | 85 |
|---|---|
| NT únicos/en contexto de BMN | 54/31 |
| Localización de NT tratados (LTD, LTI, istmo) | 57/27/1 |
| Composición (100% sólidos, > 80%, entre 50 y 80%) | 76/5/4 |
| Diámetro máximo inicial en mm (media ± DE; mediana y rango) de los NT | 44,23 ± 11,24; 42, 24,9 -73,994,11% de los NT tenían un diámetro máximo inicial > 30 mm |
| Volumen inicial (VI) en mL (media ± DE; mediana y rango) de los NT | 21,48 ± 15,89; 17,62 (4,37-72,24)96,47% de los NT tenían VI > 5 mL; 42,35% >20 mL y 12,94% > 40 mL |
| -No. de NT medianos o con < 12 mL de VI (media VI) | 30 (7,67 mL) |
| -No. de NT grandes o con 12-30 mL de VI (media VI) | 39 (19,69 mL) |
| -No. de NT muy grandes o con > 30 mL de VI (media VI) | 16 (48,85 mL) |
| Procedimientos/sesiones de ARF realizadas | 1001,17 por NT (rango 1-2) |
|---|---|
| 1ra sesión: | 85 |
| Tiempo de duración (media ± DE; mediana y rango) en min | 56,8 ± 22,4; 55 (15-135) |
| Potencia máxima (media ± DE; mediana y rango) en W | 36,9 ± 8,86; 35 (25-60) |
| Número de procedimientos que requirieron analgesia intravenosa (IV) en el procedimientob | 22 |
| Número de procedimientos en los que se administró corticoides IVc | 32 |
| Número de ARF incompletasd | 21(24,7%) |
| 2da sesión (retratamiento): | |
| Número de NT que requirieron una segunda sesión de ARFe | 15/85 (17,64%) |
| Tiempo de duración (media ± DE; mediana y rango) en minf | 58,7 ± 23,9; 60, (25-105) |
| Potencia máxima (media ± DE; mediana y rango) en W | 36,9 ± 8,48; 35, (25-55) |
| Número de procedimientos que requirieron analgesia intravenosa (IV) en el procedimientob | 5 |
| Número de procedimientos en los que se administró corticoides IVc | 3 |
| Indicaciones de tratamiento | |
| - Número de NT sintomáticos** | 58 |
| - Número de NT asintomáticos con signos compresivos | 18 |
| - Número de NT asintomáticos de > 30 mm que habían demostrado crecimiento significativo*** | 3 |
| - Número de NT hiperfuncionantes no candidatos a otras alternativas de tratamiento*** | 8 |
Determinamos tirotropina sérica (TSH) junto a T4l en suero (y en los nódulos hiperfuncionantes T3 libre de suero), por inmunoanálisis mediante quimioluminiscencia directa (Advia Centaur, Bayer rango normal 0,55–4,78 mUI/L, 0,8–1,8 ng/dL y 2,3–4,2 pg /mL, respectivamente); anticuerpos anti Tg en suero (rango normal 0–115 UI/mL) y anticuerpos antitiroperoxidasa en suero (rango normal 0–10 IU/mL) por método competitivo con señal electroquimioluminiscente (Cobas e411; Roche).
5 de los cuales estaban con tratamiento previo antitiroideo (metimazol/tiamazol, dosis media 8 ± 6,70, rango 5-20 mg/día).
Todos en correlación con algún signo compresivo (clínico, en radiografía, espirometría o estudio EGD).
Paracetamol 1g o dexketoprofeno 25 mg dosis única por dolor (leve/moderado) y/o molestias locoregionales/posturales cervicales.
< 100% del parénquima del nódulo tratado con ARF (a percepción del realizador). Entre las causas destacan: 10 (47,6%) por la localización del nódulo o parte del mismo (parcialmente endotorácico), 2 (9,52%) por las características del nódulo (macrocalcificaciones o zonas con ecogenicidad que dificultaba la visualización de estructuras de riesgo/ la punta del electrodo), 3 (14,2%) por escasa colaboración del paciente y 1 caso (4,67%)en el que se detuvo la ablación por una complicación aguda (hematoma peritiroideo, tratada con crioterapia y compresión externas permaneciendo un día de ingreso hospitalario para observación).
Los motivos del retratamiento fueron: En 8 NT (53,33% del total de retratados) una disminución de volumen menor < 50% del volumen inicial tras al menos seis meses de seguimiento, con un remanente nodular vascularizado y que no decrece en al menos dos consultas consecutivas; en 6 NT(40%) porque a pesar de que el descenso de volumen era > 50% tras al menos seis meses, persistía un remanente nodular vascularizado y clínicamente relevante (a juicio del paciente o el clínico) y 1 NT (6,66%) retratamiento precoz porque, tras una ablación incompleta, a los tres meses persistía un remanente viable de > 50% del volumen inicial y estable con respecto a la consulta del mes.
El volumen de los NT disminuyó progresiva y significativamente (p < 0,01 para todos los tiempos frente al valor inicial) mostrando una TRV respecto al VI de 54,43 ± 19,56% al mes de seguimiento, lo que correspondía a una media de volumen residual (MVR) de los NT a esa fecha de 10,19 ± 11,21 mL, 67,69 ± 17% a los tres meses (MVR de 8,12 ± 9,36 mL); 70,38 ± 15,46% a los seis meses (MVR de 7,76 ± 9,30 mL); 70,67 ± 17,27% a los 12 meses (MVR 7,66 ± 8,27 mL) y 70,24 ± 17,7% (MVR de 6,5 ± 7,01 mL) a fecha de último seguimiento (15,84 ± 12,18 meses) (fig. 2).
Si analizamos sólo los NT seguidos al menos seis meses tras la ARF (63 NT, con un VI de 21,81 ± 16,04 mL), la TRV a fecha de último seguimiento (media 19,74 ± 9,61 meses) fue del 76,99 ± 10,51%, lo que correspondía a una MVR de 7,08 ± 9,1 mL. El 90,47% de estos mantenía el ET al final del seguimiento (78,9% tras una única sesión).
En el 100% de los pacientes con clínica compresiva, ésta desapareció antes de los primeros tres meses de seguimiento. El 98,7% de los pacientes con una función tiroidea normal se mantuvieron eutiroideos en el seguimiento. Todos los pacientes hipertiroideos previos (n = 8), tanto clínicos como subclínicos, mejoraron tras el tratamiento, y el 80% (4 de 5) de los que usaban medicación antitiroidea dejó de necesitarla antes de los tres meses.
El 88% de los pacientes seguidos > 6 meses alcanzó el objetivo combinado de control morfológico, funcional y clínico, y en todos estos se mantuvo hasta la fecha final de seguimiento.
SeguridadEn nueve de las 100 ARF realizadas surgió alguna complicación aguda (en su mayoría leves y todas transitorias) y sólo en siete pacientes se reportó algún efecto secundario durante el seguimiento (tabla 3).
Resultados de seguridad
| Número de complicaciones agudas | 9 en 100 procedimientos |
|---|---|
| 3 Graves | 2 Disfonía transitoria periprocedimientoa1 Hematoma peritiroideo moderadob |
| 6 Leves | 3 Hipotensión ortostática sintomática2 Crisis hipertensivasc1 Hematoma peritiroideo leved |
| Número de efectos secundarios a mediano plazo | 7 en 100 procedimientos |
| 6 Hipertiroidismos subclínicos (asintomáticos, leves y transitorios)e | |
| 1 Hipotiroidismo subclínicof |
La TRV tras el primer tratamiento, difirió significativamente entre los NT medianos, grandes y los muy grandes (tabla 5). A su vez, la variabilidad en el porcentaje de disminución de volumen tras una primera ARF (medida por el coeficiente de variación, CV), fue significativamente mayor para los NT muy grandes que para los otros dos grupos, en todas las etapas de seguimiento.
No se detectaron diferencias significativas en la TRV ni en la proporción de pacientes que alcanzaron ET cuando se analizaron por otros parámetros demográficos (edad, sexo), clínicos (presencia o no de sintomatología, motivo de indicación), contexto (BMN o NT único), localización (derecho, izquierdo) o características del NT (proporción de componente sólido, ecogenicidad) ni del procedimiento (potencia máxima utilizada o tiempo de procedimiento).
A fin de analizar la repercusión de la CA en nuestros resultados los clasificamos en tres subgrupos: A) primeros 10 NT tratados, B) NT 11 al 40 y C) NT 41 al 85 (tabla 4). La proporción de NT que alcanzaron > 50% de descenso de volumen, y por tanto el ET (tanto tras una sesión de ARF como a fecha final de seguimiento), se incrementó progresivamente a medida que aumentó el número de procedimientos realizados, al punto que a partir del NT número 49, todos los pacientes tratados alcanzaron el ET (y sin evidencia de complicaciones).
Resultados de eficacia según el número de orden del tratamiento en nódulos seguidos al menos durante seis meses
| Volumen inicial (VI) en mL | Tasa de reducción de volumen (TRV) respecto a Vl (%) a fecha de último seguimiento tras 1ra sesión de ARF (media ± DE) | Proporción (%) de NT que alcanzaron el éxito terapéutico (ET) a fecha final seguimiento (tras 1 o 2 tratamientos de ARF) | Proporción (%) de NT que alcanzaron el ET a fecha seguimiento (tras 1 o 2 de ARF) | |
|---|---|---|---|---|
| Subgrupos según número de orden | ||||
| Grupo A: primeros 10 NT tratados | 29,87 ± 22,81 | 51,37 ± 31,66 | 50 | 70 |
| Grupo B: NT #11 al 40 | 20,61 ± 16,27* | 65,74 ± 29,02 | 83,3** | 90** |
| Grupo C: NT # 41 al 85 | 18,57 ± 9,66*,a | 71,17 ± 14,82**,a | 90,9** | 100** |
Ninguno de los 40 NT con un VI ≤ 17 mL requirió más de una sesión de tratamiento, alcanzando así una media de TRV con respecto al VI de 70,43 ± 21,27% (15,43 ± 13,29 meses, rango 0,9-53,1 meses), siendo significativamente mayor en comparación con el 56,36 ± 25,06% de los nódulos de > 17 mL tras el primer tratamiento (no así tras > 1 sesión de ARF que se alcanza una TRV en estos nódulos de 66,82 ± 22,29%).
Igualmente, aunque el 93,33% (14/15) de los NT tratados con >1 sesión de ARF presentaban síntomas compresivos previo a la primera sesión, todos dejaron de tenerlos antes de que transcurriera un mes del primer procedimiento y continuaron asintomáticos en todo el seguimiento.
Por otro lado, en 4 (26%) de los NT re-tratados, la primera sesión de ARF se consideró incompleta y uno (6,6%) era un NT hiperfuncionante que condicionaba un hipertiroidismo franco. Además, la media del VI de los NT que requirieron una segunda sesión de tratamiento era de 38,1 ± 17,37 mL (rango 17,27-72,24 mL), mientras que la de los NT que sólo requirieron una sesión de ARF era significativamente menor (17,9 ± 13,16 mL, rango 4,37-68,21 mL, p < 0,00001).
La media de seguimiento tras el segundo tratamiento de los 15 NT tratados con > una sesión fue de 6,95 ± 5,63 meses y a pesar de ello el TRV a fecha de último seguimiento de 73,74 ± 14,14%, con un 86,66% de pacientes alcanzando el ET (y 73,33% descenso > 70% del VI).
No hubo diferencias entre la TRV final alcanzada por los NT tratados con una sesión y aquellos tratados con dos (69,50 ± 18,37% vs. 65,86 ± 33,44%, p = 0,68).
Recurrencia7 NT (8,23%), con un VI de 21 ± 7,86 mL, presentaron recrecimiento significativo en el seguimiento tras el primer tratamiento (remanente del NT clínicamente relevante y de > 50% del VI a pesar de haber alcanzado ET previamente). Esto ocurrió tras una media de 21,75 meses (rango 13-34) de seguimiento.
DiscusiónLa eficacia morfológica de la ARF se ha evaluado tradicionalmente como la TRV o la proporción de NT que alcanzan el ET, y la relevancia clínica con la disminución o desaparición de la sintomatología compresiva8,17,22–24,35. No obstante, la TRV disminuye significativamente en NT predominantemente sólidos y/o de gran tamaño, además la variabilidad de respuesta y la tasa de recidivas aumentan en estos últimos18,23,27–29. Los resultados globales de nuestra serie en estos tres parámetros están dentro de lo publicado. Si bien las series más grandes o en centros con gran experiencia (en su mayoría coreanas e italianas), han obtenido resultados similares o ligeramente superiores a los nuestros en TRV y ET, en general estos estudios están hechos en pacientes bien: 1) con NT con VI medios significativamente más pequeños que los de nuestra serie o 2) incluyendo NT mixtos predominantemente quísticos o en los que la proporción de dicho componente no fue analizada8,17,19,22–24,26,28,33,36.
Tras una revisión exhaustiva de la bibliografía publicada a la fecha de culminación de este manuscrito, aparte del nuestro, sólo encontramos 11 estudios que hayan analizado resultados del tratamiento con ARF en NT predominantemente sólidos y con VI medio de ≥ 20 mL. Estos muestran TRV variables entre 44,6-80,1% respecto al inicial a seis a 24 meses de seguimiento (tabla 5). De ellos, los únicos fuera de Italia y Asia son dos series pequeñas, con resultados de eficacia a mediano plazo en principio inferiores y más heterogéneos que los nuestros. Esto puede tener que ver, como ellos mismos apuntan, con la necesidad de una mayor CA para la optimización de los mismos37,38.
Comparativa estudios (publicados a la fecha de redacción del manuscrito) de tratamiento por ARF de NT normofuncionantes, predominantemente sólidos y con VI medio de ≥ 20 mL
| Tipo de ablación y electrodo utilizado | N(#NT) | Proporción de NT no funcionantes | Proporción de componente sólido | VI (mL) Media±DE y (rango) ó [RIC] | Sesiones de ARF Media; proporción de pacientes con 1 sesión (rango) | TRV global respecto a VI a 6m. Media ± DE ó (RIC) | TRV global respecto a VI a 12m. Media ± DE ó (RIC) | TRV global respecto a VI a fecha final de seguimiento. Media ± DE ó [RIC] | Proporción de NT con ET a fecha final de seguimiento | Tasa de recrecimiento | Diferencias en TRV en subgrupo de nódulos según VI | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Spiezia et al. (2009)18 | fija con electrodo monopolar multipunta autoexpansible | 94 | 70,21% | ≥70% | 24,5±2,1; (4,5–103) | 1,47; 66% una sesión (rango 1-3)**** | 57,8±9% | 78.6±2% | 79,4±2,5% (a 24 meses) | NE | 34%. | NE. No obstante, se encontró una correlación inversa significativa entre el TRV y el VI (<0,01) |
| Valcavi et al. (2015)27 | “moving shot” con electrodo monopolar monopunta rígido autoenfriable | 40* | 100% | ≥80% | 30,0±18,2; (6,5-90) | 1 | 55,1±18.5%, | 67,7±17,3% | 80,1±16,1% (a 24 meses) | NE | 0% | NE |
| Cesareo et al. (2015)44 | “moving shot” con electrodo monopunta rígido autoenfriable | 42 | 100% | ≥70% | 24,5±19,6 (3.4 -89) | 1 | 68,6±13,5% | NE | NA | NE | NE | Si en NT de > 30 ml de VI (y con mayor coeficiente de variación) |
| Cesareo et al. (2017)45 | “moving shot” con electrodo monopolar monopunta rígido autoenfriable | 48 | 100% | ≥70% | 23,5±18,6 (NE) | 1 | 68,6±13,65% | 71,1±14,3% | NA | NE | 4,2% | Si entre los NT de <12 ml de VI, 12-30 ml y > 30 ml de VI |
| Pacella et al. (2017)29 | “moving shot” con electrodo monopolar monopunta rígido autoenfriable | 138** | 100% | ≥70% | 24,5 ± 17,9(NE) | 1 | 57±21% | 62±22% | NA | 69% | NE | Si entre los NT de <13,1 ml 13,1-30 ml y > 30 ml de VI |
| Deandrea et al.(2019)43 | “moving shot” con electrodo monopolar monopunta rígido autoenfriable | 215*** | NE | ≥70% | 20,9 [15-33] | (rango 1-2) | 56,90% | 64,11% | 66,9% tras una media de 35 meses | NE | 4,1% | Si entre los NT de <10 ml de VI, 10-20 ml y > 20 ml de VI |
| Deandrea et al.(2019)41 | “moving shot” con electrodo monopolar monopunta rígido autoenfriable | 337 | 100% | ≥70% | 20,7 [13.7–33.1] | 1 | 63.50% | 70% | NA | NE | NE | Si entre los NT de <15 ml de VI, 15-30 ml y > 30 ml de VI |
| Guang et al.(2019)32 | moving shot” con electrodo bipolar monopunta rígido autoenfriable | 194+ | 100% | ≥70% | 21,2 ± 19,7 (1.1–91,1) | 1,5± 0,6; 50,5% 1 sesión (rango 1-3) | NE | NE | NE++ | NE | 0% | Si entre los NT de <5,1 ml de VI, 5,1- 13,1 ml 13,1-30 ml y > 30 ml de VI |
| Hamidi et al. (2018)37 | “moving shot” con electrodo monopolar monopunta rígido autoenfriable | 14 | 92.30% | ≥50% | 24,2 [17,7-42,5] | 1 | 44,2% (40,7-59) | 54,3% (29,2- 57,9) | 44.6% [42,1-59,3] tras una media de 8,6 meses | NE | NE | NE |
| Familiar et al.(2020)38 | “moving shot” con electrodo monopolar monopunta rígido autoenfriable | 24 | 83.30% | ≥50% | 25,4±15,5 (8,2-66,1) | 1 | 57,5±24% | 65,4±20,7% | NA | 65% a 6 meses y 81,2% a 12 meses | NE | Si en NT de > 20 ml de VI así como el porcentaje de ET |
| Cesareo et al. (2021)35 | “moving shot” con electrodo monopolar monopunta rígido autoenfriable | 30+++ | 100% | ≥80% | 26,5 ± 21,2 (NE) | 1 | 66 ± 16% | 70,9± 16.9% | NA | 89,7% a 12 meses | 10% | NE |
| Nuestra serie | “moving shot” con electrodo monopolar monopunta rígido autoenfriable | 85 | 94,11% | ≥50% (pero 95,2% de los NT≥80%) | 21,48±15.89 (4,37-72,24) | 1,17; 82,3% una sesión, (rango 1-3) | 70,38±15,46% | 70.67±17.27% | 70,24±17,7% tras una media de 15,84 meses | 90,47% | 8,23% | Si tras 1 sesión entre los NT de <12 ml de VI, 12-30 ml y > 30 ml de VI (y con mayor coeficiente de variación) |
NT: nódulo tiroideo; VI: Volumen inicial; TRV: tasa de reducción de volumen; ET: éxito terapéutico; NE: no especificado; NA: No aplica
Tal y como hicieron Familiar et al y Aysan et al.38,39, en nuestro estudio los primeros casos se agrupan por separado para analizar la CA, e igual que los últimos autores, las TRV fueron más bajas y heterogéneas en los primeros 10 casos en comparación con los posteriores. Sin embargo, es difícil extrapolar conclusiones con respecto a nuestros resultados ya que, como hemos descrito previamente, en nuestra serie los NT que se trataron al principio tenían un VI mayor. No obstante, la proporción de NT con VI ≥ 20 mL fue similar tanto en los primeros pacientes tratados como en los NT tratados posteriormente. A pesar de esto, las TRV respecto al VI fueron estadísticamente significativas aún para los primeros 10 casos, y no hubo diferencias en la tasa de complicaciones. Hasta la fecha, sólo hay otro estudio40 que valora prospectivamente la CA para los operadores en ARF de NT y proponen un punto de corte de experiencia similar al encontrado por nosotros (> 60 casos) para alcanzar una óptima y reproducible tasa de eficacia morfológica del procedimiento (tanto en términos de TRV como de ET). Esto es coincidente con el rango de > 50-60 casos que algunos autores plantean (empíricamente), no solo para asegurar eficacia sino para minimizar la probabilidad de efectos secundarios30,31,41; aunque a igual que nosotros Aysan et al.39 tampoco encontraron diferencia en las tasas de complicaciones entre los primeros 10 pacientes y el resto en su cohorte de 100 tratados.
El número de sesiones de ARF necesarias para obtener nuestros resultados (media de 1,17 por NT, rango 1-2, 82,35% de pacientes con un único tratamiento) es equiparable o menor a lo descrito en ARF de NT de similares características y utilizando en general potencias máximas menores a las descritas hasta ahora18,28,30,32,41.
Todos los NT de ≤ 17 mL de VI y casi dos terceras partes (64,8%) de los NT de ≥ 20 mL pudieron tratarse con una sesión ARF a pesar de que varios autores describen que ya con NT de > 12 mL suele necesitarse una segunda sesión y la mayoría de los de 20-30 mL la necesitarían22,23,29,31,32. Cervelli et al. en 201725 hicieron un estudio comparativo de NT de ≥ 20 mL y < 20 mL en el que se trataron 51 NT con > 75% de componente sólido y de estos 20 tenían un volumen > 20 mL (no especifican el VI medio, DE y/o rango). En estos últimos, el descenso medio de volumen tras el tratamiento fue del 62,9% a 6 meses, significativamente más bajo que el de los NT de menor tamaño. De los 20 NT de ≥ 20 mL, el 30% necesitaron dos sesiones de ARF y en estos el descenso de volumen tras 6-12 meses de seguimiento después de la segunda ablación fue de 86,4 y 88,2% con respecto al original respectivamente, proporción y resultados comparables con los de nuestra serie. Ciertamente, el VI medio de nuestros pacientes tratados con más de una sesión (38,1 mL) era llamativamente mayor (55% más) que el de los tratados con una sesión. A pesar de esto, todos obtuvieron beneficio clínico con el primer procedimiento y una segunda sesión permitió igualar los resultados finales de eficacia morfológica.
La eficacia morfológica en la pequeña proporción de NT hiperfuncionantes en nuestra serie parece estar dentro de las descritas8,16,17,22,24,29,42, con un descenso del 73,5% con respecto a VI tras una media de 13,8 meses de seguimiento. Llamativamente no hubo diferencias significativas en la TRV comparados con los NT normofuncionantes, a pesar de ser NT también gran tamaño (VI 22,15 ± 15,82 mL).
Por otra parte, en lo que respecta al control funcional, reafirmamos la seguridad y eficacia de la ARF. Nuestro estudio mostró que el 98,7% de los pacientes con función tiroidea normal se mantuvieron eutiroideos hasta el final del seguimiento; todos los pacientes con hiperfunción previa mejoraron significativamente tras el tratamiento, y el 80% de los que usaban medicación antitiroidea dejó de necesitarla antes de los tres meses.
La proporción, características y contexto de los efectos secundarios, así como las complicaciones y las recidivas son similares a lo publicado16,20,22,25,26,29,30. No obstante, ponen en manifiesto la necesidad de más estudios que exploren marcadores pre-procedimiento predictores de eventos que permitan tomar medidas preventivas.
Entre las limitaciones de nuestro trabajo se incluyen: el ser un estudio retrospectivo sin grupo comparador, que valora la clínica compresiva mediante una escala nominal dicotómica, no considera la repercusión del tratamiento en la calidad de vida del paciente y presenta un período limitado de seguimiento con una pérdida considerable de datos a largo plazo; si bien otros estudios que carecen de estas limitaciones señalan que tras resultados iniciales y a mediano plazo similares a los nuestros, existe persistencia de la eficacia de la ARF a largo plazo en la mayoría de los casos17,21,28,43.
ConclusiónNuestra publicación parece ser de las primeras, fuera de Italia y China, sobre el tratamiento con ARF en NT predominantemente sólidos de gran tamaño que muestra reproductibilidad de los resultados de eficacia morfológica descritos en los centros con gran experiencia en la técnica. El número de procedimientos, la CA y nuestros resultados de eficacia y seguridad nos permiten posicionar a nuestro equipo dentro de este último grupo. Hasta la fecha, no se había valorado de manera específica un objetivo combinado de control clínico, morfológico y funcional de la enfermedad nodular tiroidea clínicamente relevante con ARF. Que el 88% de nuestros pacientes seguidos más de seis meses alcance este objetivo compuesto, pone en perspectiva la utilidad de la ARF como una alternativa en nuestro medio en el manejo de estos pacientes. No obstante, en aquellos pacientes con NT de > 30 mL VI los resultados morfológicos (no así los clínicos y funcionales) son más heterogéneos y por ello pueden necesitar un segundo procedimiento. Todo esto a falta de estudios prospectivos, controlados y más largo plazo en nuestro medio que den mayor solidez a estos resultados y permitan valorar su sostenibilidad en el tiempo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.