El síndrome de Cushing ACTH-independiente (SCAI) supone el 15-20% de los casos de síndrome de Cushing, de los cuales <1% son debidos a receptor anómalo. Nuestro objetivo es estudiar la presencia de receptor anómalo en los sujetos diagnosticados de SCAI con hiperplasia nodular suprarrenal en un período de 14 años (2002-2016), así como sus características clínico-biológicas y evolutivas.
Material y métodosEstudio descriptivo multicéntrico de una serie de 15 casos de SCAI con hiperplasia nodular suprarrenal (período de estudio: 2002-2016). En ellos se hizo el despistaje de receptor anómalo, mediante pruebas de estimulación, considerando patológico un aumento de cortisol plasmático ≥ del 25% respecto al valor basal.
ResultadosDe los 15 casos, 13 fueron mujeres, con una edad media al diagnóstico de 56,8 años. En 12 de los 15 casos estudiados se detectó positividad de las pruebas de estimulación. De ellos, fueron positivos para comida de prueba el 25%, para test postural de deambulación el 58,3%, para desmopresina el 33,3%, para terlipresina el 25%, para GnRH el 33,3%, para LH el 25% y para metoclopramida el 50%. En cuanto al tratamiento, se llevó a cabo suprarrenalectomía bilateral en el 16,7% y unilateral en el 41,7%. El resto continúan en observación con revisiones periódicas (41,7%).
ConclusionesEn la mayor parte de los casos estudiados con SCAI e hiperplasia nodular suprarrenal (80%) se detecta una respuesta de cortisol anormal debida a la presencia de receptor anómalo. La prueba con mayor porcentaje de positividad fue el test postural de deambulación (58,3%).
ACTH-independent Cushing's Syndrome (AICS) accounts for 15-20% of cases of Cushing's syndrome, with <1% due to abnormal receptors. Our aim is to study the presence of abnormal receptors in subjects diagnosed with AICS with nodular adrenal hyperplasia in a 14-year period (2002-2016), as well as its clinical-biological and evolutive characteristics.
Material and methodsA multicentre descriptive study of a 15-case series of AICS with nodular adrenal hyperplasia (study period: 2002-2016). In these cases, abnormal receptor screening was performed by means of stimulation tests, with a plasma cortisol increase of ≥ 25% from baseline being considered pathologic.
ResultsOf the 15 cases, 13 were female, with a mean age at diagnosis of 56.8 years. In 12 of the 15 cases studied, positivity was detected with stimulation tests, and, of them, 25% were positive for the meal test, 58.3% for posture walking test, 33.3% for desmopressin; 25% for terlipressin; 33.3% for GnRH; 25% for LH and 50% for metoclopramide. Regarding treatment, bilateral adrenalectomy was performed in 16.7% and unilateral adrenalectomy in 41.7%.
The rest continue under observation with periodic follow-up (41.7%).
ConclusionsIn most of the cases studied with AICS and nodular adrenal hyperplasia (80%), an abnormal cortisol response is detected due to the presence of abnormal receptors. The test with the highest percentage of positivity was the postural walking test (58.3%).
El síndrome de Cushing ACTH-independiente (SCAI) supone el 15-20% de los casos totales de síndrome de Cushing. La mayoría de estos casos son debidos a un tumor adrenal unilateral (≥90%) y el resto se deben a lesiones adrenales bilaterales. Dentro de las causas de SCAI por lesiones adrenales bilaterales encontramos la hiperplasia suprarrenal micronodular pigmentada y la hiperplasia suprarrenal macronodular (BMAH) de causa desconocida o secundaria a la expresión de receptores aberrantes.
La hiperplasia micronodular pigmentada es una causa muy rara de síndrome de Cushing. El tamaño de las glándulas suprarrenales suele ser normal o discretamente aumentado y están ocupadas por nódulos pigmentados de 2-4mm con córtex internodular atrófico. Aproximadamente el 50% de los casos son esporádicos y el resto, familiares, que pueden asociarse al complejo de Carney con herencia autosómica dominante. Los síntomas de hipercortisolismo aparecen siempre antes de los 30 años de edad y por debajo de los 15 años en la mitad de los casos.
La BMAH, antes conocida como hiperplasia suprarrenal macronodular ACTH-independiente, es la causa de menos del 1-2% de los casos de síndrome de Cushing1,2. No obstante, su prevalencia puede estar infraestimada por la escasa sintomatología que produce en muchos casos y por las dificultades que conlleva su diagnóstico3. Esta entidad aparece con más frecuencia en la 5.ª o 6.ª décadas de la vida y se caracteriza por presentar glándulas adrenales de tamaño aumentado que contienen nódulos no pigmentados mayores de 10mm de diámetro con el tejido internodular hipertrófico4. Suele cursar con elevación moderada de cortisol urinario como consecuencia de una esteroidogénesis ineficiente y con el síndrome clínico discreto y de larga evolución.
La BMAH constituye una entidad heterogénea cuyo diagnóstico se ve retrasado usualmente por su variedad clínica y lenta evolución. La forma de presentación más habitual es el diagnóstico en el contexto del estudio de incidentalomas suprarrenales bilaterales, para los que en ocasiones es necesario realizar el diagnóstico diferencial con lesiones malignas debido a los hallazgos radiológicos5. Los procesos fisiopatológicos que conducen a la BMAH no son conocidos por completo. Recientemente se han descrito mutaciones en línea germinal en armadillo repeat containing 5 (ARMC5) en aproximadamente la mitad de los casos y se sabe que la esteroidogénesis en la BMAH está regulada por factores circulantes no dependientes de ACTH, resultado de la expresión anómala de receptores de varias hormonas en la membrana de las células adrenocorticales6,7.
La presencia de receptores anómalos en el tejido adrenal la describió por primera vez en 1971 Schorr y Ney8, pero no fue hasta 1987 cuando se pudo evidenciar la funcionalidad de estos receptores en los trabajos de Hamet et al.9. En estos casos, la excesiva producción de cortisol puede atribuirse a la expresión anormal de receptores hormonales, particularmente en BMAH.
Se diferencian 2tipos de receptores:
- Receptores ectópicos que habitualmente no se expresan en la corteza suprarrenal. Entre ellos se encuentran los receptores para:
- •
Péptido inhibidor gástrico (GIP): se estimula con la ingesta oral, sobre todo de hidratos de carbono y lípidos.
- •
Catecolaminas: estos receptores se estimulan con diversos factores como la bipedestación o la hipoglucemia.
- •
Vasopresina: hay 3 tipos de receptores distintos para vasopresina. De ellos, V1 puede encontrarse en las células sanas de la corteza suprarrenal, pero V2 y V3 son receptores ectópicos. Pueden estimularse con los estímulos habituales de liberación de vasopresina, como el ortostatismo.
- •
Serotonina (receptor 5-HT7).
- •
Glucagón.
- Receptores eutópicos con función anormal por una expresión incrementada de receptores que sí son habituales de la corteza suprarrenal, como los siguientes:
- •
Vasopresina: como ya se ha comentado, V1 puede encontrarse en las células de la corteza suprarrenal sana.
- •
Hormona luteinizante (LH): el receptor de LH se sobrestimula en casos de elevación marcada de LH, como ocurre en el hipogonadismo primario (sobre todo en varones) o en mujeres tras la menopausia.
- •
Gonadotropina coriónica humana (hCG) en mujeres gestantes10.
- •
Serotonina (receptor 5-HT4).
- •
Angiotensina II.
Todo esto producirá elevación de cortisol con un patrón característico, según las circunstancias que eleven la expresión del factor correspondiente11.
La mayoría de los receptores anómalos forman parte de la familia de receptores acoplados a la proteína G que, a través de la estimulación de la adenilato ciclasa, activan la esteroidogénesis, de la manera en que en condiciones normales lo haría el receptor de ACTH4. Lacroix ha desarrollado un protocolo diagnóstico de la presencia de receptores anómalos en el tejido adrenal que es utilizado como referencia en los trabajos realizados en este campo11. Según este protocolo, el estudio se inicia con unas pruebas de cribado seguidas, en el caso de que sean positivas, de otras pruebas dirigidas a ligandos específicos.
Nuestro objetivo en este trabajo ha sido estudiar la presencia de receptores anómalos en los sujetos diagnosticados de SCAI con hiperplasia nodular suprarrenal en un período de 14 años (de 2002 a 2016) y además explicar nuestra experiencia en el manejo y seguimiento de estos casos.
Material y métodosSe trata de un estudio descriptivo de una serie de casos de SCAI con hiperplasia nodular suprarrenal, seleccionados por muestreo consecutivo durante el período de 2002 a 2016 en las Consultas Externas de Endocrinología y Nutrición de varios centros de la Comunidad Valenciana: Hospital Clínico Universitario de Valencia, Hospital Francesc de Borja (Gandía), Hospital de Dénia y Hospital Marina Baixa (Villajoyosa). Se diagnosticaron un total de 15 casos.
Para el diagnóstico de SCAI usamos los siguientes criterios:
- -
Síndrome de Cushing: 2 de las siguientes 3 pruebas anormales:
- •
Cortisol libre en orina de 24 h > 450μg/24 h en al menos 2determinaciones.
- •
Cortisol salivar a las 23 h > 145ng/dL.
- •
Cortisol plasmático tras supresión nocturna con 1mg de dexametasona a las 23 h (o prueba de Nugent) ≥ 2μg/dL.
- •
Cortisol plasmático tras supresión débil con 0,5mg de dexametasona cada 6 h durante 2 días ≥ 2μg/dL.
- -
ACTH independiente: ACTH < 10 pg/mL. Se hicieron, al menos, 3 determinaciones para establecer la independencia.
El diagnóstico de hiperplasia nodular suprarrenal se hizo mediante técnicas de imagen (TAC o RMN), incluyendo aquellos en los que se objetivaron lesiones múltiples en las glándulas suprarrenales.
En los 15 pacientes que cumplían estos criterios se realizó el despistaje de receptor anómalo. Se siguieron los protocolos de estudios basados en las recomendaciones de Lacroix et al. para determinar estos receptores1,11. El estudio se efectuó en cada paciente en la Unidad de Pruebas Funcionales del Hospital Clínico Universitario de Valencia en 3 días alternos de una misma semana, y consistió en la aplicación secuencial de diferentes pruebas de estímulo. La secuencia, la dosis, la vía de administración del estímulo utilizado y los tiempos de cada una de ellos fueron los recomendadas por Outeirino et al.12. Respecto a la comida de prueba, el paciente ingirió a las 8:00h, tras ayuno nocturno: 100g de pan, 250ml de café con leche, 20g de mantequilla y 20g de mermelada. La duración de las pruebas fue de 2 h y se extrajeron 5 determinaciones de cortisol, en el tiempo 0, y cada 30 min hasta finalizar la prueba. Consideramos patológico un incremento del cortisol plasmático ≥ 25% respecto al valor basal.
Las pruebas que se realizaron en nuestro estudio fueron las siguientes:
- -
Primer paso diagnóstico: incluyó algunas pruebas de cribado, cuya positividad podría corresponder a la presencia de receptores diferentes.
- •
Test de comida de prueba, que evalúa GIP o GLP-1.
- •
Test postural, que evalúa receptores para angiotensina II, vasopresina, catecolaminas y péptido auricular natriurético.
- •
Test de GnRH, que evalúa receptores para LH, FSH o GnRH.
- •
Test de TRH, que evalúa receptores para TRH, TSH o prolactina.
- •
Test de glucagón.
- •
Test de metoclopramida, que evalúa el receptor 5-HT4 de serotonina.
- -
En caso de positividad para alguna de las pruebas anteriores, se procedió a hacer pruebas de confirmación para establecer qué receptor era el implicado:
- •
Test de desmopresina, que evalúa receptores V2.
- •
Test de terlipresina, que evalúa receptores V1.
- •
Test de LH.
- •
Test de FSH.
En algunos casos las pruebas variaron por las características y limitaciones del paciente (como la movilidad limitada para hacer el test postural) o por modificaciones en los protocolos del servicio a lo largo del tiempo, dado que se fueron adaptando a lo largo de los años a partir de los resultados previos (los test que no fueron positivos en ningún caso se eliminaron). Así, a los 15 pacientes se les hizo el test de comida de prueba y el de metoclopramida, a 13 pacientes el test postural, a 11 el test de GnRH, a 7 el de desmopresina, a 5 el de TRH y el de glucagón, a 4 el de terlipresina, a 3 el de LH y a 2 el test de FSH.
ResultadosEn todos los pacientes incluidos se inició el estudio tras el hallazgo incidental de masas suprarrenales bilaterales (excepto en el paciente 6, que tenía una lesión unilateral) al realizar pruebas de imagen, todas ellas sugestivas de benignidad, con supresión incompleta tras la administración de 1mg de dexametasona. De los 15 casos, 13 fueron mujeres, con una edad media al diagnóstico de 56,8 ± 12,9 años. Los valores medios de cortisol basal al diagnóstico fueron de 17,4 ± ± 5,3μg/dL, de ACTH 3,7 ± 2,1 pg/mL, de cortisol tras frenación con 1mg de dexametasona 9,7 ± 6,9μg/dL, de cortisol tras frenación débil 10,2 ± 4,1μg/dL y de cortisoluria en orina de 24 h 285,5 ± 335,3μg/24h (tabla 1).
Características basales
| Mínimo | Máximo | Media | Desviación estándar | |
|---|---|---|---|---|
| Edad al diagnóstico | 26 | 74 | 56,8 | 12,9 |
| Cortisol basal (μg/dL) | 9,9 | 26,5 | 17,4 | 5,3 |
| ACTH (pg/mL) | 1 | 8,5 | 3,7 | 2,1 |
| Cortisol tras frenación con 1 mg de dexametasona (μg/dL) | 1,8 | 19,4 | 9,7 | 6,9 |
| Cortisol tras frenación débil (μg/dL) | 2 | 18,1 | 10,2 | 4,1 |
| Cortisoluria (μg/24 h) | 18,4 | 1.210,0 | 285,5 | 335,3 |
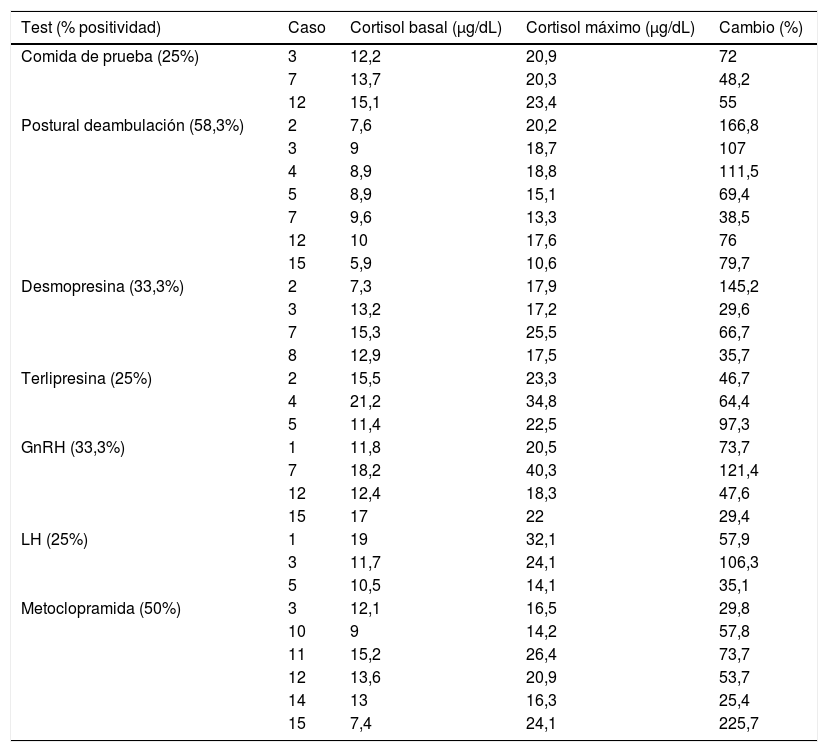
En 12 de los 15 casos estudiados (80%) se detectó positividad de las pruebas de receptores anómalos. De ellos, fueron positivos para comida de prueba los casos 3, 7 y 12 (25%); para test postural de deambulación los casos 2, 3, 4, 5, 7, 12 y 15 (58,3%); para desmopresina los casos 2, 3, 7 y 8 (33,3%); para terlipresina los casos 2, 4 y 5 (25%); para GnRH los casos 1, 7, 12 y 15 (33,3%); para LH los casos 1, 3 y 5 (25%) y para metoclopramida los casos 3, 10, 11, 12, 14 y 15 (50%). Por tanto, la prueba que dio positivo con más frecuencia fue el test postural de deambulación, que fue positivo en el 58,3% de los casos en los que se detectó receptor anómalo y que alcanzó un porcentaje de cambio máximo de 166,8% en el caso número 2 (tabla 2).
Casos con tests positivos
| Test (% positividad) | Caso | Cortisol basal (μg/dL) | Cortisol máximo (μg/dL) | Cambio (%) |
|---|---|---|---|---|
| Comida de prueba (25%) | 3 | 12,2 | 20,9 | 72 |
| 7 | 13,7 | 20,3 | 48,2 | |
| 12 | 15,1 | 23,4 | 55 | |
| Postural deambulación (58,3%) | 2 | 7,6 | 20,2 | 166,8 |
| 3 | 9 | 18,7 | 107 | |
| 4 | 8,9 | 18,8 | 111,5 | |
| 5 | 8,9 | 15,1 | 69,4 | |
| 7 | 9,6 | 13,3 | 38,5 | |
| 12 | 10 | 17,6 | 76 | |
| 15 | 5,9 | 10,6 | 79,7 | |
| Desmopresina (33,3%) | 2 | 7,3 | 17,9 | 145,2 |
| 3 | 13,2 | 17,2 | 29,6 | |
| 7 | 15,3 | 25,5 | 66,7 | |
| 8 | 12,9 | 17,5 | 35,7 | |
| Terlipresina (25%) | 2 | 15,5 | 23,3 | 46,7 |
| 4 | 21,2 | 34,8 | 64,4 | |
| 5 | 11,4 | 22,5 | 97,3 | |
| GnRH (33,3%) | 1 | 11,8 | 20,5 | 73,7 |
| 7 | 18,2 | 40,3 | 121,4 | |
| 12 | 12,4 | 18,3 | 47,6 | |
| 15 | 17 | 22 | 29,4 | |
| LH (25%) | 1 | 19 | 32,1 | 57,9 |
| 3 | 11,7 | 24,1 | 106,3 | |
| 5 | 10,5 | 14,1 | 35,1 | |
| Metoclopramida (50%) | 3 | 12,1 | 16,5 | 29,8 |
| 10 | 9 | 14,2 | 57,8 | |
| 11 | 15,2 | 26,4 | 73,7 | |
| 12 | 13,6 | 20,9 | 53,7 | |
| 14 | 13 | 16,3 | 25,4 | |
| 15 | 7,4 | 24,1 | 225,7 |
En los casos 6, 9 y 13 no se detectó positividad para ninguna de las pruebas. Los tests de TRH, FSH y glucagón no fueron positivos en ningún caso.
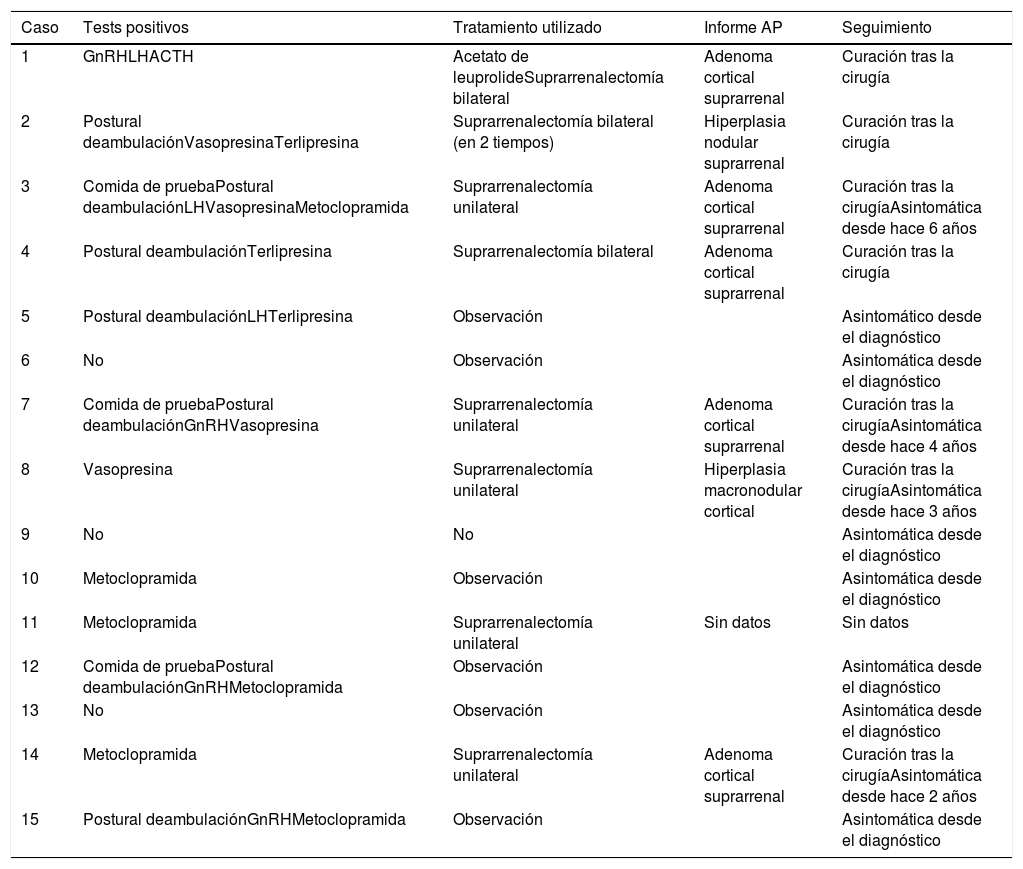
En cuanto al manejo de los pacientes con despistaje positivo, la conducta seguida fue hacer una suprarrenalectomía bilateral, unilateral o mantener en observación, según la clínica presentada (tabla 3). En los que tenían fenotipo Cushing claro con comorbilidades asociadas como diabetes o hipertensión, se hizo suprarrenalectomía bilateral (casos 1, 2 y 4; 25%). En los que tenían fenotipo Cushing, pero sin otras comorbilidades, se hizo una suprarrenalectomía unilateral, extirpando la glándula de mayor tamaño (casos 3, 7, 8, 11 y 14; 41,7%). El resto de los casos con test positivos, que tenían únicamente un Cushing subclínico, continúan en observación con revisiones periódicas (casos 5, 10, 12 y 15; 33,3%).
Resumen de los casos estudiados
| Caso | Tests positivos | Tratamiento utilizado | Informe AP | Seguimiento |
|---|---|---|---|---|
| 1 | GnRHLHACTH | Acetato de leuprolideSuprarrenalectomía bilateral | Adenoma cortical suprarrenal | Curación tras la cirugía |
| 2 | Postural deambulaciónVasopresinaTerlipresina | Suprarrenalectomía bilateral (en 2 tiempos) | Hiperplasia nodular suprarrenal | Curación tras la cirugía |
| 3 | Comida de pruebaPostural deambulaciónLHVasopresinaMetoclopramida | Suprarrenalectomía unilateral | Adenoma cortical suprarrenal | Curación tras la cirugíaAsintomática desde hace 6 años |
| 4 | Postural deambulaciónTerlipresina | Suprarrenalectomía bilateral | Adenoma cortical suprarrenal | Curación tras la cirugía |
| 5 | Postural deambulaciónLHTerlipresina | Observación | Asintomático desde el diagnóstico | |
| 6 | No | Observación | Asintomática desde el diagnóstico | |
| 7 | Comida de pruebaPostural deambulaciónGnRHVasopresina | Suprarrenalectomía unilateral | Adenoma cortical suprarrenal | Curación tras la cirugíaAsintomática desde hace 4 años |
| 8 | Vasopresina | Suprarrenalectomía unilateral | Hiperplasia macronodular cortical | Curación tras la cirugíaAsintomática desde hace 3 años |
| 9 | No | No | Asintomática desde el diagnóstico | |
| 10 | Metoclopramida | Observación | Asintomática desde el diagnóstico | |
| 11 | Metoclopramida | Suprarrenalectomía unilateral | Sin datos | Sin datos |
| 12 | Comida de pruebaPostural deambulaciónGnRHMetoclopramida | Observación | Asintomática desde el diagnóstico | |
| 13 | No | Observación | Asintomática desde el diagnóstico | |
| 14 | Metoclopramida | Suprarrenalectomía unilateral | Adenoma cortical suprarrenal | Curación tras la cirugíaAsintomática desde hace 2 años |
| 15 | Postural deambulaciónGnRHMetoclopramida | Observación | Asintomática desde el diagnóstico |
Cuatro de los casos se mantuvieron inicialmente en observación y comenzaron a presentar clínica en el seguimiento, por lo que la cirugía se llevó a cabo con posterioridad. También en un caso con test positivo para GnRH y LH se intentó el tratamiento médico con acetato de leuprolide (agonista de LHRH), que se mantuvo durante 4 meses: se consiguió al principio normalizar el cortisol basal y reducir el nivel de cortisol urinario, pero sin llegar a normalizarlo. Además, se objetivó deterioro del control de la diabetes mellitus e hipertensión arterial, así como de la miopatía proximal. Por todo ello, al final se hizo una suprarrenalectomía bilateral.
En el seguimiento posterior, aquellos pacientes con una suprarrenalectomía bilateral cumplían criterios de curación y están en seguimiento y con tratamiento corticoideo sustitutivo en la actualidad. Aquellos con suprarrenalectomía unilateral continúan seguimiento con revisiones periódicas y están clínicamente asintomáticos tras un período de seguimiento medio de 41,2 ± 41,6 meses. De la misma manera, aquellos en los que no se ha llevado a cabo ningún procedimiento también continúan por el momento con un síndrome de Cushing subclínico tras 45 ± 9,9 meses de seguimiento (tabla 3).
DiscusiónPresentamos 12 pacientes con SCAI por receptor anómalo. Esta es una entidad de baja prevalencia, por lo que la información clínico-biológica disponible se basa en estudios de series de casos. La expresión aberrante de receptores ectópicos y eutópicos en el tejido suprarrenal, acoplados a proteína G, está presente en la mayoría de los casos de BMAH, pero también en algunos tumores adrenales unilaterales, como ha sido en uno de nuestros casos13. También se han descrito alteraciones en la vía de señalización de AMP cíclico/protein cinasa A mediadas por fosfodiesterasas que están implicadas en la predisposición a desarrollar hiperplasia y tumores adrenales14 y en la regulación de la secreción de cortisol15.
Nuestra serie de casos muestra la existencia de al menos uno de los receptores anómalos estudiados en el 80% de los casos analizados. En 8 de los 15 casos (53,3%) se ha detectado positividad para más de un receptor. Los resultados encontrados son similares a los de otras series anteriores; la prueba que ha resultado positiva con más frecuencia es el test postural de deambulación, lo que confirma estudios previos13,16,17. En segundo lugar, la prueba patológica con más frecuencia ha sido el test de metoclopramida, también positiva con frecuencia en otras series13. Por el contrario, en nuestro estudio el test de glucagón no ha sido positivo en ningún caso, lo que coincide con algunos estudios previos18,19. No obstante, en otros trabajos sí se ha demostrado que algunos SCAI pueden expresar receptores anómalos para glucagón, estimulando la secreción de cortisol en situaciones de ayuno13,20.
Respecto al test postural de deambulación, evalúa la modulación potencial de la esteroidogénesis por angiotesina II, vasopresina, catecolaminas y péptido auricular natriurético. En otros estudios recogidos en la literatura se hacen pruebas específicas a posteriori para determinar cuál de estos receptores es el que está presente en el tejido adrenal de los pacientes. En nuestro centro no hemos hecho estas determinaciones por su complejidad y por los posibles efectos secundarios. Por tanto, no podemos descartar que el hipercortisolismo se deba a la presencia de múltiples receptores anómalos en el mismo tejido adrenal, con respuesta común al test postural de deambulación21.
La presencia de receptores anómalos en el tejido adrenal se ha demostrado en diversos estudios tanto por la respuesta a los estímulos como por técnicas de biología molecular11. Se ha propuesto que estos receptores podrían ser una diana farmacológica eficaz en algunos pacientes, como alternativa a la cirugía22. En nuestra serie, se intentó el tratamiento farmacológico con acetato de leuprolide (agonista de LHRH) en una paciente con test positivo para LH y GnRH, a dosis de 3,75mg por vía intramuscular cada 4 semanas, durante 4 meses, con respuesta parcial, por lo que finalmente se optó por un tratamiento definitivo con una suprarrenalectomía bilateral. Este tratamiento ha sido utilizado por otros autores con buenos resultados22. Otros tratamientos farmacológicos que se han propuesto son propranolol en el SCAI dependiente de catecolaminas23, o pasireótida u octreótrida en el dependiente de GIP24.
De los 15 pacientes incluidos en nuestra serie, 14 tenían BMAH. El único paciente con hiperplasia unilateral (caso 6) no presentó positividad para ningún test. Estos hallazgos indican una posible relación genética en la patogenia de esta entidad. Al principio se consideraba a la BMAH como una enfermedad esporádica en la que ocurrían mutaciones somáticas en las células progenitoras adrenales durante la embriogénesis11. Sin embargo, se han descrito casos familiares con patrón de herencia autosómico dominante que indican la etiología genética. Además, se ha descrito la presencia de receptores anómalos específicos en los miembros de una misma familia con BMAH, incluyendo receptores de vasopresina y 5-HT425,26. Por otro lado, en estudios recientes se ha demostrado la relación del SCAI por BMAH con mutaciones en el gen ARMC5 en aproximadamente la mitad de los casos, y un patrón de herencia autosómico dominante. Este gen se localiza en la región genómica 16p11.2, que ya había sido asociada a la BMAH en estudios previos6. La función de ARMC5 no es completamente conocida, aunque se ha propuesto que podría actuar como un gen supresor tumoral que induce apoptosis en líneas celulares de la corteza adrenal. Si bien la relación entre variaciones en el gen ARMC5 y la presencia de receptores anómalos no se ha establecido en detalle, estudios preliminares han encontrado que portadores de mutaciones en dicho gen pueden presentar respuestas aberrantes a test posturales, vasopresina y metoclopramida7,27. También se ha propuesto el posible papel del gen ARMC5 en el desarrollo de otros tumores al haber sido descritas mutaciones en dicho gen en pacientes con meningiomas3,6. Por ello, algunos autores recomiendan realizar despistaje de mutaciones en el gen ARMC5 en los pacientes afectados de BMAH con SCAI, así como a los familiares de los portadores2.
Otro gen que se ha asociado al SCAI con BMAH es el gen GNAS128,29. En nuestra serie no se observó ninguna agrupación familiar, por lo que no se realizó ningún estudio genético.
Nuestro estudio tiene algunas limitaciones. En primer lugar, la disponibilidad de información sobre los pacientes no es completa, ya que algunos de ellos fueron derivados de otros centros y algunos datos no estaban recogidos de manera adecuada, sobre todo en lo que respecta a los antecedentes familiares. No obstante, todo el estudio sí ha sido llevado a cabo en nuestro centro, por lo que sí disponemos de los datos relacionados con las pruebas de estímulo. Otra limitación importante es no haber hecho todas las pruebas de despistaje en todos los pacientes. En algunos casos, por las características clínicas del paciente (para evitar efectos adversos indeseados) y en otras ocasiones por modificaciones en los protocolos del centro, al tratarse de pacientes estudiados durante un período de 14 años (de 2002 a 2016).
Otro aspecto controvertido es el punto de corte a partir del cual una prueba de estímulo se considera positiva. Hemos seguido los criterios de Lacroix et al.30, que establecieron un cambio 25-49% como respuesta parcial y un cambio de ≥50% como respuesta completa. Estos criterios han sido aceptados también posteriormente por otros autores12, aunque no hay un consenso firme.
En la literatura médica tenemos numerosos artículos con relación a esta entidad, pero en su mayoría se trata de casos aislados o series de casos de poco tamaño. La generación de nuevas hipótesis con este tipo de estudios descriptivos es bastante limitada, aunque nuestra serie sigue en gran medida los comportamientos observados en estudios previos.
En conclusión, los resultados de nuestra serie son compatibles con expresión anómala de receptores en los sujetos con SCAI y BMAH, que es similar a la objetivada en otras series de casos. Los mecanismos de regulación que intervienen en la secreción de cortisol en el SCAI incluyen factores genéticos y moleculares que no se conocen en su totalidad. La identificación de la regulación aberrante ofrece la perspectiva de posibles opciones diagnósticas y terapéuticas farmacológicas frente a receptores hormonales acoplados a la proteína G o sus ligandos en un intento de evitar la suprarrenalectomía bilateral, que es la terapia estándar actual de la BMAH. El estudio protocolizado en centros y unidades de referencia, así como la creación de registros, puede ayudar a compilar información que permita la mejor caracterización de la expresión de receptores hormonales anómalos acoplados a la proteína G y avanzar en el tratamiento de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Sergio Martínez-Hervás es un investigador del programa Juan Rodés (JR18/00051) financiado por el Instituto de Salud Carlos III y el Fondo Europeo de Desarrollo Regional (FEDER).