El riesgo de mortalidad total y de mortalidad cardiovascular (MCV) de los pacientes con diabetes tipo2 (DM2) puede ser muy elevado ante la existencia de enfermedad cardiovascular (ECV). Nuestro objetivo fue cuantificar este riesgo considerando las diferentes manifestaciones de ECV.
Materiales y métodosEl estudio DIABET-IC es un estudio multicéntrico, observacional, prospectivo y analítico, con reclutamiento consecutivo de pacientes con DM2 procedentes de consultas externas hospitalarias.
Se recogieron variables clínicas, analíticas y ecocardiográficas, con clasificación de los pacientes en dependencia de la presencia y tipo de ECV: insuficiencia cardiaca, enfermedad arterial coronaria (EACo), enfermedad arterial cerebrovascular (EACe) y enfermedad arterial periférica (EAPe).
Las variables dependientes analizadas fueron mortalidad total y MCV. Se calcularon las tasas por cada 1.000 pacientes-año y se realizaron modelos de Cox para determinar el riesgo de mortalidad asociado a cada tipo de ECV.
ResultadosSe incluyeron 1.246 pacientes de 67,3 (DE: 9,9) años, 31,6% mujeres y con prevalencia inicial de ECV del 59,3%. Durante un seguimiento de 2,6años, hubo 122 fallecimientos (46 cardiovasculares). Las tasas asociadas a existencia de EAPe (85,6/1.000 mortalidad total y 33,6/1.000 MCV) e insuficiencia cardiaca (72,9/1.000 mortalidad total y 28,7/1.000 MCV) fueron las más elevadas.
En análisis multivariante, la insuficiencia cardiaca aumentó el riesgo de mortalidad total (HR: 1,63; IC95%: 1,03-2,58; p=0,037) y MCV (HR: 3,41; IC95%: 1,68-6,93; p=0,001).
ConclusionesLa mortalidad de los pacientes con DM2 está incrementada, especialmente ante la existencia de insuficiencia cardiaca y EAPe, lo que justifica su cribado para intensificar las medidas terapéuticas.
All-cause mortality and cardiovascular mortality (CVM) risk can be very high in adults with type2 diabetes mellitus (DM2) with previous cardiovascular disease (CVD). Our objective was to determine this risk among the different clinical spectrum of CVD.
Material and methodsThe DIABET-IC trial is a multicenter, prospective, observational, and analytical study. Consecutive subjects with DM2 attending our outpatients’ clinics were recruited. Data on clinical features, lab test results, and echocardiographic measures were collected.
Patients were categorized depending on the presence and type of CVD: heart failure (HF), coronary artery disease (CAD), cerebrovascular disease (CVD) and peripheral artery disease (PAD).
All-cause mortality and CVM were the dependent variables analyzed. Mortality rate was expressed as deaths per 1000 patients-year. Cox proportional hazards regressions models were used to establish the mortality risk associated with every type of CVD.
ResultsWe studied a total of 1246 patients (mean age, 6.3 (SD: 9.9) years; 31.6%, female) with an initial prevalence of CVD of 59.3%. A total of 122 deaths (46 due to CVD) occurred at the 2.6-year follow-up. All-cause and CVM rates associated with the presence of PAD (85.6/1000 and 33.6/1000, respectively) and HF (72.9/1000 and 28.7/1000 respectively) were the most elevated of all.
In multivariate analysis, HF increased all-cause mortality risk (HR: 1.63; 95%CI: 1.03-2.58; P=.037) and the risk of CVM (HR: 3.41; 95%CI: 1.68-6.93; P=.001).
ConclusionsMortality among DM2 patients is highly increased in the presence of HF and PAD. This justifies the screening of these conditions to intensify therapeutic strategies.
La presencia de diabetes mellitus (DM) incrementa el riesgo de mortalidad1-3. En un metaanálisis de 97 estudios prospectivos realizados entre los años 1961 y 2007 (Emerging Risk Factors Collaboration), con inclusión de más de 12 millones de personas-año en el seguimiento, el riesgo de mortalidad total y de mortalidad cardiovascular (MCV) estuvo significativamente elevado en los pacientes con DM1; este hecho se produjo tanto en las personas sin enfermedad cardiovascular (ECV) inicial (HR: 1,80 para mortalidad total y HR: 2,32 para MCV), como en aquellas con existencia de ECV (HR: 1,65 para mortalidad total y HR: 1,89 para MCV). Datos del UK Biobank2 han demostrado que, en ausencia de ECV prevalente, los pacientes con DM, en análisis ajustado para otros factores de riesgo, tienen un incremento del 50% en el riesgo de mortalidad respecto a la población sin DM; no obstante, este riesgo se multiplica por un factor de 3,6 a 4,9 ante la presencia simultánea de diabetes y de diferentes manifestaciones de ECV. Un reciente análisis combinado del Emerging Risk Factors Collaboration y del UK Biobank3 ha comprobado que cada década de diagnóstico más precoz de la DM incrementa un 14% el riesgo de mortalidad total y un 19% el riesgo de MCV.
Específicamente en la DM tipo2 (DM2), la aplicación en la práctica clínica de los resultados de ensayos que han demostrado la eficacia del control glucémico4, del control de la presión arterial (PA)5, del control lipídico6 y del abordaje simultáneo de todos los factores de riesgo vascular7, debería haberse traducido en una mejora del pronóstico de los pacientes1. Datos del Registro de Diabetes Nacional Sueco confirman una reducción de mortalidad total del 21% y de MCV del 46% en pacientes con DM2 entre 1998 y 2014, aunque este descenso es menor que en la población general8.
Es necesario recopilar datos actualizados sobre la mortalidad de los pacientes con diabetes, dada la reciente disponibilidad de fármacos hipoglucemiantes (inhibidores de SGLT2 [i-SGLT2] y agonistas del receptor de GLP1 [AR-GLP1]) con capacidad de modificar el pronóstico de la ECV9. Aunque es ampliamente conocido que la presencia de enfermedad cardiovascular aterosclerótica (ECVA)10 y de insuficiencia cardiaca11 incrementa el riesgo de mortalidad total y de MCV, es preciso cuantificar el incremento de riesgo conferido por cada una de estas complicaciones para estratificar eficazmente el riesgo de los pacientes. Es prioritario identificar los grupos de pacientes con DM2 con mayor riesgo de fallecer, ya que, en ellos, a igualdad de reducción de riesgo relativo, se producirá una mayor reducción de riesgo absoluto; este hecho se ha comprobado en un metaanálisis de ensayos de i-SGLT2 y AR-GLP1, con tasas de MCV en los grupos placebo que variaron entre 7 y 125 por cada 1.000 pacientes-año12.
Nuestra hipótesis fue que, en el momento actual, el riesgo de mortalidad de los pacientes con DM2 seguiría siendo muy variable en dependencia de sus características iniciales. Mediante el seguimiento prospectivo de una cohorte de pacientes con DM2, procedente de las consultas externas de distintos hospitales de nuestro país, nuestro objetivo fue evaluar el riesgo de mortalidad en dependencia de la presencia y del tipo de ECV inicial. Asimismo, analizamos la prevalencia de uso y la eficacia clínica sobre la reducción de mortalidad del empleo de i-SGLT2 y AR-GLP1.
Material y métodosDiseñoEl estudio DIABET-IC fue planificado como un estudio multicéntrico, observacional, prospectivo y analítico promovido conjuntamente por la Sociedad Española de Diabetes y la Sociedad Española de Cardiología. Fue llevado a cabo en 58 hospitales del territorio nacional español, con el objetivo de evaluar la prevalencia y la incidencia de insuficiencia cardíaca, así como el pronóstico vital en dependencia de la presencia y del tipo de ECV. Los datos de incidencia de insuficiencia cardiaca se presentarán en artículos adicionales.
El diseño planteado fue observacional y pragmático, con seguimiento de los pacientes en una situación de práctica clínica rutinaria, sin indicaciones específicas de prescripción terapéutica. El protocolo inicial contemplaba una visita inicial y tres visitas de seguimiento. No obstante, debido a la situación de pandemia por COVID-19, el protocolo fue modificado para intentar alcanzar en el mayor número posible de pacientes al menos la visita de cierre del estudio.
El trabajo se realizó siguiendo las normas de la Declaración de Helsinki y fue aprobado por el Comité Ético del Complejo Hospitalario de Toledo el 28 de marzo de 2018 (código de identificación 243). Todos los pacientes firmaron el consentimiento informado para la participación en el estudio.
Criterios de inclusión y exclusiónSe incluyeron pacientes con una edad igual o superior a 18años y con un diagnóstico de DM2 según criterios de la American Diabetes Association13 desde al menos 1año antes de la visita de inclusión. Podían reclutarse pacientes con y sin ECV. Los criterios de exclusión fueron un diagnóstico de DM tipo1, la participación concomitante en algún ensayo clínico, la incapacidad para otorgar consentimiento informado, la presencia de enfermedad renal crónica estadio5 y una esperanza de vida estimada inferior a 3años por patologías acompañantes.
El reclutamiento de pacientes se completó de forma consecutiva y balanceada entre consultas externas hospitalarias de endocrinología y cardiología. En cada centro participante un endocrinólogo y un cardiólogo realizaban de forma conjunta la evaluación de los pacientes.
El tamaño muestral calculado inicialmente fue de 2.400 pacientes, para conseguir una estimación de la prevalencia de insuficiencia cardiaca con una precisión de ±1,4%, con un nivel de confianza del 95%. Para ello originalmente se ofreció la participación a 60 hospitales, con selección de los primeros 40 pacientes en cada hospital que cumpliesen los criterios de inclusión (20 procedentes de consultas externas de endocrinología y 20 procedentes de consultas externas de cardiología).
Variable dependiente (punto final clínico)Cada investigador documentó, en caso de producirse, mediante consulta de la historia clínica, la fecha de mortalidad y si la muerte era o no de causa cardiovascular. Se consideró MCV la debida a síndrome coronario agudo, insuficiencia cardiaca, muerte arrítmica o muerte súbita, rotura de aneurisma arterial o ictus.
Variables recogidas en la visita inicial- 1.
Variables demográficas: edad y género.
- 2.
Comorbilidades y factores de riesgo vascular:
- -
Tabaquismo clasificado en fumador actual, exfumador y no fumador (con agrupamiento posterior en fumador actual o no fumador actual).
- -
Hipertensión arterial (HTA), definida como presión arterial sistólica (PAS) confirmada ≥140mmHg, presión arterial diastólica (PAD) confirmada ≥90mmHg o toma de antihipertensivos.
- -
Dislipemia, definida como toma de hipolipemiantes o cifras de colesterol total >240mg/dl y/o colesterol LDL >160mg/dl y/o triglicéridos >200mg/dl y/o colesterol HDL <40mg/dl en varones o <50mg/dl en mujeres.
- -
Diagnóstico de cáncer.
- -
Índice de comorbilidad de Charlson.
- 3.
Presencia inicial de ECV, definida como la constatación de una o más de las siguientes patologías:
- -
Insuficiencia cardiaca según criterios diagnósticos de la Sociedad Europea de Cardiología14 y clasificada como insuficiencia cardiaca con fracción de eyección reducida (ICFEr), intermedia (ICFEm) o preservada (ICFEp).
- -
Enfermedad cardiovascular aterosclerótica (ECVA): presencia de enfermedad arterial coronaria y/o enfermedad cerebrovascular y/o enfermedad arterial periférica. Se generó adicionalmente una variable ordinal con tres categorías: no afectación, afectación de 1territorio y afectación de >1territorio vascular.
- -
Enfermedad arterial coronaria (EACo): documentación de infarto agudo de miocardio, síndrome coronario agudo, revascularización coronaria o estenosis coronaria >50%.
- -
Enfermedad arterial cerebrovascular (EACe): documentación de ictus isquémico o hemorrágico o estenosis carotídea >50%.
- -
Enfermedad arterial periférica (EAPe): documentación de arteriopatía de miembros inferiores.
- 4.
Antecedentes relacionados con la DM: duración de la enfermedad, presencia de retinopatía, presencia de enfermedad renal crónica (ERC).
- 5.
Exploración física: PAS, PAD, peso (kg), talla (metros), índice de masa corporal (IMC) expresado en kg/m2, perímetro de la cintura (cm).
- 6.
Datos de laboratorio (obtenidos en cada hospital mediante métodos rutinarios): glucemia (mg/dl), HbA1c (%), perfil lipídico con colesterol, triglicéridos, cLDL, cHDL y colesterol no-HDL (colesterol total −cHDL) expresados en mg/dl, tasa de filtración glomerular estimada (TFGe) mediante fórmula CKD-EPI en ml/min/1,73m2, excreción de albúmina urinaria (EAU) en mg/g de creatinina, hemoglobina (g/dl).
- 7.
Electrocardiograma, con constatación de la presencia de fibrilación auricular (FA).
- 8.
NT-proBNP y ecocardiograma, con cálculo de la fracción de eyección del ventrículo izquierdo (FEVI), para determinar la presencia y la clasificación de insuficiencia cardiaca14. Posteriormente se agruparon los pacientes con insuficiencia cardiaca en dependencia de que la FEVI fuese <40% o ≥40%.
- 9.
Medicación administrada en el momento de la finalización de la visita inicial.
Se realizó la descripción de las variables cuantitativas mediante la media y la desviación estándar (DE) o mediante la mediana y el rango intercuartílico. Las variables cualitativas se describen con su distribución de frecuencias (%).
Para la comparación de variables cuantitativas se utilizó la t de Student de muestras independientes o ANOVA, con aplicación de pruebas no paramétricas en el caso de que no se cumpliesen los supuestos de normalidad. La comparación de variables cualitativas fue realizada con test de chi-cuadrado o test de Fisher.
Se realizó seguimiento de los pacientes hasta su fallecimiento, abandono del estudio o visita final programada de cierre del estudio en junio de 2022. Las tasas de incidencia (TI) de mortalidad se expresan por cada 1.000 pacientes-año. Se realizaron curvas de supervivencia de Kaplan-Meier y comparación de las tasas de mortalidad según características iniciales de los pacientes mediante log-rank-test.
El incremento del riesgo de mortalidad total y de MCV según presencia inicial, tipo de ECV y número de territorios vasculares afectados (codificado como ninguno, uno o más de uno) se evaluó mediante modelos de regresión de Cox uni y multivariante. Se presentan las hazards ratio (HR) con sus correspondientes intervalos de confianza (IC) del 95%. Para el análisis estadístico se agruparon las categorías de ICFEm e ICFEp debido al limitado número de sujetos. El ajuste multivariante se realizó mediante criterios estadísticos (significación de las variables en análisis univariante) y su sentido clínico.
Se consideraron significativas las asociaciones con p<0,05.
ResultadosEntre mayo de 2018 y marzo de 2020 se evaluaron 1.543 pacientes, con participación de 110 investigadores de 58 hospitales con representación de todo el territorio nacional español. En el presente análisis se incluyen los 1.246 pacientes en los cuales se pudo obtener información sobre mortalidad en la visita de cierre del estudio.
La edad media de los participantes fue de 67,3 (DE: 9,9) años, con un porcentaje de mujeres del 31,6%. La prevalencia inicial de ECV total fue del 59,3%, con la siguiente distribución de entidades: insuficiencia cardiaca 39,4% (ICFEr 17,3%, ICFEm 8,1% y ICFEp 14%), ECVA 49,9% (con 10,9% de los pacientes presentando más de un territorio vascular afectado por patología aterosclerótica), EACo 43,1%, EACe 8,2% y EAPe 10,8%. En la tabla 1 se refleja el porcentaje de pacientes con un determinado tipo de ECV que tienen simultáneamente otro tipo de ECV. Es de destacar que, entre los pacientes con EAPe, casi el 70% tenían EACo, el 16% EACe y el 55% insuficiencia cardiaca.
Afectación cardiovascular cruzada entre territorios vasculares
| EACo(n=537) | EACe(n=102) | EAPe(n=135) | IC con FE<40%(n=215) | IC con FE>=40%(n=275) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | % | |
| EACo | 52 | 50,98 | 94 | 69,63 | 133 | 61,86 | 124 | 45,09 | ||
| EACe | 52 | 9,68 | 22 | 16,3 | 24 | 11,16 | 26 | 9,45 | ||
| EAPe | 94 | 17,5 | 22 | 21,57 | 33 | 15,35 | 41 | 14,91 | ||
| IC con FE<40% | 133 | 24,77 | 24 | 23,53 | 33 | 24,44 | ||||
| IC con FE>=40% | 124 | 23,09 | 26 | 25,49 | 41 | 30,37 | ||||
EACe: enfermedad arterial cerebrovascular; EACo: enfermedad arterial coronaria; EAPe: enfermedad arterial periférica; FE: fracción de eyección; IC: insuficiencia cardiaca; %: porcentaje de pacientes con un determinado tipo de ECV que tienen simultáneamente otro tipo de ECV.
Las características de los pacientes en su totalidad, y en dependencia de que tuviesen o no alguna manifestación de ECV, quedan plasmadas en la tabla 2. Como puede comprobarse, los pacientes con ECV tenían mayor edad y puntuación de Charlson, menor proporción de mujeres, menor IMC, una TFGe más reducida acompañada de una EAU más elevada, y valores de NT-proBNP más altos, junto con una menor FEVI. Los pacientes con ECV tenían mejor control de los factores de riesgo vascular, con menor proporción de fumadores activos y valores inferiores de PA y lípidos (cLDL y colesterol no-HDL), lo cual puede justificarse por la mayor utilización de hipotensores e hipolipemiantes. No obstante, solo el 46,3% de los sujetos con ECV tenían una HbA1c <7%, el 43,8% tenían una PAS <130mmHg y el 30,8% tenían un colesterol no-HDL <85mg/dl. En pacientes con ECV había una elevada utilización de estatinas (90,3%), pero el uso de ezetimiba (22,3%) y de i-PCSK9 (1,3%) era bajo, a pesar de una proporción elevada de pacientes que no cumplían los objetivos terapéuticos lipídicos. Respecto al tratamiento hipoglucemiante, el 39,4% de los pacientes con ECV estaban tratados con i-SGLT2 y el 12% con AR-GLP1.
Características de los pacientes en dependencia de la presencia inicial de ECV
| Grupo total | No ECV | ECV | p | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Variables cuantitativas | n | Media | DE | n | Media | DE | n | Media | DE | |
| Edad (años) | 1.246 | 67,35 | 9,92 | 507 | 65,41 | 10,18 | 739 | 68,69 | 9,51 | <0,001 |
| Índice de Charlson (puntos) | 1.246 | 1,95 | 1,01 | 507 | 1,55 | 0,82 | 739 | 2,23 | 1,03 | <0,001 |
| PAS (mmHg) | 1.243 | 134,59 | 19,37 | 506 | 138,43 | 19,57 | 737 | 131,95 | 18,8 | <0,001 |
| PAD (mmHg) | 1.246 | 75,42 | 11,4 | 506 | 77,72 | 11,78 | 737 | 73,84 | 10,88 | <0,001 |
| IMC (kg/m2) | 1.231 | 30,3 | 5,29 | 504 | 30,97 | 5,58 | 727 | 29,84 | 5,03 | <0,001 |
| Perímetro cintura (cm) | 1.090 | 104,73 | 14,34 | 456 | 105,42 | 13,95 | 634 | 104,23 | 14,61 | 0,261 |
| Valores FEVI basales (%) | 1.174 | 54,74 | 13,68 | 451 | 61,14 | 9,64 | 723 | 50,74 | 14,3 | <0,001 |
| NT-proBNP (pg/ml) | 952 | 982 | 2464 | 351 | 468 | 1268 | 601 | 1281 | 2904 | <0,001 |
| Hemoglobina (g/dl) | 1.229 | 14,04 | 1,78 | 497 | 14,2 | 1,7 | 732 | 13,93 | 1,83 | 0,024 |
| TFGe (ml/min/1,73 m2) | 1.237 | 73,43 | 22,88 | 505 | 79,75 | 22,45 | 732 | 69,08 | 22,15 | <0,001 |
| EAU (mg/g de creatinina) | 1.072 | 77,75 | 302,25 | 444 | 53,2 | 166,4 | 628 | 95,1 | 368,4 | 0,117 |
| cLDL (mg/dl) | 1.209 | 79,91 | 29,9 | 489 | 88,77 | 29,25 | 720 | 73,88 | 28,84 | <0,001 |
| Triglicéridos (mg/dl) | 1.235 | 152,28 | 85,59 | 504 | 150,12 | 84,17 | 731 | 153,77 | 86,57 | 0,232 |
| cHDL (mg/dl) | 1.214 | 44,05 | 12,36 | 491 | 47,55 | 12,71 | 723 | 41,67 | 11,52 | <0,001 |
| Colesterol no-HDL (mg/dl) | 1.213 | 108,72 | 33,72 | 491 | 116,99 | 33,16 | 722 | 103,09 | 32,96 | <0,001 |
| Glucemia basal (mg/dl) | 1.239 | 141,18 | 46,39 | 503 | 141,33 | 46,42 | 736 | 141,07 | 46,4 | 0,933 |
| Hb1Ac (%) | 1.227 | 7,31 | 1,31 | 501 | 7,39 | 1,42 | 726 | 7,26 | 1,22 | 0,330 |
| Duración de la diabetes (años) | 1.240 | 14,22 | 11,41 | 505 | 13,83 | 9,59 | 735 | 14,49 | 12,52 | 0,516 |
| Variables cualitativas | Grupo total | No ECV | ECV | p | |||
|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | ||
| Sexo (% mujer) | 394 | 31,62 | 217 | 42,8 | 177 | 23,95 | <0,001 |
| HbA1c <7% (%) | 555 | 45,23 | 219 | 43,71 | 336 | 46,28 | <0,001 |
| PAS <130mmHg (%) | 476 | 38,29 | 153 | 30,24 | 323 | 43,83 | <0,001 |
| Colesterol no-HDL mg/dl (%) | |||||||
| <85 | 299 | 24,65 | 77 | 15,68 | 222 | 30,75 | <0,001 |
| 85-99 | 251 | 20,69 | 93 | 18,94 | 158 | 21,88 | |
| 100-130 | 378 | 31,16 | 170 | 34,62 | 208 | 28,81 | |
| >130 | 285 | 23,50 | 151 | 30,75 | 134 | 18,56 | |
| Fumador actual (%) | 127 | 10,19 | 56 | 11,05 | 71 | 9,61 | <0,001 |
| Estadio ERC (%) | |||||||
| Estadio 1 (≥90) | 34 | 8,79 | 17 | 15,18 | 17 | 6,18 | <0,001 |
| Estadio 2 (60-89) | 103 | 26,61 | 40 | 35,71 | 63 | 22,91 | |
| Estadio 3 (30-59) | 221 | 57,11 | 50 | 44,64 | 171 | 62,18 | |
| Estadio 4 (15-29) | 25 | 6,46 | 5 | 4,46 | 20 | 7,27 | |
| Estadio 5 (<15) | 4 | 1,03 | 0 | 0 | 4 | 1,45 | |
| EAU (%) | |||||||
| EAU <30 | 774 | 72,20 | 340 | 76,58 | 434 | 69,11 | 0,021 |
| EAU=[30,300) | 247 | 23,04 | 84 | 18,92 | 163 | 25,96 | |
| EAU≥300 | 51 | 4,76 | 20 | 4,50 | 31 | 4,94 | |
| Sulfonilurea (%) | 116 | 9,31 | 61 | 12,03 | 55 | 7,44 | 0,006 |
| Metformina (%) | 917 | 73,60 | 389 | 76,73 | 528 | 71,45 | 0,038 |
| i-SGLT2 (%) | 475 | 38,12 | 184 | 36,29 | 291 | 39,38 | 0,271 |
| AR-GLP1 (%) | 195 | 15,65 | 106 | 20,91 | 89 | 12,04 | <0,001 |
| i-DPP4 (%) | 422 | 33,87 | 165 | 32,54 | 257 | 34,78 | 0,413 |
| Pioglitazona (%) | 18 | 1,44 | 12 | 2,37 | 6 | 0,81 | 0,024 |
| Insulina (%) | 525 | 42,13 | 242 | 47,73 | 283 | 38,29 | <0,001 |
| Antag. mineralcorticoide (%) | 279 | 22,39 | 45 | 8,88 | 234 | 31,66 | <0,001 |
| IECA (%) | 415 | 33,31 | 139 | 27,42 | 276 | 37,35 | <0,001 |
| ARA2 (%) | 436 | 34,99 | 199 | 39,25 | 237 | 32,07 | 0,009 |
| Sacubitrilo/Valsartán (%) | 147 | 11,77 | 20 | 3,94 | 127 | 17,19 | <0,001 |
| Betabloqueantes (%) | 751 | 60,27 | 177 | 34,91 | 574 | 77,67 | <0,001 |
| Estatinas (%) | 1.049 | 84,19 | 382 | 75,35 | 667 | 90,26 | <0,001 |
| AntiPCSK9 (%) | 12 | 0,96 | 2 | 0,39 | 10 | 1,35 | 0,089 |
| Ezetimiba (%) | 219 | 17,58 | 54 | 10,65 | 165 | 22,33 | <0,001 |
| Antiagregantes (%) | 659 | 52,89 | 177 | 34,91 | 482 | 65,22 | <0,001 |
EAU: excreción de albúmina urinaria; ERC: enfermedad renal crónica; FEVI: fracción de eyección del ventrículo izquierdo; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TFGe: tasa de filtración glomerular estimada.
Durante una media de 2,6 años de seguimiento se produjeron 122 fallecimientos, de los cuales 46 fueron por causa cardiovascular. Las características de los participantes clasificados en aquellos que fallecieron o no y clasificados en aquellos que murieron o no por causa cardiovascular quedan resumidas, respectivamente, en las tablas 3 y 4. Los pacientes que fallecieron tenían mayor edad y puntuación de Charlson, una prevalencia más alta de diagnóstico de cáncer, valores más altos de EAU y valores más bajos de PA, IMC, cHDL, hemoglobina, TFGe y FEVI, así como mayores prevalencias de complicaciones micro y macrovasculares. El patrón era similar en aquellos en los que la causa de la muerte fue de origen cardiovascular.
Características iniciales de los pacientes en dependencia del pronóstico de mortalidad con análisis de Cox univariante para cada variable
| Mortalidad total (n=122) | No | Si | p | Analisis Univariante | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Variables cuantitativas | n | Media | DE | n | Media | DE | HR | IC 95% | P | ||
| Edad (años) | 1.093 | 66,68 | 9,74 | 122 | 74,34 | 7,8 | <0,001 | 1,096 | 1,073 | 1,121 | <0,001 |
| Índice de Charlson (puntos) | 1.093 | 1,86 | 0,95 | 122 | 2,75 | 1,17 | <0,001 | 1,96 | 1,700 | 2,260 | <0,001 |
| PAS (mmHg) | 1.090 | 135,36 | 19,15 | 122 | 127,94 | 20,43 | <0,001 | 0,980 | 0,970 | 0,990 | <0,001 |
| PAD (mmHg) | 1.090 | 76,09 | 11,36 | 122 | 69,43 | 10,08 | <0,001 | 0,950 | 0,935 | 0,966 | <0,001 |
| IMC (kg/m2) | 1.081 | 30,37 | 5,24 | 119 | 28,87 | 5,12 | 0,003 | 0,947 | 0,911 | 0,984 | 0,005 |
| Perímetro cintura sobre cresta ilíaca (cm) | 951 | 104,81 | 13,81 | 110 | 102,43 | 17,88 | 0,085 | 0,989 | 0,976 | 1,003 | 0,118 |
| Valores FEVI basales (%) | 1.026 | 55,34 | 13,31 | 118 | 48,79 | 15,2 | <0,001 | 0,972 | 0,960 | 0,983 | <0,001 |
| Hemoglobina (g/dl) | 1.077 | 14,1 | 1,76 | 122 | 13,3 | 1,72 | <0,001 | 0,789 | 0,717 | 0,869 | <0,001 |
| TFGe (ml/min/1,73 m2) | 1.084 | 75,29 | 22,02 | 122 | 56,17 | 22,49 | <0,001 | 0,964 | 0,956 | 0,972 | <0,001 |
| EAU (mg/g de creatinina) | 940 | 64,59 | 235,1 | 103 | 174,68 | 624,2 | <0,001 | 1,001 | 1,000 | 1,001 | <0,001 |
| cLDL (mg/dl) | 1.060 | 80,02 | 29,9 | 117 | 75,76 | 27,37 | 0,205 | 0,996 | 0,989 | 1,002 | 0,186 |
| Triglicéridos (mg/dl) | 1.085 | 152,7 | 87,4 | 119 | 148,18 | 74,84 | 0,928 | 0,999 | 0,997 | 1,002 | 0,625 |
| cHDL (mg/dl) | 1.064 | 44,33 | 12,4 | 118 | 41,24 | 11,8 | 0,004 | 0,979 | 0,963 | 0,995 | 0,011 |
| Colesterol no-HDL (total − HDL) (mg/dl) | 1.063 | 108,9 | 33,72 | 118 | 103,22 | 31,25 | 0,105 | 0,995 | 0,990 | 1,001 | 0,107 |
| Glucemia basal (mg/dl) | 1.086 | 140,14 | 44,51 | 122 | 146,36 | 60,31 | 0,53 | 1,003 | 0,999 | 1,006 | 0,139 |
| HbA1c (%) | 1.077 | 7,29 | 1,3 | 118 | 7,36 | 1,28 | 0,444 | 1,042 | 0,913 | 1,189 | 0,544 |
| Duración de la diabetes (años) | 1.087 | 14,17 | 11,44 | 122 | 14,42 | 11,38 | 0,553 | 1,002 | 0,987 | 1,018 | 0,796 |
| Mortalidad total (n=122) | No | Sí | p | HR | IC 95% | p | |||
|---|---|---|---|---|---|---|---|---|---|
| Variables cualitativas | n | % | n | % | |||||
| Sexo (% mujer) | 349 | 31,93 | 35 | 28,69 | 0,465 | 0,893 | 0,603 | 1,322 | 0,572 |
| HTA (%) | 884 | 80,88 | 106 | 86,89 | 0,105 | 1,484 | 0,877 | 2,510 | 0,141 |
| Dislipemia (%) | 886 | 81,06 | 99 | 81,15 | 0,982 | 0,918 | 0,583 | 1,446 | 0,712 |
| Tabaquismo (% fumador actual) | 108 | 9,88 | 13 | 10,66 | 0,643 | 1,124 | 0,614 | 2,055 | 0,705 |
| Cáncer (%) | 77 | 7,04 | 17 | 13,93 | 0,007 | 1,983 | 1,187 | 3,312 | 0,009 |
| Hipoglucemias graves en último año (%) | 23 | 2,1 | 3 | 2,46 | 0,797 | 1,325 | 0,421 | 4,168 | 0,631 |
| Retinopatía (%) | 145 | 13,3 | 24 | 19,7 | 0,137 | 1,607 | 1,028 | 2,512 | 0,038 |
| i-SGLT2 (%) | 435 | 39,8 | 28 | 22,95 | <0,001 | 0,473 | 0,310 | 0,722 | 0,001 |
| Ar-GLP1 (%) | 185 | 16,93 | 4 | 3,28 | <0,001 | 0,177 | 0,065 | 0,479 | 0,001 |
| Insulina (%) | 449 | 41,08 | 60 | 49,18 | 0,085 | 1,376 | 0,965 | 1,963 | 0,078 |
| Enfermedad cardiovascular (%) | 626 | 57,38 | 97 | 79,51 | <0,001 | 2,688 | 1,732 | 4,174 | <0,001 |
| Insuficiencia cardiaca (%) | 391 | 35,77 | 89 | 72,95 | <0,001 | 4,44 | 2,98 | 6,62 | <0,001 |
| Insuficiencia cardiaca (%). La categoría de referencia es ausencia de insuficiencia cardiaca | |||||||||
| FE deprimida (%) | 173 | 15,89 | 39 | 31,97 | <0,001 | 4,332 | 2,723 | 6,892 | <0,001 |
| FE intermedia (%) | 80 | 7,35 | 15 | 12,3 | 3,491 | 1,896 | 6,429 | <0,001 | |
| FE preservada (%) | 138 | 12,67 | 35 | 28,69 | 5,105 | 3,171 | 8,219 | <0,001 | |
| Enfermedad arterial cerebrovascular (%) | 82 | 7,51 | 18 | 14,75 | 0,006 | 2,057 | 1,247 | 3,394 | 0,005 |
| Enfermedad arterial periférica (%) | 104 | 9,52 | 28 | 22,95 | <0,001 | 2,631 | 1,725 | 4,013 | <0,001 |
| Enfermedad arterial coronaria (%) | 459 | 42,07 | 66 | 54,1 | 0,011 | 1,537 | 1,076 | 2,195 | 0,018 |
| Territorios vasculares afectados (%) | |||||||||
| 0 territorios (%) | 561 | 51,37 | 44 | 36,07 | <0,001 | 1 (Referencia) | |||
| 1 territorio (%) | 425 | 38,92 | 52 | 42,62 | 1,471 | 0,984 | 2,199 | 0,060 | |
| > 1 territorio (%) | 106 | 9,71 | 26 | 21,31 | 2,909 | 1,791 | 4,726 | <0,001 | |
| Fibrilación auricular (%) | 217 | 19,89 | 53 | 43,44 | <0,001 | 2,809 | 1,963 | 4,019 | <0,001 |
| Estadio ERC (%) | |||||||||
| Estadío 1 (>=90) | 30 | 9,62 | 4 | 6,15 | 0,002 | 1 (Referencia) | |||
| Estadio 2 (60-89) | 94 | 30,13 | 7 | 10,77 | 0,547 | 0,160 | 1,868 | 0,336 | |
| Estadio 3 (30-59) | 169 | 54,17 | 44 | 67,69 | 1,690 | 0,607 | 4,704 | 0,315 | |
| Estadio 4 (15-29) | 17 | 5,45 | 8 | 12,31 | 2,951 | 0,888 | 9,808 | 0,077 | |
| Estadio 5 (< 15) | 2 | 0,64 | 2 | 3,08 | 5,298 | 0,968 | 28,992 | 0,055 | |
| EAU (%) | |||||||||
| EAU <30 | 687 | 73,09 | 68 | 66,02 | 0,067 | 1 (Referencia) | |||
| EAU=[30,300) | 215 | 22,87 | 26 | 25,24 | 1,244 | 0,791 | 1,956 | 0,344 | |
| EAU>=300 | 38 | 4,04 | 9 | 8,74 | 2,190 | 1,092 | 4,391 | 0,027 | |
EAU: excreción de albúmina urinaria; ERC: enfermedad renal crónica; FEVI: fracción de eyección del ventrículo izquierdo; HTA: hipertensión arterial; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TFGe: tasa de filtración glomerular estimada.
Características iniciales de los pacientes en dependencia de que falleciesen o no por causa cardiovascular con análisis de Cox univariante para cada variable
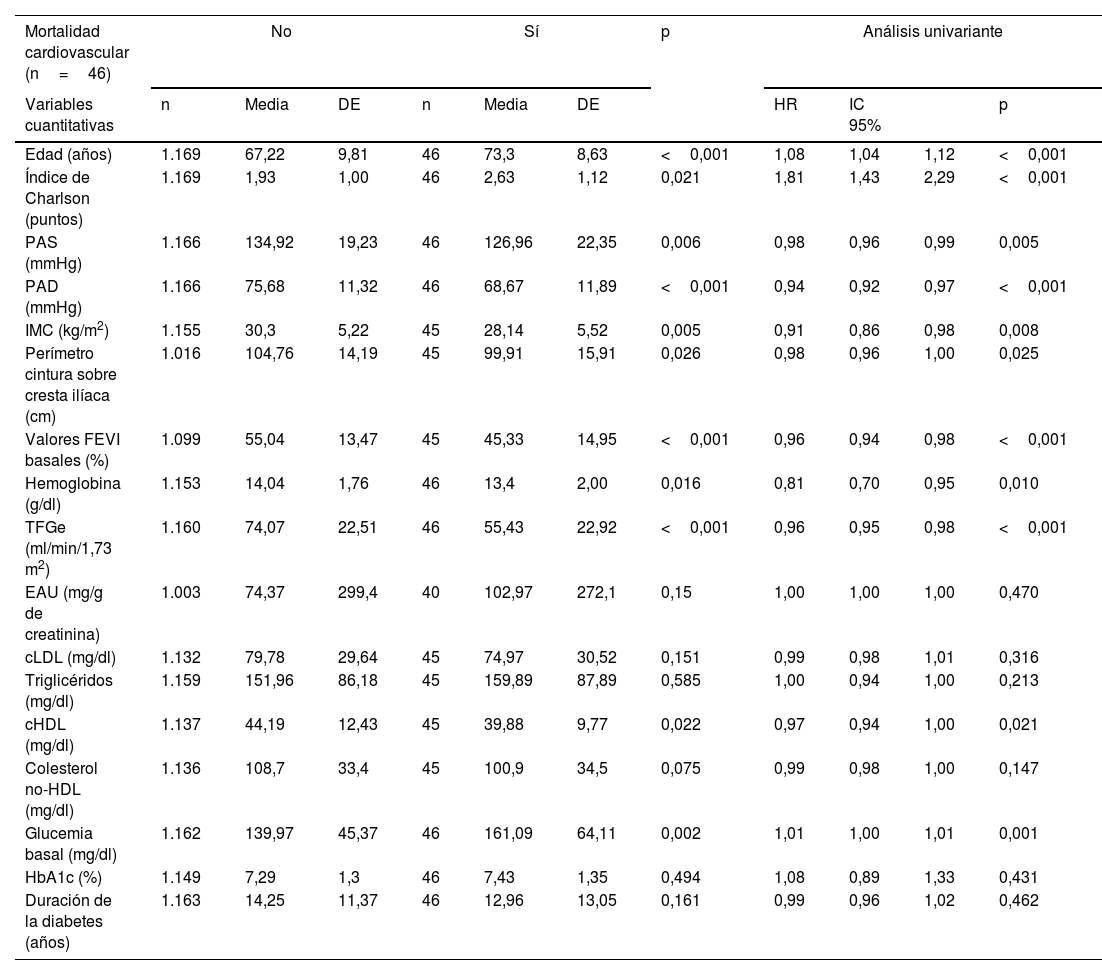
| Mortalidad cardiovascular (n=46) | No | Sí | p | Análisis univariante | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Variables cuantitativas | n | Media | DE | n | Media | DE | HR | IC 95% | p | ||
| Edad (años) | 1.169 | 67,22 | 9,81 | 46 | 73,3 | 8,63 | <0,001 | 1,08 | 1,04 | 1,12 | <0,001 |
| Índice de Charlson (puntos) | 1.169 | 1,93 | 1,00 | 46 | 2,63 | 1,12 | 0,021 | 1,81 | 1,43 | 2,29 | <0,001 |
| PAS (mmHg) | 1.166 | 134,92 | 19,23 | 46 | 126,96 | 22,35 | 0,006 | 0,98 | 0,96 | 0,99 | 0,005 |
| PAD (mmHg) | 1.166 | 75,68 | 11,32 | 46 | 68,67 | 11,89 | <0,001 | 0,94 | 0,92 | 0,97 | <0,001 |
| IMC (kg/m2) | 1.155 | 30,3 | 5,22 | 45 | 28,14 | 5,52 | 0,005 | 0,91 | 0,86 | 0,98 | 0,008 |
| Perímetro cintura sobre cresta ilíaca (cm) | 1.016 | 104,76 | 14,19 | 45 | 99,91 | 15,91 | 0,026 | 0,98 | 0,96 | 1,00 | 0,025 |
| Valores FEVI basales (%) | 1.099 | 55,04 | 13,47 | 45 | 45,33 | 14,95 | <0,001 | 0,96 | 0,94 | 0,98 | <0,001 |
| Hemoglobina (g/dl) | 1.153 | 14,04 | 1,76 | 46 | 13,4 | 2,00 | 0,016 | 0,81 | 0,70 | 0,95 | 0,010 |
| TFGe (ml/min/1,73 m2) | 1.160 | 74,07 | 22,51 | 46 | 55,43 | 22,92 | <0,001 | 0,96 | 0,95 | 0,98 | <0,001 |
| EAU (mg/g de creatinina) | 1.003 | 74,37 | 299,4 | 40 | 102,97 | 272,1 | 0,15 | 1,00 | 1,00 | 1,00 | 0,470 |
| cLDL (mg/dl) | 1.132 | 79,78 | 29,64 | 45 | 74,97 | 30,52 | 0,151 | 0,99 | 0,98 | 1,01 | 0,316 |
| Triglicéridos (mg/dl) | 1.159 | 151,96 | 86,18 | 45 | 159,89 | 87,89 | 0,585 | 1,00 | 0,94 | 1,00 | 0,213 |
| cHDL (mg/dl) | 1.137 | 44,19 | 12,43 | 45 | 39,88 | 9,77 | 0,022 | 0,97 | 0,94 | 1,00 | 0,021 |
| Colesterol no-HDL (mg/dl) | 1.136 | 108,7 | 33,4 | 45 | 100,9 | 34,5 | 0,075 | 0,99 | 0,98 | 1,00 | 0,147 |
| Glucemia basal (mg/dl) | 1.162 | 139,97 | 45,37 | 46 | 161,09 | 64,11 | 0,002 | 1,01 | 1,00 | 1,01 | 0,001 |
| HbA1c (%) | 1.149 | 7,29 | 1,3 | 46 | 7,43 | 1,35 | 0,494 | 1,08 | 0,89 | 1,33 | 0,431 |
| Duración de la diabetes (años) | 1.163 | 14,25 | 11,37 | 46 | 12,96 | 13,05 | 0,161 | 0,99 | 0,96 | 1,02 | 0,462 |
| Mortalidad cardiovascular (n=46) | No | Sí | p | HR | IC 95% | p | |||
|---|---|---|---|---|---|---|---|---|---|
| Variables cualitativas | n | % | n | % | |||||
| Sexo (% mujer) | 374 | 31,99 | 10 | 21,74 | 0,142 | 0,62 | 0,31 | 1,24 | 0,178 |
| HTA (%) | 949 | 81,18 | 41 | 89,13 | 0,173 | 1,84 | 0,73 | 4,65 | 0,200 |
| Dislipemia (%) | 946 | 80,92 | 39 | 84,78 | 0,512 | 1,19 | 0,53 | 2,66 | 0,677 |
| Tabaquismo (% fumador actual) | 114 | 9,75 | 7 | 15,22 | 0,633 | 1,68 | 0,71 | 3,98 | 0,238 |
| Hipoglucemias graves (%) | 26 | 2,22 | 0 | 0 | 0,307 | 0,00 | 0,00 | 0,00 | 0,996 |
| Retinopatia (%) | 160 | 13,7 | 9 | 19,6 | 0,718 | 1,59 | 0,77 | 3,30 | 0,212 |
| i-SGLT2 (%) | 456 | 39,01 | 7 | 15,22 | 0,001 | 0,28 | 0,13 | 0,64 | 0,002 |
| AR-GLP1 (%) | 187 | 16 | 2 | 4,35 | 0,033 | 0,24 | 0,06 | 0,97 | 0,046 |
| Insulina (%) | 487 | 41,66 | 22 | 47,83 | 0,406 | 1,30 | 0,73 | 2,32 | 0,373 |
| Enfermedad cardiovascular (%) | 683 | 58,53 | 40 | 86,96 | <0,001 | 4,62 | 1,96 | 10,91 | <0,001 |
| Insuficiencia cardiaca (%) | 445 | 38,07 | 35 | 76,09 | <0,001 | 5,26 | 2,67 | 10,37 | <0,001 |
| Insuficiencia cardiaca (%) | |||||||||
| FE deprimida (%) | 192 | 16,48 | 20 | 43,48 | <0,001 | 6,71 | 3,21 | 14,03 | <0,001 |
| FE intermedia (%) | 88 | 7,55 | 7 | 15,22 | 4,92 | 1,91 | 12,69 | 0,001 | |
| FE preservada (%) | 165 | 14,16 | 8 | 17,39 | 3,50 | 1,41 | 8,71 | 0,007 | |
| Enfermedad arterial cerebrovascular (%) | 93 | 7,96 | 7 | 15,22 | 0,079 | 2,13 | 0,95 | 4,76 | 0,066 |
| Enfermedad arterial periférica (%) | 121 | 10,36 | 11 | 23,91 | 0,004 | 2,77 | 1,41 | 5,47 | 0,003 |
| Enfermedad arterial coronaria (%) | 500 | 42,84 | 25 | 54,35 | 0,122 | 1,55 | 0,87 | 2,78 | 0,136 |
| Territorios vasculares afectados (%) | |||||||||
| 0 territorios (%) | 591 | 50,6 | 14 | 30,43 | 0,016 | 1 (Referencia) | |||
| 1 territorio (%) | 454 | 38,87 | 23 | 50 | 2,05 | 1,05 | 3,98 | 0,035 | |
| > 1 territorio (%) | 123 | 10,53 | 9 | 19,57 | 3,16 | 1,37 | 7,31 | 0,007 | |
| Fibrilación auricular (%) | 252 | 21,59 | 18 | 39,13 | 0,005 | 2,34 | 1,30 | 4,24 | 0,005 |
| Estadio ERC (%) | |||||||||
| Estadio 1 (>=90) | 33 | 9,27 | 1 | 4,76 | 0,005 | 1 (Referencia) | |||
| Estadio 2 (60-89) | 100 | 28,09 | 1 | 4,76 | 0,31 | 0,02 | 5,00 | 0,411 | |
| Estadio 3 (30-59) | 199 | 55,9 | 14 | 66,67 | 2,16 | 0,28 | 16,44 | 0,457 | |
| Estadio 4 (15-29) | 20 | 5,62 | 5 | 23,81 | 7,48 | 0,87 | 64,10 | 0,067 | |
| Estadio 5 (< 15) | 4 | 1,12 | 0 | 0 | 0,00 | 0,00 | 0,00 | 0,997 | |
| EAU (%) | |||||||||
| EAU <30 | 730 | 72,78 | 25 | 62,5 | 0,158 | 1 (Referencia) | |||
| EAU=[30,300) | 230 | 22,93 | 11 | 27,5 | 1,43 | 0,70 | 2,91 | 0,324 | |
| EAU>=300 | 43 | 4,29 | 4 | 10 | 2,61 | 0,91 | 7,51 | 0,075 | |
EAU: excreción de albúmina urinaria; ERC: enfermedad renal crónica; FEVI: fracción de eyección del ventrículo izquierdo; HTA: hipertensión arterial; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TFGe: tasa de filtración glomerular estimada.
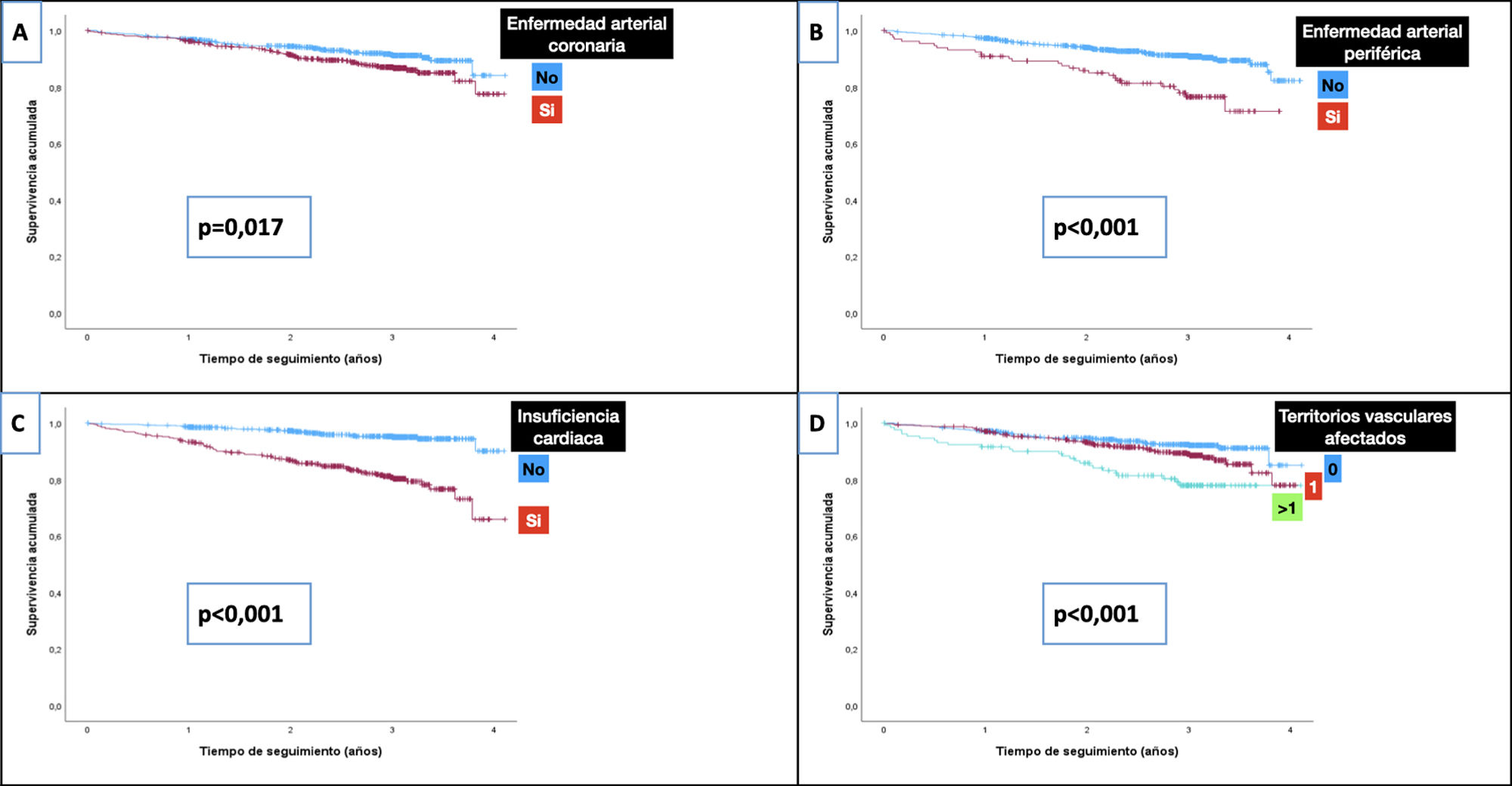
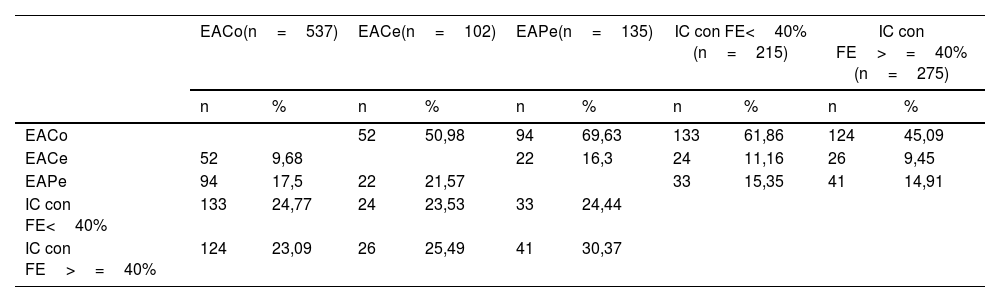
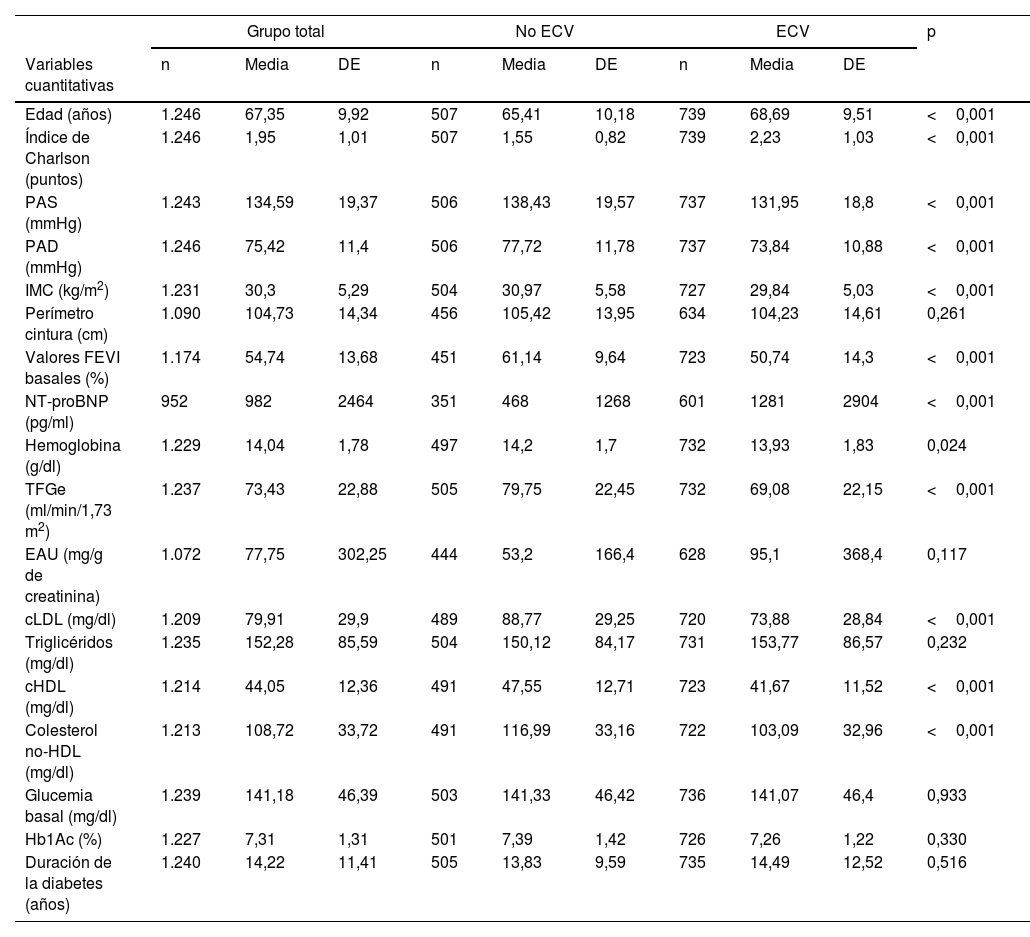
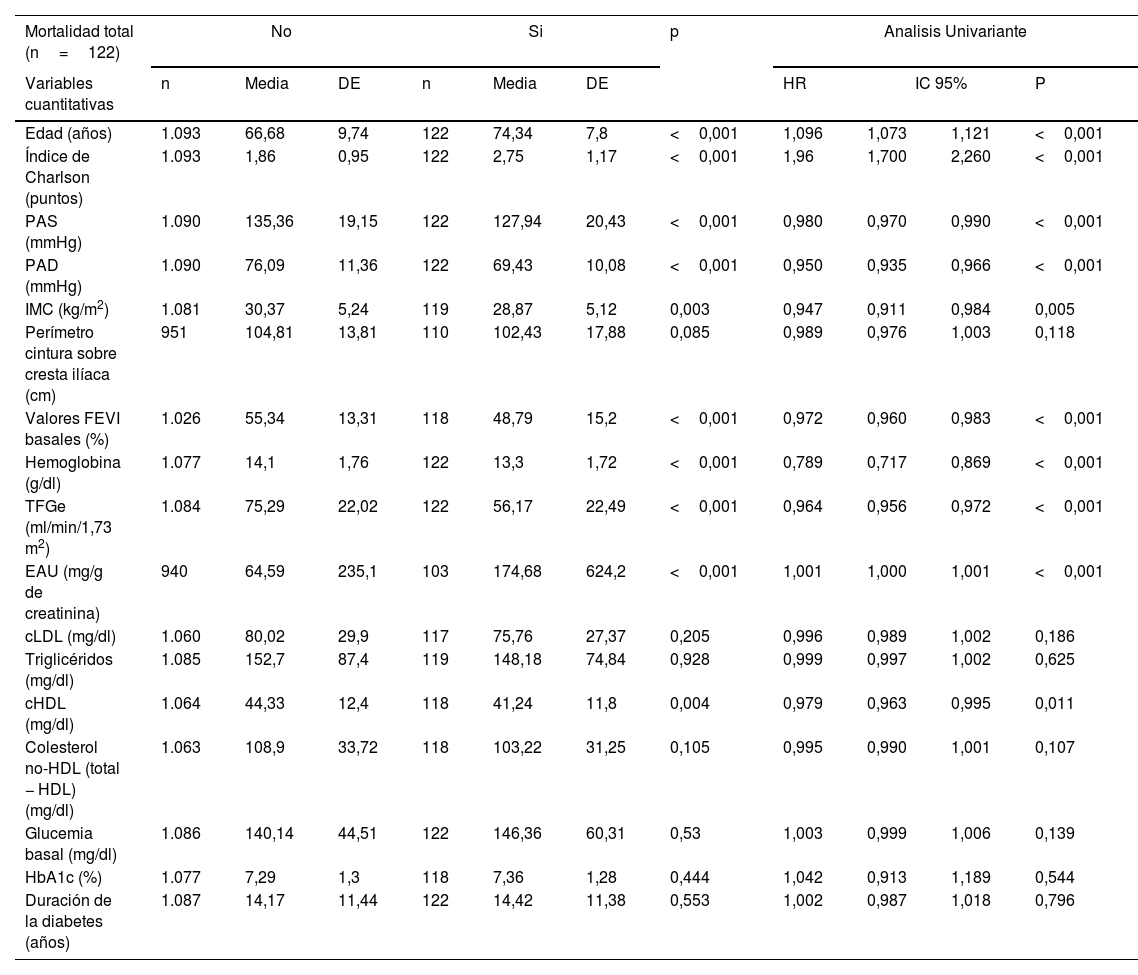
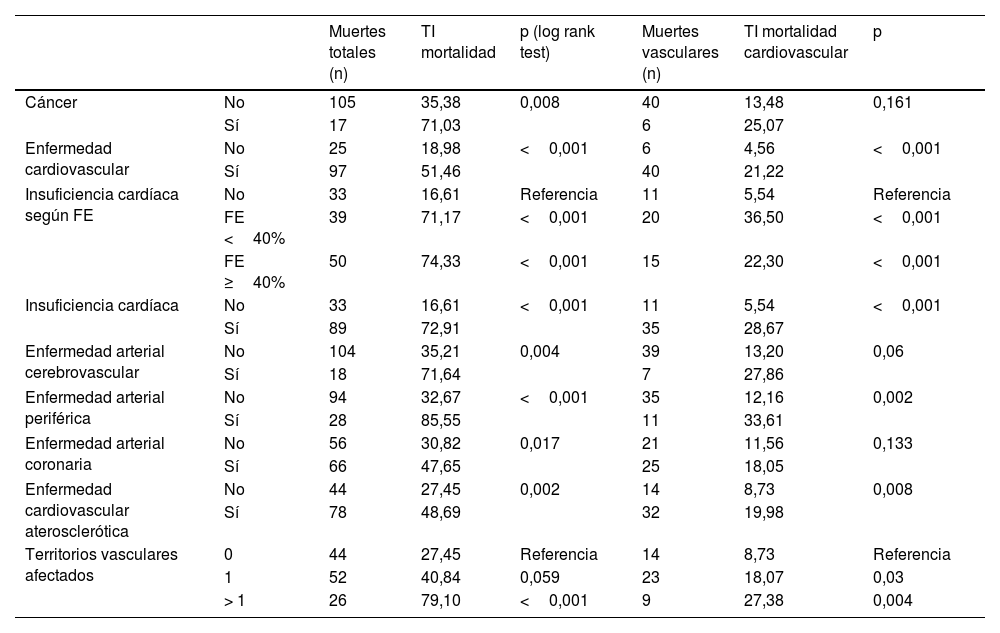
En la tabla 5 se describen las TI de mortalidad total y cardiovascular en dependencia del tipo de ECV inicial, y en la figura 1 se presentan las curvas de supervivencia. Como comparación, se incluye también la TI de mortalidad de los pacientes diagnosticados con cáncer. Los pacientes sin ECV tenían una TI de mortalidad de 19/1.000 y de MCV de 4,5/1.000. Puede comprobarse, como era de esperar, que cualquier manifestación de ECV incrementaba las tasas de mortalidad total y de MCV. Específicamente, las TI más elevadas de mortalidad total y de MCV se produjeron en los pacientes con EAPe (85,6/1.000 y 33,6/1.000 pacientes-año, respectivamente), ante la afectación de más de un territorio vascular (79,1/1.000 y 27,4/1.000, respectivamente) y en aquellos diagnosticados de insuficiencia cardiaca (72,9/1.000 y 28,7/1.000, respectivamente). Hay que resaltar que la TI más alta de MCV se observó en los pacientes con ICFEr (36,5/1.000). Las TI fueron inferiores en los sujetos con EACo (47,6/10.00 y 18,1/1.000 para mortalidad total y MCV, respectivamente).
Tasas de incidencia (TI) por cada 1.000 pacientes año de mortalidad total y cardiovascular
| Muertes totales (n) | TI mortalidad | p (log rank test) | Muertes vasculares (n) | TI mortalidad cardiovascular | p | ||
|---|---|---|---|---|---|---|---|
| Cáncer | No | 105 | 35,38 | 0,008 | 40 | 13,48 | 0,161 |
| Sí | 17 | 71,03 | 6 | 25,07 | |||
| Enfermedad cardiovascular | No | 25 | 18,98 | <0,001 | 6 | 4,56 | <0,001 |
| Sí | 97 | 51,46 | 40 | 21,22 | |||
| Insuficiencia cardíaca según FE | No | 33 | 16,61 | Referencia | 11 | 5,54 | Referencia |
| FE <40% | 39 | 71,17 | <0,001 | 20 | 36,50 | <0,001 | |
| FE ≥40% | 50 | 74,33 | <0,001 | 15 | 22,30 | <0,001 | |
| Insuficiencia cardíaca | No | 33 | 16,61 | <0,001 | 11 | 5,54 | <0,001 |
| Sí | 89 | 72,91 | 35 | 28,67 | |||
| Enfermedad arterial cerebrovascular | No | 104 | 35,21 | 0,004 | 39 | 13,20 | 0,06 |
| Sí | 18 | 71,64 | 7 | 27,86 | |||
| Enfermedad arterial periférica | No | 94 | 32,67 | <0,001 | 35 | 12,16 | 0,002 |
| Sí | 28 | 85,55 | 11 | 33,61 | |||
| Enfermedad arterial coronaria | No | 56 | 30,82 | 0,017 | 21 | 11,56 | 0,133 |
| Sí | 66 | 47,65 | 25 | 18,05 | |||
| Enfermedad cardiovascular aterosclerótica | No | 44 | 27,45 | 0,002 | 14 | 8,73 | 0,008 |
| Sí | 78 | 48,69 | 32 | 19,98 | |||
| Territorios vasculares afectados | 0 | 44 | 27,45 | Referencia | 14 | 8,73 | Referencia |
| 1 | 52 | 40,84 | 0,059 | 23 | 18,07 | 0,03 | |
| > 1 | 26 | 79,10 | <0,001 | 9 | 27,38 | 0,004 |
En análisis univariante, las patologías cardiovasculares que más incrementaron el riesgo de mortalidad (tabla 3) fueron la insuficiencia cardiaca (HR: 4,4; p<0,001) y la EAPe (HR: 2,6; p<0,001). Es de destacar que los pacientes tratados con i-SGLT2 (HR: 0,47; p<0,001) o con AR-GLP1 (HR: 0,18; p<0,001) tenían menos riesgo de mortalidad. Respecto a MCV, el riesgo aumentó significativamente con la existencia de insuficiencia cardiaca (HR: 5,3; p<0,001) y EAPe (HR: 2,8; p=0,003), mientras que fue inferior en los tratados con i-SGLT2 (HR: 0,28; p=0,002) o con AR-GLP1 (HR: 0,24; p=0,046).
En el análisis multivariante del modelo final elegido para mortalidad total, con inclusión simultánea de todos los territorios vasculares afectados y ajustado para el resto de las variables asociadas con mortalidad, la única manifestación de ECV que permaneció estadísticamente significativa fue la insuficiencia cardiaca (HR: 1,63; IC95%: 1,03-2,58; p=0,037). Otros factores que aumentaron el riesgo de mortalidad fueron la edad (HR1año: 1,07; IC95%: 1,04-1,10; p<0,001) y el índice de Charlson (HR1punto: 1,77; IC95%: 1,46-2,16); por el contrario, fueron factores asociados con menor riesgo la TFGe (HR1ml/min: 0,990; IC95%: 0,980-0,999; p=0,003) tener un diagnóstico de cáncer (HR: 0,52; IC95%: 0,28-0,98; p=0,042) y ser tratado con AR-GLP1 (HR: 0,29; IC95%: 0,10-0,78; p=0,014).
En el análisis multivariante del modelo final elegido para MCV, con inclusión simultánea de todos los territorios vasculares afectados y ajustado para el resto de las variables asociadas con MCV, la única manifestación de ECV que permaneció estadísticamente significativa fue también la insuficiencia cardiaca (HR: 3,41; IC95%: 1,68-6,93; p=0,001). Otro factor que incrementó el riesgo de MCV fue la edad (HR1año: 1,04; IC95%: 1,00-1,08; p=0,033); por el contrario, fueron factores protectores la TFGe (HR1ml/min: 0,98; IC95%: 0,96-0,99; p=0,008), y en el límite de la significación estadística el género femenino (HR: 0,50; IC95%: 0,25-1,01; p=0,053) y ser tratado con i-SGLT2 (HR: 0,44; IC95%: 0,19-1,01; p=0,052).
DiscusiónEn nuestro estudio, mediante el seguimiento prospectivo durante 2,6años de una cohorte de pacientes con DM2 reclutados en el medio hospitalario, y con una elevada prevalencia de ECV, hemos comprobado cómo las TI de mortalidad total y de MCV varían en dependencia del tipo de ECV inicial. Las TI más elevadas, y el mayor incremento de riesgo, se produjeron en pacientes con insuficiencia cardiaca, EAPe y ante la afectación aterosclerótica de más de un territorio vascular. En análisis ajustado para potenciales factores de confusión, la única ECV que incrementó el riesgo de forma estadísticamente significativa fue la insuficiencia cardiaca. Cabe resaltar que todas las TI de mortalidad, excepto las asociadas a EACo, fueron superiores a las de tener un diagnóstico de cáncer.
El riesgo de mortalidad total, y en concreto el de MCV, es variable en el paciente con DM, por lo que las guías de práctica clínica15,16 recomiendan realizar una estratificación cuidadosa del riesgo vascular en cada paciente, para fijar el tipo de tratamiento y la intensidad de los objetivos terapéuticos. Hay pocos datos en la literatura que comparen el riesgo de mortalidad de las distintas manifestaciones de ECV. En un estudio retrospectivo basado en bases de datos de atención primaria en el Reino Unido17 el riesgo de MCV fue mayor en los pacientes con múltiples comorbilidades cardiovasculares. En un estudio poblacional danés reciente18, con más de 150.000 personas con DM2 analizadas en un seguimiento de casi 10años, el mayor riesgo de mortalidad estaba asociado al desarrollo de insuficiencia cardiaca (RR: 3), un riesgo intermedio estaba asociado a EAPe y EACe (RR: 2,3 y 2,2, respectivamente) y un riesgo más bajo aparecía ante la presencia de EACo (RR: 1,3); no obstante, no dispusieron de información sobre otros factores de riesgo ni de la existencia de afectación microvascular. Estos datos son totalmente superponibles a los encontrados en nuestro estudio en el análisis univariante de mortalidad.
El reconocimiento de la insuficiencia cardiaca como una complicación asociada a la DM, debido al efecto perjudicial de la hiperglucemia y de la resistencia insulínica, se ha incrementado en los últimos años, y ha sido objeto de revisiones11 y de documentos de consenso19. La DM2 puede favorecer el desarrollo tanto de ICFEp (más frecuente en estadios iniciales de la enfermedad) como de ICFEr (más frecuente en pacientes con EACo)11. El riesgo de mortalidad parece ser más elevado en los pacientes con ICFEr20, proporcionalmente al grado de descenso de la FEVI. En nuestro estudio comprobamos que aunque las TI de mortalidad total eran similares, las de MCV eran superiores en los pacientes con insuficiencia cardiaca si la FEVI era <40%.
La presencia de EAPe incrementa notablemente la probabilidad de presentar otras manifestaciones de ECVA, así como de insuficiencia cardiaca, por lo que puede considerase un marcador de enfermedad polivascular21. Un amplio estudio epidemiológico comprobó la asociación de EAPe con otras formas de ECVA y con insuficiencia cardiaca, así como el aumento significativo del riesgo de MCV (HR: 1,86)22. Nuestro trabajo confirmó que los pacientes con EAPe tenían una elevada prevalencia de otras manifestaciones de ECVA, así como de insuficiencia cardiaca, lo que justificaba que desarrollasen las TI más elevadas de mortalidad total y una de las TI más elevadas de MCV, solo superadas por los pacientes con ICFEr.
El mayor riesgo conferido por la presencia de insuficiencia cardiaca y EAPe viene asociado al hecho de que pueden ser en el momento actual las entidades iniciales más frecuentes de ECV, además de ser la EAPe la enfermedad aterosclerótica más estrechamente asociada a la DM23. De hecho, en las últimas décadas la forma de ECVA que mayor reducción ha experimentado en sus TI ha sido la EACo; esta reducción ha ido acompañada también de una disminución del número absoluto de casos, algo que no se ha conseguido ni para la EAPe ni para la EACe24. Por ello las guías recientes recomiendan tener un alto índice de sospecha para realizar cribado de insuficiencia cardiaca16,25 y de EAPe16.
Los últimos datos epidemiológicos demuestran en nuestro país26 una tendencia favorable de reducción de mortalidad en pacientes con DM2. La tendencia global hacia una reducción en las tasas de MCV puede deberse a mejores estrategias preventivas y terapéuticas8,27. La demostración del beneficio específico de i-SGLT2 y AR-GLP19 hace que sean unánimemente recomendados ante la presencia de ECV en los pacientes con DM215,16. En nuestro estudio, aunque no específicamente diseñado para ello, vimos cómo mejoraba el pronóstico de los pacientes tratados con estos grupos terapéuticos. Además, identificamos una oportunidad de mejora, ya que apenas el 39% de los pacientes con ECV eran tratados con un i-SGLT2 y el 12% con AR-GLP1. Estos resultados pueden servir para impulsar la utilización de fármacos cardioprotectores, con el objetivo de que ningún paciente que pueda beneficiarse de ellos sea privado de su prescripción28. Hay que tener en cuenta, además, el beneficio aditivo de la utilización simultánea de varios grupos terapéuticos29. Por otra parte, también constatamos en nuestro trabajo que era necesario intensificar el tratamiento hipolipemiante hasta alcanzar los objetivos marcados por las guías15.
El presente estudio tiene como ventaja el contar con una muestra de pacientes con DM2 con elevada prevalencia de ECV, reclutados en hospitales representativos de todo el territorio nacional. Se dispuso de datos epidemiológicos, clínicos y analíticos. Además, los pacientes habían sido evaluados conjuntamente en consultas de cardiología y endocrinología, por lo que se disponía de datos ecocardiográficos en casi el 90% de la cohorte. Por ello puede considerarse que las TI descritas en las distintas situaciones son exactas.
No obstante, hay limitaciones importantes que deben ser tenidas en cuenta. En primer lugar, la muestra y el seguimiento fueron inferiores a los inicialmente proyectados, debido a las restricciones impuestas por la pandemia de COVID-19; por ello la potencia estadística puede ser limitada para la realización de modelos de regresión multivariable y análisis de subgrupos, y los resultados deben ser interpretados con precaución. A modo de ejemplo, el incremento de riesgo de mortalidad conferido por la presencia de cáncer en análisis univariante se revirtió en el análisis multivariante, lo que podría justificarse por la inclusión simultánea en los modelos del índice de Charlson y por el riesgo competitivo de la MCV. En segundo lugar, los pacientes fueron recogidos en medio hospitalario, por lo que las prevalencias de ECV no son representativas de la población total de pacientes con DM2. Finalmente, el tratamiento prescrito fue a discreción del médico responsable, por lo que los datos de eficacia respecto a reducción de riesgo de mortalidad de algunos fármacos pueden estar parcialmente sesgados (sesgo de indicación) y deben ser considerados como generadores de hipótesis y no definitivos.
En conclusión, el riesgo residual de mortalidad total y MCV de los pacientes con DM2 y ECV puede ser muy elevado. Esto es especialmente manifiesto en los sujetos con insuficiencia cardiaca, EAPe y ante la afectación aterosclerótica de múltiples territorios vasculares. La existencia de insuficiencia cardiaca triplica, de modo independiente, el riesgo de MCV, mientras que el incremento de riesgo asociado a la EAPe puede explicarse por su frecuente asociación con insuficiencia cardiaca y afectación polivascular. Por ello consideramos que es necesario detectar en los pacientes con DM2 la presencia de estas patologías para optimizar el manejo de los factores de riesgo vascular y para ampliar la utilización de fármacos hipoglucemiantes con el potencial de mejorar el pronóstico de la enfermedad.
FinanciaciónEl presente trabajo ha sido financiado con la ayuda de una beca, concedida a la Sociedad Española de Diabetes y a la Sociedad Española de Cardiología, de Boehringer Ingelheim.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.