El comportamiento alimentario está compuesto por una amplia variedad de conductas alimentarias que dependen de factores psicosociales, biológicos y ambientales. Estas conductas pueden dar origen a enfermedades relacionadas con la nutrición como la obesidad, que afecta a más de 650 millones de personas en el mundo. La grelina y la leptina son hormonas que desempeñan un papel clave en la regulación del apetito, la ingesta de alimentos y el metabolismo energético. Las investigaciones en genética evidencian que variantes en los genes de ambas hormonas se asocian con conductas alimentarias complejas como la preferencia por alimentos palatables, lo que confiere susceptibilidad al entorno obesogénico moderno. Esta revisión analiza la evidencia científica en torno a polimorfismos en los genes de grelina y leptina y su asociación con conductas alimentarias. La comprensión de dichos mecanismos es relevante, dado que podría impactar en los objetivos de las intervenciones farmacológicas o conductuales para su tratamiento.
Feeding behavior is integrated within a wide variety of eating behaviors, which depend on psychosocial, biological and environmental factors. These types of behavior can cause nutrition-related diseases such as obesity, which affects more than 650 million people worldwide. Ghrelin and leptin are key hormones that regulate appetite, food intake and energy metabolism. Research in genetics suggests that genetic variants of both hormones are associated with complex forms of eating behavior, such as a preference for palatable food, making individuals susceptible to the modern obesogenic environment. This review analyses the scientific evidence around polymorphisms in the ghrelin and leptin genes and their association with eating behavior. The understanding of these mechanisms is relevant since it could impact on the objectives of pharmacological or behavioral interventions for their treatment.
La grelina (GHRL) y la leptina (LEP) juegan un papel importante en el control neuroendocrino de la homeostasis de energía. Estas hormonas transmiten información al sistema nervioso central acerca del estado nutricional1, que se integra en el hipotálamo, principal responsable de la regulación homeostática de la alimentación2. Ambas hormonas participan como mediadores moleculares que influyen en la regulación del apetito y el metabolismo; la GHRL, promoviendo la ingesta de alimento, y la LEP, inhibiéndolo1. El comportamiento alimentario abarca un amplio espectro de conductas que anteceden la ingestión de alimentos3 y está determinado por elementos ambientales, psicosociales y biológicos en constante interacción4. Las alteraciones de estos factores pueden favorecer el desarrollo de enfermedades no transmisibles relacionadas con la nutrición, como la obesidad. Este trastorno afecta a más de 650 millones de personas alrededor del mundo y es asociado a más de 38 comorbilidades, entre ellas la diabetes mellitus tipo 2, enfermedades cardiovasculares y algunos tipos de cáncer. Los costos directos e indirectos de la obesidad y las enfermedades añadidas varían en cada país; en Estados Unidos y Brasil se ha estimado un impacto económico de 212 mil millones y 10,1 mil millones de dólares anuales, respectivamente, por lo que es considerada como una epidemia moderna global5–8.
El objetivo de esta revisión es presentar y analizar la evidencia científica en torno a la asociación entre factores genéticos (polimorfismos de un solo nucleótido [SNP]) en los genes de las hormonas GHRL y LEP como posibles elementos implicados en el desarrollo de la obesidad a través de la modulación de conductas alimentarias. Se consultó literatura en la base de datos PubMed utilizando las siguientes palabras clave y términos médicos (MeSH) en inglés para la búsqueda de artículos relacionados: single nucleotide polymorphism, SNPs, genotype, genetics, eating behavior, feeding behavior, ghrelin, leptin, food preference, snack, snacking, eating in the absence of hunger, sweet cravings. La búsqueda se realizó con el siguiente orden: la variable independiente (SNP, genotipo, hormonas) y la conjunción en inglés «AND» seguida de la variable dependiente (comportamiento alimentario, conducta alimentaria). Los criterios de inclusión fueron: el análisis de algún SNP en los genes de GHRL y LEP y la evaluación de al menos una conducta alimentaria. Se incluyeron artículos del 2007 al 2016 debido a la escasez de información con las variables mencionadas. Fueron tomados los datos de autor, año, país, población de estudio, grupos de estudio, gen, SNP, conducta alimentaria, valor de significación y odds ratio (OR).
Hormonas reguladoras de la ingesta y su papel en la obesidadA pesar de que factores como la genética, la nutrición, el sedentarismo y el ambiente alimentario están involucrados en el desarrollo de la obesidad, las investigaciones sobre la evaluación del apetito y los mecanismos que lo regulan destacan la importancia de los procesos fisiológicos, la expresión génica de las hormonas implicadas en la regulación de la ingesta y el gasto de energía y la señalización de los neurotransmisores en el cerebro9,10.
Las hormonas y neuropéptidos que participan en dichos procesos pueden clasificarse de acuerdo a sus efectos sobre la ingesta alimentaria: por un lado, se encuentran las orexigénicas, incluidas la GHRL, el neuropéptido Y y la proteína relacionada con agouti, cuya producción es estimulada por las sensaciones de hambre y por lo tanto, promueven el consumo de alimentos; y por otro lado, se encuentran las anorexigénicas, como la LEP, la proopiomelanocortina y el transcrito regulado por cocaína y anfetamina, que responden a las sensaciones de saciedad y que inhiben el consumo de los mismos7. Así, algunas investigaciones sobre el apetito y los biomarcadores metabólicos incluyen la medición de las concentraciones de algún péptido (por ejemplo, GHRL) y la evaluación de alguna conducta alimentaria (por ejemplo, preferencia alimentaria)4,7, de manera que se ha evidenciado que la respuesta biológica puede alterarse ante determinadas conductas alimentarias1.
El apetito se regula a través de interacciones entre mecanismos homeostáticos y hedónicos; es decir, aquellos que se producen como respuesta a cambios fisiológicos en los depósitos de energía en las 3 etapas de la alimentación (preprandial, prandial y posprandial) y los mecanismos fisiológicos de placer, relacionados con la palatabilidad de los alimentos, la secreción de neurotransmisores como la dopamina y la serotonina y en los que se incluyen factores psicológicos como el aprendizaje, la memoria y la recompensa. Ambos procesos, llevados a cabo en el hipotálamo, tienen funciones distintas, pero no son independientes2,4,6,11–13. Debido a que el peso corporal es en gran medida determinado por la ingesta y el gasto de energía, el placer obtenido de consumir cierto tipo de alimentos, generalmente los altos en grasa y azúcar que se encuentran de manera ubicua en el ambiente, puede sobreponerse a las señales homeostáticas de saciedad y promover la ganancia de peso2,4,14.
Bases genéticas del comportamiento alimentarioAunque vinculada a diversos factores, la predisposición genética es importante para la aparición y el mantenimiento de la obesidad1,7. Investigaciones de las últimas décadas en poblaciones de gemelos han permitido establecer que la genética contribuye entre un 40-70% al desarrollo de obesidad15. Los estudios de asociación del genoma completo (GWAS, del inglés genome-wide association studies) se han centrado en la identificación de variantes genéticas involucradas en el desarrollo de la obesidad; sin embargo, permanece menos explorado el papel que dichas variantes en genes implicados en la regulación de la ingesta y el metabolismo tienen sobre las conductas alimentarias, evidenciando un mecanismo que puede contribuir de forma indirecta al desarrollo de la obesidad15.
Debido a la diversidad de elementos biológicos, psicológicos y ambientales involucrados en el comportamiento alimentario, se ha teorizado que el riesgo genético para el desarrollo de la obesidad es probable que suceda por la vía de la regulación neurobiológica que controla el apetito. La hipótesis es que esta susceptibilidad genética se manifiesta a través de determinadas conductas alimentarias estimuladas por las señales del ambiente alimentario y mediadas por el apetito15,16.
Cabe mencionar la diferencia entre investigaciones de mutaciones puntuales en el gen LEP o en su receptor (LEPR) relacionados con formas poco comunes de obesidad monogénica, que resultan en obesidad severa de inicio temprano e hiperfagia y la consecuente influencia en el apetito17. Por otro lado, los resultados de estudios que han evaluado polimorfismos en genes de las hormonas reguladoras de la ingesta no son concluyentes en los efectos sobre patrones de la conducta alimentaria y obesidad poligénica18.
Esta premisa ha sido comprobada por GWAS realizados en diferentes poblaciones y por estudios de asociación de SNP en genes de péptidos involucrados en los mecanismos del apetito, tanto en el hipotálamo como en el hipocampo (cuya función se relaciona con procesos como la memoria y el aprendizaje), con los niveles de adiposidad, pero solo un número limitado de conductas alimentarias han sido examinadas. La ampliación del conocimiento de estas interacciones significaría un mejor acercamiento para la prevención y tratamiento de la obesidad en alguno de sus niveles, ya que si la conducta es un mediador para el desarrollo de la enfermedad, la inclusión del comportamiento alimentario en estudios de asociación genética aportaría un mejor entendimiento en la cadena causal15,16,19.
A partir del desarrollo de GWAS, se han identificado SNP en genes de péptidos involucrados en la regulación de la ingesta de alimentos, sin embargo, aún no es posible explicar la variabilidad de la obesidad entre individuos expuestos al mismo ambiente alimentario. Así, la predisposición a esta condición se sostiene en la suma de variantes de diversos genes, por lo que individualmente estos SNP explican un porcentaje reducido (2-3%) de la etiología de la obesidad y se cree que, en conjunto, contribuyen en un 20-30% al desarrollo de esta enfermedad16. A pesar de haber sido identificados diversos SNP en genes de las principales hormonas reguladoras del apetito, son escasos los estudios de asociación entre los «SNP de obesidad» y las conductas alimentarias15,16. Y así como se ha planteado la heredabilidad de las conductas, es importante señalar que los SNP, tanto en los genes de péptidos reguladores del apetito como en sus receptores, pueden alterar la interacciones fisiológicas entre ellos y orientar al desarrollo de otras perturbaciones metabólicas, como la resistencia a la GHRL o la LEP, que también son factores importantes relacionados con el desarrollo de obesidad1,20,21.
Grelina: biología y generalidadesFue identificada en 1999 como el ligando del receptor secretagogo de la hormona de crecimiento. Su función primordial es la de estimular el apetito ante la necesidad metabólica aguda en el periodo preprandial, por lo que tiene una relación inversa con el índice de masa corporal (IMC)1,22.
Además de su función en el sistema gastrointestinal (vaciado gástrico y motilidad), entre sus acciones se encuentra la regulación del sistema cardiovascular al mejorar la función endotelial por aumento de la biodisponibilidad del óxido nítrico. En el sistema inmune, ejerce efectos antiinflamatorios al inhibir las células T cooperadoras tipo 1 y la secreción de citocinas proinflamatorias como la interleucina 61,7,22–24. También juega un papel en procesos psicológicos como la recompensa, la memoria y la conducta alimentaria motivada, por la acción de la hormona sobre el sistema dopaminérgico en el área ventral tegmental, en donde el receptor secretagogo de la hormona de crecimiento se encuentra ampliamente distribuido, aumentando la frecuencia y probabilidad de liberación de dopamina2,7.
La GHRL es una hormona de 28 aminoácidos y es secretada principalmente por las células endocrinas de las glándulas oxínticas del fondo gástrico y, en menor medida, en tejidos de otros órganos del cuerpo como el corazón, los pulmones, el páncreas, el sistema inmunológico, los ovarios y la tiroides2,7,13,22,23.
El gen GHRL está compuesto por 4 exones y codifica un péptido precursor de 117 aminoácidos: la preprogrelina, la cual es procesada postraduccionalmente en al menos 5 productos, siendo la obestatina y la desacil GHRL los más relevantes1. Para que la GHRL ejerza sus actividades orexigénicas, antes de su secreción, la desacil-grelina requiere ser acilada por la enzima GHRL O-aciltransferasa, en la serina de la posición 3 del péptido, lo que posteriormente le permite acceder al sitio de unión activo del receptor secretagogo de la hormona de crecimiento1,2,7,13. Se ha postulado que el sistema GHRL O-aciltransferasa-GHRL puede actuar como un sensor de la disponibilidad de nutrientes, en particular de los ácidos grasos de cadena media, como señal de disponibilidad de alimentos altamente calóricos, los cuales son usados como sustratos de acilación y promueven la producción y secreción de acil-grelina1,22.
Los niveles circulantes de GHRL varían con el estado energético, se elevan en condición de ayuno, decaen en la etapa posprandial y oscilan de acuerdo con los patrones de alimentación del individuo1,2,22. Los niveles plasmáticos de GHRL total oscilan entre los 300 y 800pg/ml, y niveles bajos se han relacionado con la resistencia a la insulina y la diabetes mellitus tipo 2. También se han reportado diferencias entre personas con diabetes mellitus tipo 2 y distinta composición corporal; en situación de ayuno, las personas con obesidad tienen menores niveles en plasma de GHRL, mientras que individuos con mayor masa muscular tienen mayores niveles de la misma, comparados con sujetos con peso normal, razón por la cual se ha postulado una relación inversa de la GHRL plasmática con el IMC en sujetos sanos y con obesidad. Además, se ha reportado que la disminución posprandial de la GHRL sérica es menor en grupos con obesidad frente a controles con IMC normal, ya que los niveles de GHRL aumentan durante la pérdida de peso inducida por la dieta7,25.
Hormona grelina y comportamiento alimentarioComo se comentó anteriormente, las conductas alimentarias dependen de una amplia variedad de factores, y algunos estudios en modelos murinos evidencian que los procesos neurobiológicos de hormonas como la GHRL (que participa en los sistemas homeostático y hedónico) pueden dirigir otras respuestas conductuales más allá de la ingesta alimentaria26.
El estudio de Schéle et al., realizado en 201626 en ratas macho Sprague-Dawley, consistió en inyecciones intracerebroventriculares de GHRL con el objetivo de conocer si la hormona es capaz de orientar la elección alimentaria entre alimento estándar y con distribución diferente de nutrientes (grasa y sacarosa) después del ayuno nocturno. Se reportó que la GHRL puede alterar la elección alimentaria en el periodo agudo de la restricción de alimentos, con efectos notables para promover la ingesta de alimento bajo en grasa y sacarosa. Estos resultados fueron replicados en el estudio de Bake et al., de 201727; a partir del mismo procedimiento, se evaluaron los efectos de la GHRL sobre la elección de alimento durante la conducta de atracón. Los hallazgos evidencian que la GHRL actúa como moduladora de la elección de alimento en condiciones experimentales, orientando la selección hacia una opción más nutritiva26,27.
Las conductas alimentarias también son reguladas por las señales sociales de aprendizaje, sin embargo, los mecanismos neurobiológicos a través de los cuales se llevan a cabo no se han descrito en su totalidad. Una de las hipótesis propuestas es que la señalización de la GHRL en el hipocampo promueve el aprendizaje social de las conductas alimentarias. En el estudio de Hsu et al., en 201828, se utilizó un procedimiento conocido como «transmisión social de la preferencia alimentaria» con ratas macho Sprague-Dawley divididas en 2 grupos: O (observadoras) y D (demostradoras), en el cual las ratas O (a las que se administró GHRL) experimentan interacción social con las ratas D, que consumieron alimento con sabor u olor específico. Los resultados evidenciaron que la activación farmacológica de la vía de señalización de la GHRL aumenta la preferencia por alimentos asociados con la interacción social con otra rata28. Estas evidencias proporcionan nuevas perspectivas de investigación para estudios en seres humanos y amplían el conocimiento sobre las bases moleculares del comportamiento alimentario y la obesidad.
Asociación de SNPs en grelina y conductas alimentariasSe localizaron 5 artículos de asociación entre SNP en el gen de GHRL y conductas alimentarias, los cuales fueron realizados en población adulta de ambos sexos de países de los continentes europeo y asiático29–33. El resumen de dichos estudios se encuentra en la tabla 1.
Asociación entre SNP en el gen GHRL y conductas alimentarias
| Autor (año) | País | Grupos de estudio (n) | Conducta alimentaria evaluada | SNP en GHRL | Principales hallazgos |
|---|---|---|---|---|---|
| Monteleone et al.30 (2007) | Italia | MujeresSp/Ob (90)PN (119) | Atracones | rs696217 | Alelo A asociado con mayor riesgo de desarrollo de conducta de atracón (OR 2,725; IC 95% 1,168-6,35; p=0,01) |
| rs34911341 | NS | ||||
| Bienertova-Vasku et al. 31 (2008) | República Checa | AdultosOb (125)PN (60) | DietaConducta extrema de snackingTamaño de porciónIrregularidad de las comidas | rs696217 | NS |
| rs34911341 | NS | ||||
| Landgren et al.32 (2011) | Suecia | AdultosConsumidores de EtOH (296)No consumidores de EtOH (283) | Consumo de alimentos altos en azúcar | rs4684677rs42451rs34911341rs696217rs26802 | Haplotipo AGACGT se asoció con mayor ingesta de sacarosa en consumidores/no consumidores de bebidas alcohólicas (p=0,045) |
| HaplotiposAGACGTGACGT | Haplotipo GACGT se asoció con mayor ingesta de sacarosa en consumidores/no consumidores de bebidas alcohólicas (p=0,037) y consumidores de altas cantidades de bebidas alcohólicas (p=0,047) | ||||
| Takezawa et al.33 (2013) | Japón | MujeresOb (117) | Ingesta total de alimentosConsumo de macronutrientesPercepción de la constitución y el pesoMotivación para comerSensación de hambre y saciedadMalos hábitos alimentariosContenido de las comidasPatrones de alimentación inestables | rs696217 | Genotipo TT se asoció con el mayor consumo de lácteos (p=0,05) y «percepción de la constitución y el peso» (p=0,011) |
| rs3755777 | NS | ||||
| rs26311 | Genotipo CC se asoció con mayor consumo de proteína (p=0,044), consumo de lácteos (p=0,015) y motivación para comer (p=0,043) | ||||
| rs26312 | Genotipo TT se asoció con la categoría «motivación para comer» (p=0,036) | ||||
| rs2075356 | Genotipo CC se asoció con mayor consumo de lácteos (p=0,01) y percepción de la constitución y el peso (p=0,028) | ||||
| Imaizumi et al.34 (2016) | Japón | Adultos5.112 | Comidas al díaFrecuencia de alimentosCalorías consumidasConsumo de macronutrimentos | rs696217 | NS |
EtOH: alcohol etílico; NS: no significativo; Ob: obesidad; PN: peso normal; Sp: sobrepeso.
El SNP analizado con mayor frecuencia fue el rs696217 (Leu72Met), localizado en el exón número 2, y se ha postulado que puede provocar modificaciones en la secreción de la GHRL25,34. Dentro de las conductas alimentarias evaluadas, la más frecuente fue relacionada con la ingestión de alimentos/alimentos altamente calóricos y las preferencias por alimentos, seguida de las conductas de snacking, atracones, motivación para comer y tamaño de las porciones.
El estudio realizado en 2007 por Monteleone et al. en población italiana tuvo como grupos de estudio a 90 mujeres con sobrepeso y obesidad y 119 con peso normal, a las que se genotipificó para 2 SNPs en el gen GRHL (rs696217 y rs34911341) y se evaluó su asociación con la conducta de atracón a través de test psicométricos para la evaluación de psicopatologías relacionadas con la alimentación. El análisis estadístico indicó que el alelo A de la variante rs696217 fue significativamente más frecuente en pacientes que presentaron la conducta de atracón, por lo que fue asociado con riesgo moderado para desarrollar esta conducta (OR 2,725; IC 95% 1,168-6,35; p=0,01)29.
En 2008 Bienertova-Vasku et al. llevaron a cabo en la República Checa una investigación en 125 sujetos con obesidad y 60 con peso normal de ambos sexos. Se analizaron 2 variantes genéticas en el gen de GHRL (rs696217 y rs34911341) y se evaluó la ingesta alimentaria mediante un recordatorio de alimentación de 7 días, a través del cual se analizaron también las conductas extremas de snacking, dieta, porciones extremas e irregularidad en las comidas. De acuerdo con el análisis estadístico, ninguno de los SNP estudiados fue predictor de los patrones alimentarios reflejados en el recordatorio de alimentación en esta población30.
Se ha hipotetizado un mecanismo de recompensa común para el consumo de alcohol y sustancias dulces tanto en animales como en humanos35. Con base en las funciones conocidas de la GHRL tanto en el balance de energía como en el sistema de recompensa, en 2011 Landgren et al. realizaron un análisis de haplotipos incluyendo 6 variantes genéticas en el gen GHRL (rs4684677, rs42451, rs35680, rs34911341, rs696217 y rs26802). Los haplotipos analizados fueron AGACGT y GACGT en 2 grupos de estudio: consumidores de alcohol (n=283) y no consumidores (n=296), clasificados en relación con su consumo de alcohol y sacarosa en población estadounidense. El consumo de ambos se evaluó mediante un cuestionario de frecuencia de consumo de diferentes bebidas alcohólicas y de alimentos con alto contenido de azúcar. El haplotipo AGACGT se asoció con una mayor ingesta de sacarosa en los sujetos de alto y bajo consumo de alcohol (p=0,045) y el haplotipo GACGT se asoció con una mayor ingesta de sacarosa entre los individuos de ambos grupos (p=0,037) y con los consumidores de altas cantidades de alcohol (p=0,047); sin embargo, la asociación no se mantuvo después de ajustes metodológicos para el haplotipo GACGT31.
En 2013, Takezawa et al.32 analizaron 5 SNPs en GHRL (rs3755777, rs26311, rs26312, rs696217 y rs2075356) en 117 mujeres japonesas con obesidad, para estudiar la relación entre los genotipos y las tendencias de alimentación por grupos de alimentos. Fueron evaluadas mediante el cuestionario autoadministrado de historial de dieta, en el cual a través de enunciados clasificados en categorías se estiman los hábitos alimentarios y el consumo de macronutrientes de acuerdo a grupos de alimentos mediante una frecuencia de consumo. El genotipo CC del SNP rs26311 se asoció significativamente con el consumo de proteína (g/día) (p=0,044), el consumo de lácteos (g/día) (p=0,015) y con la categoría «motivación para comer» del cuestionario autoadministrado de historial de dieta (p=0,043). El genotipo TT del SNP rs26312 se asoció con «motivación para comer» (p=0,036). El genotipo TT del SNP rs696217 se asoció con el consumo de lácteos (g/día) (p=0,050) y con la categoría «percepción de la constitución y el peso» (p=0,011), al igual que el genotipo CC del SNP rs2075356, asociado significativamente con los mismos parámetros (p=0,014 y 0,028, respectivamente)32.
En el estudio retrospectivo de Imaizumi et al. realizado en 201633 se analizó la variante rs696217 del gen GHRL en población japonesa y se evaluó el estilo de vida (cantidad de macronutrientes y patrones de alimentación de los 6 meses previos) a través de un recordatorio alimentario, así como parámetros antropométricos de 5,112 adultos, sin criterios de exclusión específicos sobre la composición corporal. Los datos de alimentación analizados fueron el número de comidas al día, la frecuencia de alimentos por mes, la cantidad de energía por tiempo de comida (kcal/comida), así como la cantidad de sal, grasa, hidratos de carbono y proteína (g/comida). Los análisis estadísticos no mostraron asociación del SNP en el gen de GRHL y con ninguna variable de alimentación, sin embargo, se estimó una asociación con la obesidad ante la presencia del alelo G (OR 1,40; IC 95% 1,13-1,74; p=0,002)33.
Los estudios presentados aportan nueva evidencia sobre las bases genéticas de las conductas alimentarias, pero es importante destacar que son pocos los realizados a la fecha en las distintas poblaciones a nivel mundial, lo cual dificulta la generalización de los resultados por las diferencias raciales. Los GWAS ofrecen una posibilidad importante en la identificación de variantes genéticas de otros péptidos involucrados en la regulación del apetito, que ampliarían la investigación en relación con otras conductas alimentarias.
Leptina: biología y generalidadesFue descubierta en 1994 y fue identificada como un lipostato, es decir, que promueve una respuesta ante la presencia de lípidos almacenados en los adipocitos. Posteriormente, se distinguió entre sus principales funciones la supresión del apetito y la regulación del gasto de energía mediante la transmisión de información al cerebro acerca de los depósitos de energía del cuerpo y su disponibilidad mediante la anulación de la actividad de las neuronas de neuropéptido Y y la estimulación de las neuronas de proopiomelanocortina y el transcrito regulado por cocaína y anfetamina en el núcleo arcuato del hipotálamo1,14,22.
La LEP es una proteína de 167 aminoácidos codificada por el gen LEP. Es secretada principalmente por los adipocitos, y aunque se expresa en otros tejidos como la médula ósea, los ovarios, la placenta, el estómago y el tejido linfoide, se estima que el tejido adiposo es responsable del 95% de la producción de LEP1,14,22. La LEP ejerce su acción a través de su receptor (LEPR), que se expresa sobre todo en el hipotálamo y en tejidos cerebrales como el cerebelo1,22. Los niveles de LEP transmiten información de las reservas de energía del cuerpo a los núcleos del hipotálamo que regulan la homeostasis. El aumento de los depósitos de energía eleva su producción, lo cual desencadena una respuesta fisiológica para reducir el consumo de alimento y promover el gasto de energía1.
Debido a la relación entre la cantidad de tejido adiposo del individuo y la producción de LEP, los niveles plasmáticos de LEP total en personas con normopeso oscilan en el rango de 3-18ng/ml, siendo más elevados en la mujer que en el hombre; en individuos con un IMC superior a 30 se pueden encontrar valores de 30ng/ml o incluso superiores. Se ha descrito el fenómeno de resistencia a la LEP, el cual se relaciona con alteraciones en los niveles plasmáticos de LEP comúnmente encontrados en sujetos con obesidad y que contribuye al mantenimiento de esta enfermedad1. Se ha hipotetizado que dicha resistencia sucede por alteraciones en la señalización de la LEP, siendo esta dependiente de mecanismos moleculares como deficiencias en el paso de la hormona a través de la barrera hematoencefálica, que deriva en niveles altos de LEP circulante, la supresión de la señalización de LEPR o la inflamación a nivel celular, relacionados con la ingesta de dietas altas en grasa1,36.
Hormona leptina y comportamiento alimentarioLa regulación hedónica de la ingesta de alimentos ha ganado atención en el campo de investigación de la obesidad; resultados de investigaciones evidencian que similar al papel de la GHRL, y además de actuar en la regulación del gasto de energía y la ingesta alimentaria, la LEP también regula el sistema de recompensa en el cerebro mediante la supresión de la actividad neural posprandial10,37.
Las investigaciones en modelos murinos y el uso de paradigmas como el condicionamiento de preferencia de lugar, utilizado por Shimizu et al. en 201710 en ratones macho C57BL/6 para esclarecer los efectos de la LEP sobre la preferencia de dietas altas en grasa en ratones delgados y con obesidad deficientes de la hormona, demostraron que en condiciones no experimentales, los ratones con deficiencia de LEP tienen una mayor preferencia por dietas con grasa, pero esta preferencia cambia ante la administración de LEP, lo que a su vez reduce la ingesta alimentaria a niveles comparables a los de los ratones delgados10.
Otro estudio relacionado con la preferencia alimentaria y la percepción de sabores fue realizado por Kawai et al. en 2000, en ratones BALB y C57BL divididos en grupos: con diabetes y obesidad con defectos en LEPR, normopeso sin diabetes y normopeso. Se realizó un procedimiento quirúrgico de extracción de los nervios responsables de la respuesta periférica a las sustancias dulces (glosofaríngeo y noveno), se administró LEP a los sujetos con normopeso y se demostró que suprimió la respuesta al sabor dulce; sin embargo, esto no se encontró en los ratones con defectos de LEPR. Los resultados evidencian que la LEP puede actuar como un supresor de la detección del sabor dulce y a su vez tener un papel en la regulación de la ingesta alimentaria37; sin embargo, los resultados no son concluyentes y se han planteado otras vías moleculares, como los polimorfismos en los receptores del sabor dulce, para explicar este fenómeno.
Así, los estudios en modelos murinos proporcionan nuevas ideas de análisis en seres humanos a partir de explicaciones moleculares y mecanicistas en animales, en los cuales se pueden aislar variables fisiológicas y conductuales para un mejor entendimiento.
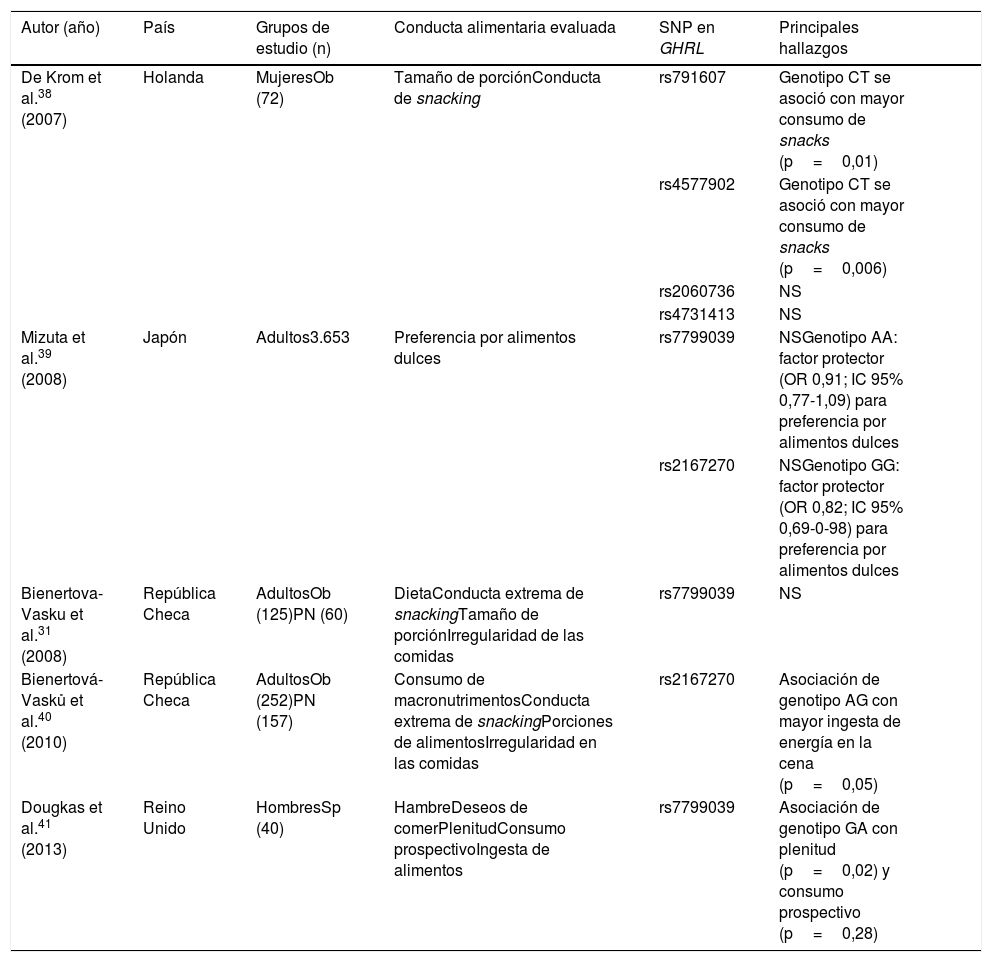
Asociación de SNP en leptina y conductas alimentariasSe encontraron 5 artículos de asociación entre SNPs en el gen de LEP y conductas relacionadas con la alimentación, realizados en población adulta de ambos sexos de países de Europa y Asia30,38–41. El resumen de los estudios se encuentra en la tabla 2.
Asociación entre SNP en el gen LEP y conductas alimentarias
| Autor (año) | País | Grupos de estudio (n) | Conducta alimentaria evaluada | SNP en GHRL | Principales hallazgos | |
|---|---|---|---|---|---|---|
| De Krom et al.38 (2007) | Holanda | MujeresOb (72) | Tamaño de porciónConducta de snacking | rs791607 | Genotipo CT se asoció con mayor consumo de snacks (p=0,01) | |
| rs4577902 | Genotipo CT se asoció con mayor consumo de snacks (p=0,006) | |||||
| rs2060736 | NS | |||||
| rs4731413 | NS | |||||
| Mizuta et al.39 (2008) | Japón | Adultos3.653 | Preferencia por alimentos dulces | rs7799039 | NSGenotipo AA: factor protector (OR 0,91; IC 95% 0,77-1,09) para preferencia por alimentos dulces | |
| rs2167270 | NSGenotipo GG: factor protector (OR 0,82; IC 95% 0,69-0-98) para preferencia por alimentos dulces | |||||
| Bienertova-Vasku et al.31 (2008) | República Checa | AdultosOb (125)PN (60) | DietaConducta extrema de snackingTamaño de porciónIrregularidad de las comidas | rs7799039 | NS | |
| Bienertová-Vasků et al.40 (2010) | República Checa | AdultosOb (252)PN (157) | Consumo de macronutrimentosConducta extrema de snackingPorciones de alimentosIrregularidad en las comidas | rs2167270 | Asociación de genotipo AG con mayor ingesta de energía en la cena (p=0,05) | |
| Dougkas et al.41 (2013) | Reino Unido | HombresSp (40) | HambreDeseos de comerPlenitudConsumo prospectivoIngesta de alimentos | rs7799039 | Asociación de genotipo GA con plenitud (p=0,02) y consumo prospectivo (p=0,28) |
NS: no significativo; Ob: obesidad; PN: peso normal; Sp: sobrepeso.
El SNP analizado con mayor frecuencia fue el rs7799039 (G-2548A), localizado en el promotor del gen, y se ha evidenciado que influye en los niveles de LEP en plasma. La conducta alimentaria evaluada con mayor frecuencia fueron las preferencias alimentarias, seguida de la ingesta de alimentos, en la que se incluyeron parámetros psicómetros que la determinan, la conducta de snacking y el tamaño de las porciones.
El estudio de De Krom et al. de 2007 incluyó 72 mujeres con obesidad de la cohorte del European Prospective Study into Cancer and Nutrition de Holanda, seleccionadas con los criterios de IMC≥33kg/m2, puntuación en el quinto percentil superior en la conducta de snacking, basada en 11 preguntas sobre la frecuencia de consumo de snacks, y puntuación en el quinto percentil superior de ingesta alimentaria, basada en 28 preguntas usando fotografías para estimar el tamaño de la porción. Se analizaron 4 variantes genéticas en el gen LEP (rs791607, rs4577902, rs2060736 y rs4731413). Se reportó una asociación significativa del genotipo CT del SNP rs791607 y el genotipo CT del SNP rs4577902 con un mayor consumo de snacks (p=0,01 y 0,006, respectivamente), pero no con el tamaño de la porción38.
En Japón, Mizuta et al. en 2008 realizaron un estudio con 3,653 adultos de ambos sexos en el que se evaluó la preferencia por alimentos dulces mediante un cuestionario con respuesta tipo Likert para conformar 2 grupos de estudio: caso (si puntuaba para la preferencia por lo dulce) o control (aquellos con puntaje menor). Se genotipificaron 2 SNP del gen LEP (rs7799039 y rs2167270). El análisis estadístico mostró una OR de 0,82 (IC 95% 0,69-0,98) y una asociación significativa para el modelo dominante (GG) de la variante rs2167270 en la preferencia por lo dulce, por lo que dicho genotipo puede ser considerado como protector para presentar dicha preferencia alimentaria. Para el modelo dominante (AA) del SNP rs7799039, se estableció una OR de 0,91 (IC 95% 0,77-1,09)39. Sin embargo, los resultados de este SNP deben interpretarse cuidadosamente debido al rango de los intervalos de confianza de la prueba de asociación.
Bienertova-Vasku et al. en 2008 llevaron a cabo en la República Checa una investigación en 125 sujetos con obesidad y 60 con peso normal de ambos sexos. Se analizó un SNP en el gen LEP (rs7799039) y se evaluó la ingesta alimentaria mediante un recordatorio de alimentación de 7 días, a través del cual se analizaron también las conductas extremas, la dieta, las porciones extremas y la irregularidad en las comidas. Los resultados no mostraron asociación significativa entre este SNP y los patrones alimentarios reportados por los participantes en esta población30.
A pesar de que el estudio anterior no reveló ninguna asociación significativa, debido a las tendencias observadas hacia conductas nutricionales específicas, en 2010 Bienertová-Vasků et al. realizaron un nuevo estudio en 409 individuos divididos en 2 grupos: 252 con obesidad y 157 con peso normal. Analizaron el SNP rs2167270 y la evaluación de recordatorios alimentarios de 7 días para conocer la distribución de macronutrimentos de la dieta y patrones dietarios como la conducta extrema de snacking (consumo de energía mayor del 25% del total diario), porciones de alimentos e irregularidad en las comidas. El genotipo AG de este SNP se asoció significativamente (p=0,05) con una mayor ingesta de energía, así como con una tendencia a un mayor consumo de la misma en la cena40.
Por su parte, Dougkas et al. realizaron en 2013 un estudio en 40 hombres con sobrepeso de Reino Unido, en el cual analizaron la variante rs7799039 del gen LEP y se evaluó mediante una escala visual análoga tipo Likert el perfil del apetito (hambre, deseos de comer, plenitud y consumo prospectivo), así como los gramos de alimento y la energía consumidos (kJ) durante una sesión experimental. El genotipo GA se asoció significativamente con la plenitud (p=0,02) y el consumo prospectivo (p=0,028)41.
Los SNP del gen LEP amplían el conocimiento sobre la influencia genética en las conductas alimentarias como posibles causantes de obesidad. Como fue señalado, se debe poner especial atención en la escasez de poblaciones de estudio, no solo por razones genéticas, sino también por las conductuales, ya que las conductas alimentarias se emiten en función de los diferentes ambientes alimentarios en donde se desarrolla el individuo. Una cuestión para tomar en cuenta en los estudios de polimorfismos de las hormonas presentadas es la cantidad de sujetos y los grupos de estudio de cada una de las investigaciones. Por un lado, el número de individuos es bajo, y si bien se incluyen los que cuentan con el criterio de determinado indicador antropométrico (sobrepeso u obesidad), la mayoría de los estudios carecen de un grupo de comparación (por ejemplo, individuos con peso normal) para contraponer la asociación entre los mismos.
ConclusionesMuchos factores contribuyen a la complejidad del comportamiento alimentario y la emisión de las conductas alimentarias4. Las hormonas GHRL y LEP son 2 mediadores clave en la regulación del metabolismo y el balance energético que actúan en los núcleos hipotalámicos en el sistema nervioso central integrando señales ambientales que indican la disponibilidad de alimentos y el inicio o la finalización del episodio alimentario. La interacción entre los elementos anteriores determina la ingesta alimentaria, la composición de las comidas y el tamaño de las porciones, entre otros, y se refleja en las variaciones en el peso corporal de los individuos1,4,13.
Las investigaciones que exploran el papel de dichas hormonas, las conductas alimentarias y sus consecuencias (por ejemplo, la obesidad) han permitido postular que una posible causa de las alteraciones en los mecanismos moleculares de los péptidos pueden explicarse por SNPs de los genes que las codifican, lo que podría conducir a cambios en la producción y/o las acciones de las hormonas7.
En este artículo se examinaron estudios de asociación de SNPs en los genes GHRL y LEP con conductas alimentarias. Es importante destacar que existe evidencia que demuestra asociaciones significativas entre determinados SNP y algunas conductas alimentarias. Si bien ha quedado demostrada la asociación de variables como el sedentarismo, la elevada ingestión de alimentos con alta densidad energética y factores hormonales con la prevalencia de obesidad, es imperativa la identificación y caracterización de los mecanismos genéticos implicados, lo cual podría cambiar los objetivos para intervenciones de tipo farmacológico, conductual o psicológico15.
AutoríaASEG y ZRC participaron en la concepción de la idea del manuscrito. ASEG redactó el manuscrito. ZRC y AGMM realizaron la revisión crítica del artículo y contribuyeron a la mejora del mismo. Todos los autores han leído y expresado su conformidad con el manuscrito final.
FinanciaciónEste trabajo fue desarrollado gracias al financiamiento del Consejo Estatal de Ciencia y Tecnología de Jalisco (COECYTJAL), convocatoria FODECIJAL-2019 para atender problemas estatales (proyecto No. 7942), otorgado a ZRC. Mientras que ASEG recibe una beca del Consejo Nacional de Ciencia y Tecnología (CONACYT) para sus estudios de posgrado (beca número 779720).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.