La inflamación generada en el tejido adiposo o lipoinflamación, puede contribuir al desarrollo de la resistencia a la insulina. Los mecanismos asociados a la lipoinflamación están relacionados con la función de los adipocitos y los macrófagos presentes en el tejido adiposo. En este contexto, el nivel del nucleósido adenosina está aumentado en individuos con obesidad. Las causas o consecuencias de este aumento no se conocen. Aunque, adenosina al activar a sus receptores (A1, A2A, A2B y A3) es capaz de modular diferencialmente la función de adipocitos y macrófagos, con el fin de evitar la reducción de la sensibilidad a la insulina y generar un estado antiinflamatorio en el individuo con obesidad. En esta revisión proponemos que adenosina podría ser un elemento clave en el desarrollo de nuevas estrategias para el control de la lipoinflamación y homeostasis metabólica a través de la regulación del diálogo adipocito-macrófago.
Lipoinflamation is the inflammation generated in the adipose tissue. It can contribute to the development of insulin resistance. The lipoinflammation-associated mechanisms are related to the function of adipocytes and macrophages present in the adipose tissue. In this regard, the level of nucleoside adenosine is increased in individuals with obesity. Causes or consequences of this increase are unknown. Although, adenosine activating its receptors (A1, A2A, A2B and A3) is able to differentially modulate the function of adipocytes and macrophages, in order to avoid the reduction of insulin sensitivity and generate an anti-inflammatory state in subject with obesity. In this review we propose that adenosine could be a key element in the development of new strategies for limit lipoinflammation and regulate metabolic homeostasis through modulation of adipocyte-macrophage dialogue.
La obesidad, considerada como la acumulación anormal o excesiva de grasa corporal que perjudica la salud del individuo, es definida por la Organización Mundial de la Salud como un índice de masa corporal (IMC) mayor o igual a 30kg/m21. La obesidad ha incrementado de forma acelerada su prevalencia en todo el mundo, convirtiéndose rápidamente en una epidemia2,3.
Múltiples esfuerzos se han realizado para comprender la fisiopatología de la obesidad4. En este contexto, los adipocitos constituyen una familia de células especializadas cuya función va más allá de la captación y depósito de grasa, y se consideran actualmente como una célula endocrina. Adicionalmente, los macrófagos del tejido adiposo, también constituyen una familia celular compleja que identifican las señales metabólicas liberadas desde el tejido adiposo como una señal de activación y generación de un estado de inflamación crónico. El estado de lipoinflamación resulta, por lo tanto, de la interacción entre adipocitos y macrófagos. Los mecanismos de comunicación entre estas dos células no son totalmente conocidos.
Adenosina (ADO) es un nucleósido derivado del metabolismo de la adenosina trifosfato (ATP), que es producida ubicuamente en nuestro organismo. Cumple una serie de funciones homeostáticas a través de la activación de cuatro receptores acoplados a la proteína G: A1, A2A, A2B y A35,6. Las funciones incluyen aumentar o disminuir el flujo sanguíneo, inhibir la agregación plaquetaria y de macrófagos, reducir los estados inflamatorios hasta inclusive provocar un estado de inmunodeficiencia en casos extremos, reducir el metabolismo de grasas, favorecer la sensibilidad a la insulina y sus consecuentes efectos metabólicos, entre otras funciones7. A pesar de la información disponible sobre ADO y su relación con el tejido adiposo, no se conoce en detalle su rol en la comunicación adipocito y macrófago.
En la presente revisión proponemos que adenosina podría ser un elemento clave en el desarrollo de nuevas estrategias para el control de la lipoinflamación y homeostasis metabólica a través de la regulación del diálogo adipocito-macrófago.
Tejido adiposo y lipoinflamaciónEl tejido adiposo es más que un reservorio de grasa y presenta diferentes funciones fisiológicas dependiendo del tipo histológico. Así, el tejido adiposo blanco se encarga principalmente de almacenar el exceso de energía; mientras que el tejido adiposo pardo se especializa en disiparla en forma de calor en respuesta a hipotermia o exceso de energía. Además, el tejido adiposo beige, que se encuentra principalmente en el tejido subcutáneo derivado del tejido adiposo blanco, cumple funciones similares al tejido adiposo pardo8.
El tejido adiposo (en general) está constituido por adipocitos, preadipocitos, células endoteliales, fibroblastos y células inmunitarias, principalmente macrófagos y linfocitos T. Los adipocitos pueden ejercer su influencia sobre el resto de los tejidos liberando interleuquinas, quimiocinas, factores de crecimiento y hormonas9. De hecho, en la actualidad el tejido adiposo blanco, es reconocido como un órgano secretor que impacta en la fisiología de todo el organismo, siendo capaz de regular funciones sistémicas como insulinosensibilidad, respuesta inmune, función cardiovascular y procesos autocrinos y paracrinos. Por lo tanto, este tejido no solo cumple un rol pasivo como almacenador de energía, sino que actúa como modulador de la homeostasis metabólica, termorregulación, regulación hormonal, presión arterial y coagulación8.
Sin embargo, en el contexto de un excesivo consumo energético a través de la dieta, sumado a un déficit en el gasto de energía acumulada, el tejido graso es susceptible a un remodelamiento («adipose tissue remodeling»)10. Concretamente, 70 a 80% de sujetos con obesidad sufren este proceso de remodelación, el cual afecta tanto la estructura como la función normal del tejido, generando un proceso inflamatorio subclínico y crónico. Los mecanismos subyacentes al estado de lipoinflamación asociado a obesidad aún están en estudio. Sin embargo, modelos animales y humanos evidenciaron que en las primeras etapas de hipertrofia del tejido adiposo se generan zonas hipóxicas, es decir, tejido adiposo con baja exposición al oxígeno, las cuales a su vez mostraron un aumento en la secreción de interleuquinas proinflamatorias, factores de crecimiento (ver tabla S1 del material adicional en el anexo)10–12; así como también moduladores inflamatorios como leptina, adiponectina y resistina13. Además, se ha visto que la hipoxia presente en el tejido adiposo reduce la expresión de dos proteínas claves para la recuperación del tejido, como el receptor activado por el proliferador de peroxisoma gamma (PPARy) y adiponectina, cuya función es reducir el estado inflamatorio en este tejido11. Por tanto, inicialmente, esta inflamación es aguda, pero al no resolverse correctamente se torna crónica, sistémica y de bajo grado, lo que se conoce como lipoinflamación14,15.
Interleuquinas proinflamatorias derivadas de macrófagos en el tejido adiposoLos macrófagos son parte del sistema inmune y derivan de los monocitos formados en la médula ósea. Además, los macrófagos presentan dos vías de activación. Estos son los activados por la vía clásica (macrófagos M1) los cuales cumplen un rol proinflamatorio; mientras que aquellos activados por la vía alternativa (macrófagos M2) están ligados a la resolución de la inflamación.
Al igual que los adipocitos, los macrófagos presentes en el tejido adiposo también desempeñan un rol fundamental en el desarrollo del estado lipoinflamatorio. Muestra de esto es el aumento del número de macrófagos en el tejido adiposo, que se correlaciona positivamente con el alza del IMC16. Además, en ratones obesos se ha visto que los macrófagos aumentan en el tejido adiposo, sin cambios cuantitativos en hígado o músculo, denotando un efecto selectivo inducido en este tejido17,18.
Para lograr determinar el rol de los macrófagos en el tejido adiposo, Xu et al.17 midieron el perfil transcripcional del tejido adiposo blanco, marrón, músculo e hígado aislados de ratones obesos. De entre los múltiples genes analizados, se encontró un aumento significativo de las citocinas proinflamatorias17. En busca del origen celular de estas citocinas, estos autores separaron dos componentes celulares, adipocitos maduros y una fracción vascular-estromal, la cual incluye macrófagos y preadipocitos. Se encontró que el aumento de estas citocinas proinflamatorios eran predominantes en la fracción vascular-estromal, concluyendo que dichas citoquinas provendrían de macrófagos y/o preadipocitos.
No solo es importante el número de macrófagos presente en el tejido adiposo, sino que también la función de estas células, dado que se evidenció que en el tejido adiposo de los ratones delgados se encontraban primordialmente macrófagos de un fenotipo antiinflamatorio o tipo M219. En contraste, los ratones obesos mostraron que la expresión de las proteínas antiinflamatorias disminuía, mientras que aumentaba la expresión de genes que codifican TNF-α y óxido nítrico sintasa, ambos asociados a la presencia de macrófagos de tipo M1, o con fenotipo proinflamatorio19. Congruente con estos hallazgos, se ha mostrado además un aumento en la movilización de M1 hacia el tejido graso en individuos con obesidad20. A su vez, las células M1 serían responsables de una mayor liberación de citoquinas proinflamatorias potenciando el círculo inflamatorio21. Estos estudios fueron confirmados por otros investigadores quienes mostraron que los macrófagos presentes en el tejido adiposo de roedores con peso normal expresan genes del fenotipo M2. Por el contrario, los macrófagos presentes en tejido adiposo de roedores obesos expresan genes clásicos del fenotipo M122.
Para reforzar la idea de la heterogeneidad de los macrófagos presentes en el tejido adiposo, Bassaganya-Riera et al.23 caracterizaron la expresión de la glicoproteína F4/80 en macrófagos de ratón, para luego diferenciarlos en aquellos que mostraban alta o baja expresión de dicha proteína. En el experimento se observó que los macrófagos con baja expresión de F4/80 son predominantes en el tejido adiposo de ratones delgados, en cambio en ratones obesos se acumularon ambos fenotipos. Se observó además que una acumulación de macrófagos de alta expresión de F4/80 se relacionaba con aumento en la resistencia a la insulina y mayores cantidades de factor de necrosis tumoral alfa (TNF-α) y proteína quimioatrayente de monocitos (MCP-1), en comparación con macrófagos con baja expresión de F4/80. También, se encontró que las células con alta expresión de F4/80 generan mayores cantidades de PPARγ/δ y receptores toll tipo 4 (TLR-4). Por su parte, los macrófagos con baja expresión de F4/80 sintetizaron mayor cantidad de la interluequina antiinflamatoria, IL-423. Por lo tanto, en ratones que expresan menos F4/80 predominaría un estado antiinflamatorio. En contraposición en ratones obesos predominarían los macrófagos con mayor expresión de F4/80. Estos resultados refuerzan la idea sobre el cambio fenotípico que sufren los macrófagos en la obesidad, así como también el importante rol de estas células en el proceso de lipoinflamación.
Al respecto, se ha planteado que los grupos de macrófagos presentes en el tejido adiposo podrían tener orígenes dispares. Algunos podrían ser derivados desde los preadipocitos presentes en dicho tejido, que en ambientes propicios adquieren características propias de los macrófagos, como la fagocitosis de elementos bacterianos24. Otra vía que dotaría al tejido adiposo de macrófagos sería la hematógena mediante los vasos sanguíneos. Esto último fue demostrado, en modelos in vivo utilizando marcadores fluorescentes específicos de monocitos en sangre circulante25.
Junto a lo anterior es preciso mencionar que tanto en roedores como en humanos obesos se ha descrito niveles elevados de MCP-1 en el tejido adiposo26, cuya función sería reclutar macrófagos22. Así, esta potente citocina tiene actividad quimiotáctica vía activación de un receptor de membrana denominado receptor de quimiocina tipo 2 (CCR2). En el contexto de la obesidad, estudios in vivo demuestran un aumento en la expresión de esta quimiocina en ratones obesos en comparación con sus controles delgados27. El mecanismo por el cual ocurre la mayor síntesis de MCP-1 en el tejido adiposo está en investigación, y se conoce que el promotor del gen de MCP-1 puede ser estimulado en presencia de insulina27, por tanto se establecería un círculo regulatorio entre insulina y MCP-1.
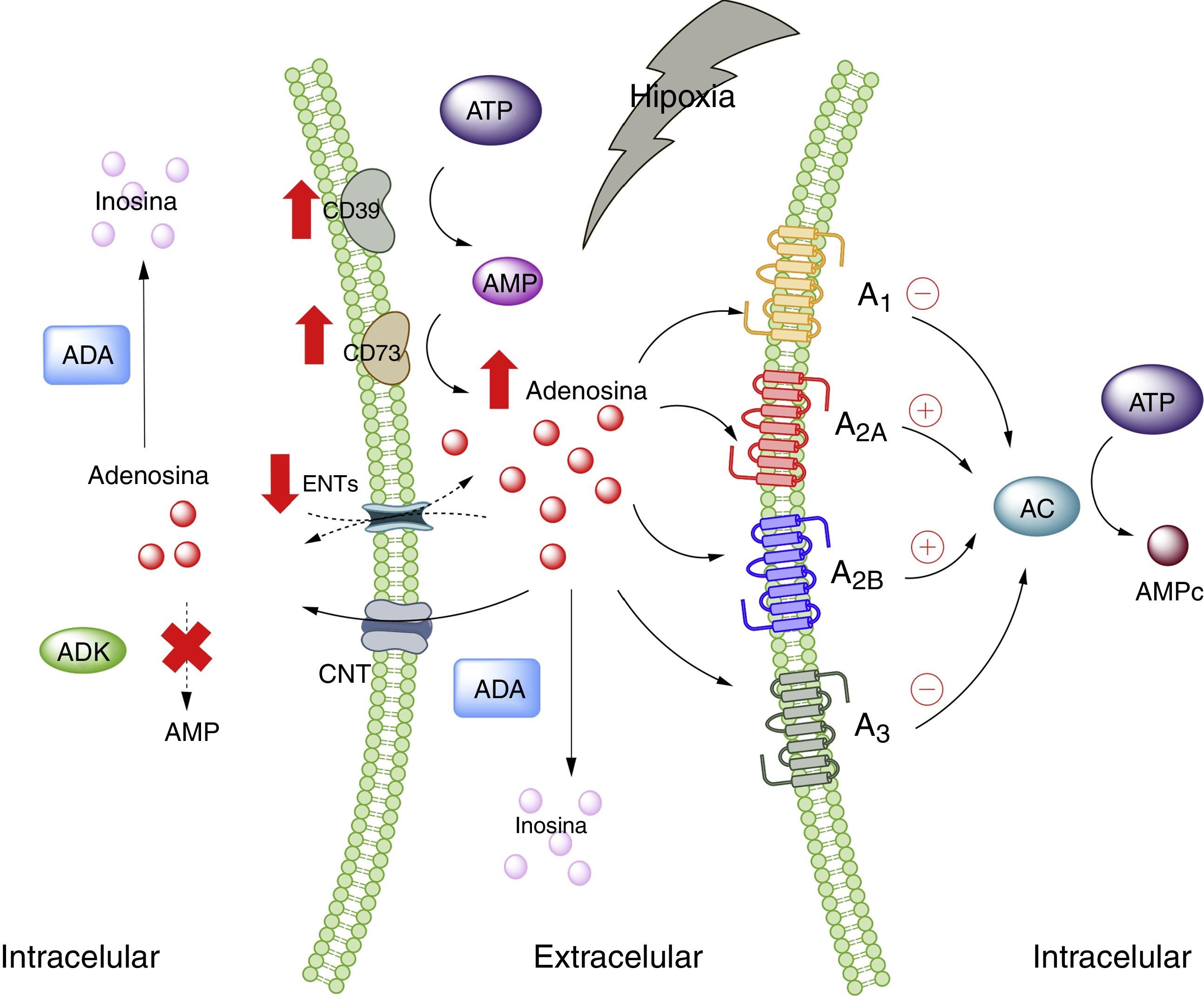
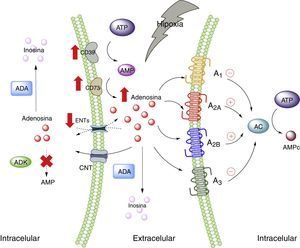
Adenosina y tejido adiposoA nivel fisiológico las concentraciones de ADO son inferiores a 1μM, las cuales, según las constantes de afinidad de los receptores de adenosina, serían capaces de activar a los receptores A1, A2A y A3; mientras que el A2B requiere concentraciones mayores a 1μM28. Sin perjuicio de aquello, es de suponerse que, en condiciones de estrés celular, tales como hipoxia, todos los receptores de ADO serían estimulados. Esto ocurre porque en hipoxia, así como en la inflamación, existe un aumento del nivel de ADO a nivel extracelular, cuya finalidad sería actuar como modulador autocrino y paracrino, iniciando mecanismos de protección del órgano frente al agente estresor5,29. Existen varias vías que explican las altas concentraciones de ADO extracelular, en donde intervienen proteínas trasportadoras de nucleósidos o enzimas encargadas de metabolizar purinas30 (fig. 1).
Adenosina y receptores de adenosina. Esquema que muestra la síntesis y degradación de adenosina. Además, resume la activación de vías metabólicas en estados de estrés celular (como hipoxia). AC: adenilciclasa; ADA: adenosindeaminasa; ADK: adenosinquinasa; AMP: adenosin monofosfato; ATP: adenosin trifosfato; CNT: transportadores de nucleósidos concentrativos; ENTs: transportadores de nucleósidos equilibrativos. Líneas continuas denota vías normales. Líneas punteadas denota vías disminuidas.
A pesar de la información disponible sobre ADO y su relación con el tejido adiposo, no se conoce en detalle el rol que cumple este nucleósido en dicho tejido, y más escasa es la información sobre los niveles plasmáticos de ADO en sujetos con obesidad. Al respecto, se ha reportado aumento en las concentraciones de ADO en tejido adiposo de adultos obesos comparados con sujetos de peso normal31. A su vez, nuestro grupo ha observado altos niveles plasmáticos de ADO en niños obesos32. Además, en ese mismo estudio mostramos que los niños con niveles altos de ADO presentaban incremento del colesterol total, triglicéridos y colesterol-LDL, en comparación a los niños con niveles indetectables de ADO. Aún más, se logró observar que el IMC se correlacionaba directamente con las concentraciones de ADO circulante. Por otro lado, estudios preliminares en mujeres embarazadas también mostraron aumento en los niveles circulantes de ADO, principalmente en aquellas con obesidad respecto a las no embarazadas o embarazadas con peso adecuado para la edad de gestación (datos no publicados). En consecuencia, estos estudios muestran que al existir obesidad se cursaría con elevadas concentraciones de ADO circulante, pero se desconocen las causas o consecuencias de este aumento.
En lo que respecta al tejido adiposo, se ha mostrado la presencia de receptores de ADO en este tejido33–35, en donde modularían la respuesta inmune, sobre todo en situaciones de estrés celular como hipoxia e isquemia como las observadas en pacientes obesos5,6 (fig. 2). En la siguiente sección analizaremos en más detalle la participación de cada uno los receptores de ADO presentes en el tejido adiposo en el proceso de lipoinflamación.
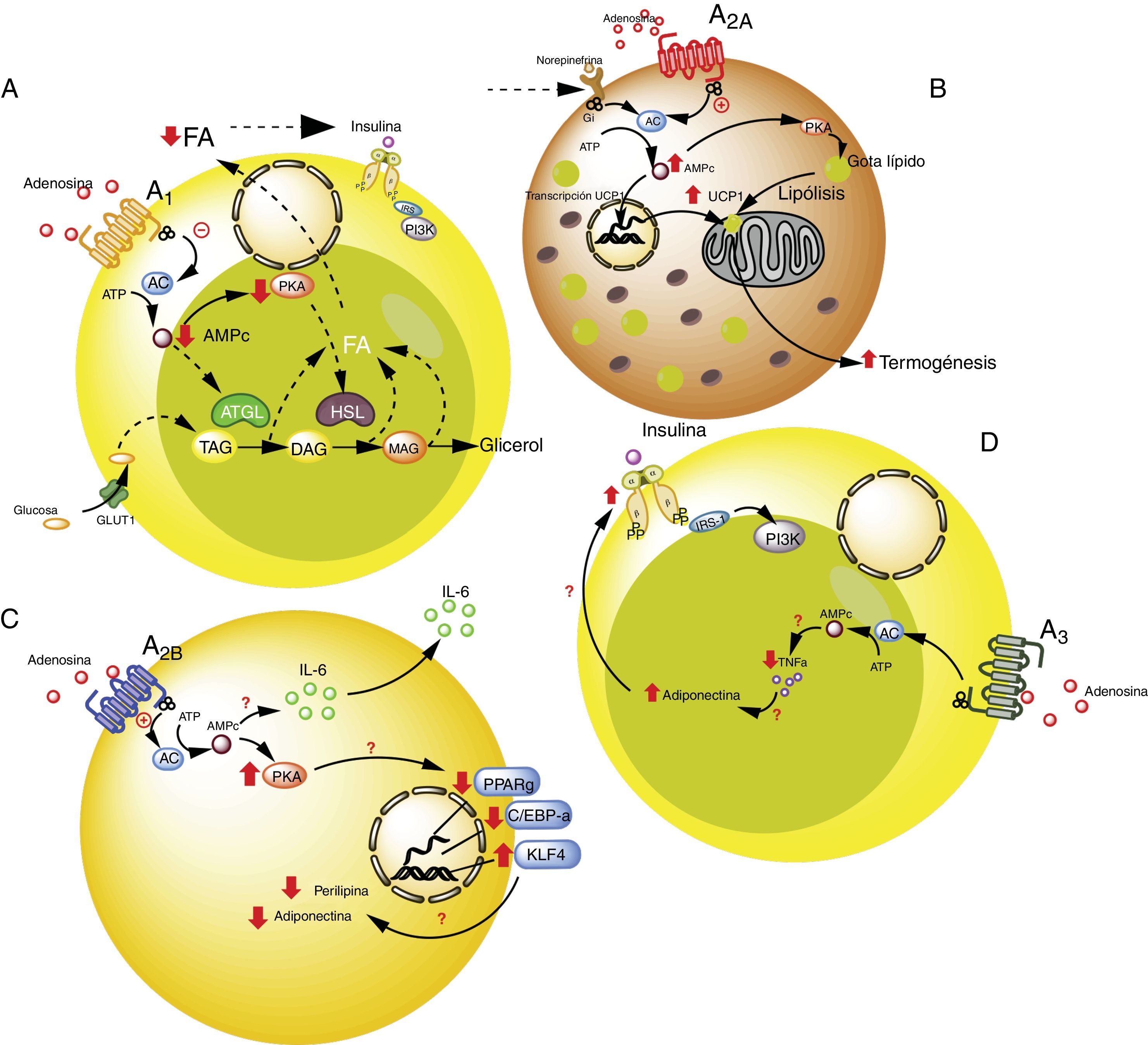
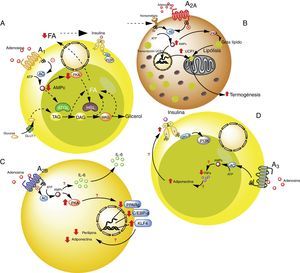
Receptores de adenosina en tejido adiposo. A). Vías de señalización intracelular asociadas al receptor A1 en el tejido adiposo blanco. En este tejido A1 inhibe la lipólisis, lo cual lleva a aumento en la sensibilidad de la insulina en el tejido adiposo y muscular. B). Vías de señalización asociadas al receptor A2A en tejido adiposo marrón. En este tejido A2A estimula la acción de UCP1 (proteína desacoplante 1) en mitocondrias promoviendo la termogénesis y con ello la homeostasis metabólica. C). El receptor A2B en preadipocitos, por un lado estaría inhibiendo la adipogénesis al disminuir adiponectina y perilipina; y por el otro, promueve la producción de IL-6 y por lo tanto de la lipoinflamación. D). Receptor A3 en tejido adiposo blanco, reduce los niveles de TNF-α lo que promueve la acción de adiponectina, estimulando adipogénesis. Para detalles recomendamos ver texto. AC: adenilciclasa; ATGL: desnutrina (adipose triglyceride lipase); C/EBP-a: facilitador de unión a proteínas (CCAAT-enhancer-binding proteins); DAG: diacilglicéridos; GLUT1: transportador de glucosa 1; HSL: lipasa sensible a hormona; KLF4: factor 4 Kruppel-like; MAG: monoacilglicéridos; PKA: proteinaquinasa A; PPARg: receptor activado por proliferadores peroxisomales; TAG: triacilglicéridos. Líneas continuas denota vías normales. Líneas punteadas denota vías disminuidas.
La activación del receptor A1 muestra un efecto antilipolítico en adipocitos, lo cual a su vez, podría modular la lipoinflamación36. Así, Dole et al.37, utilizando muestras de grasa aislada del epidídimo de ratas, demostraron que el receptor A1 inhibe la descomposición del lípido en triglicéridos y ácidos grasos libres (FFA). Estos hallazgos fueron posteriormente ratificados en modelos in vivo con ratas obesas Zucker o en ratones38–41. Además, en un modelo en ratones, se observó que tecadenoson, agonista selectivo de A1, reduce los niveles de FFA independiente de la dosis utilizada42. Así mismo, el uso de otro agonista selectivo para este receptor, conocido como GR79236, no solo fue capaz de inhibir la lipólisis, sino que también logró promover la insulinosensibilidad43.
En términos de las vías celulares involucradas en los efectos metabólicos del receptor A1, se conoce que este receptor reduce la formación de AMPc y la activación de proteína kinasa A, lo cual a su vez inhibe tanto la lipasa sensible a hormonas como la lipasa de triglicéridos presente en tejido adiposo, dos proteínas que participan activamente en la lipólisis44. Por tanto, se concluye que la activación del receptor A1 inhibe la lipólisis, reduce los niveles de FFA circulantes, favoreciendo la acumulación de estos en el tejido adiposo, promoviendo así la insulinosensibilidad en el tejido muscular y adiposo45,46. Por ello, se considera que los agonistas de A1 tienen un potencial uso en el manejo de las complicaciones metabólicas de pacientes con obesidad (ver tabla S2 del material adicional en anexo).
Receptores A2 en el adipocitoLa información disponible sobre receptores A2 en adipocito es más escasa, por lo que analizaremos el rol que podría tener A2A en termogénesis y el rol de A2B en adipogénesis, dos procesos metabólicos relevantes para el adipocito.
El receptor A2A es abundante en tejido adiposo marrón humano y de ratón, aunque es poco conocido el rol que cumple sobre dicho grupo celular. Por ejemplo, se ha visto que ratones C57BL/6 alimentados con una dieta alta en grasas y tratados con el agonista para A2A, CGS-21680, ganaron menos peso y presentaron mejor tolerancia a la glucosa respecto al grupo control47,48. Por tanto, el aumento de la actividad de este receptor podría proteger a los ratones de la obesidad inducida por una dieta alta en grasa. Los mecanismos asociados a esta protección han sido asociados a una mayor actividad de la proteína desacoplante 1 (UCP1), cuya función es promover la termogénesis mediante desarticulación de la fosforilación oxidativa47,48. Sumado a esto, en otro estudio se observó que ratones alimentados con dieta alta en grasa y que recibieron implantes de tejido adiposo beige, lograron una mejor utilización de la glucosa, lo cual fue relacionado con una mayor expresión de UCP1 en su tejido adiposo49. De esta manera, al potenciar la actividad de A2A se estimularía la actividad de UCP1 promoviendo la termogénesis y con ello la homeostasis metabólica. Debido a estos efectos, se cree que este receptor puede tener especial interés en sujetos que presenten resistencia a la insulina50.
Respecto al rol del receptor A2B en la funcionalidad de los adipocitos, se conoce muy poco. Pero, existen evidencias respecto a que este receptor inhibiría la diferenciación celular a adipocitos a partir de preadipocitos51 o células mesenquimales52–54. Particularmente, en células 7F2, una línea celular de preadipocitos, en donde se sobreexpresó el receptor A2B, se pudo observar una inhibición de la diferenciación celular hacia un fenotipo adiposo (adipogénesis)52. Igualmente se ha demostrado, en tejido adiposo de ratón y humano, que el agonista selectivo para A2B, BAY 60–6583, inhibió el proceso de diferenciación de células mesenquimales a adipocitos, asociado al aumento en la expresión del factor Krüppel 4 (KLF4) y reducción de la actividad de factores de transcripción proadipogénicos PPARγ y C/EBP-α53,54.
Por el contrario, otro aspecto importante es que en modelo animal (C57BL/6), el antagonista del receptor A2B, CVT-6883, inhibió la producción de interleuquina 6 (IL-6)55. Este efecto resulta relevante, ya que IL-6 por su parte, se asocia al fenómeno de lipoinflamación y resistencia a insulina presente en la obesidad56. En consecuencia, la información disponible sugiere que la activación de receptores A2B podría tener una participación contradictoria en la obesidad, por un lado inhibiendo la adipogénesis, pero también promoviendo el estado de lipoinflamación. Más estudios son necesarios para entender mejor estos fenómenos.
Receptores A3 en adipocitoRespecto a la participación de A3 en la fisiología del adipocito, existen evidencias indirectas que sugieren su participación en el control metabólico. Por ejemplo, en sujetos obesos hay incremento de citocinas proinflamatorias como TNF-α, cuyos niveles circulantes han demostrado ser controlados por la actividad del receptor A357. Dado que TNF-α regula a su vez la expresión de adiponectina, es de esperarse que la reducción de esta citocina proinflamatoria mediada por receptores A3, se asociaría a aumento en los niveles de adiponectina, favoreciendo de esta forma la insulinosensibilidad58–60. Aun cuando no existen reportes que aborden este proceso, creemos que al estimular la actividad del receptor A3, se puede contribuir a la reducción de los niveles de TNF-α, lo que favorecería el efecto de adiponectina sobre el adipocito promoviendo su integridad y normal funcionamiento.
Adenosina e interacción entre macrófago y adipocitoPara el desarrollo del tema es importante mencionar que se ha planteado una relación funcional entre macrófagos y adipocitos, ya que existe una correlación entre la desregulación de sus vías metabólicas y el estado inflamatorio durante la obesidad61. Ejemplo de esto es que los macrófagos y los adipocitos expresan proteínas similares, tales como proteínas transportadoras de ácidos grasos, PPARγ, y citoquinas pro- y antiinflamatorias23,62. Otro aspecto que llama la atención es que los preadipocitos pueden presentar actividad fagocitaria y realizar diferenciación celular a macrófagos61. Además, al liberar citocinas tales como TNF-α e IL-6, los macrófagos, modifican el patrón de fosforilaciones en el receptor de insulina, específicamente en IRS-1 en distintas células, incluyendo adipocitos63.
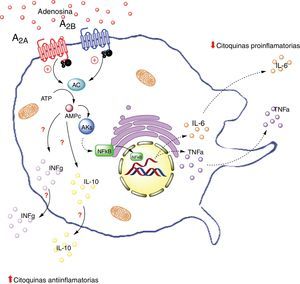
A continuación, pretenderemos explicar cuál sería el rol de la adenosina en este complejo diálogo celular entre adipocito y macrófagos. En particular se abordará esta temática desde la interacción de ADO con sus receptores A2A y A2B en los macrófagos (fig. 3).
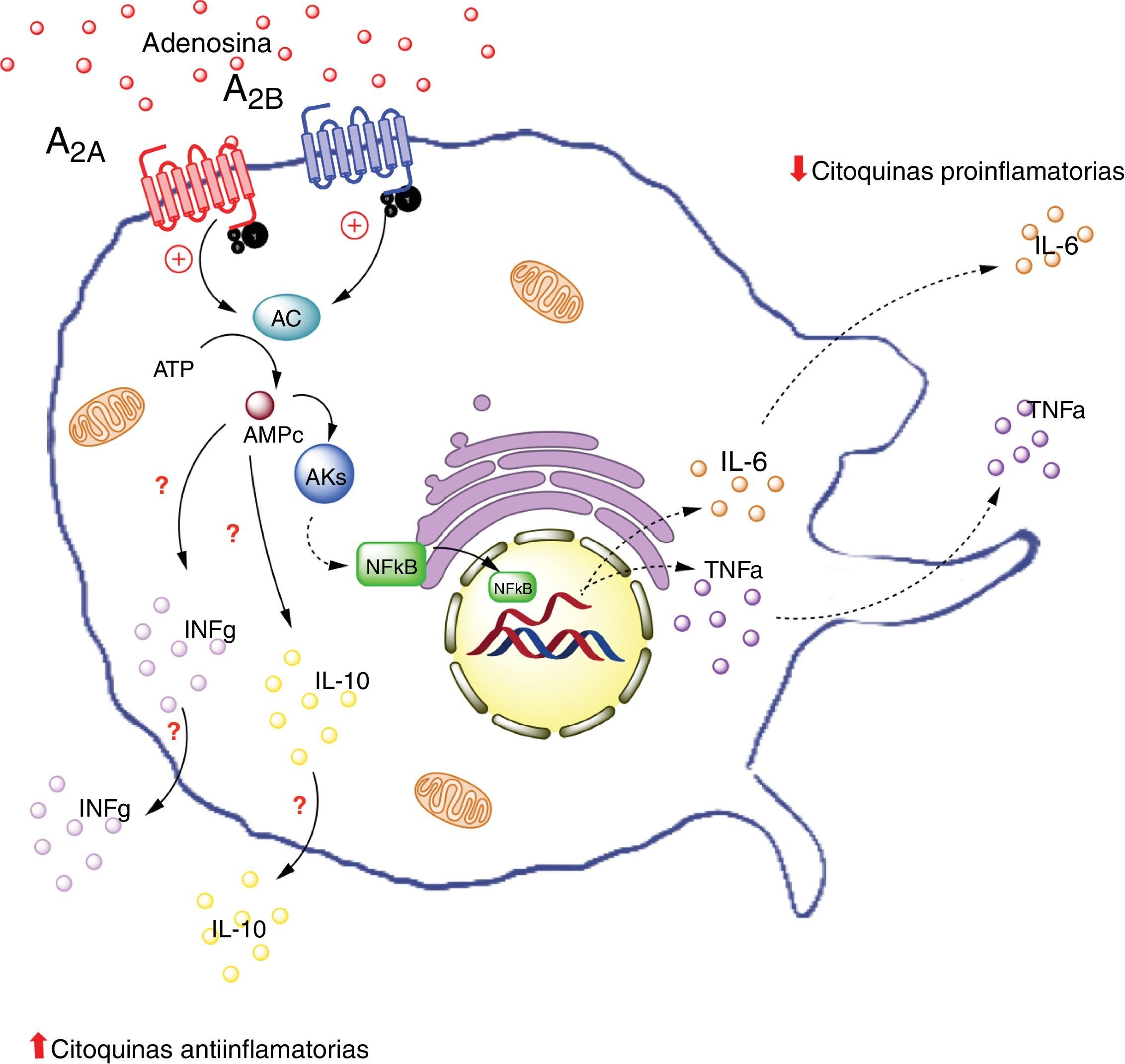
Receptores de adenosina en macrófagos. La activación de el receptor A2A en macrófagos disminuye la producción de citoquinas proinflamatorias (TNF-α), por otro lado aumenta la producción de interleuquinas antiinflamatorias (IL-10), generando un estado antiinflamatorio. La activación del receptor A2B en macrófago en cambio, promueve la producción de IL-10 e INF-γ. AC: adenilciclasa; INFg: interferón gama; NFKb: factor nuclear potenciador de las cadenas ligeras kappa de las células B activadas; PKs: proteinquinasas. Líneas continuas denota vías normales. Líneas punteadas denota vías disminuidas.
La información sobre la participación de los receptores de ADO en macrófagos del tejido adiposo es escasa. Por lo cual, nos enfocaremos en el efecto de ADO y del receptor A2A presente en macrófagos circulantes. Específicamente resaltaremos información relevante sobre la expresión y actividad de este receptor en macrófagos de tejidos tales como el pulmonar, gástrico y en modelo endotóxico en los cuales se observan beneficios relacionados con la activación de A2A.
Por ejemplo, en un estudio in vivo realizado en tejido hepático de ratones deficientes para el receptor A2A (A2AKO), se demostró una exacerbada respuesta inflamatoria sistémica secundaria a la exposición a lipopolisacáridos respecto a los ratones control64. Lo que indica la importancia de ADO extracelular y la de este receptor en particular, en la reducción de la inflamación sistémica. Además, es importante destacar que la activación del receptor A2A inhibe la producción de TNF-α en macrófagos65. Sin embargo, este no sería el único receptor que generaría este efecto inhibitorio, ya que existe evidencia sobre la modulación en la producción de TNF-α en macrófagos en ratones A2AKO66.
De manera similar, se ha visto que la activación del receptor A2A aumenta los niveles de la interleuquina antiinflamatoria IL-10 en macrófagos67. Por ejemplo, en un modelo de ratones expuestos a Escherichia coli se evidenció que los macrófagos incrementaron la expresión de IL-10 al ser expuestos al patógeno. Por el contrario, en macrófagos de ratones A2AKO no se logró este efecto68 confirmando la relevancia de A2A en el proceso antiinflamatorio.
En resumen, la activación del receptor A2A en macrófagos disminuiría la producción de citoquinas proinflamatorios (como TNF-α) y al mismo tiempo aumentaría la producción de interleuquinas antiinflamatorias (como IL-10), cuyo resultado final sería la generación de un estado antiinflamatorio. Este efecto podría ocurrir en macrófagos del tejido adiposo.
A2B en macrófagosTal vez los estudios que más datos aportan a la comprensión de la interacción entre macrófago y tejido adiposo mediado por ADO, son aquellos que tienen relación con la actividad del receptor A2B. Así, Balázs Csóka et al.7 utilizaron ratones deficientes en A2B (A2BKO) que fueron alimentados o no con una dieta rica en contenido graso. Los ratones A2BKO con dieta control aumentaron de peso en forma significativa respecto al grupo control; a diferencia de los ratones alimentados con dieta alta en grasa, cuyo peso fue comparable al ratón silvestre con la misma dieta grasa. Por ello, los investigadores decidieron evaluar al ratón A2BKO con dieta normal y compararlo con su respectivo control. En estos animales, desde el punto de vista metabólico, se evidenció que los niveles de glucosa en sangre fueron mayores en el ratón A2BKO, así como un menor valor del índice de consumo metabólico muscular (soleo, vasto, gastrocnemio), sugiriendo una menor afinidad a la insulina en estos animales. En relación al metabolismo lipídico, los ratones A2BKO presentaban niveles significativamente más altos de colesterol total, lipoproteínas de baja densidad y triglicéridos. Para dar respuesta al fenómeno antes descrito, los investigadores muestran que los ratones A2BKO presentan un perfil característico de sujetos inflamados (incluyendo aumento de la concentración de IL-6 y TNF-α), además de una disminución de concentración de IL-10 e interferón gamma (IFγ) en tejido graso del epidídimo7. Basado en estos resultados, se concluye que los ratones A2BKO sometidos a dieta alta en grasa por un periodo determinado, presentaron alteración en la sensibilidad a la insulina, que trae consigo un mal control metabólico de glucosa y grasas.
En el mismo estudio de Balázs Csóka et al., se analizó la participación de los macrófagos del tejido adiposo en los fenómenos metabólicos encontrados en el ratón A2BKO. Así, se observó que los ratones A2BKO presentaron una mayor acumulación de macrófagos tipo F4/80+, asociado a una elevación de los niveles de interleucinas proinflamatorias (CCL2, TNF-α, IL-6), pero bajos niveles de antiinflamatorias (IL-10 e INF-γ) en tejido graso del epidídimo. Estos resultados, confirman la participación de A2B en el reclutamiento de macrófagos y su rol antiinflamatorio en el tejido graso. Este estudio orienta en cómo ADO vía activación de A2B, podría ser un factor clave en la capacidad de regular el metabolismo mediante el mantenimiento de la homeostasia inflamatoria7.
Para profundizar en la idea de que ADO y su interacción con el receptor A2B presente en macrófagos del tejido adiposo sería una de las vías que regula el metabolismo de la glucosa y las grasas, Johnston-Coxl et al.69 realizaron un ensayo con ratones transgénicos (CD68-Tg) con el receptor A2B recuperado en macrófagos de ratones A2BKO. Para el experimento se utilizaron tres grupos, ratones control, A2BKO y CD68-Tg que fueron sometidos a una dieta alta en grasa durante 16 semanas. Al término de este periodo el porcentaje de grasa corporal fue mayor en el grupo de ratones A2BKO respecto a los otros dos grupos en estudio. Estos resultados, aparentemente difieren a los reportados por Csoka et al.7, quienes no mostraron cambios significativos en el peso de los animales A2BKO alimentados con dieta alta en grasa, respecto a los animales silvestres alimentados con la misma dieta. Sin embargo, varias diferencias metodológicas podrían explicar este hallazgo. Por ejemplo, estos estudios7,69 utilizan distintas dietas, así como distintos tiempos de suplementación y origen de las cepas de animales, entre otras causas. Además, interesante para la discusión en el estudio de Coxl69, se reporta la grasa acumulada y no únicamente el peso del animal como lo hace el otro estudio7.
Además, dentro de otros resultados obtenidos por Coxl et al.69, es interesante resaltar que a diferencia de los ratones CD68-Tg o control, los ratones A2BKO mostraron aumento de la glucemia en ayunas, menor aclaramiento de glucosa y aumento en la curva de insulina a las 2 h. En relación al metabolismo lipídico, la recuperación de la expresión de A2B en macrófagos evidenciada en el grupo de ratones CD68-Tg impidió la elevación de los niveles de colesterol y triglicéridos plasmáticos o hepáticos observado en ratones A2BKO. Desde el punto de vista inflamatorio los ratones A2BKO mostraron altos niveles de TNF-α e IL-6 en hígado, lo cual no fue observado en ratones CD68-Tg o ratones control. Finalmente, se analizó la expresión hepática del sustrato 2 del receptor de insulina (IRS-2), encontrándose que los niveles de esta proteína eran significativamente menores en ratones A2BKO respecto a los otros dos grupos analizados69. En conjunto, en este estudio se muestra claramente la protección tisular que trae consigo la activación de A2B en macrófagos, revelando que la sola presencia del receptor A2B sería suficiente para recuperar las complicaciones de lipoinflamación y metabólicas evidenciadas en la obesidad.
Conclusiones y direcciones futurasEn la obesidad subyace un proceso inflamatorio generado por adipocitos y macrófagos. Los mecanismos para que se establezca el diálogo potenciador del proceso inflamatorio entre estas dos células durante la obesidad son un área de investigación muy activa, debido a las implicancias farmacológicas y de prevención que tendrían en el marco del aumento epidémico de la obesidad en el mundo. En la presente revisión nos hemos enfocado en analizar como ADO, un nucleósido endógeno, es una molécula capaz de modular el diálogo entre adipocitos y macrófagos.
En el caso de los adipocitos, son capaces de sintetizar proteínas (tales como citoquinas proinflamatorias) que incrementan el estado de resistencia a insulina en un individuo con obesidad. Por lo tanto, estas células, y el tejido adiposo en general dejaron de ser considerados como tejidos pasivos de almacenaje, y muy por el contrario es considerado como un tejido endocrino. En el caso concreto de la obesidad, se genera un estado de lipoinflamación, caracterizado por el aumento de la expresión y liberación de citoquinas proinflamatorias, que generan un estado crónico, subclínico de inflamación sistémica. Si bien, es claro que el adipocito participa en la producción de estas citoquinas, no es menos cierto que los macrófagos presentes en el tejido adiposo también participan activamente.
En el caso de los macrófagos, estas células forman una extensa y compleja familia, con múltiples funciones en la regulación de la inflamación y la defensa del organismo ante agentes nocivos exógenos. En forma simple, a nivel del tejido adiposo, se ha caracterizado que existe un aumento en el número y función de macrófagos del fenotipo M1 o tipo proinflamatorios. Los cuales provendrían al menos de dos orígenes: el primero de una diferenciación desde los preadipocitos y otra (más estudiada) desde los macrófagos circulantes. En sintonía con estos hallazgos, en modelos en ratón con obesidad se ha visto una acumulación de macrófagos F4/80 con actividad proinflamatoria en el tejido graso. Sin embargo, considerando la complejidad de las funciones y fenotipos de macrófagos, esta visión es muy simplificada. Es necesario profundizar el estudio de estas células en el tejido graso.
Uno de los focos principales de esta revisión fue el resaltar la participación de ADO en la regulación de la función inflamatoria y metabólica. La participación de esta molécula y de sus receptores en la función de adipocitos o macrófagos, o de la interacción entre estas dos células durante la obesidad es limitada o parcializada. Por ejemplo, se ha dicho que este nucleósido, al activar los receptores A1 y A2A, presentes en adipocitos, podrían participar en la homeostasis insulínica mediante la disminución de los FFA. Así, A1 podría promover el uso de FFA como sustrato energético, lo cual a su vez reduciría los niveles circulantes de FFA, promoviendo la insulinosensibilidad. En el caso del receptor A2A se conoce que está presente en todos los tipos de grasa (blanca, parda y beige). La evidencia más robusta indica que el receptor A2A presente en tejido beige sería necesario para el control de la temperatura en modelos animales. Por otro lado, la actividad del receptor A2B estaría asociado a los procesos de adipogénesis o la diferenciación de preadipocitos a adipocitos, con la consecuente capacidad de acumulación de grasa. El A3 en los mismos adipocitos, intervendría en la insulinosensibilidad principalmente inhibiendo IL-6 y TNF-α, citocinas proinflamatorias que interfieren en el metabolismo de la insulina. Pese a la relevancia de las conclusiones que entregan los estudios analizados, también es necesario resaltar que resultaría una sobresimplificación el considerar que estas células y ADO, únicamente participarían en los fenómenos enunciados.
Si la regulación de la función de los adipocitos por ADO sería compleja, es de esperarse que sea aún más, cuando se analiza la participación de esta molécula en macrófagos de tejido graso. En contraposición a esta hipótesis, la información encontrada al respecto es escasa. En concreto, los receptores A2A circulantes (falta información a nivel de tejido adiposo), cumplen un rol antiinflamatorio, como ha sido demostrado en múltiples estudios in vitro e in vivo. En virtud de esa evidencia, es fácil especular que este receptor estaría jugando algún rol protector durante la lipoinflamación, pero aún no hay evidencia al respecto.
Este rol antiinflamatorio de A2A, se vería reforzado por los receptores A2B. En particular, el efecto del receptor A2B ha mostrado ser altamente significativo en la regulación a la baja de la lipoinflamación, reduciendo la expresión de citoquinas proinflamatorias (como TNF-α e IL-6) y promoviendo la producción de antiinflamatorios (como Il-4, IL-10, IF-γ). Es más, la presencia de A2B en macrófagos de animales A2BKO, se tradujo en mejora de la lipoinflamación, sensibilidad insulínica, y mejora metabólica de los animales expuestos a dieta alta en grasa. Debido a lo anterior, se puede indicar que el receptor A2B, podría convertirse en un nuevo blanco terapéutico en el manejo de las complicaciones inflamatorias y metabólicas de la obesidad.
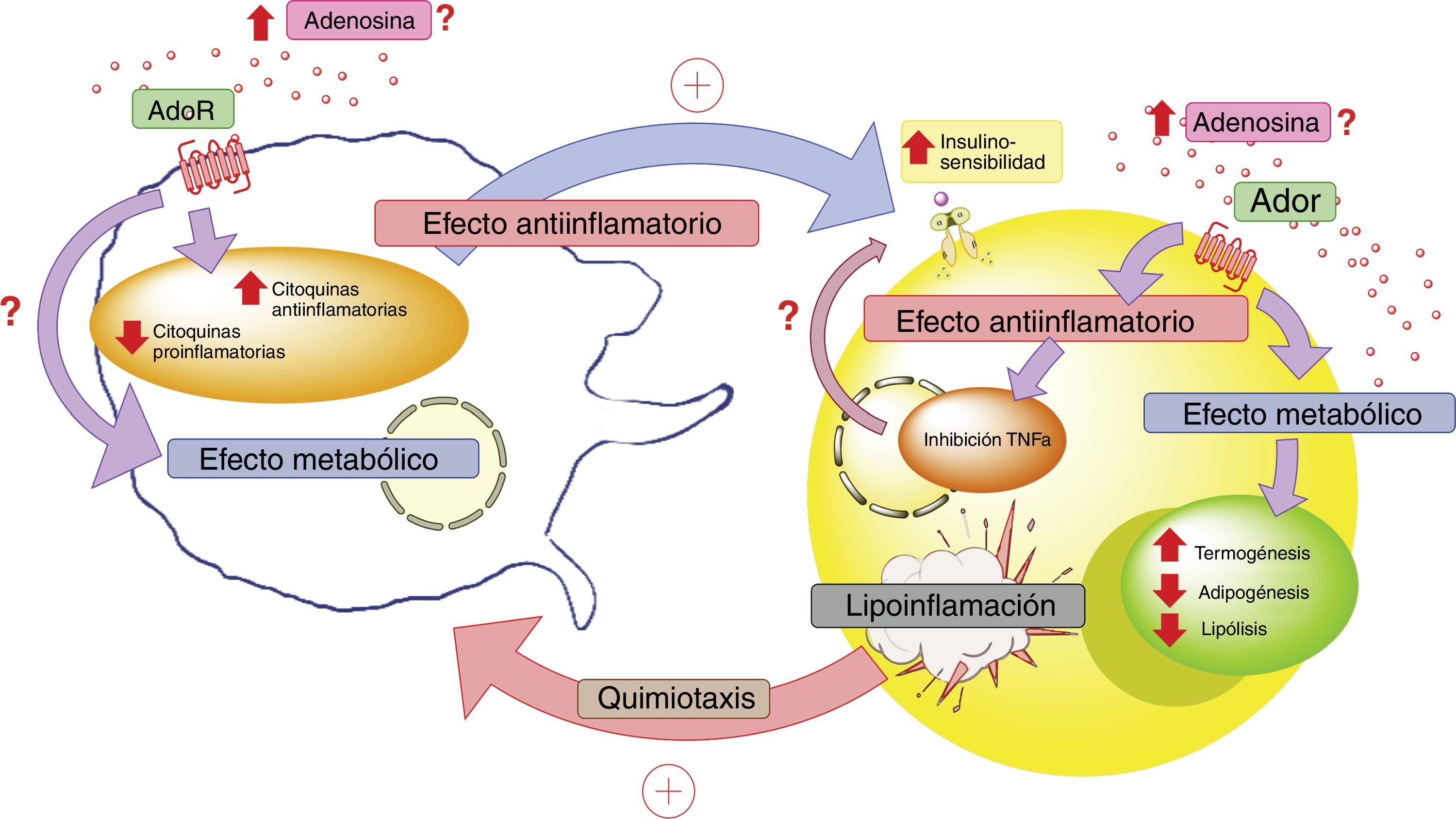
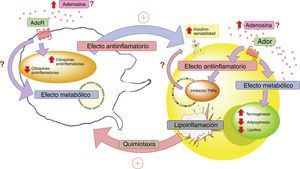
En conclusión, es necesario profundizar el conocimiento sobre el rol que cumple ADO y sus receptores en el diálogo celular que ocurre entre adipocitos y macrófagos en el tejido adiposo. Esto cobra relevancia, ya que estos elementos estarían jugando un rol principal en el proceso de lipoinflamación y en las alteraciones metabólicas presentes en individuos con obesidad (fig. 4).
Adenosina e interacción entre adipocito y macrófago. En estados patológicos como la lipoinflamación se desencadenaría una hipoxia a nivel del mismo tejido adiposo, lo que llevaría a un aumento de los niveles circulantes de adenosina; así como también, a la producción de factores quimiotácticos para macrófagos por parte de este tejido. El aumento de adenosina activaría receptores de membrana (AdoR) asociados a proteína G, los cuáles disminuirían la producción de citoquinas proinflamatorias y estimularían la producción de citoquinas antiinflamatorias tanto en el adipocito como en los macrófagos. Estas últimas citoquinas favorecerían el actuar de los receptores de insulina en el tejido adiposo, aumentando su sensibilidad y favoreciendo la respuesta metabólica del mismo. En este contexto, la activación de los receptores de adenosina en el tejido adiposo tendría un efecto metabólico aumentando la termogénesis y disminuyendo la adipogénesis y lipólisis. Lo cual se complementaría con el rol antiinflamatorio de los receptores de adenosina. Todo esto para generar un estado compensatorio que tendería a mejorar el estado metabólico y de lipoinflamación del individuo con obesidad. AdoR: receptores de adenosina.
Los autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a los integrantes del Laboratorio de Fisiología Vascular y Grupo de Investigación en Angiogénesis Tumoral (GIANT) por la discusión y análisis al trabajo presentado. Además, se agradece al Grupo de Estudio en Nutrición Aplicada en Obesidad de la Universidad del Bio Bio por su continuo apoyo para la realización de investigación. Este trabajo fue financiado por los proyectos Fondecyt Regular 1140586, Fondequip EQM140104, DIUBB GI153109/EF y GI 152920/EF.