Las determinaciones microbiológicas de la carga viral de los virus de la inmunodeficiencia humana tipo 1 (VIH-1), de la hepatitis C (VHC) y de la hepatitis B (VHB) son fundamentales para el seguimiento y control de los pacientes infectados por estos virus. Los laboratorios de microbiología disponen de herramientas que garantizan la fiabilidad de sus resultados, entre ellas se encuentran los programas de intercomparación externos, como es el Programa de Control de Calidad de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC). En el presente número se muestra el análisis de resultados del Programa de Control de Calidad SEIMC de carga viral de estos virus, incluyendo el genotipado del VHC, realizado durante el año 2017.
Métodos y resultadosEn el control de VIH-1 se remitieron 5 estándares, de los que uno (plasma humano seronegativo) no contenía el virus, y los otros 4 consistían en plasma de 3 pacientes virémicos distintos en un intervalo de concentraciones entre 2-5 log10 copias/ml. Una parte significativa de los laboratorios obtuvo de uno a varios resultados fuera de los límites aceptables (media±0,25 log10 copias/ml), dependiendo del estándar y del método empleado, en promedio el 35% de los centros. La repetibilidad fue buena, y más del 94% de los laboratorios obtuvieron resultados aceptables (D<0,5 log10 copias/ml). En los controles de VHC y VHB se remitieron 2 estándares con diferente contenido del virus. La mayor parte de los participantes, un 82% en el caso del VHC y un 87% en el del VHB, obtuvo ambos resultados dentro de los límites de la media±1,96 DE log10 UI/ml.
ConclusionesLos resultados obtenidos ponen de manifiesto la utilidad de los controles externos para asegurar la calidad de los resultados analíticos. Debido a la variabilidad interlaboratorio observada, es aconsejable utilizar el mismo método y laboratorio en el seguimiento de los pacientes.
Human immunodeficiency virus type 1 (HIV-1) and hepatitis B (HBV) and C virus (HCV) viral load determinations are among the most relevant markers for the follow-up of patients infected with these viruses. External quality control tools are crucial to ensure the accuracy of the results obtained by microbiology laboratories. This article summarised the results obtained from the 2017 SEIMC External Quality Control Programme for HIV-1, HCV, and HBV viral loads and HCV genotyping.
Methods and resultsIn the HIV-1 programme, a total of five standards were sent. One standard consisted of seronegative human plasma, while the remaining four contained plasma from three different viremic patients, in the range of 2-5 log10 copies/mL; two of these standards were identical, with the aim of determining repeatability. A significant proportion of the laboratories (35% on average) obtained values outside the accepted range (mean±0.25 log10 copies/mL), depending on the standard and on the method used for quantification. Repeatability was good, with up to 94% of laboratories reporting results within the limits (D<0.5 log10 copies/mL). The HBV and HCV programme consisted of two standards with different viral load contents. Most of the participants, 82% in the case of HCV and 87% in that of HBV, obtained all the results within the accepted range (mean±1.96 SD log10 UI/mL).
ConclusionsData from this analysis reinforce the utility of proficiency programmes to ensure the quality of the results obtained by a particular laboratory. Due to the marked interlaboratory variability observed, it is advisable to use the same method and laboratory for patient follow-up.
La determinación de carga viral del virus de la inmunodeficiencia humana tipo 1 (VIH-1), del virus de la hepatitis B (VHB) y del virus de la hepatitis C (VHC) constituye una de las funciones primordiales del laboratorio de microbiología molecular. Para ello, los laboratorios suelen emplear sistemas comerciales, pero su eficacia diagnóstica es difícil de evaluar con la sola experiencia de cada centro. El Programa de Control de Calidad de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) dispone de controles externos de carga viral de los virus VIH-1, VHC y VHB. Estos son de participación anónima y voluntaria, y están a disposición de los profesionales que desarrollan su actividad en el laboratorio e, indirectamente, a los clínicos que atienden a los pacientes infectados por esos virus. Además, el control de carga viral del VHC incluye la realización de su genotipado.
En este artículo se resumen las principales conclusiones y enseñanzas derivadas del análisis conjunto de los resultados remitidos por los participantes en la edición del año 2017.
2Control de calidad del VIH-12.1Características del material remitidoEn la ronda correspondiente al año 2017 se remitió a los participantes 5 estándares de plasma congelado denominados VIH-1/17, VIH-2/17, VIH-3/17, VIH-4/17 y VIH-5/17. Estos se habían analizado y valorado para el contenido en ARN del VIH-1. Cuatro de ellos contenían cantidades conocidas de ARN y se obtuvieron de plasma procedente de distintos pacientes virémicos (VIH-1/17 a VIH-4/17), buscando contenidos teóricos dentro de un intervalo de 2 a 5 unidades logarítmicas. Los estándares VIH-3/17 y VIH-4/17 eran idénticos y, además, estaban destinados a analizar la repetibilidad de los resultados intralaboratorio (repetitividad de resultados en un mismo momento y bajo las mismas condiciones). El estándar VIH-5/17 se preparó con plasma de un paciente seronegativo. Las muestras se analizaron antes de que se emplearan en 2 laboratorios de referencia diferentes, y se confirmaron los valores teóricos.
Una vez preparados los estándares, se mantuvieron congelados a –80°C hasta su envío a los participantes, que se realizó con nieve carbónica y las entregas se aseguraron en menos de 24h.
2.2Criterios de evaluaciónPara demostrar la especificidad de las determinaciones se contaba con el estándar VIH-5/17 como control negativo (plasma seronegativo). En este caso, se consideraron válidos los resultados que se informaron por debajo del límite de detección de la técnica utilizada, por lo que cualquier cuantificación se correspondería con un resultado falso positivo. En todos los casos, se eliminaron los valores extremos y aberrantes para el cálculo de la media1. El criterio de aceptación se fijó en la media de resultados informados en cada estándar mediante cada uno de los métodos±0,25 log102–8. Para los estándares VIH-3/17 y VIH-4/17 (plasmas idénticos), se tomó como medida central la media de los valores obtenidos en ambos por todos los participantes que utilizaban un mismo método, además, también se emplearon para evaluar la repetibilidad de los resultados. En este caso se calculó el diferencial (D) entre ambos valores expresados en unidades logarítmicas. Se consideró aceptable cuando D<0,5 log10 copias/ml, valor que tiene en cuenta tanto la variabilidad técnica2–8 como la biológica y que, en la práctica, es el que se utiliza en el seguimiento de los pacientes para considerar que se ha producido un cambio significativo de la carga viral con fines pronósticos, o para el control de la eficacia del tratamiento.
2.3Resultados del control del VIH-1Se envió el material de control a 103 participantes, de los que 98 remitieron respuesta (95,1%). El método más empleado fue la reacción en cadena de la polimerasa a tiempo real (PCR-RT) de Roche (79,6%), seguido por la PCR-RT de Abbott (8,2%), la kPCR de Siemens (5,1%), la PCR-RT Veris de Beckman Coulter (4,1%) y el resto de participantes (3,1%) informaron otras técnicas distintas (PCR-RT GenXpert de Cepheid, PCR-RT in house y PCR-RT de Qiagen). Todos los participantes emplearon técnicas de PCR-RT.
En la tabla 1 se resumen los resultados obtenidos con los 4 métodos comerciales más empleados. Desde el punto de vista de la especificidad, los resultados fueron buenos, aunque un centro informó un valor cuantificable para el estándar negativo (VIH-5/17), este por posible error de trascripción de los resultados en la página web o por error de etiquetado de las muestras, ya que en su lugar se informó otro de los estándares como negativo. En cuanto a la variabilidad de los resultados, la mayor parte de los que se encuentran fuera del intervalo de aceptación se correspondieron con el estándar VIH-4/17. Asimismo, de la tabla 1 se puede deducir la existencia de una variabilidad intermétodo, que se confirma cuando se analizan los resultados individuales de los participantes (no se muestran), de modo que los valores obtenidos con el mismo estándar utilizando 2 métodos distintos no son siempre comparables. Estos resultados, en su conjunto, son similares a los obtenidos en el Programa de Control de Calidad SEIMC de otros años3–8.
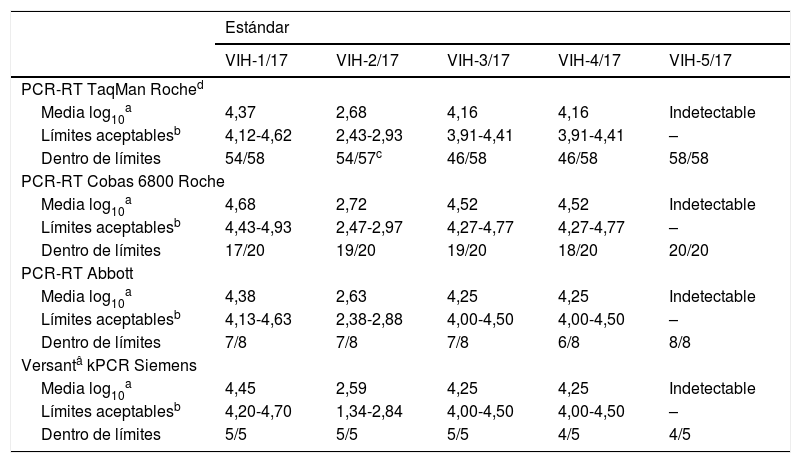
del virus de la inmunodeficiencia humana 1 (VIH-1): análisis de los resultados dentro de límites según el método comercial utilizado
| Estándar | |||||
|---|---|---|---|---|---|
| VIH-1/17 | VIH-2/17 | VIH-3/17 | VIH-4/17 | VIH-5/17 | |
| PCR-RT TaqMan Roched | |||||
| Media log10a | 4,37 | 2,68 | 4,16 | 4,16 | Indetectable |
| Límites aceptablesb | 4,12-4,62 | 2,43-2,93 | 3,91-4,41 | 3,91-4,41 | – |
| Dentro de límites | 54/58 | 54/57c | 46/58 | 46/58 | 58/58 |
| PCR-RT Cobas 6800 Roche | |||||
| Media log10a | 4,68 | 2,72 | 4,52 | 4,52 | Indetectable |
| Límites aceptablesb | 4,43-4,93 | 2,47-2,97 | 4,27-4,77 | 4,27-4,77 | – |
| Dentro de límites | 17/20 | 19/20 | 19/20 | 18/20 | 20/20 |
| PCR-RT Abbott | |||||
| Media log10a | 4,38 | 2,63 | 4,25 | 4,25 | Indetectable |
| Límites aceptablesb | 4,13-4,63 | 2,38-2,88 | 4,00-4,50 | 4,00-4,50 | – |
| Dentro de límites | 7/8 | 7/8 | 7/8 | 6/8 | 8/8 |
| Versantâ kPCR Siemens | |||||
| Media log10a | 4,45 | 2,59 | 4,25 | 4,25 | Indetectable |
| Límites aceptablesb | 4,20-4,70 | 1,34-2,84 | 4,00-4,50 | 4,00-4,50 | – |
| Dentro de límites | 5/5 | 5/5 | 5/5 | 4/5 | 4/5 |
PCR-RT: reacción en cadena de la polimerasa en tiempo real.
En cuanto a los métodos de PCR-RT, los comercializados por Roche se desglosan en 2 grupos, por un lado, los que emplean la plataforma Cobas 6800 (n=20) y, por otro, el resto de equipos y reactivos Taqman Roche (n=58). Con la plataforma Cobas 6800 se obtiene un 7% de resultados fuera del límite de aceptación, con el resto de reactivos y equipos Taqman (Roche), el 11%, con los de Abbott el 12,5% y con Siemens un 8%; si bien hay que tomar estos 2 últimos datos con mucha cautela, pues el número de participantes que utilizaron estos métodos es muy bajo (de 8 a 5, dependiendo de la técnica).
Hubo un centro que intercambió los valores de 2 de los estándares, por lo que acabó informado un resultado falso positivo y otro falso negativo, y otros 2 participantes informaron un resultado falsamente negativo. Respecto a los resultados por estándares, el 8,8% de los resultados del VIH-1/17 se encontraba fuera del intervalo de aceptación, el 5,5% del VIH-2/17, el 15,4% del VIH-3/17, el 18,7% del VIH-4/17 y el 1,1% del VIH-5/17.
En cuanto a los resultados del estudio de repetibilidad, la mayoría de los centros lo superaron sin problema (n=92; 94,8%) y obtuvieron resultados reproducibles (D<0,5 log10).
2.4Comentarios y conclusiones al control del VIH-1En términos generales, los resultados aquí presentados dan una idea de la variabilidad que se puede obtener en el laboratorio en la práctica diaria y con una prueba de importante trascendencia como es la carga viral del VIH-1. Cuando se observa la variabilidad intermétodo (incluso eliminando los resultados extremos y aberrantes), esta se aproxima, y en ocasiones supera, a las 0,5 unidades logarítmicas, que es el valor límite que se usa en clínica para establecer un cambio significativo de carga viral, lo que refuerza la conveniencia de no cambiar de laboratorio en el seguimiento habitual de los pacientes.
Es importante señalar que el método más usado por los participantes es la PCR-RT comercializada por Roche. El número de participantes que emplea la plataforma de PCR-RT Cobas 6800 (Roche) es suficiente para poder extraer conclusiones de forma independiente. Debido a un mayor empleo de los equipos y reactivos de Roche, los datos analizados tienen una mayor significación estadística respecto al resto de técnicas empleadas.
El porcentaje de valores que se sitúa fuera del intervalo de aceptación de±0,25 log10 copias/ml alrededor de la media para cada técnica fue especialmente alto en los estándares VIH-3/17 y VIH-4/17 (plasmas idénticos), que aproximadamente fue del 17%.
Cuando se analiza la especificidad, los datos son buenos, ya que el centro que informó un resultado falsamente positivo se relacionó con un error de tipo pre o postanalítico, y no con el método analítico empleado.
Como es habitual en este tipo de control, se introdujeron 2 muestras idénticas para evaluar la repetibilidad de los resultados de un determinado laboratorio. Los datos obtenidos son buenos, ya que el 95% superó la prueba.
A modo de resumen, estos resultados pueden considerarse aceptables y coherentes con lo esperado, aunque se detectan desviaciones que muestran la posibilidad de obtener resultados erróneos en cualquier laboratorio. De ahí la necesidad de introducir en la sistemática de trabajo de los laboratorios acciones de control interno y externo que minimicen la aparición de dichos errores; entre ellas, la participación en ejercicios de intercomparación externos2–11 como los representados por el Programa de Control de Calidad Externo SEIMC.
3Control de calidad del VHC3.1Características del material remitidoEn el control de carga viral de VHC se remitieron 2 estándares de plasma congelado (VHC-1/17 y VHC-2/17) obtenidos de 2 pacientes virémicos para el VHC para buscar unos contenidos aproximados en UI/ml preestablecidos. Una vez realizadas las alícuotas, se conservaron congeladas a una temperatura de –80°C hasta el momento de su envío, que se hizo en nieve carbónica y con entregas inferiores a las 24h. Ambos estándares, previamente a su envío, se habían analizado por 2 laboratorios expertos diferentes, que confirmaron los valores teóricos aproximados. También se solicitó la realización del genotipado del VHC en el estándar VHC-1/17 a todos los participantes que dispusieran de dicha técnica en su cartera de servicios. En esta ocasión, el valor asignado de esta última determinación fue genotipo 1b, y se obtuvo mediante PCR-RT de Abbott. De este modo se consideraron respuestas válidas todas las coincidentes con el genotipo 1b.
3.2Criterios de evaluaciónLos 2 estándares se analizaron de forma cuantitativa (log10 UI/ml) comparando los resultados individuales obtenidos por cada participante respecto al intervalo de confianza (IC) del 95% (media±1,96 DE —desviación estándar—) de todos los que utilizaron su mismo método comercial12,13. Al igual que con el control del VIH-1, para el cálculo de la media y de la DE se excluyeron los valores extremos y aberrantes1.
3.3Resultados del control del VHCEn este control se remitieron muestras a 103 laboratorios, de los que respondieron 100, por lo que el porcentaje de participación en la determinación de la carga viral fue del 97,1%. De ellos, 80 realizaron también el genotipado del VHC, lo que supuso el 80% del total de participantes que contestaron al control.
La técnica utilizada mayoritariamente para la realización de la carga viral fue la amplificación por PCR-RT, especialmente con el sistema comercial TaqmanÒ de Roche, siendo 21 los centros que emplean la plataforma Cobas 6800 (21%) y 57 (57%) el resto de equipos y reactivos Taqman Roche. Once participantes (11%) utilizaron la PCR-RT de Abbott, 4 la PCR-RT Veris de Beckman Coulter (4%), 3 la k-PCR Versant de Siemens (3%), 2 la PCR-RT de Qiagen Diagnostics (2%), 1 una PCR-RT de desarrollo propio y otro la PCR-RT geneXpert de Cepheid (1%).
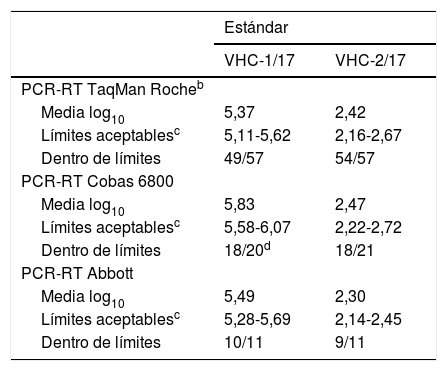
La tabla 2 resume los datos para el total de participantes. La variabilidad fue similar en términos de desviación respecto a la media en ambos estándares (VHC-1/17 y VHC-2/17). Cuando se comparan todos los resultados informados independientemente de la técnica empleada, el 90% se encuentra dentro del intervalo de aceptación. De forma general, y una vez eliminados los valores aberrantes, los resultados obtenidos se consideraron buenos, aunque se informaron 2 resultados falsamente negativos con el estándar de baja carga (VHC-2/17).
La tabla 3 resume los resultados comparados de cada una de las técnicas con la media de los que usan su mismo método; no se muestran los resultados de las técnicas empleadas por un bajo número de participantes, ya que estos deben tomarse con prudencia. En general, los valores obtenidos quedaban comprendidos dentro del margen aceptable (IC del 95% de la media de los participantes por cada técnica), y destacar que, debido a que la técnica de PCR-RT Taqman® Roche fue la que se utilizó mayoritariamente, las conclusiones que de ella se derivan son las más consistentes. Con los equipos de Roche (excluyendo la plataforma Cobas 6800) se obtuvieron 114 resultados, de ellos 11 (9,6%) quedaron fuera del intervalo de aceptación (8 se corresponden con el estándar VHC-1/17 y 3 con el VHC-2/17). Solo un centro presentó ambos estándares fuera de los límites de aceptación. Cabe destacar que, en la gran mayoría de las ocasiones, se obtienen resultados dentro del intervalo aceptable.
Control del virus de la hepatitis C (VHC): análisis de los resultados dentro de límites según el método comercial utilizadoa
| Estándar | ||
|---|---|---|
| VHC-1/17 | VHC-2/17 | |
| PCR-RT TaqMan Rocheb | ||
| Media log10 | 5,37 | 2,42 |
| Límites aceptablesc | 5,11-5,62 | 2,16-2,67 |
| Dentro de límites | 49/57 | 54/57 |
| PCR-RT Cobas 6800 | ||
| Media log10 | 5,83 | 2,47 |
| Límites aceptablesc | 5,58-6,07 | 2,22-2,72 |
| Dentro de límites | 18/20d | 18/21 |
| PCR-RT Abbott | ||
| Media log10 | 5,49 | 2,30 |
| Límites aceptablesc | 5,28-5,69 | 2,14-2,45 |
| Dentro de límites | 10/11 | 9/11 |
PCR-RT: reacción en cadena de la polimerasa en tiempo real.
Respecto a la plataforma de PCR-RT Cobas 6800, empleada por 21 centros, destacar que 5 de 41 de los valores informados se encontraban fuera del intervalo de aceptación (12,2%), de ellos 2 se correspondían con el estándar VHC-1/17 y los 3 restantes con el VHC-2/17. Un único centro presentó ambos estándares fuera de intervalo de aceptación.
En cuanto al sistema PCR-RT de Abbott, de los 22 valores informados 3 estaban fuera del intervalo de aceptación, lo que supuso que el 86,4% del total de valores informados para ambos estándares se situaran dentro de dicho intervalo. Por lo que respecta a los resultados que quedaron fuera del intervalo, uno se correspondía al estándar VHC-1/17 y 2 al VHC-2/17 (estándar de menor carga).
No se comentan los datos del resto de métodos que se emplearon porque los usaron muy pocos centros.
Aunque no es posible hacer un análisis estadístico de correlación de valores, las medias obtenidas con las PCR-RT Taqman de Roche y la de Abbott fueron bastante homogéneas y, en conjunto, se podría decir que los métodos son razonablemente comparables entre sí.
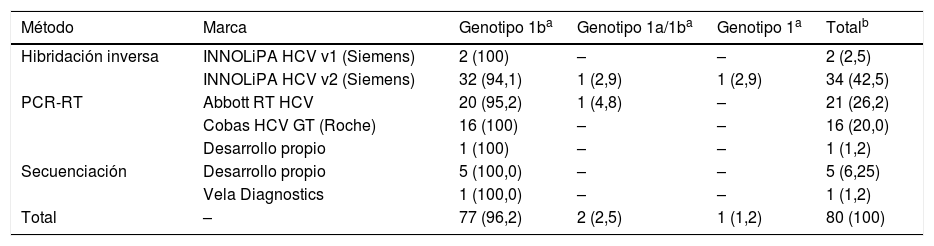
De los 103 participantes inscritos al control, 80 realizaron el genotipado del VHC (77,7%). Todos informaron genotipo 1b, 1, o 1a/1b, de acuerdo con las posibilidades del método que se empleó.
El método que se utilizó de forma mayoritaria por los participantes fue la PCR-RT (47,5%), seguido de la hibridación inversa (45%) y la secuenciación (7,5%). De los 36 participantes que emplearon el sistema de INNOLiPA HCV (Versant, Siemens), 34 usaron la versión 2.
La marca comercial que más se empleó fue INNOLiPA HCV de Siemens, con ella la mayoría de los genotipos informados se correspondieron con 1b (94,4%). Respecto a los equipos basados en una PCR-RT, en todas las ocasiones excepto una (en que se informó genotipo 1a/1b), se informó genotipo 1b; mientras que mediante secuenciación el único genotipo que se informó fue el 1b (100,0%). Los datos se muestran en la tabla 4.
Análisis de los resultados del genotipado del virus de la hepatitis C (estándar VHC-1/17)
| Método | Marca | Genotipo 1ba | Genotipo 1a/1ba | Genotipo 1a | Totalb |
|---|---|---|---|---|---|
| Hibridación inversa | INNOLiPA HCV v1 (Siemens) | 2 (100) | – | – | 2 (2,5) |
| INNOLiPA HCV v2 (Siemens) | 32 (94,1) | 1 (2,9) | 1 (2,9) | 34 (42,5) | |
| PCR-RT | Abbott RT HCV | 20 (95,2) | 1 (4,8) | – | 21 (26,2) |
| Cobas HCV GT (Roche) | 16 (100) | – | – | 16 (20,0) | |
| Desarrollo propio | 1 (100) | – | – | 1 (1,2) | |
| Secuenciación | Desarrollo propio | 5 (100,0) | – | – | 5 (6,25) |
| Vela Diagnostics | 1 (100,0) | – | – | 1 (1,2) | |
| Total | – | 77 (96,2) | 2 (2,5) | 1 (1,2) | 80 (100) |
PCR-RT: reacción en cadena de la polimerasa en tiempo real.
Desde el punto de vista de valoración general de los resultados, los que aquí se presentan se deben considerar como buenos y coherentes con lo esperado. La mayor parte de los participantes incluyen sus resultados individuales dentro del intervalo de aceptación (IC del 95%). En total fueron 2 los participantes que obtuvieron un resultado falsamente negativo con el estándar de baja carga.
Por lo que se refiere al análisis por técnicas comerciales que se emplearon en carga viral, no es posible obtener datos concluyentes debido a la utilización mayoritaria de un determinado método. Respecto a la detección del genotipo, los resultados se consideran muy buenos dado que la práctica totalidad de los centros coincidió con el valor asignado.
4Control de calidad del VHB4.1Características del material remitidoEn el control de carga viral de VHB se remitieron 2 estándares de plasma congelado (VHB-1/17 y VHB-2/17) que se obtuvieron de 2 pacientes distintos con viremia por el VHB, para buscar unos contenidos aproximados en UI/ml preestablecidos. Una vez realizadas las alícuotas, se conservaron a una temperatura de –80°C hasta el momento de su envío, que se hizo en nieve carbónica y con entregas inferiores a las 24h. Ambos estándares se habían analizado previamente a su envío por laboratorios expertos, que confirmaron los valores teóricos.
4.2Criterios de evaluaciónLos 2 estándares se analizaron de forma cuantitativa (log10 UI/ml) comparando los resultados individuales obtenidos por cada participante respecto al IC del 95% (media±1,96 DE) de todos los que utilizaron su mismo método comercial12,13. Al igual que con el control del VIH-1 y del VHC, para el cálculo de la media y de la DE se excluyeron los valores extremos y aberrantes1.
4.3Resultados del control del VHBEn este control se remitieron muestras a 92 laboratorios, de los que 88 respondieron, lo que supone un porcentaje de participación del 95,6%, superior al de otras ediciones. Como sucede con los otros controles de carga viral (VIH-1 y VHC), el método informado por la gran mayoría de los participantes fue la PCR-RT Cobas Taqman® de Roche (68 centros, 77,3%), seguida a distancia por la PCR-RT de Abbott (10 participantes, 11,4%), la PCR-RT de Veris Beckman-Coulter (4,5%), la k-PCR Versant de Siemens (3 centros, 3,4%), la PCR-RT de Qiagen (2 centros, 2,3%) y la PCR-RT de desarrollo propio (1 centro, 1,2%).
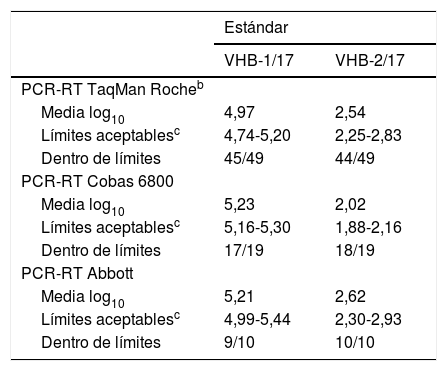
La tabla 5 resume los datos para el total de participantes. Del total de resultados informados, se encontraban dentro del intervalo de aceptación alrededor del 93%. Cabe destacar que 1 participante obtuvo ambos valores fuera del intervalo aceptable, mientras que otro solo informó resultado en el estándar VHB-1/17. En todas las ocasiones que se informa resultado se detecta carga viral, por lo que no hubo resultados falsamente negativos. En general, una vez eliminados los resultados aberrantes, estos fueron buenos.
La tabla 6 resume los resultados de los laboratorios que se obtuvieron mediante las técnicas más empleadas, y se compararon entre sí con la media de cada técnica. No se muestran los datos correspondientes a los sistemas Versant (Siemens), Qiagen, Veris (Beckman Coulter), ni PCR-RT de desarrollo propio, porque los emplearon muy pocos centros. En general, los valores obtenidos quedaban comprendidos dentro del margen aceptable (IC del 95% de la media de los participantes por cada técnica). Debido a que la técnica de PCR-RT Taqman® Roche fue la que se utilizó mayoritariamente, las conclusiones que de ella se derivan son las más consistentes. Los resultados informados mediante esta técnica se desglosan en 2 grupos, ya que los correspondientes a la plataforma Cobas 6800 se analizan de forma independiente (n=19). Así, de los 19 centros que especificaron emplear la plataforma Cobas 6800 (Roche), solo 2 aportaron resultados fuera de intervalo, uno de ellos por un error de fase pre o postanalítica. Mediante el resto de equipos de Roche (n=49) se obtuvo un total de 98 resultados, y quedaron fuera del intervalo de aceptación 9 de ellos, de los cuales 4 se correspondían al estándar VHB-1/17 y los otros 5 al VHB-2/17; en todas las ocasiones se detectó carga viral. Por otro lado, uno de los centros participantes no presentó ninguno de sus valores dentro del intervalo de aceptación.
Control del virus de la hepatitis B (VHB): análisis de los resultados dentro de límites según el método comercial utilizadoa
| Estándar | ||
|---|---|---|
| VHB-1/17 | VHB-2/17 | |
| PCR-RT TaqMan Rocheb | ||
| Media log10 | 4,97 | 2,54 |
| Límites aceptablesc | 4,74-5,20 | 2,25-2,83 |
| Dentro de límites | 45/49 | 44/49 |
| PCR-RT Cobas 6800 | ||
| Media log10 | 5,23 | 2,02 |
| Límites aceptablesc | 5,16-5,30 | 1,88-2,16 |
| Dentro de límites | 17/19 | 18/19 |
| PCR-RT Abbott | ||
| Media log10 | 5,21 | 2,62 |
| Límites aceptablesc | 4,99-5,44 | 2,30-2,93 |
| Dentro de límites | 9/10 | 10/10 |
En cuanto al sistema de PCR-RT de Abbott, 9 de los 10 participantes que emplean esta técnica tienen ambos valores dentro del intervalo de aceptación (90%). El centro restante obtiene el 50% de los valores dentro del intervalo de aceptación. El estándar fuera de intervalo se correspondió con el código VHB-1/17.
4.4Comentarios y conclusiones al control VHBDesde el punto de vista de valoración general de los resultados, los que aquí se presentan se deben considerar como aceptables y acordes con lo esperado. En todas las ocasiones se detecta carga viral, y no se observan resultados falsamente negativos. Por otro lado, se ha detectado un caso de posible error de transcripción de los datos en la web (fase postanalítica) o del etiquetado de los estándares (fase preanalítica).
La mayor parte de los participantes incluyen sus resultados individuales dentro del intervalo de aceptación (IC del 95%). No obstante, es importante que los laboratorios de forma individual mantengan un alto grado de vigilancia sobre la calidad de sus resultados en el día a día y, en caso necesario, introduzcan las medidas correctoras oportunas. Por lo que se refiere al análisis por técnicas comerciales, no es posible obtener datos concluyentes, debido a la utilización mayoritaria de un determinado método.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.