Se presenta el análisis anual de los resultados remitidos durante el año 2018 por los participantes inscritos en el Programa de Control de Calidad de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC), que incluye las áreas de bacteriología, serología, micología, parasitología, micobacterias, virología, microbiología molecular y detección genotípica de mecanismos de resistencia bacteriana. Los resultados obtenidos por los centros participantes resaltan significativamente la adecuada capacitación de la inmensa mayoría de los laboratorios españoles de microbiología clínica, tal como ya venía evidenciándose en los últimos años. Sin embargo, el Programa muestra de nuevo que es posible obtener un resultado erróneo, incluso en determinaciones de la mayor trascendencia y en cualquier laboratorio. Una vez más, se destaca la importancia de complementar el control interno que cada laboratorio lleve a cabo con estudios de intercomparación externos, como los que ofrece el Programa SEIMC.
This article provides an analysis of the results obtained in 2018 by the participants inscribed in the External Quality Control Programme of the Spanish Society of Infectious Diseases and Clinical Microbiology (SEIMC), which includes controls for bacteriology, serology, mycology, parasitology, mycobacteria, virology, molecular microbiology, and genotypic bacterial resistance. The results obtained in 2018 confirm the excellent skill and good technical standards found in the vast majority of Spanish clinical microbiology laboratories, as shown in previous editions. However, the programme again shows that erroneous results can be obtained in any laboratory and even in clinically relevant determinations. Once again, the results of this programme highlight the need to implement both internal and external controls, as in the SEIMC programme.
Los laboratorios de microbiología dedicados al diagnóstico clínico deben poseer una competencia técnica con el fin de lograr un adecuado diagnóstico etiológico a los pacientes con patología infecciosa. Para asegurar la fiabilidad de los resultados emitidos, los laboratorios de microbiología clínica deben disponer de controles de calidad, tanto internos como externos, que abarquen todas las fases del proceso analítico. Los controles de calidad permiten detectar errores sistemáticos o aleatorios, con la consiguiente posibilidad de introducir, si procede, las medidas correctoras adecuadas1–6.
La participación en programas de intercomparación externa entre diferentes laboratorios permite la obtención de diversos beneficios derivados del análisis conjunto de datos aportados por los centros participantes, como la detección de errores o inconsistencias atribuibles a algunas metodologías o sistemas, comerciales o no, que sean el punto de partida de estudios más profundos y concluyentes2,5, como se observa a lo largo de este artículo. Además, estos programas pueden aprovecharse para instaurar actividades de formación continuada que ayuden en la introducción de medidas correctoras y que repercutan en la mejora continua de la calidad. Esta ha sido una característica definitoria del Programa del Control de Calidad de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC)7–18 y es coherente con lo indicado en la Norma UNE-EN ISO 1518919, que otorga a la formación una importancia de primer orden.
En el presente número extraordinario de la revista de EnfermedadesInfecciosas y Microbiología Clínica (EIMC), además del análisis general de los resultados remitidos por los participantes a lo largo del año 2018 para las áreas de serología, bacteriología trimestral y mensual, micología, parasitología, micobacteriología, microbiología molecular, virología y detección genotípica de mecanismos de resistencia bacteriana, con sus principales conclusiones y enseñanzas, se presenta una serie de revisiones de los distintos temas sobre los que versaban los controles remitidos en este año. Las áreas de control de calidad de la carga viral de los virus de la inmunodeficiencia humana tipo 1 (VIH-1), de la hepatitis C (VHC) y de la hepatitis B (VHB) se presentan en un documento aparte. Se puede obtener información más detallada en el sitio web del Programa de Control de Calidad SEIMC (CCS)20.
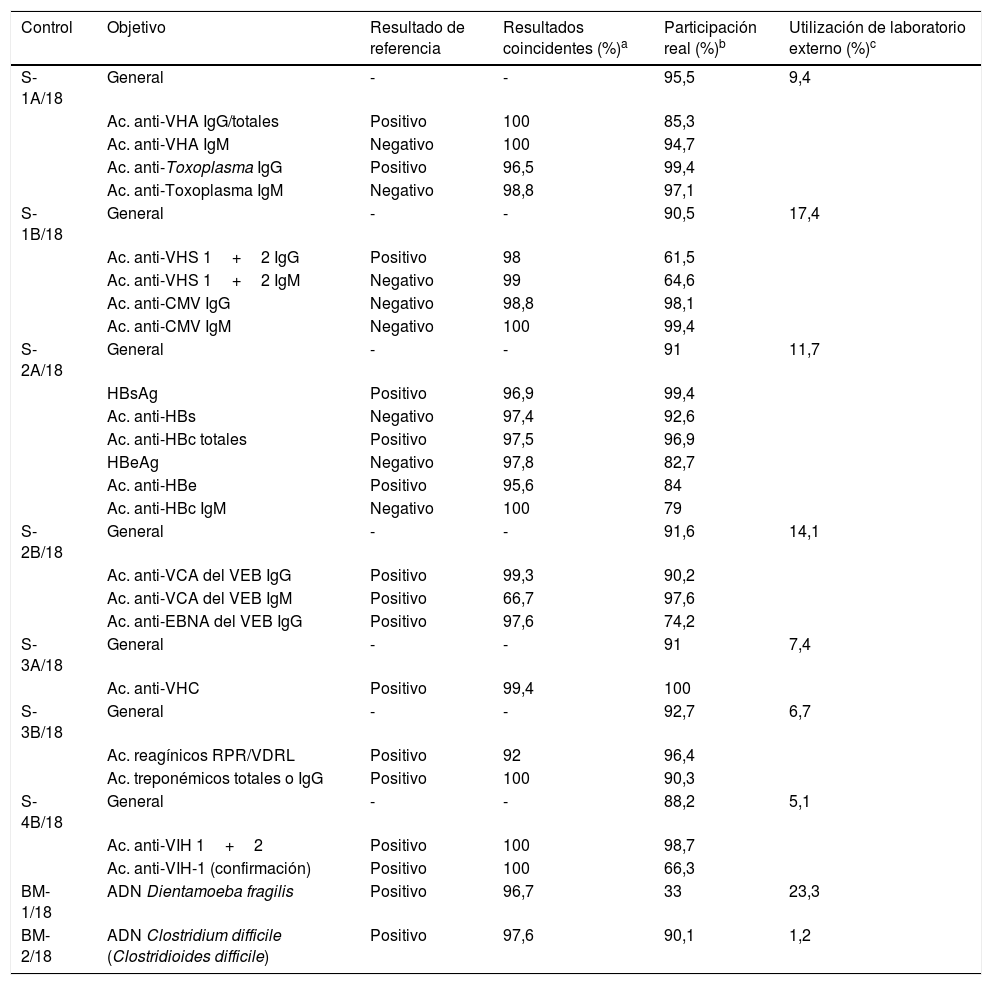
2Análisis de datos de los controles de serologíaDurante el año 2018 se realizaron 7 envíos de serología (S-1A/18, S-1B/18, S-2A/18, S-2B/18, S-3A/18, S-3B/18 y S-4B/18) a 178 centros inscritos en esta área. Previamente, para cada uno de los controles, se solicitó a 2 laboratorios con experiencia en serología la realización de estas determinaciones, que se utilizarían posteriormente como valor asignado de comparación y para la emisión de los certificados individuales a cada participante. Algunas de las características y resultados de dichos controles se resumen en la tabla 1.
Resumen de los controles de serología y microbiología molecular del año 2018
| Control | Objetivo | Resultado de referencia | Resultados coincidentes (%)a | Participación real (%)b | Utilización de laboratorio externo (%)c |
|---|---|---|---|---|---|
| S-1A/18 | General | - | - | 95,5 | 9,4 |
| Ac. anti-VHA IgG/totales | Positivo | 100 | 85,3 | ||
| Ac. anti-VHA IgM | Negativo | 100 | 94,7 | ||
| Ac. anti-Toxoplasma IgG | Positivo | 96,5 | 99,4 | ||
| Ac. anti-Toxoplasma IgM | Negativo | 98,8 | 97,1 | ||
| S-1B/18 | General | - | - | 90,5 | 17,4 |
| Ac. anti-VHS 1+2 IgG | Positivo | 98 | 61,5 | ||
| Ac. anti-VHS 1+2 IgM | Negativo | 99 | 64,6 | ||
| Ac. anti-CMV IgG | Negativo | 98,8 | 98,1 | ||
| Ac. anti-CMV IgM | Negativo | 100 | 99,4 | ||
| S-2A/18 | General | - | - | 91 | 11,7 |
| HBsAg | Positivo | 96,9 | 99,4 | ||
| Ac. anti-HBs | Negativo | 97,4 | 92,6 | ||
| Ac. anti-HBc totales | Positivo | 97,5 | 96,9 | ||
| HBeAg | Negativo | 97,8 | 82,7 | ||
| Ac. anti-HBe | Positivo | 95,6 | 84 | ||
| Ac. anti-HBc IgM | Negativo | 100 | 79 | ||
| S-2B/18 | General | - | - | 91,6 | 14,1 |
| Ac. anti-VCA del VEB IgG | Positivo | 99,3 | 90,2 | ||
| Ac. anti-VCA del VEB IgM | Positivo | 66,7 | 97,6 | ||
| Ac. anti-EBNA del VEB IgG | Positivo | 97,6 | 74,2 | ||
| S-3A/18 | General | - | - | 91 | 7,4 |
| Ac. anti-VHC | Positivo | 99,4 | 100 | ||
| S-3B/18 | General | - | - | 92,7 | 6,7 |
| Ac. reagínicos RPR/VDRL | Positivo | 92 | 96,4 | ||
| Ac. treponémicos totales o IgG | Positivo | 100 | 90,3 | ||
| S-4B/18 | General | - | - | 88,2 | 5,1 |
| Ac. anti-VIH 1+2 | Positivo | 100 | 98,7 | ||
| Ac. anti-VIH-1 (confirmación) | Positivo | 100 | 66,3 | ||
| BM-1/18 | ADN Dientamoeba fragilis | Positivo | 96,7 | 33 | 23,3 |
| BM-2/18 | ADN Clostridium difficile (Clostridioides difficile) | Positivo | 97,6 | 90,1 | 1,2 |
Ac.: anticuerpos; Ag: antígeno; CMV: citomegalovirus; EBNA: antígeno nuclear del virus de Epstein-Barr; HBeAg: antígeno “e” del virus de la hepatitis B; HBsAg: antígeno de superficie del virus de la hepatitis B; IgG: inmunoglobulina G; IgM: inmunoglobulina M; RPR/VDRL: rapid plasma reagin/venereal disease research laboratory; VCA: antígeno de la cápside viral; VEB: virus de Epstein-Barr; VHA: virus de la hepatitis A; VHC: virus de la hepatitis C; VIH: virus de la inmunodeficiencia humana.
En el control S-1A/18 se solicitó la detección de los anticuerpos de tipo inmunoglobulina (Ig)G e IgM frente al virus de la hepatitis A (VHA) y frente a Toxoplasma gondii. Los 2 laboratorios que actuaron de referencia confirmaron la existencia en la muestra control de los anticuerpos anti-VHA y anti-Toxoplasma de la clase IgG. Por el contrario, los anticuerpos anti-VHA y anti-Toxoplasma de la clase IgM fueron negativos. En cuanto a los resultados de los participantes, hubo una excelente concordancia respecto a la serología del VHA, con escasas discrepancias en la serología del Toxoplasma.
En el control S-1B/18 se solicitó la detección de los anticuerpos de tipo IgG e IgM frente al virus del herpes simple 1+2 (VHS 1+2) y frente al citomegalovirus (CMV). De acuerdo con el valor asignado, se confirmó que los anticuerpos anti-VHS 1+2 de la clase IgG eran positivos, mientras que los anticuerpos anti-VHS 1+2 de la clase IgM y los anticuerpos anti-CMV IgG e IgM eran negativos. De nuevo, hubo concordancia entre los resultados de los participantes con el valor asignado, con algunas discrepancias ocasionales.
En el control S-2A/18 se requirió la detección de los antígenos de superficie del VHB (HBsAg) y del antígeno “e” del VHB (HBeAg), y de los anticuerpos frente al antígeno de superficie (anti-HBs), frente al antígeno “e” (anti-HBe) y frente al antígeno del core (anti-HBc) del VHB. Los marcadores del VHB de referencia sugerían un patrón de hepatitis crónica en fase no replicativa (o con actividad replicativa mínima), ya que el HBsAg, los anti-HBc y los anti-HBe fueron positivos, mientras que el resto de los marcadores solicitados eran negativos. En los resultados de los participantes hubo coincidencia general con los de referencia en todas las determinaciones solicitadas, con algunas discrepancias ocasionales. Como dato negativo, por su relevancia clínica, destacan los 4 centros que informaron erróneamente un resultado falsamente negativo para el HBsAg.
En el control S-2B/18 se solicitó la determinación de los anticuerpos de tipo IgG e IgM frente al antígeno de la cápside viral (VCA), así como de los anticuerpos de tipo IgG frente al antígeno nuclear del virus de Epstein-Barr (EBNA). Respecto al valor asignado, los 3 anticuerpos solicitados fueron positivos. En cuanto a los resultados de los participantes, hubo coincidencia general con el valor asignado en los anticuerpos anti-VCA IgG y anti-EBNA IgG, con discrepancias anecdóticas. Sin embargo, respecto a los anticuerpos anti-VCA IgM, el porcentaje de resultados discrepantes alcanzó el 33,3%, en relación con un método y algunas marcas.
En el control S-3A/18 se requirió a los participantes la detección de los anticuerpos frente al VHC. De acuerdo con el valor asignado, los anticuerpos anti-VHC fueron positivos. De nuevo, hubo concordancia entre los resultados de los participantes con el valor asignado; aunque hay que señalar, por su importancia clínica, que hubo un centro que informó los anti-VHC como falsamente negativos. Asimismo, tan solo el 32,1% de los participantes confirmaron el resultado positivo debido a que, en parte, muchos participantes realizaban esta última prueba en una segunda muestra de suero, y así lo hicieron constar en sus comentarios.
En el control S-3B/18 se solicitó la detección de diversos marcadores serológicos de sífilis. Los 2 centros que actuaron como de referencia confirmaron la existencia de anticuerpos reagínicos y treponémicos en la muestra, y resultaron positivas las pruebas de RPR (rapid plasma reagin, con un título de 1/4) y los anticuerpos totales frente a Treponema pallidum. En cuanto a los resultados de los participantes, hubo coincidencia general con los de referencia para la detección de los diversos anticuerpos treponémicos, con algunas discrepancias ocasionales en el caso de los anticuerpos reagínicos.
Y, por último, en el control S-4B/18 se solicitó la detección de los anticuerpos frente al VIH de los tipos 1 y 2 y, si procedía, también la prueba de confirmación. Sobre la base del valor asignado, se confirmó que la muestra era positiva para VIH-1. En esta ocasión, como dato positivo, hubo una excelente concordancia entre los resultados de los participantes con el valor asignado, sin ninguna discrepancia. Sin embargo, respecto a la prueba confirmatoria, tan solo el 66,3% de los participantes confirmaron el resultado positivo obtenido, siendo todas ellas positivas para el VIH-1.
La participación real fue>88% en todos los 7 controles remitidos, mientras que el uso de soporte externo osciló entre un 5,1 y un 17,4%. Los menores porcentajes de utilización de un centro externo se produjeron para la serología de VIH, lúes y VHC, determinaciones al alcance de la gran mayoría de los laboratorios de microbiología clínica. Por el contrario, los mayores porcentajes de centro externo fueron para la serología frente al VHS (requerido por el 17,4% de los centros participantes).
En resumen, a la vista de los resultados obtenidos, el nivel de capacitación en serología de los laboratorios españoles se puede considerar como satisfactorio. Reiterar que, incluso en las mejores condiciones (como el procesamiento de un control de calidad), se producen resultados erróneos, incluyendo determinaciones críticas como el HBsAg y los anti-VHC. Por ello, los centros deben establecer un alto nivel de control mediante la validación clínica de los resultados.
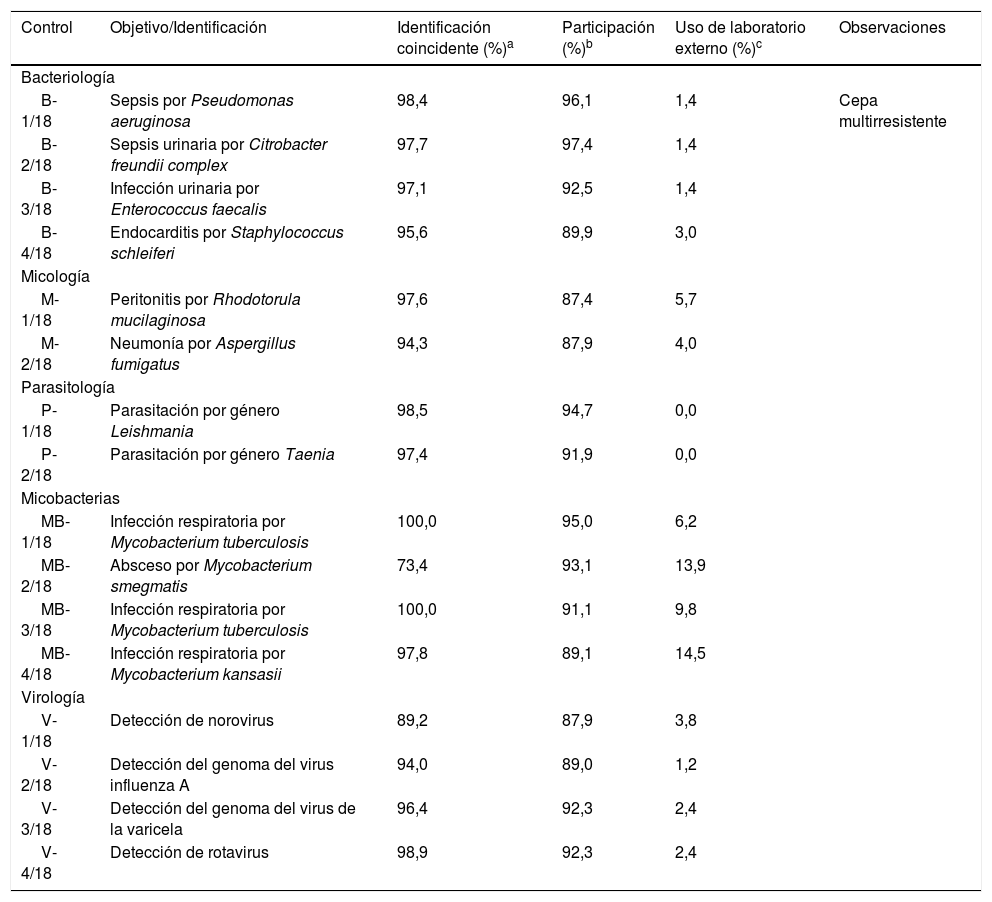
3Análisis de datos de los controles de bacteriologíaEn el año 2018 hubo una media de 228 inscritos en el área de bacteriología (tabla 2). En el control B-1/18 se remitió una cepa de Pseudomonas aeruginosa. Esta bacteria se había aislado en hemocultivos de un paciente de 61 años, ingresado en UCI y sometido a intubación con ventilación mecánica. Los porcentajes de participación real (96,1%) y de utilización de un laboratorio externo (1,4%) fueron buenos. En cuanto a la identificación, la práctica totalidad de los centros (98,4%) llegaron a la identificación de especie. Respecto al estudio de sensibilidad, hubo concordancia con el del valor asignado para la mayoría de los antibióticos a excepción de la gentamicina y la amikacina, en la que se observó discrepancia entre los diferentes centros. Ello estuvo en relación con los criterios empleados para la interpretación del antibiograma, ya que los puntos de corte del CLSI (Clinical and Laboratory Standards Institute) varían ligeramente con los del EUCAST (European Committee on Antimicrobial Susceptibility Testing). Por otra parte, la cepa de P. aeruginosa remitida era multirresistente, característica que comentaron únicamente el 43,9% de los centros.
Resumen de los resultados obtenidos en otros controles del año 2018
| Control | Objetivo/Identificación | Identificación coincidente (%)a | Participación (%)b | Uso de laboratorio externo (%)c | Observaciones |
|---|---|---|---|---|---|
| Bacteriología | |||||
| B-1/18 | Sepsis por Pseudomonas aeruginosa | 98,4 | 96,1 | 1,4 | Cepa multirresistente |
| B-2/18 | Sepsis urinaria por Citrobacter freundii complex | 97,7 | 97,4 | 1,4 | |
| B-3/18 | Infección urinaria por Enterococcus faecalis | 97,1 | 92,5 | 1,4 | |
| B-4/18 | Endocarditis por Staphylococcus schleiferi | 95,6 | 89,9 | 3,0 | |
| Micología | |||||
| M-1/18 | Peritonitis por Rhodotorula mucilaginosa | 97,6 | 87,4 | 5,7 | |
| M-2/18 | Neumonía por Aspergillus fumigatus | 94,3 | 87,9 | 4,0 | |
| Parasitología | |||||
| P-1/18 | Parasitación por género Leishmania | 98,5 | 94,7 | 0,0 | |
| P-2/18 | Parasitación por género Taenia | 97,4 | 91,9 | 0,0 | |
| Micobacterias | |||||
| MB-1/18 | Infección respiratoria por Mycobacterium tuberculosis | 100,0 | 95,0 | 6,2 | |
| MB-2/18 | Absceso por Mycobacterium smegmatis | 73,4 | 93,1 | 13,9 | |
| MB-3/18 | Infección respiratoria por Mycobacterium tuberculosis | 100,0 | 91,1 | 9,8 | |
| MB-4/18 | Infección respiratoria por Mycobacterium kansasii | 97,8 | 89,1 | 14,5 | |
| Virología | |||||
| V-1/18 | Detección de norovirus | 89,2 | 87,9 | 3,8 | |
| V-2/18 | Detección del genoma del virus influenza A | 94,0 | 89,0 | 1,2 | |
| V-3/18 | Detección del genoma del virus de la varicela | 96,4 | 92,3 | 2,4 | |
| V-4/18 | Detección de rotavirus | 98,9 | 92,3 | 2,4 | |
El control B-2/18 versaba sobre un cuadro de sepsis urinaria producido por el complejo Citrobacter freundii, que está compuesto por las especies C. freundii y Citrobacter braakii. Los porcentajes de participación real (97,4%) y de soporte externo (1,4%) fueron altos, similares a otros controles. Respecto a la identificación de la cepa remitida, debido a la elevada similitud existente entre C. freundii y C. braakii, el Programa CCS dio como válidas tanto el complejo C. freundii como cualquiera de estas 2 especies; por lo que el porcentaje de respuestas válidas fue del 97,7%. En el estudio de sensibilidad, los laboratorios mostraron unos resultados concordantes con el valor asignado, con algunos errores anecdóticos.
En el control B-3/18 se envió una cepa de Enterococcus faecalis aislada en un urocultivo de un paciente de 78 años que presentaba molestias urinarias acompañadas de febrícula. El porcentaje de participación (92,5%) y el de utilización de laboratorio externo (1,4%) fueron similares a otros controles. En cuanto a la identificación, la gran mayoría de los participantes (97,1%) identificaron correctamente el género y la especie de la cepa control. En el estudio de sensibilidad se constató una amplia concordancia para todos los antibióticos, con algunos errores ocasionales.
Finalmente, el control B-4/18 contenía una cepa de Staphylococcus schleiferi. Se había aislado a partir de varios hemocultivos de un paciente de 68 años con una endocarditis. El porcentaje de participación fue del 89,9%, algo inferior al de los últimos controles de bacteriología, mientras que el 3,0% de los participantes hicieron uso de un laboratorio externo. En cuanto a la identificación, la gran mayoría de los centros (95,6%) respondieron correctamente S. schleiferi. En el estudio de sensibilidad existió concordancia general con el antibiograma de referencia, con algunos errores anecdóticos.
En resumen, los participantes mostraron un buen nivel de capacitación y competencia, incluso para controles con un mayor nivel de dificultad diagnóstica a priori. Asimismo, la participación en los 4 controles fue alta, superior al 89% en todos ellos.
4Análisis de datos de los controles de micologíaDurante el año 2018 se realizaron 2 envíos a los 198 centros inscritos en esta área (tabla 2). En el primero de ellos (M-1/18), se remitió un liófilo que contenía un hongo levaduriforme identificado como Rhodotorula mucilaginosa. Este hongo había sido aislado a partir de una muestra de líquido peritoneal de una mujer de 79 años sometida a tratamiento con diálisis peritoneal. El índice de participación fue del 87,4%, similar al de otros controles de micología. Respecto a la identificación, la gran mayoría de los centros (97,6%) identificaron correctamente dicha especie, demostrando el buen rendimiento de los métodos comerciales de identificación utilizados, mayoritariamente espectrometría de masas y galerías de pruebas bioquímicas.
El segundo envío (M-2/18) contenía un hongo filamentoso que se identificó por los 2 laboratorios de referencia (valor asignado) como Aspergillus fumigatus. Asimismo, esta cepa control no crecía a 50°C, por lo que podría tratarse de un Aspergillus fumigati, que es una especie críptica perteneciente al complejo A. fumigatus. El hongo filamentoso se aisló a partir de una muestra de esputo de un paciente de 65 años con EPOC grave, que presentaba un aumento progresivo de su disnea habitual, tos con expectoración blanquecina y dolor torácico. El índice de participación fue bueno (87,9%), similar al de otros controles de micología. Respecto a la identificación, el Programa CCS aceptó como válidas las identificaciones A. fumigatus y Aspergillus sección fumigati, por lo que el 94,3% de los participantes identificaron correctamente el género y la especie del hongo remitido. Las características macroscópicas de la cepa, junto con el estudio microscópico con azul de lactofenol, fueron los métodos más usados para la identificación por la práctica totalidad de los participantes.
A modo de conclusión, estos resultados muestran la buena capacitación, en la inmensa mayoría de los laboratorios participantes, para la identificación de las levaduras y de los hongos filamentosos más frecuentes.
5Análisis de datos de los controles de parasitologíaDurante 2018 se realizaron 2 envíos a los 209 laboratorios inscritos en esta área (tabla 2). En el primero de ellos (P-1/18) se remitió una extensión sanguínea teñida con Giemsa. La muestra provenía de una paciente de 31 años con infección por VIH, que presentaba fiebre intermitente, sudoración nocturna y pancitopenia. Los 2 laboratorios que actuaron de referencia visualizaron, mediante un examen microscópico de la extensión, amastigotes del género Leishmania. El índice de participación real fue del 94,7%, similar al de otros controles, mientras que ningún centro hizo uso de un laboratorio externo. A efectos de comparación, el Programa CCS aceptó como respuesta óptima la identificación de género Leishmania, así como las especies Leishmaniainfantum, Leishmaniadonovani y el complejo L. donovani, dado que, como es conocido, para la identificación precisa de la especie de Leishmania son necesarios estudios genómicos o de zimodema. Así, si se agrupan todas estas respuestas, el porcentaje de acierto total fue del 98,5%.
En el segundo control (P-2/18) se remitió a los participantes un concentrado de heces en el que los 2 laboratorios de referencia detectaron, mediante un examen microscópico de las heces tras concentración, la presencia de huevos del género Taenia. El índice de participación fue del 91,9%, similar al de otros controles de parasitología, mientras que de nuevo ningún centro requirió de soporte externo. El Programa CCS aceptó como respuesta óptima el género Taenia, y como aceptables las especies Taenia saginata o Taenia solium, ya que, para la identificación precisa de la especie de Taenia se requieren estudios moleculares o la observación de las proglótides. Así, el 89,1% de los participantes informaron el género Taenia, mientras que otro 8,3% informaron alguna especie de Taenia, por lo que el número de respuestas aceptables alcanzó el 97,4%.
En general, se puede concluir que, al igual que viene sucediendo en los últimos años, los participantes del CCS presentan una alta capacitación respecto a la detección parasitológica, ya que se constatan unos altos porcentajes de identificaciones correctas con una total ausencia de utilización de laboratorio externo.
6Análisis de datos de los controles de micobacteriasDurante el año 2018 se remitieron 4 controles a los 101 laboratorios inscritos en el área de micobacteriología (tabla 2). En el primero de ellos (MB-1/18) se envió una cepa identificada como Mycobacterium tuberculosis. Procedía de un esputo de un paciente de 25 años que presentaba un cuadro de astenia y tos escasamente productiva, acompañada de sensación distérmica. El porcentaje de participación fue alto (95,0%), mientras que la necesidad de recurrir a un laboratorio externo fue baja (6,2%), al tratarse de una micobacteria tuberculosa. Desde el Programa CCS se consideró como óptima la identificación de especie M. tuberculosis y como aceptables las respuestas complejo M. tuberculosis y M.tuberculosis/Mycobacterium canetti. Así, al agrupar todas las respuestas aceptables, el porcentaje de acierto total alcanzó el 100,0% de los participantes. Para la identificación se utilizó de forma mayoritaria la hibridación inversa, seguida de la inmunocromatografía y de la PCR a tiempo real. El estudio de sensibilidad se realizó por el 84,4% de los centros, con un predominio de la dilución en medio líquido. La concordancia entre las respuestas de los participantes respecto al del valor asignado fue muy elevada, con porcentajes superiores al 95% en todos los antituberculosos.
El segundo control (MB-2/18) contenía una cepa de Mycobacterium smegmatis. Se había aislado a partir de un absceso cutáneo de un varón de 57 años, jardinero de profesión, con una lesión inflamatoria en la primera falange de su mano derecha. El porcentaje de participación (93,1%) y la necesidad de recurrir a un laboratorio externo (13,9%) fueron similares a los de otros controles con micobacterias no tuberculosas. El Programa CCS aceptó únicamente como válida la identificación M. smegmatis, especie informada por el 73,4% de los participantes. Respecto a los métodos usados para la identificación, las 2 técnicas mayoritarias fueron la espectrometría de masas y la hibridación inversa. El estudio de sensibilidad se realizó por el 56,5% de los participantes que identificaron M. smegmatis, con un predominio de la microdilución y de las tiras de concentración. Se observó coincidencia entre los laboratorios participantes con el antibiograma del valor asignado en todos los antimicrobianos ensayados, con la excepción de la cefoxitina, imipenem y claritromicina, con una moderada discrepancia entre los centros. En el caso de la cefoxitina y del imipenem esta discrepancia se debía a diferencias en una dilución, mientras que respecto a la claritromicina, M. smegmatis presenta resistencia intrínseca a los macrólidos.
En el control MB-3/18 se remitió una cepa identificada como M. tuberculosis. Procedía de muestras de esputo y broncoaspirado de una paciente de 36 años procedente de Guinea Ecuatorial, que acudía a su hospital por malestar general, astenia, febrícula, tos con hemoptisis y pérdida de peso. El porcentaje de participación (91,1%) y de utilización de un laboratorio externo (9,8%) fueron similares a otros controles de micobacterias tuberculosas. Desde el Programa CCS se consideró como óptima la identificación de especie M. tuberculosis y aceptables la de complejo M. tuberculosis y M. tuberculosis/M. canetti. Así, el 100,0% de los laboratorios identificaron correctamente la especie o el complejo. Las técnicas mayoritarias para la identificación fueron la hibridación inversa, seguida de la inmunocromatografía y de la PCR a tiempo real. El estudio de sensibilidad se realizó por el 77,2% de los centros, con un predominio de la dilución en medio líquido. Se produjo una excelente concordancia entre las respuestas de los participantes y el valor asignado, con la única excepción del etambutol. Ello se explica porque la cepa control presentaba la mutación Met306Val en el gen embB, lo que confiere una resistencia de bajo nivel al etambutol, que puede producir discrepancias de interpretación fenotípica entre los distintos laboratorios.
Por último, en el control MB-4/18 se trataba de una cepa de Mycobacterium kansasii. Procedía de una muestra de aspirado broncoalveolar de un paciente de 71 años que había desarrollado un empeoramiento de su estado general, acompañado de aumento de su disnea habitual y de su tos con expectoración blanquecina. El porcentaje de participación (89,1%) fue similar al de otros controles, mientras que la necesidad de utilización de un centro externo fue algo mayor que otros controles (14,5%). El Programa CCS aceptó como óptima la identificación correcta de M. kansasii, especie que fue informada por la gran mayoría de los participantes (97,8%). Como en los últimos controles de micobacterias no tuberculosas, los métodos mayoritariamente empleados para la identificación fueron las pruebas de hibridación inversa y la espectrometría de masas. En cuanto al estudio de sensibilidad, se realizó tan solo por el 45,5% de los participantes que informaron M. kansasii, con un predominio de la microdilución y la dilución en medio líquido. La concordancia entre los laboratorios participantes y el valor asignado para la claritromicina, etambutol, linezolida, moxifloxacino, pirazinamida, rifabutina y rifampicina fue excelente, aunque menor en el resto.
7Análisis de datos del control de microbiología molecularEn el año 2018 se realizaron 2 envíos de microbiología molecular a los 91 laboratorios inscritos en esta área (tabla 1). En el primer control (BM-1/18) se remitió una alícuota de heces en la que se solicitaba la detección del genoma de Dientamoeba fragilis. La historia clínica correspondía a la de un niño de 8 años que presentaba un cuadro de dolor abdominal acompañado de pérdida de apetito y diarrea. El valor asignado de referencia fue el de detección positiva del genoma de D. fragilis. El porcentaje de participación fue tan solo del 33,0%, mientras que el 23,3% de los laboratorios requirieron de un centro externo. Estos bajos porcentajes se deben a que dicha prueba no se encuentra disponible en la cartera de servicio de la mayoría de los laboratorios de microbiología. En cuanto a los resultados, todas las determinaciones realizadas excepto una (96,7%) fueron positivas a este parásito, coincidiendo con el valor asignado. El método mayoritariamente empleado fue la PCR a tiempo real, destacando el reactivo AllplexTM de Seegene.
En el segundo control (BM-2/18) se remitió otra alícuota de heces que procedía de una paciente de 62 años que, a los 5 días de tratamiento antibiótico, había iniciado un cuadro de náuseas, vómitos y diarrea. Se solicitó a los participantes la detección del genoma de toxina de Clostridium difficile (actualmente denominado Clostridioides difficile). El porcentaje de participación real en este control fue del 90,1%, con una utilización de un laboratorio externo del 1,2%. Todas las determinaciones realizadas excepto dos (97,6%) fueron positivas, coincidiendo con el valor asignado. El método mayoritariamente empleado fue la PCR a tiempo real, destacando el sistema Xpert® de Cepheid.
8Análisis de datos del control de virologíaEn 2018 se realizaron 4 envíos de virología (tabla 2). El primer control (V-1/18) consistía en una alícuota de heces procedente de una niña de 18 meses que presentaba un cuadro de diarrea de 4 días de evolución con características clínicas que sugerían una etiología viral. Así lo confirmaron los 2 laboratorios que actuaron de referencia, que detectaron, mediante una PCR a tiempo real múltiple, la presencia de norovirus. La muestra de heces se remitió a los 91 centros inscritos en esta área, de los que un 87,9% emitió hoja de respuesta con datos evaluables. Del total de las determinaciones efectuadas, un 89,2% fue positiva para norovirus. Respecto a los métodos empleados, hubo un predominio de la PCR a tiempo real, especialmente de los reactivos AllplexTM de Seegene y Xpert® de Cepheid.
En el segundo control (V-2/18) se remitió una alícuota de exudado nasofaríngeo que procedía de una paciente de 67 años con un cuadro de fiebre alta, tos productiva y artromialgias. Se solicitó a los participantes la detección de los virus influenza A y B en el exudado nasofaríngeo. El porcentaje de participación fue del 89,0%, similar a otros controles. Todas las determinaciones efectuadas excepto 5 (94,0%) fueron positivas para el virus influenza A, coincidiendo con el valor asignado. En cuanto a los métodos utilizados, casi todos los participantes emplearon la PCR a tiempo real, con un predominio de los reactivos AllplexTM de Seegene y Xpert® de Cepheid.
En el tercer control (V-3/18) se remitió una alícuota de un exudado de vesícula para la detección del virus varicela-zóster (VVZ). La muestra procedía de un niño de 7 años procedente de Rumanía, que presentaba diferentes tipos de lesiones cutáneas, principalmente maculopapulosas y en forma de vesícula, en tronco y cara, acompañadas de fiebre. El porcentaje de participación real fue del 92,3%, similar a otros controles. Todos los participantes excepto 3 (96,4%) detectaron el VVZ en la muestra, resultado coincidente con el valor asignado. La mayoría de las determinaciones fueron por PCR a tiempo real, con un predominio del reactivo RealCycler® de Progenie.
En el último control de esta área (V-4/18) se envió otra alícuota de heces. La muestra provenía de un niño de 2 años que presentaba un cuadro diarreico de 2 días de evolución, acompañado de fiebre alta. Se solicitó la detección de algunos virus causantes de diarrea. Los 2 centros que actuaron de referencia detectaron, tanto por inmunocromatografía como por PCR a tiempo real, la presencia de rotavirus en la muestra. El porcentaje de participación (92,3%) fue idéntico al del último control. Todos los centros excepto uno (98,9%) detectaron este virus en la muestra. En cuanto a los métodos utilizados en la identificación, la mayoría empleó una técnica rápida de inmunocromatografía.
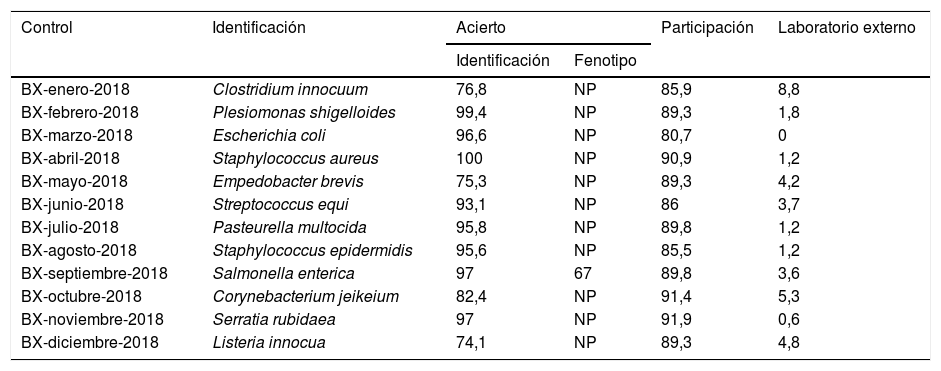
9Análisis de datos de los controles de bacteriología mensualA lo largo del año 2018 se enviaron 12 controles mensuales de bacteriología a los 186 centros inscritos (tabla 3). La participación media fue del 88,3%, con escasas oscilaciones (80,7-91,9%).
Características y porcentajes de participación, acierto y uso de laboratorio externo en los controles de bacteriología mensual del año 2018
| Control | Identificación | Acierto | Participación | Laboratorio externo | |
|---|---|---|---|---|---|
| Identificación | Fenotipo | ||||
| BX-enero-2018 | Clostridium innocuum | 76,8 | NP | 85,9 | 8,8 |
| BX-febrero-2018 | Plesiomonas shigelloides | 99,4 | NP | 89,3 | 1,8 |
| BX-marzo-2018 | Escherichia coli | 96,6 | NP | 80,7 | 0 |
| BX-abril-2018 | Staphylococcus aureus | 100 | NP | 90,9 | 1,2 |
| BX-mayo-2018 | Empedobacter brevis | 75,3 | NP | 89,3 | 4,2 |
| BX-junio-2018 | Streptococcus equi | 93,1 | NP | 86 | 3,7 |
| BX-julio-2018 | Pasteurella multocida | 95,8 | NP | 89,8 | 1,2 |
| BX-agosto-2018 | Staphylococcus epidermidis | 95,6 | NP | 85,5 | 1,2 |
| BX-septiembre-2018 | Salmonella enterica | 97 | 67 | 89,8 | 3,6 |
| BX-octubre-2018 | Corynebacterium jeikeium | 82,4 | NP | 91,4 | 5,3 |
| BX-noviembre-2018 | Serratia rubidaea | 97 | NP | 91,9 | 0,6 |
| BX-diciembre-2018 | Listeria innocua | 74,1 | NP | 89,3 | 4,8 |
NP: no procede.
La utilización de laboratorio externo fue baja en 8 de los 12 controles, y osciló entre el 0,0 y el 3,7%. Los porcentajes más altos de uso de un centro externo ocurrieron en los controles de enero y mayo, en los que se remitieron, respectivamente, una cepa de Clostridium innocuum (el 8,8% de soporte externo) y otra cepa de Empedobacter brevis (4,2%). Ello se debe, como cabe suponer, a una mayor dificultad para la identificación de estas especies.
Los porcentajes de identificaciones correctas conseguidos por los participantes fueron elevados en 8 de los controles, y se alcanzó un máximo en los controles a priori más sencillos (Staphylococcus aureus, Salmonella enterica, Serratia rubidaea, Escherichia coli) y también en otros controles algo más complicados (Plesiomonas shigelloides), con un porcentaje de acierto superior al 93,0% en todos ellos. Por el contrario, los menores índices de identificaciones correctas se obtuvieron con las cepas de Listeria innocua (el 74,1% de aciertos), E. brevis (el 75,3% de aciertos) y de C. innocuum (el 76,8% de los aciertos).
Solo en una ocasión la cepa que se envió presentaba una característica fenotípica especial que constituía el verdadero objetivo perseguido por el control. Se trataba del control de septiembre, en el que se remitió una cepa de S. enterica productora de b-lactamasa de espectro extendido (BLEE), característica que comentaron el 67,0% de los participantes.
En resumen, los porcentajes de participación y acierto son altos para casi todos los controles y se confirma de nuevo que los laboratorios de nuestro país están bien capacitados para los análisis bacteriológicos.
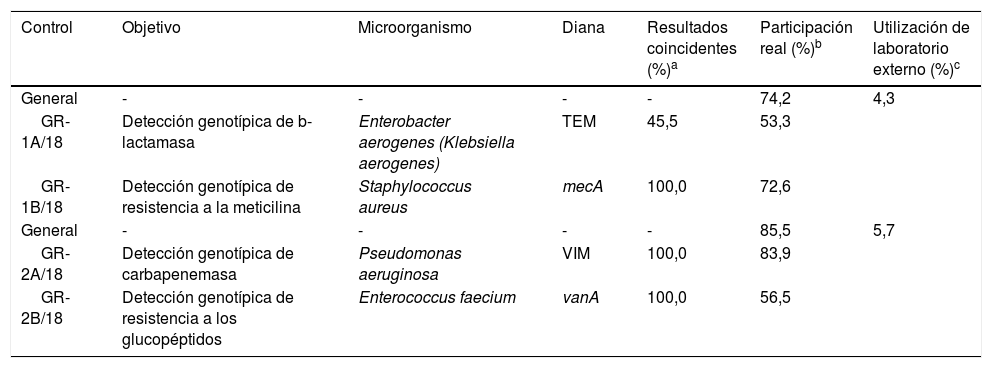
10Análisis de datos del control de detección genotípica de mecanismos de resistencia bacterianaDurante el año 2018 se remitieron 4 controles, separados en 2 envíos, a los 62 laboratorios inscritos en el área de la detección genotípica de mecanismos de resistencia bacteriana.
El primer envío costaba de una cepa de Enterobacter aerogenes (actualmente denominada Klebsiella aerogenes), en la que se solicitaba la detección molecular de b-lactamasa (control GR-1A/18), y de una cepa de S. aureus, en la que se requería la detección molecular de resistencia a la meticilina (control GR-1B/18). El porcentaje de participación real en alguno de estos 2 controles fue del 74,2%, mientras que tan solo un 4,3% de los centros hicieron uso de un centro externo (tabla 4). En cuanto a los resultados obtenidos en el control GR-1A/18, el 45,5% de los participantes detectaron un gen productor de TEM en la cepa de E. aerogenes, resultado coincidente con el valor asignado. Respecto al control GR-1B/18, todos los participantes (100,0%) detectaron el gen mecA en la cepa de S. aureus.
Resumen de los controles de genotipos de resistencia del año 2018
| Control | Objetivo | Microorganismo | Diana | Resultados coincidentes (%)a | Participación real (%)b | Utilización de laboratorio externo (%)c |
|---|---|---|---|---|---|---|
| General | - | - | - | - | 74,2 | 4,3 |
| GR-1A/18 | Detección genotípica de b-lactamasa | Enterobacter aerogenes (Klebsiella aerogenes) | TEM | 45,5 | 53,3 | |
| GR-1B/18 | Detección genotípica de resistencia a la meticilina | Staphylococcus aureus | mecA | 100,0 | 72,6 | |
| General | - | - | - | - | 85,5 | 5,7 |
| GR-2A/18 | Detección genotípica de carbapenemasa | Pseudomonas aeruginosa | VIM | 100,0 | 83,9 | |
| GR-2B/18 | Detección genotípica de resistencia a los glucopéptidos | Enterococcus faecium | vanA | 100,0 | 56,5 |
En el segundo envío se remitieron una cepa de P. aeruginosa para la detección genotípica de carbapenemasa (control GR-2A/18) y una cepa de Enterococcus faecium para la detección molecular de resistencia a los glucopéptidos (control GR-2B/18). El porcentaje de participación real en alguno de estos 2 controles fue del 85,5%, con una utilización de laboratorio externo del 5,7%. Respecto a los resultados, todos los participantes (100,0%) detectaron tanto el gen productor de VIM en la cepa de P. aeruginosa, como el gen vanA en la cepa de E. faecium, coincidiendo con el valor asignado.
11ConclusiónLos resultados obtenidos a lo largo de 2018 confirman, una vez más, la buena capacitación general de los laboratorios de microbiología, sin duda atribuible, entre otros, a la incorporación de profesionales bien formados y con conocimientos sólidos. Aun así, como en cualquier programa de control externo, se pone de manifiesto que la obtención de algún resultado erróneo, incluso en las determinaciones de mayor trascendencia, es un riesgo que puede presentarse en cualquier laboratorio. Una vez más, se resalta la importancia de complementar el control de calidad interno que cada laboratorio lleva a cabo con los ejercicios de intercomparación externos, como los que ofrece el Programa CCS7–18.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.