La tosferina ha aumentado su incidencia y severidad especialmente en lactantes, por lo que la vacunación de la embarazada se ha introducido como estrategia preventiva. La pandemia de la COVID-19 parece haber disminuido la incidencia de distintas enfermedades respiratorias.
MétodosEstudio retrospectivo entre 2012-2021, analizando la influencia de la vacunación de la embarazada y del primer año de la pandemia de la COVID-19 en los casos de tosferina.
ResultadosSe incluyeron 960 pacientes de atención primaria y hospitalaria con sospecha de tosferina, con 130 casos diagnosticados (104 niños y 26 adultos). En el periodo posvacunal, se observó una disminución de casos y de severidad de la tosferina en niños menores de 6 meses y de los diagnósticos en mujeres adultas. No se detectó ningún paciente con tosferina durante el periodo de la COVID-19.
ConclusiónTanto la vacunación de la embarazada como el primer año de la pandemia de la COVID-19 han disminuido significativamente los casos de tosferina.
Whooping cough has had an increased incidence and severity specially in infants and maternal immunization has been implemented as a prevention strategy. COVID-19 pandemic seems to decrease the incidence of other respiratory diseases.
MethodsRetrospective study from 2012 to 2021 to assess the influence of pertussis maternal immunizations and the first year of COVID-19 pandemic in the cases of whooping cough.
Results960 suspected cases from primary care and hospital, with 130 cases (104 children and 26 adults) being diagnosed of whooping cough. In the post-vaccination period, a reduction in the cases and severity in infants up to 6 months old was observed as well as in the pertussis diagnosis in adult women. There were no whooping cough cases during the COVID-19 period.
ConclusionsBoth the pertussis vaccination in pregnancy and the first year of the COVID-19 pandemic have decreased the number of pertussis cases.
La tosferina es una infección respiratoria aguda causada por Bordetella pertussis que incide especialmente en niños, aunque puede afectar a todas las edades1. Cursa con ciclos epidémicos cada tres a cinco años y ha presentado un aumento en la incidencia y mortalidad con un pico en España en 2014-20152. La gravedad afecta especialmente a niños menores de tres meses, y la vacunación de las embarazadas como estrategia de protección comenzó en Andalucía en enero de 2016, con una cobertura el primer año del 81,6%3–5.
La epidemia por coronavirus SARS-CoV-2 se inició en diciembre de 2019, declarándose el primer caso de COVID-19 en España en febrero de 2020. Desde entonces, se ha comunicado una disminución de la incidencia de algunas infecciones respiratorias6,7.
El objetivo de este estudio ha sido analizar la incidencia y evolución de la tosferina antes y después de la vacunación de la embarazada y durante el primer año de la pandemia de la COVID-19.
MétodosSe realizó un estudio retrospectivo desde enero de 2012 hasta enero de 2021 en un área sanitaria de 450.000 habitantes, que incluye un hospital universitario y 19 centros de salud, con un único laboratorio para la realización del estudio de la reacción en cadena de la polimerasa (PCR) a Bordetella pertussis. Se incluyó como caso de estudio a todo paciente en el que se realizó la PCR (Bordetella R-gene, Argene y SmartCycler Bordetella pertussis/parapertussis assay, Cepheid) y como caso de tosferina cuando la PCR fue positiva. La prueba fue solicitada por sospecha clínica desde atención hospitalaria o atención primaria. En los casos de tosferina, se contactó telefónicamente con las mujeres que debían haber sido vacunadas durante el embarazo y con los adultos ingresados para corroborar la información recogida de las historias clínicas.
Se consideraron cuatro periodos durante el estudio: periodo prevacunal (enero 2012-diciembre 2015), periodo posvacunal (enero 2016-enero 2020), incluyendo en este último un periodo ventana al inicio de la vacunación (enero-junio 2016) y un periodo COVID-19 (febrero 2020-enero 2021).
El análisis estadístico se realizó con el programa SPSS v.24.0 (IBM Corp., Armonk, NY). La medida de la asociación se realizó con odds ratio [OR] con intervalo de confianza del 95% (IC 95%) y test no paramétricos para las variables continuas. En el análisis multivariante para tener tosferina se analizaron la edad, el periodo vacunal y el periodo COVID-19.
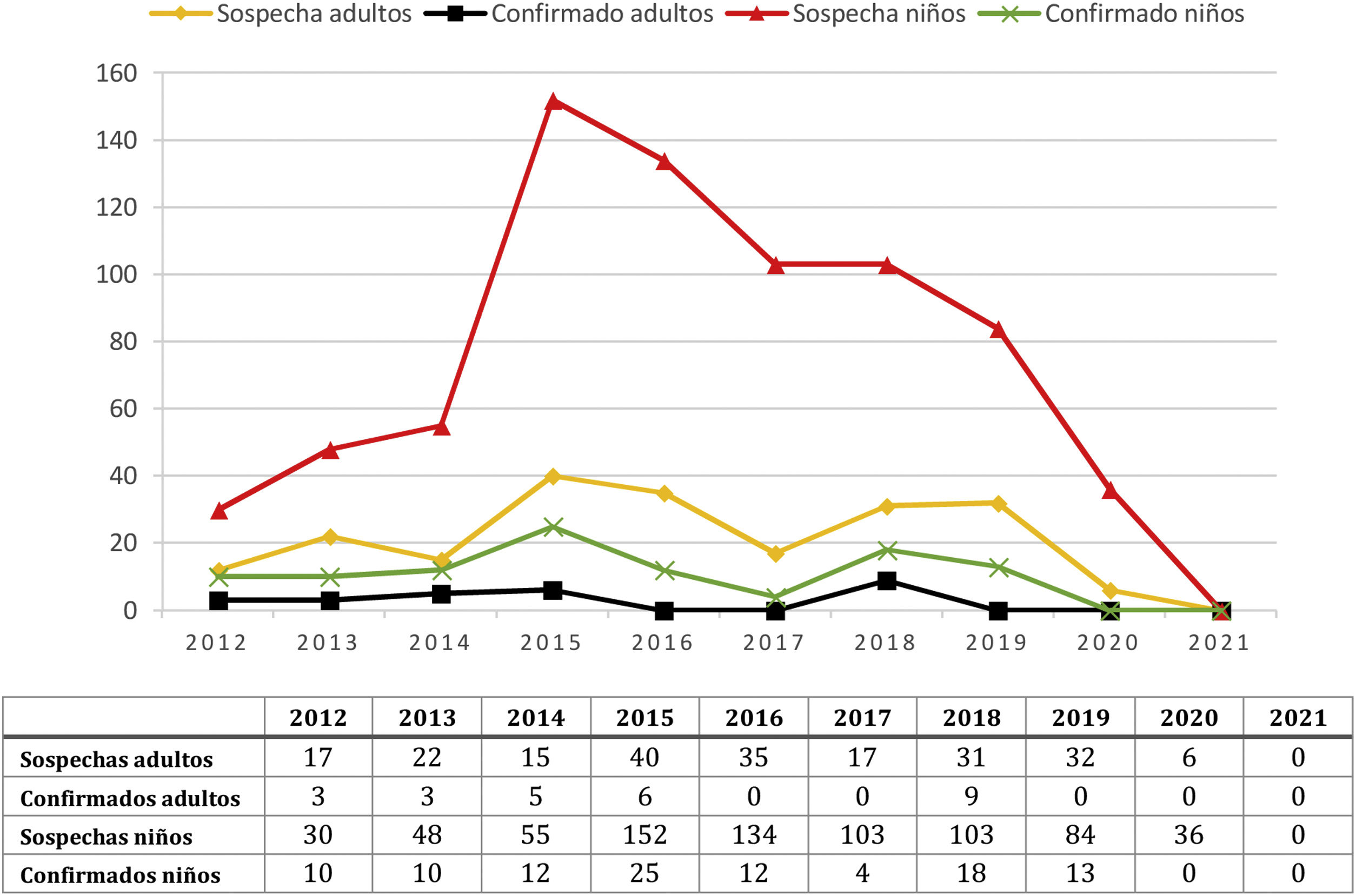
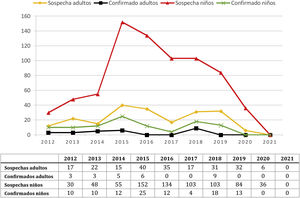
ResultadosSe incluyeron 960 sujetos con sospecha de tosferina (745 niños de hasta 15 años y 215 adultos) de entre un mes de vida y 84 años. La mediana de la edad entre los niños fue de 1,5 meses y de 48 años entre los adultos. El mayor número de sospechas (n:192) y de casos confirmados (n:31) fue en 2015 (fig. 1), antes de iniciarse la campaña vacunal, con disminución posterior. La sospecha clínica y recogida de la muestra en adultos se llevó a cabo mayoritariamente en atención primaria (56,3%) y consultas externas hospitalarias (23,3%), mientras que en niños fue en urgencias hospitalarias (44,1%) y hospitalización (35,6%).
Se detectaron 130 casos de tosferina, 104 en niños y 26 en adultos. Al comparar con el periodo prevacunal (tabla 1), se observó en el total de la muestra una reducción absoluta del número de casos de tosferina en el periodo posvacunal del 24,3%. Durante el periodo COVID-19 no se encontró ningún caso de tosferina entre los 23 sujetos (18 niños y cinco adultos), en los que se solicitó la prueba.
Características de los casos de tosferina en niños comparando los periodos pre (2012-2015) y posvacunación (2016-2021) de la embarazada
| Características | Pre V (n = 57) | Ventana (n = 10) | Post V (n = 37) | OR (IC 95%)* | p* |
|---|---|---|---|---|---|
| Edad en meses (mediana; IQ) | 2,87 (1,7-8,2) | 3,37 (1,5-14,8) | 23,3 (7,8-23,3) | < 0,001 | |
| Casos < 3 meses; n (%) | 30 (52,6%) | 4 (40%) | 4 (10,8%) | 9,17 (2,87-29,26) | < 0,001 |
| Casos < 6 meses; n (%) | 42 (73,7%) | 8 (80%) | 8 (21,6%) | 10,1 (3,81-27,04) | < 0,001 |
| Nivel de gravedad | |||||
| Ambulatorio | 14 (24,6%) | 0 | 24 (64,9%) | 5,67 (2,29-14,01) | < 0,001 |
| Hospitalización en planta | 33 (57,9%) | 6 (60%) | 13 (35,1%) | 0,39 (0,17-0,93) | 0,03 |
| UCI | 10 (17,5%) | 1 (10%) | 0 | ||
| Ventilación no invasiva | 2 (3,5%) | 0 | 0 | ||
| Ventilación mecánica | 5 (8,8%) | 1 (10%) | 0 | ||
| Tosferina maligna | 3 (5,3%) | 1 (10%) | 0 | ||
| Fallecimientos | 0 | 1 (10%) | 0 | ||
| Días ingreso (mediana, IQ) | |||||
| Planta | 11 (7-15) | 7 (3-8) | 6 (3,5-7) | < 0,001 | |
| UCI | 5 (2,75-7,25) | ||||
En niños se observó en el periodo posvacunal una reducción absoluta del 17,5% en el número de casos y del 35,1% al excluir aquellos diagnosticados en el periodo ventana. Los niños con tosferina tuvieron una mediana de edad 4,25 meses (rango intercuartílico [IQ]: 1,89-51,58; rango 0-168 meses) y durante el periodo posvacunal se comprobó un aumento significativo de la edad y una disminución de la enfermedad en niños menores de tres y de seis meses (fig. 1 y tabla 1). Sin embargo, se observó un aumento en el número de casos en la franja 11-15 años, con cuatro diagnosticados en periodo prevacunal y 12 en periodo posvacunal.
Al revisar los 47 niños con tosferina del periodo posvacunal, 26 habían nacido con anterioridad al inicio de la campaña de vacunación de la embarazada. Al contactar con las madres de los 21 restantes, se comprobó que tres no habían sido vacunadas por deseo materno o fallo en la campaña de vacunación. Las embarazadas habían sido vacunadas de media ± DE a las 29,3±2,2 semanas de edad gestacional (rango 25,4-34,3), pasando desde la vacunación al parto una media de 9,7 ± 2,6 semanas (rango 5-15,6). Tres niños nacieron prematuramente (uno a las cinco semanas de vacunarse la embarazada). Un lactante de un mes de vida, de madre no vacunada durante el periodo ventana, presentó tosferina maligna y falleció tras un día en Unidad de Cuidados Intensivos (UCI). Los demás niños con tosferina grave (tosferina maligna, ingreso en UCI o necesidad de ventilación), se presentaron en el periodo prevacunal. Además, el número de niños que requirieron ingreso en planta y los días de ingreso disminuyeron significativamente en el periodo posvacunal (tabla 1).
Se diagnosticaron 26 casos de tosferina en adultos (edad mediana 45 años, IQ: 36,2-54; rango 24-67), con predominio de mujeres (61,5%) y sin detectarse ningún caso entre 2019 y 2021. La reducción en el periodo posvacunal fue del 47,1% por diminución del 66,7% en mujeres (de 12 a cuatro casos) permaneciendo los varones sin cambios (cinco casos en cada periodo). Respecto a la severidad, en adultos no hubo ninguna complicación significativa y tan solo dos pacientes ingresaron en planta ocurriendo ambos casos en el periodo prevacunal.
El periodo de vacunación de la embarazada fue un factor protector para tener tosferina en el análisis multivariante de toda la muestra (OR = 0,46; IC 95%: 0,31-0,67; p < 0,001), así como al incluir solo los niños (OR = 0,44; IC 95%: 0,28-0,67; p < 0,001) o exclusivamente los adultos (OR = 0,38; IC 95%: 0,16-0,9; p = 0,028).
DiscusiónEn este estudio se comprobó una reducción en el número de casos de tosferina en niños de hasta seis meses de edad, así como de su severidad (hospitalización, UCI y tosferina maligna). Otros estudios también lo han refrendado, aunque algunos presentaron alto riesgo de sesgos de selección y definición de casos8. En nuestro estudio, 18 niños presentaron tosferina a pesar de la vacunación materna. Una se había vacunado a las 25 semanas de gestación y tres niños nacieron prematuramente. Existe controversia sobre el mejor momento de vacunación de la embarazada y aunque se recomienda administrarla entre las 27 y 36 semanas de gestación9, la protección en los niños prematuros posiblemente sea superior si la vacuna se recibe a partir de las 20 semanas10. En cualquier caso, la efectividad de la vacunación de la embarazada en la protección de tosferina en el lactante se ha estimado en el 90%11.
Se observó además una disminución significativa en el número de casos en adultos, a expensas de una reducción en el número de casos en las mujeres. En nuestra área sanitaria hay aproximadamente 2.500 partos al año que, estimándose una cobertura vacunal del 80%, produciría la vacunación de 10.000 embarazadas en cinco años, lo que podría justificar esta disminución. En los datos de la Red Nacional de Vigilancia Epidemiológica también se observa, al comparar entre los años 2015 y 2018, una disminución de casos en adultos, siendo algo superior en mujeres12,13. En nuestro conocimiento, el impacto de la vacunación de la embarazada sobre la población adulta no ha sido evaluado previamente en estudios que incluyan los casos detectados microbiológicamente, y no por declaración obligatoria. Existe controversia sobre la necesidad de administrar una dosis de recuerdo dTpa en adolescentes y adultos, que ayudaría a disminuir la incidencia en estos grupos, su transmisión a niños pequeños y que se ha mostrado efectiva y segura14.
Durante la pandemia de la COVID-19 se ha publicado una disminución de cuadros respiratorios. En los casos de infecciones virales se ha especulado que puede ser debido a la ocupación del nicho ecológico, mientras que las bacterianas puedan justificarse por una disminución de las consultas médicas debido al miedo al contagio y por las medidas de prevención como el distanciamiento social, el uso de mascarillas, el lavado de manos y el gel hidroalcohólico7,15.
Los resultados de nuestro estudio deben ser tomados con precaución, al ser retrospectivo, unicéntrico y con pocos casos en adultos. Sin embargo, también presenta fortalezas al abarcar el área sanitaria tanto atención primaria como hospitalaria, incluir adultos, analizar todos los resultados del laboratorio independientemente de si fueron o no declarados, valorar el periodo COVID-19 y contactar con las madres de niños con tosferina que debían haber sido vacunadas y con los adultos ingresados con tosferina.
Concluimos que tras la vacunación de la embarazada apreciamos una disminución en el número casos de tosferina y de su gravedad, fundamentalmente en lactantes de hasta seis meses, de los casos en mujeres adultas y la ausencia de tosferina durante el primer año de la pandemia de la COVID-19.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.