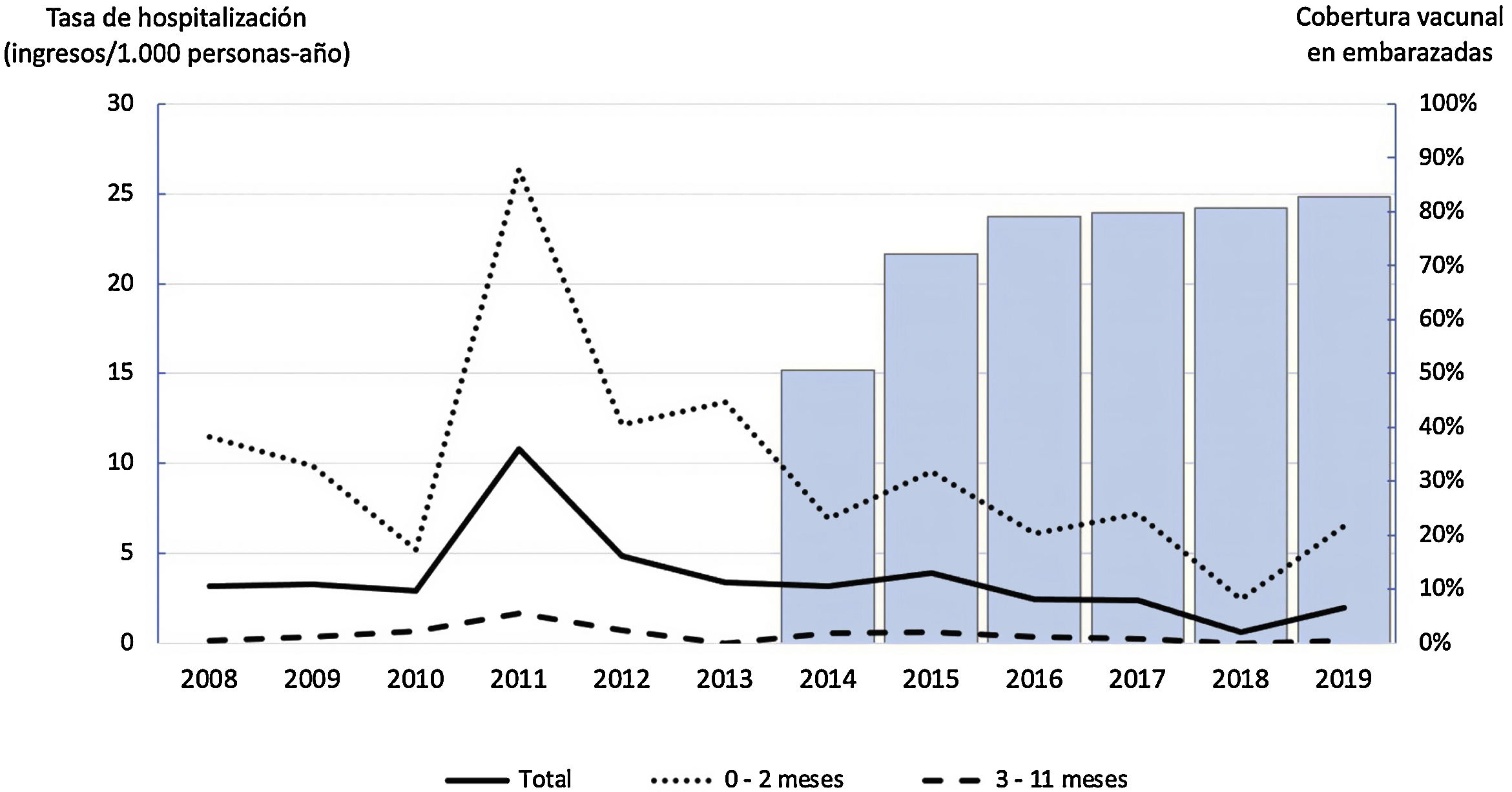
La recomendación de la vacunación frente a la tosferina en embarazadas se instauró en Cataluña en febrero del 2014. El objetivo del presente estudio fue comparar la tasa de hospitalización por tosferina en niños menores de un año de edad antes y después de la implantación del programa de vacunación.
MétodosEstudio observacional y retrospectivo de pacientes menores de un año ingresados con diagnóstico de tosferina. Se comparó la tasa de hospitalización del periodo previo al programa de vacunación (2008-2013) con la del periodo con programa de vacunación (2014-2019) en el total de menores de un año y en 2subgrupos: en menores de 3 meses y en lactantes de 3 a 11 meses.
ResultadosLa tasa de hospitalización fue significativamente menor en el periodo con programa de vacunación en menores de un año y en menores de 3 meses (2,43 vs. 4,72 por 1.000 personas-año y 6,47 vs. 13,11 por 1.000 personas-año, respectivamente). Las razones de tasas entre períodos fueron: 0,51 (IC del 95%, 0,36-0,73) para los menores de un año; 0,49 (IC del 95%, 0,32-0,75) para los menores de 3 meses y 0,56 (IC del 95%, 0,30-1,03) para los de 3-11 meses. No se observaron diferencias estadísticamente significativas en la gravedad de los cuadros clínicos de los pacientes entre ambos periodos.
ConclusiónLa instauración del programa de vacunación contra la tosferina en embarazadas se ha asociado a una menor tasa de hospitalización por tosferina de forma global en los menores de un año de edad y específicamente en los menores de 3 meses.
The recommendation for pertussis vaccination in pregnancy was established in Catalonia in February 2014. The objective of this study was to compare the hospitalization rate for pertussis in children under one year of age before and after the implementation of the vaccination program.
MethodsObservational and retrospective study of patients under one year of age admitted to hospital with a diagnosis of pertussis. The hospitalization rate of patients under one year of age of the period prior to the vaccination program (2008-2013) was compared with the period with vaccination program (2014-2019) in the total of children under one year of age and in 2subgroups: children under 3 months and between 3-11 months.
ResultsHospitalization rate was significantly lower in the period with vaccination program in children under one year of age and specifically in children under 3 months (2.43 vs. 4.72 per 1,000 person-years and 6.47 vs. 13.11 per 1,000 person-years, respectively). The rate ratios were: 0.51 (95% CI 0.36-0.73) for children under one year of age; 0.49 (95% CI 0.32-0.75) for those younger than 3 months and 0.56 (95% CI 0.30-1.03) for those with 3-11 months. No statistically significant differences were observed in the clinical severity between both periods.
ConclusionThe introduction of the pertussis vaccination program in pregnancy was associated with a global lower hospitalization rate for pertussis in children under one year of age and specifically in those under 3 months of age.
La tosferina es una infección respiratoria provocada principalmente por Bordetella pertussis (B. pertussis) y, en menor medida, Bordetella parapertussis (B. parapertussis). Los neonatos y lactantes tienen mayor riesgo de presentar complicaciones. La inmunidad natural y la vacunal, especialmente la que proporciona la vacuna acelular, tienen una duración limitada1,2. Por este motivo, algunas estrategias planteadas para prevenir la infección de los posibles contactos de los neonatos y lactantes consisten en sustituir la vacuna contra el tétanos y la difteria (Td) por la vacuna contra la difteria, el tétanos y la tosferina acelular de baja carga antigénica (dTpa) en los adolescentes, la vacunación sistemática del personal sanitario del área de Pediatría y Ginecología y la llamada estrategia del nido (cocoon strategy)1-4. Esta estrategia consiste en vacunar a los convivientes y contactos estrechos del recién nacido, pero conlleva problemas logísticos y su cumplimiento ha sido bajo en los países en los que se ha implantado1,4,5.
En el año 2011, ante los brotes acontecidos en Estados Unidos, el Advisory Committee on Immunization Practices de los Centers for Disease Control and Prevention recomendó la vacunación de las embarazadas con dTpa a partir de la semana 20 de gestación, a pesar de que no había evidencias científicas de la efectividad de esta estrategia6-8. En octubre del 2012 recomendó la vacunación en cada embarazo, independientemente del tiempo transcurrido desde la última dosis y en diciembre del mismo año especificó que el momento óptimo para administrar la vacuna era entre las semanas 27 y 36 de gestación9. Esta estrategia fue apoyada por el American College of Obstetricians and Gynecologists y la American Academy of Pediatrics10,11. Debido al aumento importante de las tasas de incidencia, hospitalización y mortalidad por tosferina en España y Cataluña en el periodo 2010-2013, el 1 de febrero del 2014 se instauró en Cataluña la estrategia de vacunación contra la tosferina con dTpa entre la semana 27 y 36 en cada embarazo2,12. Esta medida se generalizó progresivamente en toda España y en enero del 2016 todas las comunidades autónomas la habían adoptado12. La cobertura de la vacuna contra la tosferina en embarazadas en Cataluña fue del 50,6% en el año 2014, del 72,1% en 2015, del 79,1% en 2016 (Agència de Salut Pública de Catalunya, datos no publicados), del 79,9% en 2017, del 80,7% en 2018 y del 82,8% en 2019 (Ministerio de Sanidad13,14). En el análisis preliminar del impacto del programa de vacunación realizado por el Centro Nacional de Epidemiología12 se observó una disminución de la razón de la tasa de incidencia de los menores de 3 meses respecto a los niños de 3-11 meses, que se anticipó en el tiempo en las comunidades autónomas que habían implantado el programa de vacunación antes de junio del 2015.
La tosferina es una enfermedad de declaración obligatoria individualizada infranotificada en España, ya que algunos pacientes no buscan asistencia médica porque la clínica se resuelve espontáneamente y en otros casos el médico prescribe tratamiento antibiótico sin tomar muestras para estudio microbiológico. Por esta razón, el número de hospitalizaciones por tosferina es un indicador más fiable y válido que el número de casos declarados. El objetivo del presente estudio fue comparar la tasa de hospitalización por tosferina en menores de un año antes y después de la implantación del programa de vacunación de la embarazada en un centro pediátrico de referencia de Cataluña. Como objetivo secundario se analiza si los cuadros clínicos de los pacientes menores de un año ingresados por tosferina cuyas madres habían sido vacunadas fueron más leves que los de los hijos de madres no vacunadas.
MétodosEstudio observacional y retrospectivo de los pacientes menores de un año ingresados en el Hospital Infantil Vall d’Hebron con diagnóstico de tosferina confirmado microbiológicamente mediante reacción en cadena de la polimerasa (PCR) o cultivo en un periodo de 12 años (enero del 2008-diciembre del 2019), que incluye los 6 años previos a la introducción del programa de vacunación contra la tosferina en embarazadas (2008-2013) y los 6 años posteriores a su introducción (2014-2019). Los pacientes derivados al hospital desde otras áreas sanitarias se excluyeron del análisis. La información sobre la población menor de un año del área de referencia del Hospital Infantil Vall d’Hebron fue facilitada por el Servicio de Gestión de la Información e Innovación del centro.
Se calculó la tasa de hospitalización por tosferina en menores de un año en el período previo al programa de vacunación y en el período con programa de vacunación. Dicha tasa se determinó para el total de menores de un año y para 2subgrupos: menores de 3 meses y pacientes de 3-11 meses. Además, para cada año se calculó la tasa de hospitalización por grupos de edad. Como denominador se utilizó el total de personas-año de los respectivos años y periodos. El total de personas-año en cada periodo se calculó como la suma de personas-año de los 6 años correspondientes. El número de personas-año menores de 3 meses se estimó como la cuarta parte del número de personas-año del año correspondiente. Para cada grupo de edad se calculó la razón de tasas entre el período anterior y posterior al inicio del programa de vacunación y su intervalo de confianza del 95% (IC del 95%). Se estudió la correlación entre la cobertura vacunal en embarazadas en Cataluña y las tasas de hospitalización mediante el coeficiente de correlación de Spearman.
Asimismo, se compararon las características demográficas y clínicas de los pacientes ingresados en el período previo al programa de vacunación respecto a los ingresados en el período con programa vigente, y las de los pacientes ingresados durante el período con programa de vacunación (2014-2019) cuyas madres no habían recibido la vacuna durante el embarazo con las de los pacientes cuyas madres sí la habían recibido. Los pacientes se consideraron expuestos a la vacunación materna cuando la vacuna se había administrado como mínimo 14 días antes del parto. Los parámetros de gravedad analizados fueron: ingreso en la Unidad de Cuidados Intensivos Pediátricos (UCIP), convulsión, apnea, neumonía, neumotórax, hipertensión pulmonar, requerimiento de oxigenoterapia, ventilación mecánica no invasiva, ventilación mecánica invasiva (VMI), requerimiento de leucorreducción, requerimiento de oxigenación por membrana extracorpórea y fallecimiento.
Para estimar la asociación entre variables categóricas se utilizó la prueba exacta de Fisher y para estimar la asociación entre variables continuas se utilizó la prueba U de Mann-Whitney. El nivel de significación estadística se estableció en p < 0,05. Para el análisis estadístico se utilizó el programa Microsoft Excel versión 15.12.3 para Mac, el R Statistical Software versión 3.5.1 para Mac15 y el programa OpenEpi versión 3.01.16.
El estudio fue aprobado por el Comité Ético de Investigación Clínica del Hospital Universitari Vall d’Hebron (código PR_AMI_289-2012).
ResultadosEn los 12 años estudiados (2008-2019) ingresaron en el Hospital Infantil Vall d’Hebron Barcelona Hospital Campus 143 pacientes menores de un año de edad con diagnóstico de tosferina confirmado microbiológicamente. Todos los casos fueron confirmados por PCR; de los 143 casos positivos, 131 (91,6%) lo fueron para B. pertussis y 12 (8,4%) para B. parapertussis. En el 78,3% de los pacientes también se había recogido muestra respiratoria para cultivo y en el 53,6% de estos se aisló B. pertussis; en ningún cultivo se aisló B. parapertussis y el 11,2% de las muestras no fueron válidas.
De los 143 pacientes, 95 ingresaron durante el período previo al programa de vacunación (2008-2013) y 48 tras la instauración de dicho programa (2014-2019). Tal y como se observa en la tabla 1, el riesgo relativo de hospitalización fue menor en el período con programa de vacunación respecto al previo y la diferencia fue estadísticamente significativa tanto en los menores de un año de edad de forma global, como en el subgrupo de menores de 3 meses, pero no en el subgrupo de 3-11 meses. La tasa de hospitalización disminuyó un 49% en los menores de un año y un 51% en los menores de 3 meses. En la tabla 1s (anexo, material suplementario) se muestra la evolución anual de la tasa de hospitalización por grupos de edad, y en la figura 1 se representa gráficamente dicha información junto con la cobertura vacunal con dTpa en embarazadas en Cataluña. Se ha observado una correlación inversa entre la cobertura vacunal en embarazadas y las tasas de hospitalización, siendo estadísticamente significativa en el total de niños y en el subgrupo de menores de 3 meses (total de niños: rho = –0,73, p = 0,006; menores de 3 meses: rho = –0,66, p = 0,02; 3-11 meses: rho = –0,37, p = 0,239). No hubo diferencias estadísticamente significativas en el número de dosis de DTPa que habían recibido los lactantes de ambos períodos.
Tasa de hospitalización por tosferina por 1.000 personas-año en el período anterior y posterior a la implantación del programa de vacunación, según grupos de edad
| Período 2008-2013 | Período 2014-2019 | ||
|---|---|---|---|
| Total | Casos | 95 | 48 |
| 0-11 meses | Casos | 95 | 48 |
| Personas-año | 20.141 | 19.770 | |
| Tasa | 4,72 | 2,43 | |
| Razón de tasas (IC del 95%) | 1 | 0,51 (0,36-0,73) | |
| 0-2 meses | Casos | 66 | 32 |
| Personas-año | 5.035 | 4.942 | |
| Tasa | 13,11 | 6,47 | |
| Razón de tasas (IC del 95%) | 1 | 0,49 (0,32-0,75) | |
| 3-11 meses | Casos | 29 | 16 |
| Personas-año | 15.106 | 14.828 | |
| Tasa | 1,92 | 1,08 | |
| Razón de tasas (IC del 95%) | 1 | 0,56 (0,30-1,03) |
IC del 95%: intervalo de confianza del 95%.
En la tabla 2 se presentan las características demográficas y clínicas de los pacientes ingresados en ambos períodos del estudio. Al comparar las características de los pacientes del período sin programa versus el periodo con programa, observamos que fueron prematuros 16 (16,84%; de 26-36 semanas de gestación) vs. 8 (16,67%; de 28-36 semanas de gestación), ingresaron en la UCIP 11 (11,58%) vs. 5 (10,42%) y precisaron VMI 4 (4,21%) vs. 2 (4,17%), respectivamente. Ningún paciente del área de referencia del hospital falleció por tosferina en los 12 años analizados. Así, no se observaron diferencias estadísticamente significativas en las características demográficas y clínicas de los pacientes de ambos períodos, lo que significa que los pacientes del período con programa de vacunación no presentaron cuadros más leves.
Características demográficas y clínicas de los pacientes ingresados en el periodo anterior y posterior a la implantación del programa de vacunación
| Período 2008-2013 (n = 95) | Período 2014-2019 (n = 48) | p | |
|---|---|---|---|
| Edad en días, mediana (RIC) | 61 (43-100,5) | 68 (46,75-107,5) | 0,596 |
| Sexo masculino, n (%) | 54 (56,84) | 26 (54,17) | 0,859 |
| Prematuridad, n (%) | 16 (16,84) | 8 (16,67) | 1 |
| Ninguna vacuna DTPa, n (%) | 64 (67,37) | 32 (66,67) | 1 |
| 1 dosis DTPa, n (%) | 29 (30,53) | 14 (29,16) | 1 |
| 2 dosis DTPa, n (%) | 2 (2,10) | 2 (4,17) | 0,602 |
| Mediana de días de ingreso (RIC) | 6 (4-8,5) | 5 (4-6) | 0,404 |
| Ingresados en UCIP, n (%) | 11 (11,58) | 5 (10,42) | 1 |
| Mediana de días de ingreso en UCIP, de los que ingresaron en UCIP (RIC) | 5 (3-9) | 6 (4-9) | 0,728 |
| Convulsión, n (%) | 0 (0) | 0 (0) | |
| Apnea, n (%) | 39 (41,05) | 16 (33,33) | 0,467 |
| Neumonía, n (%) | 9 (9,47) | 2 (4,17) | 0,335 |
| Neumotórax, n (%) | 0 (0) | 0 (0) | |
| Hipertensión pulmonar, n (%) | 2 (2,10) | 0 (0) | 0,551 |
| Oxigenoterapia, n (%) | 32 (33,68) | 15 (31,25) | 0,851 |
| Mediana de días de oxigenoterapia, de los que precisaron oxigenoterapia (RIC) | 5 (2-9,25) | 4 (4-5) | 1 |
| VMNI, n (%) | 1 (1,05) | 1 (2,08) | 1 |
| VMI, n (%) | 4 (4,21) | 2 (4,17) | 1 |
| Leucorreducción (exanguinotransfusión), n (%) | 3 (3,16) | 0 (0) | 0,551 |
| ECMO, n (%) | 0 (0) | 0 (0) | |
| Defunción, n (%) | 0 (0) | 0 (0) |
DTPa: vacuna frente a difteria, tétanos y tosferina acelular; ECMO: oxigenación por membrana extracorpórea; RIC: rango intercuartílico; UCIP: Unidad de Cuidados Intensivos Pediátricos; VMI: ventilación mecánica invasiva; VMNI: ventilación mecánica no invasiva.
De los 48 pacientes ingresados por tosferina en el período con programa de vacunación, solo 18 (37,5%) eran hijos de madres vacunadas durante la gestación (tabla 3). Las 18 madres habían recibido la vacuna frente a la tosferina entre la semana 27 y 36 de gestación, de acuerdo con las recomendaciones. Al comparar las características de los 30 hijos de madres no vacunadas durante el embarazo respecto a los 18 hijos de madres vacunadas se observa, respectivamente, que fueron prematuros 4 (13,33%; de 28-34 semanas de gestación) vs. 3 (16,67%; de 34-36 semanas de gestación), ingresaron en la UCIP 3 (10%) vs. 2 (11,11%) y precisaron VMI 1 (3,33%) vs. 1 (5,56%). Así, durante el período con programa de vacunación no se observaron diferencias estadísticamente significativas en las características demográficas y clínicas entre ambos grupos de pacientes, no siendo más leves los cuadros de los hijos de madres vacunadas durante el embarazo.
Características demográficas y clínicas de los pacientes ingresados en el periodo 2014-2019 según el antecedente de vacunación de la madre durante el embarazo
| Hijos de madres no vacunadas (n = 30) | Hijos de madres vacunadas (n = 18) | p | |
|---|---|---|---|
| Edad en días, mediana (RIC) | 69,5 (47-105,75) | 67 (45,25-105,75) | 0,912 |
| Sexo masculino, n (%) | 16 (53,33) | 10 (55,55) | 1 |
| Prematuridad, n (%) | 4 (13,33) | 3 (16,67) | 1 |
| Ninguna vacuna DTPa, n (%) | 21 (70,00) | 11 (61,11) | 0,545 |
| 1 dosis DTPa, n (%) | 8 (26,67) | 6 (33,33) | 0,746 |
| 2 dosis DTPa, n (%) | 1 (3,33) | 1 (5,56) | 1 |
| Mediana de días de ingreso (RIC) | 5 (4-5,75) | 4,5 (3-6) | 0,764 |
| Ingresados en UCIP, n (%) | 3 (10,00) | 2 (11,11) | 1 |
| Mediana de días de ingreso en UCIP, de los que ingresaron en UCIP (RIC) | 6 (4-7,5) | 12,5 (8,25-16,75) | 0,8 |
| Apnea, n (%) | 11 (36,67) | 5 (27,78) | 0,753 |
| Neumonía, n (%) | 2 (6,66) | 0 (0) | 0,521 |
| Oxigenoterapia, n (%) | 9 (30,00) | 6 (33,33) | 1 |
| Mediana de días de oxigenoterapia, de los que precisaron oxigenoterapia (RIC) | 4 (4-5) | 4 (2,5-4,75) | 0,596 |
| VMNI, n (%) | 0 (0) | 1 (5,56) | 0,375 |
| VMI, n (%) | 1 (3,33) | 1 (5,56) | 1 |
DTPa: vacuna frente a difteria, tétanos y tosferina acelular; RIC: rango intercuartílico; UCIP: Unidad de Cuidados Intensivos Pediátricos; VMI: ventilación mecánica invasiva; VMNI: ventilación mecánica no invasiva.
No hubo diferencias estadísticamente significativas en el número de dosis de DTPa que habían recibido los lactantes comparándolos por períodos y por el antecedente de vacunación materna. Todos los casos graves que requirieron ingreso en la UCIP, con o sin VMI, correspondieron a pacientes que no habían recibido ninguna dosis de DTPa, independientemente del antecedente de vacunación materna.
DiscusiónEl presente estudio muestra una disminución de la tasa de hospitalización por tosferina en el período con programa de vacunación de la embarazada respecto al período previo en el conjunto de menores de un año y en el subgrupo de menores de 3 meses, con una reducción del 49 y el 51%, respectivamente. La diferencia no fue estadísticamente significativa para el subgrupo de 3-11 meses, en el que la primovacunación es el principal factor protector17. Estos datos están en consonancia con los hallazgos de otros estudios, como el de Chong-Valvuena et at.18, que mostró una disminución del 71% de la tasa de hospitalización en menores de 3 meses, pero no en los lactantes de 3-11 meses, en la provincia de Castellón. La mayor disminución de la tasa respecto a nuestro estudio podría deberse a que la cobertura vacunal en embarazadas era mayor (87,4%). Del mismo modo, el estudio de Gentile et al.19 mostró una disminución de la tasa de hospitalización del 47,6% en menores de un año tras la instauración del programa de vacunación en embarazadas en Argentina. Dicho estudio también señala que los pacientes tenían una edad media mayor y que no hubo ningún fallecimiento en el periodo con programa, pero no se modificaron los días de hospitalización ni la necesidad de ingreso en la UCIP. En un estudio llevado a cabo en California por Winter et al.20 se observó que los hijos de madres vacunadas presentaron cuadros clínicos más leves y menor riesgo de ser hospitalizados e ingresados en la UCIP, que estuvieron menos días hospitalizados y que ninguno precisó VMI ni falleció. Al analizar a los pacientes hospitalizados en el período con programa de vacunación, en nuestro estudio no observamos cuadros clínicos significativamente más leves en los hijos de madres vacunadas respecto a los de madres no vacunadas. Tampoco encontramos diferencias en la gravedad de los pacientes comparando ambos periodos. Estos resultados podrían deberse a que el número de pacientes con complicaciones en la muestra es relativamente bajo.
En el periodo de 12 años analizados en nuestro estudio se han registrado en España 3ondas epidémicas de tosferina12. En 2008, primer año incluido en nuestro estudio, se produjo el pico de la primera onda epidémica de este período, con tasas de incidencia y hospitalización muy inferiores a las de las 2siguientes. La segunda onda epidémica se inició en el año 2010 y alcanzó el pico en 2011, con una tasa de incidencia de 1,98 por 1.000 habitantes en menores de un año y de 5,39 por 1.000 habitantes en menores de 3 meses, y una tasa de hospitalización de 2,06 por 1.000 habitantes en menores de un año y de 6,66 por 1.000 habitantes en menores de 3 meses dicho año. La tercera onda epidémica fue de mayor magnitud que las anteriores, se inició en 2014 y en 2015 la tasa de incidencia alcanzó los 4,57 por 1.000 habitantes en menores de un año y los 11,14 por 1.000 habitantes en menores de 3 meses, con una tasa de hospitalización de 3,16 por 1.000 habitantes en menores de un año y de 9,97 por 1.000 habitantes en menores de 3 meses12. En nuestro estudio, en el año 2008, pico de la primera onda epidémica, registramos una tasa de hospitalización de 3,15 por 1.000 habitantes en menores de un año y de 11,45 por 1.000 habitantes en menores de 3 meses. Se produjo una tendencia a la disminución hasta que, en 2011, pico de la segunda onda epidémica, obtuvimos las tasas de hospitalización más elevadas, de 10,78 por 1.000 habitantes en menores de un año y de 26,35 por 1.000 habitantes en menores de 3 meses. Se observa un descenso progresivo hasta el año 2014, con tasas de 3,16 por 1.000 habitantes en menores de un año y 6,90 por 1.000 habitantes en menores de 3 meses. Posteriormente, hubo una discreta elevación en relación con la tercera onda epidémica, pero sin aproximarse a los valores de la segunda onda, siendo de 3,88 por 1.000 habitantes en menores de un año y de 9,55 por 1.000 personas en menores de 3 meses en 2015. El hecho de que la tercera onda fuera la de mayor magnitud en España y, en cambio, fue la de menor repercusión en nuestra área podría ser consecuencia de la instauración más temprana del programa de vacunación en embarazadas en Cataluña respecto al resto de las comunidades autónomas. Se observa una correlación negativa entre la cobertura vacunal y las tasas de hospitalización, siendo estadísticamente significativa en el total de niños y en el subgrupo de menores de 3 meses.
Las tasas de hospitalización en el presente estudio son mayores que las registradas a nivel estatal. Esto puede deberse a que el centro hospitalario se localiza en el área metropolitana de Barcelona, donde hay una elevada densidad de población que favorece los contagios ante brotes epidémicos.
El momento idóneo para administrar la vacuna es el tercer trimestre del embarazo buscando el paso óptimo de anticuerpos2,21. El paso de anticuerpos al feto en el tercer trimestre es progresivo a medida que avanzan las semanas de gestación, por lo que los recién nacidos prematuros podrían no beneficiarse o beneficiarse en menor medida según el grado de prematuridad. Por esta razón, ante la amenaza de parto prematuro sería preferible administrar la vacuna en el segundo trimestre del embarazo sin esperar al tercer trimestre. Por otra parte, la vacunación de la gestante proporciona inmunidad a la principal fuente de contagio en los menores de un año22. Estudios observacionales de tipo ecológico que comparan la incidencia de tosferina en lactantes de madres vacunadas con la cobertura vacunal en las embarazadas estiman una efectividad vacunal superior al 75%23-26. La vacuna contra la tosferina, que es inactivada, ha demostrado ser segura tanto para la gestante como para el feto21,27.
Los últimos datos publicados sobre coberturas vacunales a nivel estatal hacen referencia al año 2019 y, sin disponer de datos de Aragón, Asturias y las Islas Canarias, la cobertura global fue del 83,6%. Las comunidades autónomas que registraron las coberturas más bajas fueron Cantabria (55,8%) y las Islas Baleares (66,2%); la ciudad autónoma de Ceuta registró una cobertura de tan solo el 60%14. La ausencia de control médico durante el embarazo o la omisión de la pertinente información a la embarazada por parte del obstetra, médico de familia o matrona pueden ser causas de que una gestante no reciba la vacuna28,29. Por otra parte, la embarazada puede rechazar la vacunación por desconfiar de la seguridad de la vacuna en su estado o por no creer necesaria la prevención de esta infección. Así, son muchos los factores que pueden influir en la cobertura vacunal y deberíamos indagar en ellos mediante, por ejemplo, encuestas a embarazadas, para diseñar estrategias a fin de mejorarla, como se hizo en el Hospital Universitario La Paz30, donde observaron que el 86% de las gestantes que no había recibido la vacuna no habían sido informadas sobre su indicación y solo el 8% la habían rechazado; destaca también que un 6% de ellas fueron vacunadas a petición propia sin recomendación previa por parte de ningún profesional sanitario. En cualquier caso, la cobertura de vacunación contra la tosferina en embarazadas en nuestro medio es mejorable y se deberían definir estrategias para optimizarla.
Este estudio tiene ciertas limitaciones, como haber sido realizado en un único centro. Asimismo, existe la posibilidad de que algunos niños con tosferina del área de referencia del hospital hayan sido hospitalizados en centros privados. En Cataluña, la estrategia de vacunación frente a la tosferina en embarazadas se inició el 1 de febrero del 2014 (año incluido en el periodo con programa de vacunación), por lo que los pacientes nacidos en los primeros meses de ese año no estaban expuestos al programa de vacunación y, por este motivo, los resultados del estudio podrían infraestimar el impacto del programa. Sería interesante realizar nuevos estudios que analicen las características de los pacientes ingresados por tosferina cuyas madres hayan recibido la vacuna durante la gestación, pero este grupo es reducido, probablemente debido a la efectividad del programa de vacunación.
En conclusión, la instauración del programa de vacunación frente a la tosferina en embarazadas se asoció con una menor tasa de hospitalización por tosferina en menores de un año de edad y en menores de 3 meses de edad en el Hospital Infantil Vall d’Hebron de Barcelona. No se observaron diferencias estadísticamente significativas en la gravedad de la enfermedad entre los hijos de madres vacunadas y no vacunadas. Estos resultados están en consonancia con otros estudios y apoyan la recomendación de numerosas sociedades científicas de vacunar frente a la tosferina a las mujeres en el tercer trimestre de cada embarazo. A pesar de que se alcancen altas coberturas vacunales en embarazadas habrá que mantener la sospecha diagnóstica ante casos sospechosos, pues el riesgo de contagio no desaparecerá por completo y la tosferina es una enfermedad infecciosa potencialmente grave, especialmente en los lactantes más pequeños.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
La presente investigación no ha sido presentada previamente en reuniones, congresos ni simposios.