Paciente de 61 años que acude a Urgencias por dolor en el ojo derecho tras entrada de cuerpo extraño hace una semana mientras realizaba tareas en el campo. Como antecedentes oftalmológicos destacan el diagnóstico de retinopatía diabética bilateral en tratamiento con terapia antiangiogénica intravítrea y glaucoma crónico simple controlado con tratamiento tópico.
Durante la exploración se observa úlcera corneal paracentral a 8 horas, con infiltrados estromales satélites. Se etiqueta como queratitis infecciosa, se recoge muestra de exudado corneal para cultivo, se pauta tratamiento con tobramicina (3mg/ml, 1 gota/6h) y moxifloxacino (5mg/ml, 1 gota/12h) y se cita para revisión. La paciente acude a las 48 horas y se observa que no existe mejoría, siendo negativo el cultivo del exudado. Se inicia tratamiento con corticoides, ciclopléjico, colirios fortificados de vancomicina (25mg/ml, 1 gota/4h) y ceftazidima 5% (50mg/ml, 1 gota/4h) y, ante la sospecha de queratitis fúngica, se pauta voriconazol tópico (10mg/ml, 1 gota/en pauta descendente/ 2-4-6h durante 5 días en cada posología). Transcurridas dos semanas no se obtiene respuesta satisfactoria, la úlcera ha aumentado de tamaño y el infiltrado se ha hecho más profundo, con aumento del edema estromal y endotelial, por lo que se programa queratoplastia penetrante. Durante la intervención se toman muestras de líquido, estroma y raspado corneal, enviándose al laboratorio de Microbiología. La paciente mantuvo el mismo tratamiento durante los 3 meses posteriores a la intervención, presentando una progresiva mejoría en el aspecto del injerto y una epitelización completa. En la última exploración realizada a los 8 meses de la queratoplastia, se mantenía una buena evolución y una agudeza visual con corrección de 0,500.
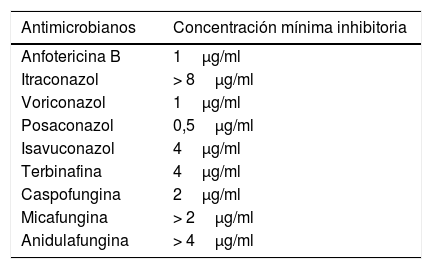
En el cultivo del raspado corneal se aisló un hongo filamentoso, siendo el resto de los cultivos negativos. Dicho hongo se envía al Centro Nacional de Microbiología, donde se identificó por métodos moleculares mediante la secuenciación de la región internal transcribed spacer según el procedimiento previamente descrito1. La cepa fue identificada molecularmente como Albifimbria verrucaria(A. verrucaria) (N.° de acceso a Genbank: MK946705 con un porcentaje de similitud del 99,9% con la secuencia de internal transcribed spacer de la cepa tipo A. verrucaria (KU845893). El estudio de sensibilidad se llevó a cabo siguiendo las recomendaciones del European Committee on Antimicrobial Susceptibility Testing (EUCAST)2. Los resultados del antifungigrama se muestran en la tabla 1. Dado que no existen puntos de corte establecidos, no se pueden interpretar las concentraciones mínimas inhibitorias.
Estudio de sensibilidad del aislado de Albifimbria verrucaria
| Antimicrobianos | Concentración mínima inhibitoria |
|---|---|
| Anfotericina B | 1μg/ml |
| Itraconazol | > 8μg/ml |
| Voriconazol | 1μg/ml |
| Posaconazol | 0,5μg/ml |
| Isavuconazol | 4μg/ml |
| Terbinafina | 4μg/ml |
| Caspofungina | 2μg/ml |
| Micafungina | > 2μg/ml |
| Anidulafungina | > 4μg/ml |
A. verrucaria, antes denominada Myrothecium verrucaria, es un hongo saprófito de distribución mundial que habita tanto el suelo como la materia vegetal en descomposición3. Se trata de un hongo con importante actividad fitopatógena3, habiendo sido identificado recientemente en dos casos de queratitis micótica4,5. Refojo et al.5 analizan 157 queratitis, identificándose un caso por Myrothecium spp. Asimismo, Rameshkumar et al.4 describen un caso de queratitis por M. verrucaria, el paciente no respondió al tratamiento tópico con natamicina (5%) y voriconazol (1%), teniendo que realizarse una queratoplastía. Ninguno de los trabajos analiza la evolución clínica ni los resultados del antifungigrama.
A. verrucaria puede sintetizar una serie de micotoxinas, como los tricotocenos3, capaces de causar efecto citotóxico en las células animales, pudiendo afectar a la síntesis proteica, al sistema inmune y a los macrófagos alveolares6. Se ha demostrado que los tricotocenos inhiben la síntesis proteica de las células eucariotas al unirse a la subunidad 60S del ribosoma e interactuar con la enzima peptidiltransferasa7.
Las especies del género Albifimbria se caracterizan por la falta de esporulación y su lento crecimiento en los medios de cultivo4, lo que dificulta el diagnóstico microbiológico convencional y hace necesario recurrir a técnicas de biología molecular. El manejo de este tipo de infecciones conlleva la aplicación de antifúngicos tópicos (natamicina o voriconazol), siendo necesaria la intervención quirúrgica en los casos en que no exista respuesta a tratamiento4. Por tanto, ante lesiones oculares lacerantes y/o penetrantes causadas por materia vegetal o similar, la infección micótica debería ser contemplada en todos los casos. Además, dada la dificultad diagnóstica que conllevan algunas especies de hongos filamentosos, frente a una infección fúngica demostrada clínica y microbiológicamente, es recomendable realizar la identificación y el estudio de sensibilidad en un centro de referencia, en el caso de España el Centro Nacional de Microbiología.