Los pacientes con cáncer pueden constituir un especial grupo de riesgo para el desarrollo de endocarditis infecciosa (EI) debido a que frecuentemente están sometidos a maniobras invasivas. Nuestro objetivo es conocer cuál es el perfil diferencial y el pronóstico de los pacientes con EI y cáncer.
MétodosEstudio observacional retrospectivo de todos los pacientes con EI diagnosticados consecutivamente en un hospital entre 2005 y 2015. Se realiza un análisis comparativo entre los pacientes con enfermedad oncológica y sin ella, así como un seguimiento a largo plazo.
ResultadosSe diagnosticaron 208 casos de EI, de los cuales 32 sufrían enfermedad oncológica. No hubo diferencias significativas en cuanto a la edad (67,5 [59,2-74] vs. 64 [51-74] años), y la comorbilidad estimada por el índice de Charlson fue similar cuando no se consideró el propio diagnóstico de cáncer (4 [2,2-5] vs. 3,9 [2-5]). Se relacionó principalmente con la asistencia sanitaria (59,5% vs. 24,4%, p<0,001), predominó Staphylococcus aureus como agente causal (35%) y la localización tricuspídea fue 3 veces más frecuente (18,8% vs. 6,2%). Un 18,7% de pacientes no se intervinieron quirúrgicamente a pesar de tener indicación, frente al 7,4% de pacientes sin cáncer. La mortalidad intrahospitalaria alcanzó el 45,5% en pacientes con cáncer y la probabilidad de supervivencia al año fue del 40%.
ConclusionesLa EI en pacientes con cáncer está predominantemente causada por estafilococos y presenta una elevada mortalidad precoz. A pesar de que se relaciona frecuentemente con la asistencia sanitaria, los pacientes se ven limitados desde el punto de vista terapéutico.
Cancer patients may constitute a special risk group for the development of infective endocarditis (IE) because they are often subjected to invasive procedures. The aim of this study is to determine the differential clinical profile and prognosis of patients with IE and cancer.
MethodsA retrospective observational study was conducted on all patients consecutively diagnosed with IE in a single centre between 2005 and 2015. A comparative analysis was performed between patients with cancer and those free of disease, as well as a long-term follow-up.
ResultsThere were 208 IE cases, of which 32 had a cancer diagnosis. There were no significant differences in age (67.5 [59.2-74] vs. 64 [51-74] years). The Charlson comorbidity index was same whether cancer was diagnosed or not (4 [2.2-5] vs. 3.9 [2-5]). IE in cancer patients was mainly associated with health care (59.5% vs 24.4%, P<.001). Staphylococcus aureus was the main causative agent (35%), and the tricuspid location was three times more common (18.8% vs. 6.2%). Surgery was not performed in 18.7% of patients, despite having an indication, compared with 7.4% of patients without cancer. In-hospital mortality for cancer patients was 45.5%, and the probability of survival at one year was 40%.
ConclusionsIE in patients with cancer is predominantly caused by staphylococci, and has high early mortality. Although it is often related to health care, patients are limited from the therapeutic point of view.
La endocarditis infecciosa (EI) es una enfermedad grave cuya epidemiología ha cambiado drásticamente en las últimas décadas, pasando de ser un proceso propio de sujetos jóvenes y con valvulopatía reumática a una complicación que afecta a un número cada vez mayor de pacientes con alta comorbilidad, sometidos a exámenes y tratamientos invasivos1. Es de suponer que los enfermos con patología oncológica son un grupo especial de riesgo, ya que representan una proporción creciente de los pacientes atendidos en el entorno sanitario. No solo las bacteriemias estafilocócicas por catéter suponen una especial amenaza2; la endocarditis puede estar en relación directa con el cáncer y llevar a su diagnóstico, como en el caso del adenocarcinoma de colon3-5. Por otra parte, existen formas de endocarditis no infecciosas (endocarditis trombótica no bacteriana) que pueden confundir al especialista y obligan a afinar el diagnóstico en estos enfermos.
El diagnóstico de cáncer tiene aún connotaciones incluso entre el colectivo médico que pueden llevar a tomar actitudes terapéuticas diferentes de las que se tomarían en ausencia de la enfermedad.
El objetivo de nuestro trabajo es averiguar cuál es la forma de presentación y el perfil microbiológico diferencial de los pacientes con EI y cáncer e investigar su pronóstico a corto y largo plazos.
MétodosPacientesRealizamos un estudio retrospectivo de todos los enfermos diagnosticados de forma consecutiva de EI en el Hospital Universitario Nuestra Señora de Candelaria, en Santa Cruz de Tenerife, entre enero de 2005 y septiembre de 2015. Nuestro centro atiende a una población aproximada de 600.000 habitantes que incluye la mayor parte de la isla de Tenerife y es centro de referencia para las islas de El Hierro y La Gomera.
Existe una base de datos en la que se incorporan de forma sistemática todos los enfermos con diagnóstico de EI al ingreso o que la desarrollan durante su estancia hospitalaria. Incluye variables clínicas, microbiológicas, ecocardiográficas y las complicaciones que tienen lugar durante el transcurso de la enfermedad.
DefinicionesTodos los pacientes deben cumplir criterios de EI posible o definitiva siguiendo los criterios de Duke modificados6. Las endocarditis recurrentes incluyen las recaídas (infección por el mismo microorganismo del episodio inicial) y nuevas infecciones por un microorganismo diferente o por el mismo después de 2 meses de finalizado el tratamiento antibiótico7. La EI aguda se define como aquel episodio de menos de 2 semanas de evolución desde la aparición de los primeros signos y síntomas. La comorbilidad se calcula usando el índice de Charlson8, y realizamos un cálculo corregido de este índice restando la puntuación que aporta el propio proceso oncológico (Charlson-C). Se considera el desarrollo de insuficiencia renal aguda siguiendo los criterios RIFLE9. Consideramos las clases III y IV de la New York Heart Association (NYHA) cuando hablamos del desarrollo de insuficiencia cardiaca. El embolismo cerebral o periférico debe constatarse mediante pruebas de imagen (TAC, RM o ecografía). La cirugía urgente se define como aquella que no se demoró más de 24h tras el establecimiento de la indicación. El riesgo quirúrgico se calcula en los pacientes con indicación de cirugía según las guías vigentes de la European Society of Cardiology (ESC)10,11 usando la escala EuroSCORE II12. La adecuación del tratamiento antibiótico se refiere al cumplimiento de las guías vigentes de la ESC y es valorada por un especialista independiente, como anteriormente ha sido publicado13.
Los pacientes con cáncer incluyen a aquellos con enfermedad metastásica/no metastásica, a los pacientes bajo tratamiento quimioterápico curativo (adyuvante o neoadyuvante), a aquellos con quimioterapia paliativa y a los que se encuentran con soporte sin quimioterapia.
Consideramos que existe neutropenia cuando el recuento de neutrófilos es menor a 1.000células/mm3.
Variables de estudio y análisis estadísticoSe comparan las características clínicas, microbiológicas, ecocardiográficas y la evolución intrahospitalaria (mortalidad y complicaciones derivadas de la enfermedad) de los pacientes con EI y diagnóstico de cáncer previo o en los que se diagnostica la enfermedad durante el episodio de endocarditis con los pacientes con EI sin diagnóstico de cáncer.
Se utiliza el test de Kolmogorov-Smirnov para comprobar si las variables continuas siguen una distribución normal. Se expresan como media (desviación estándar) o como mediana (rango intercuartílico) según proceda, y se comparan con el test de la t de Student o el de la U de Mann-Whitney.
Las variables categóricas se representan como número absoluto (porcentaje) y se comparan con el test de la Chi-cuadrado, empleando el test exacto de Fisher cuando es necesario.
Para el grupo de pacientes con endocarditis y procesos oncológicos asociados se calcula la curva de supervivencia a través del método de Kaplan-Meier.
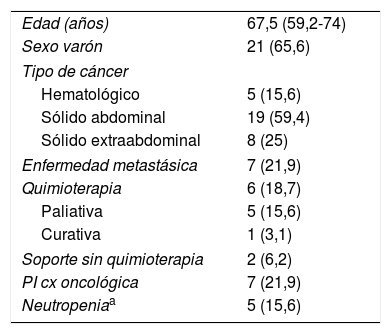
ResultadosEn el periodo de estudio se diagnosticaron 208 casos de EI, de los cuales 32, además, tenían un diagnóstico de enfermedad oncológica. Las características de los pacientes con cáncer se muestran en la tabla 1. Predominaban los tumores sólidos abdominales con un 59,4% de los casos; de ellos, los adenocarcinomas colorrectales constituyeron el 42%. La mayoría de los pacientes no presentaban enfermedad avanzada, un 18,8% estaban bajo tratamiento activo y en solo un 15,6% de enfermos se comprobó la existencia de neutropenia en el momento del diagnóstico de la EI.
Características de los pacientes con cáncer
| Edad (años) | 67,5 (59,2-74) |
| Sexo varón | 21 (65,6) |
| Tipo de cáncer | |
| Hematológico | 5 (15,6) |
| Sólido abdominal | 19 (59,4) |
| Sólido extraabdominal | 8 (25) |
| Enfermedad metastásica | 7 (21,9) |
| Quimioterapia | 6 (18,7) |
| Paliativa | 5 (15,6) |
| Curativa | 1 (3,1) |
| Soporte sin quimioterapia | 2 (6,2) |
| PI cx oncológica | 7 (21,9) |
| Neutropeniaa | 5 (15,6) |
Los datos representan n (%) o mediana (rango intercuartílico).
PI cx oncológica: postoperatorio inmediato cirugía oncológica.
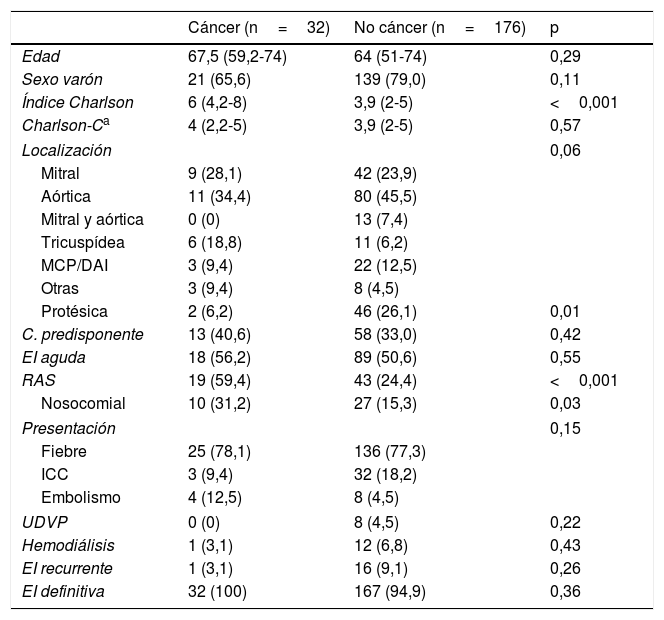
En la tabla 2 se resumen las características clínicas por grupos en el momento del diagnóstico. No existían diferencias significativas en cuanto a edad, sexo o síntoma predominante de presentación. Los enfermos con diagnóstico de cáncer tenían un índice de comorbilidad de Charlson más alto. Sin embargo, esta diferencia desapareció cuando se eliminó el propio diagnóstico de cáncer de la puntuación. La proporción de casos relacionados con la atención sanitaria fue significativamente mayor, especialmente debido a infecciones nosocomiales. Hubo un elevado porcentaje de enfermos con endocarditis previa en el grupo de pacientes sin cáncer, siendo reinfecciones en 14 casos y recaídas en otros 2. El caso de recurrencia del paciente con cáncer se trataba de una reinfección.
Características clínicas diferenciales en el momento del diagnóstico
| Cáncer (n=32) | No cáncer (n=176) | p | |
|---|---|---|---|
| Edad | 67,5 (59,2-74) | 64 (51-74) | 0,29 |
| Sexo varón | 21 (65,6) | 139 (79,0) | 0,11 |
| Índice Charlson | 6 (4,2-8) | 3,9 (2-5) | <0,001 |
| Charlson-Ca | 4 (2,2-5) | 3,9 (2-5) | 0,57 |
| Localización | 0,06 | ||
| Mitral | 9 (28,1) | 42 (23,9) | |
| Aórtica | 11 (34,4) | 80 (45,5) | |
| Mitral y aórtica | 0 (0) | 13 (7,4) | |
| Tricuspídea | 6 (18,8) | 11 (6,2) | |
| MCP/DAI | 3 (9,4) | 22 (12,5) | |
| Otras | 3 (9,4) | 8 (4,5) | |
| Protésica | 2 (6,2) | 46 (26,1) | 0,01 |
| C. predisponente | 13 (40,6) | 58 (33,0) | 0,42 |
| EI aguda | 18 (56,2) | 89 (50,6) | 0,55 |
| RAS | 19 (59,4) | 43 (24,4) | <0,001 |
| Nosocomial | 10 (31,2) | 27 (15,3) | 0,03 |
| Presentación | 0,15 | ||
| Fiebre | 25 (78,1) | 136 (77,3) | |
| ICC | 3 (9,4) | 32 (18,2) | |
| Embolismo | 4 (12,5) | 8 (4,5) | |
| UDVP | 0 (0) | 8 (4,5) | 0,22 |
| Hemodiálisis | 1 (3,1) | 12 (6,8) | 0,43 |
| EI recurrente | 1 (3,1) | 16 (9,1) | 0,26 |
| EI definitiva | 32 (100) | 167 (94,9) | 0,36 |
Los datos representan n (%) o mediana (rango intercuartílico).
C. predisponente: existencia de cardiopatía que predispone al desarrollo de EI; EI: endocarditis infecciosa; ICC: desarrollo de insuficiencia cardiaca; MCP/DAI: sobre marcapasos o desfibrilador implantable; RAS: relacionado con la atención sanitaria; UDVP: usuarios de drogas por vía parenteral.
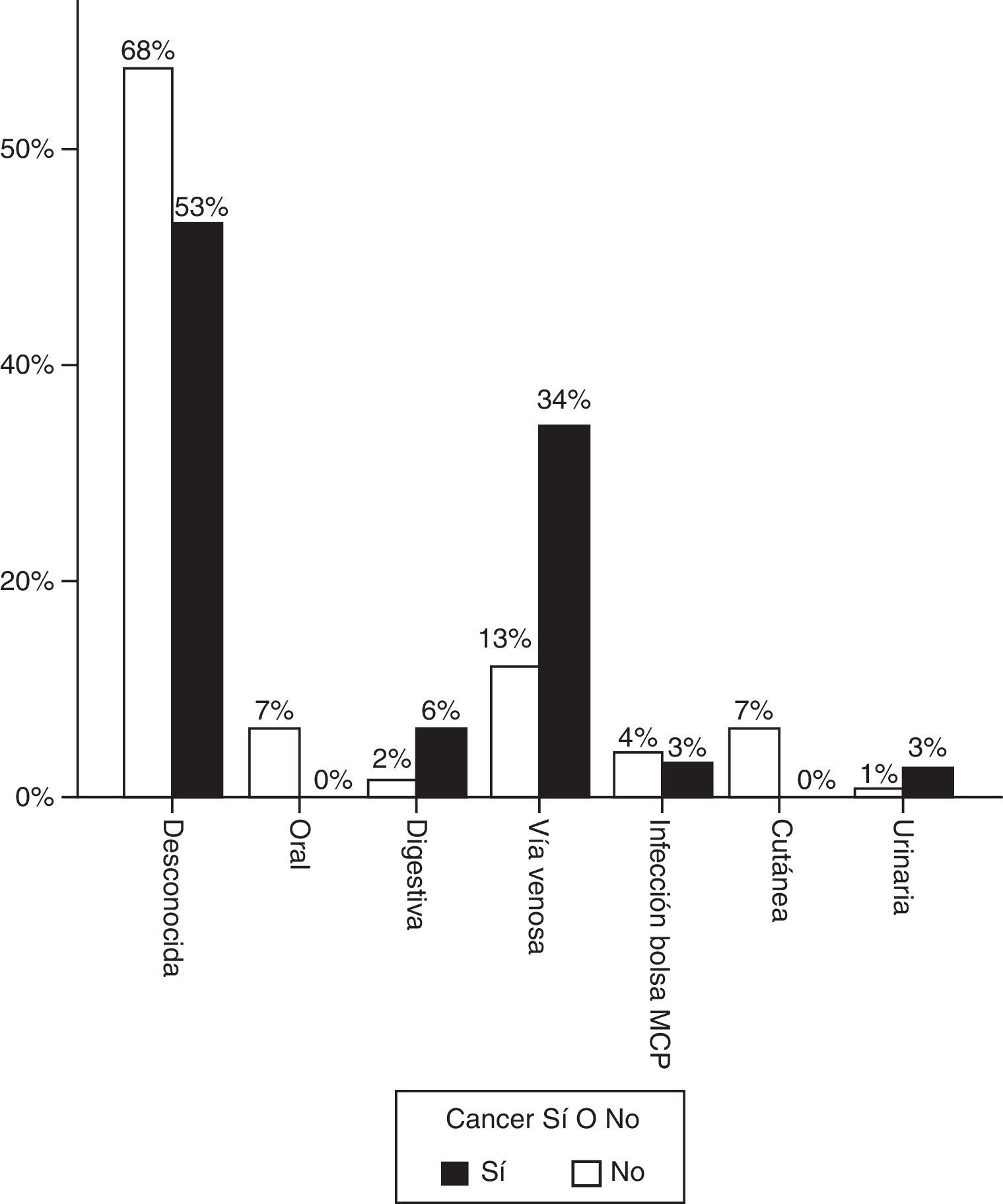
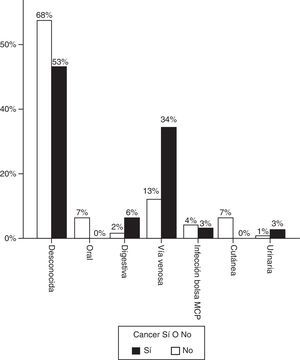
La figura 1 representa el origen más probable de la infección. En la mayoría de casos no se identificó foco, pero cuando este fue evidente, predominó la infección por catéter en los pacientes con enfermedad oncológica. En 7 casos (21,9%) la infección se adquirió en el periodo postoperatorio inmediato de cirugía oncológica.
En los pacientes con cáncer la proporción de EI tricuspídea fue 3 veces mayor (18,8% vs. 6,2%). Tres de los pacientes con cáncer y endocarditis tricuspídea eran portadores de catéter reservorio venoso subcutáneo, y en los otros casos la infección se relacionó con una vía periférica. Staphylococcus aureus fue identificado como agente causal en la mitad de estos episodios. Las endocarditis sobre prótesis fueron significativamente menos frecuentes (6,2% vs. 26,1%, p=0,01).
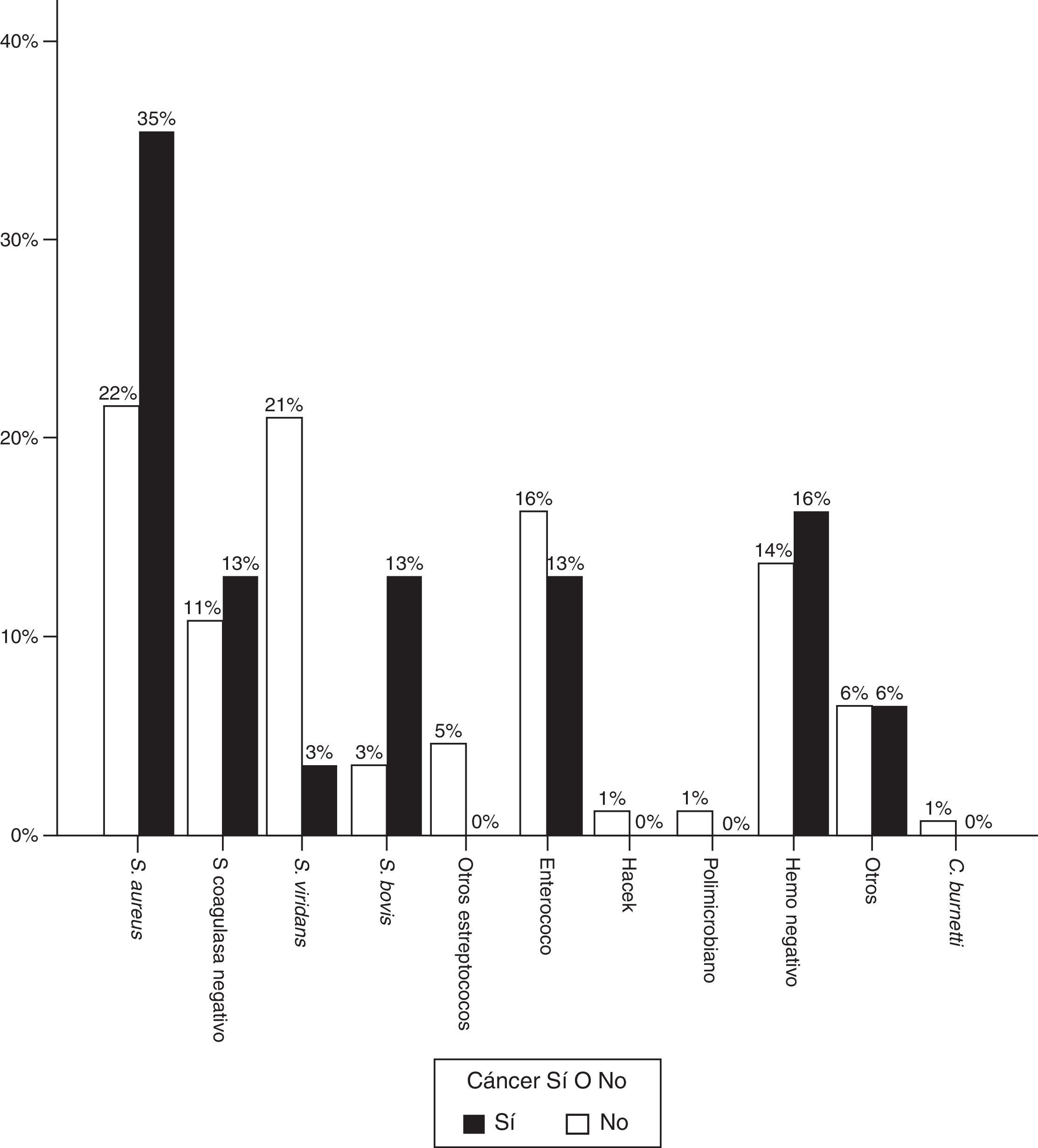
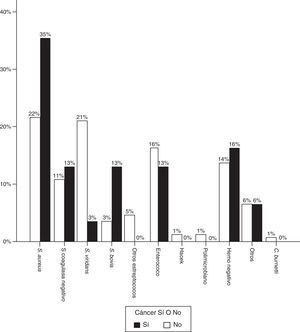
En cuanto al microorganismo responsable, en los casos de EI y enfermedad oncológica existía una proporción significativamente mayor de S. aureus, siendo el causante de la mayoría de episodios (37,5% vs. 21%, p=0,02). Los Streptococcus viridans supusieron una amenaza menor (15,6% vs. 29,5%, p=0,04).
La proporción de Streptococcus gallolyticus (antes Streptococcus bovis) también fue claramente superior (12,9% vs. 3,4%), y en 3 de 4 casos la infección tuvo lugar en el contexto de cáncer de colon. Visto de otra forma, de los 8 casos de cáncer colorrectal, la infección fue provocada por S. bovis en 3 de ellos, hubo un caso por S. aureus, otro por Enterococcus faecalis, otro por Staphylococcus epidermidis, y los hemocultivos fueron negativos en 2 pacientes. La figura 2 representa la distribución de agentes causales en ambos grupos de pacientes.
A pesar de una proporción relativamente alta de pacientes en los que no se identificó el agente causal (en relación con el uso de antibióticos antes de la extracción de las muestras de sangre), todos cumplían criterios de endocarditis definitiva a través de los hallazgos clínicos y ecocardiográficos.
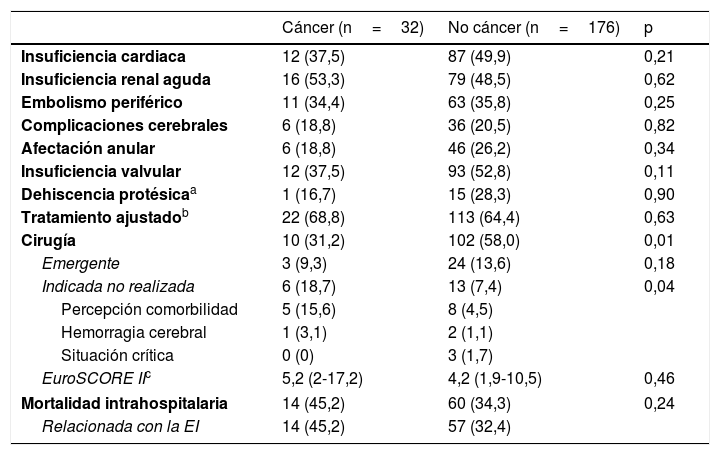
Evolución y supervivenciaSi bien las complicaciones evolutivas no fueron significativamente mayores en los pacientes con cáncer (tabla 3), la mortalidad intrahospitalaria fue del 45,2%, frente a un 34,3% de los pacientes sin cáncer, y en la mayoría de casos (47,1%) la causa de la muerte fue la sepsis grave o el shock séptico.
Evolución intrahospitalaria de los pacientes
| Cáncer (n=32) | No cáncer (n=176) | p | |
|---|---|---|---|
| Insuficiencia cardiaca | 12 (37,5) | 87 (49,9) | 0,21 |
| Insuficiencia renal aguda | 16 (53,3) | 79 (48,5) | 0,62 |
| Embolismo periférico | 11 (34,4) | 63 (35,8) | 0,25 |
| Complicaciones cerebrales | 6 (18,8) | 36 (20,5) | 0,82 |
| Afectación anular | 6 (18,8) | 46 (26,2) | 0,34 |
| Insuficiencia valvular | 12 (37,5) | 93 (52,8) | 0,11 |
| Dehiscencia protésicaa | 1 (16,7) | 15 (28,3) | 0,90 |
| Tratamiento ajustadob | 22 (68,8) | 113 (64,4) | 0,63 |
| Cirugía | 10 (31,2) | 102 (58,0) | 0,01 |
| Emergente | 3 (9,3) | 24 (13,6) | 0,18 |
| Indicada no realizada | 6 (18,7) | 13 (7,4) | 0,04 |
| Percepción comorbilidad | 5 (15,6) | 8 (4,5) | |
| Hemorragia cerebral | 1 (3,1) | 2 (1,1) | |
| Situación crítica | 0 (0) | 3 (1,7) | |
| EuroSCORE IIc | 5,2 (2-17,2) | 4,2 (1,9-10,5) | 0,46 |
| Mortalidad intrahospitalaria | 14 (45,2) | 60 (34,3) | 0,24 |
| Relacionada con la EI | 14 (45,2) | 57 (32,4) | |
Los datos representan n (%) o mediana (rango intercuartílico).
La proporción de pacientes operados fue significativamente menor (31,2% vs. 58%, p=0,01), y en un 18,7% de los casos no se realizó cirugía aunque esta estuviera indicada. Este porcentaje fue solo del 7,4% en los pacientes sin cáncer (p=0,04).
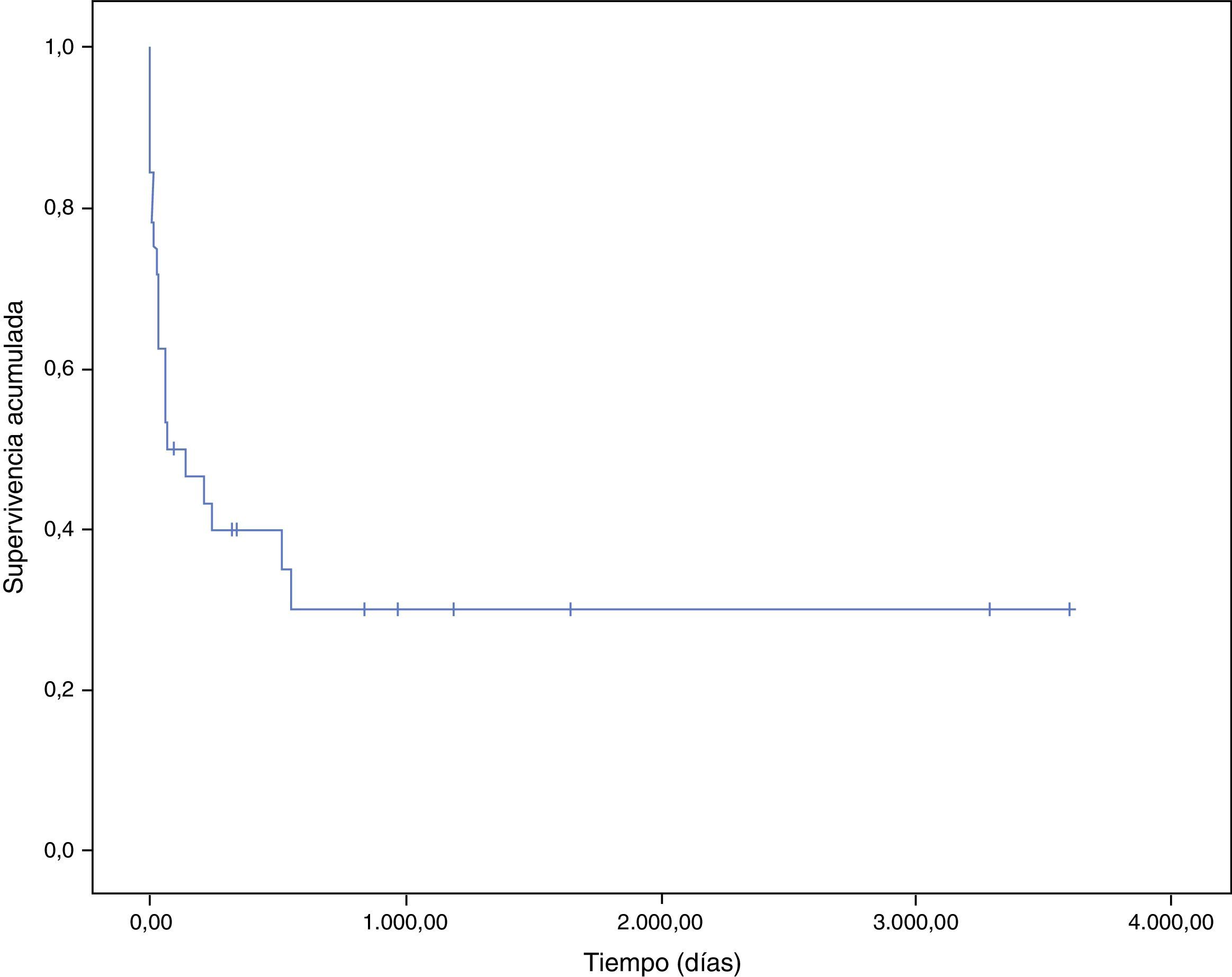
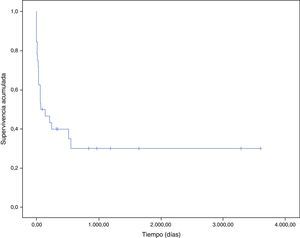
En la figura 3 se representa la curva de supervivencia de los pacientes con endocarditis y cáncer. La mayoría de pacientes fallecieron durante el periodo hospitalario (100% por la propia endocarditis). La probabilidad estimada de supervivencia a un mes fue del 62%, y se reduce al 40% al año. La principal causa de muerte tras el alta fue el proceso oncológico (5 de 6 pacientes, 83,3%).
DiscusiónExiste poco conocimiento sobre la magnitud de la asociación entre EI y cáncer y sobre su historia natural. García-Albéniz et al. han publicado recientemente que la incidencia peridiagnóstica de EI es casi 10 veces mayor en los pacientes con cáncer colorrectal y el doble en los pacientes con cáncer de pulmón, asociándose con una supervivencia claramente reducida14.
En nuestro medio, un 15% de pacientes con EI tienen antecedentes de enfermedad oncológica. La mayoría de ellos son tumores sólidos abdominales y en el momento del diagnóstico de la EI la proporción de pacientes en curso de tratamiento quimioterápico o que sufren neutropenia es muy baja. La gran mayoría no presentan enfermedad avanzada. Salvo por el propio antecedente de cáncer su comorbilidad no es mayor, pero sí lo es la gravedad de los episodios.
La endocarditis puede ser un marcador de cáncer oculto, sobre todo en lo que se refiere a cáncer digestivo15, sin embargo, en nuestro centro la mayoría de casos están relacionados con la atención sanitaria, principalmente con bacteriemias por catéter venoso central, y en una proporción importante la infección se adquiere en el periodo postoperatorio inmediato de cirugía oncológica. Estos aspectos explican que la mayoría de episodios sean causados por estafilococos y que la frecuencia de afectación de la válvula tricúspide sea 3 veces mayor que la de enfermos sin cáncer.
La mortalidad por EI es especialmente alta en nuestro centro y ha sido el origen de un trabajo comparativo directo con otro hospital español de reconocido prestigio en el estudio y tratamiento de la enfermedad. Sospechamos que el origen de estas diferencias radica en el hecho de que tratamos pacientes con un riesgo especialmente alto16. En cualquier caso, la endocarditis empobrece claramente el pronóstico de los enfermos oncológicos: casi la mitad fallece durante el periodo hospitalario por la propia infección y, aunque el tratamiento antibiótico correctamente dirigido fue similar al de los pacientes sin cáncer, se operan con menor frecuencia a pesar de tener indicación quirúrgica. Esta actitud explica al menos en parte que la mortalidad sea tan alta: el grupo de pacientes de peor pronóstico en nuestro medio es el de los que no se opera cuando necesitan intervención17. Esta limitación al tratamiento, en parte debida a una falsa percepción de comorbilidad o riesgo quirúrgico, contrasta con el hecho de que es el propio medio sanitario el responsable de la mayoría de los episodios de EI, y debe hacernos reflexionar sobre varios aspectos: el primero es que se deben extremar las medidas encaminadas a la prevención de las bacteriemias en estos enfermos. El segundo, que la aparición de fiebre debe ponernos en alerta y hacernos buscar de forma activa una posible endocarditis cuando no exista un foco claro claramente alternativo. De hecho, hay pacientes con sepsis grave y shock séptico en los que no se llega a un diagnóstico definitivo o, cuando se encuentra, se hace de forma tardía, disminuyendo las posibilidades de supervivencia. Por último, creemos que debe valorarse objetivamente el riesgo y la comorbilidad del enfermo antes de limitar el esfuerzo terapéutico. El diagnóstico de cáncer no debe ser motivo por sí mismo para tomar actitudes que comprometan aún más el pronóstico de los pacientes con EI.
Nuestro trabajo tiene varias limitaciones que deben considerarse. En primer lugar, se trata de la experiencia de un único centro y que por tanto no necesariamente tiene por qué reflejar lo que ocurre en otras regiones. El tamaño muestral es limitado y existe una importante proporción de pacientes en los que no se conoce el origen de la endocarditis. Quizás, una búsqueda sistemática de la puerta de entrada podría aclarar más cuál fue el mecanismo de infección.
Para concluir, podemos decir que los enfermos con cáncer que sufren EI en nuestro medio constituyen un grupo de riesgo especial, siendo las maniobras invasivas responsables de una gran parte de los casos. Presentan una mortalidad elevada a corto plazo y en muchas ocasiones se limita el tratamiento quirúrgico sin que se considere de forma objetiva la comorbilidad o el riesgo.
Conflicto de interesesNo existen para ninguno de los autores.