Paciente de 42 años, búlgaro que vive en la calle, fue llevado a urgencias por la ambulancia debido a cuadro progresivo de disnea con comienzo 72h antes. También presentaba expectoración hemoptoica, dolor en hemitórax derecho y fiebre >38,5°C. Como antecedentes médicos destacaban diabetes mellitus tipo 2, infección pasada de hepatitis C y bebedor de 1l de cerveza al día. A la exploración presentaba mal estado general, sudoración profusa, crepitantes en lóbulo superior derecho pulmonar, taquipnea (>40rpm) con trabajo respiratorio global y saturaciones de oxígeno <85% a pesar de gafas nasales de oxígeno de alto flujo. En la analítica de sangre destacaban una PCR de 256,29mg/l (0-5) y una procalcitonina de 17,06ng/ml (0-0,5), bilirrubina de 6,5mg/dl (<1,2), 10,94×103/μl leucocitos (4,50-11,00) en niveles normales cercanos al límite superior con 8,85×103 neutrófilos (2,0-5,0), 43×103 plaquetas (135-450), dímero D de 3.300ng/ml, tiempo de protrombina del 48% (65-120) y fibrinógeno de 691mg/dl (200-450) compatible con shock séptico de origen respiratorio. También se hallaron GPT de 73U/l (5-41) y bilirrubina de 6,5mg/dl (<1,2). En muestra de serología se observan anticuerpos de hepatitis C mediante inmunoanálisis Elecsys® Anti-HCV II (Roche Diagnostics, Basilea, Suiza) con un valor: 21,40 (positivo >1), confirmándose después mediante técnica inmunoblot INNO-LIA™ HCV Score (Fujirebio, Tokyo, Japón). Se realiza cuantificación de ARN mediante el sistema Cobas® 4800 (Roche Diagnostics) con resultado indetectable, que confirma ausencia de infección aguda y, por tanto, infección pasada.
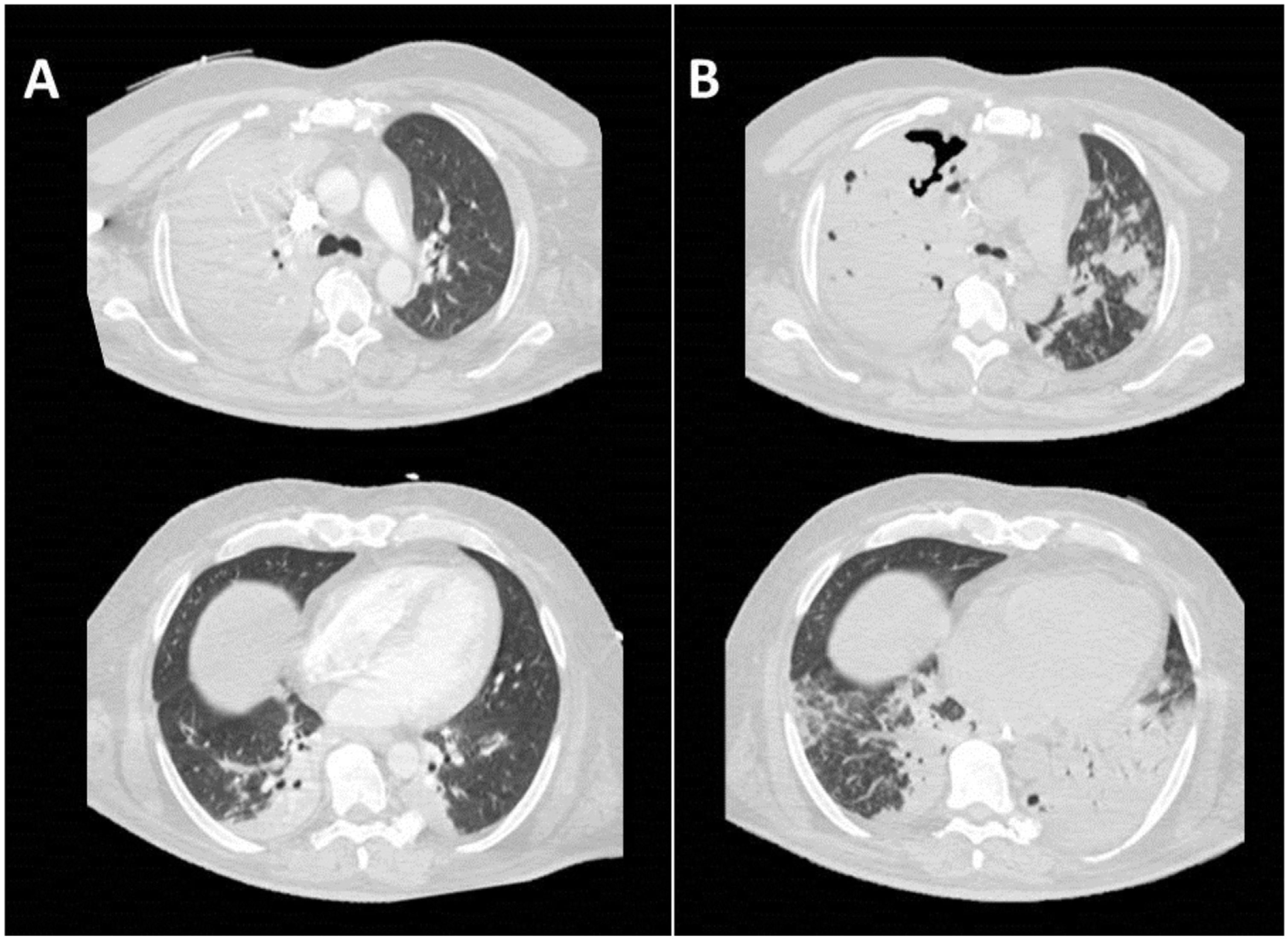
Se realizó una tomografía computerizada (TC) toraco-abdominal en la que se informa de gran consolidación en el lóbulo superior derecho (LSD), en el lóbulo medio (LM), pericisural y opacidad nodular en el lóbulo superior izquierdo, compatibles con neumonía (figura 1a). También se observan signos de hepatopatía crónica con hipertrofia del lóbulo caudado, lóbulo hepático izquierdo y disminución de la densidad de manera difusa, sin observar lesiones focales de sospecha (ver material suplementario). Además, presentaba colelitiasis única sin signos de colecistitis. Se decidió intubación orotraqueal, sufriendo parada cardiorrespiratoria. Se realizaron maniobras de reanimación, requiriéndose desfibrilación a 360J, durante la cual recibió 2mg de adrenalina y 300mg de amiodarona. Finalmente, el paciente recuperó el ritmo sinusal y fue ingresado con antibioterapia de amplio espectro con meropenem (1g/cada 8h IV), vancomicina (1g/cada 8h IV) y levofloxacino (1g/cada 24h IV). Previa instauración de antibioterapia se recogieron muestras de orina, hemocultivo y broncoaspirado, aislándose en estas 2 últimas Klebsiella pneumoniae, únicamente resistente a ampicilina (ver material suplementario).
Imágenes axiales con ventana de pulmón de TC torácica. Extensa consolidación neumónica con broncograma aéreo en lóbulo superior derecho (LSD), consolidaciones neumónicas de menor tamaño en pulmón izquierdo y atelectasias bibasales (A). En estudio realizado 13 días después se observa empeoramiento radiológico con áreas de cavitación en la consolidación de LSD y mayor número y tamaño de las consolidaciones neumónicas preexistentes en pulmón izquierdo con tendencia a la confluencia (B).
El paciente sufrió empeoramiento progresivo, realizándose de nuevo una TC toraco-abdominal con aparición de zonas de cavitación junto con extensa condensación con broncograma aéreo en LSD y LM (figura 1b) respecto a anteriores pruebas de imagen. A pesar de escalada de tratamiento antibiótico, el paciente progresó hacia situación clínica con abundante hemoptisis, evidenciándose aumento de las áreas de necrosis y de las cavitaciones (figura 1b). El paciente falleció 2 días después.
Tanto en la muestra de hemocultivo como en la de broncoaspirado se aisló Klebsiella pneumoniae con elevada producción de moco en las placas de cultivo con string test positivo (>5mm). Previa a la realización de antibiograma se realizó prueba rápida de inmunocromatografía NG-Test CTX-M Múltiple (NG Biotech, Guipry-Messac, Francia) que permite detectar los tipos más frecuentes de beta-lactamasas de espectro extendido (grupos CTX-M-1, 2, 8, 9 y 25), con resultado negativo. La determinación de la sensibilidad a antimicrobianos se realizó mediante difusión con discos en agar Mueller-Hinton y mediante el panel ID/NMIC 503 (BDTM Phoenix; Becton Dickinson, Franklin Lakes, NJ, USA).
El aislado procedente del broncoaspirado se envió al Centro Nacional de Microbiología, Instituto de Salud Carlos III (Majadahonda. Madrid), donde se realizó la secuenciación genómica completa y se confirmó la ausencia de mecanismos de resistencia. Los datos relacionados con factores de virulencia de la cepa fueron los siguientes: serotipo capsular K1, ST23 (mediante tipificación molecular por multilocus sequence typing- MLST), presencia de los genes de virulencia rmpA y rmpA2 (regulador del fenotipo mucoide A, responsable de la hipermucoviscosidad de la cepa) característicos del patotipo hipervirulento de Klebsiella pneumoniae y otros genes de virulencia como IucABCD-iutA (que forman el complejo operón del sideróforo aerobactina) e iroBCN (perteneciente al cluster de genes del sideróforo salmochelina).
Las cepas pertenecientes al patotipo hipervirulento de K. pneumoniae (hvKp) se caracterizan por la capacidad de producir infecciones graves y la diseminación desde el sitio de infección. El factor diferencial y característico de estas cepas frente al fenotipo clásico es la elevada producción de polisacárido capsular, que les confiere la propiedad de hipermucoviscosidad. Esta característica radica en el gen magA (gen A relacionado con la mucoviscosidad, específico del serotipo capsular K1), así como el gen rmpA/rmpA2 de localización plasmídica y la producción de sideróforos (quelantes de hierro que aumentan la supervivencia bacteriana como aerobactina o salmochelina, entre otros). Esta característica les confiere a las hvKp resistencia a la opsonofagocitosis del suero humano1. El string test o prueba del hilo mucoide permite predecir en la mayoría de los casos la asociación de las cepas con el patotipo hipervirulento, aunque en un pequeño porcentaje cepas con test positivo podrían no mostrar patogenicidad grave como las hvKp. De modo que parece más eficiente utilizar tanto el string test como la detección de rmpA y otros factores de virulencia como la producción de sideróforos para poder detectar todas las cepas hvKp2.
No hay datos epidemiológicos a nivel nacional acerca de la incidencia de estas cepas, aunque Cubero M et al. publicaron un estudio prospectivo en el que estudiaron 878 cepas aisladas en hemocultivos entre los años 2007 y 2013 de K. pneumoniae en un hospital de Barcelona. Del total de cepas aisladas, 53 (5,4%) fueron categorizadas como hipermucoviscosas (string test), aunque solo la mitad (28/53) contaban con los genes magA y/o rmpA siendo categorizadas como hipervirulentas. En este sentido, sería importante realizar más estudios epidemiológicos nacionales para conocer la incidencia de estas cepas3.
De los más de 77 serotipos capsulares descritos en K. pneumoniae, la mayoría de casos los concentran los serotipos capsulares K1 y K2, asociados al fenotipo hipervirulento. El serotipo K1 es el que más frecuentemente se ha visto asociado al síndrome de absceso secundario y a infección diseminada o metastásica, conocido por ser enfermedad endémica en Asia4,5. Otros cuadros clínicos a los que se ha visto asociados el patotipo hvKp son neumonías complicadas con cavitaciones/necrosantes o con empiema, abscesos de distintas localizaciones (hepáticos, cerebrales, esplénicos…), tromboflebitis, peritonitis bacteriana espontánea o colecistitis/colangitis6,7. Por otro lado, la cepa aislada en este caso pertenece al grupo clonal ST23, conocido por presentar algunas cepas que portan plásmidos de resistencia bacteriana que las convierte en cepas multirresistentes, pero en nuestro caso la cepa estudiada era sensible a todos los antibióticos testados8.
En cuanto a factores de riesgo, en la serie de casos de Liu C et al., se estudiaron 175 infecciones en las que se detectó hvKp, y se encontró que la diabetes mellitus y la enfermedad hepatobiliar previa mostraban gran poder de asociación (valor de p de 0,007 y 0,049, respectivamente)9. El paciente de nuestro caso presentaba tanto diabetes mellitus tipo 2 como hepatitis C pasada. El tratamiento de estas infecciones consiste en antibioterapia dirigida durante 2-6 semanas según el contexto clínico y el paciente junto con drenaje de las colecciones cuando sea necesario10. En situaciones complejas como pacientes inmunodeprimidos, infecciones por cepas extremadamente resistentes o dificultad de los antibióticos para alcanzar el sitio de infección, se podrían utilizar terapias diferentes y/o adyuvantes al tratamiento tradicional como es el caso de la inmunización pasiva o activa mediante anticuerpos monoclonales o vacunas o el uso de terapias con bacteriófagos10,11.
En conclusión, las infecciones por cepas hipervirulentas de K. pneumoniae cada vez suponen un mayor problema a nivel mundial. La detección y el tratamiento precoz adecuado mediante el avance de las herramientas diagnósticas y terapéuticas puede evitar no solo desarrollo de consecuencias fatales como shock séptico, fallo multiorgánico o muerte, sino también la transmisión de plásmidos de virulencia o resistencia y, por ende, la aparición de más cepas hipervirulentas y/o multirresistentes.
FinanciaciónLa presente carta no ha recibido ayudas económicas.
AutoríasDomingo Fernández Vecilla: escribió el caso y parte de la discusión.
Miren Josebe Unzaga Barañano: ayudó con la concepción del caso y lo revisó.
Carlota García de Andoin Sojo: describió las imágenes y ayudó con la revisión.
José Luis Díaz de Tuesta del Arco: revisó el caso y la discusión, con distintas correcciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.