Varón de 41 años sin antecedentes médicos de interés que acudió a urgencias por cuadro febril y disnea basal de 24h de evolución, junto con expectoración hemoptoica. Durante el mes previo a este episodio había estado en tratamiento con distintos AINE, diazepam (5mg/24h por vía oral) y dexametasona (4mg/12h por vía oral) debido a lumbociatalgia moderada de curso subagudo. A su llegada, el paciente presentaba eritrodermia generalizada y cianosis acra. Además, presentaba dificultad respiratoria con tiraje toracoabdominal y taquipnea (32rpm). Dada la situación de gravedad clínica, el paciente fue llevado al área de reanimación. Se inició oxigenoterapia de alto flujo, pero se procedió a intubación por mala oxigenación. Se produjo un rápido deterioro clínico con shock séptico y fracaso multiorgánico con fracaso renal: urea=73mg/dL (<40mg/dL) y creatinina=2,68mg/dL (0,6-1,1mg/dL); leucopenia=2,18*10^3/μL [3,5-11*103/uL]; trombocitopenia=104*10^3/μL (150.000-400.000uL) y alteraciones de la coagulación (tiempo de protrombina=33% [70-100%]; INR=2,3 [0,8-1,2]; dímero D: 3.400ng/mL [<100ng/mL]). Además, se evidenció una insuficiencia respiratoria global con pO2 de 61mm Hg (75-100mm Hg) y pCO2 de 61mm Hg (23-29 mmol/L). Se realizó angio-TC torácica en la que se mostraba neumonía necrosante (fig. 1). Se inició cobertura antibiótica por vía intravenosa de amplio de espectro con meropenem (1g/8h), teicoplanina (400mg/12h), clindamicina (900mg/8h) y caspofungina (70mg/día).
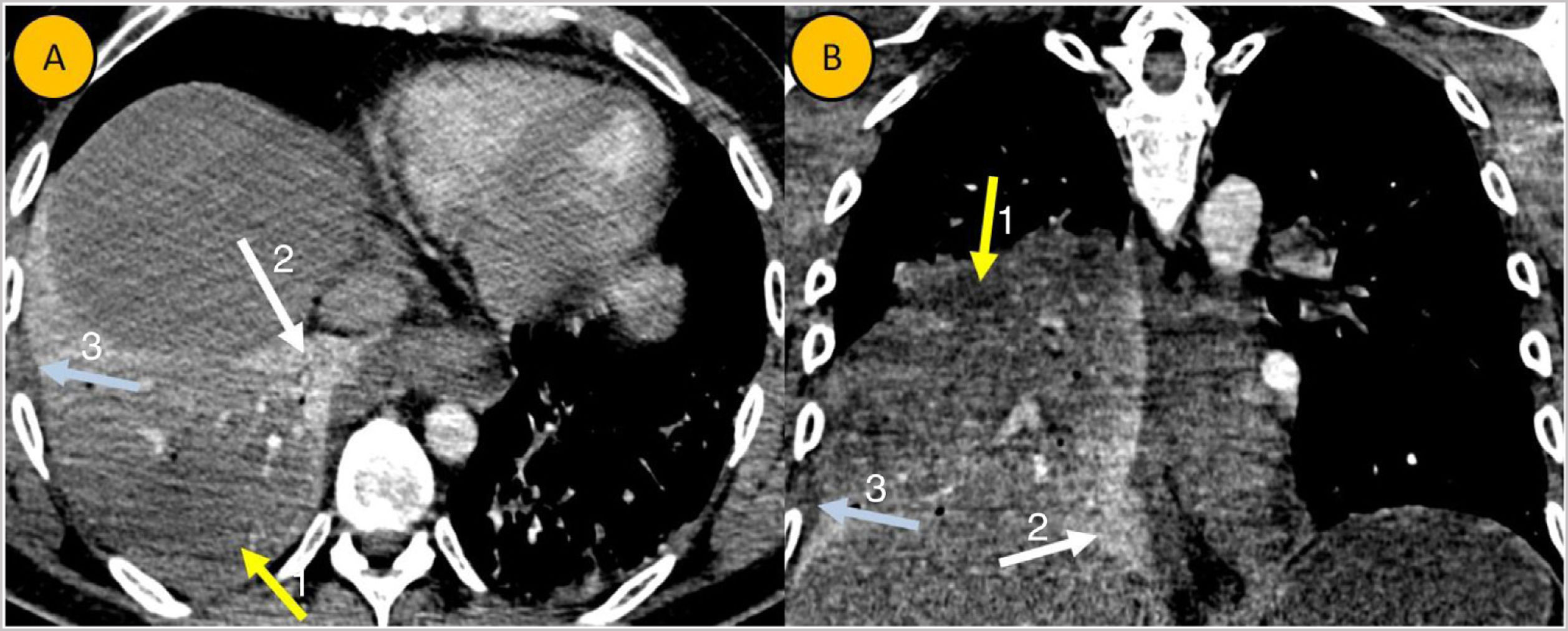
Cortes axial (A) y coronal (B) de una angio-TC de arterias pulmonares con contraste yodado intravenoso. Se aprecia una extensa consolidación pulmonar en LID, que presenta captación heterogénea de contraste. Predomina un componente más hipodenso con escaso realce (flecha amarilla, número 1), identificándose otras zonas normocaptantes de mayor densidad (flecha blanca, número 2). Mínima cantidad de derrame pleural derecho (flecha azul, número 3). Los hallazgos son compatibles con neumonía necrosante asociada a mínimo derrame pleural.
Se trasladó al paciente a otro centro para oxigenación de membrana extracorpórea dada la mala situación respiratoria. El paciente se estabilizó, pero varios días después se produjo una elevación de bilirrubina (4,8mg/dL [0,1-1-2mg/dL]) y lactato deshidrogenasa (1000U/L [140-280U/L]) respecto a analíticas previas. Se realizó ecografía abdominopélvica con hallazgos sugestivos de colecistitis aguda alitiásica, realizándose colecistectomía percutánea guiada por ecografía. Tras retirada del drenaje, el paciente sufrió hemoperitoneo masivo por perforación de arteria mamaria izquierda y epigástrica inferior con embolización efectiva posterior. Finalmente, tras 2 meses hospitalizado fue dado de alta.
MicrobiologíaSe recogieron muestras de hemocultivo, broncoaspirado y aspirado traqueal. La muestra de aspirado traqueal se utilizó para realizar el panel de neumonía del sistema Filmarray® (BioFire Diagnostics, Salt Lake City, UT, Estados Unidos) con identificación de Klebsiella pneumoniae (K. pneumoniae). En ambas muestras respiratorias se aisló K. pneumoniae de aspecto mucoso con «String test» positivo (>5mm; ver material suplementario) y tras estudiar la sensibilidad antibiótica mediante el panel ID/NMIC 503 BDTM Phoenix (Becton Dickinson, Franklin Lakes, NJ, Estados Unidos) solo presentaba resistencia (intrínseca) a ampicilina (CMI en material suplementario). Se realizaron pruebas complementarias (fenotípicas) para confirmar la susceptibilidad antibiótica y la ausencia de mecanismo de resistencia (betalactamasas de espectro extendido, AmpC, KPC, metalobetalactamasas u OXA-48). Para ello, se emplearon los kits de «KPC/Metallo-beta-lactamase and OXA-48 Confirm Kit» y «Total ESBL, AmpC and ESBL+AmpC Confirm kit» de ROSCO Diagnostica (ROSCO Diagnostica A/S, Taastrupgaardsvej 30, DK-2630 Taastrup, Dinamarca). Se confirmó que la cepa no presentaba betalactamasas de espectro extendido, AmpC o carbapenemasas (material suplementario). Una muestra de bilis es enviada para cultivo tras colecistectomía percutánea, pero no hay crecimiento de ningún microorganismo.
Se envió la cepa aislada en la muestra del aspirado traqueal al «Centro Nacional de Microbiología» (Instituto de Salud Carlos III). Se realizó secuenciación genómica completa, que confirmó la ausencia de mecanismos de resistencia mediante su caracterización genotípica. Además, se pudo conocer que la cepa pertenecía al serotipo capsular K2 y MLST 66 (tipificación multilocus de secuencias que permite una caracterización taxonómica, útil en epidemiología molecular para filiación de brotes). La cepa poseía otros genes de virulencia característicos como rmpA, localizados en plásmidos (regulador del fenotipo mucoide A, responsable de la hipermucoviscosidad de la cepa), Iuc2 (aerobactina, sideróforo), clb1 (colibactina, endotoxina) y ybt12 (yersinabactina, sideróforo). Además, se encontró también que poseía un elemento conjugado integrado denominado ICEKp10, que se comporta como elemento genético móvil que porta el locus clb y se asocia con algunos linajes del sideróforo yersinabactina, entre los que se encuentra ybt12. Mediante el análisis llevado a cabo con PlasmidID se detecta un plásmido de unos 160.000bp que pertenece al grupo de incompatibilidad IncFIB1 (con un porcentaje de similitud y cobertura superiores al 99%, con respecto al plásmido LR792629.1). Los siguientes factores de virulencia rmpA (regulador de la síntesis de polisacárido capsular asociado al fenotipo mucoide) e Iuc2 (aerobactina).
DiscusiónKlebsiella pneumoniae hipervirulenta (hvKp) presenta mayor virulencia que las cepas clásicas de K. pneumoniae (cKp). Se describió por primera vez a mediados de 1980 en Asia, donde actualmente se considera una enfermedad endémica2.
En hvKp, la hiperproducción de polisacárido capsular (CPS) es el factor de virulencia más importante, que les confiere esa propiedad de hipermucoviscosisdad. Su variabilidad ha permitido clasificar las cepas de K. pneumoniae en más de 77 serotipos capsulares distintos. Los serotipos capsulares más frecuentes son K1 y K2 (en torno al 70% de estas cepas)3. El plásmido regulador de fenotipo mucoide A (rmpA) permite amplificar la síntesis de polisacáridos. La hiperproducción de polisacárido capsular confiere mayor resistencia a la acción bactericida del suero4. La producción de sideróforos (como enterobactina o yersiniabactina) permite la adquisición de hierro, así como reducir la producción de especies reactivas de oxígeno, aumentando la supervivencia bacteriana5. Por otra parte, la endotoxina colibactina parece inducir la fragmentación del ADN y podría tener un papel importante en el desarrollo de cáncer colorrectal. La inactivación de los genes responsables de su síntesis (claA y clbP, pertenecientes a un islote genómico llamado pks) podría reducir la capacidad de las bacterias para colonizar el intestino, translocar a la sangre y producir enfermedad invasiva6.
Las cepas hvKp tienen gran capacidad para producir enfermedad invasiva. El síndrome de absceso hepático secundario a K. pneumoniae es una de las entidades más características7. Si bien el serotipo K1 es el más frecuentemente asociado al síndrome de absceso hepático secundario a K. pneumoniae, y que más fácilmente se asocia a endoftalmitis o complicaciones del SNC, cualquier serotipo hipervirulento puede ser causante de cuadros invasivos como neumonía complicada, bacteriemia o abscesos en distintas localizaciones8,9.
Desde su caracterización, cepas de K. pneumoniae del sublinaje ST66 y serotipo capsular K2 no habían sido aisladas salvo en un estudio genómico de más de 400 cepas provenientes de humanos y animales realizado en Australia10. En los últimos años, se han podido aislar cepas de este grupo clonal como causa de neumonía o faringoamigdalitis, siendo un hecho anecdótico aún11.
La diabetes mellitus, portar catéteres o sondas y enfermedad digestiva previa muestran un alto poder de asociación con infecciones por hvKp12. En nuestro caso, el paciente se encontraba en un estado transitorio de inmunosupresión debido a la toma de corticoides durante el mes previo al episodio.
En cuanto al tratamiento, el control del foco mediante drenaje de los abscesos puede evitar consecuencias fatales (incluida su diseminación). La mayoría de las cepas hipervirulentas han presentado un fenotipo sensible a todos los antibióticos hasta el momento, pero cada vez es mayor la incidencia de cepas hipervirulentas con fenotipos multirresistentes. Por ejemplo, Zhang et al. informaron de un aumento de cepas con serotipos hipervirulentos como K47 o K64 y ST11 resistentes a carbapenemes13.
Se encuentran en desarrollo estrategias terapéuticas complementarias al tratamiento antimicrobiano, capaces de reducir el impacto clínico que estos serotipos producen en la presentación antigénica, tales como los anticuerpos monoclonales, vacunas o el uso de bacteriófagos. Se han identificado posibles dianas terapéutica que podrían ser atacadas por anticuerpos monoclonales como el antígeno-O del lipopolisacárido o la cápsula, que parece ejercer una acción protectora en el caso de sepsis o infección pulmonar murina, así como disminuir su diseminación14. También se ha estudiado la eficacia de posibles vacunas, que reducirían significativamente la colonización intestinal y la carga bacteriana15. Sin embargo, la falta de modelos experimentales animales que imiten las comorbilidades y susceptibilidades de los pacientes humanos hace que sea difícil recoger evidencia científica apropiada acerca de estos nuevos enfoques de tratamiento. Por otra parte, los bacteriófagos son virus que reconocen la superficie de la célula bacteriana con alta especificidad, inyectan su ADN o ARN, y se multiplican dentro de la bacteria, para finalmente romper la célula y liberar su progenie, que infectará en nuevas células bacterianas16. Su combinación con antibióticos para el tratamiento de cepas multirresistentes en casos complejos podría tener utilidad en un futuro cercano cuando las opciones terapéuticas sean limitadas, pero igual que en el caso de las vacunas y anticuerpos monoclonales, el estrecho espectro de actividad podría obligar al uso de cocktail, cuya farmacocinética y seguridad están todavía por estudiar.
La creciente incidencia de cepas hvKp representa una grave amenaza para la salud mundial. Es imperativo que se apliquen estrategias desde el punto de vista preventivo, diagnóstico y terapéutico para evitar la diseminación del plásmido de virulencia en la población de cKp, ya que podría tener consecuencias devastadoras.