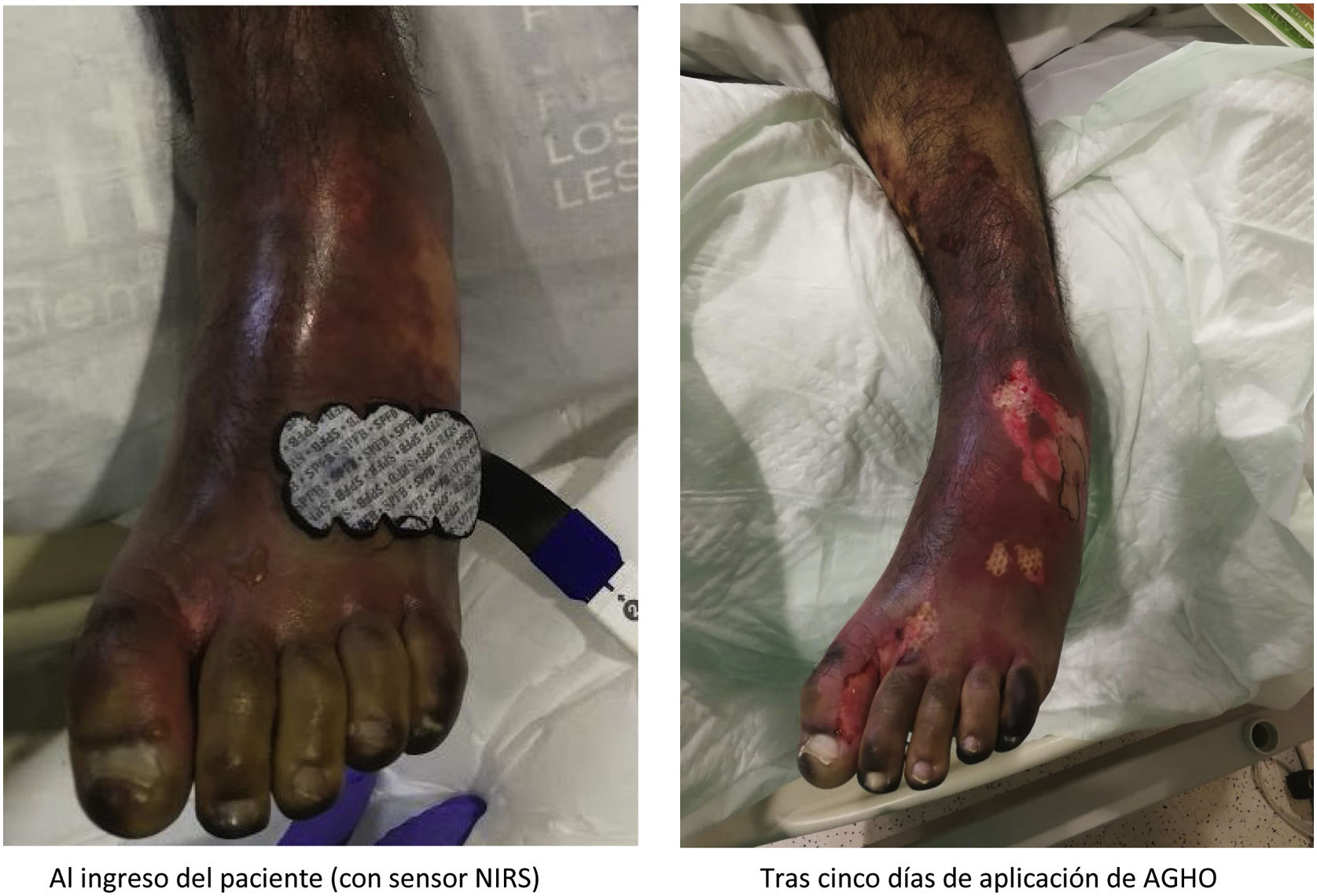
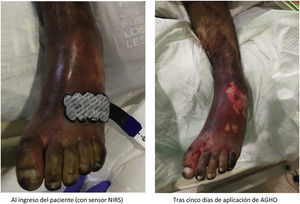
La púrpura fulminante (PF) es una complicación grave de la sepsis resultado de un conjunto de alteraciones caracterizadas por el desarrollo de lesiones hemorrágicas equimóticas y necrosis de la piel.
ObjetivoAnalizar la eficacia y la seguridad de la aplicación tópica de un compuesto de ácidos grasos hiperoxigenados (AGHO) en la microcirculación de la PF en pacientes pediátricos afectados de sepsis.
Material y métodosSe llevó a cabo un estudio prospectivo cuasiexperimental pretest-posttest de un solo grupo en una Unidad de Cuidados Intensivos Pediátrica (UCIP). Se incluyeron en el estudio pacientes con PF de 0 a 18 años. Para evaluar la efectividad del producto objeto de evaluación en la microcirculación de las lesiones por PF se determinaron los valores de oximetría somática antes y después de la aplicación de AGHO cada 4h durante los 3 primeros días de ingreso de los pacientes.
ResultadosSe reclutaron 4 pacientes, con una mediana de edad de 98 meses. Las lesiones purpúricas que se midieron estaban ubicadas, sobre todo, en ambos pies y manos y, en 2 pacientes, también en los maléolos laterales y gemelos de ambas extremidades inferiores. Se obtuvieron un total de 225 mediciones, observando unas puntuaciones medias preintervención de 71,17±15,65% versus los 73,68±14,83% postintervención. Se objetivó significación estadística (p<0,001) al comparar las mediciones pre- y postintervención.
ConclusionesLa aplicación precoz y continuada de AGHO en el manejo de la PF por sepsis es una práctica eficaz y segura en los casos de población pediátrica analizada. En más de la mitad de los episodios analizados se objetivó un aumento de microcirculación tisular tras la aplicación de los AGHO, sin eventos adversos.
Purpura fulminans (PF) is a serious complication of sepsis resulting from a set of alterations characterised by the development of ecchymotic haemorrhagic lesions and skin necrosis.
AimTo analyse the efficacy and safety of the topical application of HOFA compound, in the cutaneous microcirculation of PF lesions in paediatric patients affected by sepsis.
Material and methodsA prospective quasi-experimental pre-test/post-test single-group conducted in a Paediatric Intensive Care Unit of a third level hospital was performed. Paediatric patients aged 0-18 years with sepsis were included. Somatic oximetry values were measured before and after application of HOFAs every 4hours over the first three days of the patients’ hospitalisation. Patient's socio-demographic and clinical variables and somatic oximetry by placing a sensor for measuring tissue perfusion on the area with PF were determined.
ResultsFour patients were recruited, with a median age of 98 months. The purpuric lesions measured were mainly located on both feet and hands and, in two patients, also on the lateral malleoli and calves of both lower extremities. A total of 225 measurements were obtained, with mean pre-intervention scores of 71.17±15.65% versus 73.68±14.83% post-intervention. Statistical significance (p<0.001) was observed upon comparison of the pre- and post-intervention measurements.
ConclusionsEarly and continued application of HOFAs in the management of sepsis-induced PF is an effective and safe practice in the cases analysed. In more than half of the episodes analysed, an increase in tissue microcirculation was observed after the application of HOFAs, with no adverse events.
- •
La púrpura fulminante es una complicación grave de la sepsis resultado de un conjunto de alteraciones caracterizadas por el desarrollo de lesiones hemorrágicas equimóticas y necrosis de la piel.
- •
Los ácidos grasos hiperoxigenados son productos compuestos por ácidos grasos esenciales y se caracterizan por presentar unas propiedades como aumentar la microcirculación sanguínea disminuyendo el efecto de la isquemia.
- •
Los ácidos grasos hiperoxigenados en el tratamiento de la púrpura fulminante inducida por sepsis son una práctica eficaz y segura en los casos pediátricos analizados.
- •
En más de la mitad de los episodios analizados se objetivó un aumento de microcirculación tisular tras la aplicación de los ácidos grasos hiperoxigenados, sin eventos adversos.
- •
El tratamiento cutáneo con ácidos grasos hiperoxigenados se utiliza como medida complementaria de tratamiento local para heridas complejas e isquémicas, como la púrpura fulminante.
- •
Se requieren más estudios que evalúen cómo otros parámetros o posibles tratamientos, como la proteína C y la administración de fármacos vasoactivos, pueden afectar la evolución de estas lesiones isquémicas y el desarrollo de secuelas en pacientes pediátricos afectos de sepsis.
La sepsis se define como un proceso clínico y fisiopatológico en continuo cambio producido por la patogenicidad microbiana y por la respuesta del huésped a dicha agresión, que puede pasar por varias etapas que delimitarían su estadio y gravedad. Podemos clasificar a este tipo de patología en sepsis, sepsis grave y shock séptico1. La sepsis grave es el estadio que tiene un índice de mortalidad más elevado, sobre todo cuando se asocia a shock séptico.
Un estudio epidemiológico sobre la incidencia de sepsis grave nos indica que esta está aumentando2. En una reciente revisión basada en 8 estudios de diferentes países, se estimó una incidencia global de sepsis de 22-240 casos/105 personas, de sepsis grave en 13-300/105 y de shock séptico en 11/1053.
Si nos centramos en la población pediátrica, observamos cómo los registros sobre sepsis son escasos y parciales. La Organización Mundial de la Salud, en 2010, estimó que cerca de 7,6 millones de niños de edad inferior a 5 años mueren anualmente, la mayor parte de ellos a causa de enfermedades infecciosas (64%). En un estudio español realizado en 7 Unidades de Cuidados Intensivos Pediátricas (UCIP) publicado en 2014 la incidencia estimada de sepsis fue de 5,6/105 niños/año4.
Un reporte posterior realizado en 2013 por la Organización Mundial de la Salud estimaba que más del 50% de la mortalidad en niños menores de 5 años fue por infección y que más de 6.000.000 de niños morían al año por sepsis. Todos estos datos se refuerzan con el estudio Sepsis Prevalence Outcomes and Therapies (SPROUT) publicado en 2015, que describe una mortalidad hospitalaria del 25% por esta patología5.
Dentro de las complicaciones derivadas de la sepsis grave, la púrpura fulminante (PF) es el resultado de un conjunto de alteraciones que se caracterizan por el desarrollo de lesiones hemorrágicas equimóticas y necrosis de la piel, de tamaño y profundidad variables6. Por consiguiente, la PF es el término que se emplea para describir estas lesiones dérmicas hemorrágicas, de rápida evolución, con fiebre, septicemia y shock que se ha observado que aparecen en el 10-20% de las sepsis. Estas lesiones son una manifestación en la piel asociada a coagulación intravascular diseminada (CID), que está producida por la infección o sepsis y también por la respuesta del huésped y que se caracteriza por necrosis de la piel y trombosis de pequeños vasos7.
La PF es una enfermedad muy grave, que se inicia de forma aguda evolucionando y extendiéndose rápidamente por todo el cuerpo, incidiendo en las extremidades inferiores, finalizando su evolución con la formación posterior de placas necróticas como muestra del daño tisular e incluso orgánico que se produce en la zona afectada8.
Otra de las alteraciones producidas a causa del proceso séptico es la CID, la cual aumenta el riesgo de desarrollar PF. Dicho proceso se desarrolla por una activación de la coagulación sanguínea, que genera trombina en exceso, formándose así trombos de fibrina en la microcirculación9,10. Por este motivo, las lesiones isquémicas secundarias a la PF en pacientes pediátricos con sepsis pueden dejar graves secuelas llegando incluso a la amputación de miembros, a causa de la oclusión trombótica de vasos de mediano y pequeño tamaño11,12.
La medición de la oximetría somática puede ser útil para el diagnóstico de enfermedad vascular periférica (EVP), o la determinación de isquemia crítica en miembros inferiores (MMII)13. Para poder determinar el grado de isquemia que la PF puede ocasionar en la microcirculación se puede emplear un medidor de oximetría somática, un dispositivo que permite cuantificar el aporte de oxígeno desde el sistema respiratorio hasta los tejidos mediante la determinación de sus niveles en el flujo sanguíneo.
La oximetría somática es una técnica no invasiva para monitorizar cambios en el metabolismo tisular de oxígeno. Este método se basa en la tecnología Nearinfrared spectroscopy (NIRS), que difunde fotones de luz cercanos al infrarrojo en la piel del paciente. Después de extenderse por el interior de esta, parte de estos fotones retornan a la piel por reflectancia. Contabilizando el número de fotones que regresan, se puede concluir cuál ha sido la absorción espectral del tejido interior y estimar su oxigenación media. Para determinar la oxigenación tisular mediante NIRS se utilizan dos sensores situados en dos distancias distintas del punto transmisor. La diferencia entre las dos señales nos aportará la que corresponde al tejido localizado debajo de los sensores14.
Los ácidos grasos hiperoxigenados (AGHO) son productos compuestos por ácidos grasos esenciales que han sido sometidos a un proceso de hiperoxigenación y se caracterizan por presentar unas propiedades como aumentar la microcirculación sanguínea disminuyendo el efecto de la isquemia, potenciar la unión celular de la epidermis, facilitar la renovación de las células epidérmicas, aumentar la resistencia de la piel, proteger de la fricción, evitar la deshidratación cutánea, disminuir la fragilidad cutánea y reducir el efecto de los radicales libres en la matriz extracelular15.
En lo que hace referencia al efecto de los AGHO en el cuidado de la piel, existen evidencias experimentales de que Mepentol® (Alfasigma, Barcelona), un compuesto de AGHO con ácidos oleico y linoleico (ácidos esenciales), cuando se aplica de manera tópica, desarrolla un efecto proinflamatorio que facilita la regeneración del manto cutáneo y la estimulación de la producción de citoquinas (VEGF e IL-1) por parte de los neutrófilos para estimular la formación de nuevos vasos sanguíneos y, por tanto, acelerar así la cicatrización16. La formación de nuevos vasos sanguíneos aumenta la microcirculación de zonas con posibilidad de sufrir isquemia.
En un proceso inflamatorio, como podría ser el que se produce en una sepsis, los radicales libres de oxígeno tienen una gran repercusión en el desarrollo del proceso isquémico. Así, un exceso de radicales libres contribuye a la destrucción del endotelio al hacer que aparezcan más plaquetas y granulocitos, inducen al éxtasis de flujo sanguíneo produciendo microtrombosis y, como consecuencia, reduciendo el flujo sanguíneo y activando la formación de tejido necrótico. Se ha estudiado que la hiperoxigenación de los ácidos grasos reduce la formación de radicales libres16. Es por ello, que, de manera empírica, en nuestra institución se utiliza, de acuerdo con la evidencia que lo sustenta, el producto de AGHO antes mencionado en el cuidado de la piel de pacientes afectos de PF como medida complementaria de tratamiento local para minimizar la extensión de las zonas de necrosis, con efectos positivos determinados mediante observación clínica directa y control evolutivo en la PF del paciente pediátrico con sepsis.
La relevancia y necesidad de realizar el presente estudio radica en que no existe evidencia científica disponible en el campo pediátrico de la efectividad y del efecto en la microcirculación de este producto en la evolución de las lesiones purpúricas por sepsis.
Objetivos- -
Analizar la eficacia y la seguridad de la aplicación tópica de Mepentol®, un compuesto de AGHO en la microcirculación de la PF en pacientes pediátricos afectados de sepsis.
- -
Describir las características principales de los pacientes afectos de PF y de sus lesiones.
- -
Determinar la oximetría somática en las lesiones purpúricas en pacientes pediátricos afectados de sepsis antes y después de la aplicación protocolizada de AGHO y detectar posibles diferencias.
- -
Determinar las complicaciones que surgen tras aplicar tópicamente los AGHO en la piel del paciente pediátrico con PF secundaria a sepsis.
Se llevó a cabo un estudio prospectivo cuasiexperimental pretest-postest de un solo grupo en una UCIP de 24 camas ubicada en un hospital maternoinfantil de tercer nivel y de referencia nacional en Barcelona, España. La investigación se realizó de septiembre de 2017 a enero de 2022.
La población de estudio la configuraron pacientes que cumplieron los siguientes criterios de inclusión: (i) edad comprendida entre los 0 a 18 años, y (ii) que ingresasen en la UCIP con cuadro de sepsis y presencia de PF. Se excluyó a niños que presentaron criterios de isquemia crítica con ausencia de pulsos distales. Debido a la ausencia de estudios que hayan investigado la relación existente entre los AGHO y la PF, se realizó el presente estudio piloto en la UCIP de un hospital terciario. Por ello, no se determinó el cálculo muestral, sino que se tomó como referencia la casuística del centro que obedece a 2-3 casos al año de sepsis con dichas características. La selección de los pacientes se realizó de forma no probabilística y consecutiva.
Para cada caso se registraron las siguientes variables sociodemográficas y clínicas: (i) sexo (masculino/femenino), (ii) edad (en meses), (iii) horas de evolución de la enfermedad, (iv) tiempo (en días y horas) que habían pasado desde que empezaron a aparecer los primeros síntomas hasta el ingreso en la UCIP, (v) microorganismo patógeno implicado, (vi) localización de las lesiones, (vii) temperatura central (medida a nivel rectal o esofágico), (viii) saturación de hemoglobina, (ix) sedación (sí/no), (x) fármacos vasoacticos (sí/no), (xi) tipo de fármaco vasoactivo y (xii) presencia de edema (sí/no). Además, se determinó la oximetría somática mediante la colocación de un sensor de medición de perfusión tisular en la zona con PF y se monitorizaron las posibles reacciones adversas a los AGHO. Se consideraron como reacciones adversas la presencia o no de alteraciones hemodinámicas o de rash cutáneo tras la aplicación de AGHO.
IntervenciónLa principal intervención del estudio fue la aplicación de AGHO en las zonas purpúricas más afectadas. Para ello se utilizó como AGHO el Mepentol®, un producto sanitario de clase II B (uso tópico en piel intacta y en lesiones cutáneas superficiales) con evidencias experimentales y clínicas15, que se presenta en espray con una válvula que impide la contaminación del mismo. Este producto está compuesto por AGHO, Equisetum arvense, que mejora la elasticidad y tonicidad cutánea, e Hypericum perforatum, con propiedades preventivas y normalizantes de eritemas y actividad lenitiva y dermoprotectora.
Procedimiento de recogida de datosPara llevar a cabo el registro de todos los datos se diseñó un procedimiento y una parrilla ad hoc. Dicho procedimiento consistió en:
- 1.
Al ingreso de un paciente afectado de sepsis con PF, la investigadora principal informó a la familia del estudio y de sus objetivos y solicitó el consentimiento informado (CI) para su participación.
- 2.
Una vez aceptada la participación, se registraron todas las variables sociodemográficas y clínicas. Además, se identificaron las 3 o 4 zonas con PF más afectadas para proceder a la aplicación de los AGHO y determinación de oximetría somática. En este sentido, se priorizaron las lesiones más extensas y visualmente con aspecto más necrótico. Con la finalidad de homogenizar las intervenciones y la recogida de datos se realizaron tres sesiones formativas de una hora de duración aproximada, en turnos de mañana, tarde y noche a todas/os las/os enfermeras/os de la UCIP donde se realizó el estudio. En ellas se explicaron los objetivos y la metodología del estudio, detallando que se debían aplicar dos pulverizaciones de AGHO y que el compuesto debía ser extendido de forma suave por la zona lesional y perilesional. Además, se incidió en cómo se debían realizar y registrar las mediciones de oximetría antes y después de la intervención.
- 3.
Para cada paciente se seleccionaron hasta un máximo de 3 zonas purpúricas para aplicar los AGHO, priorizando las más afectadas.
- 4.
Se determinaron los valores de oximetría somática de cada una de las lesiones seleccionadas mediante la colocación de un sensor NIRS y se registraron los valores.
- 5.
Se aplicaron dos pulverizaciones de AGHO en las lesiones y perilesiones seleccionadas, extendiendo el producto con los dedos de manera suave.
- 6.
Transcurridos 30 minutos de la aplicación de los AGHO se retiró suavemente con una gasa el producto y se repitió la medición de la oximetría somática, procediendo al registro de valores.
- 7.
El procedimiento comentado en el punto 4 y 5 se repitió cada 4h, durante los 3 primeros días de ingreso del paciente.
Para describir las variables de los pacientes incluidos en el estudio se utilizaron estadísticos descriptivos con medidas de frecuencia para las variables cualitativas y medidas de tendencia central, de forma y de posición para las cuantitativas. Para evaluar el efecto de la intervención y los valores de oximetría somática antes y después de la aplicación de los AGHO se realizó la prueba T de Student. Se estableció un intervalo de confianza del 95% y los datos se consideraron estadísticamente significativos si p valor<0,05.
Consideraciones éticasLa presente investigación se ha realizado de acuerdo con la normativa estatal y autonómica relativa a estudios clínicos. Los datos de los pacientes obtenidos fueron protegidos de acuerdo con la normativa vigente sobre protección de datos, así como respetando los principios bioéticos que contempla el Informe Belmont y la Declaración de Helsinki. Previamente a la realización del estudio se solicitó autorización y permiso al Comité de Ética e Investigación Clínica del Hospital Sant Joan de Déu de Barcelona (PIC-170-16), para garantizar el cumplimiento de los principios éticos y normas de buena práctica y la buena praxis investigadora, así como a la dirección enfermera del centro en donde se realizó el estudio.
Antes de incluir a los pacientes en el estudio se informó verbalmente y por escrito de la finalidad de la investigación y se solicitó la firma del consentimiento informado. En este caso, al tratarse de población pediátrica, se preguntó a los progenitores del paciente o en su defecto a los tutores legales, si deseaban que sus hijos formasen parte del estudio, informándoles en todo momento del objetivo de la investigación, el procedimiento y de la posibilidad de retirarse del estudio si ellos lo creían necesario. En el caso de que el paciente superase los 12 años, si este se encontraba consciente y orientado, también prestó su consentimiento/asentimiento tras recibir la información necesaria adaptada a su nivel de entendimiento.
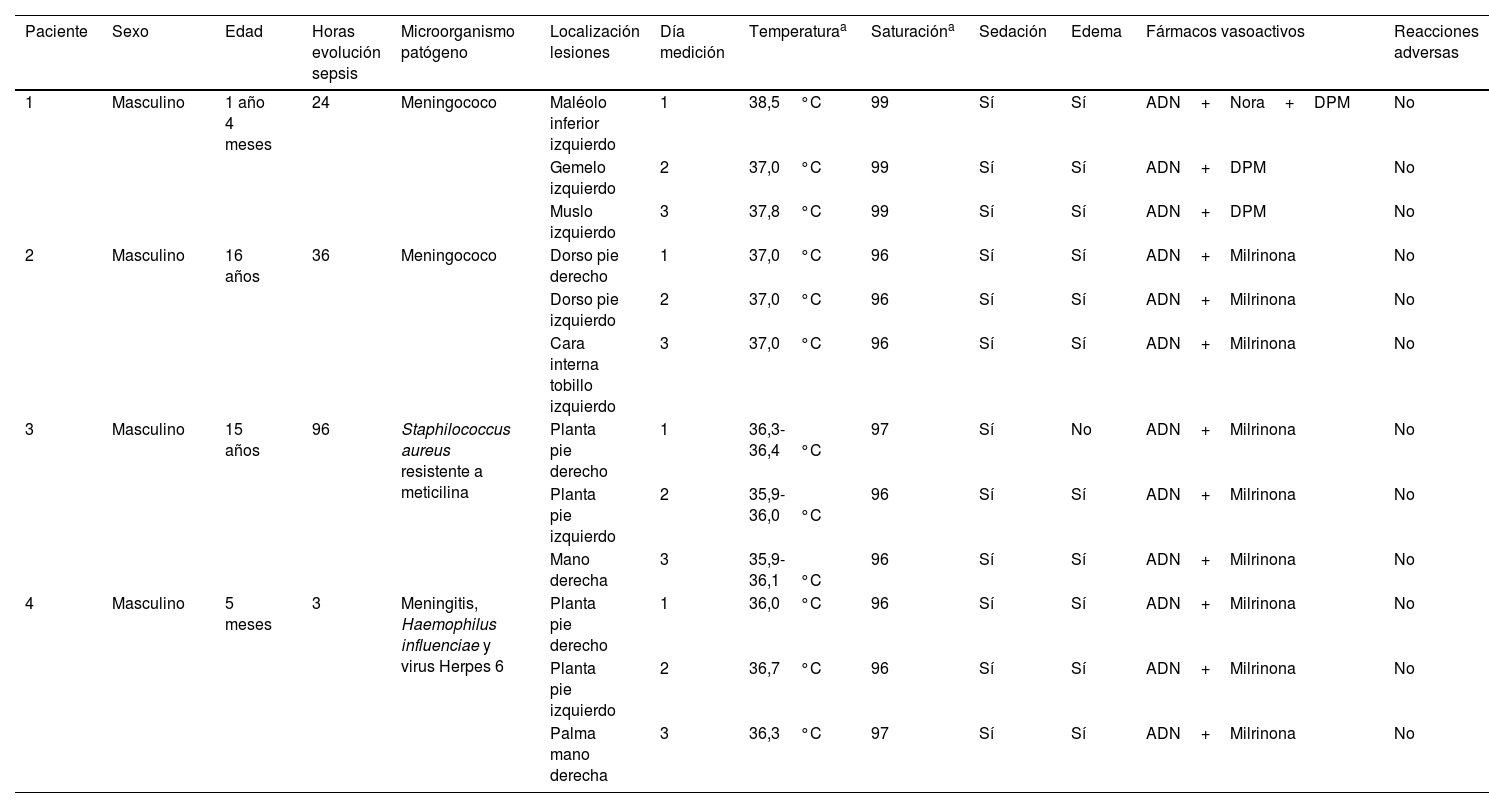
ResultadosDurante el período de estudio, se pudo reclutar a 4 pacientes, que presentaron un estado muy crítico con hipertermia e inestabilidad hemodinámica. Dos de ellos fallecieron durante su ingreso. La edad de los pacientes fue de 1 año y 4 meses, 16 años, 15 años y 4 meses (mediana de 98 meses). Los principales microorganismos patógenos implicados en la sepsis y aparición de PF fueron: meningococo, Staphilococcus aureus resistente a meticilina, Haemophilus influenciae y el virus Herpes 6.
Las lesiones purpúricas que se midieron estaban ubicadas, sobre todo, en ambos pies y manos y, en 2 pacientes, también en los maléolos laterales y gemelos de ambas extremidades inferiores. Todos los pacientes estaban ventilados mecánicamente, analgosedados en perfusión continua y con soporte inotrópico, siendo la adrenalina, noradrenalina, dopamina y milrinona los fármacos más empleados. La temperatura media de los pacientes fue de 36,8°C, alternando algún momento de hipertermia (máximo 38,5°C), y la saturación de hemoglobina (SatHb) media fue del 97% (tabla 1). Si analizamos las mediciones de oximetría somática desglosadas por paciente observamos los siguientes resultados:
- -
Paciente 1 (tiempo de seguimiento de 3 días):Se realizaron 74 mediciones apareadas. El valor medio de las mediciones preintervención fue de 67,2±19,5%, mientras que la media de las determinaciones postintervención fue de 70,5±18,5%. Se obtuvieron datos estadísticamente significativos (p<0,05) tras comparar las mediciones pre- y postintervención. A la vez, se objetivó que las mediciones postintervención eran un 0,8-5,7% superiores respecto a las correspondientes en la preintervención.
- -
Paciente 2 (tiempo de seguimiento de 3 días):Se llevaron a cabo 58 mediciones apareadas pre-postintervención. El valor medio de las mediciones preintervención fue de 75,6±14,6% versus los 79,2±12,7% postintervención (fig. 1). Tras comparar ambos valores se objetivó una p<0,05, por lo que consideramos el resultado estadísticamente significativo. Las mediciones postintervención fueron un 1,7-5,4% superiores respecto a las correspondientes mediciones preaplicación de AGHO.
- -
Paciente 3 (tiempo de seguimiento de 3 días):Se registraron 63 mediciones apareadas pre-postaplicación de AGHO. El valor medio de las mediciones preintervención fue de 72,6±7,4%, mientras que la media de las determinaciones postintervención fue de 74,4±7,7%. Al comparar los valores pre- y postintervención se obtuvieron datos estadísticamente significativos (p<0,05). En el caso del paciente 3, los análisis realizados estimaron diferencias de entre 0,1 y 3,4% entre las medidas pre- y postaplicación de AGHO.
- -
Paciente 4 (tiempo de seguimiento de 3 días):Se valoraron 30 mediciones apareadas pre-postintervención. El valor medio de las mediciones preintervención fue de 69,2±17,5%, mientras que la media de las determinaciones postintervención fue de 69,3±16,8%, no observándose relación estadísticamente significativa (p=0,96). Cabe considerar que este paciente vino con un estado de sepsis muy evolucionado y que a los 3 días falleció, lo que nos puede hacer pensar el por qué en este paciente los AGHO no han mostrado impacto en los valores postaplicación.
Características sociodemográficas y clínicas de los pacientes
| Paciente | Sexo | Edad | Horas evolución sepsis | Microorganismo patógeno | Localización lesiones | Día medición | Temperaturaa | Saturacióna | Sedación | Edema | Fármacos vasoactivos | Reacciones adversas |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Masculino | 1 año 4 meses | 24 | Meningococo | Maléolo inferior izquierdo | 1 | 38,5°C | 99 | Sí | Sí | ADN+Nora+DPM | No |
| Gemelo izquierdo | 2 | 37,0°C | 99 | Sí | Sí | ADN+DPM | No | |||||
| Muslo izquierdo | 3 | 37,8°C | 99 | Sí | Sí | ADN+DPM | No | |||||
| 2 | Masculino | 16 años | 36 | Meningococo | Dorso pie derecho | 1 | 37,0°C | 96 | Sí | Sí | ADN+Milrinona | No |
| Dorso pie izquierdo | 2 | 37,0°C | 96 | Sí | Sí | ADN+Milrinona | No | |||||
| Cara interna tobillo izquierdo | 3 | 37,0°C | 96 | Sí | Sí | ADN+Milrinona | No | |||||
| 3 | Masculino | 15 años | 96 | Staphilococcus aureus resistente a meticilina | Planta pie derecho | 1 | 36,3-36,4°C | 97 | Sí | No | ADN+Milrinona | No |
| Planta pie izquierdo | 2 | 35,9-36,0°C | 96 | Sí | Sí | ADN+Milrinona | No | |||||
| Mano derecha | 3 | 35,9-36,1°C | 96 | Sí | Sí | ADN+Milrinona | No | |||||
| 4 | Masculino | 5 meses | 3 | Meningitis, Haemophilus influenciae y virus Herpes 6 | Planta pie derecho | 1 | 36,0°C | 96 | Sí | Sí | ADN+Milrinona | No |
| Planta pie izquierdo | 2 | 36,7°C | 96 | Sí | Sí | ADN+Milrinona | No | |||||
| Palma mano derecha | 3 | 36,3°C | 97 | Sí | Sí | ADN+Milrinona | No |
ADN: adrenalina; DPM: dopamina; Nora: noradrenalina.
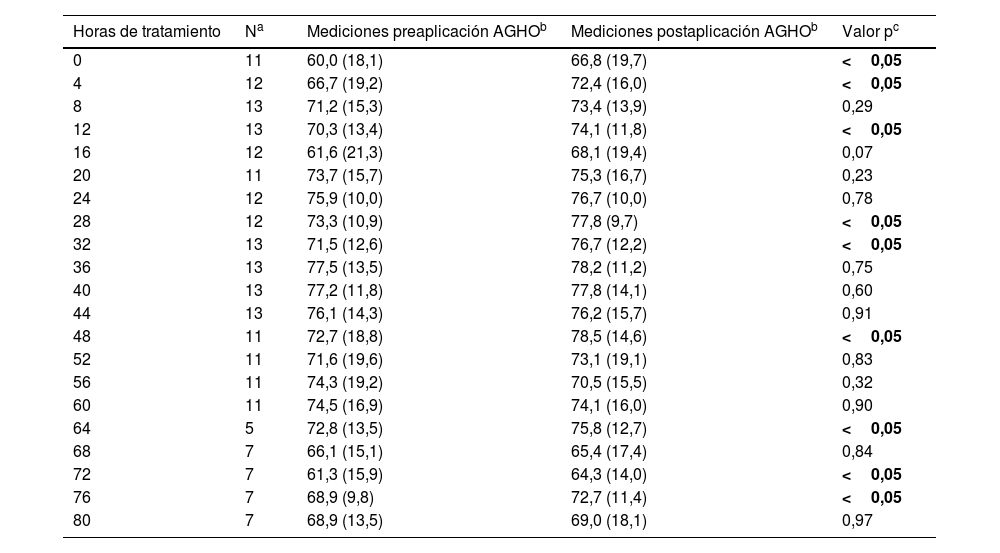
En relación con los datos globales registrados, se obtuvieron un total de 225 mediciones, observando unas puntuaciones medias preintervención de 71,2±15,6% versus los 73,7±14,8% postintervención, observándose relación significativa (p<0,05). Por tanto, se puede evidenciar que hay una diferencia estadísticamente significativa entre las mediciones pre- y postaplicación de AGHO en la globalidad de los datos obtenidos, obteniendo puntuaciones medias superiores de entre 1,3 y 3,6% en las determinaciones postintervención. Al analizar por horas todos los datos obtenidos, se objetivó una tendencia a mejorar los valores durante las primeras horas (al inicio, a las 4, a las 12, a las 28 y 32h de aplicación de los AGHO) (tabla 2).
Análisis de la oximetría somática según horas de aplicación de ácidos grasos hiperoxigenados (AGHO)
| Horas de tratamiento | Na | Mediciones preaplicación AGHOb | Mediciones postaplicación AGHOb | Valor pc |
|---|---|---|---|---|
| 0 | 11 | 60,0 (18,1) | 66,8 (19,7) | <0,05 |
| 4 | 12 | 66,7 (19,2) | 72,4 (16,0) | <0,05 |
| 8 | 13 | 71,2 (15,3) | 73,4 (13,9) | 0,29 |
| 12 | 13 | 70,3 (13,4) | 74,1 (11,8) | <0,05 |
| 16 | 12 | 61,6 (21,3) | 68,1 (19,4) | 0,07 |
| 20 | 11 | 73,7 (15,7) | 75,3 (16,7) | 0,23 |
| 24 | 12 | 75,9 (10,0) | 76,7 (10,0) | 0,78 |
| 28 | 12 | 73,3 (10,9) | 77,8 (9,7) | <0,05 |
| 32 | 13 | 71,5 (12,6) | 76,7 (12,2) | <0,05 |
| 36 | 13 | 77,5 (13,5) | 78,2 (11,2) | 0,75 |
| 40 | 13 | 77,2 (11,8) | 77,8 (14,1) | 0,60 |
| 44 | 13 | 76,1 (14,3) | 76,2 (15,7) | 0,91 |
| 48 | 11 | 72,7 (18,8) | 78,5 (14,6) | <0,05 |
| 52 | 11 | 71,6 (19,6) | 73,1 (19,1) | 0,83 |
| 56 | 11 | 74,3 (19,2) | 70,5 (15,5) | 0,32 |
| 60 | 11 | 74,5 (16,9) | 74,1 (16,0) | 0,90 |
| 64 | 5 | 72,8 (13,5) | 75,8 (12,7) | <0,05 |
| 68 | 7 | 66,1 (15,1) | 65,4 (17,4) | 0,84 |
| 72 | 7 | 61,3 (15,9) | 64,3 (14,0) | <0,05 |
| 76 | 7 | 68,9 (9,8) | 72,7 (11,4) | <0,05 |
| 80 | 7 | 68,9 (13,5) | 69,0 (18,1) | 0,97 |
Las mediciones postaplicación de AGHO fueron mayores en 156 casos (69,3%), en 19 ocasiones (8,4%) las mediciones pre y post fueron iguales y, en 50 casos (22,2%), las mediciones post fueron inferiores a la preintervención.
No se han observado diferencias estadísticamente significativas entre los datos pre y postintervención en las diversas variables sociodemográficas y clínicas analizadas, así como tampoco diferenciando por zona anatómica de medición. A la vez, se ha podido constatar que no apareció ninguna complicación tras aplicar tópicamente los AGHO en la piel de ninguno de los casos estudiados.
DiscusiónTodos los artículos revisados manifiestan la gravedad de los procesos de sepsis en la población pediátrica con una tasa de mortalidad muy elevada. Dentro de las complicaciones derivadas de la sepsis grave, la PF se caracteriza por desarrollar lesiones hemorrágicas, equimóticas y necrosis de la piel. Se inicia de forma aguda evolucionando y extendiéndose rápidamente por todo el cuerpo, incidiendo en extremidades inferiores y finalizando su evolución con la formación posterior de placas necróticas que frecuentemente desencadenan la pérdida del miembro. Ante la gravedad de la enfermedad se prioriza la estabilización hemodinámica del paciente y el manejo del cuadro séptico sin tratar en un inicio la PF, con las consecuencias funcionales que esta puede desencadenar. Aun así, no se han hallado estudios pediátricos que especifiquen la efectividad y seguridad de la aplicación de tratamientos tópicos específicos para mejorar o reducir la progresión de la PF. Ninguna investigación reporta evidencia sobre los beneficios del aumento de la oxigenación tisular de las zonas afectadas por la PF, tal como se refleja en el estudio piloto que se presenta. La presente investigación evidencia que la aplicación de AGHO podría tener un impacto en el tratamiento de la PF por sepsis, puesto que en la primera medición tras su aplicación, e incluso más allá de las 32h, se observó una mejora en el grado de oxigenación tisular de las lesiones analizadas. Esta idea se contrasta en otro estudio en el que se reporta el caso de un paciente neonatal tratado de forma similar y en el que se objetivó una mejoría de la perfusión de las lesiones purpúricas que padecía tras aplicar AGHO17. En nuestro estudio 3 de los 4 pacientes mejoraron sus niveles de microcirculación cutánea tras aplicar AGHO. En relación con las determinaciones, se objetivaron mejoras postintervención en casi un 70% de las mediciones.
Los tratamientos con fármacos vasoactivos están considerados un factor de riesgo de desarrollar lesiones por presión en los pacientes críticos puesto que su efecto vasoconstrictor reduce la perfusión periférica18. Todos los pacientes del estudio requirieron soporte con fármacos vasoactivos vasoconstrictores durante el primer día, incorporando en el segundo, tercer y cuarto caso soporte vasoactivo con milrinona, por su efecto vasodilatador, para intentar mejorar la isquemia distal de sus extremidades. Podríamos asociar el beneficio de dicho fármaco vasodilatador a la mejoría de la púrpura, si eso mismo se hubiese aplicado también en el primer caso. Sin embargo, en el primer paciente no solo no se utilizaron vasodilatadores, sino que se administraron 3 tipos diferentes de fármacos vasoconstrictores. Aun así, la mejoría de la oxigenación tisular de las zonas purpúricas estudiadas fue elevada, por lo que los AGHO podrían haber tenido un papel importante en este hecho.
Es conocido por diversos autores que ante una sepsis la respuesta inflamatoria que se produce desarrolla una alteración en la CID con un desequilibrio en la coagulación que llevará al paciente a sufrir pequeños trombos, que son los principales causantes del daño tisular en las zonas de vasos de menor calibre. Parte de esta alteración de la coagulación es fruto de la pérdida de proteína C. Esta proteína inactiva principalmente los factores de coagulación V y VII, lo que previene la generación de trombina y formación de dichos trombos19,20. Es tal la importancia de asegurar unos correctos niveles de proteína C que un estudio describe su aplicación en el tratamiento de la PF en pacientes con déficit congénito de esta, mostrando una estabilización de los parámetros de la coagulación21. Aun así, es importante destacar que la evidencia de la administración de concentrados de proteína C humana y proteína C activada recombinada en el manejo de la sepsis meningocócica fulminante queda discutida en la literatura con conclusiones poco claras22, por lo que se requieren de más estudios que contrasten la efectividad y seguridad de dichos tratamientos en el manejo del paciente pediátrico afecto de sepsis.
Otra de las alternativas terapéuticas documentada ante la falta de proteína C activada es la administración de plasma fresco, junto con anticoagulantes coma la heparina y la warfarina. Los autores de dicho estudio realizaron la mayor serie de casos de PF de etiología no séptica, sino por déficit congénito de proteína C. Los pacientes con déficit congénito de dicha proteína cursan también con equimosis que rápidamente evoluciona a necrosis y gangrena, por lo que requieren, al igual que los afectos por PF de origen séptico, tratamientos desbridantes y tienen un alto riesgo de sufrir amputaciones20. Por estos motivos, su manejo clínico puede servir de ejemplo para el manejo del paciente pediátrico con PF por sepsis.
Aunque en la presente investigación no se analizó la presencia de déficit de proteína C, una llevada a cabo de manera retrospectiva en la que se analizaron 94 casos pediátricos a los que se les administró proteína C no activada objetivó en un 79,8% de casos una recuperación o mejoría de las lesiones por PF, en un 13,8% se mantuvieron sin cambios y, en un 6,4% de los casos, hubo un deterioro23. Por tanto, la determinación del déficit de proteína C debería tenerse en consideración en futuras investigaciones y durante el manejo del paciente pediátrico afecto de PF por sepsis.
Además de lo mencionado anteriormente, el tratamiento de las lesiones purpúricas requiere desbridamiento de las zonas necróticas, escarectomías, fasciotomías y/o amputaciones. Este tratamiento no se debe realizar de manera temprana. Es preferible iniciarlo cuando los bordes de las lesiones están bien definidos y delimitados y no se objetivan signos de infección como la presencia de exudado purulento que indique un deterioro de la zona perilesional. La utilización tópica de AGHO facilita la delimitación de dichas áreas. Frecuentemente también es necesario la cobertura de las zonas desbridadas con injertos de dermis y aloinjertos, más las posteriores curas con terapias avanzadas como la terapia de presión negativa24.
Las diferencias en cuanto a la composición de los diferentes productos de AGHO existentes en el mercado condicionan su posible mecanismo de acción, por lo que los resultados del presente estudio solo son aplicables al producto utilizado en la investigación.
LimitacionesEl estudio que se detalla presenta como gran dificultad y limitación la falta de estudios con los que comparar los resultados y el tamaño muestral incluido, por tratarse de una patología con una muy baja incidencia. Aunque inicialmente se planteó incluir un mayor número de pacientes, la introducción en el calendario vacunal sistemático de Cataluña de la vacuna contra el meningococo dificultó este hecho porque, afortunadamente, disminuyó la incidencia de casos de pacientes pediátricos afectos de PF por sepsis. Aun así, los resultados obtenidos asientan evidencia para tratar tanto a aquellos casos pediátricos que aún siguen presentes en el contexto de estudio como a los que se den en los países en los que no existe esta vacuna en su calendario sistemático. Además, se plantea ampliar la muestra del presente estudio piloto, extendiendo la investigación a un contexto multicéntrico.
Otra de las limitaciones del estudio es la derivada del diseño. Para que esta investigación pudiera demostrar una relación directa entre la aplicación de AGHO y la mejoría de la microcirculación en la PF de pacientes pediátricos con sepsis se debería haber realizado un ensayo clínico aleatorizado (ECA). La limitación muestral comentada dificultó este hecho. Además, en el caso de plantear un ECA, el hecho de limitar el acceso de los AGHO en algunos pacientes habría comportado en el equipo investigador un dilema ético y moral, al dejar pacientes sin una opción que ha mostrado ser efectiva y exponerlos a un mayor número de secuelas relacionadas con PF. Finalmente, es importante remarcar que en la presente investigación únicamente se pudieron incluir sujetos del sexo masculino. A pesar de que no se espera encontrar diferencias entre sexos, este hecho se pretende subsanar en futuras ampliaciones del estudio.
ConclusionesEl presente estudio muestra cómo la aplicación precoz y continuada de AGHO en el manejo de la PF por sepsis es una práctica eficaz y segura en los casos de población pediátrica analizada. En más de la mitad de los episodios analizados se objetivó un aumento de microcirculación tisular tras la aplicación de los AGHO, sin eventos adversos. Aun así, se debe analizar el impacto que tienen otras variables relacionadas con el manejo clínico del paciente crítico pediátrico afecto de PF por sepsis, como la disminución o ausencia de proteína C y la administración de fármacos vasoactivos, en la evolución de dichas lesiones isquémicas y desarrollo de secuelas.
FinanciaciónEste estudio ha sido financiado total o parcialmente por la Fundación Enfermería y Sociedad del Colegio Oficial de Enfermeros y Enfermeras de Barcelona en el marco de las Ayudas competitivas a la Investigación Enfermera (PR-242 /2017).
Conflicto de interesesLos autores manifiestan no tener conflicto de intereses.
Los autores quieren agradecer de manera explícita la colaboración del equipo de enfermería y del equipo médico de la UCIP del hospital donde se ha realizado el estudio, así como a la dirección del centro y al Colegio Oficial de Enfermeros y Enfermeras de Barcelona por facilitar su realización.