Actualización en terapias renales
More infoEn las situaciones agudas, los pacientes pueden presentar asociaciones entre diversas patologías. Una de las más habituales en el paciente crítico es el fallo del riñón.
Los niveles de urea, creatinina y potasio, entre otros, son indicativos de la función renal sobre los cuales es necesario actuar para mantener el medio interno de los pacientes sin riesgo vital. La actuación sobre estos elementos se convierte en un elemento central para el control y el tratamiento de los pacientes críticos.
La valoración de esta patología en situaciones precoces resulta complicada. Por tanto, la vigilancia continua es una pieza fundamental para la prevención de empeoramientos debidos a diversas situaciones clínicas, como, por ejemplo, la afectación renal secundaria a fármacos nefrotóxicos en pacientes frágiles. Este juicio clínico, realizado de forma correcta, posibilita una actuación precoz de los profesionales sanitarios. Este texto nos aproximará a la clasificación de la lesión renal aguda como herramienta para fomentar su prevención y detectar su aparición. Para los profesionales en el área de cuidados críticos es fundamental manejar estos conceptos para garantizar una atención sanitaria de calidad.
In acute illnesses, patients may present associations between several pathologies. Kidney failure is one of the most common in critically ill patients.
Urea, creatinine and potassium blood levels, among others, are indicative of renal function and the health professionals need to be acted upon to maintain the patients’ internal functions without vital risk. Addressing these elements become a central element in the management and treatment of critically ill patients.
The assessment of this disorder in early stages is complicated. Therefore, continuous monitoring is a key element in the prevention of worsening due to various clinical situations such as, for example, renal dysfunction secondary to nephrotoxic drugs in frail patients. This clinical assessment, carried out correctly, enables health professionals to perform early intervention. This text will provide an approach to the classification of acute kidney injury as a tool to promote the prevention and to detect the incidence. For critical care staff, these concepts are essential to ensure high quality healthcare.
En los pacientes críticos, la afectación del sistema renal es una complicación habitual durante el ingreso. En los últimos años, la nomenclatura ha ido variando desde la insuficiencia renal aguda, pasando al fallo renal agudo y determinándose actualmente como lesión renal aguda (LRA) y definida por la comunidad científica global por su acrónimo en inglés AKI (Acute Kidney Injury). Esta afección, según distintos estudios, puede llegar a una prevalencia de entre el 20 y el 60%1,2. Esta gran variabilidad ha sido estudiada desde hace tiempo y tiene mucho que ver con las definiciones y las clasificaciones utilizadas3. De esta forma, surge en la comunidad científica la necesidad de estandarizar las clasificaciones de la enfermedad renal en fase aguda4,5.
El objetivo prioritario de los servicios sanitarios es desarrollar y proporcionar unos adecuados niveles asistenciales, fomentando la seguridad del paciente y contribuyendo a la detección y al tratamiento de esta patología. Los pacientes que sufren fallo renal agudo tienen peores resultados en su evolución clínica, peor pronóstico y una mayor morbimortalidad6, además de que muchos de ellos pueden desarrollar posteriormente una insuficiencia renal crónica7. Incluso el desarrollo de esta entidad nosológica ha sido descrito como un factor independiente de mortalidad2,3. A la LRA se le han atribuido hasta 1,7 millones de muertes cada año en el mundo1, dato que demuestra que se trata de una patología con una alta letalidad entre los pacientes críticos, con el consecuente aumento de los costes para los servicios sanitarios.
La LRA incorpora una etiología multicausal que debe ser conocida por los profesionales sanitarios a la hora de prevenir, identificar y tratar adecuadamente8. Los factores presentes en el desarrollo de una lesión renal aguda incluyen: los factores genéticos, la edad, el sexo y las comorbilidades preexistentes9. Además, hay que añadir el contexto en el cual se encuentra el paciente en ese momento. Las agresiones a las que se somete el riñón deben ser prevenidas y, en su defecto, ser tratadas de la manera más precoz posible. Entre las agresiones frecuentes en los pacientes críticos tenemos la sepsis y los fármacos nefrotóxicos10-12. Honore et al.13 determinaron en los pacientes sépticos una alta tasa de desarrollo de LRA. Se estima que la incidencia de sufrir LRA en pacientes sometidos a extracorporeal membrane oxygenation (ECMO) se encuentra entre el 70 y el 85%14. Todos los profesionales sanitarios que atienden a un paciente crítico deben ser capaces de reconocer los factores predisponentes para el desarrollo de una lesión renal aguda5,15. La identificación de la etiología del fallo del renal se convierte en un elemento fundamental para garantizar una atención de calidad, pues la atención y los cuidados deben ir centrados en solucionar la agresión recibida. Debido a sus características fisiopatológicas, pueden existir disfunciones a distintos niveles16. La disminución de la perfusión sanguínea al riñón o una hipotensión prolongada pueden provocar insuficiencia renal prerrenal. Van der Ven et al.17, en una consulta hecha a profesionales de cuidados intensivos (UCI) europeos, opinaban que la hipotensión era la causa más frecuente de LRA. El uso de fármacos nefrotóxicos, las intoxicaciones por herbicidas y solventes orgánicos, además de los daños en los vasos, los glomérulos y los túbulos, serán consideradas de afectación parenquimatosa16.Por otra parte, pueden existir causas obstructivas que imposibiliten la excreción de la orina al exterior. Por esta razón es necesario identificar lo antes posible la causa que ha llevado al fallo renal9. Actualmente en muchas UCI está protocolizada la vigilancia del incremento de la presión abdominal, constituido como síndrome compartimental abdominal, ya que se ha observado como una etiología de disminución de la función renal18. Por tanto, vigilar la presión intraabdominal de manera indirecta a través de la vejiga y manteniendo unos valores <20mmHg se ha convertido en una práctica habitual en la UCI18.
A pesar de los recientes avances para poder contar con marcadores de daño renal que identifiquen de manera precoz los casos de lesión renal aguda19, actualmente seguimos necesitando el uso de las herramientas con las cuales hemos contado en los últimos años, como son la creatinina, el filtrado glomerular y la diuresis horaria9,20. La presencia de alteraciones en el débito urinario, además de repercutir en otros sistemas por un mal manejo de líquidos, ha llevado a homogeneizar la clasificación de esta identidad y su gradación clínica.
ObjetivosReconocer las distintas clasificaciones de la lesión renal aguda, así como su importancia en el manejo y en el tratamiento de los pacientes críticos.
Clasificaciones de la lesión renal agudaLa necesidad clínica de detectar de manera precoz el fallo renal ha provocado el desarrollo de diversas herramientas centradas en indicadores y en manifestaciones clínicas del mal funcionamiento de este órgano fundamental. Diferentes escalas han sido probadas en el ámbito internacional en los últimos 20años. La necesidad de un consenso clínico ha animado a la comunidad científica a ir desarrollando distintas conferencias sobre el tema3,21,22.
El primer consenso internacional para la clasificación de lesión renal aguda fueron los criterios RIFLE, propuestos en el año 2002. Esta clasificación viene determinada por el acrónimo en inglés de cada uno de los estadios del fallo renal agudo: Risk, Injury, Failure, Loss y End stage kidney disease (tabla 1).
Escala RIFLE
| Estadio | Criterios de función renal | Criterios urinarios |
|---|---|---|
| Risk / Riesgo | Incremento de la creatinina sérica*1,5 o Descenso del filtrado glomerular >25% | DmH <0,5ml/kg/h durante más de 6horas |
| Injury / Lesión | Incremento de la creatinina sérica*2 o Descenso del filtrado glomerular >50% | DmH <0,5ml/kg/h durante más de 12horas |
| Failure / Fallo | Incremento de la creatinina sérica*3 o creatinina >4mg/dl. Descenso del filtrado glomerular >75% | DmH <0,3ml/kg/h durante 24horas o anuria en 12horas |
| Loss / Pérdida | Pérdida total de la función renal durante más de 4semanas | |
| End stage kidney disease / Enfermedad renal terminal | Pérdida total de la función renal durante más de 3meses |
DmH: diuresis media horaria.
A efectos de clasificación solo es necesario uno de los criterios. En caso de que haya criterios en estadios distintos, se elegirá el peor.
Esta clasificación permitió identificar la fase en la que se encontraba cada paciente. Se observó además que, según la severidad del estadio, se incrementaba la probabilidad de morir y se elevaba la necesidad de terapias de depuración renal23. Una de las mayores dificultades de esta clasificación era, por un lado, la necesidad de contar con una creatinina basal y, por el otro, que esta clasificación fue creada para adultos. Se consensuó que valores de creatinina mayores de 4mg/dl se consideraba una situación de fallo. Esta decisión se tomó para no retrasar la estratificación de los pacientes y por el hecho de que el filtrado glomerular (FG) era lento a la hora de adoptar decisiones5. Para la población pediátrica, se consideró que era necesario utilizar un aclaramiento estimado de creatinina, donde valores inferiores a 35ml/min/1,73m2 se considera ya un estadio 35. A modo de ejemplo, consideremos un paciente que ingresa con un valor de creatinina basal de 1,21mg/dl: si se eleva a 1,81mg/dl lo clasificaremos, según la escala RIFLE, como «riesgo»; si detectamos un valor de 2,42mg/dl, sería clasificado de «lesión», y si llegara a 3,63mg/dl, sería «fallo».
También se considera que es necesario en todo momento tratar cualquier estadio mediante la resolución de las causas de manera precoz y con medidas específicas16,24. Esta escala se convirtió en una herramienta de uso clínico muy extendido por su facilidad y por la disponibilidad de elementos10,23,25.
Posteriormente, en 2006, se desarrolló otra clasificación buscando la homogeneidad a nivel internacional. Así surgió la escala AKIN (Acute Kidney Injury Network). Esta escala buscaba consensos a la hora de aplicar un mismo instrumento, para poder hacer una adecuada comparación entre las distintas investigaciones realizadas a nivel internacional. Esta clasificación englobaba los estadios de la LRA en tres, tal como se muestra en la tabla 2.
Escala AKIN
| Estadio | Criterios de función renal | Criterios urinarios |
|---|---|---|
| AKIN 1 | Incremento de la creatinina sérica ≥150% basaloIncremento absoluto ≥0,3mg/dl (≥26,4μmol/l) | DmH <0,5ml/kg/h durante más de 6horas |
| AKIN 2 | Incremento de la creatinina sérica basal entre el 200 y el 300% | DmH <0,5ml/kg/h durante más de 12horas |
| AKIN 3 | Incremento de la creatinina sérica basal superior al 300% o creatinina ≥4mg/dl (≥353,61μmol/l) | DmH <0,3ml/kg/h durante 24horas o anuria en 12horas |
DmH: diuresis media horaria.
Los pacientes tratados con terapias de depuración renal son englobados directamente en AKIN3, independientemente de los valores analíticos y clínicos.
Siguiendo la clasificación AKIN que se muestra en la tabla 2, a un paciente que ingresa en urgencias con un valor de creatinina de 88,4μmol/l, y al ingreso en la UCI ya presenta el valor de 116,1μmol/l, se le debe clasificar como AKIN1, pues ha tenido un incremento absoluto mayor de 26,4μmol/l.
En este momento, debido a que se contaba ya con dos herramientas, se comenzaron a realizar estudios comparativos entre las dos propuestas. Esto comenzó a generar distintas conclusiones. Por ejemplo, Joannidis et al.26 observaron que la escala RIFLE era más sensible en las primeras 48horas para detectar episodios de LRA. En su estudio multicéntrico, Salgado et al.27 observaron que RIFLE identificaba más casos de insuficiencia renal aguda que la escala AKIN, siendo el criterio urinario más útil.
En el año 2012, en una reunión internacional de consenso, se adopta la escala KDIGO (Kidney Disease Improving Global Outcomes). Esta escala continúa la estructura de las dos escalas anteriores y se desarrolla de forma muy parecida (tabla 3).
Clasificación KDIGO
| Estadio AKI | Creatinina sérica | Flujo urinario |
|---|---|---|
| Estadio 1 | 1,5-1,9 veces el valor de la creatinina basal o incremento ≥0,3mg/dl (≥26,4μmol/l) | <0,5ml/kg/h durante 6-12horas |
| Estadio 2 | 2-2,9 veces el valor de la creatinina basal | <0,5ml/kg/h durante más de 12horas |
| Estadio 3 | 3 veces el valor de la creatinina basaloValor de la creatinina sérica ≥4mg/dl (≥353,61μmol/l)oInicio de tratamiento sustitutivo renaloEn pacientes menores de 18años descenso del filtrado glomerular por debajo de 35ml/min/1,73m2 | <0,3ml/kg/h durante más de 24horasoanuria durante 12horas |
AKI: Acute Kidney Injury.
Después de la aplicación de estas tres escalas, se observó la necesidad de definir cuál de ellas se ajustaba más a las necesidades de la clínica. Detectar el concepto de enfermedad aguda también se convirtió en un elemento de preocupación. Este hecho es debido a que el proceso agudo es más frecuente en contextos hospitalarios e interrelacionados con distintas patologías y puede llegar desde una evolución en 48horas hasta una semana. La agresión se considera brusca y, por tanto, la afectación de la funcionalidad del riñón se desarrolla más rápidamente5. La evaluación de los factores de riesgo para desarrollar una LRA debe convertirse en una atención personalizada a cada paciente y acorde a las características que lo conforman. Muchos pacientes sufren una única agresión (hipotensiones arteriales, sepsis, trauma, etc.) que les provoca un daño renal agudo; este debe ser detectado con una adecuada monitorización, evitando la exposición a otros elementos agresores e implementando medidas de soporte adecuadas17,28.
También debe minimizarse el tiempo de detección de los precursores de posibles eventos lesivos del riñón. Se ha observado que la sepsis, las cirugías complejas y los fármacos nefrotóxicos son elementos precursores y se deben tener en cuenta a la hora de desarrollar herramientas de detección que eviten un tiempo de daño prolongado10,12,28,29. Los pacientes que desarrollan una enfermedad renal subclínica con los marcadores funcionales normales, pero con alteraciones de los biomarcadores de daño renal, tienen peores resultados clínicos (incluyendo mortalidad y necesidad de diálisis). Este hecho también puede suceder en pacientes con insuficiencia prerrenal debido a la dilución de los marcadores funcionales por las cargas de volumen8.
El estudio de Koeze et al.21 determinó que tanto la escala AKIN como la KDIGO detectan más episodios de LRA que la escala RIFLE, y que la adición de los criterios de diuresis es un factor que adelanta la detección de estos episodios. En la población pediátrica, a la hora de aplicar las tres escalas se observó que la escala pRIFLE (adaptada a pediatría) era más sensible y detectaba más casos leves. La escala AKIN no precisaba pesos ni valores previos, lo que la hacía útil ante la ausencia de antecedentes, y la escala KDIGO era eficaz tanto para la población pediátrica como para la adulta30. La adición de los criterios urinarios a las escalas utilizadas influye en la incidencia y en el resultado del desarrollo de la LRA, siendo más rápida la detección que el uso único de los valores de creatinina21.
Esta estadificación de la enfermedad renal influye a la hora de aplicar medidas de soporte, como son las terapias depurativas. Se establece que en el estadio3 los pacientes precisan esta medida de soporte, e incluso en el estadio2, cuando se encuentran presentes algunos de los factores predisponentes, como es la inestabilidad del paciente o la presencia de sepsis13. El inicio de soporte renal requiere la detección precoz del nivel de agresión. Mientras surgen marcadores eficaces, dependerá de la valoración que se haga del paciente por otros medios31. El exceso de resucitación volumétrica en pacientes con ciertas patologías graves puede constituir un evento adverso que se ha de vigilar estrechamente y podría ser un problema añadido al fallo renal15,32.
La formación de los sanitarios, y más concretamente de las enfermeras de cuidados críticos, es una preocupación que lleva a adoptar medidas formativas que aseguren una identificación adecuada tanto de los factores de riesgo como de las situaciones ya establecidas para lograr una atención de la mejor calidad posible8,9,31. Esto nos indica que las nuevas afecciones clínicas pueden cambiar el escenario al que nos enfrentamos en el día a día. Tal como observan en su revisión bibliográfica Silver et al.33, la LRA en la pandemia COVID-19 ha tenido también su repercusión en los casos de afectación renal, ya que el 30% de los pacientes ingresados en hospitalización desarrollaron una LRA, el 45% de estos pacientes precisaron ingreso en la UCI y, de estos, el 20% necesitaron terapias de depuración extracorpórea.
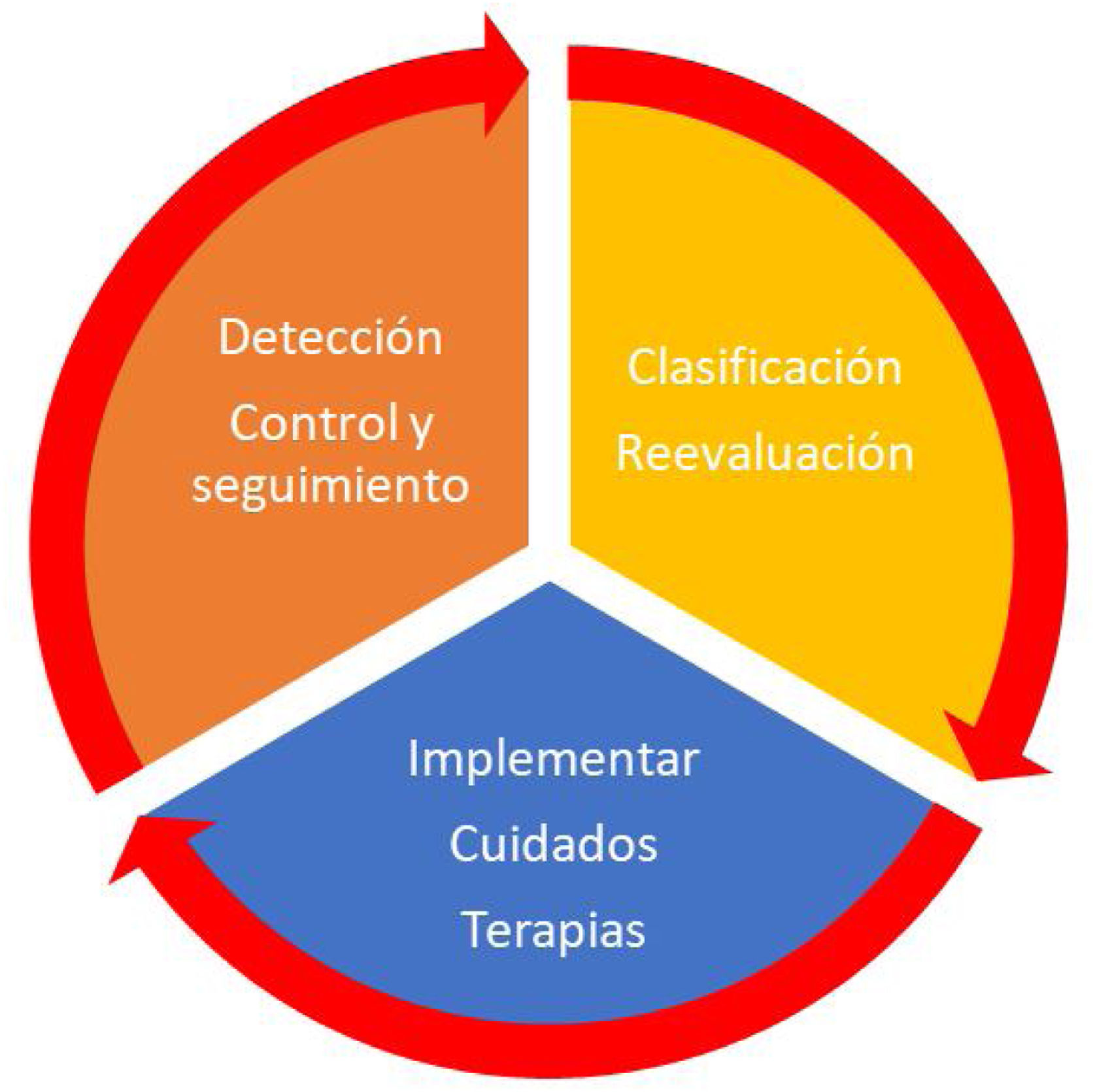
Es un elemento central que se mantenga continuamente una actitud de vigilancia. Las recaídas han sido detectadas hasta a las 72horas de la mejoría de la situación clínica, provocando reagudizaciones de la afectación renal6. Cada profesional debe valorar de manera continua y activa qué factores han mejorado, cuáles han empeorado y en qué situación clínica se encuentra el paciente. Es preciso un pensamiento crítico del profesional y un juicio clínico que utilice la clasificación de modo habitual en el contexto sanitario, tal como se aprecia en la figura 1.
Implementar todos aquellos elementos que dentro de las instituciones sanitarias puedan describir la situación ante esta entidad nosológica, evaluando y desarrollando una política de detección activa y precoz, promueve entre los sanitarios la posibilidad de actuaciones rápidas y consecuentes que mejorarían los resultados clínicos que ya observan distintas investigaciones34,35. La calidad de la atención debe estar basada en todos aquellos elementos que garanticen una correcta identificación y registro de los datos, llevándolo a cabo de forma sistematizada y garantizando la adaptación de las actuaciones a los recursos disponibles de las instituciones sanitarias7,15,20,21,36,37.
ConclusiónLa sistematización de la detección de la LRA, así como la clasificación de los elementos que la constituyen, se han demostrado útiles como herramientas clínicas a la hora de estratificar tanto terapias como cuidados. El camino recorrido en estos últimos años nos ha ofrecido tres escalas que se han utilizado ampliamente, dejando pros y contras en su aplicación.
El desarrollo de habilidades, la formación y la gestión del conocimiento deben garantizarse de forma continua durante la vida profesional de las enfermeras, impulsando y fomentando un ambiente propicio para la formación y la actualización en un entorno multidisciplinar como son las unidades de cuidados críticos.
Potenciar la investigación clínica puede ser una oportunidad para las enfermeras de desarrollar evidencias en el cuidado de estos pacientes mediante el cribado de casos de afectación renal.
Las enfermeras de cuidados críticos debemos garantizar una vigilancia sistemática y precisa de los parámetros clínicos que puedan alertarnos del deterioro de la función renal del paciente crítico. Garantizar la seguridad del paciente, evitando procedimientos que puedan ponerlo en peligro, se convierte en un elemento fundamental para proporcionar una asistencia sanitaria de calidad.
Conflicto de interesesLos autores declaran no tener conflictos de intereses relacionados con el artículo.