La efectividad del tratamiento del virus de la hepatitis C (VHC) parece ser menor en usuarios de drogas por vía parenteral (UDVP). Analizamos la influencia de diversos factores como los trastornos psiquiátricos y la terapia de sustitución con opiáceos (TSO) en el tratamiento con antivirales de acción directa (AAD) de este colectivo.
Pacientes y métodosTrescientos treinta y dos pacientes UDVP fueron tratados con AAD en 12 hospitales de España entre 2004 y 2020. Se catalogaron, si se disponía del dato, en consumidores recientes y pasados (según si el último consumo fue en los últimos 3 años) y se recogieron diversas variables, evaluándose la efectividad del tratamiento según la carga viral 12 semanas tras la finalización del tratamiento con el parámetro «respuesta viral sostenida» (RVS12).
ResultadosEl 23,4% eran consumidores recientes y el 27,7% estaban en TSO. El 41,5% presentaban algún diagnóstico de enfermedad psiquiátrica. La RVS12 fue del 84,04%, ascendiendo al 96,21% al excluir del análisis a los pacientes que perdieron el seguimiento (12,7%). La RVS12 fue significativamente inferior debido a un aumento de la pérdida de seguimiento en consumidores recientes, aquellos en TSO, los que habían estado en prisión los últimos 5 años y pacientes naïve, así como en el trastorno de ansiedad generalizada y consumidores de benzodiacepinas.
ConclusionesLa efectividad del tratamiento del VHC con AAD en UDVP es similar a la población general si se consigue un adecuado seguimiento. Es importante realizar un seguimiento más estrecho en pacientes en TSO, consumidores recientes y aquellos con enfermedad psiquiátrica.
The effectiveness of the hepatitis C virus (HCV) treatment seems to be lower in people who inject drugs (PWID). We analyze the influence of various factors as psychiatric disorders and opioid substitution therapy (OST) on the treatment with direct-acting antivirals (DAA) in this collective.
Patients and methodsThree hundred thirty-two PWID patients were treated with DAA in 12 Spanish hospitals between 2004 and 2020. They were catalogued in recent and former consumers (if the last consumption was in the last 3 years) and several variables were included, evaluating the effectiveness of the treatment according to the viral load 12 weeks after the end of the treatment with the parameter «sustained viral response» (SVR12).
Results23.4% were recent consumers and 27.7% were on OST. The 41.5% had any diagnosis of psychiatric disorder. SVR12 was 84.04%, ascending to 96.21% when excluded from the analyses the patients lost to follow-up (12.7%). SVR12 was lower due to an increase in the loss to follow-up in recent consumers and other factors like OST, being in prison the last 5 years, naïve patients, generalized anxiety disorder and benzodiazepine consumption.
ConclusionsThe effectiveness of the HCV treatment with DAA in PWID is similar than in general population in patients whit an appropriate follow-up. It is important to maintain a closer follow-up in patients on OST, recent consumers and those with psychiatric disorders.
La infección por el virus de la hepatitis C (VHC) constituye en la actualidad una de las principales causas de hepatopatía crónica, cirrosis y carcinoma hepatocelular1.
Tradicionalmente, el tratamiento de la enfermedad ha sido poco efectivo y con una elevada tasa de efectos secundarios2; desde 2013, con el desarrollo de nuevos antivirales orales de acción directa, las pautas de tratamiento de la enfermedad ha conseguido tener una elevada efectividad, baja tasa de efectos secundarios e interacciones y fácil posología1,3,4. Tanto es así, que la OMS ha marcado como como objetivo la erradicación mundial de la infección por VHC en el año 20305.
Para conseguirlo, es necesario prestar especial atención a algunos subgrupos de difícil tratamiento como son los usuarios de drogas por vía parenteral (UDVP)6.
El VHC se transmite fundamentalmente por vía parenteral, de modo que los UDVP constituyen actualmente el colectivo con mayor prevalencia de la infección (60%) y la mayor parte de los casos incidentes (80%)7, sobre todo en los países desarrollados1,8.
Además de ser los principales transmisores del virus por su etiopatogenia, suelen ser personas que con frecuencia presentan comorbilidades tanto médicas como psiquiátricas9, factores que aumentan la rapidez de progresión de la enfermedad hepática10 y dificultan la toma de decisiones sobre su manejo11,12.
Los UDVP tradicionalmente se han visto excluidos para el tratamiento por una menor efectividad, baja adherencia con pérdida de seguimiento2,13, mayor número de efectos secundarios y elevado riesgo de reinfección6. Por estos motivos, en la actualidad un porcentaje importante de estas personas todavía no han sido tratadas en nuestro medio14. No obstante, en distintos estudios se ha ido demostrando que la menor efectividad del tratamiento se ha visto influida más por un problema de adherencia al mismo que por la efectividad en sí de los fármacos15,16.
El objetivo del presente estudio es valorar la efectividad del tratamiento con antivirales de acción directa (AAD) en el subgrupo de pacientes UDVP con VHC y la influencia en la misma de variables como las enfermedades mentales o la terapia sustitutiva con opiáceos (TSO) entre otros.
Material y métodosParticipantesSe realizó un estudio de cohortes colaborativo multicéntrico, con un análisis retrospectivo de datos recogidos prospectivamente sobre enfermos tratados de hepatitis C entre julio de 2014 y diciembre de 2020 en 12 hospitales de España. Se incluyeron en el estudio pacientes mayores de 18 años diagnosticados de hepatitis crónica VHC tratados con AAD, con o sin cirrosis, tanto naïve como pretratados. El régimen de tratamiento fue el indicado por cada médico responsable según las guías clínicas vigentes en ese momento. La duración del tratamiento fue de 8, 12, 16 o 24 semanas, añadiendo o no ribavirina (RVB) a juicio de sus médicos.
VariablesSe recogieron las siguientes variables: edad, sexo, presencia de diabetes mellitus, grado de fibrosis hepática, infección VIH, haber estado en prisión en los últimos 5 años, genotipo viral, cirrosis, descompensación, carga viral y si recibieron tratamiento previo. Respecto a los hábitos tóxicos los pacientes fueron clasificados como consumidores de drogas recientes si la fecha de último consumo fue en los últimos 3 años, o pasados si fue posterior (clasificación según estudios previos), y de alcohol (analizados como consumidores de más de 30 y más de 80g de alcohol al día), así como el consumo adicional de marihuana y cocaína en la actualidad. Se recogió si estaban en TSO y el tipo de tratamiento específico.
Se incluyó el diagnóstico de trastorno psiquiátrico no relacionado con las drogas catalogado según el manual DSM-5 y el tipo de fármacos para tratar las mismas.
El grado de fibrosis hepática se evaluó mediante biopsia hepática, índices de fibrosis, elastografía transitoria (FibroScan®), MELD y Child-Pugh. Los valores de corte de la elastografía fueron los siguientes: F0-1 hasta 6,9kPa; F2 entre 7 y 9,4kPa; F3 entre 9,5 y 12,4kPa.; F4 a partir de 12,5kPa.
El seguimiento se realizó en consulta al inicio y final del tratamiento y 12 semanas postratamiento. Se consideró curación de la infección la presencia de una carga viral del VHC indetectable a las 12 semanas de su conclusión (RVS12), aunque también se recogió la carga viral al finalizar el tratamiento. La carga viral se cuantificó por medio de COBAS® TaqMan® HCV assay (versión 2.0; Roche), con un límite inferior de cuantificación de 15UI/ml y un límite inferior de detección de 10UI/ml.
Teoría/cálculosEl análisis estadístico se realizó con el programa SPSS® versión 23. Se analizaron las características basales utilizando medidas de frecuencia (absolutas y porcentajes) para las variables cualitativas, y media (con IC al 95%) y desviación estándar para las cuantitativas. Se calculó la RVS12 obtenida entre los distintos subgrupos de pacientes en función de consumo reciente o pasado, estar o no en TSO y se realizó análisis univariante según las características demográficas.
Para la comparación de las variables categóricas se aplicó el test estadístico Chi-cuadrado o el test exacto de Fisher según procedía. Para la comparación de las variables cuantitativas se utilizaron la prueba ANOVA, Kruskal-Wallis, U de Man-Whitney o la t de Student, según procedía. En todos los casos se consideraron como significativas aquellas diferencias cuyo valor p asociado a la prueba de contraste fue menor o igual a 0,05.
ResultadosCaracterísticas demográficasDe un total de 332 pacientes con antecedentes de uso de drogas por vía parenteral (UDVP) se disponía el dato de la fecha de último consumo en 188, siendo de ellos el 76,6% consumidores pasados (más de 3 años del último consumo) y el 23,4% consumidores recientes (menos de 3 años).
De 188 pacientes, 52 (27,7%) estaban en TSO. Entre estos, el 57,7% eran consumidores recientes y el 42,3% pasados.
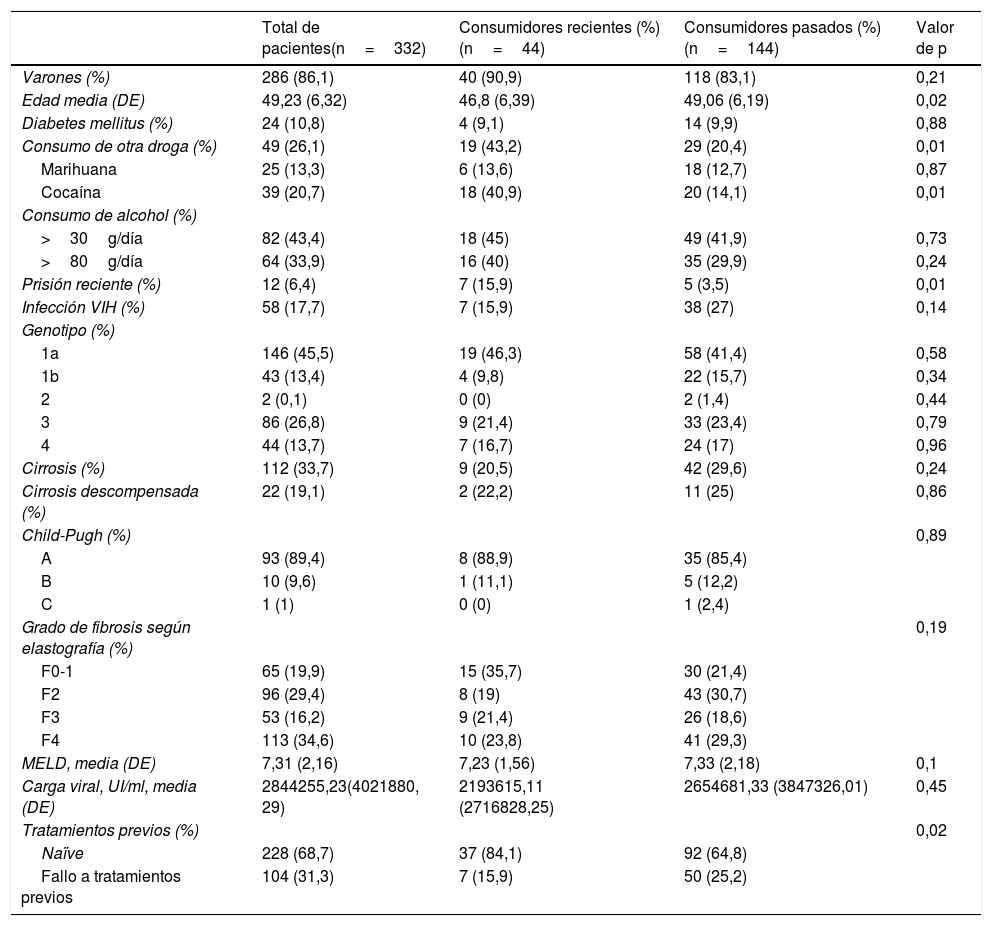
Se recogieron las variables edad, sexo, causa de la infección, presencia de diabetes mellitus, infección VIH, genotipo, cirrosis, descompensación, Child-Pugh, Fibroscan® basal, valor MELD, carga viral, tratamiento previo, consumo de alcohol y otras drogas, y se dividieron según fueran consumidores recientes o pasados, indicando el valor p de las diferencias entre ambos grupos (tabla 1).
Características demográficas de los pacientes
| Total de pacientes(n=332) | Consumidores recientes (%)(n=44) | Consumidores pasados (%) (n=144) | Valor de p | |
|---|---|---|---|---|
| Varones (%) | 286 (86,1) | 40 (90,9) | 118 (83,1) | 0,21 |
| Edad media (DE) | 49,23 (6,32) | 46,8 (6,39) | 49,06 (6,19) | 0,02 |
| Diabetes mellitus (%) | 24 (10,8) | 4 (9,1) | 14 (9,9) | 0,88 |
| Consumo de otra droga (%) | 49 (26,1) | 19 (43,2) | 29 (20,4) | 0,01 |
| Marihuana | 25 (13,3) | 6 (13,6) | 18 (12,7) | 0,87 |
| Cocaína | 39 (20,7) | 18 (40,9) | 20 (14,1) | 0,01 |
| Consumo de alcohol (%) | ||||
| >30g/día | 82 (43,4) | 18 (45) | 49 (41,9) | 0,73 |
| >80g/día | 64 (33,9) | 16 (40) | 35 (29,9) | 0,24 |
| Prisión reciente (%) | 12 (6,4) | 7 (15,9) | 5 (3,5) | 0,01 |
| Infección VIH (%) | 58 (17,7) | 7 (15,9) | 38 (27) | 0,14 |
| Genotipo (%) | ||||
| 1a | 146 (45,5) | 19 (46,3) | 58 (41,4) | 0,58 |
| 1b | 43 (13,4) | 4 (9,8) | 22 (15,7) | 0,34 |
| 2 | 2 (0,1) | 0 (0) | 2 (1,4) | 0,44 |
| 3 | 86 (26,8) | 9 (21,4) | 33 (23,4) | 0,79 |
| 4 | 44 (13,7) | 7 (16,7) | 24 (17) | 0,96 |
| Cirrosis (%) | 112 (33,7) | 9 (20,5) | 42 (29,6) | 0,24 |
| Cirrosis descompensada (%) | 22 (19,1) | 2 (22,2) | 11 (25) | 0,86 |
| Child-Pugh (%) | 0,89 | |||
| A | 93 (89,4) | 8 (88,9) | 35 (85,4) | |
| B | 10 (9,6) | 1 (11,1) | 5 (12,2) | |
| C | 1 (1) | 0 (0) | 1 (2,4) | |
| Grado de fibrosis según elastografía (%) | 0,19 | |||
| F0-1 | 65 (19,9) | 15 (35,7) | 30 (21,4) | |
| F2 | 96 (29,4) | 8 (19) | 43 (30,7) | |
| F3 | 53 (16,2) | 9 (21,4) | 26 (18,6) | |
| F4 | 113 (34,6) | 10 (23,8) | 41 (29,3) | |
| MELD, media (DE) | 7,31 (2,16) | 7,23 (1,56) | 7,33 (2,18) | 0,1 |
| Carga viral, UI/ml, media (DE) | 2844255,23(4021880, 29) | 2193615,11 (2716828,25) | 2654681,33 (3847326,01) | 0,45 |
| Tratamientos previos (%) | 0,02 | |||
| Naïve | 228 (68,7) | 37 (84,1) | 92 (64,8) | |
| Fallo a tratamientos previos | 104 (31,3) | 7 (15,9) | 50 (25,2) | |
Los consumidores recientes de drogas tenían una edad significativamente menor, así como un mayor consumo de cocaína, un mayor porcentaje de estancia reciente en prisión y una mayor proporción de pacientes no tratados previamente.
En cuanto a los antecedentes psiquiátricos, se disponía del dato en 188 pacientes. Setenta y ocho pacientes (41,5%) presentaban algún diagnóstico de enfermedad mental, que sumados a los pacientes en TSO con diagnóstico de «trastorno por abuso de sustancias» (TAS) ascendió a 110 (58,5%).
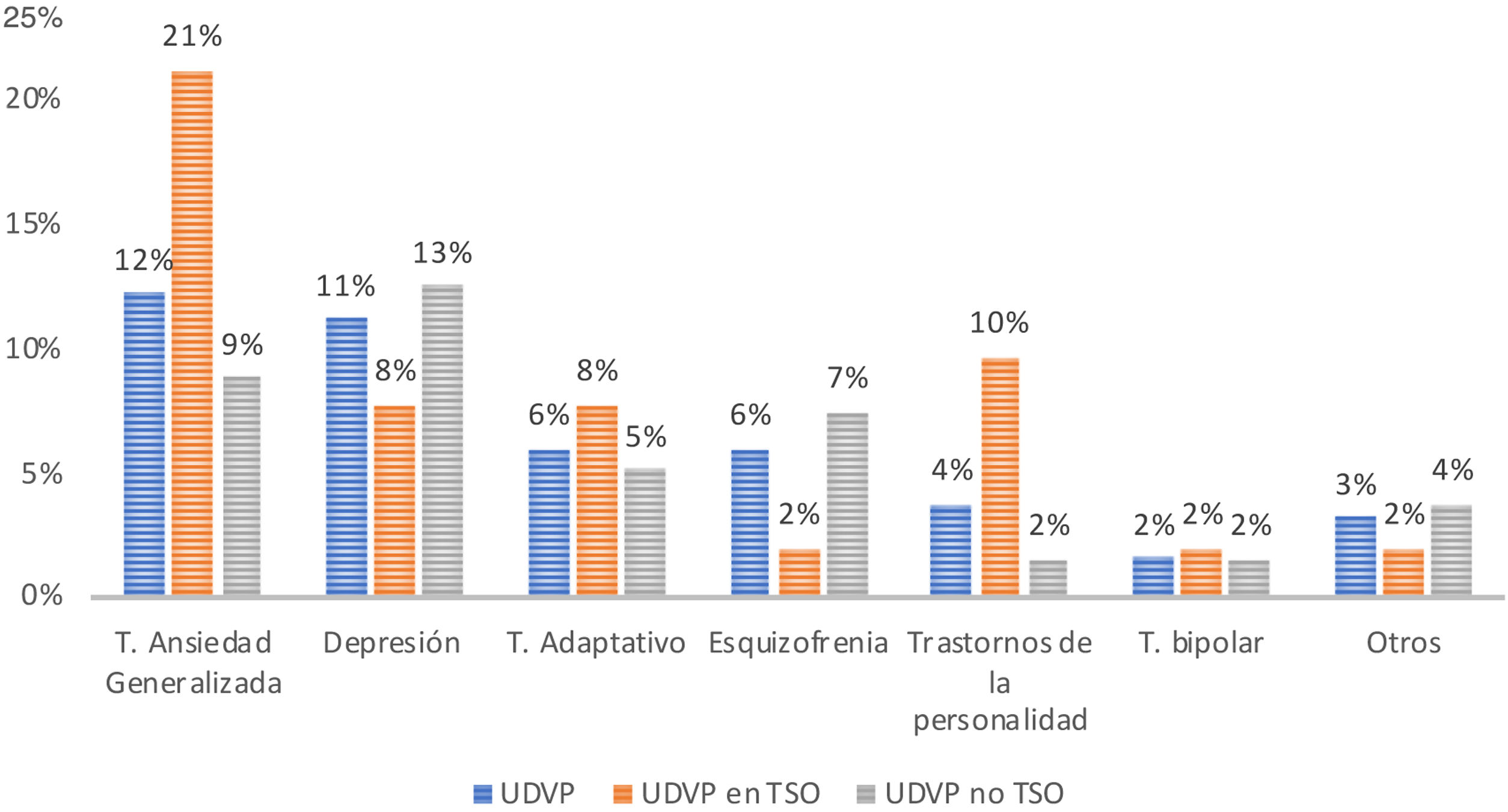
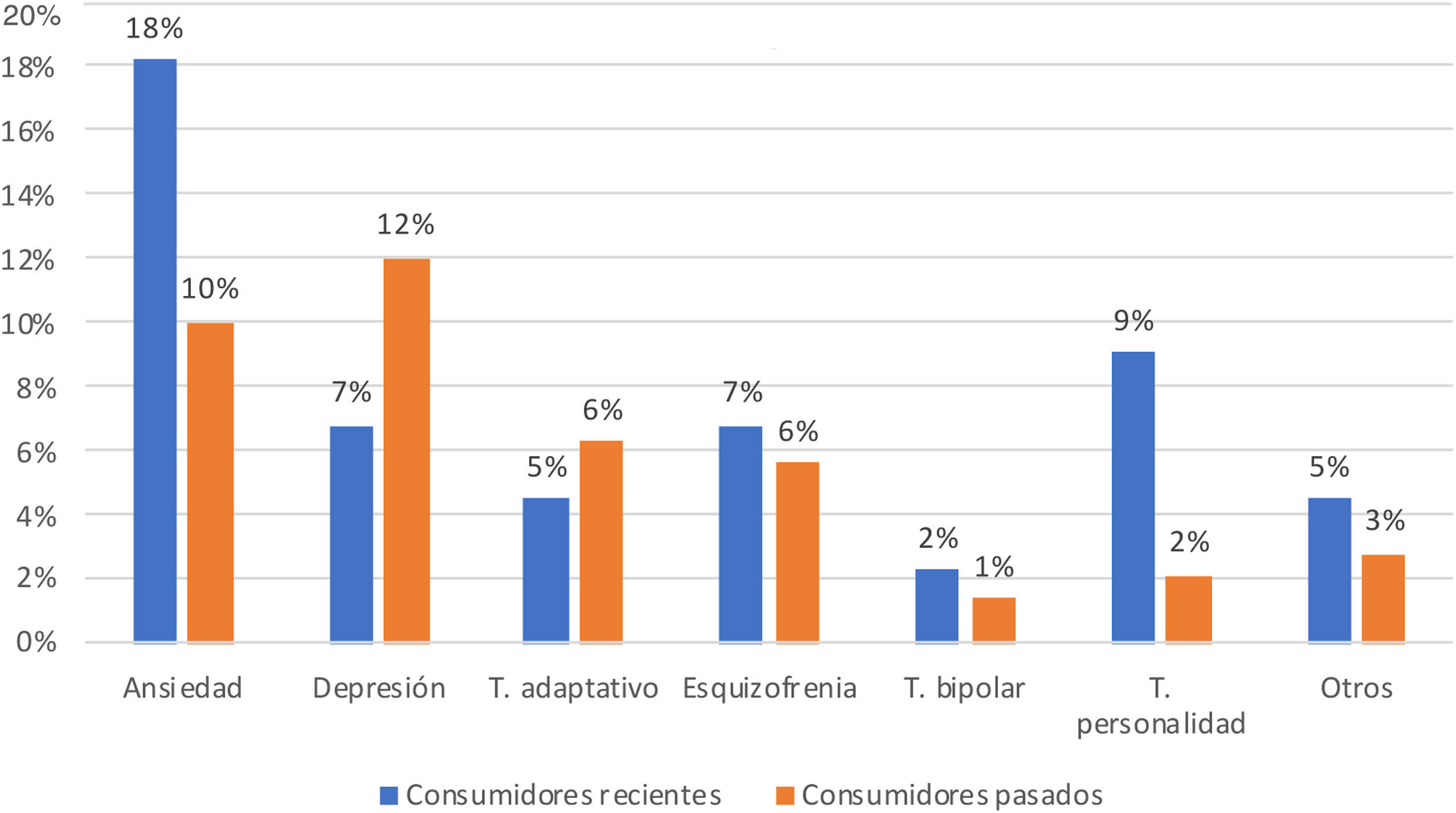
Se analizaron los trastornos psiquiátricos (excluyendo el TAS) tanto en la muestra general de UDVP como en función de la TSO, y según la fecha de último consumo (figs. 1 y 2). Por orden de frecuencia el más prevalente en la población general UDVP fue el trastorno de ansiedad generalizada (n=23), seguido de la depresión mayor (n=21), los trastornos adaptativos (n=11, siendo 7 tipo mixto, uno depresivo y 3 ansiedad), la esquizofrenia (n=11), los trastornos de la personalidad (n=7) con un paciente de cada tipo: trastorno antisocial, trastorno límite, disocial, tipo C, no especificado con componente impulsivo, trastorno no especificado y rasgos disfuncionales), el trastorno bipolar (n=3) y otros (n=6) incluyendo intentos autolíticos frecuentes sin diagnóstico establecido (n=2), el trastorno de angustia-agorafobia, el síndrome de Diógenes, el trastorno de insomnio y el trastorno psicótico no catalogado.
En pacientes en TSO se encontró una mayor proporción de pacientes con trastorno de ansiedad generalizada (p=0,02) y trastornos de la personalidad (p=0,01) con respecto al resto de pacientes, no encontrando mayor proporción de otros trastornos psiquiátricos en este subgrupo.
En consumidores recientes, al igual que en pacientes en TSO, se observó una mayor proporción de trastornos de la personalidad (p=0,03), sin diferencias en el resto de trastornos.
La mediana de fármacos en cuanto a medicación psiquiátrica fue de 2, siendo el mínimo 0 y el máximo 11. Los fármacos más consumidos en pacientes diagnosticados de trastornos pisquiátricos, por orden de frecuencia, fueron las benzodiacepinas (38,3%) seguidas de la quetiapina y similares (14,4%), los inhibidores selectivos de la recaptación de serotonina (12,2%), mirtazapina (9,6%), risperidona (5,9%), desvenlafaxina (3,2%), gabapentina (3,2%), pregabalina (2,7%), trazodona (2,1%), clometiazol (1,6%), tiaprida (1,1%) y amitriptilina (1,1%).
El consumo de fármacos en pacientes en TSO fue significativamente mayor al resto de pacientes psiquiátricos, con una mediana de 3 y un consumo significativamente mayor de benzodiacepinas y quetiapina. De los pacientes en TSO, 36 estaban en tratamiento con metadona (69,2%), 13 con buprenorfina/naloxona (25%) y los 3 restantes (5,8%) sin tratamiento específico.
Resultados RVS12De todos los pacientes que iniciaron el tratamiento, un paciente falleció por cáncer de colon (0,3%). Teniendo en cuenta este caso, los que no acudieron a consulta tras 12 semanas de finalizar el tratamiento y en los que se suspendió el tratamiento, se obtuvo un total de 42 pacientes (12,7%) en los que no se recogió el valor de la carga viral a las 12 semanas tras finalizar el tratamiento. Los resultados de la RVS12 global fue del 84,04%, y este porcentaje ascendió hasta el 96,21% al excluir el resultado negativo de los pacientes perdidos.
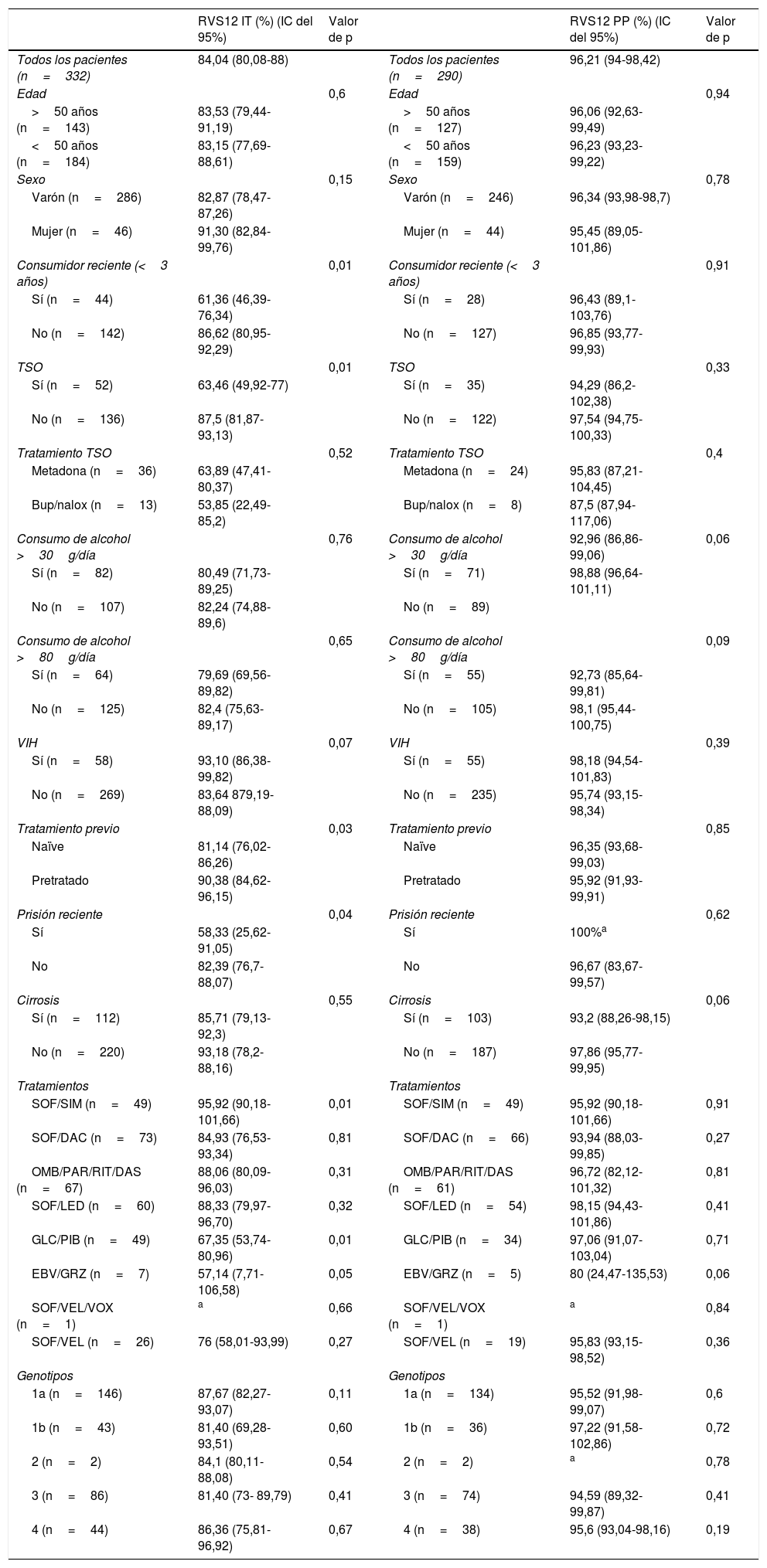
Los valores de RVS12 se analizaron en función del sexo, edad, fecha de último consumo, TSO, tipo de tratamiento TSO, consumo de alcohol, régimen de tratamiento, genotipo, presencia de cirrosis y VIH, realizándose tanto por intención de tratar (considerando negativos los pacientes en los que no se dispone del dato) como por protocolo (excluyendo el resultado negativo de los pacientes perdidos), obteniendo el valor p de la comparación de categorías dicotómicas (tabla 2).
Resultados de RVS12 global por protocolo e intención de tratar
| RVS12 IT (%) (IC del 95%) | Valor de p | RVS12 PP (%) (IC del 95%) | Valor de p | ||
|---|---|---|---|---|---|
| Todos los pacientes (n=332) | 84,04 (80,08-88) | Todos los pacientes (n=290) | 96,21 (94-98,42) | ||
| Edad | 0,6 | Edad | 0,94 | ||
| >50 años (n=143) | 83,53 (79,44-91,19) | >50 años (n=127) | 96,06 (92,63-99,49) | ||
| <50 años (n=184) | 83,15 (77,69-88,61) | <50 años (n=159) | 96,23 (93,23-99,22) | ||
| Sexo | 0,15 | Sexo | 0,78 | ||
| Varón (n=286) | 82,87 (78,47-87,26) | Varón (n=246) | 96,34 (93,98-98,7) | ||
| Mujer (n=46) | 91,30 (82,84-99,76) | Mujer (n=44) | 95,45 (89,05-101,86) | ||
| Consumidor reciente (<3 años) | 0,01 | Consumidor reciente (<3 años) | 0,91 | ||
| Sí (n=44) | 61,36 (46,39-76,34) | Sí (n=28) | 96,43 (89,1-103,76) | ||
| No (n=142) | 86,62 (80,95-92,29) | No (n=127) | 96,85 (93,77-99,93) | ||
| TSO | 0,01 | TSO | 0,33 | ||
| Sí (n=52) | 63,46 (49,92-77) | Sí (n=35) | 94,29 (86,2-102,38) | ||
| No (n=136) | 87,5 (81,87-93,13) | No (n=122) | 97,54 (94,75-100,33) | ||
| Tratamiento TSO | 0,52 | Tratamiento TSO | 0,4 | ||
| Metadona (n=36) | 63,89 (47,41-80,37) | Metadona (n=24) | 95,83 (87,21-104,45) | ||
| Bup/nalox (n=13) | 53,85 (22,49-85,2) | Bup/nalox (n=8) | 87,5 (87,94-117,06) | ||
| Consumo de alcohol >30g/día | 0,76 | Consumo de alcohol >30g/día | 92,96 (86,86-99,06) | 0,06 | |
| Sí (n=82) | 80,49 (71,73-89,25) | Sí (n=71) | 98,88 (96,64-101,11) | ||
| No (n=107) | 82,24 (74,88-89,6) | No (n=89) | |||
| Consumo de alcohol >80g/día | 0,65 | Consumo de alcohol >80g/día | 0,09 | ||
| Sí (n=64) | 79,69 (69,56-89,82) | Sí (n=55) | 92,73 (85,64-99,81) | ||
| No (n=125) | 82,4 (75,63-89,17) | No (n=105) | 98,1 (95,44-100,75) | ||
| VIH | 0,07 | VIH | 0,39 | ||
| Sí (n=58) | 93,10 (86,38-99,82) | Sí (n=55) | 98,18 (94,54-101,83) | ||
| No (n=269) | 83,64 879,19-88,09) | No (n=235) | 95,74 (93,15-98,34) | ||
| Tratamiento previo | 0,03 | Tratamiento previo | 0,85 | ||
| Naïve | 81,14 (76,02-86,26) | Naïve | 96,35 (93,68-99,03) | ||
| Pretratado | 90,38 (84,62-96,15) | Pretratado | 95,92 (91,93-99,91) | ||
| Prisión reciente | 0,04 | Prisión reciente | 0,62 | ||
| Sí | 58,33 (25,62-91,05) | Sí | 100%a | ||
| No | 82,39 (76,7-88,07) | No | 96,67 (83,67-99,57) | ||
| Cirrosis | 0,55 | Cirrosis | 0,06 | ||
| Sí (n=112) | 85,71 (79,13-92,3) | Sí (n=103) | 93,2 (88,26-98,15) | ||
| No (n=220) | 93,18 (78,2-88,16) | No (n=187) | 97,86 (95,77-99,95) | ||
| Tratamientos | Tratamientos | ||||
| SOF/SIM (n=49) | 95,92 (90,18-101,66) | 0,01 | SOF/SIM (n=49) | 95,92 (90,18-101,66) | 0,91 |
| SOF/DAC (n=73) | 84,93 (76,53-93,34) | 0,81 | SOF/DAC (n=66) | 93,94 (88,03-99,85) | 0,27 |
| OMB/PAR/RIT/DAS (n=67) | 88,06 (80,09-96,03) | 0,31 | OMB/PAR/RIT/DAS (n=61) | 96,72 (82,12-101,32) | 0,81 |
| SOF/LED (n=60) | 88,33 (79,97-96,70) | 0,32 | SOF/LED (n=54) | 98,15 (94,43-101,86) | 0,41 |
| GLC/PIB (n=49) | 67,35 (53,74-80,96) | 0,01 | GLC/PIB (n=34) | 97,06 (91,07-103,04) | 0,71 |
| EBV/GRZ (n=7) | 57,14 (7,71-106,58) | 0,05 | EBV/GRZ (n=5) | 80 (24,47-135,53) | 0,06 |
| SOF/VEL/VOX (n=1) | a | 0,66 | SOF/VEL/VOX (n=1) | a | 0,84 |
| SOF/VEL (n=26) | 76 (58,01-93,99) | 0,27 | SOF/VEL (n=19) | 95,83 (93,15-98,52) | 0,36 |
| Genotipos | Genotipos | ||||
| 1a (n=146) | 87,67 (82,27-93,07) | 0,11 | 1a (n=134) | 95,52 (91,98-99,07) | 0,6 |
| 1b (n=43) | 81,40 (69,28-93,51) | 0,60 | 1b (n=36) | 97,22 (91,58-102,86) | 0,72 |
| 2 (n=2) | 84,1 (80,11-88,08) | 0,54 | 2 (n=2) | a | 0,78 |
| 3 (n=86) | 81,40 (73- 89,79) | 0,41 | 3 (n=74) | 94,59 (89,32-99,87) | 0,41 |
| 4 (n=44) | 86,36 (75,81-96,92) | 0,67 | 4 (n=38) | 95,6 (93,04-98,16) | 0,19 |
Bup/nalox: buprenorfina/naloxone; DAC: daclatasvir; DAS: dasabuvir; EBV: Eelbasvir; GLC: glecaprevir; GRZ: grazoprevir; IC: intervalo de confianza; IT: intención de tratar; LED: ledipasvir; OMB: ombitasvir; PAR: paritaprevir; PIB: pibrentasvir; PP: por protocolo; RBV: ribavirina; RIT: ritonavir; SIM: simeprevir; SOF: sofosbuvir; VEL: velpatasvir; VIH: virus de inmunodeficiencia humana; VOX: voxilaprevir.
El consumo de otras drogas en el momento del tratamiento (marihuana y/o cocaína) no conllevó una menor respuesta.
Las tasas de RVS12 fueron notablemente superiores para todas las variables al excluir del análisis a los pacientes perdidos.
En el análisis por intención de tratar, se obtuvo una menor tasa de RVS12 en consumidores recientes (<3 años), aquellos que estaban en TSO, los que habían estado en prisión los últimos 5 años, pacientes no tratados previamente (naïve) y en algunas pautas de tratamientos (sofosvubir asociado a simeprevir y glecaprevir/pibrentasvir), siendo similares en el resto de variables estudiadas. No obstante, en el análisis por protocolo no se encontraron diferencias significativas en los resultados con respecto al resto de pacientes.
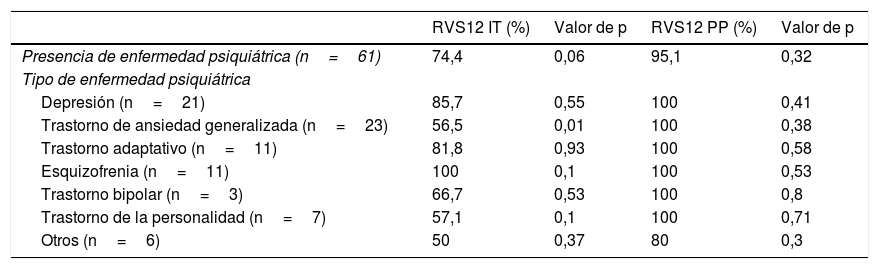
Del mismo modo, se estudió la relación entre los distintos trastornos psiquiátricos y los resultados de RVS12, tanto por intención de tratar como por protocolo (tabla 3).
RVS12 y trastornos psiquiátricos
| RVS12 IT (%) | Valor de p | RVS12 PP (%) | Valor de p | |
|---|---|---|---|---|
| Presencia de enfermedad psiquiátrica (n=61) | 74,4 | 0,06 | 95,1 | 0,32 |
| Tipo de enfermedad psiquiátrica | ||||
| Depresión (n=21) | 85,7 | 0,55 | 100 | 0,41 |
| Trastorno de ansiedad generalizada (n=23) | 56,5 | 0,01 | 100 | 0,38 |
| Trastorno adaptativo (n=11) | 81,8 | 0,93 | 100 | 0,58 |
| Esquizofrenia (n=11) | 100 | 0,1 | 100 | 0,53 |
| Trastorno bipolar (n=3) | 66,7 | 0,53 | 100 | 0,8 |
| Trastorno de la personalidad (n=7) | 57,1 | 0,1 | 100 | 0,71 |
| Otros (n=6) | 50 | 0,37 | 80 | 0,3 |
El hecho de presentar enfermedad psiquiátrica no conllevó tener tasas significativamente menores de curación de la infección. No se encontró una relación entre el número de psicofármacos y la RVS12 (p=0,39).
La toma de ningún fármaco concreto conllevó una menor curación de la infección a excepción del empleo de benzodiacepinas (69,4 vs. 87,6%; p=0,02).
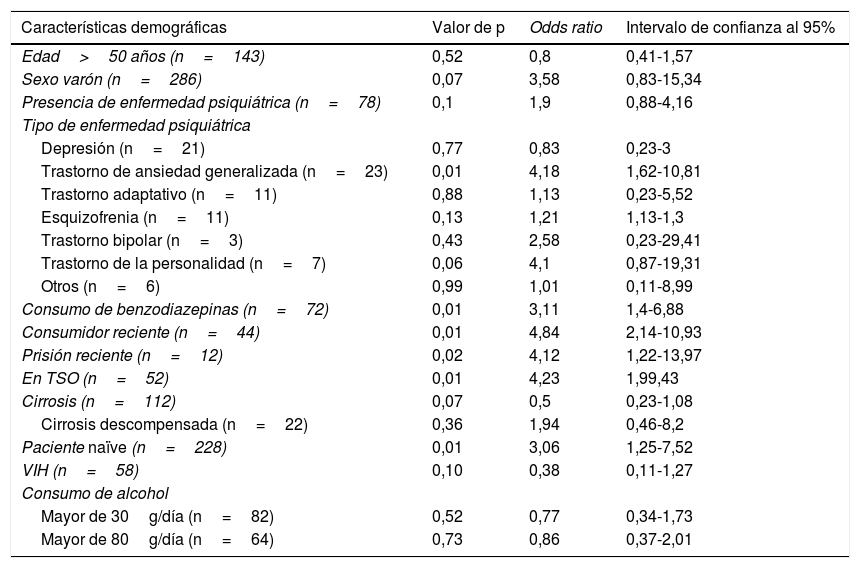
Análisis de los pacientes perdidosDado que las tasas de respuesta fueron notablemente superiores en el análisis por protocolo, se analizaron las características de los pacientes perdidos a las 12 semanas postratamiento. Se realizó regresión logística simple entre cada característica basal y la pérdida de seguimiento dentro de la muestra, cuyos resultados se muestra en la tabla 4.
Relación entre las características demográficas y la pérdida de seguimiento a las 12 semanas postratamiento
| Características demográficas | Valor de p | Odds ratio | Intervalo de confianza al 95% |
|---|---|---|---|
| Edad>50 años (n=143) | 0,52 | 0,8 | 0,41-1,57 |
| Sexo varón (n=286) | 0,07 | 3,58 | 0,83-15,34 |
| Presencia de enfermedad psiquiátrica (n=78) | 0,1 | 1,9 | 0,88-4,16 |
| Tipo de enfermedad psiquiátrica | |||
| Depresión (n=21) | 0,77 | 0,83 | 0,23-3 |
| Trastorno de ansiedad generalizada (n=23) | 0,01 | 4,18 | 1,62-10,81 |
| Trastorno adaptativo (n=11) | 0,88 | 1,13 | 0,23-5,52 |
| Esquizofrenia (n=11) | 0,13 | 1,21 | 1,13-1,3 |
| Trastorno bipolar (n=3) | 0,43 | 2,58 | 0,23-29,41 |
| Trastorno de la personalidad (n=7) | 0,06 | 4,1 | 0,87-19,31 |
| Otros (n=6) | 0,99 | 1,01 | 0,11-8,99 |
| Consumo de benzodiazepinas (n=72) | 0,01 | 3,11 | 1,4-6,88 |
| Consumidor reciente (n=44) | 0,01 | 4,84 | 2,14-10,93 |
| Prisión reciente (n=12) | 0,02 | 4,12 | 1,22-13,97 |
| En TSO (n=52) | 0,01 | 4,23 | 1,99,43 |
| Cirrosis (n=112) | 0,07 | 0,5 | 0,23-1,08 |
| Cirrosis descompensada (n=22) | 0,36 | 1,94 | 0,46-8,2 |
| Paciente naïve (n=228) | 0,01 | 3,06 | 1,25-7,52 |
| VIH (n=58) | 0,10 | 0,38 | 0,11-1,27 |
| Consumo de alcohol | |||
| Mayor de 30g/día (n=82) | 0,52 | 0,77 | 0,34-1,73 |
| Mayor de 80g/día (n=64) | 0,73 | 0,86 | 0,37-2,01 |
TSO: terapia sustitutiva con opiáceos; UDVP: usuarios de drogas por vía parenteral; VIH: virus de inmunodeficiencia humana.
Los pacientes perdidos fueron mayoritariamente varones (95,2%), aunque sin diferencias significativas con respecto a los pacientes no perdidos (86%; p=0,07). No se observaron diferencias de edad significativas entre ambos grupos. Un 54,8% de los pacientes perdidos tenían enfermedad psiquiátrica frente a un 38,9% de los pacientes no perdidos. El hecho de tener un diagnóstico de este tipo, no obstante, no conllevó mayor riesgo de pérdida de seguimiento, aunque en el análisis univariante el trastorno de ansiedad sí lo aumentó en 4 veces, de la misma forma que el consumo de benzodiacepinas lo hizo en 3.
El 54,8% de los pacientes perdidos estaban en TSO (vs. 22,3% de los pacientes no perdidos), y esto supuso un riesgo muy aumentado (más de 4 veces) de pérdida de seguimiento. Del mismo modo, un 36,4% de los consumidores recientes perdieron el seguimiento (vs. 10,6% de los consumidores pasados), con un riesgo de casi 5 veces superior.
También se hubo una pérdida mayor de seguimiento de los pacientes naïve y en aquellos que habían estado en prisión los últimos 5 años. No se encontraron diferencias en cirróticos, pacientes con VIH ni en consumidores de alcohol.
DiscusiónAunque se ha demostrado la efectividad del tratamiento con VHC en pacientes UDVP, los estudios y metaanálisis sobre el mismo muestran gran heterogeneidad en los resultados, oscilando las tasas de erradicación entre el 6317 y el 95-100%18,19.
En lo que sí parece haber unanimidad, tal y como se pone de manifiesto en nuestro estudio, es que los aparentemente peores resultados en la efectividad del VHC en estos sujetos se deben a una pérdida en el seguimiento de los mismos. Las tasas de erradicación observadas aquí fueron notablemente inferiores a las series previas para la población general20–22, aunque una vez excluidos del análisis los pacientes perdidos, se obtuvieron resultados similares (RVS12 del 96,21%). Por este motivo es fundamental conseguir una adecuada adherencia al tratamiento.
La relación entre la enfermedad psiquiátrica y la infección VHC es bien conocida, aunque la bibliografía sobre cómo influye en el tratamiento en UDVP es escasa. La presencia de comorbilidad psiquiátrica es elevada en pacientes con VHC y UDVP (50-60%), predominando la depresión, la ansiedad y la esquizofrenia; del mismo modo, la infección por VHC tiende a existir con mayor frecuencia entre pacientes con enfermedades mentales y psiquiátricas15. Así mismo, los pacientes con enfermedades hepáticas en estadios finales debido a la infección por el VHC suelen estar más deprimidos y tener más trastornos del ánimo que los debidos a otras causas23. En nuestro estudio el porcentaje de trastornos psiquiátricos en UDVP fue consistente con los estudios anteriormente citados, y el hecho de presentar el diagnóstico de trastorno de ansiedad conllevó una menor efectividad en el tratamiento del VHC en UDVP debido a una mayor pérdida de seguimiento, al igual que se ha demostrado en estudios para el tratamiento de otras enfermedades24. De manera análoga, el consumo de benzodiacepinas se vio relacionado con la pérdida de seguimiento, aunque probablemente esto fue debido al alto consumo de estos fármacos por los pacientes con ansiedad. La presencia de enfermedad psiquiátrica y la pérdida de seguimiento ha sido tradicionalmente una causa de exclusión del tratamiento por su menor efectividad.
Se ha demostrado ampliamente que en pacientes en TSO los AAD han demostrado ser seguros y efectivos, sin requerir ajuste de dosis específico ni disminuir la adherencia ni la tasa de RVS con los últimos tratamientos AAD3,4,25. No obstante, aún en algunos registros la efectividad en TSO es menor que en individuos sin TSO por un aumento en la pérdida en el seguimiento26, como se ha observado de manera manifiesta en nuestra muestra. Consideramos que esto podría ser debido a que en el diagnóstico de «trastorno por abuso de sustancias» con el que fueron catalogados estos pacientes puede enmascarar otros trastornos psiquiátricos, unido a la elevada proporción de pacientes con el diagnóstico de trastorno de ansiedad entre los que estaban en esta terapia, y probablemente también debido a una baja conciencia de enfermedad en cuanto a la infección por VHC por parte de estos sujetos.
Así mismo, aquellos que habían consumido drogas por vía parenteral en los últimos 3 años y los que habían estado en prisión los últimos 5 años presentaron una menor adherencia al tratamiento, mayor pérdida de seguimiento y, por tanto, peores resultados, hallazgos en consonancia con otras series de datos15,27.
En definitiva, con este estudio se pone de manifiesto la importancia de conseguir una adecuada adherencia al tratamiento en pacientes UDVP, especialmente en consumidores recientes y aquellos en TSO, siendo vital hacer una adecuada valoración psiquiátrica y llevar un seguimiento más estrecho en estos sujetos. En la actualidad ninguna guía clínica justifica retrasar o impedir el tratamiento en estos pacientes ni obliga a suspender el consumo de estos o de la TSO20–22.
Medidas como el apoyo multidisciplinar28, la incentivación financiera29 y la telemedicina30, los programas de jeringuillas-agujas, las habitaciones supervisadas de consumo y la asistencia en primaria3,25 han demostrado aumentar esta adherencia y, por tanto, ayudarían a conseguir tasas de remisión de la infección más elevadas. No obstante, la implantación real de estas intervenciones aún es baja, y por este motivo deben seguir ejecutándose para conseguir finalmente la erradicación del virus en este colectivo, considerado vulnerable y en el que se encuentran los mayores transmisores de la infección y los pacientes con mayor morbimortalidad por enfermedad hepática.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
AutoríasJC Fernández de Cañete: revisión bibliográfica, proceso de investigación, análisis estadístico, elaboración y edición del artículo original.
JM Moreno: diseño el estudio, protocolo y dirección del estudio.
MA García y A Mancebo: recogida de datos.
Conflicto de interesesLos autores declaran que no hay conflicto de intereses.