Los pacientes con enfermedades inflamatorias intestinales de localización colónica tienen mayor riesgo de desarrollar cáncer colorrectal que la población general, por lo que precisan de técnicas endoscópicas de cribado con intervalos de seguimiento basados en los diferentes factores de riesgo descritos.
En el presente documento de posicionamiento analizamos la evidencia científica vigente para las diferentes técnicas endoscópicas disponibles en la actualidad, cómo debe realizarse su implementación en las unidades de endoscopia, y se describe con detalle cómo debe ser técnicamente su realización, a qué pacientes y con qué intervalo debe realizarse, y finalmente, cuál debe ser nuestra actitud ante el hallazgo de displasia, proponiendo un algoritmo de seguimiento específico.
Colonic inflammatory bowel diseases have a higher risk of developing colorectal cancer compared to the general population, which is why they require endoscopic screening techniques with specific follow-up intervals based on the different risk factors described on the literature.
This position paper analyzes the current scientific evidence for the different endoscopic techniques available today, how their implementation should be carried out in endoscopic units and describes in detail how their implementation should be carried out, in which patients and with what interval, and finally, what should be the response to finding dysplasia, proposing a specific follow-up algorithm.
«Los médicos se esfuerzan en ser precisos y, para conseguirlo, utilizan su inteligencia, capacitación, conocimiento y experiencia. El uso de la biopsia aleatoria para detectar displasia es la antítesis de este enfoque.» Esta frase es una traducción literal que Ray Soetikno et al.1, gastroenterólogos expertos en este tema, publican a finales de 2019 refrendando el consenso SCENIC publicado en 20152; consenso internacional y multidisciplinar realizado con metodología GRADE que implicó un cambio radical en la práctica clínica del cribado de cáncer colorrectal (CCR) de nuestros pacientes con enfermedad inflamatoria intestinal (EII).
Sabemos que los pacientes con EII de larga evolución, sobre todo colitis ulcerosa (CU), pero también enfermedad de Crohn (EC) de localización colónica, tienen más riesgo de desarrollar CCR, por lo que debemos implementar la mejor técnica endoscópica disponible para prevenirlo y/o detectarlo de forma precoz. En las últimas décadas se ha demostrado que la implementación de estas técnicas de cribado en pacientes con EII se asocia a una disminución de riesgo de CCR, a una disminución de muerte por CCR, así como a un incremento en la detección de CCR en estadios más precoces3.
El futuro de este escenario vendrá guiado por biomarcadores moleculares que serán capaces de discriminar aquellos pacientes con alto riesgo de CCR, e incluso aquellos que ya presenten displasia y que necesiten cribado específico, pero hasta entonces deberemos responder con la evidencia científica disponible en la actualidad a una serie de preguntas que pasamos a enumerar y responder en el presente documento de posicionamiento.
¿Es eficaz el programa de cribado con endoscopia en pacientes con EII?Los pacientes con CU izquierda o extensa presentan mayor riesgo de desarrollar CCR que la población general, con una prevalencia del 3,7% y una incidencia del 2% a los 10años en estudios ya clásicos con evidente sesgo de selección4. Metaanálisis más recientes5,6 confirman que, si bien esta incidencia ha disminuido en las últimas décadas, todavía se estima que el riesgo de CCR es 1,21 veces superior al de la población general. Respecto a los pacientes con EC de localización colónica, aunque con menor evidencia, los datos parecen ser similares7.
La eficacia del programa de cribado con colonoscopia en pacientes con EII no ha sido evaluada en ensayos clínicos aleatorizados (ECA). Una revisión Cochrane publicada en 2006 concluye que «no hay una clara evidencia de que el seguimiento aumente la supervivencia de pacientes con CU extensa»8; no obstante, identificó evidencia indirecta en estudios retrospectivos caso-control de la disminución de muerte de pacientes con EII con cáncer diagnosticado en programas de seguimiento9-11. Un estudio retrospectivo poblacional observó una supervivencia del 100% en CCR diagnosticado en programa de seguimiento frente al 74% en CCR diagnosticado fuera de seguimiento (p=0,042)12.
En una revisión más reciente de la Cochrane3 publicada en 2018, en la que incluyen 7.199 pacientes todos ellos incluidos en estudios observacionales, se concluye que la detección de CCR es significativamente mayor en el grupo sin seguimiento endoscópico (3,2%; 135/4.256) comparado con el grupo de seguimiento (1,8%; 53/2.895) (OR: 0,58; IC95%: 0,42-0,80), p<0,001; además, el seguimiento endoscópico se asoció a una disminución de muerte por CCR (8,5% vs 22,3%) (OR: 0,36; IC95%: 0,19-0,69; p=0,002) y a un incremento de la detección de CCR en estadios precoces (15,5% vs 7,7) (OR: 5,40; IC95%: 1,51-19,30; p=0,009).
Con estos datos, podemos concluir que el programa de cribado en pacientes con EII de larga evolución es eficaz, ya que detecta un mayor número de CCR en estadios más precoces y disminuye así la mortalidad por CCR.
¿Cuál es la técnica de elección para el cribado de displasia de los pacientes con EII?Clásicamente, el seguimiento de estos pacientes con EII de larga evolución se realizaba con endoscopia convencional y toma de biopsias aleatorizadas, precisándose un total de 34biopsias de todos los segmentos del colon para detectar una displasia con una probabilidad del 90%, debiendo doblar este número (64biopsias) para aumentar este intervalo de confianza al 95%13. Se estima que con esta estrategia se detecta aproximadamente un caso de displasia por cada 1.505 biopsias obtenidas14. Sin embargo, en los últimos años, con las mejoras y avances tecnológicos endoscópicos, se van a hacer visibles las lesiones con displasia no visibles previamente15.
Actualmente disponemos de varias técnicas de endoscopia avanzada en este escenario específico: cromoendoscopia virtual (VCE) (narrow band imaging [NBI], i-scan, FICE), cromoendoscopia con colorante (dye-chromoendoscopy [DCE]) y autofluorescencia (AFI), que a lo largo de estos años se han comparado con luz blanca (WLE) y luz blanca de alta definición (HDWLE), habiéndose realizado también ECA que comparan estas técnicas entre sí. Los resultados se han incluido en 4 metaanálisis16-19 con resultados no comparables entre sí, ya que los criterios de selección son diferentes (alguno incluye resúmenes a congresos, otro solo ECA, otro ECA y estudios observacionales), lo que, añadido a la elevada heterogeneidad y baja calidad de alguno de los estudios, hace complicado extraer conclusiones.
Cromoendoscopia virtual (VCE) comparada con luz blanca (WLE) y luz blanca de alta definición (HDWLE)Las técnicas de VCE usan filtros en el propio endoscopio sin necesidad de colorantes. El azul es la luz que más absorbe la hemoglobina, por lo que la red capilar se aprecia mejor y, con ello, el patrón mucoso de criptas, evitándose el uso de colorantes y siendo la exploración más rápida20. Cuando se incluyen los 3ECA que comparan VCE (NBI, i-scan o FICE) (161 pacientes) con HDWLE (171 pacientes)21, no hallan diferencias en la detección de displasia por paciente (RR: 0,72; IC95%: 0,45-1,15); por el contrario, encuentran una diferencia estadística a favor de HDWLE en el análisis de detección de lesión con displasia (RR: 0,64; IC95%: 0,48-0,90) sin hallar heterogeneidad en ninguno de los 2análisis (I2=0%) pero disminuyendo la calidad de la evidencia por imprecisión en ambos.
Cromoendoscopia con colorante (DCE) comparada con luz blanca (WLE) y luz blanca de alta definición (HDWLE)El primer ECA que demostró la utilidad de la DCE comparada con WLE para detección de displasia en pacientes con EII de larga evolución se publicó en 2003 (Kiesslich et al.22). Posteriormente, 5 ensayos clínicos más se incluyen en un metaanálisis publicado en 201123 con un total de 1.277 pacientes que demuestra claramente la superioridad de la DCE tanto en la detección de lesiones con displasia de forma global, como en la detección de lesiones con displasia plana, multiplicándose esta probabilidad por 2-3 en el porcentaje de detección de displasia por paciente y por 4-5 en la detección de displasia por lesión.
En el metaanálisis italiano17 la DCE es significativamente superior a la HDWLE (5 estudios incluidos) (OR: 4,218; IC95%: 1,240-14,345). Estos resultados no se confirman sin embargo en una publicación más reciente en la que tan solo se incluyen los 2ECA publicados hasta entonces19. Más recientemente, un nuevo ECA viene a demostrar la superioridad de la DCE frente a HDWLE24, obteniéndose similares resultados en vida real publicados en la serie española multicéntrica (grupo endoCAR)25.
Cromoendoscopia con colorante (DCE) comparada con cromoendoscopia virtual (VCE)La comparación entre la VCE y la DCE precisa un análisis más exhaustivo que la constatación de que no hay diferencias en la detección de displasia, conclusión que establecen los diferentes metaanálisis publicados. El primer estudio que comparó DCE con NBI fue el diseñado por el grupo del Hospital Clínic de Barcelona realizando un ensayo clínico aleatorizado cruzado (back to back)26 con 60 pacientes con EII de larga evolución a los que se les realiza ambas exploraciones sin diferencias significativas a la hora de diagnosticar lesiones con displasia, pero siendo la DCE significativamente superior a la hora de detectar lesiones de cualquier tipo, estimando que con el NBI se perderían en términos absolutos 6 lesiones con displasia por paciente frente a 2 que perdería la DCE. Un estudio australiano posterior con la misma metodología confirma estos resultados27. Más recientemente, el grupo de Leuven28 y el de Birmingham29 publican los resultados de sus ensayos clínicos utilizando una metodología distinta aleatorizando a los pacientes a la realización de VCE o DCE sin hallar diferencias entre ambas técnicas en ambos estudios para la detección de displasia; sin embargo, esta metodología paralela no permite calcular las pérdidas de lesiones con displasia en el mismo paciente.
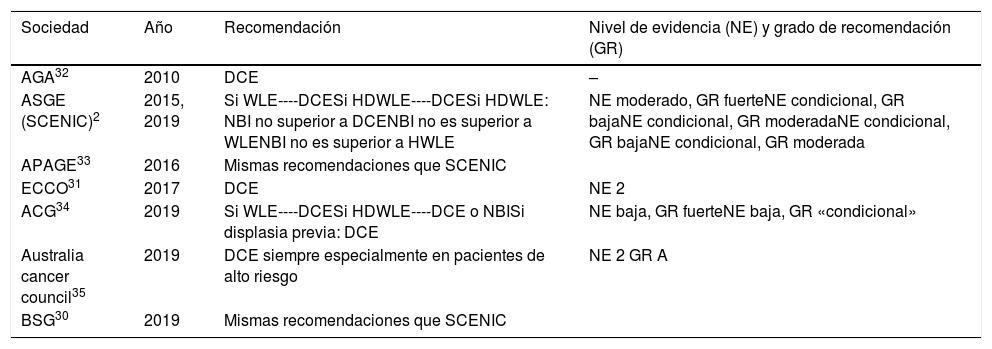
Con esta evidencia disponible, consideramos que la cromoendoscopia con colorante (DCE) es la técnica de elección para el cribado de CCR en pacientes con EII de larga evolución o con riesgo elevado de CCR, opinión que compartimos con la mayoría de guías actuales, tanto clínicas como endoscópicas, nacionales e internacionales (tabla 1)2,30-35.
Recomendaciones de cribado de CCR según las diferentes guías
| Sociedad | Año | Recomendación | Nivel de evidencia (NE) y grado de recomendación (GR) |
|---|---|---|---|
| AGA32 | 2010 | DCE | – |
| ASGE (SCENIC)2 | 2015, 2019 | Si WLE----DCESi HDWLE----DCESi HDWLE: NBI no superior a DCENBI no es superior a WLENBI no es superior a HWLE | NE moderado, GR fuerteNE condicional, GR bajaNE condicional, GR moderadaNE condicional, GR bajaNE condicional, GR moderada |
| APAGE33 | 2016 | Mismas recomendaciones que SCENIC | |
| ECCO31 | 2017 | DCE | NE 2 |
| ACG34 | 2019 | Si WLE----DCESi HDWLE----DCE o NBISi displasia previa: DCE | NE baja, GR fuerteNE baja, GR «condicional» |
| Australia cancer council35 | 2019 | DCE siempre especialmente en pacientes de alto riesgo | NE 2 GR A |
| BSG30 | 2019 | Mismas recomendaciones que SCENIC | |
ACG: American College of Gastroenterology; AGA: American Gastroenterology Association; APAGE: Asia Pacific Association of Gastroenterology; ASGE: American Society of Gastrointestinal Endoscopy; BSG: British Society of Gastroenterology; ECCO: European Crohn and Colitis Organization.
La elección de los pacientes con EII que van a precisar un seguimiento endoscópico es uno de los puntos más importantes en el cribado de displasia y CCR. A pesar de las mejoras en los últimos años en la endoscopia, la colonoscopia no deja de ser una prueba invasiva con riesgo de complicaciones y que requiere una preparación del colon que, aunque también ha mejorado sustancialmente, no es agradable para el paciente. Además, se deben optimizar los recursos disponibles, de manera que solo aquellos pacientes que, según la evidencia científica disponible, se van a beneficiar entren en el programa de cribado.
Actualmente existen una serie de factores de riesgo que van a determinar la elección de los pacientes con EII que se deben incluir en el programa de cribado de displasia y CCR.
Duración de la enfermedadComo ya hemos explicado anteriormente, y aunque actualmente el riesgo de CCR en la población con CU ha disminuido4, sigue siendo mayor que el de la población general5,6, estimándose que la incidencia acumulada en la primera década tras el diagnóstico suele ser <0,5%, aumentando al 1% a los 10años, al 3% a los 20años y al 7% a los 30años después del diagnóstico de CU35,36. En la EC de localización colónica este riesgo también está presente, multiplicándose al doble tras 10años de evolución35.
Extensión de la enfermedadLos pacientes con CU extensa claramente tienen más riesgo de CCR, estimándose un exceso de riesgo de 19,2 y 14,8 (IC95%: 11,4-18,9) en 2 estudios europeos ya clásicos37,38. Respecto al riesgo de CCR en pacientes con CU izquierda, los datos son controvertidos, probablemente por las diferencias en la definición de extensión de estudios antiguos; no obstante, y aunque el desarrollo de CCR en pacientes con CU izquierda descrito en los años noventa no es tan frecuente durante las primeras 2décadas de enfermedad, esta incidencia se iguala en estos estudios en la cuarta década37,39, e incluso a 15años en estudios más recientes7.
Actividad de la enfermedadEl papel de la actividad de la enfermedad ha sido analizado en distintos estudios40, y aunque es muy probable que el desarrollo de CCR esté relacionado con el proceso inflamatorio subyacente, hay algunos datos controvertidos.
En un estudio de casos-control de 68 pacientes con CU y CCR se demostró que mayores grados de inflamación tanto en la colonoscopia (OR: 2,5; p=0,001) como en la histología (OR: 5,1; p=0,001) se asociaban con un mayor riesgo de CCR41. Sin embargo, estudios más recientes, como el de Mooiweer et al.42 de 2013 o el estudio neerlandés previamente citado7, no observaron diferencias significativas entre las personas con inflamación leve, moderada o grave al evaluar el riesgo de CCR. Matsuoka et al.43 informaron que el riesgo de CCR se asoció únicamente con la inflamación de la fase activa (RR: 0,04; IC95%: 0,01-0,11) o colitis leve (RR: 5,80; IC95%: 3,52-9,55) en un seguimiento de 5años.
Estenosis y pseudopóliposYa en 1990, Lashner et al.44 describieron en su registro retrospectivo la existencia de displasia y CCR durante su evolución en estenosis de 27 pacientes localizadas principalmente en colon izquierdo. Datos más recientes45 confirman este aumento de riesgo de neoplasia en pacientes con estenosis (OR: 5,7; IC95%: 1,7-18,9), habiéndose descrito porcentajes de malignidad de hasta el 25% de los casos46 e identificándose en este estudio como factores de riesgo la aparición tardía en el curso de la enfermedad (61% si más de 20años vs. 0% si menos de 10años de evolución) y la localización proximal al ángulo esplénico (86% vs. 47% en sigma y 10% en recto).
La presencia de pólipos postinflamatorios o pseudopólipos se asocia también a un aumento de riesgo de CCR, probablemente porque traducen una mayor inflamación previa de la mucosa adyacente9,45; además, en ocasiones es complicado realizar el diagnóstico diferencial con los pólipos adenomatosos. Por estos motivos, se recomienda inspeccionar la mucosa circundante al pólipo con cautela, y su presencia implica acortar el intervalo de vigilancia endoscópica31.
Colangitis esclerosante primaria (CEP)La CEP es un factor de riesgo claramente establecido de desarrollar un CCR en los pacientes con EII, con incidencias de CCR del 4,9% vs 0% y del 11% vs 0% en 2 estudios de cohortes publicados47,48, y habiéndose publicado un riesgo de hasta 9 veces mayor49 con un claro aumento de riesgo, sobre todo de 10 a 20años después del diagnóstico de la CEP. No obstante, y dado que la CEP, y en ocasiones la CU, se presentan de forma subclínica con un importante retraso en el diagnóstico, el cribado de CCR en estos pacientes se establece desde el mismo año de diagnóstico.
Historia familiar de CCRNuevamente, al analizar este factor de riesgo, hay estudios que objetivan un aumento de riesgo significativo de CCR en pacientes con EII y familiares con CCR42 y otros que por el contrario no hallan asociación estadística7,49.
Con esta evidencia, la realización de cromoendoscopia está indicada en todos los pacientes diagnosticados de CU de localización izquierda o extensa y en todos los pacientes diagnosticados de EC con al menos 1/3 de afectación colónica de más de 8años de evolución. Una excepción son los pacientes que asocian CEP, en los que el seguimiento debe comenzarse al diagnóstico de la misma. Fuera de seguimiento endoscópico específico está la CU de afectación únicamente rectal (proctitis [E1]) y EC de localización ileal o <1/3 de afectación colónica, dado que no parece existir un aumento de riesgo de CCR en estos subgrupos de pacientes. En la tabla 2 se resumen los intervalos de seguimiento recomendados.
Seguimiento endoscópico según factores de riesgo
| Riesgo | Criterio | Intervalo de seguimiento |
|---|---|---|
| ALTO | CEP asociada (incluso con trasplante hepático) | 1 año |
| CU extensa con actividad inflamatoria moderada-grave activa endoscópica o histológica | ||
| Presencia de displasia, estenosis o colon tubular durante los 5 años previos | ||
| Antecedente familiar de CCR de 1.er grado <50 años | ||
| MEDIO | CU extensa con actividad inflamatoria leve activa endoscópica o histológica | 3 años |
| Presencia de pseudopólipos inflamatorios | ||
| Antecedente familiar de CCR de 1.er grado ≥ 50 años | ||
| BAJO | CU extensa sin actividad inflamatoria endoscópica o histológica | 5 años |
| CU izquierda | ||
| EC con afectación <50% colon | ||
| Enfermedad inactiva en colonoscopias de seguimiento consecutivas |
La implementación de cualquier técnica requiere una serie de pasos para que su rendimiento sea óptimo. Este procedimiento de implementación, en el caso de la DCE, no es, en general, muy conocido en nuestro ámbito en la práctica clínica. En el consenso SCENIC se dan una serie de recomendaciones tanto sobre el equipo necesario como sobre el procedimiento2. Los autores de esta revisión hacen hincapié en el papel fundamental de realizar una formación sistemática en DCE, además de la necesidad de desarrollar medidas para evaluar el rendimiento de la vigilancia endoscópica mediante DCE en los pacientes con EII.
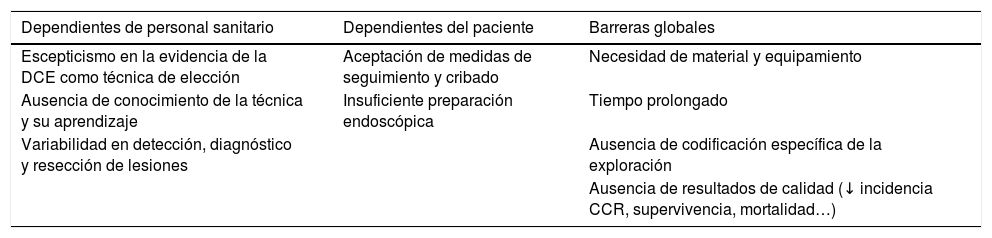
La implementación de la DCE en los distintos servicios viene establecida en un documento de consenso publicado en 2016 por expertos internacionales50. Existen, tal y como comentan estos expertos en su artículo, una serie de barreras que son las responsables de la dificultad de su implementación en los diferentes hospitales y que resumimos en la tabla 3.
Barreras de implementación de la cromoendoscopia con colorante
| Dependientes de personal sanitario | Dependientes del paciente | Barreras globales |
|---|---|---|
| Escepticismo en la evidencia de la DCE como técnica de elección | Aceptación de medidas de seguimiento y cribado | Necesidad de material y equipamiento |
| Ausencia de conocimiento de la técnica y su aprendizaje | Insuficiente preparación endoscópica | Tiempo prolongado |
| Variabilidad en detección, diagnóstico y resección de lesiones | Ausencia de codificación específica de la exploración | |
| Ausencia de resultados de calidad (↓ incidencia CCR, supervivencia, mortalidad…) |
Una vez conocidas las principales barreras existentes y siguiendo las recomendaciones de estos autores expertos internacionales, para la implementación de la DCE en nuestras unidades debemos seguir los siguientes pasos:
- 1.
Entrenamiento sistemático utilizando atlas, vídeos, aprendizaje en páginas web, asistencia a cursos y talleres específicos, utilizando algoritmos existentes detallados para realizar DCE pancólica en la EII20,51:
- •
Aprendizaje y uso de terminología estandarizada para caracterizar las lesiones endoscópicas e histológicas de la displasia.
- •
Uniformidad en la notificación de displasia y CCR que permitan la comparación de los resultados entre los programas de vigilancia.
- •
Conocimiento de intervalos de seguimiento e indicaciones de la DCE.
- 2.
Familiarización de los endoscopistas en los protocolos de DCE, tanto del equipo como del material necesario:
- •
Tipo de endoscopio y magnificación (si es posible).
- •
Agente de contraste y su concentración: índigo carmín/azul de metileno.
- •
Método de aplicación del contraste: utilización de catéter difusor.
- •
Método de inspección con capacidad para discernir las lesiones que son resecables endoscópicamente o, en caso contrario, referirlas a cirugía.
- •
Técnicas de resección endoscópica2,51.
- 3.
Aprendizaje práctico con endoscopista experto en DCE realizando al menos 5 procedimientos.
- 4.
Monitorización de calidad registrando los datos propios de detección de displasia e intervalos de seguimiento:
- •
Fotodocumentación de las lesiones, importante tanto como ítem de calidad como para la toma de decisiones compartidas, que además pueden tener implicaciones médico-legales. Las imágenes (fotos o videograbación) deben registrar puntos de referencia en el colon (válvula cecal, apéndice, íleon terminal), la extensión y la gravedad de la inflamación si existe, la presencia de estenosis y la enfermedad perianal. También se deben obtener imágenes de cada lesión focal antes y después de la tinción, además de documentar en las resecciones la técnica de inyección submucosa, la integridad de la resección, y se pueden documentar tatuajes aplicados a lesiones preocupantes (p.ej., lesiones grandes no resecadas o con resecciones en varios tiempos o incompletas).
- •
Calidad de la preparación endoscópica.
- •
Seguimiento de displasia según los algoritmos establecidos.
- •
Monitorización y revisión de las medidas de calidad, con el objetivo final de evitar colectomías innecesarias (proporción de procedimientos en los que se realizan biopsias dirigidas, proporción de pacientes en los que se detecta displasia, o con lesiones planas, proporción de resección completa de las lesiones con displasia y tasa de cáncer de intervalo).
Finalmente, un aspecto importante de la implementación de la DCE es la valoración de su rentabilidad (coste-eficacia). Aunque el coste de la compra de equipos endoscópicos de alta calidad-alta definición (endoscopios, procesadores, monitores, etc.) es significativo, en la mayoría de nuestros hospitales ya están disponibles y se utilizan ampliamente. El coste del colorante es variable y depende de la concentración y el volumen utilizado, pero suele ser bajo y mucho más barato aún si utilizamos la fórmula magistral en vez de preparados comerciales con la dilución adecuada. El uso del colorante para su perfusión en el frasco o bomba de lavado del equipo endoscópico también puede acortar el tiempo de la exploración y abaratar los costes evitando el gasto del catéter en alguna exploración; no obstante, en muchas ocasiones vamos a necesitar catéter difusor para mejorar la visualización de las lesiones detectadas.
Se estima que la media de tiempo de realización de una DCE aumenta en 11min (rango entre 9 y 12min) respecto a la de una colonoscopia estándar cuando se toman biopsias tanto dirigidas como aleatorias52; sin embargo, las biopsias aleatorias en la mayoría de los procedimientos no son necesarias2, y se ahorra tiempo, disminuyendo también el coste del análisis del patólogo.
La eficiencia podría mejorar si disminuye el porcentaje de cáncer de intervalo; en este sentido, un estudio de coste-eficacia53 comparando diferentes estrategias de seguimiento concluye que la cromoendoscopia es más coste-eficaz y menos cara que la luz blanca con biopsias en todos los intervalos de seguimiento.
La implementación de la cromoendoscopia con colorante en nuestras unidades de EII es relativamente sencilla tras el estudio de la técnica y la realización de 5 procedimientos con endoscopista experto.
¿Cómo debe realizarse una cromoendoscopia con colorante? Preparación, técnica y descripción de las lesionesLa cromoendoscopia con colorante consiste en la aplicación de un colorante específico directamente sobre la mucosa intestinal para realzar el patrón mucoso, lo que favorece la identificación y la caracterización de las lesiones54. Los colorantes validados para la tinción en este escenario son índigo carmín (colorante de contraste más frecuentemente utilizado) y azul de metileno (colorante de absorción contraindicado en pacientes con déficit de glucosa-6-fosfato deshidrogenasa). Este último colorante, si bien se ha descrito en modelos animales un potencial daño del ADN en los tejidos teñidos55, no parece que este efecto tenga significado relevante en la práctica clínica real en humanos56.
La cromoendoscopia con colorante debe realizarse siguiendo la metodología SURFACE57 (selección del paciente, preparación endoscópica adecuada, exploración completa del colon, utilización de colorantes y descripción de patrón de criptas con biopsias dirigidas) en ausencia de actividad inflamatoria macroscópica: UCEIS0-1 o SES-CD0-1.
Durante la inserción del endoscopio todos los restos fecales deben ser lavados y aspirados utilizando en ocasiones un agente mucolítico o antiespumante (dimeticona o N-acetilcisteína). Tras alcanzar el ciego se inicia la tinción con el colorante de forma uniforme sobre toda la mucosa utilizando índigo carmín en fórmula magistral al 0,4% (agregando 1g de índigo carmín a 250ml de agua estéril) mediante catéter difusor, o agregando 1-4g de índigo carmín al frasco lavador (2ampollas de 5ml de índigo carmín al 0,8% en 250ml de agua, o 1ampolla de 10ml de azul de metileno al 1% en 240ml de agua2 si no se dispone de fórmula magistral), aplicando mayores concentraciones de solución al detectar lesiones (1ampolla de 5ml de índigo carmín al 0,8% en 25ml de agua o 1ampolla de 10ml de azul de metileno al 1% en 40ml de agua2) administradas con jeringa a través del canal del endoscopio para una mejor caracterización de las mismas.
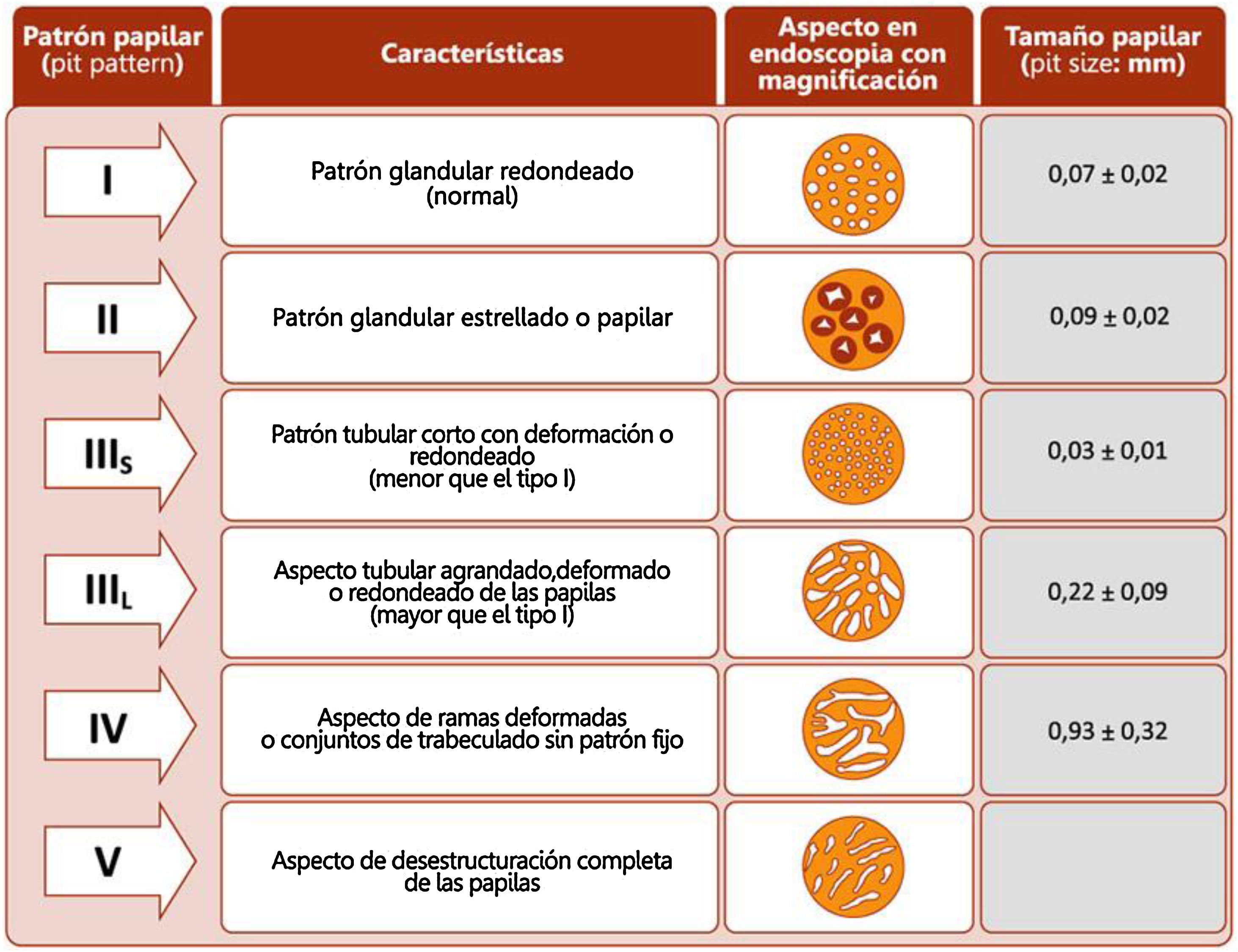
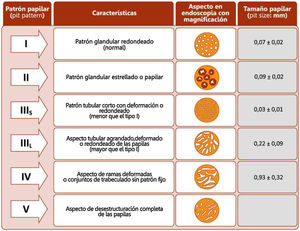
La retirada del endoscopio se realiza con un movimiento en espiral y por tramos de 20-30cm, de manera secuencial mediante reinserción y retirada lenta, aspirando el colorante sobrante para permitir una minuciosa evaluación de la mucosa. Al detectar una lesión debemos realizar una correcta descripción morfológica siguiendo los criterios de París modificados descritos en el consenso SCENIC (tabla 4)2, así como una descripción del patrón de criptas descrito por primera vez por Kudo et al.58, diferenciando los patrones no neoplásicos (I yII) de los sospechosos de displasia (III alV) (fig. 1). En la descripción de las lesiones debemos abandonar términos como displasia asociada a lesión o masa (DALM) o adenoma-like. Además de las lesiones con displasia, en los pacientes con EII se aprecian cada vez con más frecuencia lesiones serradas hiperplásicas o adenomas serrados, que también podrían contribuir al desarrollo de CCR identificándose hasta en el 11%, presentando el 86% de las mismas un patrón de criptas KudoII59.
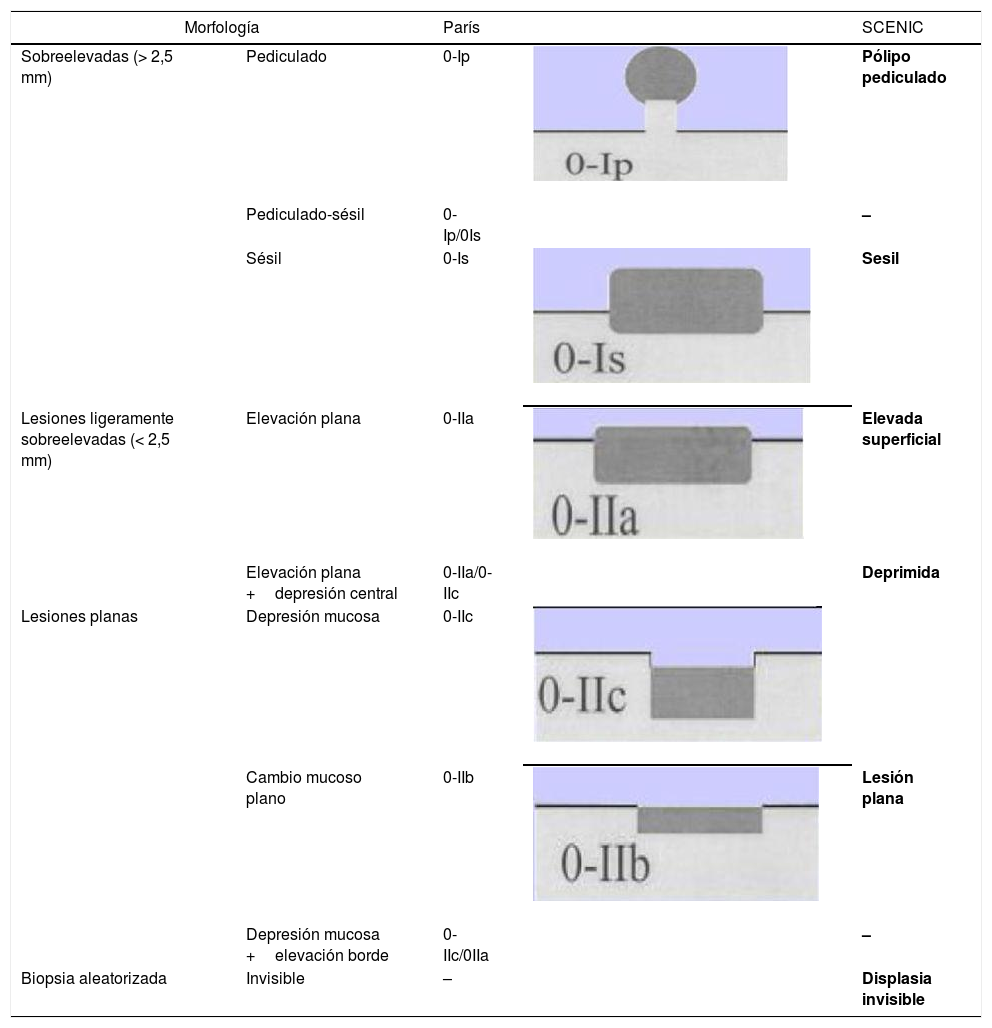
Morfología de las lesiones. Clasificación de París y equivalencia
| Morfología | París | SCENIC | ||
|---|---|---|---|---|
| Sobreelevadas (> 2,5 mm) | Pediculado | 0-Ip | Pólipo pediculado | |
| Pediculado-sésil | 0-Ip/0Is | – | ||
| Sésil | 0-Is | Sesil | ||
| Lesiones ligeramente sobreelevadas (< 2,5 mm) | Elevación plana | 0-IIa | Elevada superficial | |
| Elevación plana +depresión central | 0-IIa/0-IIc | Deprimida | ||
| Lesiones planas | Depresión mucosa | 0-IIc | ||
| Cambio mucoso plano | 0-IIb | Lesión plana | ||
| Depresión mucosa +elevación borde | 0-IIc/0IIa | – | ||
| Biopsia aleatorizada | Invisible | – | Displasia invisible | |
Fuente: Laine et al.2.
Patrones de Kudo.
Fuente: Kudo et al.58.
Una vez descrita la lesión hemos de valorar su exéresis, siendo esta posible cuando sus márgenes son definidos y no existe sospecha de componente invasivo, intentando su resección en bloque siempre que sea posible, realizando polipectomía, resección mucosa endoscópica (REM) o disección endoscópica submucosa (DES)60. En caso de derivación a centro de referencia o alta sospecha de displasia, se debe tatuar la lesión.
La toma de biopsias perilesionales es cada vez más discutida, dado el bajo rendimiento diagnóstico en la detección de displasia y su cuestionable impacto clínico, describiéndose porcentajes de entre el 0,7% y el 5% pero sin asociación con el desarrollo posterior de displasia de alto grado o cáncer61-63. En las dos series de cromoendoscopia españolas (EndoCAR25 y Grupo de Enfermedad Inflamatoria Intestinal de Castilla y León [GEICYL]64) las biopsias perilesionales no identificaron displasia.
En cuanto a la toma sistemática de biopsias aleatorias, en los últimos años numerosos estudios han demostrado una baja rentabilidad y un escaso cumplimiento de esta estrategia, siendo las biopsias dirigidas el método de vigilancia de elección comparado con las aleatorias65,66. La mayor parte de la displasia es visible en la CU67,68, y su detección en las biopsias aleatorias cuando se utiliza cromoendoscopia es muy baja2. Por ello, las guías de la ECCO31, BSG30, ACG34, APAGE33 y Cancer Council of Australia35 recomiendan biopsias dirigidas frente a las aleatorias cuando se realiza cromoendoscopia. El estudio multicéntrico prospectivo de GETAID69 confirma el bajo rendimiento de las biopsias aleatorias para identificar displasia (1,2% por colonoscopia), similar al de otros estudios que emplean cromoendoscopia (1,2 al 6,2%), asociándose a historia personal de CCR, morfología tubular del colon o presencia de CEP, siendo quizás recomendable en estos pacientes de alto riesgo mantener la toma de biopsias aleatorias múltiples. Si durante el procedimiento no se identifican lesiones ni se aprecia actividad endoscópica, puede considerarse la toma de biopsias aleatorias (2 por segmento) para determinar actividad histológica en función de la cual se recomendará si es preciso intensificar la vigilancia endoscópica2.
Es frecuente apreciar lesiones numerosas y en ocasiones grandes con patrón de criptas KudoI yII en recto y sigma. Dado el alto valor predictivo negativo (VPN) que la clasificación de Kudo ha demostrado25,64,70,71, evidenciando gran precisión para excluir displasia, así como el hecho de que la mayor parte de las lesiones con displasia se localizan en el colon proximal25,29,64, podría obviarse la resección de las lesiones KudoI y quizás las KudoII de sigma y recto. Con ello podrían evitarse complicaciones endoscópicas en pacientes en muchas ocasiones asintomáticos y ahorrar tiempo en los procedimientos. En la serie de GEICYL las lesiones localizadas en recto y sigma fueron factor protector de displasia64. Si bien las lesiones con patrón KudoII en la mayor parte de los casos corresponden a lesiones hiperplásicas, en algún caso podrían corresponder a lesiones serradas con posible potencial neoplásico. En la serie de Iacucci et al.59 el 80% de los adenomas serrados se localizaban en colon proximal, eran lesiones planas y mostraban un patrón vascular espiral irregular. En los próximos años serán necesarios nuevos estudios que evalúen la historia natural de estas lesiones en la EII.
Finalmente, un buen informe de cromoendoscopia debe contener toda la información que hemos descrito:
- -
Valoración de cicatrización mucosa (UCEIS /SES-CD).
- -
Valoración de la limpieza del colon utilizando escala objetiva (p.ej., escala de Boston por tramos).
- -
Presencia y/o ausencia de pseudopólipos.
- -
Morfología de las lesiones según la clasificación modificada de París. Descripción de bordes y presencia y/o ausencia de ulceración.
- -
Patrón de criptas de las lesiones siguiendo la clasificación de Kudo.
- -
Fotodocumentación de las lesiones y/o vídeo.
- -
Resecabilidad de las lesiones, con descripción del tipo de exéresis.
La utilización de índigo carmín o azul de metileno permite una descripción morfológica y de los patrones de criptas con un elevado valor predictivo negativo para excluir displasia. Se debe realizar exéresis de las lesiones, sin biopsias perilesionales, valorando la toma de biopsias aleatorias solo en caso de historia personal de CCR, morfología tubular del colon o CEP asociada.
¿Qué significado tiene la displasia en el momento actual y cómo debemos actuar ante su hallazgo?Se conoce como displasia o «neoplasia intraepitelial» a la alteración de carácter neoplásico de las células del epitelio intestinal limitada a la membrana basal, sin invasión de la lámina propia. La aparición de una serie de alteraciones moleculares e histológicas en el contexto de la inflamación crónica asociada condiciona el desarrollo de CCR generalmente ligado a la secuencia: inflamación, displasia (indefinida, de bajo o alto grado) y carcinoma. La displasia constituye el marcador relacionado con incremento del riesgo de malignización en más del 90% de los casos, formando parte de las estrategias de seguimiento endoscópico en la EII31. Hay que tener en cuenta ciertas limitaciones a esta secuencia, ya que el 10-15% de los cánceres se pueden desarrollar sin el antecedente de displasia o directamente desde una displasia de bajo grado (DBG) en ausencia de displasia de alto grado (DAG). La presencia de displasia indefinida pone de manifiesto los problemas de identificación de la displasia, describiéndose una progresión a DAG y CCR variable, entre el 13-28%72.
Por otra parte, el hallazgo de displasia en el seguimiento de los pacientes (displasia incidental) tiene menor riesgo asociado que este diagnóstico en la colonoscopia inicial (displasia prevalente) donde el riesgo de DAG y CCR es mayor (29% vs 16%). La displasia recurrente (DBG en dos colonoscopias consecutivas) tiene gran impacto en la indicación de colectomía, al igual que el hallazgo de displasia multifocal (especialmente si una de ellas es DAG).
La clasificación microscópica más utilizada en la actualidad en Europa es la clasificación de Viena, que estratifica la displasia en 5 categorías: negativo para displasia, indefinido para displasia, DBG, DAG y neoplasia invasiva. Las mayores dificultades diagnósticas se asocian a la diferenciación entre cambios regenerativos y DBG, así como entre DAG y carcinoma invasivo precoz, por lo que una segunda valoración por un patólogo experto es crucial antes de tomar cualquier decisión en el manejo del paciente14,31.
En nuestra práctica habitual debemos utilizar la clasificación macroscópica de la displasia que desde 2015 sigue las normas y definiciones adoptadas en Consenso Internacional (SCENIC) con adaptación de los términos descriptivos de la clasificación de París a su potencial resecabilidad endoscópica2,73 (tabla 4).
Lesión polipoide (tipo I)Lesión que protruye >2,5mm sobre la mucosa (referencia: 2,5mm =altura de una pinza con las palas cerradas).
- •
Lesión polipoide pediculada (París tipo Ip).
- •
Lesión polipoide sésil (París tipo Is).
Manejo de las lesiones polipoides. Generalmente son extirpables endoscópicamente e independientemente del grado de displasia deben tratarse mediante resección endoscópica completa (confirmada con estudio histológico y con el tejido que rodea a la lesión extirpada libre de displasia: técnicas de tinción o magnificación) y posterior seguimiento preferiblemente con cromoendoscopia (DCE) con endoscopio de alta definición. Debe asegurarse, sobre todo en lesiones DAG, la no existencia de otras lesiones con displasia en el resto del colon2,31,73,74.
La incidencia estimada de CCR en estos pacientes tras resección endoscópica de lesiones polipoides con displasia es de aproximadamente un 0,5/100 paciente/año, similar a la incidencia tras polipectomía en pacientes sin colitis asociada75. Estudios posteriores reflejan una progresión a cáncer de entre el 0% y el 4,5% a 2años y de entre el 0% y el 13,6% a 4años76. En muchos de estos estudios la diferenciación de las lesiones con DBG o DAG no existe.
Lesión sésil no polipoide (tipo II)- •
Lesiones elevadas o protruyentes <2,5mm (tipo IIa).
- •
Lesiones planas o no elevadas (tipo IIb).
- •
Lesiones deprimidas (tipo IIc), que a veces se presentan con ulceración; de mayor dificultad o no extirpables endoscópicamente.
Son frecuentes las lesiones combinadas: por ejemplo, lesiones sésiles o no polipoides elevadas acompañadas de una lesión plana (Is +IIb/IIa +IIb).
Manejo de lesiones no polipoides. En todos los casos, y especialmente en lesiones combinadas, conviene evaluar la existencia de ulceración en la lesión y definir bien los bordes de la lesión (técnicas de tinción/magnificación) para diferenciarlos de la mucosa circundante y poder realizar una resección completa74. La visualización de estas lesiones, especialmente las planas o deprimidas (IIb y IIc), se incrementa con la realización de técnicas de cromoendoscopia (DCE) con endoscopios de alta definición (HDWLE). Hay que tener en cuenta la baja probabilidad de diagnóstico de displasia, que se sitúa en torno al 15%74, tratándose en la mayoría de los casos de cambios hiperplásicos o regenerativos, cuya extirpación conllevaría un riesgo innecesario. La interpretación del patrón de criptas (clasificación de Kudo) por cromoendoscopia, para la diferenciación entre lesiones con displasia o lesiones hiperplásicas, muestra en publicaciones recientes una sensibilidad en torno al 93-100% con una especificidad del 88 al 97%74,77, con valor predictivo negativo y positivo del 88% y del 46%, respectivamente. El valor predictivo negativo para DCE y NBI fue comparable, con dudas de si estos resultados eran extrapolables en el caso de que la colonoscopia sin magnificación fuera realizada por endoscopistas no entrenados. Recientemente, el grupo castellano de EII (GEICYL)64 ha publicado sus resultados en un programa poblacional de incidencia de displasia con DCE, y aunque no se demuestra buena correlación entre lesiones con patrón de Kudo ≥III y displasia, las lesiones KudoI yII se identificaban correctamente, mostrando un alto valor predictivo negativo (92%), incluso entre los endoscopistas inexpertos.
En el consenso SCENIC no se considera la asociación entre el tipo de lesión y su probabilidad de predecir lesiones con displasia o lesiones invasivas, pero publicaciones posteriores señalan una mayor frecuencia de aparición de DAG en lesiones no polipoides con descripción de patrones de Kudo (III-V) al estudiarlas con magnificación endoscópica73,74.
Recientemente un grupo internacional de expertos han validado una nueva clasificación, The Frankfurt Advanced CE IBD LEsions system (FACILE) para mejorar la predicción de displasia en las lesiones detectadas que incluye la valoración del patrón de criptas (redondeado, patrón en vellosidades regular o irregular, desestructurado) y del patrón vascular (no visible, regular o irregular). Las cuatro características predictoras de displasia incluyen la morfología no polipoide de la lesión, patrón irregular de criptas, patrón vascular irregular y signos de inflamación en la lesión78.
Los datos de progresión a CCR de lesiones no polipoides son limitados y provienen de estudios observacionales y series de casos en los que no se diferencia claramente entre DBG y DAG76; en estos estudios hay amplia variabilidad (40-100%) en cuanto al porcentaje de resección completa de la lesión con márgenes libres de displasia (R0) condicionando el pronóstico del seguimiento. Los estudios de seguimiento más recientes incluyen resecciones R0<70%, dada la presencia de lesiones grandes con elevado porcentaje de fibrosis79,80. De todo ello se deriva una elevada heterogeneidad e inconsistencia al realizar metaanálisis de los estudios publicados76.
Globalmente, se detecta una menor progresión actual a lesiones avanzadas que en los estudios previos tras la introducción de la DCE y la endoscopia de alta definición a partir de 2012; los estudios que reportan un R0>70-80% muestran una baja progresión a DAG y CCR (incluso del 0%), aunque con periodos cortos de seguimiento (2años)76. Si tomamos como ejemplo un estudio multicéntrico y consecutivo de 69 pacientes, utilizando DCE y endoscopia de alta definición, durante los años 2000 y 2014, se observa una progresión a lesiones avanzadas tras la resección de DBG 1,34 por 100 pacientes/año con un seguimiento medio de 3,3años81. Un estudio belga reciente82 de seguimiento retrospectivo de 410 pacientes durante más de 20años describe un menor riesgo de aparición de lesiones avanzadas (CCR y DAG) en comparación con los estudios previos83, con un riesgo de progresión en caso de resección de lesiones con DBG del 2,3% al año de seguimiento (0,5% de CCR) y el 13,8% (8,5% de CCR) a los 10años, siendo el riesgo de CCR tras resección previa de lesiones con DAG del 9,1% al año y del 24,3% a los 10años. El 19% de los pacientes colectomizados por displasia tenían CCR en la pieza quirúrgica (5 de ellos con estenosis asociada) y el 42% de los pacientes colectomizados por DAG presentaban cáncer en la pieza. La presencia de lesiones metacrónicas, CEP, estenosis colónica y el antecedente de lesiones con displasia no polipoides >1cm se asociaban con un RR de 15 para el desarrollo posterior de CCR82,83.
Lesión invisibleSe denomina así la displasia detectada en biopsias aleatorias. Ya hemos comentado previamente que actualmente estas lesiones son generalmente visibles. Existen en la literatura 8 estudios con pequeño número de pacientes, seguimiento limitado y cohortes heterogéneas que incluyen pacientes con alto riesgo de CCR (CEP y displasia multifocal) que comunican porcentajes de progresión de este tipo de displasia de entre el 2,3 y el 13% a un año y del 4,6 al 44% a 2años76, con porcentajes de progresión a CCR de entre el 0 y el 28% con una media de seguimiento de 2años. La detección de lesiones con DBG utilizando DCE o endoscopios de alta definición es mayor, observando solo un 12% de lesiones con DBG invisibles frente a un 88% de lesiones invisibles previas81. En lo que respecta al seguimiento, los porcentajes de progresión son también más bajos, con cifras de 2,29/100 pacientes/año y tan solo el 3,8% de desarrollo de CCR con una media de seguimiento de 5años.
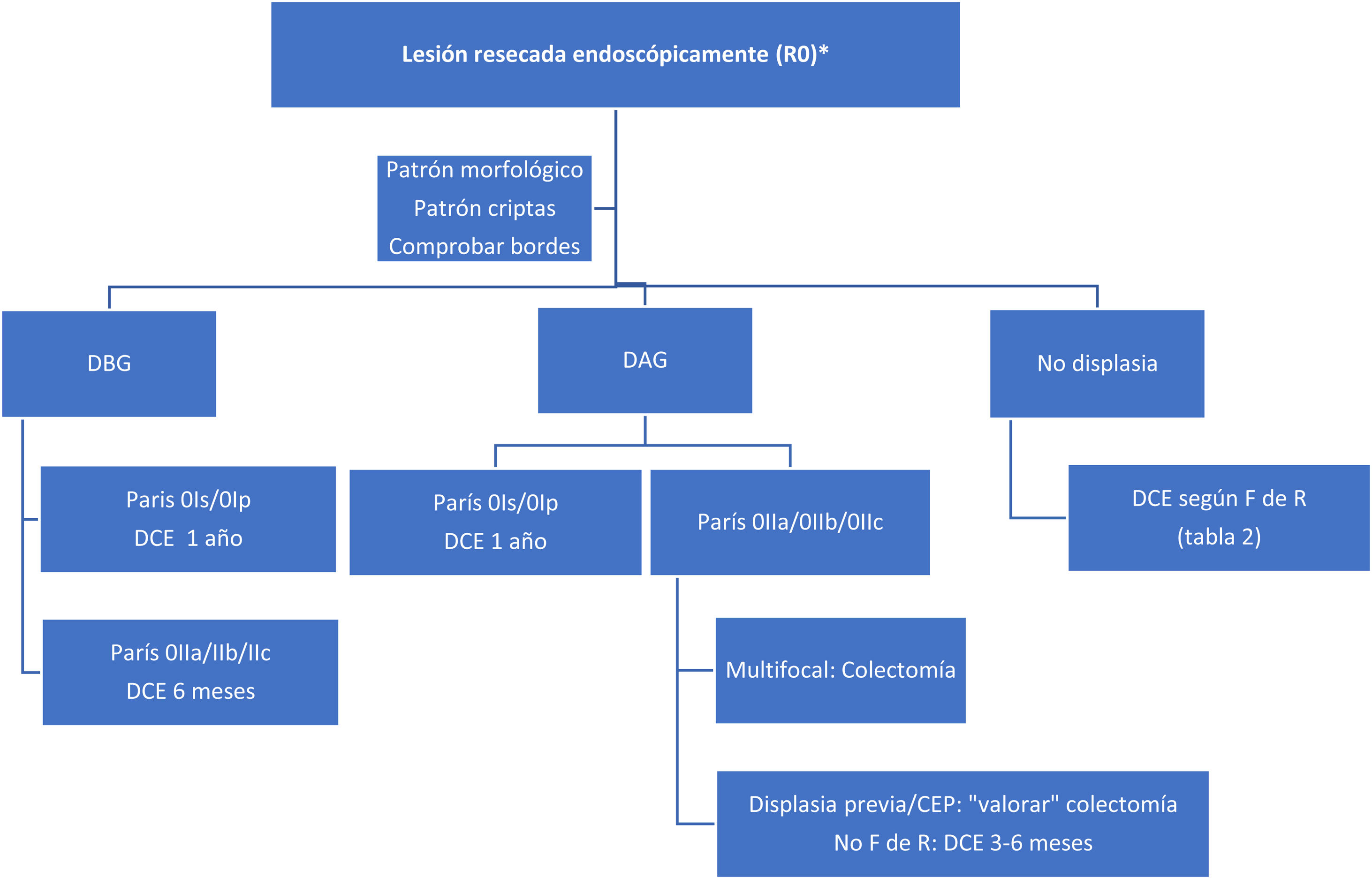
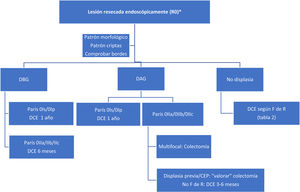
Con estos datos tan limitados, proponemos un algoritmo de seguimiento ante el hallazgo de displasia y lesión resecada completamente (fig. 2). Ante la no posibilidad de resección y existencia de displasia, la indicación quirúrgica es indiscutible.
ConclusionesEl cribado de displasia de los pacientes con EII de riesgo se debe realizar preferentemente con cromoendoscopia con colorante, estableciendo intervalos de seguimiento dependiendo de los factores de riesgo conocidos, tanto clínicos como endoscópicos e histológicos.
La historia natural de la displasia hallada con endoscopios de alta definición y técnicas de cromoendoscopia es desconocida; tan solo el tiempo y registros multicéntricos nos ayudarán progresivamente a la toma de decisiones en nuestros pacientes con EII a medio plazo.
Conflicto de interesesDra. B. Sicilia: asesoramiento científico, soporte para investigación y/o actividades formativas de Tillots Pharma, Kern Pharma, Abbvie, Janssen, Pfizer y Takeda.
Dra. L. Arias: asesoramiento científico, soporte para investigación y/o actividades formativas de Abbvie, FAES Pharma, Kern Pharma, Ferring y MSD
Dra. R. Vicente: asesoramiento científico, soporte para investigación y/o actividades formativas de Abbvie, Jannsen, MSD, Pfzer, Takeda, Shire, Dr. Falk, FAES Pharma, y Ferring.
Dra. Y. Zabana: asesoramiento científico, soporte para investigación y/o actividades formativas de AbbVie, Adacyte, Almirall, Amgen, Dr. Falk, FAES Pharma, Ferring, Jannsen, MSD, Otsuka, Pfizer, Shire, Takeda y Tillots
Dra. M Mañosa: asesoramiento científico, soporte para investigación y/o actividades formativas de AbbVie, FAES Pharma, Ferring, Jannsen, MSD, Pfizer y Takeda
B. Beltrán: consultor y miembro asesor de Takeda, Pfizer, MSD y Fresenius.
Dr. M Barreiro-de Acosta: asesoramiento científico, soporte para investigación y/o actividades formativas de MSD, AbbVie, Janssen, Kern Pharma, Celltrion, Takeda, Gillead, Pfizer, Ferring, FAES Farma, Shire Pharmaceuticals, Dr Falk Pharma, Chiesi, Gebro Pharma, Adacyte y Vifor Pharma