Los tumores gástricos representan el 3% de las causas de hemorragia digestiva alta1, siendo la neoplasia más frecuente el adenocarcinoma gástrico, muy por delante de otro tipo de tumores como los linfomas. Habitualmente, los linfomas gástricos son de estirpe B, fundamentalmente los tipo MALT (linfoma de tejido asociado a la mucosa) y los linfomas B difusos de células grandes. Por el contrario, los linfomas derivados de células T son excepcionales en esta localización2.
Presentamos el caso de un paciente varón de 86 años que ingresó en nuestro servicio por deposiciones melénicas de 15 días de evolución, sin repercusión hemodinámica. Entre los antecedentes personales destacaba una cardiopatía isquémica tipo infarto agudo de miocardio, estando doblemente antiagregado con ácido acetilsalicílico y clopidogrel. Recibía tratamiento gastroprotector con omeprazol 40mg/día. El examen físico era irrelevante y en los datos de laboratorio destacaba una anemia moderada de perfil ferropénico con hemoglobina de 10,2g/dl.
Se realizó una gastroscopia que objetivó la presencia de una lesión ulcerada y friable al roce, de unos 5cm de diámetro y aspecto submucoso, que se localizaba en curvatura mayor de cuerpo gástrico bajo. Tras la toma de biopsias y ante la sospecha de una neoplasia gástrica, se solicitó el estudio de extensión mediante una TAC toracoabdominopélvica que mostró una tumoración de la pared anterior del antro gástrico de 5,7×15cm. Así mismo, se detectaron adenopatías en el epiplón mayor y en la ventana aortopulmonar consideradas patológicas por sus características radiológicas, y por presentar una captación similar a la masa primaria en la gammagrafía realizada posteriormente (fig. 1).
El informe anatomopatológico de las biopsias de la masa gástrica describió una mucosa con proliferación de células atípicas distribuidas en sábana ocupando la lámina propia. La relación núcleo-citoplasma era elevada y se distinguían núcleos hipercromáticos e irregulares así como frecuentes figuras de mitosis, muchas de ellas atípicas. El resultado de las técnicas de inmunohistoquímica resultó positivo para CD3, CD4, CD43, CD79a y negativo para CD19, CD20, CD30, CD56 y CD2. El índice de proliferación Ki67 fue muy elevado, cercano al 100% de la celularidad. No se detectó presencia de Helicobacter pylori (HP) ni tampoco del virus de Epstein-Barr. En conjunto, el estudio inmunohistoquímico era compatible con linfoma primario gástrico T.
El paciente fue derivado al servicio de hematología del mismo centro, quien amplió el estudio con aspirado de médula ósea, y citometría de flujo de médula ósea y sangre periférica. No se determinó la serología para HTVL-1. El estadio del paciente fue IIIE según la clasificación de Ann Arbor. Se detectó como hallazgo casual una leucemia linfocítica crónica B, sin observar datos sugestivos de clonalidad T.
Dado al buen estado basal del paciente (ECOG1), se administraron 5 ciclos de tratamiento quimioterápico según esquema CEOP (ciclofosfamida, etopósido, vincristina y prednisona). Tras la última sesión se objetivó anemización pese al tratamiento con hierro oral, por lo que se realizó gastroscopia que evidenció progresión de la masa gástrica. Ante este hallazgo, se indicó una segunda línea de tratamiento con gemcitabina y oxaliplatino. Esta pauta se suspendió tras la administración de 2 ciclos por toxicidad neurológica y empeoramiento del estado general del paciente. En la actualidad, tras 7 meses del diagnóstico, se encuentra recibiendo cuidados paliativos.
Los linfomas extranodales constituyen alrededor del 40% del total de los linfomas, y se localizan con mayor frecuencia en el tracto gastrointestinal, sobre todo a nivel gástrico, donde representan el 3% de las neoplasias primarias a este nivel2,3. Los más frecuentes son los de estirpe B, fundamentalmente el linfoma MALT, el difuso de células grandes, el linfoma folicular y el linfoma del manto que abarcan en conjunto más del 96% de los casos.
La presentación clínica suele ser inespecífica, fundamentalmente epigastralgia, vómitos y síndrome general. La presencia de hematemesis o melenas como manifestación de hemorragia digestiva es poco frecuente, aunque el sangrado digestivo oculto se observa hasta en el 19% de los casos1,4. No existe una imagen endoscópica patognomónica pudiendo observarse una masa, lesión sugestiva de úlcera péptica o engrosamiento de pliegues5. Es frecuente su distribución multifocal, por lo que es importante la toma de biopsias múltiples incluso en áreas aparentemente no afectas6. El diagnóstico diferencial debe abarcar los principales linfomas gástricos y se basa en la inmunohistoquímica. En nuestro paciente, la positividad de CD3 y la ausencia de CD19 y CD20 permitieron descartar una neoplasia de linfocitos B, confirmando el diagnóstico de un proceso linfoproliferativo T.
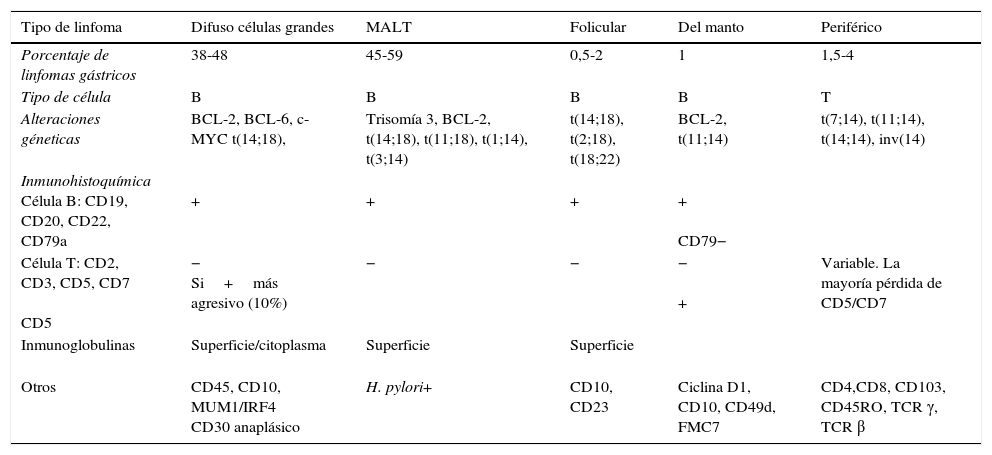
La tabla 1 resume las principales características de los linfomas gástricos que facilitan su diagnóstico diferencial. Los linfomas T constituyen un grupo heterogéneo y de difícil diagnóstico, dada la variabilidad en su inmunohistoquímica, pues, incluso marcadores típicos de células T como el CD5 y CD7 pueden estar ausentes7. Se trata de una enfermedad infrecuente que representa el 1,5% de los linfomas gástricos. A diferencia de otros linfomas más frecuentes como el MALT, el HP no está implicado en su patogenia, por lo que el tratamiento erradicador no es una terapia eficaz. Generalmente, el pronóstico es malo debido a su agresividad y frecuentes recaídas8.
Diagnóstico diferencial de los linfomas gástricos más frecuentes
| Tipo de linfoma | Difuso células grandes | MALT | Folicular | Del manto | Periférico |
|---|---|---|---|---|---|
| Porcentaje de linfomas gástricos | 38-48 | 45-59 | 0,5-2 | 1 | 1,5-4 |
| Tipo de célula | B | B | B | B | T |
| Alteraciones géneticas | BCL-2, BCL-6, c-MYC t(14;18), | Trisomía 3, BCL-2, t(14;18), t(11;18), t(1;14), t(3;14) | t(14;18), t(2;18), t(18;22) | BCL-2, t(11;14) | t(7;14), t(11;14), t(14;14), inv(14) |
| Inmunohistoquímica Célula B: CD19, CD20, CD22, CD79a | + | + | + | + CD79− | |
| Célula T: CD2, CD3, CD5, CD7 CD5 | − Si+más agresivo (10%) | − | − | − + | Variable. La mayoría pérdida de CD5/CD7 |
| Inmunoglobulinas | Superficie/citoplasma | Superficie | Superficie | ||
| Otros | CD45, CD10, MUM1/IRF4 CD30 anaplásico | H. pylori+ | CD10, CD23 | Ciclina D1, CD10, CD49d, FMC7 | CD4,CD8, CD103, CD45RO, TCR γ, TCR β |
BCL-6: B-cell lymphoma 6 protein; c-MYC: myelocytomatosis oncogen homolog; FMC7: formation of mitochondrial complexes 1 homolog; inv: inversion; MALT: linfoma de tejido asociado a mucosa; MUM1: multiple myeloma oncogene 1, también llamado IRF4: interferon regulatory factor 4; t: translocación; TCR: T-cell receptor.