La infección por el virus de la hepatitis C (VHC) es un problema de salud de primera magnitud en Europa y especialmente en los países mediterráneos, donde las tasas de prevalencia oscilan entre el 0,31 y el 0,42%.
Los pacientes con hepatitis crónica por virus C presentan una mayor prevalencia de tuberculosis (TBS) respecto a la población general. El contexto epidemiológico de ambas enfermedades es similar en algunos casos como en las personas con adicción a drogas por vía parenteral, privados de libertad y personas sin hogar. El tratamiento del VHC con peginterferón y ribavirina se asociaba a un mayor riesgo de reactivación de TBC1,2, pero la experiencia con relación a la reactivación de infecciones con los nuevos antivirales de acción directa (AAD) es limitada.
Presentamos el caso de un varón de 59 años, nacido en Guinea y residente en España desde los 10 años. Presenta una cirrosis hepática por VHB (HBeAg−, DNA-VHB 1.753UI/ml) y VHC (genotipo 2a, RNA-VHC 2470203UI/ml); Child A (5 puntos); anticuerpos anti-HIV negativo; FibroScan® de 69,1Kpa y sin varices esofágicas. Ascitis grado 1 hacía unos meses que se resolvió tras tratamiento deplectivo y dieta hiposódica. No fue posible obtención de líquido ascítico para estudio dada su escasa cuantía. Inició entecavir a principios de diciembre del 2015. A mediados de diciembre inicia tratamiento con sofosbuvir y ribavirina.
Ingresa en febrero del 2016 por clínica de un mes de evolución de astenia, anorexia, pérdida de peso de 10kg y episodios de fiebre de hasta 38,7°C de predominio vespertino. Como único signo guía presentaba constipación pertinaz en las últimas semanas. Nada a destacar a la exploración cardio-respiratoria. Abdomen con semiología ascítica grado 2. En analítica destaca leucocitos de 3.850×109, Hb 146g/l; Plq 213×109, AST/ALT de 65/57U/l, bilirrubina 0,8mg/dl; INR 1.1. VSG 52mm 1.ª h, PCR de 7,9mg/dl, CA 125 de 115,6U/ml; RNA VHC indetectable y DNA VHB<20UI/ml. La Rx de tórax muestra mínimo derrame pleural derecho y sin condensaciones. Hemocultivos seriados negativos.
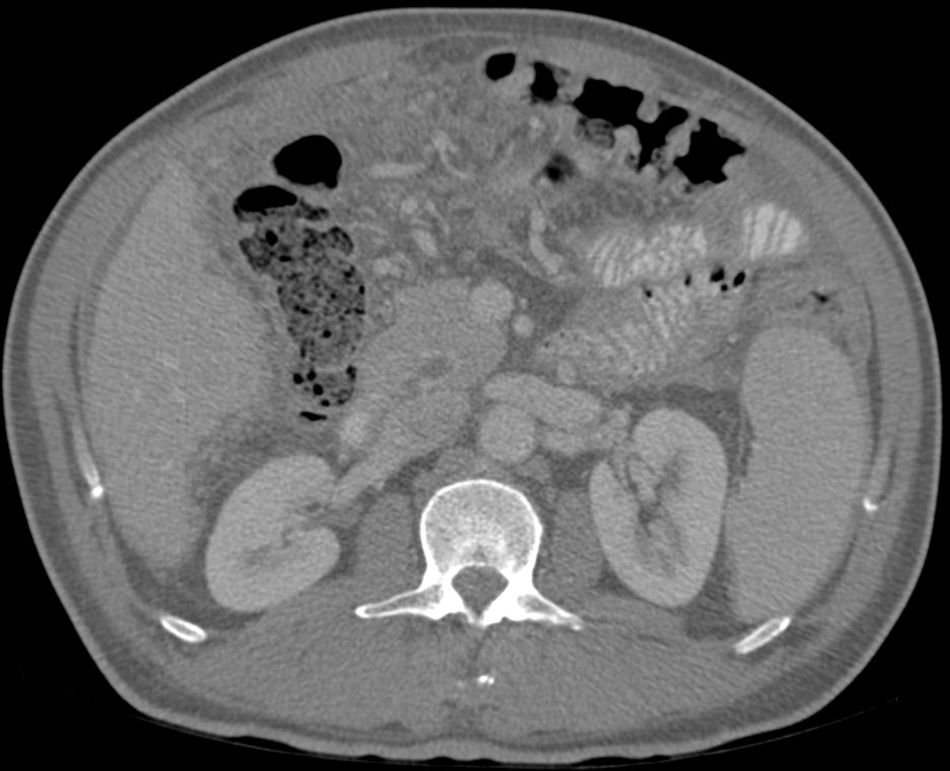
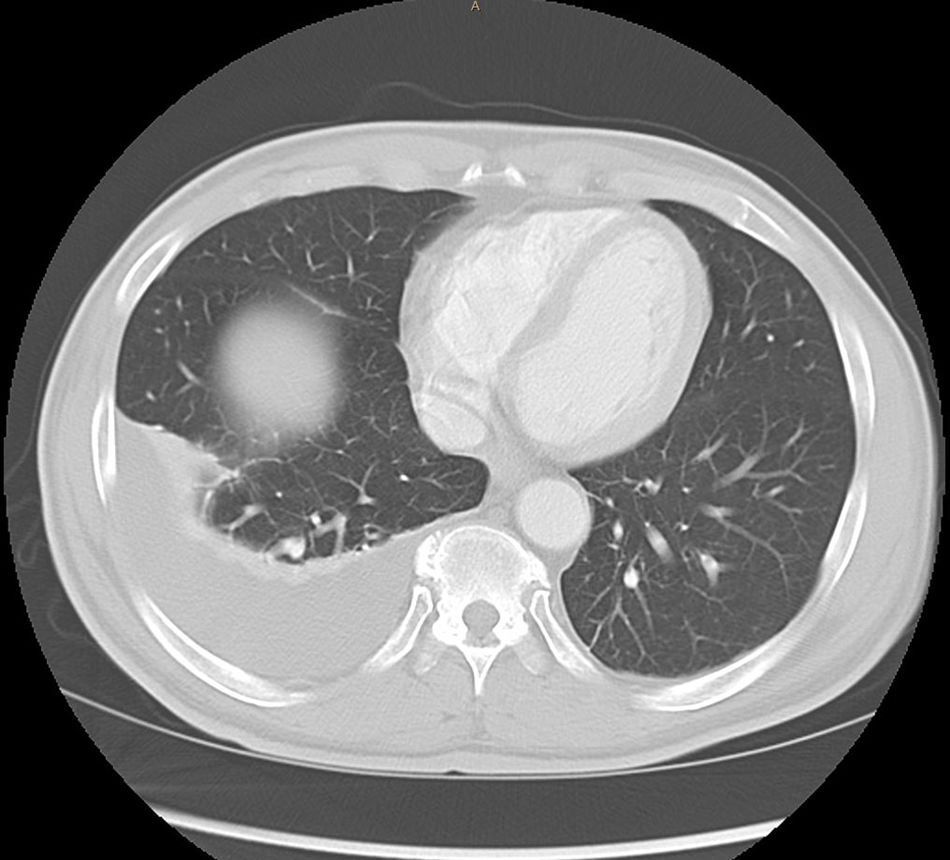
Se realiza paracentesis evacuadora de 3,5l que mostraba un líquido ascítico con 400 leucocitos, 95% linfocitos (no se determinaron proteínas, albúmina o ADA en aquel momento por asumir descompensación de su CH). Se realizó TAC toracoabdominal que informa de múltiples nódulos de 2-3mm de predominio subpleural, líquido libre perihepático, periesplénico y engrosamiento de peritoneo y aumento de densidad difuso del mesenterio. Derrame pleural derecho (figs. 1 y 2).
Se realiza toracocentesis que muestra líquido pleural con proteínas de 58g/l, leucocitos 1.325 /mm3 (99% de linfocitos), ADA de 42,3U/l (límite superior de la normalidad), PCR de líquido pleural positivo para Mycobacterium tuberculosis. QuantiFERON-TB®>4UI/ml.
Con estos resultados se orienta el caso como una reactivación de TBC abdominal y pleural en contexto de tratamiento con AAD en paciente con cirrosis por VHB y VHC.
Se suspende el tratamiento con AAD el 18/02/2016 e inicia tratamiento tuberculostático con rifampicina (RIF), isoniazida (INH) y etambutol (× 2 meses) y 4 meses más de RIF + INH. Correcta evolución clínica posterior con desaparición de la fiebre, resolución del cuadro tóxico y la constipación (colonoscopia ambulatoria normal). Desaparición de la ascitis sin tratamiento diurético.
Respuesta virológica sostenida de la hepatitis C pese a recibir únicamente 12 semanas de tratamiento. La TAC tóraco-abdominal a los 6 meses de finalizado el tratamiento de TBC muestra resolución del derrame pleural derecho, del líquido peritoneal, del engrosamiento de la grasa peritoneal y sin identificase los micronódulos pulmonares.
Las reactivaciones de infecciones con los AAD son poco frecuentes y existen casos descritos en relación a la hepatitis B y VHS entre otras infecciones3-5. Los casos descritos de reactivación de TBC son infrecuentes y en relación a las terapias dobles con interferón y ribavirina o las triples con la asociación con boceprevir o telaprevir. Hasta la fecha únicamente se ha descrito un caso de reactivación de una TBC miliar durante el tratamiento con AAD. El paciente había recibido tratamiento con sofosbuvir/ledipasvir y ribavirina6. Existen varios factores que pueden haber contribuido a la reactivación de la TBC en el paciente. El primero es la cirrosis subyacente que se ha asociado a disfunción de neutrófilos, linfocitos y macrófagos y a una disminución de la producción de IFN-α y TNF-α7-9. Por otro lado, las alteraciones producidas por los AAD sobre el sistema inmune no son del todo conocidas. Diferentes estudios muestran una reducción de la activación de los linfocitos y una normalización de la función de las células NK10-13. Se han descrito reactivaciones de herpes virus y de la hepatitis B, así como un potencial aumento de las recidivas de los hepatocarcinomas en pacientes tratados con AAD. Al igual que en el caso anteriormente descrito, resulta difícil establecer una relación causal con el tratamiento con AAD o simplemente se trata de una coincidencia en el tiempo de las 2 infecciones. Se trataría del segundo caso de reactivación de TBC durante el tratamiento con AAD. La baja incidencia de casos de reactivación de TBC con los AAD reportada hasta el momento, no permite realizar recomendaciones sobre su cribado antes de iniciar el tratamiento.