La evidencia disponible para estratificar el riesgo de presentar un cáncer colorrectal metacrónico tras la extirpación de pólipos colorrectales y determinar los intervalos de vigilancia es limitada y se basa en estudios observacionales. No obstante, a la espera de nuevas evidencias, es necesario unificar los criterios del seguimiento endoscópico en nuestro medio. Por ello, desde las principales sociedades científicas involucradas en el manejo de estos pacientes, como son la Asociación Española de Gastroenterología, la Sociedad Española de Medicina Familiar y Comunitaria, la Sociedad Española de Endoscopia Digestiva y el Grupo de Cribado de Cáncer Colorrectal de la Sociedad Española de Epidemiología, se ha creado este documento de consenso, que se encuentra incluido en el capítulo 10 de la «Guía de Práctica Clínica de Diagnóstico y Prevención del Cáncer Colorrectal. Actualización 2018».
A continuación, se presentarán importantes novedades respecto a la edición previa publicada en 2009. En primer lugar, se establecen situaciones que requieren y no requieren vigilancia endoscópica y se elimina la necesidad de realizar seguimiento en individuos que no presentan un riesgo especial de cáncer de colon metacrono. En segundo lugar, se establecen recomendaciones de vigilancia endoscópica en individuos con pólipos serrados. Finalmente, a diferencia de la edición anterior, se dan recomendaciones de vigilancia endoscópica en individuos intervenidos por cáncer colorrectal. Paralelamente, supone un avance sobre la guía europea de calidad en el cribado del cáncer colorrectal, ya que elimina la división entre grupo de riesgo medio y grupo de riesgo alto, lo que supone la eliminación de una proporción considerable de colonoscopias de vigilancia precoz. Finalmente, se dan recomendaciones claras sobre la ausencia de necesidad de seguimiento en el grupo de riesgo bajo, para el que la guía europea mantenía cierta ambigüedad.
There is limited scientific evidence available to stratify the risk of developing metachronous colorectal cancer after resection of colonic polyps and to determine surveillance intervals and is mostly based on observational studies. However, while awaiting further evidence, the criteria of endoscopic follow-up needs to be unified in our setting. Therefore, the Spanish Association of Gastroenterology, the Spanish Society of Family and Community Medicine, the Spanish Society of Digestive Endoscopy, and the Colorectal Cancer Screening Group of the Spanish Society of Epidemiology, have written this consensus document, which is included in chapter 10 of the “Clinical Practice Guideline for Diagnosis and Prevention of Colorectal Cancer. 2018 Update”.
Important developments will also be presented as regards the previous edition published in 2009. First of all, situations that require and do not require endoscopic surveillance are established, and the need of endoscopic surveillance of individuals who do not present a special risk of metachronous colon cancer is eliminated. Secondly, endoscopic surveillance recommendations are established in individuals with serrated polyps. Finally, unlike the previous edition, endoscopic surveillance recommendations are given in patients operated on for colorectal cancer. At the same time, it represents an advance on the European guideline for quality assurance in colorectal cancer screening, since it eliminates the division between intermediate risk group and high risk group, which means the elimination of a considerable proportion of colonoscopies of early surveillance. Finally, clear recommendations are given on the absence of need for follow-up in the low risk group, for which the European guidelines maintained some ambiguity.
La progresiva implementación de los programas de cribado de cáncer colorrectal (CCR) poblacionales en todas las comunidades autónomas está ocasionando un aumento considerable del número de colonoscopias, derivadas de la positividad del test de sangre oculta en las heces inmunológico (SOHi) y de las indicaciones de vigilancia endoscópica de las lesiones detectadas en colonoscopias previas. Se estima que un 20-25% de las colonoscopias realizadas en individuos mayores de 50 años corresponden a indicaciones de vigilancia endoscópica1–3 tanto derivadas de los programas de cribado poblacional como de la evaluación de los pacientes con síntomas digestivos, con un coste importante para el sistema de salud y consumiendo una elevada proporción de la limitada oferta de colonoscopias, con indicaciones no siempre correctas. Concretamente, al 21,99‰ de la población candidata a cribado poblacional se le detectará y resecará una lesión colorrectal que posteriormente requerirá seguimiento endoscópico4. Por otra parte, la tasa de progresión de adenoma avanzado a CCR no se conoce con exactitud y se estima que puede ser baja y oscilar entre el 2,6% en población de 50 a 59 años y el 5,6% en población≥80 años de forma anual5. Es fundamental dirigir la vigilancia endoscópica a aquellos pacientes que realmente se beneficien de ella, con la mínima frecuencia necesaria para lograr el mayor rendimiento preventivo del CCR, evitando las molestias y complicaciones de la colonoscopia y limitando el número de exploraciones de eficacia dudosa.
Esta revisión tiene como objetivo establecer una adecuada estratificación del riesgo de presentar CCR metacrónico tras la extirpación de pólipos colorrectales o de aquellos pasados por alto en estudios previos y determinar los intervalos de vigilancia adecuados con base en la evidencia científica disponible6. Hoy por hoy, la evidencia disponible se basa en estudios observacionales en los que la indicación del intervalo de repetición de la colonoscopia de seguimiento es arbitraria7,8. La mayoría de los estudios evalúan la eficacia de la colonoscopia de seguimiento a partir de variables intermedias (tasa de detección de adenomas avanzados) y no de variables finales (incidencia y mortalidad)9,10. Los resultados de los actuales estudios, con participación de centros de nuestro país, contribuirán a generar nuevas evidencias para dar respuesta a cuáles son las situaciones de riesgo tras la extirpación de los pólipos colorrectales y cuáles son los intervalos de vigilancia más adecuados en las diferentes situaciones, así como a conocer las vías de carcinogénesis implicadas en función de la lesión precursora asociada y el potencial uso de marcadores moleculares en la estratificación del riesgo de CCR11.
MétodosEste documento se ha elaborado tras una reunión de consenso entre profesionales de las principales sociedades científicas involucradas en la vigilancia endoscópica: la Asociación Española de Gastroenterología, la Sociedad Española de Endoscopia Digestiva, la Sociedad Española de Medicina Familiar y Comunitaria y la Sociedad Española de Epidemiología.
El objetivo de dicha reunión ha sido unificar los criterios del seguimiento endoscópico en nuestro medio para disminuir la variabilidad en la toma de decisiones, establecer una referencia en la práctica clínica habitual de los profesionales involucrados y extender las recomendaciones a los programas de cribado poblacional del CCR.
La revisión de las evidencias y las recomendaciones establecidas que se enumeran a continuación tienen como documento de partida la Guía de la Sociedad Europea de Endoscopia Digestiva publicada en 201312 y el documento de posicionamiento de la British Society of Gastroenterology de 2017 sobre el seguimiento de los pólipos serrados13. Se ha realizado una búsqueda bibliográfica exhaustiva con base en la evidencia científica disponible hasta diciembre de 2017 que, inicialmente, se ha centrado en revisiones sistemáticas, metaanálisis y guías de práctica clínica publicados en MEDLINE, EMBASE y Cochrane Library; posteriormente, se ha ampliado la selección hacia estudios clínicos en las fuentes de información mencionadas previamente. Asimismo, se han valorado las referencias destacadas de los documentos consultados. La estrategia de búsqueda empleada ha sido:
- •
#1 POPULATION SURVEILLANCE[MeSH] OR Surveillan*
- •
#2 DISEASE PROGRESSION[MeSH]
- •
#3 TIME FACTORS[MeSH]
- •
#4 #1 OR #2 OR #3
Por último, la calidad de la evidencia y la fuerza de la recomendación se han establecido con base en el sistema Grading of Recommendations, Assessment, Development and Evaluation (GRADE).
Calidad de la colonoscopia basalLas recomendaciones de vigilancia se establecen con base en los hallazgos de la colonoscopia basal, por lo que es necesario que esta exploración sea de máxima calidad. Los aspectos fundamentales en los que se centra la calidad de la colonoscopia, necesarios para poder establecer las recomendaciones de vigilancia, son 3: inspección completa del colon, limpieza colónica adecuada y resección completa de las lesiones detectadas. En la tabla 1 se definen los requisitos mínimos de calidad que la colonoscopia basal debe cumplir, establecidos por un panel de expertos de la World Endoscopy Organization14.
Criterios de calidad que debe cumplir la colonoscopia basal antes de dar recomendaciones de vigilancia
| Inspección total del ciego, incluidos válvula ileocecal y orificio apendicular. Se recomienda adjuntar fotografía al respecto |
| Calidad de la limpieza colónica adecuada según una escala validada |
| Informe de la colonoscopia que incluya |
| Número total de pólipos, de pólipos extirpados y de pólipos recuperados |
| Tamaño de cada pólipo |
| Localización de cada pólipo |
| Morfología de cada pólipo |
| Método de extirpación de cada pólipo |
| Evaluación de la integridad de la resección |
| Si la resección es en bloque o fragmentada |
| Informe de anatomía patológica que incluya |
| Número total de adenomas y de pólipos serrados |
| Diagnóstico histopatológico de cada pólipo |
| La presencia de componente velloso en cada pólipo |
| El grado de displasia de cada pólipo |
Fuente: Elaboración propia de los autores.
Por su morfología pueden ser planos, sésiles y pediculados. Por su histología, se clasifican en: adenomatosos (60-70%), serrados (10-30%) y otros (10-20%), que incluyen pólipos inflamatorios, juveniles, hamartomatosos y otras lesiones no mucosas.
Lesión adenomatosaDiversos estudios y metaanálisis han mostrado que los principales factores de riesgo de metacronicidad son el tamaño y el número de lesiones extirpadas en la colonoscopia basal. Un tamaño mayor de 10mm lleva consigo un riesgo en torno a 2-3 veces superior de adenoma avanzado o CCR en el seguimiento9,10,15, con un riesgo algo mayor cuando la lesión es de tamaño superior a 20mm10,16. Respecto al número de lesiones, la existencia de 3 o más se asocia también con un mayor riesgo de lesión colorrectal avanzada o CCR10,15. Sin embargo, estos datos proceden de estudios realizados en la década de 1990. Es probable que los avances tecnológicos en la endoscopia, junto con la introducción de una política de calidad en la colonoscopia, hayan producido, por una parte, un incremento en el número de sujetos a los que se detectan múltiples adenomas, y por otra parte, una reducción en el riesgo real de cáncer metacrono17,18.
Respecto a la histología, se dispone de menos evidencias que asocien el riesgo a los hallazgos histológicos avanzados, especialmente en las lesiones con un tamaño inferior a 10mm. Las lesiones con componente velloso (>20%) o displasia de alto grado (DAG) presentan un pequeño incremento del riesgo de lesión colorrectal avanzada respecto a las lesiones predominantemente tubulares, que tienen únicamente componente tubular (≥80%) o displasia de bajo grado (DBG)10,15,19.
Con todo ello, se considera lesión adenomatosa avanzada el adenoma con componente velloso (>20%), 10mm o más de diámetro o con DAG, y lesión no avanzada, el adenoma tubular (≥80%) con DBG menor de 10mm (tabla 2).
Clasificación de las lesiones colorrectales en avanzadas y no avanzadas
| Lesión adenomatosa | |
|---|---|
| No avanzada | Adenoma tubular, <10mm y con DBG |
| Avanzada | Adenoma con componente velloso o≥10mm o con DAG |
| Lesión serrada | |
|---|---|
| No avanzada | Pólipo serrado<10mm y sin displasiaa |
| Avanzada | Pólipo serrado≥10mm o con displasia |
DAG: displasia de alto grado; DBG: displasia de bajo grado.
La mayoría de los CCR se desarrollan a través de la secuencia adenoma-carcinoma tradicional. No obstante, alrededor del 20-30% de los CCR lo hacen por medio de la denominada vía serrada de carcinogénesis, cuya lesión precursora es el pólipo serrado. Los pólipos serrados se clasifican en pólipos hiperplásicos, sésiles y adenomas serrados tradicionales20,21. Diversos estudios observacionales han mostrado que la presencia de pequeños pólipos hiperplásicos en recto-sigma no se asocia con riesgo de lesiones avanzadas metacronas22,23.
Algunos estudios han evaluado el riesgo de lesiones síncronas o metacronas tras la extirpación de lesiones serradas y las características de estas que parecen conferir un mayor riesgo son la presencia de displasia y el tamaño mayor de 10mm22,24–29, por lo que estas lesiones se consideran avanzadas (tabla 2). Contrariamente, se consideran lesiones no avanzadas los pólipos serrados menores de 10mm sin displasia.
Grupos de riesgoRiesgo de los pacientes con pólipos adenomatosos de desarrollar cáncer colorrectalMúltiples estudios muestran que la presencia de adenomas no avanzados no se asocia con riesgo de CCR metacrono (anexo 1). Un estudio retrospectivo publicado en 1992 con 1.618 pacientes30 observó que aquellos con adenomas no avanzados presentaban un riesgo de desarrollar CCR similar al de la población general, a pesar de no realizar seguimiento endoscópico, resultado que fue corroborado posteriormente por otro estudio con mayor número de sujetos participantes: 5.7797. Más tarde, en el estudio de Løberg et al.31, que evaluó la mortalidad por CCR, se detectó que los pacientes con adenomas no avanzados (1-2 adenomas tubulares con DBG) a los cuales se les realizaba polipectomía en la colonoscopia basal, presentaban una reducción del riesgo de muerte por CCR del 25% respecto a la población general. Estos hallazgos confirman el efecto protector de la polipectomía frente a la vigilancia endoscópica en este grupo de pacientes, con una menor mortalidad por CCR que la población general.
En cambio, diversos estudios muestran la asociación entre adenomas avanzados y CCR metacrono (anexo 1). Ya en 1992, se observó que los pacientes con lesiones avanzadas presentaban un riesgo de CCR de 3,6-6,6 veces más que la población general30. Estos resultados se confirmaron en el estudio de Cottet et al.7, en el que los pacientes con adenomas avanzados sin seguimiento endoscópico presentaban una tasa de incidencia estandarizada de CCR de 4,26 (IC 95% 2,89-6,04). Por otra parte, Løberg et al.31 mostraron que los pacientes con adenomas de alto riesgo (al menos 3, histología vellosa o DAG) presentaban un incremento del 16% en la mortalidad por CCR respecto a la población general. Asimismo, Atkin et al.16 muestran en un estudio retrospectivo que incluye cerca de 12.000 pacientes con adenomas de riesgo medio (1-2 adenomas≥10mm o 3-4 adenomas<10mm), que la vigilancia endoscópica reduce la incidencia de CCR y que una serie de variables definen el grupo de pacientes en los que se concentra el incremento del riesgo y el beneficio del seguimiento endoscópico: colonoscopia de baja calidad, tamaño mayor de 20mm, DAG o localización proximal de los adenomas.
Lesión colorrectal avanzada metacronaLa incidencia de neoplasia avanzada metacrona en pacientes con adenomas no avanzados comparada con población sin adenomas ha sido analizada en diferentes estudios (anexo 1). Dos ensayos clínicos controlados y aleatorizados9,32, así como 3 estudios de cohortes33–35 han comparado la prevalencia de dicha lesión en diferentes intervalos de seguimiento (2 frente a 4 años; 3 frente a 5 años; 3-5 frente a 6-10 años), sin detectar diferencias estadísticamente significativas. Posteriormente, en el año 2014, se publicó una revisión sistemática36 de 7 estudios observacionales (3 retrospectivos, 4 prospectivos) que analizaba la incidencia de neoplasia avanzada metacrona en pacientes con adenomas no avanzados y aquellos sin neoplasia en la colonoscopia basal; el riesgo relativo fue de 1,83 (IC 95% 1,31-2,56), si bien la incidencia de neoplasia avanzada fue baja en ambos grupos: del 1,6% en pacientes sin neoplasia y del 3,6% en aquellos con adenomas de bajo riesgo. Adicionalmente, Gupta et al.19 analizaron qué factores permitían identificar a un grupo de mayor riesgo de lesión colorrectal avanzada metacrona entre estos pacientes. De esta manera, la edad (≥70 años), una historia previa de pólipos y la presencia de adenomas proximales y distales podrían estratificar el riesgo entre estos pacientes.
La evidencia disponible respecto al riesgo de detección de lesión colorrectal avanzada metacrona en pacientes con adenomas de alto riesgo (adenomas avanzados o más de 2 adenomas no avanzados) indica que se incrementa entre 5 y 7 veces (estudios de cohortes prospectivas)9,35,37 y 2 veces (análisis unificado de 8 ensayos clínicos y 2 metaanálisis)10,15,38 respecto a los sujetos sin adenomas (anexo 1).
Riesgo de los pacientes con pólipos serrados de desarrollar cáncer colorrectalEn el estudio de casos-controles publicado por Erichsen et al.24, los pacientes con lesiones serradas sin displasia presentaban un riesgo de CCR a los 10 años del 2,56%, resultado muy similar al de los pacientes con adenomas convencionales, con un 2,33% de riesgo de CCR en el mismo periodo. Por otro lado, datos de este mismo estudio muestran que los pacientes con pólipos hiperplásicos tenían un riesgo inferior (anexo 2).
En cambio, el riesgo de las lesiones serradas avanzadas es superior. Así, la hazard ratio (HR) de CCR a los 10 años en pacientes con lesiones serradas≥10mm, respecto a la de sujetos sin pólipos, es de 4,2 (IC 95% 1,3-13,3), similar a la de los pacientes con adenomas avanzados (HR 3,3, IC 95% 2,1-5,2)26. Por otra parte, el estudio de Erichsen et al.24 define que el riesgo de CCR en pacientes con lesiones serradas con displasia (pólipos serrados sésiles con displasia y adenomas tradicionales) es del 4,43%. Por otra parte, no existe información respecto al riesgo de desarrollo de CCR en pacientes con múltiples lesiones serradas no avanzadas.
Lesión colorrectal avanzada metacronaDos estudios observacionales22,23 han demostrado que la presencia de pólipos hiperplásicos pequeños no se asocia con un aumento del riesgo de adenomas avanzados metacronos. Asimismo, la coexistencia de pólipos hiperplásicos y adenomas tampoco supone un aumento del riesgo de adenomas metacronos ni adenomas avanzados si se compara con aquellos que solo presentan adenomas25,39,40 (anexo 2).
Por otra parte, respecto a los pólipos serrados avanzados, no se dispone de estudios sólidos que evalúen la incidencia de neoplasia avanzada metacrona. No obstante, se ha observado que la presencia de displasia, el tamaño>10mm o la localización proximal pueden ser predictores de lesión colorrectal avanzada sincrónica22,26–28. En este sentido, un estudio reciente muestra que la aparición sincrónica de adenomas avanzados y lesiones serradas>10mm o con displasia incrementa el riesgo tanto de adenomas avanzados metacronos como de lesiones serradas metacronas>1cm. En cambio, la aparición sincrónica de lesiones serradas de pequeño tamaño sin displasia no incrementa el riesgo en los pacientes con adenomas no avanzados29.
Clasificación según grupos de riesgoCon base en los criterios de lesiones colorrectales avanzadas y no avanzadas expuestos en el apartado anterior y en las evidencias disponibles sobre el riesgo de los pacientes de desarrollar CCR o lesión colorrectal avanzada, se proponen 2 grupos de riesgo: pacientes que no requieren vigilancia endoscópica y pacientes que requieren vigilancia endoscópica (tabla 3).
Clasificación de los grupos de riesgo en pacientes que no requieren y que requieren vigilancia
| Pacientes que no requieren vigilancia endoscópica | Una o 2 lesiones adenomatosas tubulares con DBG y tamaño<10mm |
| Lesiones serradas sin displasia<10mm (incluye cualquier número de pólipos hiperplásicos en recto-sigma<10mm) | |
| Pacientes que requieren vigilancia endoscópica | Tres o más lesiones adenomatosas tubulares con DBG y tamaño<10mm |
| Al menos una lesión adenomatosa con componente velloso (>20%), DAG o tamaño≥10mm | |
| Al menos una lesión serrada con displasia o tamaño≥10mm |
DAG: displasia de alto grado; DBG: displasia de bajo grado.
Fuente: Elaboración propia de los autores.
Según los estudios comentados previamente, los pacientes con lesiones consideradas no avanzadas o de bajo riesgo tienen un pequeño incremento del riesgo de lesión colorrectal avanzada respecto a los pacientes sin lesiones, pero menor mortalidad por CCR que la población general, por lo que el beneficio de la vigilancia endoscópica es residual en este grupo. Por ello, se propone el retorno al cribado poblacional con test de SOHi o indicar una colonoscopia a los 10 años en caso de que no haya programa poblacional de cribado de CCR. En cuanto al retorno al programa de cribado poblacional, dado el riesgo similar al de la población con colonoscopia normal, se recomienda reincorporar a esta población a los 10 años. Sin embargo, en el momento actual no hay evidencias ni a favor ni en contra de reincorporar a estos pacientes en este periodo o en plazos más cortos (2, 5 años).
Los pacientes con lesiones avanzadas presentan un incremento del riesgo de desarrollar lesión colorrectal avanzada y de mortalidad por CCR, por lo que se propone realizar la primera vigilancia endoscópica a los 3 años de la colonoscopia basal. Este intervalo se ha establecido basándose en una evidencia científica escasa, ya que no existen estudios al respecto, por lo que es posible que intervalos más amplios reporten resultados similares. Únicamente existe un ensayo clínico controlado y aleatorizado publicado en 199341 que compara 2 intervalos de seguimiento en pacientes a los que se les han extirpado adenomas de colon: 1 y 3 años frente a 3 años, sin obtener diferencias estadísticamente significativas en cuanto a la tasa de adenomas avanzados en el seguimiento.
Por otro lado, las guías europeas y las de Reino Unido42,43 dividen el grupo de alto riesgo en riesgo medio y riesgo alto (un adenoma con al menos 20mm o 5 o más adenomas). Para los primeros, establecen la colonoscopia de vigilancia a los 3 años, y para los segundos, al año. En los programas de cribado poblacionales españoles, el 44% de los pacientes con adenomas corresponden a la primera categoría y el 21% a la segunda44. Diferentes estudios han comparado ambas estrategias45,46. En el estudio de Martínez et al.46 se encuentra una tasa de más del doble de lesión colorrectal avanzada al año de la colonoscopia basal en el grupo de alto riesgo frente al de riesgo medio, sin diferencias en la tasa de CCR. Por su parte, Cubiella et al.45, en un estudio retrospectivo realizado en los programas de cribado españoles, observaron que la incidencia de neoplasia avanzada a los 3 años en el grupo de alto riesgo era del 16% frente al 12% del grupo medio (HR 1,5, IC 95% 1,2-1,8). En este estudio no se encontraron diferencias en la incidencia de CCR (0,5% en alto riesgo y 0,4% en riesgo medio; HR 1,6, IC 95% 0,6-3,8), aunque el estudio no fue diseñado para este objetivo. Por tanto, a partir de estos datos, consideramos que no disponemos de evidencia suficiente que justifique realizar la primera colonoscopia de vigilancia al año en los pacientes que cumplen los criterios de alto riesgo de la guía europea42. Por otro lado, únicamente disponemos de los datos anteriormente mencionados para justificar la eliminación de dicho grupo de riesgo en los programas poblacionales de cribado de CCR. Por consiguiente, en pacientes con 5 o más adenomas o algún adenoma de 20mm o superior, que constituyen el grupo de alto riesgo de la guía europea42, en el momento actual no hay evidencias ni a favor ni en contra de acortar el intervalo de seguimiento a un año.
Por último, cabe resaltar que en la actualidad se está desarrollando el estudio multicéntrico European Polyp Surveillance (EPoS), prometedor, que se compone de 3 ensayos clínicos controlados y aleatorizados que evalúan la incidencia de CCR a los 10 años en diferentes brazos de seguimiento en pacientes con adenomas de bajo y alto riesgo; en este último grupo, se aleatorizan 1:1 los pacientes a 3 y 5 años, frente a 5 años de intervalo de vigilancia11. Por el momento no se dispone de resultados, si bien aportarán mayor evidencia científica para poder establecer de manera más adecuada los intervalos de seguimiento.
| Antes de realizar recomendaciones de vigilancia debe comprobarse que la colonoscopia basal se ha realizado en condiciones de alta calidad: exploración completa con inspección cuidadosa de la mucosa, limpieza colónica adecuada y extirpación completa de los pólipos. |
| Los pacientes con 1-2 lesiones adenomatosas tubulares con DBG y un tamaño<10mm no requieren vigilancia endoscópica. Se les debe reincorporar al programa de cribado poblacional, preferentemente a los 10 años, o indicar una colonoscopia a los 10 años en caso de que no haya programa poblacional de cribado de CCR. Calidad de la evidencia moderada, nivel de recomendación fuerte a favor. |
| Los pacientes con lesiones serradas sin displasia<10mm no requieren vigilancia endoscópica, independientemente del número de lesiones. Se les debe reincorporar al programa de cribado poblacional, preferentemente a los 10 años, o indicar una colonoscopia a los 10 años en caso de que no haya programa poblacional de cribado de CCR. Calidad de la evidencia baja, nivel de recomendación fuerte a favor. |
| Los pacientes con pólipos hiperplásicos en recto-sigma<10mm no requieren vigilancia endoscópica. A los 10 años, se les debe reincorporar al programa de cribado poblacional o indicar una colonoscopia en dicho intervalo en caso de que no haya programa poblacional de cribado de CCR. Calidad de la evidencia baja, nivel de recomendación fuerte a favor. |
| Los pacientes con 3 o más lesiones adenomatosas tubulares con DBG<10mm o al menos una lesión adenomatosa vellosa, con DAG o tamaño≥10mm deben realizar la primera vigilancia endoscópica a los 3 años. Calidad de la evidencia moderada, nivel de recomendación débil a favor. |
| Los pacientes con al menos una lesión neoplásica serrada con displasia o tamaño≥10mm deben realizar la primera vigilancia endoscópica a los 3 años. Calidad de la evidencia baja, nivel de recomendación fuerte a favor. |
| En pacientes con 5 o más adenomas o algún adenoma≥20mm, que constituyen el grupo de alto riesgo de la guía europea42, en el momento actual no hay evidencias ni a favor ni en contra de acortar el intervalo de seguimiento a un año. Calidad de la evidencia baja, nivel de recomendación débil a favor. |
Las recomendaciones de vigilancia se dan siempre tras la resección completa de lesiones halladas en la colonoscopia basal. Si esta resección completa no se consigue en una sola colonoscopia, debe repetirse hasta conseguir el objetivo de dejar el colon completamente explorado y libre de lesiones neoplásicas. Factores como una colonoscopia incompleta16 o la resección incompleta de lesiones se asocian a cáncer de intervalo y a una mayor incidencia de CCR47,48.
Resección fragmentadaLa resección fragmentada de pólipos se relaciona en ocasiones con una resección incompleta, especialmente cuando la lesión es sésil o plana y mide≥20mm49. La tasa de recidiva a los 3-6 meses en lesiones no pediculadas>20mm puede ser de hasta el 32%50, y en un estudio retrospectivo publicado en 201651, en el que se evaluó la resección endoscópica de este tipo de lesiones, se observó que la extirpación fragmentada incrementa el riesgo de tejido residual sobre la cicatriz pospolipectomía. Por ello, ante la posibilidad de incrementar el riesgo de recidiva y CCR de intervalo52, se recomienda realizar una revisión endoscópica en un plazo de 6 meses de la colonoscopia basal en caso de resección fragmentada de lesiones≥20mm, incluso aunque se haya realizado una resección completa, así como la toma de biopsias de la cicatriz de polipectomía50,53,54. En estos casos el riesgo de recidiva sigue siendo considerable53, por lo que se recomienda, una vez comprobada la ausencia de tejido adenomatoso en la cicatriz, realizar la primera colonoscopia de vigilancia al año de la revisión de la escara.
Lesiones resecadas no recuperadasSe recomienda la recuperación de todas las lesiones resecadas. No obstante, en ocasiones no es posible debido a diversas circunstancias55. En estos casos, puesto que no se puede conocer la histología de las lesiones resecadas y no recuperadas, se considerarán como avanzadas aquellas lesiones≥10mm y como no avanzadas aquellas<10mm. Para la evaluación del riesgo y establecer la recomendación de vigilancia, estas lesiones se sumarán a las recuperadas.
Tatuaje de lesionesTras la resección de las lesiones con sospecha de cáncer invasivo o dificultad para la localización en sucesivas exploraciones endoscópicas, se recomienda realizar un tatuaje adyacente a la lesión (inyección de un marcador de carbono líquido biocompatible), para facilitar la identificación de la ubicación de la lesión con vistas a un seguimiento o a una cirugía posterior, excepto si la lesión se localiza en el ciego, adyacente a la válvula ileocecal o en el recto bajo56.
Situaciones de riesgo especialDerivación a consultas de alto riesgo o de prevención del cáncer colorrectal- •
≥10 adenomas. Una proporción no definida de pacientes con 10 o más adenomas presentan síndromes de cáncer hereditario57 y, por tanto, estos casos deben tratarse de forma individualizada. En estos pacientes debe considerarse repetir la colonoscopia de forma precoz y valorar la conveniencia del consejo genético. Por ello, deben ser evaluados en una consulta de alto riesgo (CAR)58 o en una consulta especializada de gastroenterología si no estuviese disponible una CAR.
- •
≥5 pólipos serrados o≥2 pólipos serrados de≥10mm proximales al sigma o≥10 pólipos con≥50% de pólipos serrados. Una proporción de estos pacientes serán diagnosticados de síndrome de poliposis serrada (SPS) en sucesivas colonoscopias59. Respecto a los pacientes con pólipos serrados múltiples, se ha visto que tanto ellos como sus familiares presentan un riesgo elevado de desarrollar CCR60. Por este motivo, también deben ser evaluados y seguidos de forma individualizada en una CAR.
- •
Criterios de SPS. Los pacientes que cumplen criterios de SPS tienen un riesgo elevado de presentar CCR61 y deben también ser evaluados y seguidos en una CAR.
| Las recomendaciones de vigilancia se dan siempre tras la resección completa de lesiones halladas en la colonoscopia basal. |
| Cuando la resección es incompleta se debe repetir la colonoscopia hasta conseguir el objetivo de dejar el colon completamente explorado y libre de lesiones neoplásicas. Calidad de la evidencia baja, nivel de recomendación fuerte a favor. |
| En las lesiones sésiles o planas de gran tamaño (≥20mm) y resecadas de forma fragmentada se debe realizar una revisión endoscópica de la cicatriz en un plazo de 6 meses desde la colonoscopia basal. Calidad de la evidencia alta, nivel de recomendación fuerte a favor. |
| En las lesiones sésiles o planas de gran tamaño (≥20mm) y resecadas de forma fragmentada se debe realizar una primera vigilancia endoscópica al año de confirmar la resección completa. Calidad de la evidencia alta, nivel de recomendación fuerte a favor. |
| Se recomienda la recuperación de todas las lesiones resecadas. |
| Las lesiones≥10mm resecadas y no recuperadas se considerarán como avanzadas y las lesiones de<10mm, como no avanzadas. No se tendrán en consideración las lesiones resecadas no recuperadas<10mm en el recto-sigma. |
| Para establecer la recomendación de vigilancia, las lesiones avanzadas y no avanzadas no recuperadas se sumarán a las recuperadas. |
| Tras la resección de lesiones con sospecha de cáncer invasivo o con dificultad para la localización posterior se debe realizar tatuaje de la lesión. Calidad de la evidencia baja, nivel de recomendación fuerte a favor. |
| Los individuos con riesgo elevado de CCR (≥10 adenomas; ≥5 pólipos serrados proximales; ≥2 pólipos serrados≥10mm; ≥10 pólipos con≥50% de pólipos serrados o con criterios de SPS) requieren un estudio individualizado y han de derivarse a una CAR específica o a una consulta especializada de gastroenterología. |
Algunos estudios observacionales40,62–64 han evaluado el riesgo de neoplasia avanzada metacrona en la segunda colonoscopia de vigilancia basándose en los hallazgos de la primera vigilancia, si bien la evidencia disponible es limitada. Asimismo, apenas existen estudios al respecto tras 2 colonoscopias de vigilancia normales. En todos estos estudios se ha observado que los hallazgos en la segunda colonoscopia de vigilancia dependen más de lo encontrado en la primera vigilancia que de los hallazgos de la colonoscopia basal40,62–64. No obstante, puesto que en pacientes con lesiones avanzadas basales el riesgo de lesión colorrectal avanzada en la segunda colonoscopia es de alrededor del 10%, aun en el caso de encontrar lesiones de bajo riesgo, recomendamos una segunda vigilancia con colonoscopia a los 5 años en el caso de no encontrar lesiones que requieran vigilancia en la primera colonoscopia o a los 3 años en el caso de encontrarlas. Aunque no hay evidencias al respecto, parece razonable que tras 2 colonoscopias de vigilancia normales o con lesiones que no requieran vigilancia, el paciente vuelva al programa de cribado a los 10 años.
Cese de la vigilanciaSe puede establecer que el beneficio de esta actividad para los individuos sanos a partir de una determinada edad puede estar limitado por la comorbilidad, la esperanza de vida del paciente o los riesgos y complicaciones de un procedimiento invasivo. El riesgo de desarrollo de CCR sin seguimiento en una cohorte de pacientes con adenomas de riesgo medio (1-2 adenomas≥10mm o 3-4 adenomas<10mm) durante un periodo medio de 7,8 años es del 3,3%16. Por lo tanto, el beneficio de la vigilancia cuando la esperanza de vida es inferior a los 10 años es dudoso. Como ejemplo, el riesgo de muerte en nuestro país a los 75 años es del 21,03‰ y a los 80 años, del 36,9‰65. Por lo tanto, parece difícil que la vigilancia endoscópica tenga algún efecto y, en este sentido, se recomienda que en aquellos pacientes candidatos a vigilancia endoscópica se finalice dicha vigilancia a los 75 años o, excepcionalmente, a los 80 años en pacientes seleccionados sin comorbilidades.
Adecuación de la vigilancia endoscópicaExiste una elevada tasa de inadecuación de la vigilancia pospolipectomía1,66, así como de falta de cumplimiento de las guías67,68. Para asegurar la adecuación y la realización de la vigilancia endoscópica, se recomienda establecer estrategias dentro de los programas poblacionales de cribado de CCR1. Si no es posible, se aconseja establecer sistemas de recordatorio dirigidos al paciente o al médico de atención primaria. Fuera del programa de cribado, se deben aplicar medidas que incentiven la utilización de las recomendaciones de seguimiento de los pólipos de colon.
Aparición de nuevos síntomasLas recomendaciones de vigilancia se realizan en individuos asintomáticos. La aparición de síntomas en un individuo al que se le han extirpado pólipos de colon hace que deban ser evaluados en el contexto adecuado y deben indicarse las exploraciones pertinentes para su estudio.
| Los intervalos de vigilancia endoscópica se establecerán en función de los hallazgos en la última colonoscopia. |
| En los pacientes con lesiones avanzadas en la colonoscopia de vigilancia se debe realizar el siguiente control endoscópico a los 3 años. Calidad de la evidencia moderada, nivel de recomendación débil a favor. |
| En los pacientes sin lesiones avanzadas en la colonoscopia de vigilancia se debe realizar el siguiente control endoscópico a los 5 años. Calidad de la evidencia baja, nivel de recomendación débil a favor. |
| Tras 2 colonoscopias de vigilancia sin lesiones colorrectales avanzadas, se debe reincorporar a los pacientes a los programas poblacionales de cribado de CCR o indicar una colonoscopia en 10 años en caso de que no haya programa poblacional de cribado de CCR. Calidad de la evidencia baja, nivel de recomendación débil a favor. |
| Se aconseja integrar las estrategias de vigilancia dentro de los programas de cribado poblacional de CCR. |
| Los pacientes a los que se les han extirpado pólipos del colon y que consultan por síntomas requieren ser evaluados cuidadosamente en el contexto clínico. |
| Se debe finalizar la vigilancia endoscópica para el CCR en adultos de más de 75 años o excepcionalmente a los 80 años en pacientes seleccionados sin comorbilidades. Calidad de la evidencia baja, nivel de recomendación débil a favor. |
Se considera cáncer invasivo pT1 cuando sobrepasa la muscularis mucosae y se extiende a la submucosa sin alcanzar la muscular propia69. Una vez que se ha realizado una resección endoscópica completa de la lesión que permita la valoración de los bordes, existe un riesgo de infiltración de los ganglios locorregionales que se sitúa en el 6,8-17,8% de los casos70,71. Varios metaanálisis han evaluado qué criterios histológicos se asocian y han determinado que el grado de diferenciación, la invasión linfática o vascular, la presencia de budding (nidos tumorales) y el grado de infiltración de la submucosa son factores predictores de infiltración de las adenopatías de forma independiente72–76. En las lesiones pT1, el riesgo de invasión linfática cuando no se cumplen los criterios referidos es del 1,9%. A la hora de tomar decisiones se tiene que equilibrar este riesgo con el de la mortalidad asociada a la intervención quirúrgica, que se sitúa en el 0,5%. Esto implica que, si se cumplen los criterios de buen pronóstico (tabla 4), el número necesario a intervenir para prevenir una muerte por CCR es de 208, por lo que el beneficio de una intervención quirúrgica es residual77. En cambio, cuando no se cumple alguno de los criterios antes referidos, el riesgo de enfermedad residual o afectación linfática se incrementa. Por este motivo, se recomienda que los pacientes con CCR pT1 resecados endoscópicamente sean evaluados en las CAR o en consultas especializadas de gastroenterología y que la toma de decisiones se realice finalmente en comités multidisciplinares.
Criterios histológicos de buen pronóstico en adenocarcinomas sobre pólipos con invasión de la submucosa
| Extirpación en bloque |
| Grado de diferenciación: bueno/moderado |
| Ausencia de invasión linfática o vascular |
| Distancia al margen de resección a≥1mm del carcinoma |
| Ausencia de budding (nidos tumorales) |
| Grado de infiltración de la submucosa En pólipos planos y sésiles, infiltración de la submucosa≤1.000μm (1mm) En pólipos pediculados, clasificación de Haggitt 1 o 267 o con infiltración de la submucosa<3mm |
Fuente: Elaboración propia de los autores.
Los objetivos de completar el estudio del colon de forma perioperatoria son tanto detectar lesiones síncronas como resecar lesiones precancerosas, ya que se estima que en los pacientes con CCR la prevalencia de un cáncer sincrónico oscila entre el 0,7 y el 7%78–80. Se recomienda, por tanto, que en aquellas situaciones en las que la colonoscopia haya sido incompleta por la presencia de un tumor estenosante, mala preparación o resección incompleta de las lesiones neoplásicas visualizadas en la exploración basal (no incluidas en la pieza quirúrgica o sin resección previa a la cirugía), la exploración del colon se complete preferentemente de forma preoperatoria o, si no fuera posible, postoperatoria en un plazo de 3 a 6 meses, con el fin de tener un margen de seguridad tras la intervención. De todos modos, no se recomienda realizar el estudio endoscópico de forma intraoperatoria81. Cabe destacar que la colonoscopia ha de cumplir los criterios de calidad estándar aplicados al resto de los procedimientos endoscópicos. En los casos de neoplasia estenosante, podremos recurrir también a la colonoscopia por tomografía computarizada de forma preoperatoria82.
Colonoscopia de vigilanciaLas colonoscopias de vigilancia tras la resección de un CCR con intención curativa tienen como objetivo tanto la detección de nuevas lesiones precancerosas y de CCR como de recidivas. La evidencia disponible para establecer los intervalos de vigilancia es escasa y no se basa en ensayos clínicos aleatorizados, pero existen algunos estudios que evalúan el riesgo de lesiones metacronas en la vigilancia.
Diferentes estudios estiman que entre el 1,5-3% de los pacientes desarrollan lesiones metacronas en los 3-5 primeros años tras la resección inicial73,74. Asimismo, algunos estudios observacionales79,83 han analizado la incidencia de CCR metacrónico en estos pacientes y han observado que en los primeros años tras la intervención quirúrgica la incidencia de CCR es elevada. Todo ello puede ser debido a que en la colonoscopia basal no se detectaron lesiones neoplásicas ya existentes, aspecto que resalta la importancia tanto de la calidad de la colonoscopia basal como el hecho de completar el estudio perioperatorio de posibles lesiones síncronas. Por otra parte, se estima que el 80% de las recidivas son detectadas en los 2,5 primeros años84,85. Por todo ello, se establece la recomendación de la primera colonoscopia de vigilancia al año (fig. 1), intervalo que además es clínicamente eficiente y una estrategia coste-efectiva en términos de detección de cáncer y prevención de muertes por cáncer, como ha demostrado el estudio de coste-efectividad de Hassan et al.86. Sin embargo, tras el primer intervalo de vigilancia, la evidencia disponible para establecer los siguientes periodos es débil y se basa fundamentalmente en las recomendaciones establecidas para otras lesiones avanzadas.
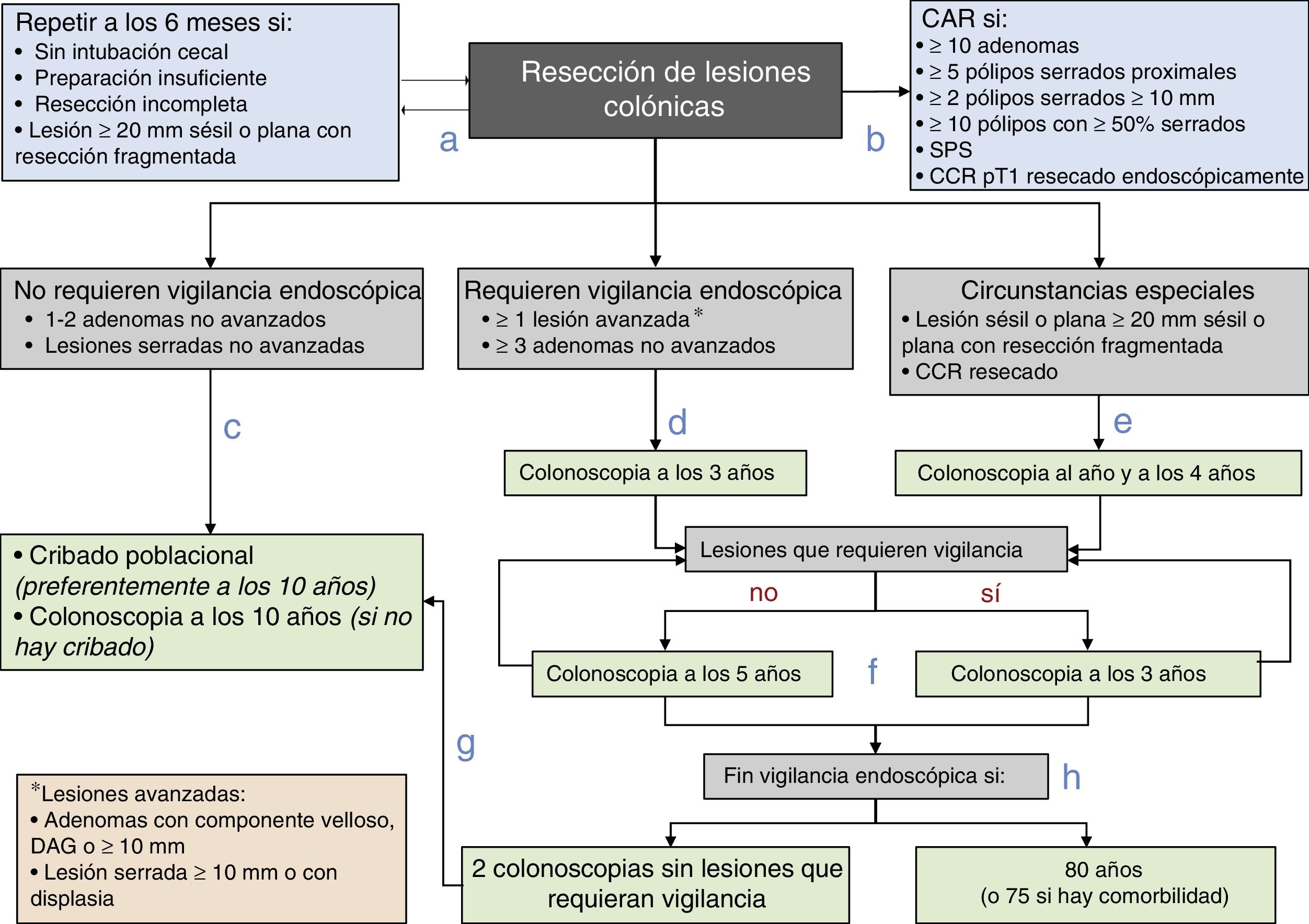
Diagrama de recomendaciones de vigilancia pospolipectomía de la Asociación Española de Gastroenterología, la Sociedad Española de Endoscopia Digestiva, la Sociedad Española de Medicina Familiar y Comunitaria y la Sociedad Española de Epidemiología.
CAR: consulta de alto riesgo; CCR: cáncer colorrectal; DAG: displasia de alto grado; SPS: síndrome de poliposis serrada.
Fuente: Elaboración propia de los autores.
El cáncer de recto merece una mención especial debido a su elevada probabilidad de recidiva local. En algunos estudios se ha observado que más del 80% de las recidivas en la anastomosis se dan en pacientes con cáncer de recto87–89, si bien esto depende a su vez de la estadificación preoperatoria, del tratamiento neoadyuvante y de la técnica quirúrgica. Asimismo, existe escasa evidencia respecto a los intervalos de vigilancia en estos pacientes.
Por todo ello, en aquellos pacientes tratados con cirugía rectal con escisión total del mesorrecto asociado, si lo precisa, a tratamiento neoadyuvante, no se recomienda una vigilancia específica del recto, ya que la probabilidad de recidiva es muy baja. Por el contrario, en aquellos pacientes sin escisión total del mesorrecto sería adecuado realizar vigilancia endoscópica estrecha los 2 primeros años tras la resección mediante rectosigmoidoscopia o ecoendoscopia, sin existir datos a favor de una u otra técnica (fig. 1) ni existir evidencias claras sobre el beneficio de una estrategia en concreto. Finalmente, en aquellos que no han recibido neoadyuvancia, en función del estadio tumoral, se decidirá de forma individualizada la estrategia de vigilancia a seguir90–94.
| Los individuos con CCR pT1 resecado endoscópicamente han de derivarse a una CAR específica o a una consulta especializada de gastroenterología. |
| Los pacientes con adenocarcinoma sobre pólipo con invasión de la submucosa (pT1) no requieren resección quirúrgica si se cumplen todos los criterios de buen pronóstico (tabla 4). Calidad de la evidencia baja, nivel de recomendación fuerte a favor. |
| Si la colonoscopia basal ha sido incompleta, se recomienda realizar una colonoscopia preoperatoria o postoperatoria completa en un plazo de 3-6 meses tras la intervención quirúrgica. Si la colonografía por tomografía computarizada está disponible, se recomienda su realización antes de la intervención. Calidad de la evidencia baja, nivel de recomendación fuerte a favor. |
| Se recomienda realizar la primera colonoscopia de vigilancia al año de la intervención, 3 años después de esta primera revisión y posteriormente cada 5 años si las colonoscopias son normales o con lesiones no avanzadas. Calidad de la evidencia baja, nivel de recomendación fuerte a favor. |
| En el caso de detección de lesiones colorrectales metacronas se seguirán las mismas recomendaciones de vigilancia pospolipectomía expuestas anteriormente. Calidad de la evidencia baja, nivel de recomendación fuerte a favor. |
| En los pacientes con cáncer de recto sin escisión total del mesorrecto se recomienda vigilancia los 2 primeros años tras la resección, sin evidencias a favor de una estrategia en concreto. Calidad de la evidencia baja, nivel de recomendación débil a favor. |
- a.
Antes de establecer la estrategia de vigilancia, se debe completar la exploración basal dentro de los 6 meses posteriores si la colonoscopia es incompleta, la preparación es insuficiente, se han resecado de forma incompleta las lesiones o se ha realizado una resección fragmentada de una lesión sésil o plana con un diámetro igual o superior a 20mm.
- b.
Los pacientes se remitirán a una CAR para completar la evaluación si cumplen alguna de las siguientes características: ≥10 adenomas, ≥5 pólipos serrados proximales, ≥2 pólipos serrados≥10mm, ≥10 pólipos con≥50% serrados, SPS o CCR pT1 resecado endoscópicamente.
- c.
A los pacientes con lesiones que no requieren vigilancia endoscópica (1-2 adenomas no avanzados y/o lesiones serradas no avanzadas) se les vigilará dentro del programa poblacional de cribado de CCR o se les realizará una colonoscopia a los 10 años si no estuviese disponible.
- d.
A los pacientes con lesiones que requieren vigilancia endoscópica (al menos una lesión avanzada o más de 2 adenomas no avanzados) se les recomendará realizar la vigilancia endoscópica a los 3 años de la exploración basal.
- e.
Se recomendará realizar la vigilancia endoscópica al año y a los 4 años de la confirmación de la resección completa de una lesión sésil o plana resecada de forma fragmentada inicialmente o tras la resección de un CCR.
- f.
El intervalo de vigilancia posterior se establecerá en función de las lesiones detectadas: 3 años si se detectan lesiones que requieran vigilancia endoscópica y 5 años si no se detectan.
- g.
Los pacientes se reincorporarán al programa poblacional de cribado de CCR si en 2 colonoscopias consecutivas no se detectan lesiones que requieran vigilancia.
- h.
Se finalizará la vigilancia endoscópica si el paciente tiene 80 años (o 75 años con comorbilidad asociada).
Este documento de consenso presenta importantes novedades respecto a la edición previa de la guía de práctica clínica de 2009. En primer lugar, establece situaciones que requieren y que no requieren vigilancia endoscópica y elimina la necesidad de realizar seguimiento en individuos que no presentan un riesgo especial de cáncer de colon metacrono. Estos individuos suponen una proporción elevada de pacientes a los que actualmente todavía se indica vigilancia pospolipectomía, y para estos se establece un comportamiento igual al que se adoptaría si la colonoscopia hubiese resultado normal, puesto que su riesgo es similar al de aquellos individuos con colonoscopia normal. En segundo lugar, se establecen recomendaciones de vigilancia endoscópica en individuos con pólipos serrados, determinando, con base en las escasas evidencias disponibles, qué pacientes a los que se les extirpan pólipos serrados deben ser vigilados. Finalmente, a diferencia de la edición anterior, se dan recomendaciones de vigilancia endoscópica en individuos intervenidos por cáncer colorrectal.
Estas recomendaciones también suponen un avance sobre la guía europea de calidad en el cribado del CCR12, que son las recomendaciones actualmente aceptadas y aplicadas por la mayoría de los programas de cribado del CCR en nuestro país. Los principales avances son, por un lado, la eliminación de la división entre grupo de riesgo medio y grupo de riesgo alto, lo que supone la supresión de una proporción considerable de colonoscopias de vigilancia precoz. Esta recomendación carece de demasiadas evidencias a su favor y resultados recientes, algunos generados en nuestro país, parecen desaconsejarla. Por otra parte, se dan recomendaciones claras sobre la ausencia de necesidad de seguimiento en el grupo de riesgo bajo, para el que la guía europea mantenía cierta ambigüedad.
Finalmente, es importante mencionar que este documento nace del consenso de las principales sociedades científicas involucradas en el manejo de estos pacientes, como son el campo de la gastroenterología y la endoscopia digestiva, la atención primaria y la salud pública con los programas de cribado del CCR. En estas recomendaciones se actualizan las evidencias disponibles en el momento actual y se espera ofrecer racionalidad en una de las principales indicaciones de la colonoscopia en nuestro medio. Es necesario generar nuevas evidencias que racionalicen el empleo de un recurso tan valioso como la endoscopia en esta indicación, en especial en el conocimiento de cuáles son los intervalos de vigilancia endoscópica más adecuados en las diferentes situaciones, cuáles son las situaciones de riesgo real tras la extirpación de pólipos de colon, así como en el potencial uso de marcadores moleculares que puedan ir más allá del tamaño y el número en la estratificación del riesgo de cáncer tras la resección de neoplasias colónicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.