Los pacientes de cirugía cardiovascular (CCV) presentan una alta incidencia de anemia perioperatoria y de sangrado que determina una elevada tasa de la transfusión de sangre alogénica (TSA). Esto se asocia a un aumento de la morbimortalidad y prolonga la estancia hospitalaria. La transfusión no necesaria es una medida a evitar y los programas de optimización de transfusión sanguínea o Patient Blood Management (PBM) han demostrado su eficacia.
Nuestro objetivo fue disminuir la transfusión de los pacientes en cirugía cardiaca, sin inferioridad de resultados en la morbimortalidad, la estancia hospitalaria y ajustando los costes mediante la implementación de un programa de PBM.
Material y métodosEstudio de cohortes mixto de 226 pacientes divididos en dos grupos: pre-PBM (GP), retrospectivo del año 2016, y grupo intervención (GI), prospectivo del año 2018, con los resultados de la implementación de la guía.
ResultadosLos resultados clínicos obtenidos permitieron reducir la TSA del 92,59% al 79,69% (p<0,001), ahorrando 2,59 unidades de concentrados de hematíes (CH) y 2,5 de plasma (PFC) por paciente (p<0,001). Se encontró descenso de pacientes con fiebre (12,35% vs 1,56%, p=0,006) y de la necesidad de escalar antibióticos (64,8% vs 42,19%, p=0,002). El resto de complicaciones postoperatorias y la mortalidad a los 3meses no presentaron diferencias estadísticamente significativas. La estancia hospitalaria se redujo 3,6días de media en el GI (IC95%: −8,10 a 0,9, p=0,18). El gasto descendió en 163,29€ por paciente teniendo en cuenta exclusivamente el ahorro de hemocomponentes.
ConclusiónEl programa del PBM es efectivo para disminuir la TSA en cirugía cardiaca en un hospital terciario con pacientes complejos y con alta tasa de transfusión. Se observan signos sugestivos de descenso en infecciones y una tendencia a disminuir los días de ingreso y la mortalidad. En la aproximación económica realizada, el coste de la intervención fue menor que el ahorro que implicó el descenso de la transfusión.
Cardiovascular surgery (CCV) patients have a high incidence of perioperative anemia and bleeding that determines a high rate of allogeneic blood transfusion (AST). This is associated with an increase in morbidity, mortality and prolongs length of stay in hospital. Unnecessary transfusion is one of the measures to avoid and Patient Blood Management (PBM) programs have proven their effectiveness.
Our objective was to reduce the transfusion of patients in cardiac surgery, without inferior results in morbidity and mortality, length of stay in hospital and being cost-effective, through the implementation of a PBM program.
Material and methodsA mixed cohort study of 226 patients divided into 2 groups: retrospective pre-PBM (GP), from 2016, and intervention group (IG), prospective from 2018, with the results of the implementation of the guide.
ResultsThe clinical results obtained allowed reducing the TSA from 92.59% to 79.69% (P<.001), saving 2.59 units of CH and 2.5 of PFC per patient (P<.001). A decrease was found in patients with fever (12.35% vs 1.56% with P=.006) and the need to escalate antibiotics (64.8% vs 42.19%, P=.002). The rest of postoperative complications and mortality at 3months did not present statistically significant differences. The length of stay was reduced by an average 3.6days in the IG, (95%CI: −8.10 to 0.9, P=.18). The cost decreased by 163.29€ per patient, taking into account exclusively the saving of blood components.
ConclusionThe PBM program is effective in reducing TSA in cardiac surgery in a tertiary hospital with high complexity patients and high transfusion rate. There are signs suggestive of a decrease in infections and a tendency to decrease the length of stay and mortality. In the economic approximation carried out, the cost of the intervention was lower than the savings implied by the decrease in transfusion.
La mayor parte de los procedimientos en cirugía cardiovascular (CCV) tienen un alto riesgo de sangrado y alta tasa de transfusión de sangre alogénica (TSA). Esto se ha relacionado directamente con un aumento de complicaciones en el postoperatorio (insuficiencia renal, respiratoria, infecciones, daño cerebral, coronario, aumento de estancia hospitalaria…) y de la mortalidad1-3.
La anemia preoperatoria es el principal determinante de transfusión y es factor independiente de mal pronóstico4,5. La conjunción de anemia y politransfusión determinan peor pronóstico con aumento de la mortalidad6,7.
El movimiento Right Care es una iniciativa que promueve las prácticas clínicas adecuadas y eficientes. Se definió como la atención sanitaria que aporta más beneficios que efectos no deseados, teniendo en cuenta las circunstancias y los valores del paciente, y se sustenta en la mejor evidencia disponible y en estudios de coste-efectividad8. Se desarrolló en Estados Unidos y en el Reino Unido con guías clínicas del National Institute for Health and Clinical Excellence (NICE) donde se consideraron las «recomendaciones de no hacer»9. En España, la Sociedad Española de Medicina Interna, junto con el Ministerio de Sanidad y el Instituto Aragonés de Ciencias de la Salud, lideraron el «compromiso por la calidad» con 5 medidas de «no hacer» por parte de cada sociedad científica. Entre esas medidas se encontraban evitar la transfusión no necesaria y no programar para cirugía electiva a un paciente anémico10,11.
El desarrollo de programas multidisciplinares y multimodales de optimización de transfusiones sanguíneas, también conocidos como Patient Blood Management (PBM), ha conseguido disminuir la transfusión con mejores resultados en el pronóstico de los pacientes, manteniendo la seguridad y la eficiencia12,13. Se trata de un nuevo paradigma donde se desarrollan medidas para evitar la anemia y la transfusión no necesaria14.
En el año 2013 se inició en nuestro hospital un programa PBM en cirugía ortopédica. Tras su éxito, con el estímulo de mejorar la calidad asistencial, comenzó a aplicarse a todo paciente anémico propuesto para cirugía de alto riesgo de sangrado. Concienciados de su importancia en el pronóstico de nuestros pacientes, decidimos implementar un programa de PBM en CCV adaptado a nuestro entorno (tabla 1). Por ello se elaboró un programa de PBM en CCV abarcando sus tres pilares: promover la eritropoyesis, evitar las pérdidas sanguíneas y fomentar la tolerancia a la anemia15-17.
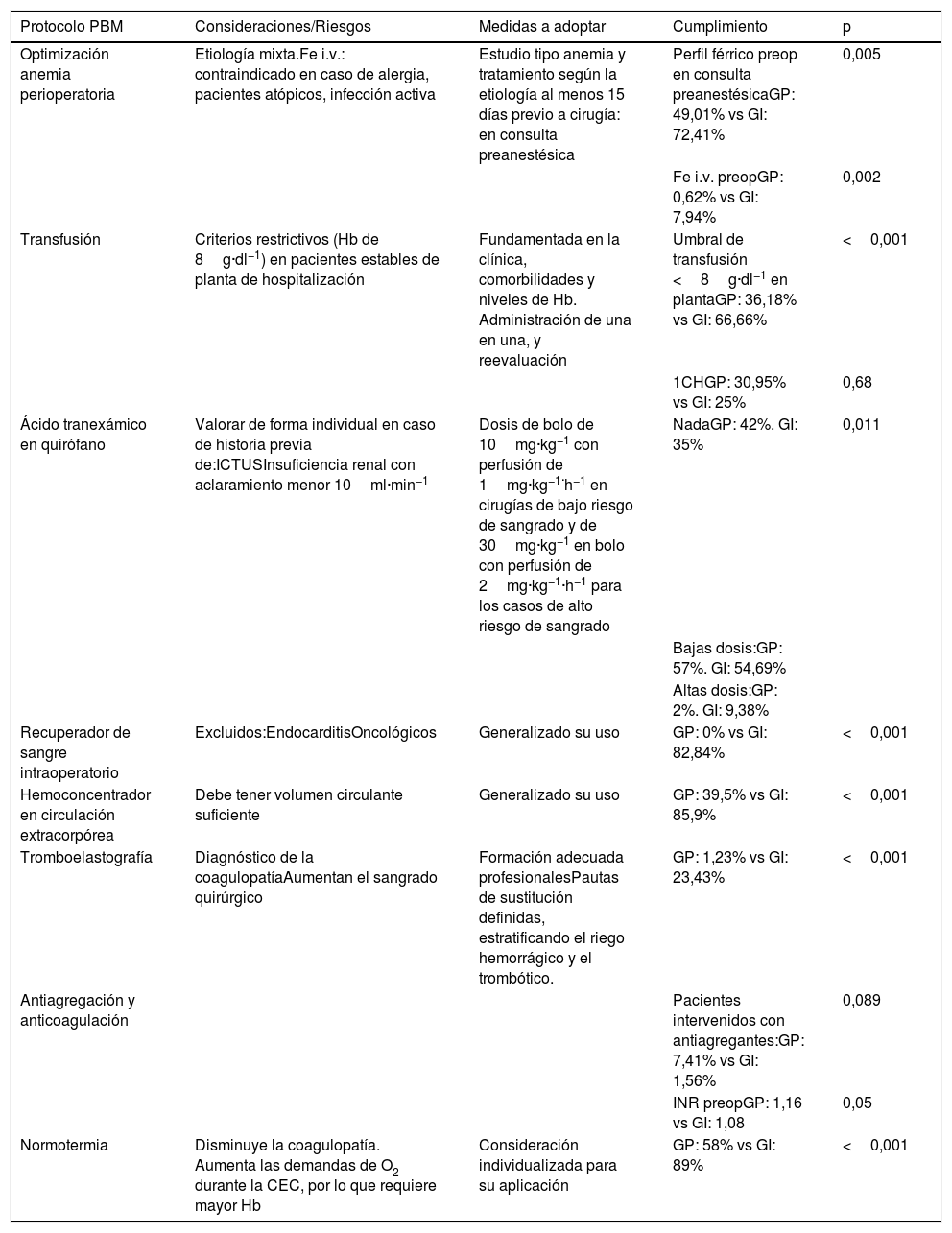
Protocolo de PBM en cirugía cardiaca
| Protocolo PBM | Consideraciones/Riesgos | Medidas a adoptar | Cumplimiento | p |
|---|---|---|---|---|
| Optimización anemia perioperatoria | Etiología mixta.Fe i.v.: contraindicado en caso de alergia, pacientes atópicos, infección activa | Estudio tipo anemia y tratamiento según la etiología al menos 15 días previo a cirugía: en consulta preanestésica | Perfil férrico preop en consulta preanestésicaGP: 49,01% vs GI: 72,41% | 0,005 |
| Fe i.v. preopGP: 0,62% vs GI: 7,94% | 0,002 | |||
| Transfusión | Criterios restrictivos (Hb de 8g·dl−1) en pacientes estables de planta de hospitalización | Fundamentada en la clínica, comorbilidades y niveles de Hb. Administración de una en una, y reevaluación | Umbral de transfusión <8g·dl−1 en plantaGP: 36,18% vs GI: 66,66% | <0,001 |
| 1CHGP: 30,95% vs GI: 25% | 0,68 | |||
| Ácido tranexámico en quirófano | Valorar de forma individual en caso de historia previa de:ICTUSInsuficiencia renal con aclaramiento menor 10ml·min−1 | Dosis de bolo de 10mg·kg−1 con perfusión de 1mg·kg−1·h−1 en cirugías de bajo riesgo de sangrado y de 30mg·kg−1 en bolo con perfusión de 2mg·kg−1·h−1 para los casos de alto riesgo de sangrado | NadaGP: 42%. GI: 35% | 0,011 |
| Bajas dosis:GP: 57%. GI: 54,69% | ||||
| Altas dosis:GP: 2%. GI: 9,38% | ||||
| Recuperador de sangre intraoperatorio | Excluidos:EndocarditisOncológicos | Generalizado su uso | GP: 0% vs GI: 82,84% | <0,001 |
| Hemoconcentrador en circulación extracorpórea | Debe tener volumen circulante suficiente | Generalizado su uso | GP: 39,5% vs GI: 85,9% | <0,001 |
| Tromboelastografía | Diagnóstico de la coagulopatíaAumentan el sangrado quirúrgico | Formación adecuada profesionalesPautas de sustitución definidas, estratificando el riego hemorrágico y el trombótico. | GP: 1,23% vs GI: 23,43% | <0,001 |
| Antiagregación y anticoagulación | Pacientes intervenidos con antiagregantes:GP: 7,41% vs GI: 1,56% | 0,089 | ||
| INR preopGP: 1,16 vs GI: 1,08 | 0,05 | |||
| Normotermia | Disminuye la coagulopatía. Aumenta las demandas de O2 durante la CEC, por lo que requiere mayor Hb | Consideración individualizada para su aplicación | GP: 58% vs GI: 89% | <0,001 |
CEC: circulación extracorpórea; Fe i.v.: hierro intravenoso; GI: grupo intervención; GP: grupo pre-intervención; Hb: hemoglobina; INR: international normalized ratio del tiempo de protrombina; PBM: Patient Blood Management; Preop: preoperatorio.
Este estudio tuvo como objetivo verificar el nivel de cumplimiento y eficacia de la implementación de un programa PBM en CCV para disminuir la transfusión, la estancia hospitalaria, sin inferioridad de resultados en la morbimortalidad y siendo coste-efectivos.
Material y métodosDiseño y tipo de estudioEstudio cuasi-experimental, con un grupo pre implantación del programa PBM (GP) retrospectivo y con otro grupo intervención (GI) prospectivo.
Criterios de inclusión y exclusiónSe incluyeron los pacientes mayores de 18años sometidos a CCV mayor. La cirugía de revascularización coronaria que no requirió circulación extracorpórea (CEC) fue incluida especificándose esta circunstancia.
Se rechazaron los pacientes sometidos a varias intervenciones en el mismo periodo, los que no completaron el postoperatorio en nuestro hospital por traslado a su centro de referencia y los que fallecieron en el quirófano.
Cronograma del estudioEl estudio se dividió en dos periodos. En el primer periodo se recogieron de forma retrospectiva los datos de los pacientes intervenidos de CCV (n=162) en el año 2016 (abril-julio) para analizar la actividad transfusional basal; constituyen el grupo pre-PBM (GP). En el segundo periodo se recogieron de manera prospectiva los pacientes intervenidos de CCV (n=64) aplicando la guía clínica intrahospitalaria desarrollada. Se realizó un seguimiento desde la intervención hasta el alta o el fallecimiento. Abarcó desde el 8 de junio de 2018 hasta el 30 de julio de 2018, y es el grupo intervención (GI).
Se desarrolló un programa de PBM con las nuevas medidas a implementar15-17 (tabla 1), consensuado con los distintos servicios implicados: Cirugía Cardiaca, Admisión, Dirección Médica, Enfermería y Anestesiología18.
Se estableció un circuito con los servicios de Cirugía Cardiaca y de Admisión con la solicitud de un estudio de anemias para valorarlo en la consulta de Anestesia. Se citaban de forma preferente y, si procedía, se trataba la anemia en el Hospital de Día Quirúrgico en el mismo día de la consulta preanestésica.
El protocolo de PBM se difundió mediante varias sesiones clínicas en el hospital convocando a todo el personal implicado: anestesistas, cirujanos cardiacos, servicio de Admisión, enfermería perfusionista y de quirófano, consulta, unidad de hospitalización de día y Cuidados Críticos. Se redactó un documento con las recomendaciones que se distribuyó entre el personal por correo electrónico y se dejó disponible en el área quirúrgica.
Muestras y pacientesSe recogieron las características de los grupos (tabla 2): datos demográficos, factores de riesgo de los pacientes y de las cirugías. También se registraron los datos de las medidas implementadas (tablas 1 y 3), los resultados en la transfusión, hemoglobina (Hb), sangrado, complicaciones cardiorrespiratorias, infecciosas, renales, neurológicas, la estancia hospitalaria y la mortalidad (tablas 4 y 5).
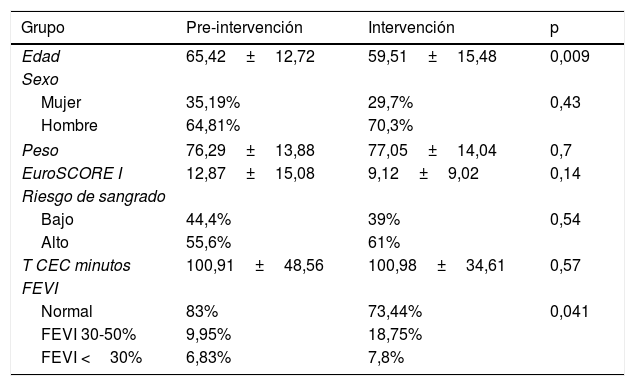
Características de las muestras
| Grupo | Pre-intervención | Intervención | p |
|---|---|---|---|
| Edad | 65,42±12,72 | 59,51±15,48 | 0,009 |
| Sexo | |||
| Mujer | 35,19% | 29,7% | 0,43 |
| Hombre | 64,81% | 70,3% | |
| Peso | 76,29±13,88 | 77,05±14,04 | 0,7 |
| EuroSCORE I | 12,87±15,08 | 9,12±9,02 | 0,14 |
| Riesgo de sangrado | |||
| Bajo | 44,4% | 39% | 0,54 |
| Alto | 55,6% | 61% | |
| T CEC minutos | 100,91±48,56 | 100,98±34,61 | 0,57 |
| FEVI | |||
| Normal | 83% | 73,44% | 0,041 |
| FEVI 30-50% | 9,95% | 18,75% | |
| FEVI <30% | 6,83% | 7,8% | |
EuroSCORE I: European System for Cardiac Operative Risk Evaluation; FEVI: fracción de eyección de ventrículo izquierdo; T CEC: tiempo de circulación extracorpórea.
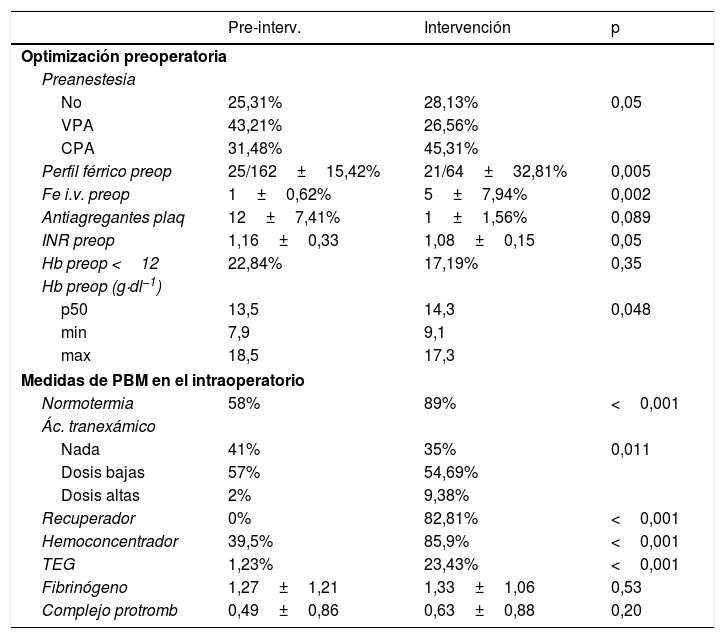
Medidas de PBM implementadas
| Pre-interv. | Intervención | p | |
|---|---|---|---|
| Optimización preoperatoria | |||
| Preanestesia | |||
| No | 25,31% | 28,13% | 0,05 |
| VPA | 43,21% | 26,56% | |
| CPA | 31,48% | 45,31% | |
| Perfil férrico preop | 25/162±15,42% | 21/64±32,81% | 0,005 |
| Fe i.v. preop | 1±0,62% | 5±7,94% | 0,002 |
| Antiagregantes plaq | 12±7,41% | 1±1,56% | 0,089 |
| INR preop | 1,16±0,33 | 1,08±0,15 | 0,05 |
| Hb preop <12 | 22,84% | 17,19% | 0,35 |
| Hb preop (g·dl−1) | |||
| p50 | 13,5 | 14,3 | 0,048 |
| min | 7,9 | 9,1 | |
| max | 18,5 | 17,3 | |
| Medidas de PBM en el intraoperatorio | |||
| Normotermia | 58% | 89% | <0,001 |
| Ác. tranexámico | |||
| Nada | 41% | 35% | 0,011 |
| Dosis bajas | 57% | 54,69% | |
| Dosis altas | 2% | 9,38% | |
| Recuperador | 0% | 82,81% | <0,001 |
| Hemoconcentrador | 39,5% | 85,9% | <0,001 |
| TEG | 1,23% | 23,43% | <0,001 |
| Fibrinógeno | 1,27±1,21 | 1,33±1,06 | 0,53 |
| Complejo protromb | 0,49±0,86 | 0,63±0,88 | 0,20 |
Ác. tranexámico: ácido tranexámico; Complejo protromb.: complejo protrombínico; CPA: consulta preanestésica realizada con antelación a la intervención; Hb preop: hemoglobina preoperatoria expresado en g·dl−1; Hb preop <12: hemoglobina preoperatoria menor de 12g·dl−1; Hemoconcentrador: hemoconcentrador de sangre en circulación extracorpórea; PBM: Patient Blood Management; Plaq: plaquetas; Pre-interv: grupo del periodo pre-intervención; Preop: preoperatorio; Recuperador: recuperador de sangre intraoperatoria; TEG: tromboelastograma; VPA: visita preanestésica realizada en planta pocos días antes de la intervención.
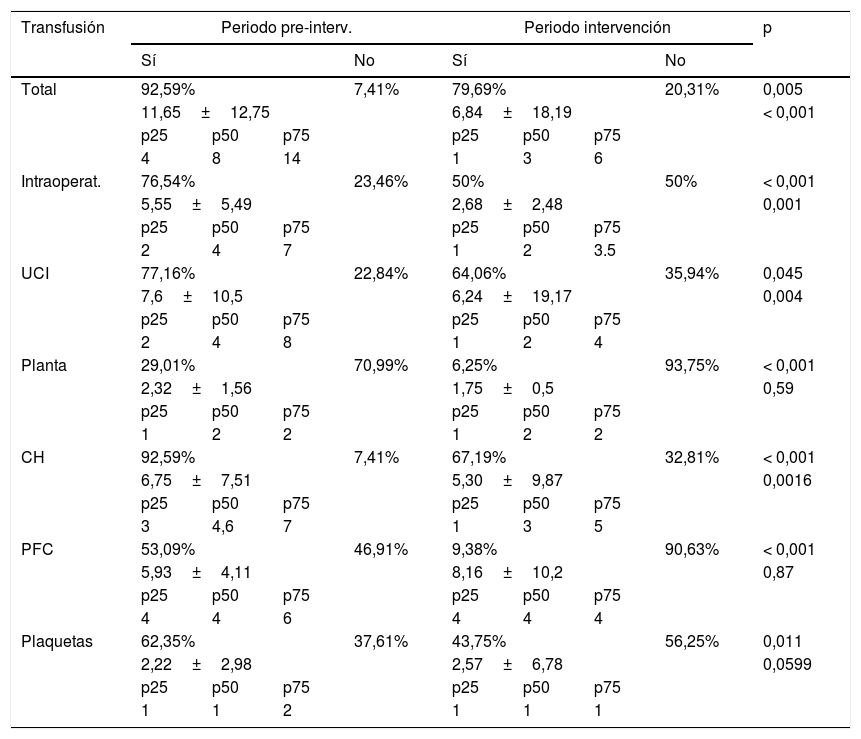
Resultados en la transfusión de sangre alogénica
| Transfusión | Periodo pre-interv. | Periodo intervención | p | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Sí | No | Sí | No | ||||||
| Total | 92,59% | 7,41% | 79,69% | 20,31% | 0,005 | ||||
| 11,65±12,75 | 6,84±18,19 | < 0,001 | |||||||
| p25 | p50 | p75 | p25 | p50 | p75 | ||||
| 4 | 8 | 14 | 1 | 3 | 6 | ||||
| Intraoperat. | 76,54% | 23,46% | 50% | 50% | < 0,001 | ||||
| 5,55±5,49 | 2,68±2,48 | 0,001 | |||||||
| p25 | p50 | p75 | p25 | p50 | p75 | ||||
| 2 | 4 | 7 | 1 | 2 | 3.5 | ||||
| UCI | 77,16% | 22,84% | 64,06% | 35,94% | 0,045 | ||||
| 7,6±10,5 | 6,24±19,17 | 0,004 | |||||||
| p25 | p50 | p75 | p25 | p50 | p75 | ||||
| 2 | 4 | 8 | 1 | 2 | 4 | ||||
| Planta | 29,01% | 70,99% | 6,25% | 93,75% | < 0,001 | ||||
| 2,32±1,56 | 1,75±0,5 | 0,59 | |||||||
| p25 | p50 | p75 | p25 | p50 | p75 | ||||
| 1 | 2 | 2 | 1 | 2 | 2 | ||||
| CH | 92,59% | 7,41% | 67,19% | 32,81% | < 0,001 | ||||
| 6,75±7,51 | 5,30±9,87 | 0,0016 | |||||||
| p25 | p50 | p75 | p25 | p50 | p75 | ||||
| 3 | 4,6 | 7 | 1 | 3 | 5 | ||||
| PFC | 53,09% | 46,91% | 9,38% | 90,63% | < 0,001 | ||||
| 5,93±4,11 | 8,16±10,2 | 0,87 | |||||||
| p25 | p50 | p75 | p25 | p50 | p75 | ||||
| 4 | 4 | 6 | 4 | 4 | 4 | ||||
| Plaquetas | 62,35% | 37,61% | 43,75% | 56,25% | 0,011 | ||||
| 2,22±2,98 | 2,57±6,78 | 0,0599 | |||||||
| p25 | p50 | p75 | p25 | p50 | p75 | ||||
| 1 | 1 | 2 | 1 | 1 | 1 | ||||
CH: concentrado de hematíes; Intraoperat: intraoperatorio; Periodo pre-interv.: periodo preintervención; p25: percentil 25; p50: percentil 50 o mediana; p75: percentil 75; PFC: plasma fresco congelado; UCI: unidad de cuidados intensivos.
Complicaciones
| GP | GI | p | |
|---|---|---|---|
| Sangrado y coagulación | |||
| Hb postQx (g·dl−1) | 9,97±1,37p50: 9,8 | 11,32±1,16p50: 11,25 | <0,01 |
| Hb 24 h(g·dl−1) | 9,4±1,16p50: 9,3 | 10,33±1,66p50: 10 | 0,002 |
| INR | 1,36±0,25 | 1,35±0,23 | 0,26 |
| Débito drenajes (ml) | 702,3±416p50: 610 | 514,84±290,2p50: 450 | 0,005 |
| Reintervención | 6,8% | 1,5% | 0,11 |
| Fe i.v. UCI | 0,6% | 14% | <0,001 |
| Hb al alta H (g·dl−1) | 10,14±1,03 | 10,15±1,22 | 0,9 |
| Cardiorrespiratorias | |||
| VM > 24 h | 25,47% | 23,44% | 0,75 |
| P/F < 250 | 27,33% | 35% | 0,2 |
| DVA > 24hs | 71% | 2,5% | 0,19 |
| PROBNP | 5.997,6±1.1477p50: 2.721 | 4.813,98±9.199,9p50: 2.158,5 | 0,1 |
| BCIAO | 10,6% | 0 | 0,03 |
| ECMO/Asistencia | 4,3% | 3,1% | 0,67 |
| Renal | |||
| I renal | 20,99% | 18,75% | 0,7 |
| Urea (mg·dl−1) | 50,075±23,8 p50: 47 | 50,45±23,06p50: 46 | 0,96 |
| Creatinina (mg·dl−1) | 0,93±0,79 | 0,78±0,69 | 0,6 |
| Infecciosa | |||
| Leucocitos | 12,21±4,85 | 12,64±3,9 | 0,12 |
| Fiebre | 12,35% | 1,56% | 0,006 |
| Procalcitonina | 4,15±13,1 | 2,28±4,99 | 0,24 |
| Cultivos+ | 15,4% | 14% | 0,46 |
| Antibiótico | 64,8% | 42,19% | 0,002 |
| Neurológicas | |||
| Convulsiones | 2,5% | 1,5% | 0,56 |
| Focalidad neurológica | 4,3% | 7,8% | 0,3 |
| Estancia hospitalaria | |||
| Días de ingreso en hospital | 15,61±16,5 | 11,6±8,51 | 0,035 |
| Coef −4,1 días, IC95 −8,44 a 0,4 días | 0,079 | ||
| Ajustado edad | Coef −3,6 días, IC95 −8,10 a 0,9 | 0,118 | |
| Días de ingreso en UCI | 6,76±10,03 | 5,16±6,38 | 0,116 |
| Mortalidad | |||
| 17 / 162 pac10,49% | 5/64 pac7,81% | 0,36 | |
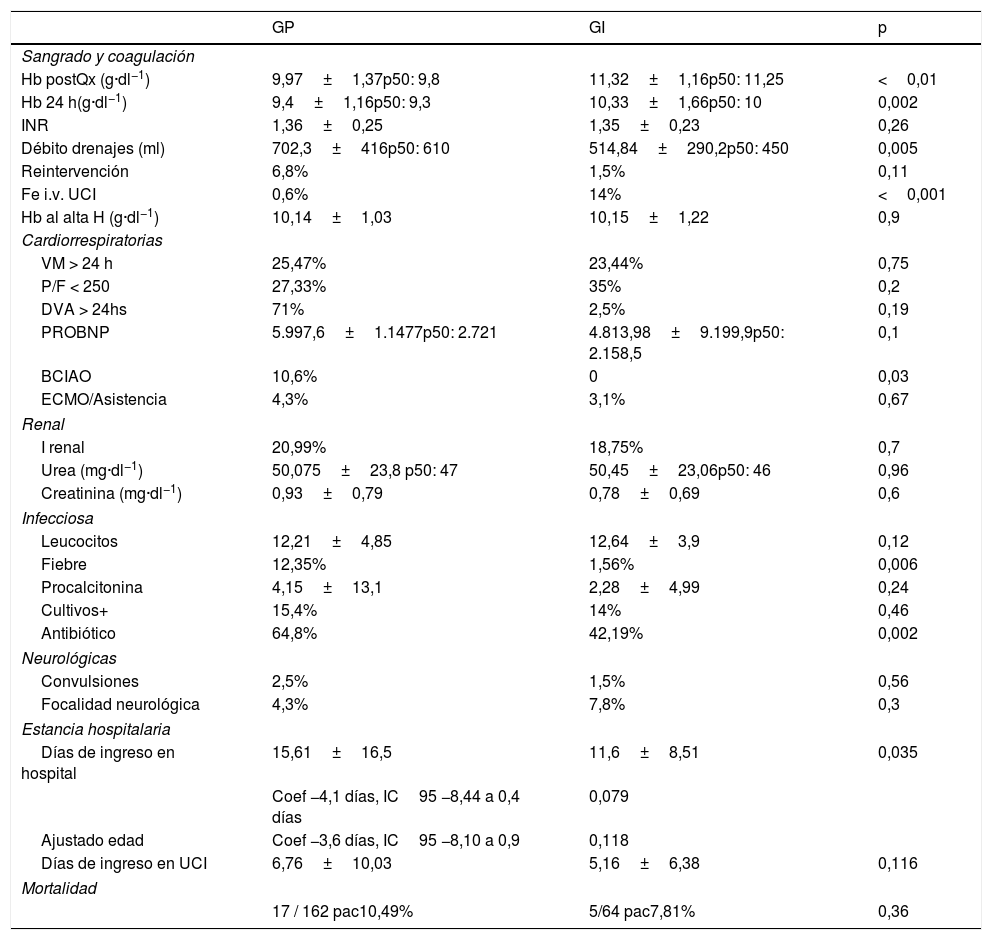
Drenajes: débito por los drenajes torácicos a las 24 h de la cirugía; Fe i.v. UCI: administración de hierro intravenoso en el postoperatorio; GI: grupo intervención; GP: Grupo pre-intervención de PBM; Hb al alta H: hemoglobina al alta del hospital; Hb postQx: hemoglobina posquirúrgica; Hb 24 h: hemoglobina a las 24 h de la cirugía, INR: international normalized ratio del tiempo de protrombina; Reintervención: la necesidad de reintervención por sangrado en las primeras 24 h tras la cirugía; VM > 24 h: requerimientos de ventilación mecánica más allá de las 24 h del postoperatorio.
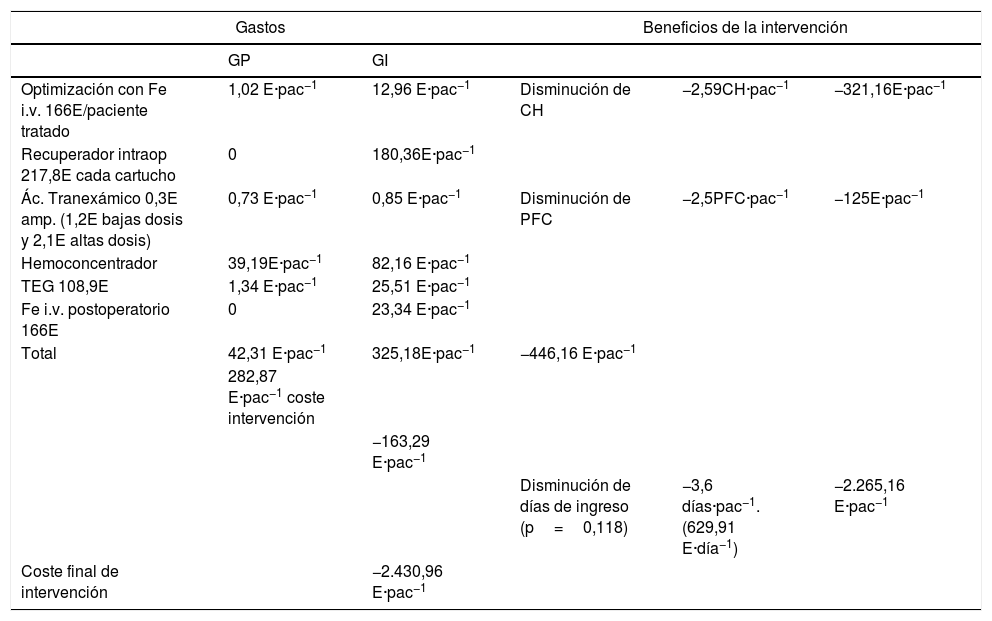
Se diseñó un análisis de minimización de costes. Se incluyó como coste de la implementación del PBM el incremento del gasto de cada medida del programa en función del uso dado. Ni el soporte del programa de PBM ni la consulta de anestesia y el hospital de día quirúrgico no se han considerado porque son recursos que ya existían para otras cirugías. También se disponía de recuperador de sangre intraoperatoria, hemoconcentrador (HC) en CEC o el tromboelastograma (TEG), cedidos por las casas comerciales a cambio de la compra de reactivos y fungibles (estos sí incluidos en el cálculo). La disminución de hemocomponentes constituyó el ahorro conseguido (tabla 6).
Aproximación económica
| Gastos | Beneficios de la intervención | ||||
|---|---|---|---|---|---|
| GP | GI | ||||
| Optimización con Fe i.v. 166E/paciente tratado | 1,02 E·pac−1 | 12,96 E·pac−1 | Disminución de CH | −2,59CH·pac−1 | −321,16E·pac−1 |
| Recuperador intraop 217,8E cada cartucho | 0 | 180,36E·pac−1 | |||
| Ác. Tranexámico 0,3E amp. (1,2E bajas dosis y 2,1E altas dosis) | 0,73 E·pac−1 | 0,85 E·pac−1 | Disminución de PFC | −2,5PFC·pac−1 | −125E·pac−1 |
| Hemoconcentrador | 39,19E·pac−1 | 82,16 E·pac−1 | |||
| TEG 108,9E | 1,34 E·pac−1 | 25,51 E·pac−1 | |||
| Fe i.v. postoperatorio 166E | 0 | 23,34 E·pac−1 | |||
| Total | 42,31 E·pac−1 | 325,18E·pac−1 | −446,16 E·pac−1 | ||
| 282,87 E·pac−1 coste intervención | |||||
| −163,29 E·pac−1 | |||||
| Disminución de días de ingreso (p=0,118) | −3,6 días·pac−1. (629,91 E·día−1) | −2.265,16 E·pac−1 | |||
| Coste final de intervención | −2.430,96 E·pac−1 | ||||
Ác. tranexámico: ácido tranexámico; amp: ampollas; CH: concentrado de hematíes; E: euros; Fe i.v.: hierro intravenoso; Intraop: intraoperatorio; pac: paciente; PFC: plasma fresco congelado; TEG: tromboelastograma.
El estudio fue realizado con la aprobación del Comité de Ética (Acta n.° 05.16, 30 de marzo del 2016) en el Hospital Universitario Puerta de Hierro Majadahonda (HUPHM), centro hospitalario de tercer nivel del Servicio Público de Salud de la Comunidad de Madrid, que cumple las normas éticas del Comité de Investigación y de la Declaración de Helsinki de 1975 con la revisión de octubre del 2013 (https://jamanetwork.com/journals/jama/fullarticle/1760318).
Análisis estadísticoSe realizó un análisis descriptivo de las variables categóricas mediante frecuencias absolutas y relativas, y en las variables numéricas mediante la media y desviación estándar o mediana y percentiles 25 y 75, valores mínimo y máximo, según cumplimiento de la asunción de normalidad. En las variables cualitativas se realizó test de Pearson chi-cuadrado o test exacto Fisher cuando la frecuencia esperada fuera menor de 5. En las variables cuantitativas se usó el test de U Mann-Whitney. Para la comparación entre ambos grupos en cuanto a número total de hemocomponentes ahorrados, concentrados de hematíes (CH), plasma fresco congelado (PFC) y plaquetas se realizaron modelos de regresión de Poisson, ajustando por la edad del paciente en cada caso. Se muestra la razón de incidencia (incidence rate ratio [IRR]) como medida de efecto, junto a sus correspondientes intervalos de confianza al 95%.
La estancia hospitalaria se analizó con una regresión lineal. Para la mortalidad se utilizó una regresión logística ajustada por edad.
El tamaño muestral se calculó con los datos recogidos de transfusión del año 2013, estimando qué número de pacientes necesitábamos para detectar una reducción en la tasa de transfusión del 10%. Para que los grupos fueran lo más parecidos posible, el GP lo constituyeron pacientes del 2016 inmediatamente antes del inicio del protocolo de PBM. Se requerían al menos 160 pacientes, lo que implicó un periodo de 4meses de pacientes consecutivos. Sin embargo, para el GI bastaban 63pacientes para obtener diferencias significativas en el descenso de la transfusión. Debido a que se tardó en la implementación total del programa, no se inició la recogida prospectiva del GI hasta el año 2018, aunque dentro del mismo periodo de los 4meses del año del GP.
El nivel de significación se fijó en 0,05. El paquete estadístico utilizado es Stata/IC v.16. (StataCorp. 2019. Stata Statistical Software: Release 16. College Station, TX: StataCorp LLC.)
ResultadosLa distribución por sexos fue 64,81% varones en el GP y 70,31% en el GI (p=0,43). No hubo diferencias estadísticamente significativas en el resto de los datos demográficos, excepto en la edad media de las muestras y la fracción de eyección del ventrículo izquierdo (FEVI) (tabla 2).
El protocolo PBM implementado tuvo un buen cumplimiento, ya que sus medidas presentaron un aumento de su uso con diferencias estadísticamente significativas (tablas 1 y 3). Especial seguimiento tuvieron el recuperador intraoperatorio y el HC (82,84 y 85,9%, respectivamente). El estudio y el tratamiento de la anemia preoperatoria mejoraron de manera significativa en pacientes vistos en consulta (tabla 1).
Se disminuyó de forma significativa la TSA: GP 92,59% vs GI 79,69% (OR: 0,31; IC95%: 0,13-0,73; p<0,001). Según los periodos, en el intraoperatorio la TSA varió del 76,54% en el GP al 50% en el GI (OR: 0,31; IC95%: 0,17-0,56; p<0,001), en la unidad de cuidados intensivos (UCI) del 77,16% en el GP al 64,06% en el GI (OR: 0,53; IC95%: 0,28-0,99; p=0,045) y en planta del 29,01% en el GP al 6,25% en el GI (OR: 0,16; IC95%: 0,06-0,47; p<0,001). Por hemocomponentes, se transfundieron CH en el 92,59% de los pacientes en el GP, mientras que fue del 67,19% en el GI (OR: 0,16; IC95%: 0,07-0,36; p<0,001); en PFC pasó del 53,09% en el GP al 9,38% en el GI (OR: 0,09; IC95%: 0,04-0,22; p<0,001) y en plaquetas del 62,35% en el GP al 43,75% en el GI (OR: 0,47; IC95%: 0,26-0,85; p=0,011) (tabla 4). Se calcularon el número de bolsas transfundidas en cada grupo ajustado por edad. En el GP fue de 6,21 de CH (IC95%: 5,8-6,6) mientras que en el GI es de 3,62 (IC95%: 3,1-4,1; p<0,001). La disminución fue de 2,59 bolsas de CH por paciente.
La tasa de transfusión de PFC fue en el GP de 3,22 (IC95%: 2,94-3,50) vs en el GI de 0,72 (IC95%: 0,52-0,93; p<0,001). La disminución fue de 2,5 bolsas de PFC por paciente.
En la tasa de transfusión de plaquetas no se obtuvieron diferencias estadísticamente significativas al ajustar por edad: GP 1,38 (IC95%: 1,20-1,56) vs GI 1,15 (IC95%: 0,88-1,42; p=0,182).
Al analizar exclusivamente los pacientes transfundidos (tabla 4) se observó una disminución de la tasa global de transfusión: GP 11,65±12,72 unidades de hemocomponentes, mientras GI 6,84±18 (p<0,001). En CH presentó el GP una media de 6,75±7,5 vs GI 5,3±9,8 (p=0,0016). Este descenso no se evidenció con los otros 2 hemocomponentes al valorase por separado (tabla 4).
Al estudiar la transfusión en los distintos periodos (tabla 4) se observó una mayor incidencia durante la estancia en UCI y menor en planta. El intraoperatorio fue el momento que más se benefició de las medidas adoptadas.
En cuanto a la anemia, hubo un aumento de la Hb preoperatoria (GP p50=13,5 vs GI p50=14,3; p=0,048), aunque no disminuyó de forma estadísticamente significativa el número de pacientes que llegaron a quirófano anémicos (tabla 3). También mejoraron los niveles de Hb en el postoperatorio inmediato (GP 9,97g·dl−1 vs GI 11,32g·dl−1; p<0,001) y a las 24h de la cirugía (GP 9,4g·dl−1 vs GI 10,33g·dl−1). A pesar del descenso de la transfusión, los pacientes se fueron al alta con los mismos niveles de Hb (10,15g·dl−1).
En las complicaciones postoperatorias (tabla 5) destacaron los resultados en sangrado y hemostasia. Los parámetros de coagulación no se vieron alterados. El débito por drenajes en las primeras 24h disminuyó de forma significativa (GP 700ml vs GI 500ml; p=0,005). En referencia a las complicaciones en las primeras 24h no hubo diferencias significativas a nivel cardiorrespiratorio, renal ni neurológico, aunque se observó una tendencia a disminuir el tiempo de administración de fármacos vasoactivos y del valor de proBNP, sin llegar a ser significativo. Sí hubo diferencias en la presencia de fiebre (GP 12,35% vs GI 1,56%; p=0,006) y en la necesidad de escalar antibioterapia a favor del GI (GP 64,8% vs GI 42,19%; p=0,002).
En el análisis de la estancia hospitalaria ajustado por la edad se encontró 3,6días menos de ingreso hospitalario en el GI (IC95%: −8,10 a 0,9; p=0,118).
No hubo inferioridad de resultados en el estudio de mortalidad en los 3 primeros meses (GP 10,49% vs GI 7,81%; p=0,36). Ajustada por la edad presentó un descenso del 2% (OR 0,98±0,54; IC95%: 0,33-2,89; p=0,97).
Por último, se realizó un análisis de costes (tabla 6). La implementación del programa supuso un gasto de 282,87€ por paciente. Por otro lado, se tenía la disminución de uso de hemocomponentes. En el BCM núm. 215 de 10 de septiembre de 2013 se estableció el coste de los CH en 124€ y del PFC en 50€ por unidad. Se calculó un ahorro en CH de 319,92€ por paciente y en PFC de125€ por paciente. Con las plaquetas no se obtuvieron diferencias estadísticamente significativas. Con todo, la intervención obtuvo una reducción del gasto de 163,29€ por paciente.
DiscusiónTras su implementación, se observó un cumplimiento generalizado de la guía PBM elaborada, donde todas las medidas aumentaron su uso de forma estadísticamente significativa. El recuperador intraoperatorio y el HC fueron las medidas con mayor seguimiento (tabla 1).
El primer pilar de actuación consistió en la detección y corrección de la anemia preoperatoria, con una incidencia en torno al 30% en los pacientes de CCV1,4. Sus causas son multifactoriales (hemodilución, estado inflamatorio, insuficiencia renal) y se produce anemia ferropénica, acrecentada por anemia de trastornos crónicos4,19. En nuestro estudio, el diagnóstico y la optimización de la anemia se realizó solo en los pacientes vistos en la consulta de preanestesia. La incidencia de anemia disminuyó del 22,84% del GP al 17,19% del GI, pero sin ser estadísticamente significativa. La anemia es más frecuente en pacientes que no son demorables para la optimización (insuficiencia cardiaca descompensada, urgencias…) y que pueden tener contraindicaciones para su tratamiento (infección por endocarditis). Sí aumentaron los valores de Hb preoperatoria con diferencias estadísticamente significativas, probablemente atribuible a los pacientes tratados con suficiente antelación en la consulta preanestésica.
El segundo pilar del PBM (reducción de las pérdidas sanguíneas) se desarrolló con la implementación de normotermia durante la CEC, uso de HC en CEC, recuperador intraoperatorio y corrección de la coagulopatía guiada por TEG.
La hipotermia (temperatura corporal menor de 34°C) es una medida utilizada durante la CEC para mejorar la protección cerebral, miocárdica y renal. En contrapartida, produce disfunción plaquetaria, de los factores de la coagulación y aumenta la fibrinólisis20,21. Actualmente la normotermia se está implantando en los programas de recuperación precoz en cirugía cardiaca por una disminución del uso de fármacos vasoactivos y del tiempo de ventilación mecánica22,23. Sin embargo, durante la CEC en normotermia se requiere un hematocrito más alto que en hipotermia debido a un mayor consumo de oxígeno. Como medida de PBM se consideró en pacientes con condiciones favorables: jóvenes, sin factores de riesgo de accidente cerebrovascular, con hematocrito alto en el preoperatorio y con tiempos cortos de CEC.
Para que la normotermia no repercuta en un aumento de la transfusión durante la CEC, una medida fundamental fue el uso del HC. De esta forma se disminuyó la hemodilución producida al entrar en bomba además de la respuesta inflamatoria24,25. Esto ha influido en el resultado de la Hb a la salida de quirófano, mayor en el GI 11,32g·dl−1 frente a GP 9,97g·dl−1 (p<0,001), incluso habiéndose transfundido menos en el intraoperatorio (GP 63,5%, 3,1 CH de media por paciente transfundido vs GI 28,1%, 2,6 CH de media por paciente; p<0,001).
El ácido tranexámico (ATx) también puede haber influido en este resultado con el aumento de su uso y sus dosis. El ATx disminuye la fibrinólisis durante la CEC y, por consiguiente, el sangrado20,26,27. Aunque ya se utilizaba antes de la implementación del protocolo PBM, se añadieron las dosis altas para los pacientes de alto riesgo de sangrado (30mg·kg−1 en bolo inicial seguido de una perfusión de 2mg·kg−1·h−1, con un máximo 60mg·kg−1). Esto puede justificar el descenso del débito de los drenajes en las primeras 24h (GP 702ml vs GI 514,8ml; p<0,001), de la transfusión en el postoperatorio inmediato (GP 77,5% vs GI 62,5%; p=0,045) y en el número total de CH transfundidos27.
Disminuyeron los pacientes en los que se administró plasma en el intraoperatorio (GP 38,9% vs GI 6,25%; p<0,001), aunque no lo hizo la media de unidades usadas por paciente transfundido (GP 4,42 vs GI 4). La explicación puede ser porque su uso se reservó para sangrados masivos con altos requerimientos de transfusión.
Probablemente la medida de mayor impacto en nuestro programa fue la incorporación del recuperador intraoperatorio. Con él, la Hb aumentó tanto a la salida de quirófano (GP 9,97g·dl−1 vs GI 11,32g·dl−1) como a las 24h (GP 9,4g·dl−1 vs GI 10,33g·dl−1). La sangre recuperada se solía administrar tras la desconexión de la CEC y a la llegada a UCI. Su repercusión fue evidente en las primeras 24h y en pacientes con un sangrado leve o moderado, donde la transfusión del recuperador podía compensar las pérdidas28.
Como consecuencia de la reducción de la transfusión, observamos descenso de los signos de infección del postoperatorio así como una tendencia hacia menor estancia hospitalaria y menor mortalidad3,5,6. La normotermia intraoperatoria también pudo influir en la disminución de infecciones29.
Por último, se estudió si las actuaciones introducidas resultaban rentables desde el punto de vista económico (tabla 6). La implementación del protocolo de PBM supuso un gasto por paciente de 282,87€. En cuanto al ahorro, se valoró el descenso de la transfusión de 2,58 bolsas de CH y de 2,5 bolsas en plasma por paciente que, según los datos del BOCM de 2013, son 446,16€ menos por paciente. Teniendo en cuenta ambas cosas, podemos concluir que nuestra intervención supone un ahorro de 163,29€ por paciente.
Están subestimados los gastos derivados de la transfusión al no contabilizar el gasto del material necesario en la misma, el personal implicado y las complicaciones que pueden derivar de la misma. Kleinerüschkamp et al.30 describieron un ahorro de 1761€ por paciente en CCV con programa PBM, incluidos gastos derivados de las complicaciones y la estancia hospitalaria. En nuestro estudio no se incluyó el ahorro de días de ingreso hospitalario por no tener diferencias estadísticamente significativas, aunque parece razonable que se debiera a que fue una muestra pequeña para demostrar esta variable. Si esto fuera así, supondría un ahorro de 2.267,68€ por paciente (629,91€ por día de hospitalización en planta según datos de gestión de nuestro hospital).
Como limitaciones del estudio podemos decir que se trata de un estudio clínico cuasi-experimental con un grupo retrospectivo y otro prospectivo, diseñado según las características del servicio en el momento inicial y que cambiaron durante su desarrollo (3años). Entre los principales cambios destacan un aumento de los pacientes derivados de otros centros que requieren cirugía preferente sin poder optimizarse, y la creación de una «unidad de aorta» donde los pacientes son más jóvenes, aunque con patología de alto riesgo de sangrado. Además, nuestro hospital pasó a ser centro de referencia de implantación de asistencias ventriculares.
La baja mortalidad en nuestros pacientes precisa de muestras muy grandes para poder demostrar diferencias estadísticamente significativas. Solo recogimos mortalidad hasta los 3meses, ya que hay pacientes que realizaron el seguimiento en sus centros de origen.
Este estudio fue diseñado para el cálculo del descenso de la transfusión. Las diferencias del tamaño muestral de cada grupo estaban dentro de este diseño. Dos muestras con el mismo número de pacientes ampliando el GI habrían sido más homogéneas y quizá demostrarían diferencias estadísticamente significativas en la disminución de la estancia hospitalaria.
Como conclusiones, podemos decir que la implementación del PBM en CCV reduce la TSA, con signos sugestivos de descenso de infecciones y una tendencia a disminuir los días de ingreso y la mortalidad. En la aproximación económica realizada el coste de la intervención es menor que el ahorro producido con el descenso en la transfusión. Se necesitan más estudios, con muestras más grandes, para demostrar los resultados de mejoría en la morbimortalidad y la disminución de la estancia hospitalaria.
FinanciaciónEl presente trabajo no ha sido financiado ni ha recibido becas o subvenciones de ningún tipo.
Conflicto de interesesNinguno.
A Ana Royuela, por su colaboración en el análisis estadístico y en la elaboración del manuscrito.