En los últimos meses se han realizado grandes esfuerzos para evaluar las terapias más eficaces en el manejo de pacientes con COVID-19. Actualmente ninguna combinación ha demostrado de manera consistente una relación clara con la mortalidad. Nuestro objetivo fue valorar el patrón de asociaciones observado entre los distintos tratamientos intrahospitalarios administrados a 238 pacientes ingresados por COVID-19 y la mortalidad.
Materiales y métodosSe analizaron las historias clínicas electrónicas de aquellos pacientes dados de alta o que fallecieron por COVID-19 entre el 16 de marzo y el 10 de abril de 2020 en el Hospital Universitario San Cecilio (Granada, España). Se obtuvo información sobre sexo, edad, comorbilidades al ingreso, parámetros clínicos, analíticos, pruebas de imagen y tratamientos empíricos empleados. La variable de desenlace fue la mortalidad intrahospitalaria. Para estimar las asociaciones entre los diferentes tratamientos y el riesgo de mortalidad se estimaron, mediante modelos de regresión de Cox, hazard ratio ajustadas por edad, sexo, patologías previas y gravedad al ingreso.
ResultadosLa combinación de fármacos más frecuentemente empleada fue la formada por heparina de bajo peso molecular (HBPM), hidroxicloroquina y ritonavir/lopinavir. Ninguno de los tratamientos utilizados mostró una asociación independiente con la mortalidad. Los fármacos que mostraron una asociación inversa de mayor magnitud fueron el tocilizumab y los corticoides.
ConclusionesEl patrón se asociaciones obtenido es consistente con lo reportado en la bibliografía. Parece oportuno diseñar ensayos aleatorizados que valoren el posible efecto protector de los corticoides y el tocilizumab sobre el riesgo de muerte en algunos subgrupos de pacientes hospitalizados por COVID-19.
In the last months great efforts have been developed to evaluate the more efficient therapeutic agents in the management of patients with COVID-19. Currently, no specific drug combination has consistently demonstrated an association with mortality. The aim of this study was to assess the pattern of associations observed between the different in-hospital treatments administered to a series of 238 patients admitted for COVID-19 and their relationship with mortality.
MethodsThe electronic medical records of patients that discharged or died from COVID-19 in the Hospital Universitario San Cecilio (Granada, Spain) between March 16 and April 10, 2020 were analysed. From these records, information was obtained on sex, age, comorbidities at admission, clinical information, analytical parameters, imaging tests and empirical treatments used. The outcome variable was the in-hospital mortality. To estimate the associations between the different therapeutic alternatives and the risk of mortality, hazard ratios adjusted for age, sex, previous pathologies and severity at discharge were estimated using Cox regression models.
ResultsThe most frequently used combination of drugs was low molecular weight heparins, hydroxychloroquine, and ritonavir/lopinavir. None of the analysed treatments showed independent association with mortality. The drugs that showed a greater inverse association with mortality were tocilizumab and corticoids.
ConclusionsThe observed association patterns are consistent with previous literature. It seems necessary to design randomized controlled clinical trials that evaluate the possible protector effect of tocilizumab and corticoids in the risk of mortality for some subgroups of COVID-19 hospitalized patients.
En los últimos dos meses se han realizado grandes esfuerzos por parte de la comunidad científica internacional para identificar la efectividad de los agentes terapéuticos utilizados para el tratamiento de la enfermedad producida por el SARS-CoV-2, denominada COVID-191-3. Al margen de los tratamientos de soporte como la administración de fluidos y oxigenoterapia4, no se han identificado tratamientos específicos con efectividad contrastada. Así, una revisión reciente5 que incluyó 22 estudios concluyó que, a pesar del potencial de algunas alternativas terapéuticas, ninguna de ellas se muestra recomendable con la evidencia disponible, a la espera de un mayor desarrollo farmacológico o de la conclusión de ensayos clínicos, cuyos primeros resultados se prevén para finales del mes de junio de 2020. Esta tesis coincide con la de las revisiones más recientes publicadas1,6,7. A pesar de la gran cantidad de estudios realizados en los últimos dos meses, solo hay unos pocos datos disponibles de estudios observacionales, dado que todos los fármacos utilizados hasta el momento se basan en su actividad in vitro o bien en la experiencia clínica previa en otras enfermedades producidas por coronavirus8, tales como el síndrome respiratorio agudo severo (SARS) y el síndrome respiratorio de oriente medio (MERS) o contra el virus del Ébola.
Los diferentes tratamientos que se han probado incluyen la cloroquina9, hidroxicloroquina10, lopinavir/ritonavir11, favipiravir12, remdesivir13, darunavir14, interferones15, nitazoxanida16, ivermectina17 o azitromicina18, entre otros. Las revisiones acerca de estos tratamientos indican que ninguna terapia tiene suficiente evidencia de efectividad en la actualidad sustentada por ensayos clínicos controlados19,20. A modo de ejemplo, la hidroxicloroquina, ampliamente incluida en las guías de tratamiento de COVID-19 en todo el mundo, no ha demostrado efectividad en un ensayo clínico piloto de 30 adultos21, ni asociación en un estudio observacional de 1.376 pacientes en Nueva York22. Este último estudio calculó regresiones de Cox ajustando por variables sociodemográficas, clínicas, test de laboratorio y otros tratamientos, y obtuvo una hazard ratio (HR) de mortalidad con hidroxicloroquina de 1,04 (IC 95% 0,82-1,32). Similares resultados se obtuvieron en otro ensayo que combinó hidroxicloroquina con azitromicina23.
Por otro lado, se ha propuesto que la utilización de terapias antiinflamatorias podría tener repercusiones positivas en la evolución clínica de los pacientes hospitalizados por COVID-1924. Así, el uso de corticoides25, inhibidores de la IL-6 como el tocilizumab26 o el sarilumab (NCT04315298), u otros fármacos con propiedades antiinflamatorias como el baricinitib27, se han propuesto como alternativas terapéuticas efectivas, aunque las evidencias de su utilidad en la práctica clínica son aún limitadas28. El uso de corticoesteroides ha sido especialmente debatido. Mientras la Organización Mundial de la Salud no recomienda su uso salvo que haya otra indicación, y algunos estudios clínicos no avalan su utilidad e informan de su peligro potencial29, otros estudios apuntan a la utilidad de estos fármacos en la fase aguda de la enfermedad30. En nuestro medio se ha descrito una asociación entre el uso de pulsos de corticoides y un número menor de eventos (mortalidad e intubación) en pacientes diagnosticados con tormenta de citocinas por COVID-19, obteniendo una HR de supervivencia de 0,02 (IC 95% 0,0004-0,835; p = 0,04) en pacientes tratados con pulsos de corticoides y tocilizumab frente a pacientes tratados únicamente con tocilizumab31.
Además de los fármacos antivirales y antiinflamatorios, se plantean como posibles futuras estrategias el uso de anticuerpos, la transfusión de plasma y el desarrollo actual de vacunas32. Los estudios observacionales de mayor tamaño publicados, así como los resultados preliminares de los dos principales ensayos clínicos con remdesivir (HR de mortalidad 0,70; IC 95% 0,47-1,0433 y HR de mejoría clínica 1,23; IC 95% 0,87-1,7534) no arrojan resultados concluyentes respecto a ninguna de las estrategias terapéuticas empleadas contra el SARS-CoV-28,22. Además, hasta la fecha no hemos encontrado ningún estudio observacional publicado que analice, mediante modelos multivariantes, la asociación de estos tratamientos sobre la morbimortalidad por COVID-19 en España.
Con todo, pese a que son múltiples las guías de manejo y tratamiento de la COVID-19 que incorporan entre sus recomendaciones el empleo sistemático de muchos de los fármacos antes descritos, son muy escasos los estudios observacionales que analizan la asociación de tales fármacos con la mortalidad precoz ocasionada por el SARS-CoV-2 y, en el caso de España, inexistentes hasta la fecha. Información sin duda muy valiosa para la adecuación y mejora de tales guías, basándonos en el impacto que el uso de los diferentes fármacos tiene en un contexto clínico como el nuestro.
El objetivo de nuestro estudio es, por tanto, valorar el patrón de asociaciones observado entre los distintos tratamientos intrahospitalarios administrados a una serie de 238 pacientes ingresados por COVID-19 y la mortalidad.
Material y métodosDiseñoPara el diseño del presente manuscrito se siguieron las recomendaciones de la guía STROBE (REF) para estudios observacionales. Se ha analizado de forma retrospectiva la serie de casos constituida por todos los 238 pacientes que, habiendo ingresado por COVID-19 en el Hospital Universitario Clínico «San Cecilio» (HUSC) de Granada, fallecieron o fueron dados de alta entre el 16 de marzo y el 10 de abril de 2020. No hubo pérdidas. El HUSC es un hospital de tercer nivel, con 480 camas, que da cobertura asistencial especializada a una población de 291.797 habitantes. El período de ingreso de todos los pacientes incluidos en el estudio estuvo comprendido entre el 8 de marzo y el 5 de abril de 2020.
VariablesA partir de las historias clínicas electrónicas de cada paciente se recogió, entre otra información, la referente a las siguientes variables:
- •
Datos generales al ingreso y del informe de Urgencias: fecha de ingreso, sexo, edad y presencia de comorbilidades (hipertensión arterial [HTA], diabetes mellitus [DM], neumopatía previa, insuficiencia renal crónica, enfermedad cardiovascular [ECV] o neoplasia activa).
- •
Variables de la exploración clínica y la analítica al ingreso: presión arterial sistólica y diastólica, frecuencia cardiaca, temperatura, saturación basal de oxígeno (SatO2), aporte externo de oxígeno necesario (litros), fracción de oxígeno inspirada (FiO2), cociente SatO2/FiO2, hemoglobina, linfocitos, neutrófilos, plaquetas, dímero D, glucemia, bilirrubina total, lactato-deshidrogenasa (LDH), ferritina, proteína C reactiva (PCR), procalcitonina, troponinas, creatinina, función renal (elevación de urea y de creatinina), presión parcial de O2 y de CO2 arteriales (PO2 y PCO2), bicarbonato, pH arterial, sequential organ failure assessment (índice SOFA) e índice CURB65.
- •
Tratamientos administrados durante la estancia del paciente en el hospital: heparinas de bajo peso molecular (bemiparina sódica a dosis de 2.500 a 3.500, 5.000 a 7.000, o 7.500 a 10.000, las dosis utilizadas en nuestra serie), hidroxicloroquina, ritonavir/lopinavir, azitromicina, corticoides (metilprednisolona < 61 mg, 80-160 mg, 200-250 mg, < 500 mg, nuevamente basándonos en los datos observados que se emplearon), IECA/ARA2 y tocilizumab.
- •
Variables de desenlace: exitus y días de duración de la estancia.
Como variable dependiente se consideró el tiempo hasta la muerte y se aplicaron modelos de regresión de Cox para cuantificar, mediante el cálculo de las correspondientes hazard ratios (HR), la magnitud de las asociaciones entre el hazard o tasa instantánea de muerte y cada uno de los tratamientos administrados a los pacientes de nuestra serie. Para cada tratamiento se obtuvieron dos estimaciones de HR. La primera (HR1) resultó de ajustar un modelo de regresión de Cox separadamente para cada tratamiento considerado, en el que aparte de dicho tratamiento, se incluyeron aquellas variables que, en un modelado previo, se comportaron como predictoras del riesgo de muerte (edad, diabetes, cociente SatO2/FiO2 y puntuación en las escalas SOFA y CURB65), más otras variables al ingreso que, de acuerdo con la bibliografía revisada35,36, podrían también comportarse como factores de confusión (sexo, antecedentes de ECV, HTA, IRC y días desde el ingreso del primer paciente de la serie). En segundo lugar, y puesto que tratándose de un estudio observacional la administración de los distintos tratamientos aplicados no era, en principio, independiente entre sí (la fuerza de asociación de cada uno con el exitus podía verse afectada por el efecto del resto de tratamientos administrados), se obtuvieron las HR para cada tratamiento obtenidas en un único modelo en el que, a las variables anteriores, se añadieron el conjunto de tratamientos administrados (HR2). Para todas las estimaciones de HR se obtuvieron sus correspondientes intervalos de confianza al 95% (IC 95%). El software utilizado para el análisis de datos fue el paquete estadístico STATA® (versión 15.0) (StataCorp. 2017. Stata Statistical Software: Release 15. College Station, TX: StataCorp LLC.).
Consideraciones éticasEl presente estudio cumplió con los requisitos necesarios de idoneidad en relación con el objetivo propuesto y se ajustó a los principios éticos aplicables a este tipo de diseños. Fue aprobado por el Comité de Ética de Investigación de la Provincia de Granada (CEI) con fecha 13.04.2020.
ResultadosLa distribución de los pacientes en función de las variables al ingreso ha sido descrita en un trabajo previo (actualmente en fase de publicación) en el que se analizaron los factores de riesgo al ingreso, y puede consultarse en el apéndice (tabla A).
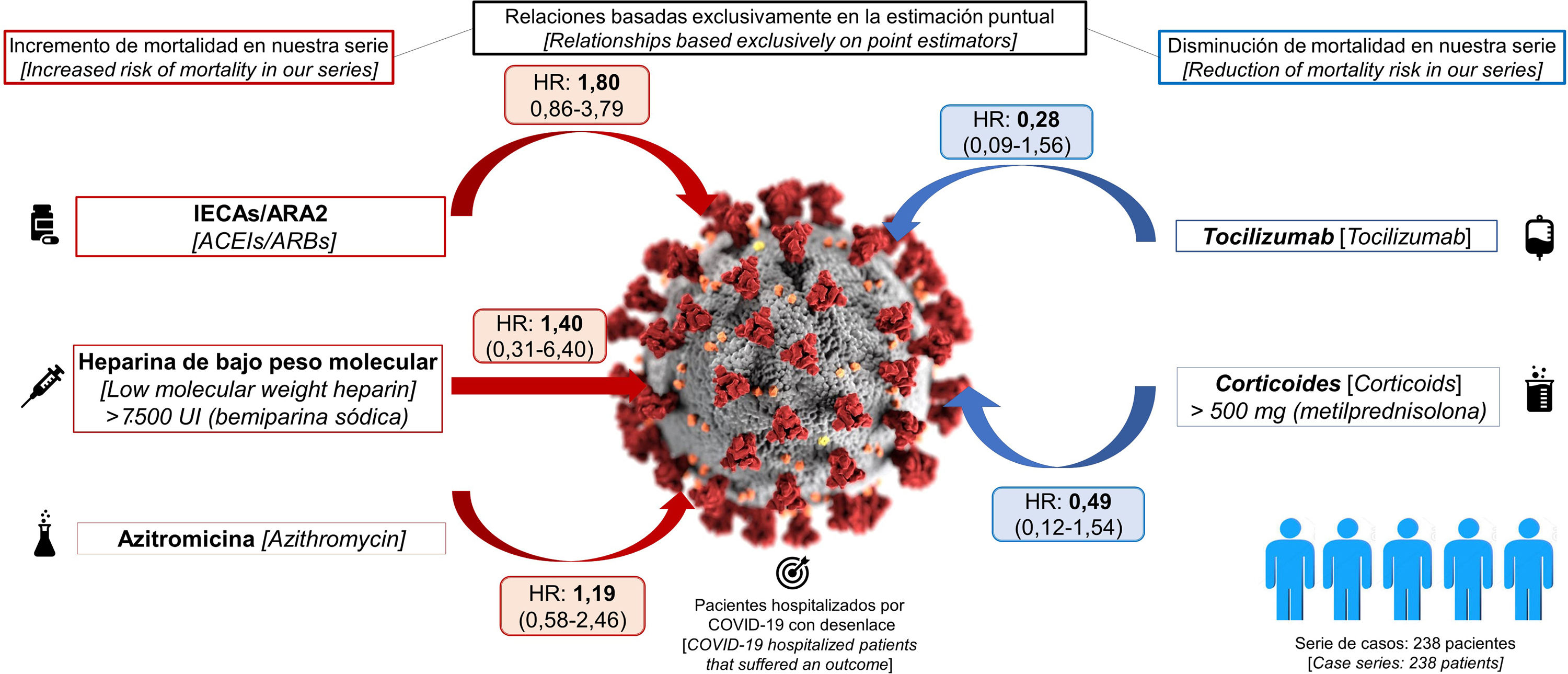
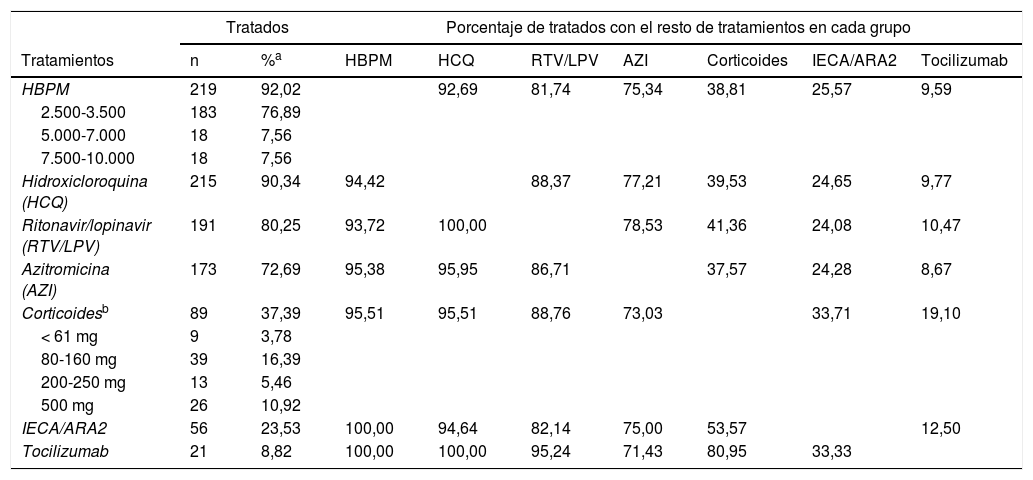
La tabla 1 muestra la distribución de los 238 pacientes en función del tratamiento administrado. Puede comprobarse como casi todos ellos (más del 90%), recibieron en algún momento de su estancia HBPM, la mayoría de ellos a dosis bajas, e hidroxicloroquina. También un elevado porcentaje de pacientes recibió ritonavir/lopinavir y azitromicina. El 38% de los pacientes hospitalizados recibieron corticoides (a dosis variables), a un 23% se les administró IECA/ARA2 y, finalmente, solo el 9% de los pacientes recibieron tocilizumab. figura 1
Distribución de los tratamientos en la muestra de pacientes (n = 238)
| Tratados | Porcentaje de tratados con el resto de tratamientos en cada grupo | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Tratamientos | n | %a | HBPM | HCQ | RTV/LPV | AZI | Corticoides | IECA/ARA2 | Tocilizumab |
| HBPM | 219 | 92,02 | 92,69 | 81,74 | 75,34 | 38,81 | 25,57 | 9,59 | |
| 2.500-3.500 | 183 | 76,89 | |||||||
| 5.000-7.000 | 18 | 7,56 | |||||||
| 7.500-10.000 | 18 | 7,56 | |||||||
| Hidroxicloroquina (HCQ) | 215 | 90,34 | 94,42 | 88,37 | 77,21 | 39,53 | 24,65 | 9,77 | |
| Ritonavir/lopinavir (RTV/LPV) | 191 | 80,25 | 93,72 | 100,00 | 78,53 | 41,36 | 24,08 | 10,47 | |
| Azitromicina (AZI) | 173 | 72,69 | 95,38 | 95,95 | 86,71 | 37,57 | 24,28 | 8,67 | |
| Corticoidesb | 89 | 37,39 | 95,51 | 95,51 | 88,76 | 73,03 | 33,71 | 19,10 | |
| < 61 mg | 9 | 3,78 | |||||||
| 80-160 mg | 39 | 16,39 | |||||||
| 200-250 mg | 13 | 5,46 | |||||||
| 500 mg | 26 | 10,92 | |||||||
| IECA/ARA2 | 56 | 23,53 | 100,00 | 94,64 | 82,14 | 75,00 | 53,57 | 12,50 | |
| Tocilizumab | 21 | 8,82 | 100,00 | 100,00 | 95,24 | 71,43 | 80,95 | 33,33 | |
La tabla 1 también muestra cómo se distribuyó la administración de cada fármaco en función de los restantes tratamientos utilizados. En general, se comprueba que los porcentajes de pacientes que recibieron cada tratamiento no varían sustancialmente en función de que recibieran los restantes. Únicamente es reseñable la asociación entre la administración de tocilizumab y corticoides.
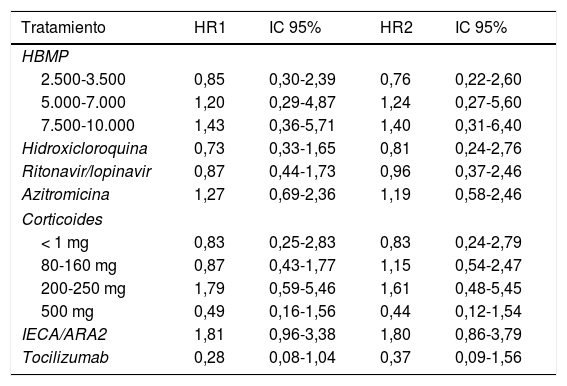
La duración del seguimiento de los pacientes incluidos en nuestra serie (equivalente a la duración de su estancia), osciló entre 0 (tres pacientes fallecieron el mismo día del ingreso), y 27 días. El 25,6% de los pacientes fallecieron. No hubo defunciones por debajo de los 50 años. Sin embargo, a partir de dicha edad la proporción de fallecidos creció exponencialmente: 5,8% (IC 95% 1,2-15,9%) de mortalidad en los pacientes de 50-59 años, 12,8% (IC 95% 4,8-25,7%) en los pacientes de 60-69 años, 28,6% (IC 95% 16,6-43,3%) en los pacientes de 70-79 años y 79,2% (IC 95%: 65,0-89,5%) en los pacientes de 80 o más años. La tabla 2 presenta las estimaciones de HR para cada tratamiento y, en el caso de la HBPM y los corticoides, para cada subgrupo de dosis administrado, obtenidas con los dos modelos diseñados (el ajustado para cada tratamiento por las principales variables confusoras [días de estancia, sexo, edad, comorbilidades, etc.] y el que incluye estas variables más el conjunto de tratamientos recibidos por cada paciente). Puede comprobarse cómo el patrón de asociaciones obtenido para los distintos tratamientos es similar en ambos modelos, si bien en el segundo la amplitud de los intervalos de confianza es algo mayor. En conjunto, para ninguna de las asociaciones estimadas se encontraron asociaciones evidentes, ni en el modelo ajustado por las principales variables confusoras (días de estancia, sexo, edad, comorbilidades, etc.), ni en el modelo ajustado por estas variables más el resto de los tratamientos recibidos por cada paciente. Los fármacos que se asociaron de manera más consistente con un menor riesgo de mortalidad entre los hospitalizados fueron el tocilizumab (HR2 0,37; IC 95% 0,09-1,56), y los corticoides a dosis de 500 mg o más (HR2 0,44; IC 95% 0,12-1,54).
Hazard ratio ajustadas para cuantificar la asociación entre cada tratamiento y el hazard de muerte
| Tratamiento | HR1 | IC 95% | HR2 | IC 95% |
|---|---|---|---|---|
| HBMP | ||||
| 2.500-3.500 | 0,85 | 0,30-2,39 | 0,76 | 0,22-2,60 |
| 5.000-7.000 | 1,20 | 0,29-4,87 | 1,24 | 0,27-5,60 |
| 7.500-10.000 | 1,43 | 0,36-5,71 | 1,40 | 0,31-6,40 |
| Hidroxicloroquina | 0,73 | 0,33-1,65 | 0,81 | 0,24-2,76 |
| Ritonavir/lopinavir | 0,87 | 0,44-1,73 | 0,96 | 0,37-2,46 |
| Azitromicina | 1,27 | 0,69-2,36 | 1,19 | 0,58-2,46 |
| Corticoides | ||||
| < 1 mg | 0,83 | 0,25-2,83 | 0,83 | 0,24-2,79 |
| 80-160 mg | 0,87 | 0,43-1,77 | 1,15 | 0,54-2,47 |
| 200-250 mg | 1,79 | 0,59-5,46 | 1,61 | 0,48-5,45 |
| 500 mg | 0,49 | 0,16-1,56 | 0,44 | 0,12-1,54 |
| IECA/ARA2 | 1,81 | 0,96-3,38 | 1,80 | 0,86-3,79 |
| Tocilizumab | 0,28 | 0,08-1,04 | 0,37 | 0,09-1,56 |
HR1 ajustadas por días desde el ingreso del primer paciente de la serie, sexo, edad, diabetes, ECV, HTA, IRC, SatO2FiO2, SOFA e índice CURB65.
HR2 ajustadas por las variables anteriores más el resto de los tratamientos administrados (n = 232).
Este estudio pone de relieve que las opciones terapéuticas mayoritariamente empleadas en los pacientes hospitalizados por COVID-19 de nuestra serie, al margen del tratamiento basal con oxigenoterapia, fluidoterapia, etc., fueron las HBPM, sobre todo a dosis iguales o menores a 3.500 UI (92,4%), la hidroxicloroquina (90,7%) y el ritonavir/lopinavir (80,6%). La prescripción de estos tres fármacos de manera combinada la identificamos en promedio en más de un 83,3% de los pacientes. En menor medida aparecen las prescripciones de azitromicina, corticoides o tocilizumab. Este hallazgo es consistente con el manejo realizado con los pacientes que conformaban las primeras series publicadas de COVID-19 en China11,21,36 y que es fácilmente comprensible si tenemos en cuenta que, tanto nuestro desenlace (alta a domicilio o exitus), como el periodo a estudio (16 de marzo a 10 de abril de 2020) definen una subpoblación muy concreta de estudio: la formada por aquellos pacientes que sufrieron el desenlace de su enfermedad durante las primeras semanas de la pandemia en nuestro país37.
Nos ha sido complejo comparar nuestros resultados con los de otros trabajos publicados hasta la fecha, dada la todavía escasa cantidad de estudios que analicen la relación ajustada entre tratamientos y mortalidad mediante estudios observacionales con análisis multivariantes.
Respecto al aumento de mortalidad encontrado en el uso de heparina de bajo peso molecular a dosis elevadas (7.500-10.000 UI de bemiparina sódica), la interpretación de estos resultados puede ser doble. Por un lado, puede deberse a que el uso este medicamento a dosis elevadas aumente la mortalidad debido a los efectos secundarios, o puede deberse a la causa que justifica la indicación: necesidad de anticoagulación (por ejemplo, cardiopatía). Por otro lado, dado que este fármaco se dosifica en función del peso, es posible que esta variable esté actuando como factor de confusión y sea realmente el peso elevado lo que se asocie a la mortalidad (el mismo sesgo es aplicable a los corticoides analizados en nuestra serie). En cualquier caso, este estudio pone de manifiesto la necesidad de incluir de manera rutinaria, en la medida de lo posible, el peso y talla de los pacientes durante la hospitalización, datos a los que no hemos podido acceder y que dificultan mucho la elección de la correcta posología en situaciones de incertidumbre terapéutica como la que vivimos actualmente con la pandemia de COVID-19. El patrón dosis-respuesta encontrado para la HBPM y, que puede ser parcialmente explicado por el peso, no ha sido observado, sin embargo, para las dosis crecientes de corticoides. El uso de estos últimos en nuestra muestra no se ha aplicado de forma extensiva, sino probablemente a un subgrupo de pacientes con características especiales (suponemos que son los que han desarrollado una respuesta inflamatoria aguda al virus). Sería especialmente interesante comparar tratados y no tratados con corticoides en este subgrupo de pacientes, pero nuestros datos nos impiden realizar este tipo de análisis en nuestro estudio.
El aumento de mortalidad encontrado con los IECA/ARA2 puede deberse, sin duda, a un sesgo por indicación. Los pacientes bajo estos tratamientos son, probablemente, pacientes que ya tenían indicación domiciliaria de los mismos debido a patologías crónicas (por ejemplo, hipertensión o enfermedad renal). Es posible que sean dichas patologías las que aumentan la mortalidad. En cualquier caso, tras ajustar por las mismas, sigue apareciendo una tendencia hacia el incremento de mortalidad en nuestro estudio. No podemos, no obstante, conocer las consecuencias que tendría el dejar de administrar estos fármacos en dichos pacientes, por lo que la interpretación de estos resultados debe ser cautelosa.
Nuestros resultados no muestran una asociación concluyente entre la azitromicina, ritonavir/lopinavir, hidroxicloroquina y la mortalidad. A pesar de ello, estos tratamientos se han pautado de manera sistemática, por lo que las comparaciones con pacientes que no han recibido dichos tratamientos resultan difíciles de analizar.
Por lo demás, el hecho de que los fármacos más fuertemente asociados a un menor riesgo de mortalidad sean, sobre todo, el tocilizumab y dosis elevadas de corticoides entre los pacientes de nuestra serie, concuerda con los hallazgos a los que apuntan diferentes revisiones recientemente publicadas según las cuales la inmunosupresión como mecanismo de defensa frente a la exagerada respuesta inflamatoria que genera el virus en el organismo se ha mostrado como una estrategia terapéutica eficaz, en especial en pacientes más jóvenes con síndrome de distrés respiratorio del adulto (SDRA)38,39.
LimitacionesLa principal limitación del presente estudio es su carácter observacional, que impide interpretar causalmente las HR estimadas para cada tratamiento. En segundo lugar, como ya se ha comentado en la sección de métodos, nuestro estudio no es una verdadera cohorte de pacientes ingresados, pues excluimos aquellos aún ingresados al cierre del período de reclutamiento. Puesto que la duración de la estancia tiende a asociarse con la mortalidad de forma inversa, esto conduce a un sesgo de selección que, por una parte, tenderá a sobreestimar la proporción de defunciones en nuestra muestra y, por otra, podría sesgar, con un sentido variable, la magnitud de las asociaciones entre los tratamientos administrados y la defunción. En segundo lugar, puede existir un sesgo de selección, análogo al ya descrito en una revisión sobre estudios de factores pronóstico en pacientes con COVID-1940. De forma resumida, este sesgo se debe a que, aunque nuestra población de referencia sería la cohorte de todos pacientes ingresados por COVID-19 en el hospital a lo largo de un cierto período, nuestra muestra de estudio solo ha podido incluir a los pacientes ingresados que, o bien se habían recuperado y habían sido dados de alta, o bien habían fallecido durante el período de reclutamiento. Así pues, en ella faltan los pacientes que, habiendo ingresado en nuestro hospital, aún permanecían en cama cuando se cerró el período de reclutamiento (ni habían fallecido ni habían sido dados de alta). Estos serían los datos censurados de un estudio de cohortes convencional, que en el nuestro han sido obligadamente excluidos. En la medida en la que el riesgo de muerte de estos pacientes excluidos sea diferente del resto, existirá un sesgo de selección que afectará a la estimación del riesgo de muerte (supervivencia): si la duración de la estancia de los pacientes excluidos es, como cabe suponer, mayor que la de los sí incluidos, la supervivencia estimada en nuestra muestra será inferior a la de la cohorte completa de pacientes ingresados. El sesgo de selección también puede afectar a la magnitud de las estimaciones de asociación entre tratamientos y exitus, aunque en este caso el sentido del mismo es difícil de predecir. En cualquier caso, para tratar de minimizarlo hemos optado por considerar como variable dependiente el tiempo hasta la muerte y aplicar, en consecuencia, modelos de regresión de Cox. En tercer lugar, el pequeño tamaño muestral, además de limitar la potencia del estudio (lo que se ve reflejado en la elevada amplitud de los intervalos de confianza) impide, para la mayoría de los tratamientos evaluados, aplicar otros métodos de análisis causal. Igualmente, no nos ha sido posible incluir en los modelos los correspondientes términos de interacción entre tratamientos, ni tampoco valorar desenlaces secundarios, como la necesidad de intubación o ingreso en UCI, ni posibles efectos adversos específicos de cada fármaco, así como realizar análisis exploratorios por subgrupos de pacientes. Por último, somos conscientes de la más que probable confusión residual existente en nuestras estimaciones al no poder haber incorporado variables como, por ejemplo, el peso de los pacientes. A la luz de todas estas limitaciones debe quedar claro, pues, que estamos ante un estudio descriptivo de carácter exploratorio, cuyo único objetivo es identificar patrones de asociaciones que pudieran ser objeto de ulteriores estudios.
ConclusionesNuestros resultados evidencian que la combinación terapéutica más frecuentemente empleada entre los pacientes de nuestra serie fue la formada por HBPM, hidroxicloroquina y ritonavir/lopinavir. Ninguno de los tratamientos aplicados se ha asociado claramente con la mortalidad intrahospitalaria. Los fármacos asociados a una menor mortalidad en nuestra serie fueron el tocilizumab y los corticoides a altas dosis. Aún son necesarios estudios observacionales analíticos con estimaciones ajustadas mediante modelos multivariantes y estudios experimentales puros para analizar la relación entre los tratamientos y la mortalidad por COVID-19.
FinanciaciónNo se ha recurrido a ninguna fuente de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a la Cátedra de Docencia e Investigación SEMERGEN-Medicina de Familia de la Universidad de Granada, por su apoyo para la realización de este estudio. De igual forma, los autores agradecen a todos los profesionales que han trabajado en el Hospital Universitario San Cecilio durante la pandemia, por su incansable labor en el cuidado de los pacientes.