Se han comunicado varios trabajos donde se ha demostrado un efecto beneficioso de los glucocorticoides como tratamiento de la tormenta de citocinas que se asocia a los cuadros graves por SARS-CoV-2, plateándose diferentes pautas de glucocorticoides.
MétodosEstudio observacional retrospectivo que incluye pacientes con neumonía grave por SARS-CoV-2 y compara el ingreso en una unidad de cuidados intensivos (UCI) o fallecimiento durante la hospitalización en 3 grupos de pacientes: sin tratamiento con glucocorticoides, uso de dosis diarias de glucocorticoides equivalentes menores a 250mg de prednisona y dosis diarias equivalentes mayores o iguales a 250mg de prednisona. Se realizó un análisis multivariante mediante regresión logística, utilizando el índice de propensión como covariante.
ResultadosDe los 259 pacientes incorporados al estudio 67 (25,9%) tuvieron una evolución desfavorable, falleciendo o precisando ingreso en UCI. Los análisis comparativos entre diferentes tratamientos con glucocorticoides, y la asociación con ingreso en UCI o fallecimiento fueron: tratamiento con glucocorticoides (cualquier dosis) versus sin tratamiento con glucocorticoides (OR: 0,71 [0,30-1,66]), tratamiento con glucocorticoides (≥250mg de prednisona al día) versus sin tratamiento con glucocorticoides (OR: 0,35 [0,11-1,08]) y tratamiento con glucocorticoides (≥250mg de prednisona al día) versus pacientes con dosis de glucocorticoides<250mg de prednisona o sin tratamiento con glucocorticoides (OR: 0,30 [0,10-0,88]).
ConclusiónLos resultados de este estudio muestran que los paciente con neumonía grave por SARS-CoV-2 tratados con pulsos con glucocorticoides con dosis equivalentes de prednisona mayor o igual de 250mg tienen una evolución más favorable (menos mortalidad e ingreso en UCI).
Several studies have reported the beneficial effect of glucocorticoids in the treatment of cytokine storm that occurs in patients with severe COVID-19. Various glucocorticoids regimens have been proposed.
MethodsRetrospective observational study that includes patients with severe SARS-CoV-2 pneumonia and compares admission to an Intensive Care Unit (ICU) or death during hospitalization in three groups of patients: no glucocorticoids treatment, use of glucocorticoids doses equivalent to less than 250mg of prednisone daily and use of equivalent doses greater than or equal to 250mg of prednisone daily. Multivariate analysis was performed using logistic regression, using the propensity index as a covariant.
ResultsOf the 259 patients enrolled in the study, 67 (25.9%) had an unfavorable evolution, dying or requiring ICU admission. Comparative analyzes between different glucocorticoids treatments and the association with ICU admission or death were: glucocorticoids treatment (any dose) versus no glucocorticoids treatment (OR: 0.71 [0.30-1.66]), treatment with glucocorticoids (≥250mg prednisone daily) versus no glucocorticoids treatment (OR: 0.35 [0.11-1.08]) and glucocorticoids treatment (≥250mg prednisone daily) versus patients with glucocorticoids doses <250mg prednisone daily or without glucocorticoids treatment (OR: 0.30 [0.10-0.88]).
ConclusionThe results of this study show that patients with severe SARS-CoV-2 pneumonia treated with glucocorticoids pulses with equivalent doses of prednisone greater than or equal to 250mg have a more favorable evolution (less mortality and less admission to ICU).
Alrededor de un 80% de los pacientes con coronavirus infection disease 2019 (COVID-19) tienen síntomas leves, pero el resto pueden tener una afectación más severa con desarrollo de neumonía intersticial que puede complicarse con un síndrome de distrés respiratorio agudo, requiriendo ingreso en una unidad de cuidados intensivos (UCI) hasta en un 5% de los casos1,2.
Se han definido 2 fases en la patogenia de la enfermedad que se superponen, y de duración no bien definida3,4. La primera, en la que predomina el daño directo por el virus, y la segunda debida a la respuesta inflamatoria del huésped. Muchos de los pacientes con COVID-19 severa presentan una excesiva respuesta inflamatoria ocasionada por una liberación incontrolada de citocinas proinflamatorias, definida como tormenta de citocinas, que causan un daño alveolar difuso3–6.
Ante la ausencia de un tratamiento antiviral eficaz, actualmente las únicas armas disponibles que tenemos son el tratamiento de soporte y el tratamiento inmunomodulador, con el objetivo de controlar esta tormenta inflamatoria.
El tratamiento con glucocorticoides ha sido un tema controvertido en los pacientes con infección por SARS-CoV-2. Por un lado, se estima que pueda inhibir el daño tisular al disminuir la respuesta inflamatoria, pero por otro lado, se teme que frene la inmunidad celular, pudiendo disminuir el aclaramiento viral y empeorar la evolución7.
Se han comunicado varios trabajos, incluido un ensayo clínico, donde se ha demostrado un efecto beneficioso de los glucocorticoides en la evolución de los pacientes con COVID-198–14, aunque no todos los estudios han encontrado ese mismo beneficio15,16. Las dosis de glucocorticoides empleadas han sido muy variadas, y algunos autores apuestan por las dosis altas en bolos (prednisona>250mg) por tener más efecto sobre la vía de acción denominada no genómica13,17.
El objetivo del presente estudio fue examinar la evolución de los pacientes ingresados con neumonía grave por SARS-CoV-2 en nuestro hospital al inicio de la pandemia, donde se utilizaron diversas pautas de tratamiento con glucocorticoides, y determinar la asociación del uso de glucocorticoides con el ingreso en UCI o fallecimiento.
MetodologíaDiseño del estudio y pacientesEstudio observacional y retrospectivo que examina la eficacia del tratamiento con glucocorticoides en pacientes de edades comprendidas entre los 18 y los 75 años con neumonía grave por SARS-CoV-2 en planta de hospitalización convencional en el Hospital Universitario Infanta Sofía (HUIS) de San Sebastián de los Reyes (Madrid), con fecha de ingreso desde el 28 de febrero de 2020 hasta el 9 de abril de 2020.
El diagnóstico de infección por SARS-CoV-2 se confirmó por amplificación genómica mediante reacción en cadena de la polimerasa de muestra de nasofaringe.
La neumonía grave se definió por la presencia de:
- -
Consolidaciones en más de 2 campos en la radiografía de tórax a la llegada a urgencias, o empeoramiento radiológico con aparición de nuevos infiltrados en las primeras 48horas del ingreso hospitalario.
- -
Saturación de oxígeno con aire ambiente<93% o un cociente entre saturación de oxígeno y fracción inspiratoria de oxígeno (SAFI) equivalente<443 en las primeras 48horas de ingreso hospitalario.
Se excluyeron los pacientes con estancia en planta de hospitalización de menos de 48horas, con tratamiento previo con inmunosupresores o glucocorticoides, con comorbilidad asociada, que tenían un papel más relevante que la infección por SARS-CoV-2 y que motivaron realmente el ingreso hospitalario, y pacientes con otras enfermedades que podían actuar como factor de confusión, como la leucemia linfática crónica, en las que no era valorable la linfopenia como marcador pronóstico.
Exposición a glucocorticoides y definición de evento finalEl estudio comparó pacientes que recibieron tratamiento estándar frente a pacientes que recibieron tratamiento estándar más glucocorticoides, y su asociación con el desarrollo de un evento final desfavorable.
Se definió como evento final desfavorable el fallecimiento o el ingreso en la UCI durante la hospitalización. Como evento final favorable se definió el alta hospitalaria sin haber ingresado en UCI.
Se consideró como exposición a glucocorticoides el uso de cualquier dosis de metilprednisolona o dexametasona durante el ingreso. Se definieron 2 grupos de exposición a glucocorticoides. Un grupo de pacientes que recibió dosis equivalentes máximas diarias de prednisona menores de 250mg y otro grupo que recibió dosis equivalente máximas diarias de prednisona mayores o iguales a 250mg. Las dosis diarias equivalentes mayores o iguales a 250mg de prednisona se administraron en forma de bolos intravenosos de dexametasona de 40mg, o de metilprednisolona de 250 o 500mg durante un tiempo de 3 a 5 días.
La decisión de iniciar o no tratamiento con glucocorticoides dependía del equipo médico que atendía a cada paciente, de manera individualizada. Se informaba a los pacientes de su uso fuera de ficha técnica, y estos daban su consentimiento de forma verbal, quedando así reflejado en la historia electrónica.
Como tratamiento estándar se consideraron las medidas de soporte con aporte de oxigenoterapia y la combinación de otros fármacos como lopinavir-ritonavir, hidroxicloroquina, azitromicina, tocilizumab y anakinra, acorde con una guía local, dinámica, orientativa y consensuada del hospital, que fue actualizada en función de las publicaciones que fueron surgiendo durante el periodo de inclusión. Tocilizumab y anakinra se administraron según criterio del equipo médico responsable del paciente; para administrar tocilizumab los valores de interleucina 6 debían ser mayores de 40pg/ml.
Método de trabajo y variablesLos pacientes que cumplían todos los criterios de inclusión y ninguno de exclusión se seleccionaban de una base de datos (HUIS-COVID) que se creó para registrar los datos clínicos de los pacientes hospitalizados por COVID-19.
Las variables analizadas fueron: características demográficas (edad, sexo y raza), antecedentes médicos previos, medicación previa al ingreso, fecha de inicio de los síntomas, fecha de ingreso hospitalario, fecha del evento final, cociente de saturación de oxígeno y fracción inspiratoria de oxígeno (SAFI) a la llegada a urgencias y a las 48horas, datos analíticos a la llegada a urgencias y a las 48horas (porcentaje de linfocitos, proteína C reactiva [PCR], lactato deshidrogenasa [LDH] y dímero D), hallazgos radiológicos a la llegada a urgencias y a las 48horas y tratamientos durante el ingreso.
Análisis estadísticoCon fines descriptivos las variables cualitativas se expresaron en forma de frecuencia absoluta y porcentaje, las variables cuantitativas como medianas e intervalos intercuartílicos (ICC).
En primer lugar se realizó un análisis univariante de las variables registradas en los diferentes grupos de exposición a glucocorticoides. Las variables cualitativas se analizaron utilizando la prueba de Chi cuadrado y las variables cuantitativas el test de U-Mann-Whitney. Las variables que en el análisis univariante demostraron diferencias estadísticamente significativas (p<0,05) se utilizaron mediante regresión logística para calcular el índice de propensión de recibir tratamiento con glucocorticoides (cualquier dosis) y dosis equivalentes de prednisona superiores o iguales a 250mg.
Posteriormente, se realizó un análisis univariante para describir las variables que se asociaban con el desarrollo de un evento desfavorable. Finalmente se realizó un análisis multivariante mediante regresión logística para estudiar la asociación del uso de glucocorticoides (cualquier dosis) y el empleo de dosis equivalentes de prednisona superiores o iguales a 250mg con el desarrollo de un evento desfavorable. El análisis multivariante se ajustó a las variables que habían demostrado asociación en el análisis univariante. Se repitió el mismo análisis incorporando los índices de propensión con el uso de glucocorticoides (cualquier dosis) o del grupo de exposición a dosis equivalente de prednisona≥250mg. El análisis estadístico se realizó con el programa SPSS versión 19.0.
Aspectos éticosEl comité de investigación del hospital aprobó el desarrollo del estudio. El estudio cumple las normas y estándares éticos de investigación reflejados en la Declaración de Helsinki de la Asociación Médica Mundial y en el Convenio de Oviedo, relativo a los derechos humanos y la biomedicina. Todos los datos fueron tratados con la máxima confidencialidad, de acuerdo con la legislación vigente.
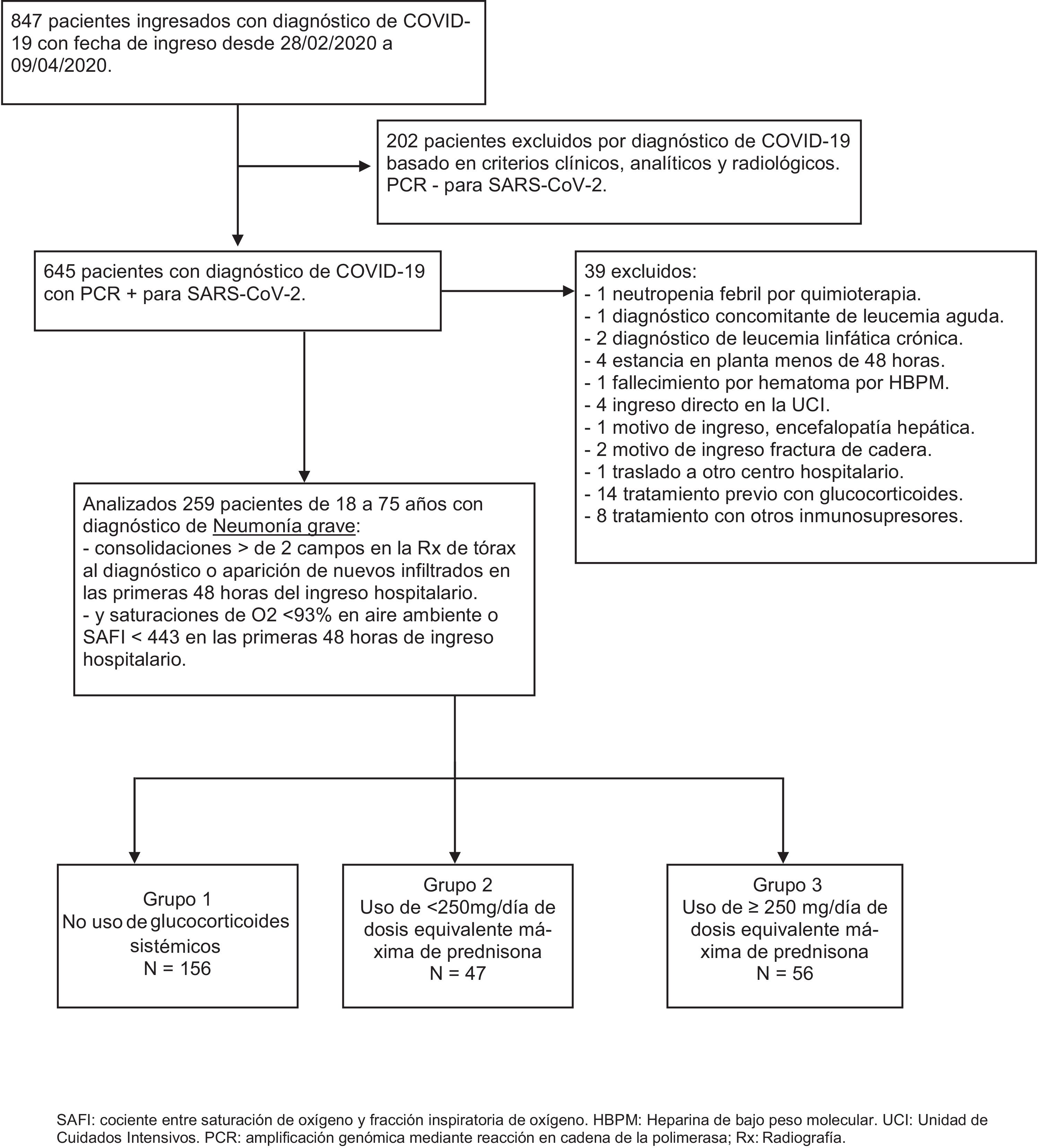
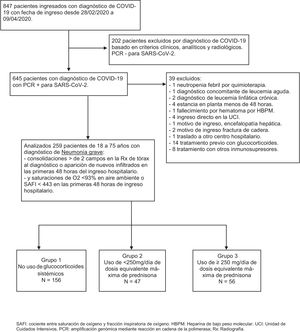
ResultadosDe los 847 pacientes que ingresaron en nuestro hospital del 28 de febrero al 9 de abril de 2020 con diagnóstico de infección por coronavirus (fig. 1), inicialmente se excluyeron 202 pacientes en los que el diagnóstico fue basado en criterios clínicos, analíticos y radiológicos.
Diagrama de flujo de pacientes incluidos y excluidos en el estudio.
HBPM: heparina de bajo peso molecular; PCR: amplificación genómica mediante reacción en cadena de la polimerasa; Rx: radiografía; SAFI: cociente entre saturación de oxígeno y fracción inspiratoria de oxígeno; UCI: unidad de cuidados intensivos.
De los 645 pacientes en los que se confirmó el diagnóstico de SARS-CoV-2 con estudio de amplificación genómica mediante reacción en cadena de la polimerasa de muestra de nasofaringe, se excluyeron 39 pacientes: uno por ingreso, coincidiendo con neutropenia febril por quimioterapia, otro por diagnóstico concomitante de leucemia aguda, 2 con diagnóstico de leucemia linfática crónica, 4 por estancia en planta menos de 48horas, un fallecimiento por hematoma secundario a tratamiento con heparina de bajo peso molecular (HBPM), 4 ingresos directos en la UCI, un ingreso por encefalopatía hepática como causa fundamental, 2 por ingreso de fractura de cadera, otro por traslado a otro centro, 14 por uso previo con glucocorticoides y 8 por uso de otros tratamientos inmunosupresores.
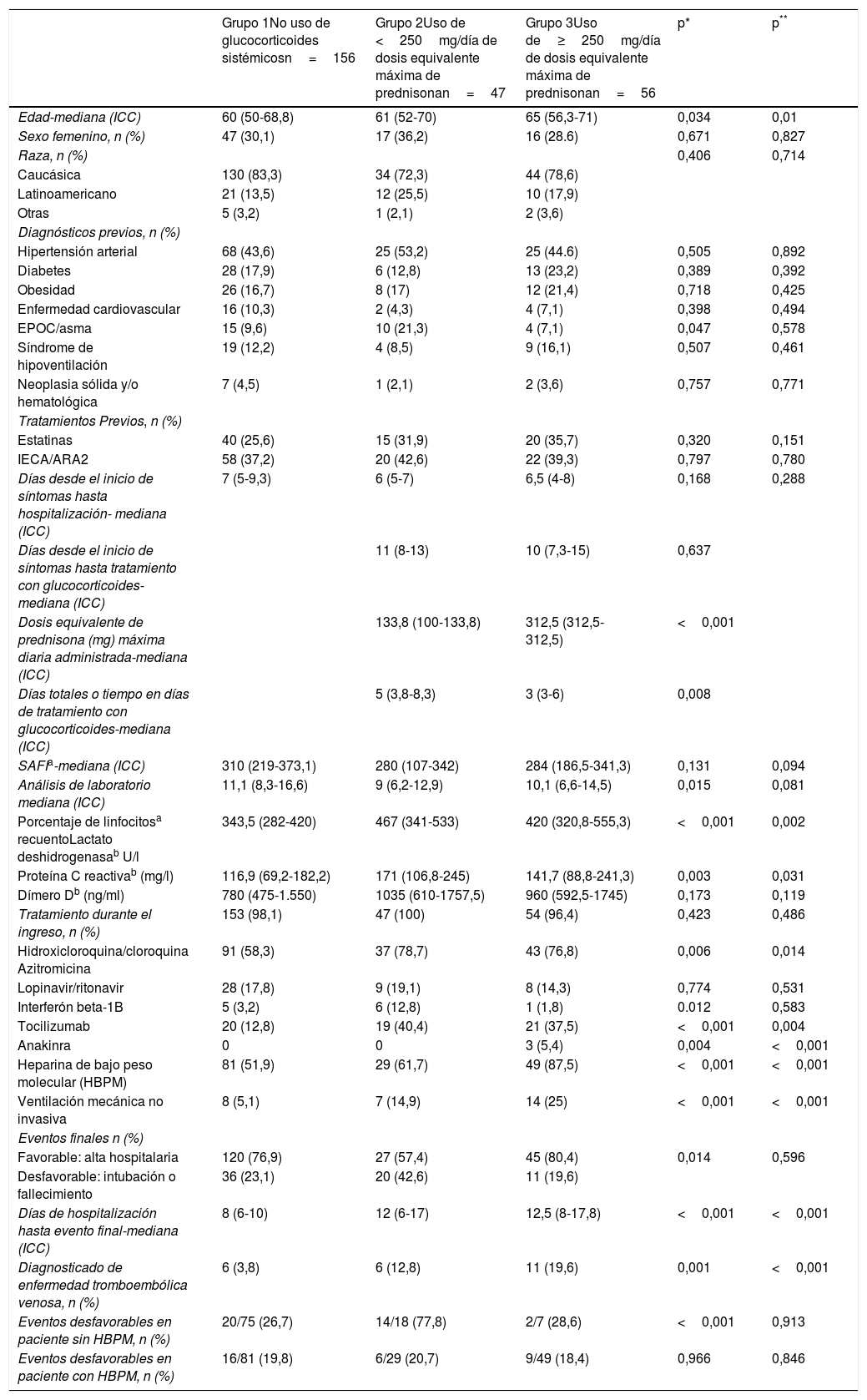
Se incluyeron finalmente 259 pacientes de 18 a 75 años con diagnóstico de neumonía grave por SARS-CoV-2, de los cuales 156 no recibieron tratamiento con glucocorticoides (grupo 1), 47 recibieron dosis de glucocorticoides máximas diarias equivalentes menores de 250mg de prednisona (grupo 2) y 56 dosis de glucocorticoides máximas diarias equivalentes mayores o iguales a 250mg de prednisona (grupo 3). Las características de los pacientes estratificados en los diferentes grupos se detallan en la tabla 1. Los pacientes que recibieron glucocorticoides tenían más edad, siendo el grupo 3 los de mayor edad. No había diferencias en cuanto a sexo y raza en los diferentes grupos. La comorbilidad fue muy similar, variando únicamente el porcentaje de asmáticos, que fue mayor en el grupo 2.
Características de los pacientes
| Grupo 1No uso de glucocorticoides sistémicosn=156 | Grupo 2Uso de <250mg/día de dosis equivalente máxima de prednisonan=47 | Grupo 3Uso de≥250mg/día de dosis equivalente máxima de prednisonan=56 | p* | p** | |
|---|---|---|---|---|---|
| Edad-mediana (ICC) | 60 (50-68,8) | 61 (52-70) | 65 (56,3-71) | 0,034 | 0,01 |
| Sexo femenino, n (%) | 47 (30,1) | 17 (36,2) | 16 (28.6) | 0,671 | 0,827 |
| Raza, n (%) | 0,406 | 0,714 | |||
| Caucásica | 130 (83,3) | 34 (72,3) | 44 (78,6) | ||
| Latinoamericano | 21 (13,5) | 12 (25,5) | 10 (17,9) | ||
| Otras | 5 (3,2) | 1 (2,1) | 2 (3,6) | ||
| Diagnósticos previos, n (%) | |||||
| Hipertensión arterial | 68 (43,6) | 25 (53,2) | 25 (44.6) | 0,505 | 0,892 |
| Diabetes | 28 (17,9) | 6 (12,8) | 13 (23,2) | 0,389 | 0,392 |
| Obesidad | 26 (16,7) | 8 (17) | 12 (21,4) | 0,718 | 0,425 |
| Enfermedad cardiovascular | 16 (10,3) | 2 (4,3) | 4 (7,1) | 0,398 | 0,494 |
| EPOC/asma | 15 (9,6) | 10 (21,3) | 4 (7,1) | 0,047 | 0,578 |
| Síndrome de hipoventilación | 19 (12,2) | 4 (8,5) | 9 (16,1) | 0,507 | 0,461 |
| Neoplasia sólida y/o hematológica | 7 (4,5) | 1 (2,1) | 2 (3,6) | 0,757 | 0,771 |
| Tratamientos Previos, n (%) | |||||
| Estatinas | 40 (25,6) | 15 (31,9) | 20 (35,7) | 0,320 | 0,151 |
| IECA/ARA2 | 58 (37,2) | 20 (42,6) | 22 (39,3) | 0,797 | 0,780 |
| Días desde el inicio de síntomas hasta hospitalización- mediana (ICC) | 7 (5-9,3) | 6 (5-7) | 6,5 (4-8) | 0,168 | 0,288 |
| Días desde el inicio de síntomas hasta tratamiento con glucocorticoides-mediana (ICC) | 11 (8-13) | 10 (7,3-15) | 0,637 | ||
| Dosis equivalente de prednisona (mg) máxima diaria administrada-mediana (ICC) | 133,8 (100-133,8) | 312,5 (312,5-312,5) | <0,001 | ||
| Días totales o tiempo en días de tratamiento con glucocorticoides-mediana (ICC) | 5 (3,8-8,3) | 3 (3-6) | 0,008 | ||
| SAFIa-mediana (ICC) | 310 (219-373,1) | 280 (107-342) | 284 (186,5-341,3) | 0,131 | 0,094 |
| Análisis de laboratorio mediana (ICC) | 11,1 (8,3-16,6) | 9 (6,2-12,9) | 10,1 (6,6-14,5) | 0,015 | 0,081 |
| Porcentaje de linfocitosa recuentoLactato deshidrogenasab U/l | 343,5 (282-420) | 467 (341-533) | 420 (320,8-555,3) | <0,001 | 0,002 |
| Proteína C reactivab (mg/l) | 116,9 (69,2-182,2) | 171 (106,8-245) | 141,7 (88,8-241,3) | 0,003 | 0,031 |
| Dímero Db (ng/ml) | 780 (475-1.550) | 1035 (610-1757,5) | 960 (592,5-1745) | 0,173 | 0,119 |
| Tratamiento durante el ingreso, n (%) | 153 (98,1) | 47 (100) | 54 (96,4) | 0,423 | 0,486 |
| Hidroxicloroquina/cloroquina Azitromicina | 91 (58,3) | 37 (78,7) | 43 (76,8) | 0,006 | 0,014 |
| Lopinavir/ritonavir | 28 (17,8) | 9 (19,1) | 8 (14,3) | 0,774 | 0,531 |
| Interferón beta-1B | 5 (3,2) | 6 (12,8) | 1 (1,8) | 0.012 | 0,583 |
| Tocilizumab | 20 (12,8) | 19 (40,4) | 21 (37,5) | <0,001 | 0,004 |
| Anakinra | 0 | 0 | 3 (5,4) | 0,004 | <0,001 |
| Heparina de bajo peso molecular (HBPM) | 81 (51,9) | 29 (61,7) | 49 (87,5) | <0,001 | <0,001 |
| Ventilación mecánica no invasiva | 8 (5,1) | 7 (14,9) | 14 (25) | <0,001 | <0,001 |
| Eventos finales n (%) | |||||
| Favorable: alta hospitalaria | 120 (76,9) | 27 (57,4) | 45 (80,4) | 0,014 | 0,596 |
| Desfavorable: intubación o fallecimiento | 36 (23,1) | 20 (42,6) | 11 (19,6) | ||
| Días de hospitalización hasta evento final-mediana (ICC) | 8 (6-10) | 12 (6-17) | 12,5 (8-17,8) | <0,001 | <0,001 |
| Diagnosticado de enfermedad tromboembólica venosa, n (%) | 6 (3,8) | 6 (12,8) | 11 (19,6) | 0,001 | <0,001 |
| Eventos desfavorables en paciente sin HBPM, n (%) | 20/75 (26,7) | 14/18 (77,8) | 2/7 (28,6) | <0,001 | 0,913 |
| Eventos desfavorables en paciente con HBPM, n (%) | 16/81 (19,8) | 6/29 (20,7) | 9/49 (18,4) | 0,966 | 0,846 |
ICC: intervalo intercuantílico; enfermedad cardiovascular: fibrilación auricular crónica y/o cardiopatías isquémica y/o insuficiencia cardiaca; SAFI: cociente entre saturación de oxígeno y fracción inspiratoria de oxígeno.
Los pacientes del grupo 2 y 3 tenían un SAFI y porcentajes de linfocitos más bajos respecto al grupo 1, siendo los valores de LDH, PCR y dímero D más elevados. No había diferencias significativas de los valores de estas variables entre los pacientes del grupo 2 y 3. Hubo diferencias en cuanto a los diversos tratamientos empleados durante el ingreso en cada uno de los grupos, siendo estadísticamente significativas en los tratamientos con HBPM, azitromicina, tocilizumab, interferón beta-1B y anakinra, y en la utilización de ventilación mecánica no invasiva (tabla 1). En cuanto al tratamiento con glucocorticoides fue más prolongado en los pacientes del grupo 2. La mediana e ICC del tiempo total de tratamiento con glucocorticoides en el grupo 3 fue de 3 (3-6) días. Un total de 21 pacientes (37,5%) del grupo 3 recibieron otras pautas de glucocorticoides aparte de los bolos de glucocorticoides. La mediana e ICC de dosis equivalente de prednisona máxima diaria administrada en el grupo 3 fue de 312,5mg (312,5-312,5), frente a 133,8mg (100-133,8) del grupo 2 (tabla 1).
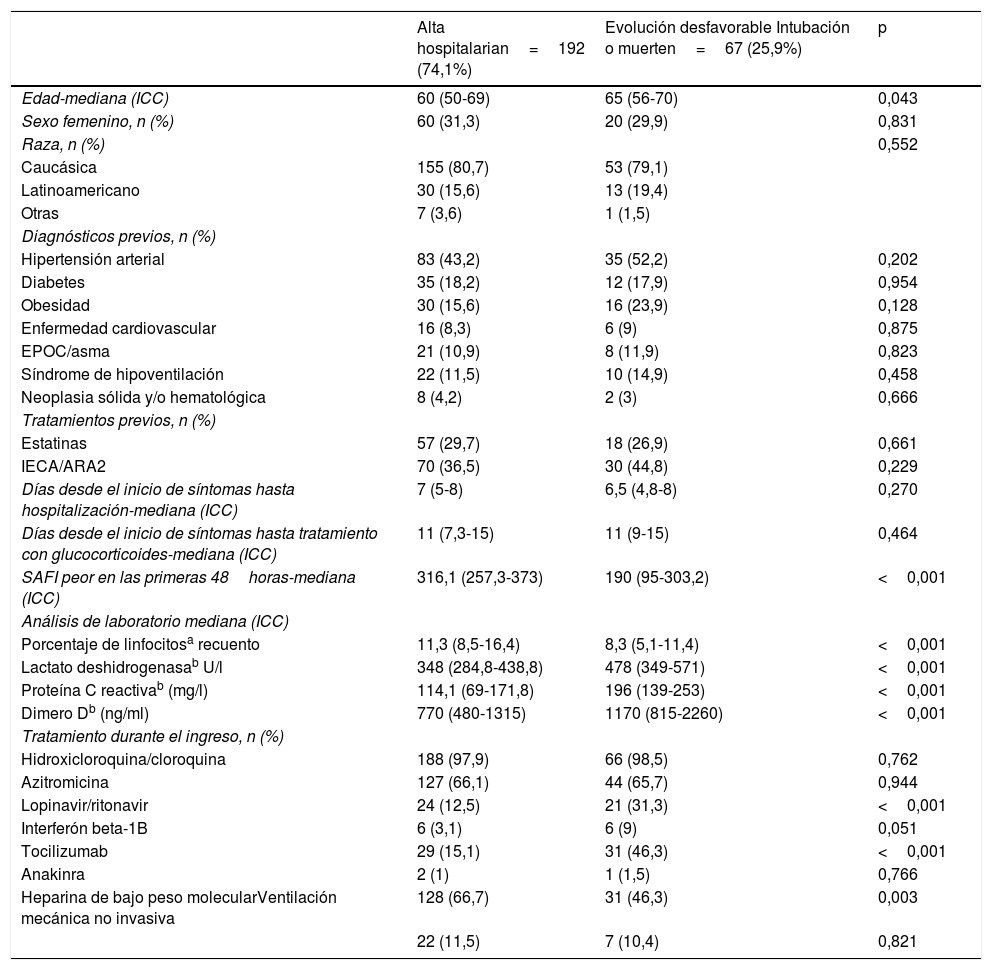
De los 259 pacientes incorporados al estudio, 67 (25,9%) tuvieron una evolución definida como desfavorable. Estos tenían un SAFI y porcentajes de linfocitos más bajos y valores más elevados de dímero D, LDH y PCR (tabla 2). Además, estos pacientes recibieron más tratamiento con lopinavir-ritonavir, interferón beta 1-B y tocilizumab que los pacientes con evolución favorable. Por otro lado, los pacientes con evolución desfavorable tenían pautada HBPM con menos frecuencia.
Factores asociados con evolución desfavorable (ingreso en UCI o fallecimiento)
| Alta hospitalarian=192 (74,1%) | Evolución desfavorable Intubación o muerten=67 (25,9%) | p | |
|---|---|---|---|
| Edad-mediana (ICC) | 60 (50-69) | 65 (56-70) | 0,043 |
| Sexo femenino, n (%) | 60 (31,3) | 20 (29,9) | 0,831 |
| Raza, n (%) | 0,552 | ||
| Caucásica | 155 (80,7) | 53 (79,1) | |
| Latinoamericano | 30 (15,6) | 13 (19,4) | |
| Otras | 7 (3,6) | 1 (1,5) | |
| Diagnósticos previos, n (%) | |||
| Hipertensión arterial | 83 (43,2) | 35 (52,2) | 0,202 |
| Diabetes | 35 (18,2) | 12 (17,9) | 0,954 |
| Obesidad | 30 (15,6) | 16 (23,9) | 0,128 |
| Enfermedad cardiovascular | 16 (8,3) | 6 (9) | 0,875 |
| EPOC/asma | 21 (10,9) | 8 (11,9) | 0,823 |
| Síndrome de hipoventilación | 22 (11,5) | 10 (14,9) | 0,458 |
| Neoplasia sólida y/o hematológica | 8 (4,2) | 2 (3) | 0,666 |
| Tratamientos previos, n (%) | |||
| Estatinas | 57 (29,7) | 18 (26,9) | 0,661 |
| IECA/ARA2 | 70 (36,5) | 30 (44,8) | 0,229 |
| Días desde el inicio de síntomas hasta hospitalización-mediana (ICC) | 7 (5-8) | 6,5 (4,8-8) | 0,270 |
| Días desde el inicio de síntomas hasta tratamiento con glucocorticoides-mediana (ICC) | 11 (7,3-15) | 11 (9-15) | 0,464 |
| SAFI peor en las primeras 48horas-mediana (ICC) | 316,1 (257,3-373) | 190 (95-303,2) | <0,001 |
| Análisis de laboratorio mediana (ICC) | |||
| Porcentaje de linfocitosa recuento | 11,3 (8,5-16,4) | 8,3 (5,1-11,4) | <0,001 |
| Lactato deshidrogenasab U/l | 348 (284,8-438,8) | 478 (349-571) | <0,001 |
| Proteína C reactivab (mg/l) | 114,1 (69-171,8) | 196 (139-253) | <0,001 |
| Dimero Db (ng/ml) | 770 (480-1315) | 1170 (815-2260) | <0,001 |
| Tratamiento durante el ingreso, n (%) | |||
| Hidroxicloroquina/cloroquina | 188 (97,9) | 66 (98,5) | 0,762 |
| Azitromicina | 127 (66,1) | 44 (65,7) | 0,944 |
| Lopinavir/ritonavir | 24 (12,5) | 21 (31,3) | <0,001 |
| Interferón beta-1B | 6 (3,1) | 6 (9) | 0,051 |
| Tocilizumab | 29 (15,1) | 31 (46,3) | <0,001 |
| Anakinra | 2 (1) | 1 (1,5) | 0,766 |
| Heparina de bajo peso molecularVentilación mecánica no invasiva | 128 (66,7) | 31 (46,3) | 0,003 |
| 22 (11,5) | 7 (10,4) | 0,821 |
Enfermedad cardiovascular: fibrilación auricular crónica y/o cardiopatía isquémica y/o insuficiencia cardiaca; ICC: intervalo intercuantílico; SAFI: cociente entre saturación de oxígeno y fracción inspiratoria de oxígeno.
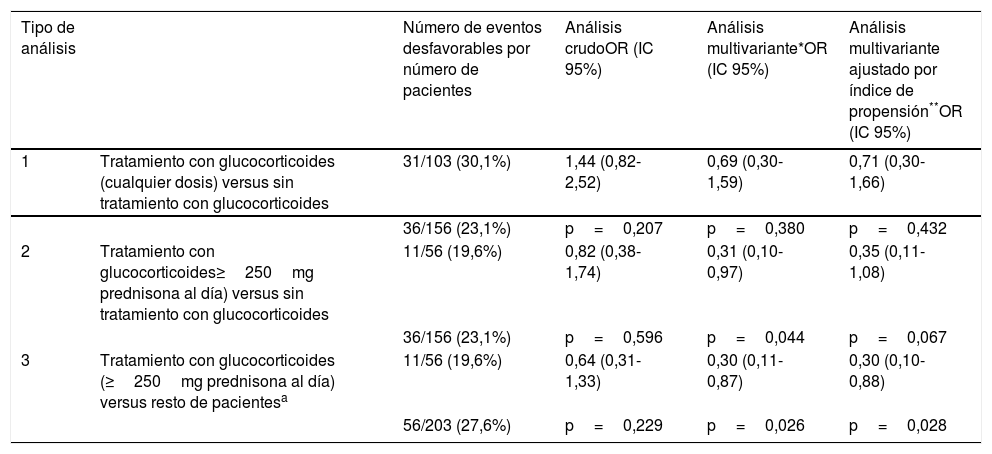
En cuanto al uso de glucocorticoides y la asociación con una evolución desfavorable, el análisis crudo no encontró diferencias significativas entre el uso de dosis altas de glucocorticoides y el no recibir glucocorticoides, aunque sí hubo diferencias significativas respecto al grupo de pacientes tratados con dosis más bajas de glucocorticoides, presentando este último grupo una evolución desfavorable hasta del 42,6% (tabla 1).
En el análisis multivariante (tabla 3) se demostró un efecto beneficioso del uso de dosis altas de glucocorticoides (grupo 3) respecto a los pacientes no tratados con glucocorticoides y a los pacientes tratados con dosis más bajas de corticoides (grupo 2). Esta asociación fue estadísticamente significativa, aunque se perdió la significación estadística cuando se comparaba únicamente con el grupo que no había recibido tratamiento con corticoides, y se ajustaba con el índice de propensión como covariante.
Análisis comparativos entre diferentes tratamientos con o sin glucocorticoides y la asociación con eventos desfavorables (ingreso en UCI o fallecimiento)
| Tipo de análisis | Número de eventos desfavorables por número de pacientes | Análisis crudoOR (IC 95%) | Análisis multivariante*OR (IC 95%) | Análisis multivariante ajustado por índice de propensión**OR (IC 95%) | |
|---|---|---|---|---|---|
| 1 | Tratamiento con glucocorticoides (cualquier dosis) versus sin tratamiento con glucocorticoides | 31/103 (30,1%) | 1,44 (0,82-2,52) | 0,69 (0,30-1,59) | 0,71 (0,30-1,66) |
| 36/156 (23,1%) | p=0,207 | p=0,380 | p=0,432 | ||
| 2 | Tratamiento con glucocorticoides≥250mg prednisona al día) versus sin tratamiento con glucocorticoides | 11/56 (19,6%) | 0,82 (0,38-1,74) | 0,31 (0,10-0,97) | 0,35 (0,11-1,08) |
| 36/156 (23,1%) | p=0,596 | p=0,044 | p=0,067 | ||
| 3 | Tratamiento con glucocorticoides (≥250mg prednisona al día) versus resto de pacientesa | 11/56 (19,6%) | 0,64 (0,31-1,33) | 0,30 (0,11-0,87) | 0,30 (0,10-0,88) |
| 56/203 (27,6%) | p=0,229 | p=0,026 | p=0,028 |
Ajustado a la edad cociente entre saturación de oxígeno y fracción inspiratoria de oxígeno (SAFI) peor en las primeras 48horas, porcentaje de linfocitos más bajo en las primeras 48horas, PCR más alta en las primeras 48horas, LDH más alta en las primeras 48horas, tratamiento con lopinavir/ritonavir, tratamiento con tocilizumab y tratamiento con heparina de bajo peso molecular.
Análisis multivariante ajustado a las mismas variables descritas anteriormente más el índice de propensión de cada pauta de glucocorticoides especificada en cada tipo de análisis. El análisis para calcular el índice de propensión incluía las variables: edad, SAFI más bajo en las primeras 48horas, porcentaje más bajo de linfocitos en las primeras 48horas, valores más altos de PCR en las primeras 48horas, valores más altos de LDH en las primeras 48horas, tratamiento con azitromicina, tratamiento con interferón beta 1B (excepto en el análisis 2), tratamiento con tocilizumab, tratamiento con anakinra, tratamiento con heparinas de bajo peso molecular, uso de ventilación no invasiva y antecedentes de asma (excepto en el análisis 2).
El análisis multivariante no incluyó 6 pacientes por no tener valores de LDH. Eran 6 pacientes que no habían recibido glucocorticoides y que habían tenido una evolución favorable. Tampoco se incluyó la variable del dímero D, pues no estaba recogida en 14 pacientes. Había una correlación entre los valores de dímero D y el porcentaje de linfocitos (índice de correlación de Pearson de –0,130, con una p=0,042) y los valores de PCR (índice de correlación de Pearson de 0,200, con una p=0,002).
DiscusiónLos resultados de este estudio orientan a que los pacientes con neumonía grave por SARS-CoV-2 tratados con pulsos de glucocorticoides, con dosis equivalentes de prednisona mayor o igual a 250mg, tienen una evolución más favorable que los pacientes tratados con dosis más bajas de glucocorticoides, o que los que no recibieron tratamiento con glucocorticoides (tabla 3). Esta evolución favorable no se objetivaba en el análisis crudo, pero sí cuando se ajustaba a otras variables como las asociadas a más gravedad como edad, SAFI, porcentaje de linfocitos, dímero D, LDH y PCR. En la misma línea que los resultados de nuestro estudio están los reportados por Calleja et al.13, que analizaron la evolución de los pacientes tratados con dosis altas de glucocorticoides (>250mg de metilprednisolona) asociados o no a tocilizumab, encontrando una tendencia a la disminución de los fallecimientos y de la intubación cuando asociaban ambos fármacos.
Esta evolución favorable no la hemos encontrado con dosis de glucocorticoides más bajas, como se ha evidenciado en otros trabajos. Recientemente se han comunicado los resultados del ensayo clínico RECOVERY14, que comparaba el tratamiento con dosis de dexametasona de 6mg al día, durante 10 días, frente al tratamiento estándar, y donde encontraron una disminución de la mortalidad a los 28 días (21,5% vs. 25%), siendo esta más evidente en los pacientes sometidos a ventilación mecánica invasiva (29% vs. 40,7%).
Una posible explicación de la ausencia de beneficio del uso de glucocorticoides con dosis más bajas en nuestro estudio podría ser por las características de estos pacientes, pues este grupo tenía menor porcentaje de uso de HBPM (tabla 1), especialmente teniendo en cuenta que hasta casi un 78% de los pacientes sin HBPM en este grupo tuvieron una evolución desfavorable (tabla 1). Este hecho pudiera significar un papel importante de la enfermedad tromboembólica no diagnosticada ni tratada como causa de evolución desfavorable en este grupo18–22. En este sentido cabe preguntarse si el utilizar dosis más bajas de glucocorticoides pudiera tener un menor efecto antiinflamatorio y, por tanto, favorecer más el desarrollo de enfermedad tromboembólica, sobre todo en este grupo de pacientes que tenían marcadores peores de severidad (SAFI y porcentaje de linfocitos más bajos y valores más altos de dímero D, PCR y LDH). Una hipótesis sería que las dosis de prednisona menores de 250mg no activarían plenamente la vía de acción de los glucocorticoides denominada no genómica17, actuando solo sobre la vía genómica, pudiendo disminuir su efecto sobre la tormenta de citocinas. Por otro lado, se debe tener en cuenta que el mecanismo de acción por vía no genómica es más rápido y podría tener otros efectos, como la inhibición de la agregación plaquetaria23, que pudieran influir en la evolución de los pacientes con neumonía severa por SARS-CoV-2.
El grupo 1 (pacientes no tratados con glucocorticoides) presentaba el porcentaje más bajo de tratamiento con HBPM, si bien se trataba de pacientes menos graves (SAFI y porcentaje de linfocitos más altos y valores más bajos de dímero D, PCR y LDH). Probablemente en este grupo tenga menos relevancia la ausencia de tratamiento con HBPM, ya que un 26,7% de los pacientes sin tratamiento con HBPM en este grupo tuvo una evolución desfavorable, frente a un 77,8% del grupo 2 y un 28,6% del grupo 3 (tabla 1). El hecho de que se incorporen en el estudio los primeros pacientes atendidos por COVID-19 en nuestro hospital pudiera explicar el porcentaje alto de pacientes sin tratamiento con HBPM, ya que en ese momento no estaba protocolizado el tratamiento con HBPM en estos pacientes.
Por otro lado, destacar que los pacientes tratados con glucocorticoides en nuestro estudio tenían una mayor estancia hospitalaria respecto a los pacientes no tratados con ellos, resultado que difiere de otras publicaciones, que demostraron beneficios con dichos fármacos. Este hecho lo interpretamos como un marcador de mayor gravedad de estos pacientes, al igual que el valor más bajo de SAFI y porcentaje de linfocitos o valores más altos de dímero D, LDH y PCR, incluso el mayor uso de ventilación mecánica no invasiva en estos pacientes. Una hipótesis sería que, al no estar protocolizado el uso de glucocorticoides, los pacientes más graves recibieron tratamiento con glucocorticoides, incluso más tarde de lo que muchos autores recomiendan. Fadel et al. demostraron reducción de la estancia hospitalaria en los pacientes tratados con glucocorticoides cuando se les administraban de una manera precoz8.
Las limitaciones de nuestro trabajo, aparte de tratarse de un estudio unicéntrico, son las inherentes a los estudios de cohortes retrospectivas, al comparar grupos no totalmente homogéneos. Para intentar minimizar estos sesgos el modelo se ajustó a los índices de propensión de recibir tratamiento con glucocorticoides. Como hemos comentado previamente los pacientes que se trataron con glucocorticoides tenían marcadores de mayor gravedad. El ajuste se realizó utilizando el índice de propensión como covariable en el modelo de regresión logística para el desarrollo de eventos desfavorables. No utilizamos otros métodos como el emparejamiento o la estratificación por el tamaño de muestra pequeño de nuestro estudio. No obstante, hay que tener en cuenta la limitación fundamental que tiene el ajuste mediante el índice de propensión, y es que solo ajusta a las variables registradas. En este sentido, hay variables no registradas en nuestros datos que pudieron influir a la hora de pautar o no glucocorticoides, como son la evolución de la disnea durante el ingreso o del SAFI o la radiografía de tórax después de las 48horas de ingreso, u otras variables muy difíciles de registrar, como la valoración subjetiva del médico.
Este estudio orienta a un efecto beneficioso de los glucocorticoides a dosis equivalentes de prednisona>250mg en los pacientes con neumonía grave por SARS-CoV-2, pero son necesarios más ensayos clínicos que estudien el efecto de los glucocorticoides en estos pacientes, y determinen tanto la dosis idónea de glucocorticoides como el momento de inicio más adecuado. A día de la redacción de este estudio hay en marcha muchos ensayos clínicos que valoran el efecto de otros inmunomoduladores en los pacientes con COVID-19 severa, pero no hay que olvidar que estos fármacos son más caros que los glucocorticoides, e incluso pudieran tener problemas de abastecimiento en el caso de que aumentara la demanda en otras oleadas de la pandemia actual.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses relacionado directamente o indirectamente con los contenidos del manuscrito.
D. Arranz, R. Beltrán, R. Cadenas, C. Casanova, J.A. de Boer, R. del Valle, G. García, B. Iglesias, A. Lung, O. Madridano, M. Martín, M. Merino, M. Moral, S. Muñoz, M. Neira, B. Núñez, I. Perales, A. Pérez, M. Reche, T. Reinoso, J.M. Rizo, C. Sánchez, M. Sereno y T. Valbuena.