El tabaquismo influye en el control glucémico de las personas con diabetes tipo1 (DM1); sin embargo, su impacto en la era de la monitorización continua de glucosa (MCG) no ha sido suficientemente estudiado.
Material y métodosSe realizó un estudio de cohortes retrospectivo de dos centros con 405 pacientes con DM1, tratados con múltiples dosis de insulina y usuarios de MCG, emparejados por puntajes por propensión según características sociodemográficas y clínicas. Se analizaron los niveles de HbA1c antes y después de un seguimiento de 2,2años. El análisis se realizó mediante modelos de regresión lineal mixta y logística condicional multivariable.
ResultadosLa muestra incluyó 135 fumadores y 270 no fumadores, con una edad media de 47,6años; el 50,1% eran mujeres. Ambos grupos comenzaron con una HbA1c similar de 8,0 (1,5%). Tras el seguimiento, los no fumadores redujeron su HbA1c a 7,3 (1,1%), mientras que los fumadores solo a 7,7 (1,3%), IC95% [−0,57-0,10] La proporción de no fumadores con HbA1c <7% aumentó de 25% a 38,1%, IC95% [0,14-0,36], mientras que los fumadores permanecieron sin cambios (25,9%; IC95% [−0,13-0,21]). El tabaquismo se asoció de manera independiente con un mayor riesgo de no alcanzar HbA1c<7%, a pesar del uso de MCG (odds ratio 1,89; IC95% [1,13-3,17].
ConclusiónEl tabaquismo limita los beneficios del uso de MCG en el control glucémico de personas con DM1. Es esencial incluir a fumadores en ensayos clínicos y desarrollar estrategias para desalentar el tabaquismo en esta población, con el fin de maximizar los beneficios de la tecnología en diabetes.
Smoking affects glycemic control in individuals with type1 diabetes (T1D); however, its impact in the era of continuous glucose monitoring (CGM) has not been thoroughly studied.
Materials and methodsA retrospective cohort study was conducted at two centers, involving 405 T1D patients treated with multiple daily insulin injections and using CGM. The patients were matched using propensity scores based on sociodemographic and clinical characteristics. HbA1c levels were analyzed before and after a 2.2-year follow-up period. The analysis was performed using mixed linear regression and multivariable conditional logistic models.
ResultsThe sample included 135 smokers and 270 non-smokers, with a mean age of 47.6years, and 50.1% were women. Both groups had a similar baseline HbA1c of 8.0 (1.5%). After follow-up, non-smokers reduced their HbA1c to 7.3 (1.1%), while smokers only reduced it to 7.7 (1.3%), 95%CI [−0,57-0,10]). The proportion of non-smokers achieving HbA1c<7% increased from 25% to 38.1%, 95%CI [0,14-0.36], whereas smokers showed no change (25.9%, 95%CI [−0.13-0.21]). Smoking was independently associated with a higher risk of not achieving HbA1c<7%, despite CGM use (odds ratio 1.89, 95%CI [1.13-3.17].
ConclusionSmoking limits the glycemic control benefits of CGM in individuals with T1D. It is crucial to include smokers in clinical trials and to develop strategies to discourage smoking in this population to maximize the benefits of diabetes technology.
La diabetes tipo 1 (DM1) es una enfermedad crónica caracterizada por la destrucción autoinmune de las células beta pancreáticas, lo que conduce a una deficiencia absoluta de insulina. Esta condición requiere un manejo meticuloso del control glucémico para prevenir complicaciones a largo plazo. Uno de los principales indicadores del control glucémico es la hemoglobina glucosilada A1c (HbA1c), que refleja los niveles promedio de glucosa en sangre durante los últimos dos a tres meses. Un control adecuado de la HbA1c se asocia con una reducción en el riesgo de complicaciones microvasculares, como la retinopatía, la nefropatía y la neuropatía diabética1.
A pesar de la importancia del control glucémico en la prevención de complicaciones, no todos los factores que afectan los niveles de HbA1c están completamente comprendidos. El tabaquismo, un hábito conocido por su impacto negativo en la salud general, ha sido identificado como un factor que podría influir en el control glucémico2. Sin embargo, su impacto específico en la HbA1c de personas con DM1 ha sido menos estudiado, especialmente en la era moderna de la monitorización continua de glucosa (MCG). La tecnología MCG ha revolucionado el manejo de la diabetes al proporcionar datos en tiempo real sobre las fluctuaciones glucémicas, lo que permite ajustes más precisos en la terapia con insulina, logrando mejorías en el control glucémico tanto en ensayos clínicos aleatorizados3-5 como en estudios en vida real6,7.
Estudios previos han sugerido que el tabaquismo podría estar asociado con un control glucémico subóptimo en personas con DM1. Se ha propuesto que el tabaquismo podría aumentar la resistencia a la insulina8 y agravar el estrés oxidativo9, factores ambos que podrían contribuir a un aumento de la HbA1c. No obstante, estos estudios a menudo no han controlado adecuadamente los factores de confusión, lo que deja espacio para la incertidumbre sobre la magnitud real del impacto del tabaquismo en los niveles de HbA1c en esta población.
El objetivo de este estudio es evaluar el impacto del tabaquismo activo en los niveles de HbA1c en personas con DM1 a las que se coloca un dispositivo MCG, y determinar si existen diferencias en la probabilidad de alcanzar una HbA1c dentro del rango objetivo de control en fumadores y no fumadores que utilizan un dispositivo de monitorización continua de glucosa.
Material y métodosSe realizó un estudio de cohortes retrospectivo de dos centros españoles que incluyeron personas adultas con DM1 tratadas con múltiples dosis de insulina y que utilizaban sensores MCG (FreeStyle Libre®, Abbott). Se excluyeron sujetos con otros tipos de diabetes; personas con un uso del sensor en el momento de la extracción de datos inferior al 70%, tal y como recomiendan los consensos internacionales10; personas de las que no se disponía de información clínica actualizada, y de las que no se disponía una HbA1c tras la colocación del sensor. La duración mediana del seguimiento fue de 2,2años [1,3-3,1]. Este estudio siguió las pautas de «Fortalecimiento de la presentación de informes de estudios observacionales en epidemiología» (STROBE)11 (material suplementario S1). El estudio fue aprobado por el Comité de Ética de Investigación del Hospital de La Princesa, Madrid (número de estudio: 5084-01/2023). La investigación se llevó a cabo de acuerdo con la Declaración de Helsinki.
ProcedimientosPrevio al inicio del uso del sensor, todos los pacientes recibieron una sesión de capacitación sobre el uso del sensor de acuerdo a las recomendaciones internacionales10. A todos los pacientes se les dieron instrucciones escritas sobre cómo utilizar los datos proporcionados por el sistema para realizar ajustes en tiempo real de las dosis de insulina y sobre el uso de la nube Libreview para revisar retrospectivamente los datos de glucosa para ajustar futuras dosis de insulina. A todos los pacientes se les indicó que ajustaran sus dosis de insulina y el tratamiento de la hipoglucemia de acuerdo con sus perfiles y tendencias de glucosa.
Recopilación de datosLos datos que incluían características sociodemográficas y clínicas, así como pruebas de laboratorio y medicación farmacológica para la DM1, se obtuvieron de las historias clínicas electrónicas. Se definió como tabaquismo fumar al menos un cigarrillo, puro o pipa por día12 (excluidos los cigarrillos electrónicos). Se consideró exfumador aquel paciente que previamente cumplía con estos criterios, pero que ya no lo hacía al momento del estudio. Las variables sociodemográficas y clínicas recopiladas incluyeron sexo, edad, duración de la diabetes mellitus, índice de masa corporal (IMC), HbA1c basal (inmediatamente antes de la colocación del sensor), última HbA1c disponible y tiempo como usuario del sistema MCG. La hemoglobina glucosilada se midió de forma rutinaria mediante cromatografía líquida (ADAMS A1c HA8180V ARKRAY®). Las métricas de glucosa se recuperaron de la plataforma Libreview utilizando el dispositivo FreeStyle 2 (FreeStyle Libre2®, Abbott) en intervalos de 14días. Se recopilaron las siguientes variables: tiempo en rango, tiempo por debajo <70mg/dl y tiempo por encima del rango, glucemia >180mg/dl y >250mg/dl, número de lecturas diarias y coeficiente de variación de glucosa.
Nivel socioeconómico (NSE): índice de privación e ingreso neto anual medio por personaEl status socioeconómico en España se evaluó mediante el índice de privación para todo el territorio español según sección censal, 202113. Combina información sobre las siguientes variables para cada sección censal: población trabajadora manual, población asalariada ocasional, desempleo, personas de 16 y más años y de 16 a 29años con educación insuficiente y hogares principales sin acceso a Internet.
Análisis estadísticoDespués de evaluar la plausibilidad de los valores atípicos, se evaluó el ajuste a la distribución normal empleando métodos estadísticos (prueba de Kolmogorov-Smirnov) y enfoques gráficos (gráfico de probabilidad normal). Las variables continuas que se ajustan a la distribución normal se expresan como media y desviación estándar (DE), mientras que las variables que no se distribuyen normalmente se presentan como mediana y percentiles 25 a 75 (p25-p75). Las variables categóricas se informan como recuentos y porcentajes de la muestra.
Para abordar la falta de aleatorización entre los grupos de estudio y minimizar el sesgo de confusión se utilizó el método de emparejamiento por puntaje de propensión del vecino más cercano en una proporción 1:2 (con un ancho de calibre de 0,05 veces la DE del puntaje de propensión logit) para estimar el efecto del tabaquismo en la consecución de niveles de HbA1c por debajo del 7%14. Los puntajes de propensión al tabaquismo se calcularon mediante un modelo de regresión logística, incorporando variables relevantes y de uso en práctica clínica habitual en diabetes: edad, sexo, duración de la diabetes, presencia de retinopatía y nefropatía diabética, HbA1c, IMC, dosis de insulina/kg/día e índice de privación. Este enfoque permitió equilibrar la probabilidad de fumar entre individuos con características basales muy similares, logrando así estudiar el efecto del tabaquismo con un sesgo mínimo.
El resultado primario tuvo como objetivo verificar el cambio de HbA1c tras la colocación del sistema MCG en el grupo de fumadores y el grupo control. Se realizó un análisis por medio de un modelo de regresión lineal mixta con las cifras de HbA1c como variable dependiente y con el grupo de fumadores, la interacción entre el tiempo transcurrido y el tabaquismo y el número de lecturas del sensor y el tiempo como usuario de sistema MCG como efectos fijos y la terna de emparejamiento como un efecto aleatorio.
Para el estudio de los resultados secundarios, que era alcanzar HbA1c objetivo <7%, se llevó a cabo un modelo de regresión logística condicional para datos emparejados; incluyendo adicionalmente el tiempo como usuario del sensor y el número de lecturas diarias del sensor como covariables.
El análisis estadístico se realizó utilizando la versión R 4.0.3 y el software estadístico STATA 17.0. BE-Basic Edition (Lakeway Drive, College Station, TX, EE.UU.). La significación estadística se estableció en p<0,05; sin embargo, no se ha utilizado de forma sistemática, priorizando el uso del intervalo de confianza (IC) del 95% a lo largo del texto, de acuerdo con las recomendaciones internacionales15.
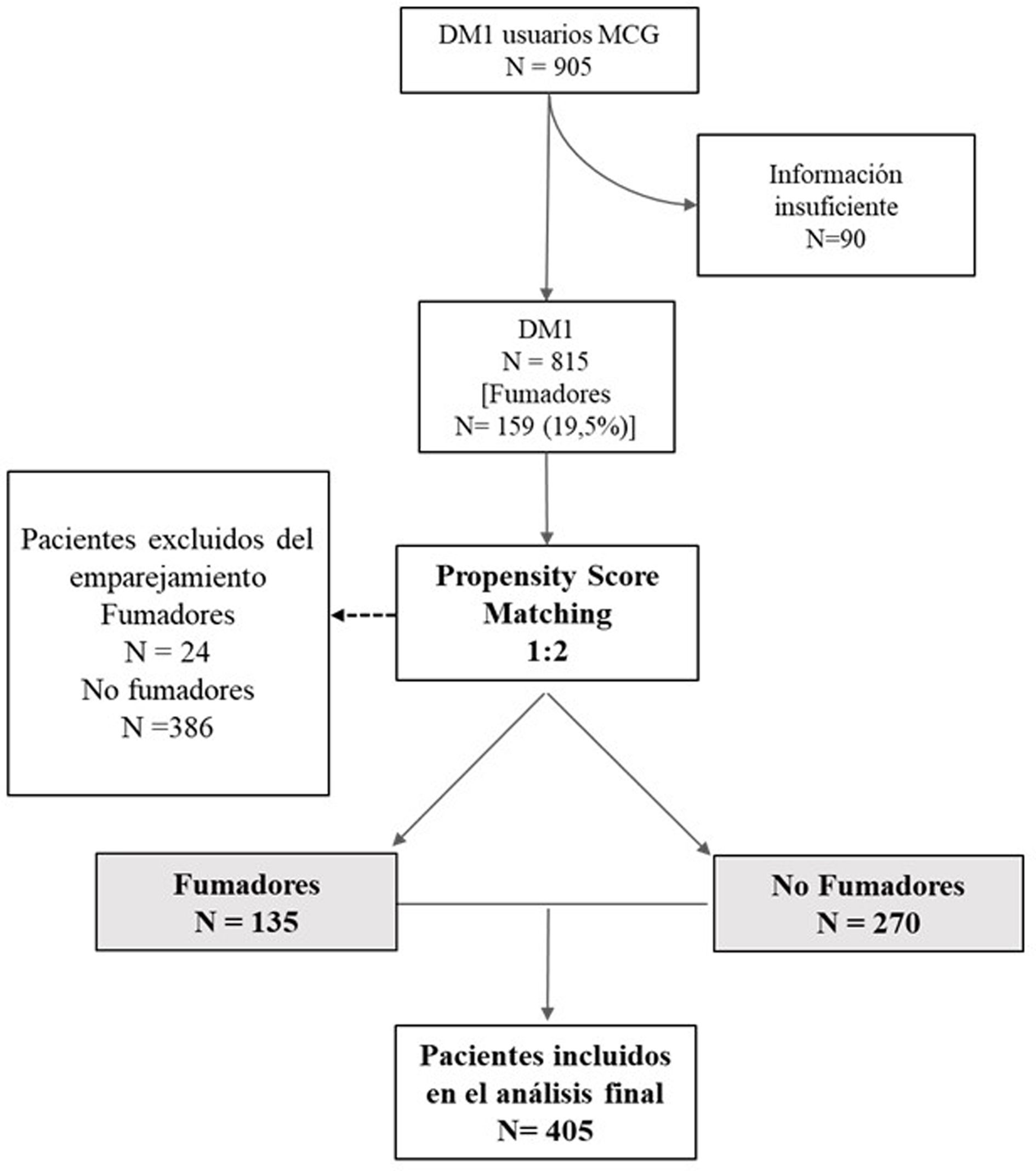
ResultadosA fecha de diciembre de 2022 se analizaron retrospectivamente las historias clínicas de 905 personas con DM1 usuarias de sistemas MCG FreeStyle Libre2, recogiendo datos clínicos basales en el momento de la colocación del dispositivo MCG (HbA1c incluida) y la HbA1c en el momento de la extracción de los datos.
De la cohorte inicial se eliminaron 90 individuos de los que no se disponía de las características basales necesarias para ser incluidos en el análisis. De un total de 815 pacientes elegibles, tras realizar el emparejamiento por puntajes propensión a razón de fumador 1:2 no fumadores, se obtuvo una muestra final bien compensada (material suplementario S2) de 405 pacientes, siendo 135 fumadores y 270 no fumadores (48 de los cuales eran exfumadores). En la figura 1 se muestra el diagrama de flujo.
La edad media fue de 47,6 (17,7) años, siendo mujeres 203 (50,1%). La duración de la diabetes fue de 19,1 (12,5) años; 126 sujetos (31,1%) tenían retinopatía diabética y 56 (14,9%), nefropatía diabética. La HbA1c previa a la colocación del sensor era de 8,0% (1,5) y el IMC de 25,7 (7,4) kg/m2. No se observaron diferencias en las variables basales entre el grupo de fumadores y el de no fumadores, tal y como se muestra en la tabla 1.
Características basales de la muestra
| Totaln=405 | No fumadorn=270 | Fumadorn=135 | IC 95% | |
|---|---|---|---|---|
| Edad (años) | 47, 6 (17,7) | 47,8 (16,5) | 47,1 (13,9) | [−2,40 a 4,02] |
| Sexo (mujer) | 203 (50,1%) | 138 (51,1%) | 65 (48,2%) | [−0,07 a 0,13] |
| Tiempo de evolución (años) | 19,1 (12,5) | 19,1 (12,7) | 19,0 (12,0) | [−2,48 a 2,69] |
| Retinopatía diabética (%) | 126 (31,1%) | 87 (32,2%) | 39 (28,9%) | [−0,13 a 0,06] |
| Nefropatía diabética (%) | 56 (14,9%) | 35 (14,0%) | 21 (16,7%) | [−0,05 a 0,10] |
| HbA1c basal (%) | 8,0 (1,5) | 8,0 (1,6) | 7,9 (1,3) | [−0,20 a 0,43] |
| IMC (kg/m2) | 25,7 (7,4) | 25,8 (4,3) | 25,6 (11,2) | [−1,40 a 1,66] |
| Dosis de Insulina (UI/kg/día) | 0,64 (0,26) | 0,63 (0,27) | 0,65 (0,24) | [−0,08 a 0,03] |
| Índice de Privación (pts) | −0,93 (0,80) | −0,969 (0,80) | −0,877 (0,78) | [−0,27 a 0,06] |
IC 95%: intervalo de confianza al 95% de las diferencias entre el grupo fumador y no fumador.
Variables basales y estratificadas en el grupo de fumadores y no fumadores.
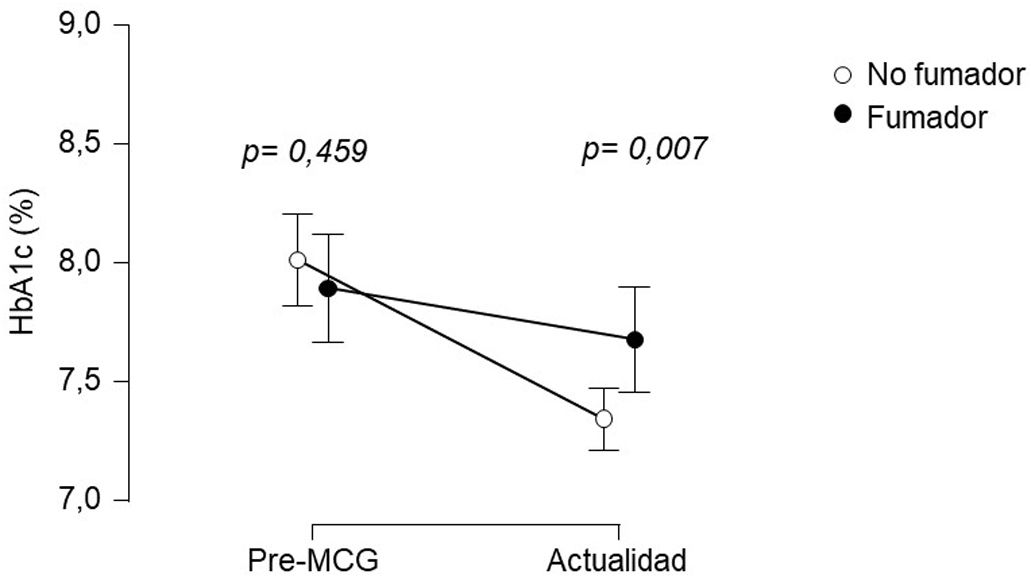
Se evaluó la HbA1c después de un seguimiento de 2,2años [1,3-3,1] tras la colocación del dispositivo MCG. Antes de la colocación del sensor, los niveles de HbA1c eran de 7,9 (1,3%) en el grupo de fumadores y de 8,0 (1,6%) en el grupo de no fumadores, sin diferencias entre ambos grupos (IC95% [−0,20 a 0,43]) Después de la colocación del sensor, la HbA1c fue de 7,7 (1,3%) en fumadores y de 7,3 (1,1%) en no fumadores (IC95% de la diferencia [−0,57 a 0,10]) La figura 2 ilustra la evolución de la HbA1c en ambos grupos. La mediana de lecturas diarias del sensor en el momento de la recogida de datos fue de 9 (6-14), sin diferencias entre fumadores: 9 (6-15) y no fumadores: 9 (6-14), IC95% [−1,9 a 1,9].
El modelo de regresión lineal mixta para datos longitudinales reveló que el tabaquismo limita la mejoría de la HbA1c tras la colocación del sensor. Se observó una reducción de la HbA1c del 0,66% IC95% [−0,89 a −0,44] tras la instalación del dispositivo, y que un mayor número de lecturas del sensor se asoció con un descenso más pronunciado de HbA1c (β=−0,02; IC95% [−0,03 a −0,01] por cada lectura diaria del sensor). No se detectó una influencia relevante del tiempo de uso del sensor en el cambio de HbA1c (β=0,01; IC95% [−0,05 a 0,08] por año de uso del sensor). Además, se observó una interacción entre el tabaquismo y la HbA1c (β=0,44; IC95% [0,06 a 0,82]), lo que indica que la evolución de la HbA1c difiere entre fumadores y no fumadores, siendo la reducción de HbA1c menos pronunciada en los fumadores.
La eficacia de la MCG en el grupo de exfumadores fue muy similar al de los nunca fumadores, como se muestra en material suplementario S3. Se analizaron también las métricas de glucosa obtenidas mediante la descarga de datos del sensor. En los no fumadores se observó un tiempo en rango 70-180mg/dl del 63% (53-73%), mientras que en los fumadores fue del 59% (47-70%), con un IC95% [−7,8 a −0,2]. El TAR >180mg/dl fue del 35% (24-46%) en fumadores y del 32% (22-43%) en no fumadores, con un IC95% [−1,7-7,7]. El TAR >250mg/dl mostró una leve tendencia a ser superior en fumadores (8% [4-19%]) en comparación con no fumadores (7% [3-14%]), con un IC95% [−1,7-3,7]. El tiempo por debajo de rango (<70mg/dl) fue similar entre fumadores (3% [2-7%]) y no fumadores (3% [1-7%]), con un IC95% [−0,99 a 0,99]. Tampoco se observaron diferencias relevantes en el coeficiente de variación entre fumadores (37,8% [33,2-42,8%]) y no fumadores (36,7% [32,1-41,4%]), con un IC95% [−0,72 a 2,92].
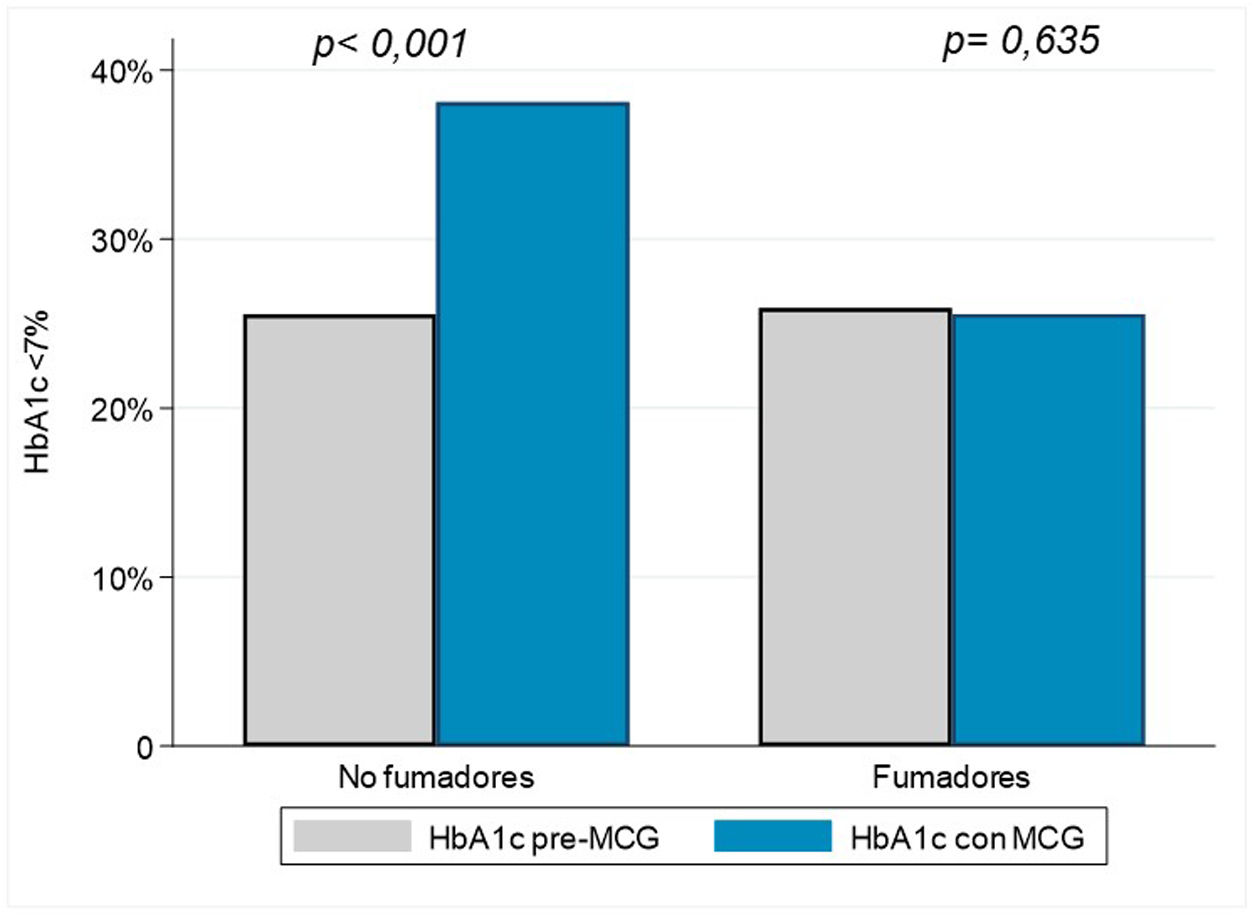
Objetivo de HbA1c <7% en fumadores y no fumadoresAntes de la colocación del dispositivo MCG la proporción de individuos con una HbA1c objetivo (<7%) era del 25,9% en fumadores y del 25,6% en no fumadores; IC95% [−0,09 a 0,09]. Tras la colocación del sensor, el 38,1% de los no fumadores tenían una HbA1c <7%, mientras que los fumadores permanecían en el 25,6%; IC95% [−0,21 a −0,03]. El cambio de proporción de sujetos dentro de la HbA1c <7% en no fumadores fue relevante (del 25,6% al 38,1%; IC95% [0,14-0,36]), sin observarse diferencias en los fumadores (25,9% previamente al sensor y 25,6% tras la colocación del sensor; IC95% [−0,13 a 0,21]). La figura 3 muestra las diferencias en lograr la HbA1c objetivo en fumadores y no fumadores.
Objetivo de control glucémico en fumadores y no fumadores tras la colocación de un sensor de glucosa. Se observa una proporción similar de sujetos con HbA1c <7% previamente a la colocación del sensor y una mejoría en los no fumadores que no se presenta en los fumadores.
DM1: diabetes tipo 1; MCG: monitorización continua de glucosa.
Adicionalmente se realizó un modelo de regresión logística condicional para datos emparejados que mostró que el tabaquismo se asoció con no lograr la HbA1c óptima ≥7%, odds ratio (OR) 1,89, IC95% [1,13-3,17], en un modelo ajustado por las lecturas diarias del sensor OR=0,93, IC95% [0,89-0,98], y el tiempo como usuario del sensor, IC95% [0,75-1,13].
DiscusiónEste estudio de cohortes emparejado por puntajes de propensión investigó el impacto del tabaquismo en los niveles de HbA1c en personas con DM1 que utilizan un dispositivo de MCG. Los resultados demostraron que el tabaquismo es un factor independiente que obstaculiza la mejora en el control glucémico que ofrecen los sistemas MCG.
La utilidad de los sistemas de monitorización de glucosa en el manejo de la DM es actualmente incuestionable5,16-18 .Se ha descrito una reducción de hasta el 0,6% en la HbA1c en pacientes con múltiples dosis de insulina en ensayos clínicos aleatorizados en comparación con los que utilizan glucemia capilar3,4. La mejoría de la hipoglucemia, que es una de las mayores preocupaciones de las personas con DM119, en base a las alarmas que estos dispositivos aportan, es otra de las grandes ventajas que ofrecen los sistemas MCG20. Sin embargo, a pesar de la evidencia que respalda el efecto beneficioso de la MCG en el control crónico de la DM, aspectos como el impacto del tabaquismo han sido poco explorados. En este sentido, los ensayos clínicos aleatorizados que han estudiado el impacto de la MCG en la HbA1c no incluyeron la variable tabaquismo en el análisis3,4 o tan solo contaron con una muestra de fumadores pequeña21, muy inferior a las cifras de cohortes en vida real, donde ronda el 20-25% de la población con DM122,23.
Nuestro trabajo aborda específicamente el impacto del tabaco en la HbA1c y muestra que fumar dificulta la mejoría de la HbA1c y el logro de objetivos glucémicos en un grupo de pacientes emparejados en función de sus características clínicas basales y socioeconómicas. Con nuestros datos se observa que la disminución de HbA1c del 0,7% en el grupo de no fumadores tras una mediana de 2,2años es clínicamente significativa y similar a otros trabajos3. En contraste, el grupo de fumadores no mostró una mejoría relevante: 7,9 (1,3%) previo al sensor y 7,7 (1,3%) con el sensor. Además, la proporción de pacientes con HbA1c <7% aumentó del 25% al 38,1% en los no fumadores, mientras que en los fumadores no hubo una mejora similar. El modelo multivariable, ajustado por lecturas diarias del sensor7 y tiempo de uso del dispositivo, indicó que el tabaquismo disminuye de forma independiente la probabilidad de alcanzar la HbA1c objetivo en usuarios de MCG.
Estos resultados son coherentes con otros estudios que asocian el tabaquismo con un peor control crónico de la DM124,25 y también en usuarios de dispositivos MCG26. Los mecanismos por los que el tabaquismo podría deteriorar el control glucémico y tener efectos en las personas con DM1 son diversos.
El consumo de tabaco tiene efectos importantes en la secreción hormonal. En cultivos celulares, se ha demostrado que la nicotina induce resistencia a la insulina en las células del músculo esquelético al activar mTOR8, que favorece el desarrollo de la diabetes tipo2 (DM2). Fumar empeora el control glucémico en personas ya diagnosticadas con DM2 y también en DM126. Además, fumar induce una secreción anormal de hormonas hipofisarias y contrarreguladoras en sujetos con diabetes27, lo cual puede contribuir a los mecanismos multicausales que inducen a una mayor hiperglucemia en personas con DM1 que fuman. Targher et al.28 demostraron que la eliminación total de glucosa se reducía notablemente en los sujetos fumadores, lo que llevó a la conclusión de que fumar cigarrillos agrava la resistencia a la insulina en personas con DM2. Aunque la resistencia a la insulina también es relevante en la DM129, la dosis de insulina diaria fue un criterio de ajuste en nuestro estudio, lo que sugiere que este factor estaba controlado en ambos grupos. El tabaco también se asocia con un estilo de vida menos saludable, como un menor consumo de frutas y verduras y una mayor ingesta de alcohol30, lo que podría contribuir a un peor control glucémico de forma adicional a su impacto directo sobre la glucosa.
Este estudio tiene varias limitaciones. A pesar de utilizar un diseño emparejado por puntajes de propensión bien equilibrados y con seguimiento en dos centros geográficamente distintos, su naturaleza retrospectiva limita la capacidad de extraer conclusiones causales, restringiéndolo al planteamiento de hipótesis. Además, como nuestras comparaciones no se basan en una asignación aleatoria, tenemos que reconocer que la incertidumbre es mayor que la reflejada por los intervalos de confianza del 95%. Por otro lado, no se cuantificó el consumo de tabaco ni se valoró de manera objetiva mediante métodos indirectos, como la medición de carboxihemoglobina, ni se registraron sus fluctuaciones durante el seguimiento, lo que podría haber influido en los resultados. Además, no se dispuso de más mediciones de HbA1c a lo largo del tiempo, lo que dificulta la extrapolación de tendencias temporales adicionales sobre el impacto del tabaco en el control glucémico. No se incluyeron variables clave para el control glucémico y su relación con el tabaquismo, como los hábitos dietéticos, la actividad física o los antecedentes de salud mental, lo que limita el análisis a factores clínicos y socioeconómicos. La posible existencia de variables no medidas que podrían influir tanto en la probabilidad de ser fumador como en el control glucémico representa una limitación importante. Aunque el análisis se ajustó por factores clave, como la edad, el sexo, la duración de la diabetes y las comorbilidades, la metodología de puntaje de propensión no puede controlar por variables no observadas o no medidas, lo cual podría afectar la solidez de los resultados obtenidos. Finalmente, no se incluyó a pacientes con DM2, lo que podría haber fortalecido las conclusiones del estudio.
En resumen, el tabaquismo es una variable que impacta negativamente en el control glucémico y puede obstaculizar los beneficios del uso de dispositivos MCG. Es recomendable incluir a pacientes fumadores en ensayos clínicos aleatorizados para evitar sesgos y plantear estrategias poblacionales que desalienten el tabaquismo en personas con diabetes, con el objetivo de maximizar los beneficios de la tecnología disponible.
FinanciaciónEste trabajo fue financiado por Proyectos de Investigación en Salud PI19/00584, PI22/01404 y PMP22/00021 (financiado por el Instituto de Salud CarlosIII), iTIRONET-P2022/BMD7379 (financiado por la Comunidad de Madrid) y cofinanciado por FEDER fondos a MM.
Aprobación ética y consentimiento para participarEste estudio se realizó de acuerdo con los principios de la Declaración de Helsinki. El Comité de Ética de Investigación del Hospital de La Princesa, Madrid (número de estudio: 5084-01/2023) aprobó este estudio y eximió del consentimiento informado a los pacientes. En vista de la naturaleza retrospectiva del estudio, todos los procedimientos que se realizaron fueron parte de la atención de rutina.
Contribución de los autoresTodos los autores han revisado y aprobado los datos, han contribuido al desarrollo y aprobación del manuscrito y han acordado la decisión de enviar el manuscrito para su publicación.
- 1.
Concepción y diseño del manuscrito: Fernando Sebastián-Valles.
- 2.
Recogida de datos: Juan José Raposo López, Maria Sara Tapia Sanchiz, Iñigo Hernando, Jon Garai y Victor Navas Moreno.
- 3.
Análisis de datos: Fernando Sebastián-Valles y Miguel Antonio Sampedro
- 4.
Redacción, revisión y aprobación del manuscrito remitido: José Alfonso Arranz Martín, Mónica Marazuela, Julia Martínez y Fernando Sebastián-Valles.
Ninguno.