El nuevo coronavirus (SARS-CoV-2) es el responsable de un síndrome respiratorio agudo severo (SARS). Entre sus manifestaciones puede desarrollar una enfermedad trombótica, tanto venosa como arterial, debido a la inflamación excesiva que afecta al sistema vascular, con activación plaquetaria y disfunción endotelial, entre otros mecanismos. La trombosis se asocia a la infección producida por el SARS- CoV-2, aumentando su gravedad y confiriendo un peor pronóstico. Nuestra actuación como Médicos de Familia puede aportar acciones importantes en el manejo y control de esta severa complicación. Teniendo en cuenta que muchos de nuestros pacientes ya reciben terapia antitrombótica o anticoagulante, el hecho de que puedan desarrollar una infección por COVID-19 tendrá implicaciones para la elección, la dosificación y el control en su tratamiento.
En este documento, revisamos, con la información actualmente disponible, la relación entre enfermedad producida por el SARS-CoV-2 y trombosis, así como su manejo con un enfoque centrado en Atención Primaria.
The new coronavirus (SARS-CoV-2) is responsible for a severe acute respiratory syndrome. Among its manifestations, it can develop a thrombotic disease, both venous and arterial, due to excessive inflammation that affects the vascular system, with platelet activation and endothelial dysfunction, among other mechanisms. Thrombosis is associated with SARS-CoV-2 infection, increasing its severity and conferring a worse prognosis. Our performance as Family Physicians can contribute important actions in the management and control of this severe complication. Considering that many of our patients already receive antithrombotic or anticoagulant therapy, the fact that they may develop a COVID-19 infection will have implications for the choice, dosage and control of their treatment.
In this document we review, with the information currently available, the relationship between disease caused by SARS-CoV-2 and thrombosis, as well as its management with a focus on Primary Care.
La pandemia de COVID-19 supone una urgencia sanitaria a nivel global debido a que provoca un importante colapso sanitario con aumento de la morbimortalidad e importantes consecuencias socioeconómicas en todo el mundo, con una mortalidad mayor de 550.000 personas y más de 12 millones de casos confirmados en la actualidad1.
El objetivo del documento, elaborado desde el Grupo de Trabajo de Vasculopatías de la Sociedad Española de Médicos de Atención Primaria (SEMERGEN), es presentar la información disponible con relación a la enfermedad tromboembólica venosa (ETEV) que puede ocurrir en la COVID-19, así como la valoración de tromboprofilaxis y el tratamiento si procede, con un enfoque centrado en la Atención Primaria.
AntecedentesLa enfermedad producida por coronavirus SARS-CoV-2 (COVID-19), si bien en la mayoría de los pacientes infectados cursa con síntomas leves, en casos más severos puede progresar rápidamente y desarrollar un síndrome de dificultad respiratoria aguda, shock séptico, coagulopatía y disfunción endotelial, que son los determinantes principales de la afectación microvascular, al producir una mayor vasoconstricción, isquemia orgánica, inflamación con edema tisular asociado y un estado procoagulante que predispone a la ETEV y arterial2.
La excesiva activación del sistema inmunitario causa una tormenta de citocinas y ocasiona daño del sistema microvascular, activando el sistema de coagulación e inhibiendo el de la fibrinólisis3. La coagulopatía que se produce conduce a trastornos generalizados de la microcirculación, contribuyendo así a la situación de fallo multiorgánico4.
Se ha observado que los niveles de antitrombina son menores en casos de COVID-19 y los niveles de dímero D y fibrinógeno son mayores que en la población general y casos más leves. Así, la progresión de la gravedad de la enfermedad va ligada a un aumento gradual del dímero D. Estos hallazgos apoyan la teoría del desarrollo de una coagulopatía en las infecciones producidas por SARS-CoV-2 y que, cuando esta ocurre, empeora el pronóstico3.
Aunque el mecanismo no está completamente establecido, hay varias causas que pueden contribuir a este fenómeno. La interleucina-6 (IL-6), entre otras interleucinas, desempeña un papel importante en la red de mediadores inflamatorios y puede causar trastornos de la coagulación a través de diversas vías, como la estimulación hepática para la síntesis de trombopoyetina y fibrinógeno, aumento de la expresión del factor de crecimiento endotelial vascular, expresión de los factores tisulares de los monocitos y la activación del sistema de coagulación extrínseco. La trombina generada, a su vez, puede inducir al endotelio vascular a producir más IL-6 y otras citocinas. La tormenta de citocinas y los trastornos de la coagulación, de este modo, se retroalimentan3-5.
Se ha observado asimismo una alteración de las plaquetas por 2vías diferentes: la primera, a través del daño directo mediante la activación del complemento, y la segunda, mediante un daño indirecto a causa de la invasión de las células madre hematopoyéticas de la médula ósea. Además, la inflamación y la hipoxia que se producen en los casos que cursan con neumonía son las causantes de la agregación plaquetaria y la trombosis, con un aumento de consumo de las plaquetas. Todos estos factores contribuyen a desencadenar el estado de hipercoagulabilidad que se observa en los casos de COVID-196-8.
El conocimiento preciso de la incidencia de complicaciones trombóticas en pacientes con COVID-19 es importante para la toma de decisiones con respecto a la intensidad de la tromboprofilaxis, debiendo ajustarse de forma individualizada al riesgo de cada paciente.
Zhou et al.9 realizaron un estudio de cohorte multicéntrico retrospectivo de 191 pacientes ingresados en hospitales de Wuhan con COVID-19 confirmado por laboratorio. La coagulopatía estaba presente en el 50% de los fallecidos, pero solo en el 7% de los que sobrevivían. La trombocitopenia fue un factor de mal pronóstico, al igual que en otros grupos de pacientes ingresados en cuidados intensivos.
Tang et al.10 observaron una elevación progresiva del dímero D en la cohorte estudiada (pacientes con COVID-19 confirmados ingresados con neumonía severa) donde el 71% de los fallecidos cumplieron con los criterios de la Sociedad Internacional de Trombosis y Hemostasia de coagulación intravascular diseminada (CID) en comparación con el 0,4% de los supervivientes. Los fallecidos tenían alteraciones significativas en la coagulación en el momento del ingreso, en comparación con los supervivientes, mostrando prolongación del tiempo de tromboplastina parcial activado, tiempo de protrombina, dímeros D elevados y productos de degradación de la fibrina. Los niveles de fibrinógeno se mantuvieron elevados, de acuerdo con una respuesta de fase aguda inicial, en lugar de la reducción que se observa comúnmente en la CID, principalmente después del séptimo día.
Klok et al.11 evaluaron la incidencia del resultado compuesto de embolia pulmonar aguda sintomática, trombosis venosa profunda, accidente cerebrovascular isquémico, infarto de miocardio o arteriopatía sistémica en todos los pacientes COVID-19 ingresados en 3 hospitales universitarios holandeses. Concluyeron que la incidencia del 31% de complicaciones trombóticas en pacientes de la Unidad de Cuidados Intensivos (UCI) con infecciones por COVID-19 era notablemente alta, por lo que reforzaban la recomendación de utilizar tromboprofilaxis farmacológica en todos los pacientes COVID-19 ingresados en la UCI, sugiriendo la utilización de dosis profilácticas altas para mayor beneficio.
Reflejaban asimismo que para la tromboembolia venosa (TEV) asociada al hospital (TEV que incluye el que ocurre en el hospital y hasta 90 días después del alta) fuera probable que los pacientes COVID-19 presentaran un mayor riesgo, especialmente si estaban inmovilizados en cuidados críticos.
El riesgo de ETEV en pacientes hospitalizados con COVID-19 es un problema en aumento12. La tasa de ETEV sintomática en pacientes hospitalizados con enfermedades médicas agudas (no quirúrgicas), como es el caso de los cuadros infecciosos, aumenta hasta el 10%. La inmovilización prolongada durante la enfermedad, la deshidratación, el estado inflamatorio agudo, la presencia de otros factores de riesgo cardiovascular, como la hipertensión arterial, la diabetes, el tabaquismo, la obesidad, el antecedente de enfermedad cardiovascular establecida, como la cardiopatía isquémica, accidente cerebrovascular o enfermedad arterial periférica, los antecedentes de ETEV y la trombofilia, son comorbilidades comunes en pacientes hospitalizados con COVID-19, pudiendo todo ello aumentar el riesgo de ETEV13.
Dado el riesgo protrombótico asociado a la COVID-19, se hace necesario plantear estrategias profilácticas o de tratamiento según el caso. Teniendo en cuenta las interacciones farmacológicas entre tratamientos antivirales y anticoagulantes orales directos, y la dificultad de mantener controles de International Normalized Ratio (INR) estables en pacientes que toman antagonistas de la vitamina K (AVK), cabe inclinarse por el uso de heparinas de bajo peso molecular (HBPM) o heparinas no fraccionadas (HNF) con o sin profilaxis mecánica14. Las HBPM son las más comúnmente utilizadas, presentando efecto antiinflamatorio, mayor biodisponibilidad y vida media más larga con menor variabilidad interindividual que la HNF, permitiendo su administración a dosis fijas.
El riesgo de ETEV debe ser evaluado en todos los pacientes COVID-19 debiendo indicarse prevención a los de alto riesgo, con base en las guías sobre tromboprofilaxis en pacientes médicos15 como refleja la guía National Institute for Health and Care Excellence (NICE) y la de la Sociedad Americana de Hematología (ASH)16.
RecomendacionesEl médico de Atención Primaria desempeña un papel fundamental17 en la prevención, el manejo y el seguimiento de la ETEV en los pacientes con COVID-19, sobre todo en las fases pre y post hospitalaria.
Aunque la evidencia científica actual y las características de los estudios publicados puedan suponer una limitación de cara a establecer recomendaciones en el ámbito extrahospitalario, dada la repercusión observada en el curso evolutivo de la COVID-19, y con relación a la trombosis, sugerimos la utilización de medidas de tromboprofilaxis en pacientes con COVID-19, en el marco de la Atención Primaria, de acuerdo con las siguientes valoraciones:
- 1.
Se debe realizar una evaluación individualizada del riesgo trombótico de la ETEV.
El riesgo trombótico viene definido por la presencia de factores de riesgo de ETEV y su cuantificación. Hay factores de riesgo relacionados con el padecimiento de la enfermedad infecciosa en sí (como es la elevación del dímero D, por ejemplo) y otros relacionados con las características del paciente y otras circunstancias concomitantes18.
Se consideran factores de mayor riesgo trombótico en pacientes con COVID-19, de acuerdo con la Sociedad Española de Trombosis y Hemostasia (SETH)19, los siguientes:
- ∘
Formas de COVID grave (aquellos con proteína C reactiva >150mg/l, dímero D> 1.500 ng/ml, ferritina>1.000 ng/ml, linfocitopenia <800×106/l).
- ∘
Dímero D> 3.000 ng/ml.
- ∘
Antecedentes familiares o personales de ETEV.
- ∘
Trombofilia conocida.
- ∘
Cirugía reciente.
- ∘
Gestación.
- ∘
Terapia hormonal sustitutiva.
No se dispone actualmente de una escala de valoración de riesgo trombótico validada específica para pacientes con COVID-19 a nivel ambulatorio. Si bien hay que tener en cuenta que la escala de Padua20 (tabla 1A) es la recomendada por la American College of Chest Physicians (ACCP) en la evaluación del riesgo de ETEV en pacientes hospitalizados con enfermedad médica aguda21. López et al.22 evaluaron la aplicabilidad en ámbito ambulatorio de las escalas disponibles para pacientes hospitalizados con enfermedad médica no quirúrgica, mostrando cómo el perfil de riesgo en pacientes ambulatorios no difiere de forma importante del observado en estudios en pacientes hospitalizados por enfermedad médica aguda (no quirúrgicos), concluyendo que las escalas validadas para la predicción de riesgo trombótico en pacientes hospitalizados por enfermedad médica aguda (no quirúrgicos) podrían ser utilizadas en pacientes ambulatorios en cualquier ámbito (Atención Primaria, hospitalaria y Urgencias), sobre todo la escala IMPROVE23 (tabla 1B). Algunos autores han modificado esta escala, introduciendo variables como el aumento de valores del dímero D (dímero D×2=2 puntos), con objeto de identificar mejor los pacientes de alto riesgo trombótico, si bien todavía no están validadas estas modificaciones24.
Tabla 1.Escalas de valoración del riesgo trombótico en pacientes con enfermedad médica
A. Factor de riesgo trombótico Puntuación Cáncer activo (con metástasis o tratados con quimio o radioterapia en los últimos 6 meses. 3 ETEV previa (se excluye la trombosis venosa superficial) 3 Movilidad reducida (reposo en cama pudiendo levantarse para ir al baño, durante al menos 3 días) 3 Trombofilia conocida (déficit de la antitrombina, déficit proteína C o S, factor Leiden, mutación G20210A de la protrombina, síndrome antifosfolípido 3 Cirugía o traumatismo reciente (≤ 1 mes) 2 Edad avanzada (≥ 70 años) 1 Insuficiencia cardíaca (NYHA III/IV) o respiratoria (reagudización) 1 IAM o ictus isquémico 1 Infección aguda grave o enfermedad reumatológica activa 1 Obesidad (IMC ≥ 30 kg/m2) 1 Tratamiento hormonal en curso 1 B. Factor de riesgo trombótico Puntuación HR ETEV previa (< 3 meses) 3 4,7 Trombofilia conocida 2 3,5 Parálisis MMII actual 2 3,0 Cáncer activo 2 2,8 Inmovilización ≥ 7 días (antes y durante el ingreso) 1 1,9 Ingreso en UCI o Unidad coronaria 1 1,8 Edad > 60 años 1 1,7 Tabla 1 A. Escala de Padua, predicción de riesgo trombótico en pacientes con enfermedad médica. Interpretación. Riesgo alto ≥ 4 puntos.
Tabla 1 B. Escala IMPROVE de valoración de riesgo trombótico. Interpretación. Riesgo alto: ≥ 2 puntos.
ETEV: enfermedad tromboembólica venosa; HR: hazard ratio; IAM: Infarto agudo de miocardio; MMII: miembros inferiores; NYHA: clasificación funcional de la New York Heart Association; UCI: Unidad de Cuidados Intensivos.
Tabla 1 A: modificada de Barbar et al.20.
Tabla 1 B: modificada de Spyropoulos et al.23.
El objetivo de valorar de forma individualizada el riesgo trombótico en pacientes con COVID-19 es establecer la necesidad de una profilaxis antitrombótica, con el método adecuado, a la dosis correcta.
- 2.
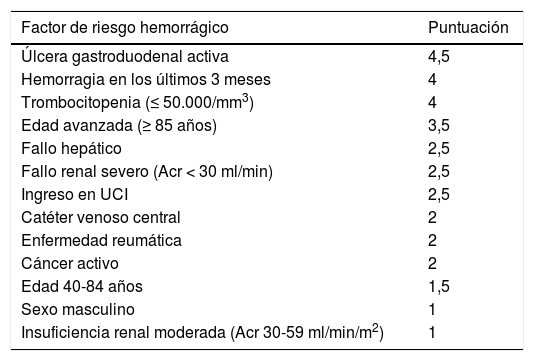
Se recomienda realizar una evaluación individualizada del riesgo hemorrágico con base en la escala IMPROVE25.
Al igual que ocurre con el apartado anterior, tampoco se ha definido una escala validada para valorar el riesgo hemorrágico en estos pacientes, por lo que tenemos que acudir a herramientas que nos orienten en esta acción. La ACCP recomienda utilizar la escala IMPROVE en la valoración del riesgo de sangrado en pacientes con enfermedad médica (tabla 2).
Tabla 2.Escala IMPROVE de evaluación del riesgo de sangrado. Valoración de riesgo (riesgo alto ≥ 7 puntos)
Factor de riesgo hemorrágico Puntuación Úlcera gastroduodenal activa 4,5 Hemorragia en los últimos 3 meses 4 Trombocitopenia (≤ 50.000/mm3) 4 Edad avanzada (≥ 85 años) 3,5 Fallo hepático 2,5 Fallo renal severo (Acr < 30 ml/min) 2,5 Ingreso en UCI 2,5 Catéter venoso central 2 Enfermedad reumática 2 Cáncer activo 2 Edad 40-84 años 1,5 Sexo masculino 1 Insuficiencia renal moderada (Acr 30-59 ml/min/m2) 1 Acr: aclaramiento de creatinina; INR: ratio internacional normalizada; UCI: Unidad de Cuidados Intensivos.
Modificado de Kahn et al.25.
- 3.
Se debe realizar una evaluación de riesgos continua en pacientes con COVID-19 para ajustar la estrategia de tromboprofilaxis.
- 4.
Para pacientes con COVID-19 con alto riesgo de trombosis, se recomienda HBPM como fármaco de primera línea, en ausencia de contraindicación.
- 5.
En pacientes con COVID-19 con bajo riesgo de trombosis, se debe valorar individualmente la tromboprofilaxis no farmacológica y realizar un seguimiento continuo del riesgo.
- 6.
En personas aisladas por haber estado en contacto con pacientes COVID-19, con alto riesgo de trombosis se recomienda la tromboprofilaxis con HBPM, en ausencia de contraindicación.
- 7.
En personas aisladas por haber estado en contacto con pacientes COVID-19, con bajo riesgo de trombosis, se recomienda valorar individualmente la tromboprofilaxis no farmacológica y realizar un seguimiento continuo del riesgo.
- 8.
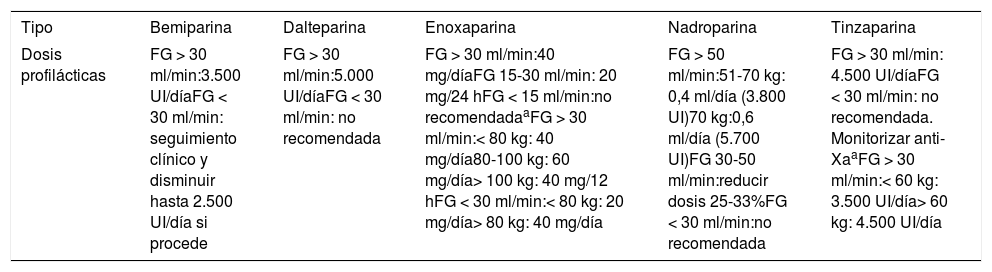
Se recomienda una evaluación de la función renal para ajuste de dosis según filtrado glomerular (FG) y tipo de HBPM (tabla 3).
Tabla 3.Dosis profilácticas de las diferentes heparinas según su ficha técnica
Tipo Bemiparina Dalteparina Enoxaparina Nadroparina Tinzaparina Dosis profilácticas FG > 30 ml/min:3.500 UI/díaFG < 30 ml/min: seguimiento clínico y disminuir hasta 2.500 UI/día si procede FG > 30 ml/min:5.000 UI/díaFG < 30 ml/min: no recomendada FG > 30 ml/min:40 mg/díaFG 15-30 ml/min: 20 mg/24 hFG < 15 ml/min:no recomendadaaFG > 30 ml/min:< 80 kg: 40 mg/día80-100 kg: 60 mg/día> 100 kg: 40 mg/12 hFG < 30 ml/min:< 80 kg: 20 mg/día> 80 kg: 40 mg/día FG > 50 ml/min:51-70 kg: 0,4 ml/día (3.800 UI)70 kg:0,6 ml/día (5.700 UI)FG 30-50 ml/min:reducir dosis 25-33%FG < 30 ml/min:no recomendada FG > 30 ml/min: 4.500 UI/díaFG < 30 ml/min: no recomendada. Monitorizar anti-XaaFG > 30 ml/min:< 60 kg: 3.500 UI/día> 60 kg: 4.500 UI/día Disponible en: https://cima.aemps.es/cima/publico/home.html.
FG: filtrado glomerular.
- 9.
En cuanto a la dosis de HBPM para tromboprofilaxis, de acuerdo con la SETH26 en pacientes no ingresados, se utilizarán dosis profilácticas estándar de HBPM (tabla 3).
- 10.
En caso de alergia a HBPM o trombocitopenia inducida por heparinas27,28, en Atención Primaria se recomienda el uso de fondaparinux, a las siguientes dosis:
- ∘
2,5mg/24h sc en FG> 50m/min.
- ∘
Si FG está entre 20-50ml/min, reducir a dosis de 1,5mg/24h.
- ∘
Contraindicado si el FG es <20ml/min.
- 11.
Todos los pacientes completamente inmovilizados se beneficiarán de la tromboprofilaxis no farmacológica con terapia compresiva29 con medias elásticas, valorando la indicación de tromboprofilaxis farmacológica de forma individualizada.
- 12.
En pacientes con alto riesgo de sangrado o con sangrado activo, se recomienda utilizar solo tromboprofilaxis mecánica.
- 13.
Tras el alta hospitalaria, el médico de familia continuará la profilaxis pautada, evaluando periódicamente el riesgo trombótico y hemorrágico, manteniéndola mientras persistan los factores de riesgo transitorios, un mínimo de 7 días, asegurando una correcta adherencia y cumplimentación del tratamiento, debiendo tenerse en cuenta la situación individual de cada paciente y el conjunto de condicionantes biopsicosociales.
- 14.
Las pacientes embarazadas con infección por SARS-CoV-2 constituyen un grupo de riesgo incrementado de ETEV30, como se ha indicado anteriormente, por lo que requieren una valoración adecuada tanto en el embarazo como en el puerperio, compartida con el obstetra o el hematólogo. Acorde con la SETH26, se proponen las siguientes medidas:
- ∘
Durante la gestación:
- •
Con enfermedad leve o asintomática, en domicilio: HBPM a dosis profiláctica durante 2 semanas.
- •
Con enfermedad moderada (inmovilización prolongada): HBPM a dosis profiláctica durante 2 semanas y hasta 7 días tras la resolución de la COVID-19.
- ∘
Durante el puerperio, cabe tener presente que la lactancia materna no limita el uso de algunas HBPM (según ficha técnica puede administrarse enoxaparina, y bemiparina con precaución). Se mantiene la recomendación de continuar con la lactancia materna, a pesar de padecer COVID-19, procurando el uso de mascarilla y siguiendo las precauciones y medidas de higiene habituales, reseñando el lavado de manos y a nivel mamario.
- •
Con enfermedad leve o asintomática, en domicilio:
- -
Si no hay otro factor de riesgo, HBPM a dosis profiláctica durante 2semanas.
- -
Si añade más factores de riesgo, prolongar la HBPM a dosis profiláctica durante 6 semanas.
- •
Con enfermedad moderada (inmovilización prolongada) HBPM a dosis profiláctica durante 2 semanas y hasta 7 días tras la resolución del cuadro e inicio de la movilización.
- 15.
En mujeres con infección SARS-CoV-2 que toman anticonceptivos hormonales combinados26, se recomienda valorar su suspensión temporal, salvo prescripción ginecológica.
- 16.
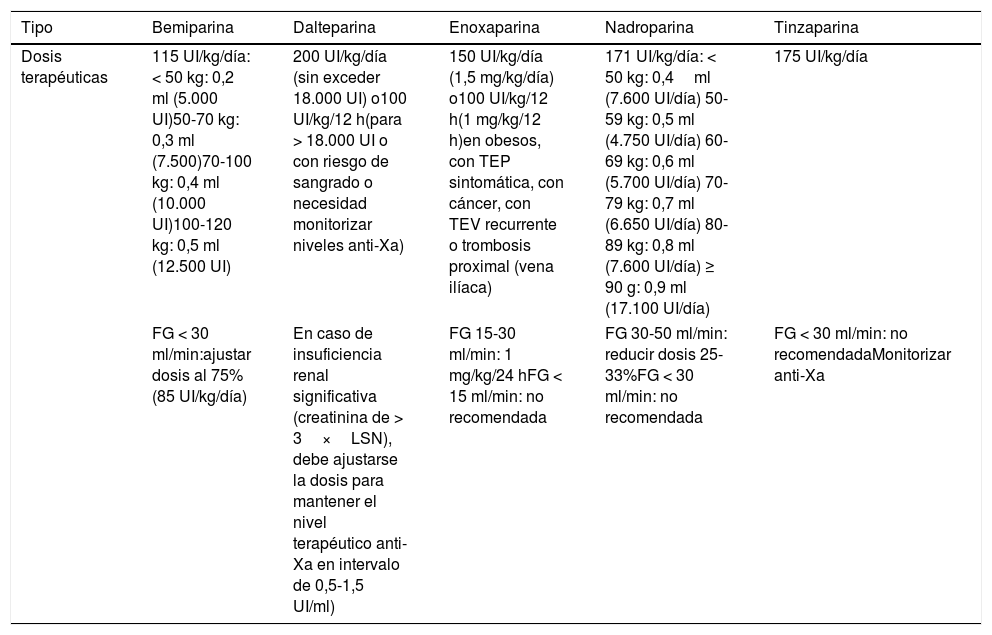
En pacientes con tratamiento anticoagulante previo, tanto anticoagulantes de acción directa como AVK, y COVID-19 se recomienda31,32suspenderlo y pautar HBPM a dosis terapéuticas (tabla 4). Asimismo, se recomienda tener en cuenta la posibilidad de que se produzcan exposiciones innecesarias en caso de tener que acudir a centros sanitarios para control del INR en pacientes a tratamiento con AVK, por lo que se recomienda valorar cambio a anticoagulantes de acción directa, excepto en circunstancias especiales como la presencia de válvulas protésicas mecánicas o el síndrome antifosfolípido33.
Tabla 4.Dosis terapéuticas de las diferentes heparinas según su ficha técnica
Tipo Bemiparina Dalteparina Enoxaparina Nadroparina Tinzaparina Dosis terapéuticas 115 UI/kg/día: < 50 kg: 0,2 ml (5.000 UI)50-70 kg: 0,3 ml (7.500)70-100 kg: 0,4 ml (10.000 UI)100-120 kg: 0,5 ml (12.500 UI) 200 UI/kg/día (sin exceder 18.000 UI) o100 UI/kg/12 h(para > 18.000 UI o con riesgo de sangrado o necesidad monitorizar niveles anti-Xa) 150 UI/kg/día (1,5 mg/kg/día) o100 UI/kg/12 h(1 mg/kg/12 h)en obesos, con TEP sintomática, con cáncer, con TEV recurrente o trombosis proximal (vena ilíaca) 171 UI/kg/día: < 50 kg: 0,4ml (7.600 UI/día) 50-59 kg: 0,5 ml (4.750 UI/día) 60-69 kg: 0,6 ml (5.700 UI/día) 70-79 kg: 0,7 ml (6.650 UI/día) 80-89 kg: 0,8 ml (7.600 UI/día) ≥ 90 g: 0,9 ml (17.100 UI/día) 175 UI/kg/día FG < 30 ml/min:ajustar dosis al 75% (85 UI/kg/día) En caso de insuficiencia renal significativa (creatinina de > 3×LSN), debe ajustarse la dosis para mantener el nivel terapéutico anti-Xa en intervalo de 0,5-1,5 UI/ml) FG 15-30 ml/min: 1 mg/kg/24 hFG < 15 ml/min: no recomendada FG 30-50 ml/min: reducir dosis 25-33%FG < 30 ml/min: no recomendada FG < 30 ml/min: no recomendadaMonitorizar anti-Xa Disponible en: https://cima.aemps.es/cima/publico/home.html.
FG: filtrado glomerular; LSN: valores normales de laboratorio.
- ∘
En caso de no alteración de la coagulación ni riesgo trombótico añadido: se deberá tener en cuenta si se ha realizado tratamiento con fármacos que puedan interaccionar con el tratamiento anticoagulante. En estos casos, los pacientes recibirán tratamiento con HBPM a dosis terapéuticas hasta el fin de la interacción farmacológica, teniendo en cuenta la vida media de los fármacos administrados (la azitromicina tiene una vida media de hasta 72 h, la cloroquina 5 días y la hidroxicloroquina hasta 40 días; lopinavir/ritonavir de 6 h y tocilizumab de 6 días).
- ∘
En caso de alteración de la coagulación o riesgo trombótico: se continuará el tratamiento con HBPM tras el alta hospitalaria debiéndose valorar las interacciones farmacológicas antes de volver a instaurar el tratamiento anticoagulante que tomaba previamente. Se recomienda reintroducir la anticoagulación por vía oral solo cuando se negativice la reacción en cadena de la polimerasa en tiempo real (RT-PCR) o el riesgo trombótico, el curso clínico o la situación socio-sanitaria de la pandemia lo permita.
- 17.
En los pacientes que ya tomaban tratamiento antiagregante32,33 el hecho de presentar COVID-19 no contraindica el uso profiláctico con HBPM. En caso del uso de terapia con clopidogrel o ticagrelor, en pacientes que requieren tratamiento antiviral, se recomienda su sustitución teniendo en cuenta las interacciones medicamentosas.
- 18.
El cáncer en fase activa, con metástasis o que haya sido tratado con quimioterapia o radioterapia en los últimos 6 meses, predispone a un mayor riesgo de ETEV. Además, es probable que ese riesgo se vea incrementado si se produce una infección concomitante por COVID-19, por el estado de hipercoagulabilidad que conlleva. Sería necesario en estos casos la valoración integral del paciente de forma multidisciplinar entre Oncología o los correspondientes servicios hospitalarios34.
- 19.
Es conveniente promover una serie de medidas generales como: fomentar la deambulación, reducir la estancia prolongada de pie o sentado y evitar cruzar las piernas, cambiar de posición como mínimo cada media hora y realizar ejercicios de flexoextensión y movimientos circulares de los pies cada hora35. Es importante evitar la deshidratación, bebiendo un volumen apropiado de agua durante su aislamiento en el hogar, haciendo especial hincapié en aquellos pacientes con fiebre o síntomas gastrointestinales (diarrea, astenia, etc.) en los que debe procurarse rehidratación adecuada sin demora.
La trombosis se asocia a la infección producida por el SARS-CoV-2, aumentando su gravedad y confiriendo peor pronóstico al paciente. Nuestra actuación como médicos de Familia, trabajando en Atención Primaria, puede mejorar el curso evolutivo de la enfermedad. Este documento ha sido elaborado con base en la evidencia publicada hasta el momento, pero debido a la rapidez con la que surgen nuevas publicaciones y a la gran cantidad de estudios que están en proceso de investigación actual, debemos hacer constar la necesidad de una continua actualización. Se necesitan más estudios que nos ayuden a clarificar las estrategias en el manejo de estas enfermedades, sobre todo en el ámbito extrahospitalario, asegurando así la mejor salud de nuestros pacientes.
Aguado Castaño, Ana Carlota, Centro de Salud San Vicente I, Alicante. Aicart Bort, María Dolores, Centro de Salud Rafalafena, Castellón. Babiano Fernández, Miguel Ángel, Centro de Salud Almadén, Ciudad Real. Caballer Rodilla, Julia, Centro de Salud El Restón, Madrid. Cabrera Ferriols, María Ángeles, Centro de Salud San Vicente del Raspeig, Alicante. Carrasco Carrasco, Eduardo, Centro de Salud de Abarán, Murcia. Frías Vargas, Manuel, Centro de Salud Comillas, Madrid. Fuertes Domínguez, Diana, Centro de Salud Cervera de Pisuerga, Palencia. García Fernández, Pedro, Centro de Salud Nueva Málaga, Málaga. García Lerín, Aurora, Centro de Salud, Almendrales, Madrid. Gil Gil, Inés, Centro de Salud Vielha, Lleida. García Vallejo, Olga, Centro de Salud Comillas, Madrid. López Téllez, Antonio, Centro de Salud Puerta Blanca, Málaga. Mayorga Criado, Alberto, Centro de Salud Llefia, Badalona. Peiró Morant, Juan, Centro de Salud Ponent, Islas Baleares. Perdomo García, Frank J, Urgencias, Hospital La Paz, Madrid. Piera Carbonell, Ana, Centro de Salud Luanco-Gozón, Asturias. Pietrosanto, Teresa, Centro de Salud San Vicente del Raspeig, Alicante. Ramírez Torres, José Manuel, Centro de Salud Puerta Blanca, Málaga. Robledo Orduña, Carlos, Centro de Salud San Vicente del Raspeig I, Alicante. Vázquez Gómez, Natividad, Centro de Salud Auxiliar Moncófar, Castellón.
Los nombres de los componentes del Grupo de trabajo de Vasculopatías de SEMERGEN están relacionados en el anexo 1.
Este documento ha sido valorado de forma positiva por la Comisión Nacional de Validación de la Sociedad Española de Atención Primaria (SEMERGEN) con el n°. 0071/2020.