La infección periamigdalina (IPA) supone un motivo de consulta urgente entre las molestias de garganta. Un diagnóstico diferido o incorrecto puede comprometer la vía aerodigestiva alta y resultar mortal en su evolución. Nuestro objetivo fue desarrollar un modelo predictivo de presencia de IPA que ayude en su rápida detección.
Pacientes y métodosUn estudio observacional retrospectivo de 66 meses desde 2017 fue desarrollado en un hospital comarcal y su centro terciario de referencia, recogiendo datos de todos los pacientes diagnosticados de IPA y un volumen proporcional de sujetos con sintomatología faríngea sin IPA. Recopilación de datos clínicos, exploratorios y demográficos entre participantes. Su mayor riesgo relativo de presencia de IPA los etiquetó como variables a testar. Elaboración de una escala de puntuación de probabilidad de padecerla y análisis de regresión logística, con obtención de la curva ROC que ofreciera mejor correlación diagnóstica. Validación interna y cálculo de los valores predictivos de este modelo.
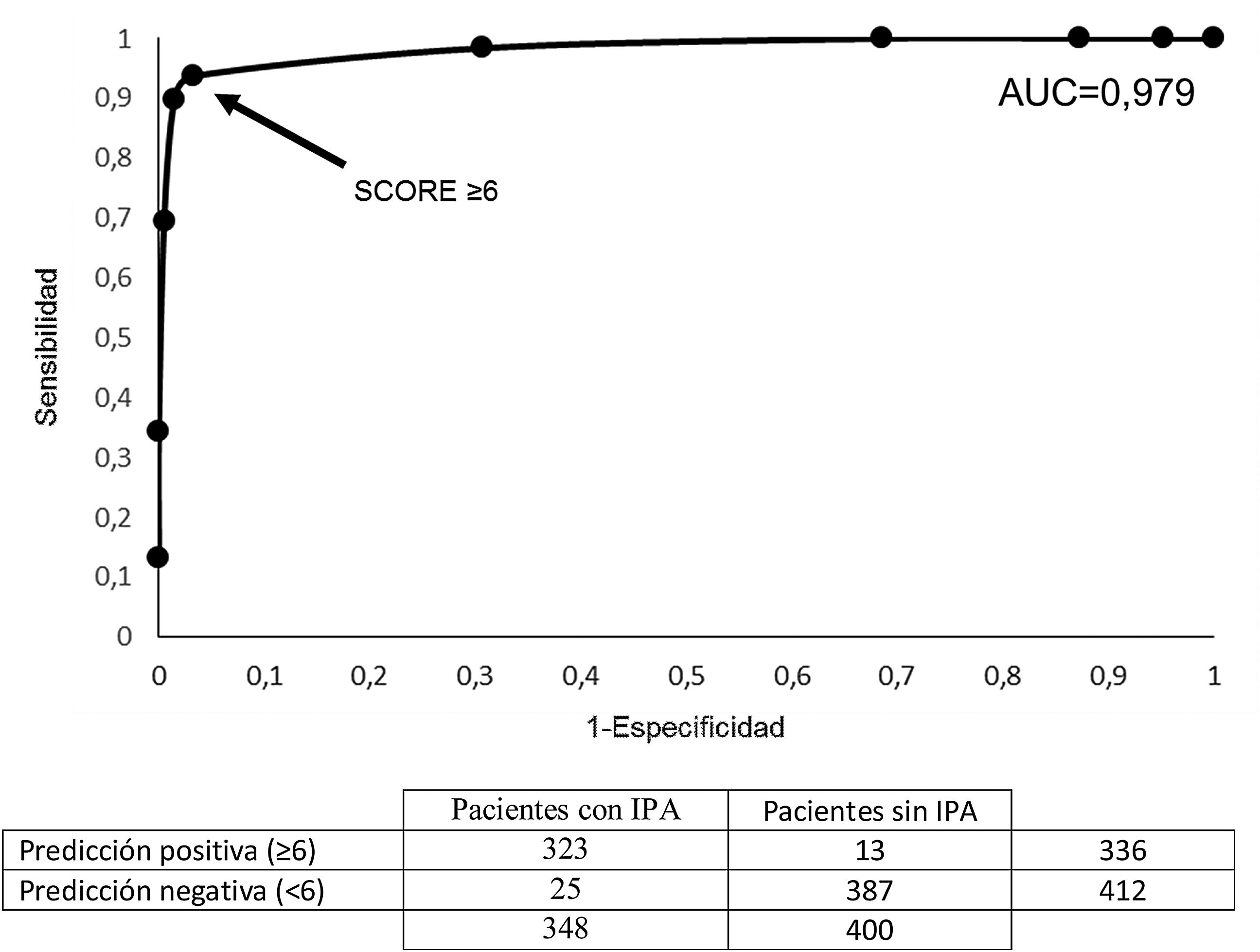
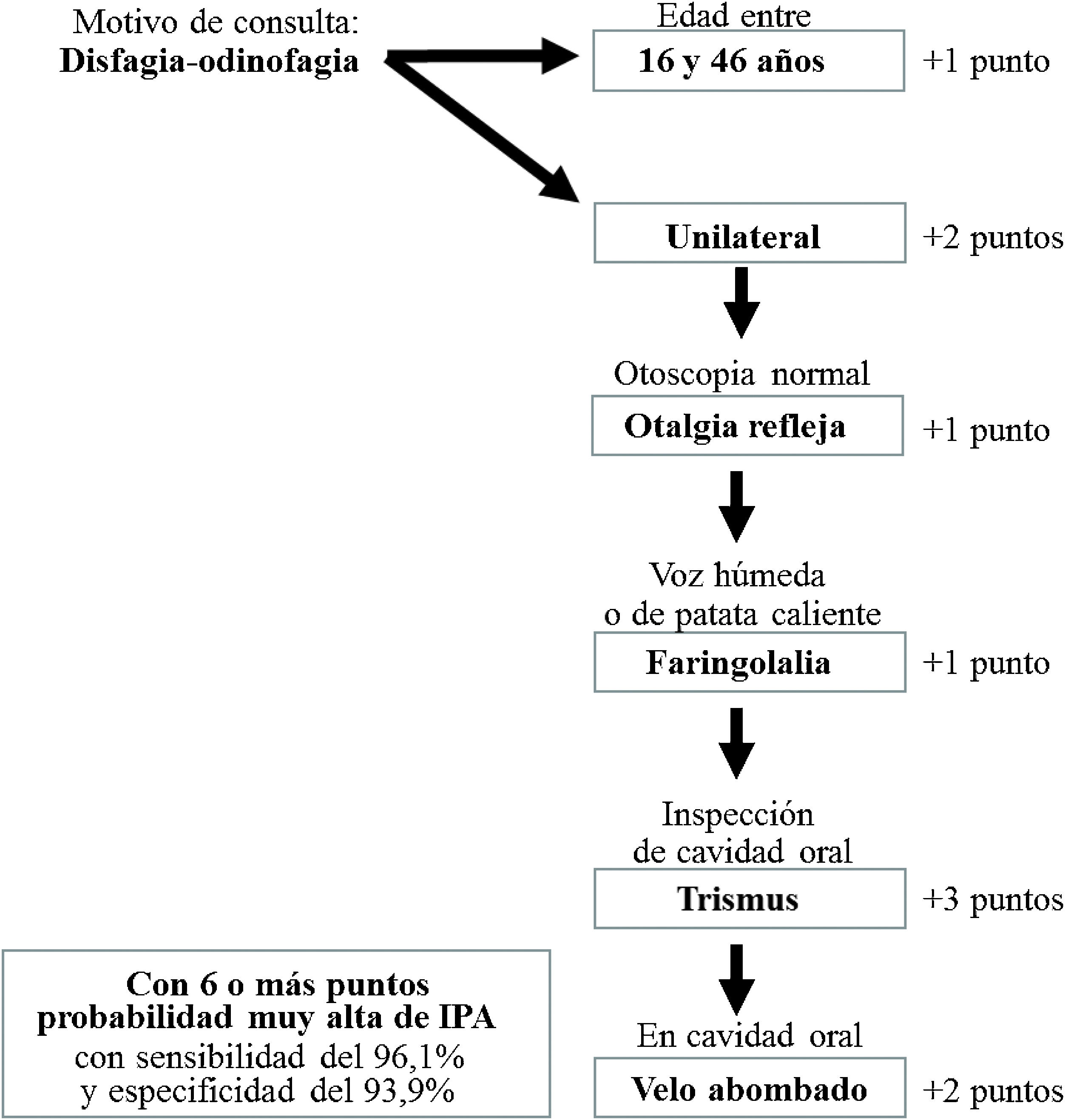
ResultadosSobre 348 casos de IPA, la escala de valoración puntuó la presencia de 6 variables: trismus (3), disfagia-odinofagia unilateral (2), abombamiento velar (2), otalgia refleja (1), faringolalia (1) y edad de 16-46 años (1). Con un rango de 0 a 10, un cut-off≥6 ofreció una sensibilidad del 96,1%, una especificidad del 93,9% y una eficienca del 94,9%. El área bajo la curva ROC fue de 0,979.
ConclusionesLa validación interna de este modelo basado en signos y síntomas la faculta como herramienta muy útil para detectar precozmente IPA en otorrinolaringología y atención primaria.
Peritonsillar infection (PTI) is a reason for urgent consultation due to intense throat discomfort. A delayed or inaccurate diagnosis can jeopardize the upper aerodigestive tract and be fatal in its evolution. Our objective was to develop a predictive model for the presence of IPA helping in its rapid detection.
Patients and methodsA 66-month retrospective observational study from 2017 was carried out in a county and tertiary referral hospitals, registering data from all patients diagnosed with PTI and a proportional volume of subjects with pharyngeal symptoms without PTI. Collection of clinical, exploratory and demographic data among participants. Their higher relative risk of PTI presence allowed them to be considered as variables to be tested. Development of a scoring scale for the probability of suffering from it and logistic regression analysis, obtaining the ROC curve with the best diagnostic correlation. Internal validation and estimation of the predictive values of the model.
ResultsOn 348 cases of PTI, the assessment scale scored the presence of six variables: trismus (3), unilateral dysphagia-odynophagia (2), velar bulging (2), reflex otalgia (1), pharyngolalia (1) and age between 16 and 46 years (1). With a range of 0-10, a cut-off ≥6 offered a sensitivity of 96.1%, a specificity of 93.9%, and an efficiency of 94.9%. The area under the ROC curve was 0.979.
ConclusionsThe internal validation of this model based on signs and symptoms makes it a very useful tool for early detection of PTI in otorhinolaryngology and primary care.
La infección periamigdalina (IPA) es la más frecuente de las complicaciones potenciales de la faringoamigdalitia aguda (FA) cuando esta se trata de forma inadecuada, con una incidencia que además crece1-4. Sin embargo, muchos casos no presentan cuadros amigdalares previos ni FA de repetición4,5. Una IPA surge en el espacio periamigdalino posterolateral, entre la amígdala y el músculo constrictor superior de la faringe, pudiendo evolucionar desde celulitis a colección. Es característico de ella la odinofagia unilateral con trismus y estrechamiento de la faringe, generando la característica «voz de patata caliente» o faringolalia4,6. La ralentización en el diagnóstico y la ausencia de drenaje si existe absceso conducen a la potencial progresión a espacios cervicales profundos3,7,8.
La disfagia-odinofagia es indudablemente uno de los principales motivos de consulta en centros de salud8-10, y aunque entre ellos la IPA es relativamente rara, su incidencia oscila entre 5 y 45 casos/100.000 habitantes/año3,4,11. En atención primaria no siempre resulta fácil diferenciar entre odinofagia de origen periamigdalina y otras, y con la aparición de la pandemia en 2020 las restricciones asistenciales minimizaron la visita presencial y potenciaron la telemedicina, reduciendo aún más la posibilidad de detección rápida de episodios. El diagnóstico de absceso periamigdalino se efectúa mediante punción-aspiración del mismo, y aunque su realización no compete al nivel asistencial sanitario básico, sí lo es la sospecha de IPA, pues está reconocido que solo precisa de una evaluación clínica y exploración física muy sencillas7-9.
Pensamos que la planificación de una escala de puntuación clínica podría predecir y establecer el diagnóstico de IPA. Sus signos y síntomas orofaríngeos, sometidos a un cribado sistemático y estandarizado, alcanzarían a etiquetar con certeza el episodio. Hemos generado un modelo de valoración en 2 departamentos de salud de nuestra comunidad sobre la probabilidad de padecer IPA en pacientes con odinofagia en base a características clínicas, exploratorias y demográficas. Es nuestro objetivo proporcionar la capacidad de diagnóstico o descarte rápido de la infección tanto en atención primaria como en formación especializada.
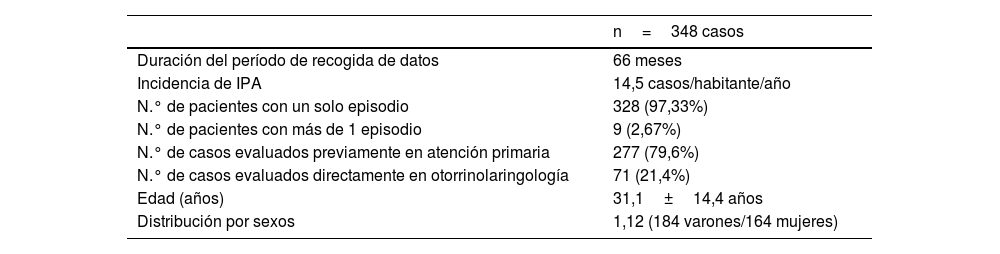
Material y métodosModelo de estudioSe realizó un estudio observacional, longitudinal y descriptivo retrospectivo de pacientes atendidos en centros de salud y urgencias hospitalarias por IPA entre septiembre de 2017 y febrero de 2023. Para ello se emplearon los registros sanitarios informatizados del nivel asistencial primario y los 2 hospitales implicados, un comarcal y su centro terciario de referencia, con cobertura sobre 480.000 habitantes. Las características epidemiológicas de la muestra se ofrecen en la tabla 1.
Características epidemiológicas de los casos registrados con IPA
| n=348 casos | |
|---|---|
| Duración del período de recogida de datos | 66 meses |
| Incidencia de IPA | 14,5 casos/habitante/año |
| N.° de pacientes con un solo episodio | 328 (97,33%) |
| N.° de pacientes con más de 1 episodio | 9 (2,67%) |
| N.° de casos evaluados previamente en atención primaria | 277 (79,6%) |
| N.° de casos evaluados directamente en otorrinolaringología | 71 (21,4%) |
| Edad (años) | 31,1±14,4 años |
| Distribución por sexos | 1,12 (184 varones/164 mujeres) |
IPA: infección periamigdalina.
La recogida de datos se ajustó a la regulación del Comité de Etica de ambos centros, con preservación del anonimato de cada paciente. Fueron admitidos a estudio todos aquellos casos diagnosticados de IPA, tanto flemones como abscesos. Este diagnóstico se fundamentó en la anamnesis y la exploración física efectuadas en los servicios de urgencias y otorrinolaringología de ambos hospitales.
Consideración de episodio de infección periamigdalina y elaboración del modeloCon el volumen de pacientes evaluados en los 66 meses se definieron los signos y síntomas de la infección, agrupados y ordenados por orden de frecuencia. Se anotó igualmente la edad y el sexo de los participantes. Cada uno de ellos fue considerado variable independiente.
Para cuantificar la importancia de la asociación entre cada variable (dato demográfico, manifestación o hallazgo clínico) y la presencia de IPA se calculó el riesgo relativo (RR) y odds ratio (OR) de cada uno de ellas. Se estudiaron 2 muestras de pacientes, con y sin IPA, sobre los que investigar la presencia del hallazgo clínico, exploratorio o demográfíco. Mediante análisis univariante se identificaron aquellas variables con incidencia elevada y estadísticamente significativa en el grupo con IPA. Con ellas se elaboró la escala de puntuación, y sobre esta escala, el modelo predictivo de identificación de IPA.
El grupo sin IPA se obtuvo con registros de individuos asistidos en urgencias hospitalarias y atención primaria con diagnóstico odinofagia no periamigdalina, e incluyó casos consecutivos de catarro común, gripe, glositis, estomatitis y FA, en 6 meses de 2019. Con este grupo se efectuó paridad de cohortes para encontrar puntuaciones bajas en el modelo predictivo con las variables propuestas en sujetos sin la enfermedad.
Validación interna del modelo predictivoCon los datos recogidos pudieron agregarse significativamente 6 variables al modelo. Para alcanzar la puntuación de IPA en la escala, el valor numérico del RR de cada variable elegida fue transformado en un valor proporcional absoluto. Posteriormente, se ajustó la puntuación obtenida secuencialmente validando cada ítem con la función de clasificación —es decir, con su sensibilidad en la muestra del estudio— buscando las condiciones óptimas de puntuación predictiva de IPA frente a no-IPA. Empleando la muestra del estudio se desarrolló la curva ROC derivada y el área bajo la curva (AUROC), valorando qué calidad de valor predictivo señalaba.
Tratamiento estadístico de los datosLa recopilación retrospectiva de todos los datos anónimos fue ingresada en hojas de trabajo Excel® (Microsoft Office 365®; Microsoft, Redmond, WA, EE. UU.). Se realizaron los análisis estadísticos utilizando el paquete informático que proporcionó SPSS® (IBM Corp. Released 2016. IBM SPSS Statistics for Windows, version 24.0. Armonk, NY: IBM Corp).
Para evaluar si las variables independientes eran útiles como predictoras de la variable dependiente dicotómica «padecer IPA» se realizó un análisis de regresión logística binaria. La elección de estas variables se realizó según criterios de significación estadística de porcentaje de su detección en dos cohortes con y sin IPA, mediante test Chi-cuadrado de Pearson (porcentaje de casos que mostraban un ítem y presentaban IPA frente al de sujetos que también lo mostraban y no padecían IPA). Todas las variables se transformaron en categóricas y dicotómicas. La bondad de ajuste del modelo a los datos se midió a través del cálculo del logaritmo de verosimilitud, obteniendo el coeficiente R2 de Nagelkerke.
El RR indicó así cuánto más probable resultó padecer la IPA cuando la variable estuvo presente. Aunque también se calculó el OR, se eligió con preferencia el RR al tratarse de variables que sucedían con bastante frecuencia en el grupo con IPA12.
Para otorgar la puntuación de cada variable predictora se adjudicó a cada una de ellas un número absoluto conforme a la influencia relativa de su RR. Así, cuanto más alto fue un RR y mayor era la probabilidad de padecer IPA, más grande resultó la puntuación que otorgó la variable. A las variables con RR≤3 se les asignó una puntuación de uno, con RR>3, pero ≤6 una puntuación de 2, y con riesgo >6 una puntuación de 3.
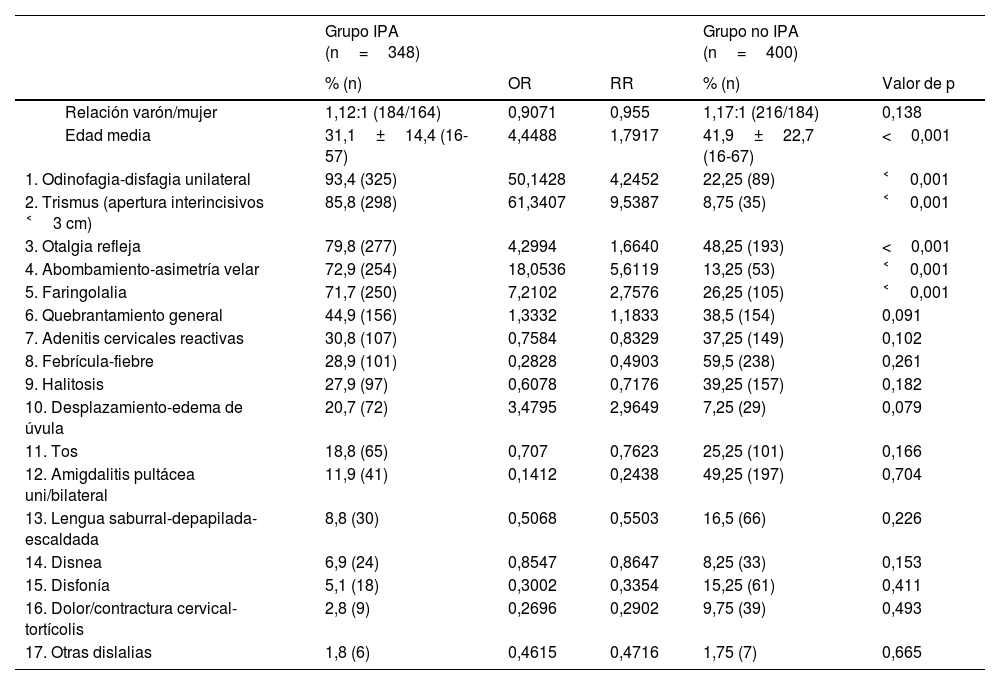
ResultadosSe diagnosticaron 348 casos de IPA, con una tasa global de 14,5 casos/100.000 habitantes/año y un significativo número de casos detectados desde atención primaria, el 80% del total. Esta muestra incluyó 337 pacientes, ya que en 7 casos se diagnosticó una IPA en 2 ocasiones, y en 2 casos el cuadro apareció 3 veces. Los pacientes recurrentes contabilizaron el 2,67% de los casos de IPA, padecían todos amigdalitis de repetición y su edad media era de 21,3±4,8 años. Con este volumen se elaboró la tabla 2, que ilustra la incidencia de las variables que caracterizaron la infección. Puede apreciarse que 4 manifestaciones clínicas y un hallazgo a la exploración destacan por encima de otras observaciones: la disfagia-odinofagia unilateral, el trismus, la otalgia refleja, el abombamiento velar y la faringolalia (o voz de «patata caliente»). Fueron detectadas entre el 72 y el 93% de los casos diagnosticados.
Manifestaciones y hallazgos clínicos registrados en la anamnesis y exploración de los 348 casos de IPA y porcentaje de aparición de los mismos
| Grupo IPA (n=348) | Grupo no IPA (n=400) | ||||
|---|---|---|---|---|---|
| % (n) | OR | RR | % (n) | Valor de p | |
| Relación varón/mujer | 1,12:1 (184/164) | 0,9071 | 0,955 | 1,17:1 (216/184) | 0,138 |
| Edad media | 31,1±14,4 (16-57) | 4,4488 | 1,7917 | 41,9±22,7 (16-67) | <0,001 |
| 1. Odinofagia-disfagia unilateral | 93,4 (325) | 50,1428 | 4,2452 | 22,25 (89) | ˂0,001 |
| 2. Trismus (apertura interincisivos ˂3 cm) | 85,8 (298) | 61,3407 | 9,5387 | 8,75 (35) | ˂0,001 |
| 3. Otalgia refleja | 79,8 (277) | 4,2994 | 1,6640 | 48,25 (193) | <0,001 |
| 4. Abombamiento-asimetría velar | 72,9 (254) | 18,0536 | 5,6119 | 13,25 (53) | ˂0,001 |
| 5. Faringolalia | 71,7 (250) | 7,2102 | 2,7576 | 26,25 (105) | ˂0,001 |
| 6. Quebrantamiento general | 44,9 (156) | 1,3332 | 1,1833 | 38,5 (154) | 0,091 |
| 7. Adenitis cervicales reactivas | 30,8 (107) | 0,7584 | 0,8329 | 37,25 (149) | 0,102 |
| 8. Febrícula-fiebre | 28,9 (101) | 0,2828 | 0,4903 | 59,5 (238) | 0,261 |
| 9. Halitosis | 27,9 (97) | 0,6078 | 0,7176 | 39,25 (157) | 0,182 |
| 10. Desplazamiento-edema de úvula | 20,7 (72) | 3,4795 | 2,9649 | 7,25 (29) | 0,079 |
| 11. Tos | 18,8 (65) | 0,707 | 0,7623 | 25,25 (101) | 0,166 |
| 12. Amigdalitis pultácea uni/bilateral | 11,9 (41) | 0,1412 | 0,2438 | 49,25 (197) | 0,704 |
| 13. Lengua saburral-depapilada-escaldada | 8,8 (30) | 0,5068 | 0,5503 | 16,5 (66) | 0,226 |
| 14. Disnea | 6,9 (24) | 0,8547 | 0,8647 | 8,25 (33) | 0,153 |
| 15. Disfonía | 5,1 (18) | 0,3002 | 0,3354 | 15,25 (61) | 0,411 |
| 16. Dolor/contractura cervical-tortícolis | 2,8 (9) | 0,2696 | 0,2902 | 9,75 (39) | 0,493 |
| 17. Otras dislalias | 1,8 (6) | 0,4615 | 0,4716 | 1,75 (7) | 0,665 |
IPA: infección periamigdalina; OR: odds ratio; RR: riesgo relativo.
Odds ratio y riesgo relativo de cada manifestación y hallazgo clínico, así como de los datos demográficos de edad y sexo, obtenidos del grupo y relacionados con otros 400 casos de dolor de garganta no periamigdalino, con análisis estadístico univariante derivado de la equiparación de ambos grupos. El modelo predictivo solo incluyó aquellas variables cuyo porcentaje de aparición difirió de forma estadísticamente significativa entre los grupos con y sin IPA (estas variables se remarcan en fondo gris).
El análisis de regresión logística binaria para evaluar qué datos clínicos, exploratorios o demográficos tuvieron impacto en el diagnóstico de IPA se efectuó frente a una cohorte de 400 pacientes con odinofagia sin IPA. Se apreciaron indicadores de RR y OR de padecer IPA significativamente mayores cuando se presentaron los cinco signos y síntomas anteriormente expuestos. El intervalo de confianza del 95% de la edad media del grupo con la infección proporcionó una sexta variable de naturaleza demográfica, «edad entre 16-46 años», que también mostró RR y OR con significación estadística.
Este modelo de regresión fue estadísticamente significativo, con p<0,001 para cada una de las 6 variables predictoras escogidas. El modelo ofreció un coeficiente R2 de Nagelkerke de 0,861, indicador óptimo de la correcta clasificación de los casos.
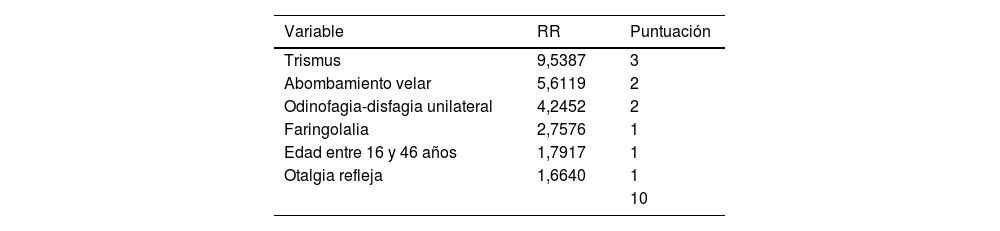
En la escala de puntuación de la que derivó el modelo predictivo el valor numérico del RR de cada variable se ajustó a un número absoluto. Esta escala acumulaba 3 puntos el caso que presentaba trismus al diagnóstico, con 2 puntos si existía disfagia-odinofagia unilateral o abombamiento velar, y un punto cuando el paciente mostraba faringolalia, otalgia refleja o tenía una edad entre 16 y 46 años. La máxima valoración posible fue, así, de 10 puntos. Su rentabilidad diagnóstica se refleja en la tabla 3.
Puntos atribuídos a cada variable admitida en el modelo de predicción de IPA y fiabilidad diagnóstica para un cutt-off ≥6 sobre los ítems agregados con una puntuación máxima de 10
| Variable | RR | Puntuación |
|---|---|---|
| Trismus | 9,5387 | 3 |
| Abombamiento velar | 5,6119 | 2 |
| Odinofagia-disfagia unilateral | 4,2452 | 2 |
| Faringolalia | 2,7576 | 1 |
| Edad entre 16 y 46 años | 1,7917 | 1 |
| Otalgia refleja | 1,6640 | 1 |
| 10 |
| Cutt-off predictivo de IPA≥6 | ||
|---|---|---|
| Sensibilidad | 96,1% | |
| Especificidad | 93,9% | |
| Valor predictivo positivo | 92,8% | |
| Valor predictivo negativo | 96,7% | |
| Eficiencia | 94,9% |
IPA: infección periamigdalina; RR: riesgo relativo.
Empleando la muestra de casos del estudio se desarrolló la curva Receiver Operating Characeristic (ROC) derivada y con un área bajo la curva (AUROC) de 0,979, que tipifica el modelo como excelente. El valor cut-off de la escala con mayor fiabilidad diagnóstica en la función predictiva del modelo fue ≥6 (fig. 1).
Curva ROC de validación interna de la capacidad de clasificación correcta del modelo predictivo con AUC=0,979, apreciándose que la puntuación ≥6 de la escala es el valor más próximo a la unidad en la razón de verdaderos positivos. AUC: area bajo la curva; IPA: infección periamigdalina.
Los casos de IPA tratados incorrectamente o con retraso elevan el número de ingresos hospitalarios y la morbimortalidad significativa13-15. La sospecha clínica se establece precozmente en presencia de sus manifestaciones características, y no exige anamnesis ni exploración complejas. Aunque en circunstancias de absceso el tratamiento de la IPA compete al especialista otorrinolaringólogo, algunos autores abogan por su manejo ambulatorio ya que muchos consultan inicialmente en atención primaria y servicios de urgencias generales2,7,8,15. De igual forma, tras un tratamiento agudo que haya podido precisar estancia hospitalaria, los hallazgos clínicos y exploratorios aportan suficiente información para que posteriores evaluaciones sean efectuadas eficazmente en centros de salud11,16. Las recurrencias en el mismo paciente detectadas en nuestro trabajo se sitúan por debajo de las informadas en las grandes series en este siglo de Wang et al. con el 5% sobre 28.837 pacientes en 201417 y Mizuno et al. con el 11% sobre 12.012 pacientes en 202218, coincidiendo como factores predisponentes la corta edad, la amigdalitis de repetición y la punción del absceso como única terapia invasiva.
En nuestro país Costales et al. aprecian en su estudio prospectivo sobre 100 casos consecutivos que la odinofagia de predominio unilateral aparece en el 100% de los casos de IPA estudiados, y las alteraciones en úvula y amígdala en un 95%6. Diversos estudios internacionales han valorado correlaciones significativas entre el diagnóstico definitivo de IPA y determinadas observaciones. El trismus y en menor medida el desplazamiento contralateral de la amígdala afecta y la úvula podrían considerarse alertas específicas de la infección3,4,13,19. Nuestros datos sobre expresividad clínica de la IPA coinciden con los anteriores, aunque en porcentajes algo variables, que en cualquier caso permiten apreciar un cortejo sintomático bien diferenciado de otros desórdenes no urgentes de garganta y cuello7,8,20-22. Pensamos que la detección de trismus, voz faringolálica y la unilateralidad de la odinofagia unilateral suponen las claves discriminatorias esenciales.
Una primera aproximación hacia la sospecha de IPA mediante la puntuación de una serie de variables la establece Spiekermann et al. en 201823 sobre una serie de 51 casos. Los hallazgos que los autores evalúan son 2 clínicos —halitosis y trismus—, 2 exploratorios —el edema de úvula y el abombamiento velar unilateral— y 2 de laboratorio —las elevaciones en sangre y saliva de la calprotectina (proteína S100A8/A9)—. La verificación de 2 o más de los 6 indicadores propuestos sería suficiente para considerar riesgo alto de IPA en el paciente y recomendaría su derivación a un centro hospitalario. Stahl et al. defienden la elevada sensibilidad de la determinación de calprotectina en saliva24, pero resulta altamente sofisticada y en absoluto accesible a los niveles asistenciales básicos de nuestro país. Además, la halitosis es poco específica como indicador de IPA. Esta escala de puntuación no ha tenido reconocimiento general.
Lau et al. presentan en 2019 el Liverpool Peritonsillar abscess Score (LPS), un estudio prospectivo observacional multicéntrico con 46 casos de IPA cuya escala de puntuación predictiva se basa en la detección de 5 hallazgos. Tres de ellos son clínicos —trismus, faringolalia y odinofagia unilateral—, uno epidemiológico —género masculino— y otro exploratorio —desplazamiento de úvula—. En un rango de 0 a 8 y en el que la odinofagia unilateral sumaba ya 3 puntos, la fiabilidad diagnóstica del test en pacientes con una puntuación ≥4 evidenció una especificidad y sensibilidad diagnósticas del 91 y 83%, respectivamente25. La escala ha sido validada en tiempos de pandemia con pequeñas modificaciones por el mismo grupo sobre 54 casos con severas restricciones asistenciales, que no permitieron en muchos casos explorar a los pacientes26.
Nuestro estudio ha valorado las relaciones entre la presencia de IPA, sin distinguir entre flemón o absceso, y diversas variables —síntomas, hallazgos a la exploración y fecha de nacimiento—. El análisis univariante pudo apreciar que la IPA se asoció significativamente con variables tales como la edad media de la vida, la disfagia-odinofagia y el trismus, coincidiendo con otras publicaciones3,4,6,13,19-22. El análisis de regresión logística multivariante reveló además, que la IPA podría predecirse a partir de 6 variables. Se trata de un sistema de puntuación en base a observaciones sobre 348 casos, el 80% de los cuales fue derivado desde centros de salud. Ello confiere a este diseño una proximidad significativa a la realidad actual en cualquier nivel asistencial. El modelo predictivo de puntuación fue diseñado conforme a la fortaleza en su relación de probabilidades y presenta algunas diferencias de contenido con respecto al LPS de Lau et al.
Así, nuestra escala puntuó más el trismus que la odinofagia unilateral, de forma inversa a los trabajos previos, ya que el RR del trismus resultó mucho más elevado, aunque su incidencia fuera menor, caracterizando casi exclusivamente a pacientes con IPA. El abombamiento velar también puntuó doble, y no se encontró valor a la afectación de la úvula, ya que esta aparecía en un grupo considerable de pacientes con FA sin IPA. Que este signo puntúe así podría tener repercusión en circunstancias de consulta telefónica, como ha venido ocurriendo asiduamente durante la pandemia, ya que no podría apreciarse y dejaría de acumular probabilidad casuística de estar frente a un caso de IPA. Mallen et al. defienden de hecho la telefonía para este diagnóstico siempre que vaya acompañada de videoimagen27. Selwyn et al. no encontró sin embargo influencia de la variable detectada mediante exploración sobre la fiabilidad del LPS en su validación externa26. Desde el punto de vista epidemiológico, no consideramos el sexo como una condición influyente, contrariamente al LPS25. Con lo anteriormente expuesto, nos parece un aceptable algoritmo de aproximación diagnóstica de la IPA el ofrecido en la figura 2.
Nuestra validación interna evidenció un alto índice de sensibilidad y valor predictivo negativo, determinantes en la utilidad clínica de cualquier escala clínica de valoración de una afección potencialmente mortal. Su mayor especificidad —entendida como la capacidad de identificar al paciente sano— hace del cuestionario una poderosa arma de descarte de IPA tanto en atención primaria como en servicios de urgencias.
ConclusionesEste estudio se fundamenta en un diseño retrospectivo, y se ha beneficiado de un amplio volumen muestral. Ello recomienda un ejercicio de validación externa con una calibración de varios centros externos y por separado, tanto en la visita primaria como especializada, especialmente en tiempos donde el contacto con el paciente vuelve a ser directo y las 6 variables pueden ser evaluadas. Mejorará así el valor predictivo diagnóstico en la población general de un proceso inflamatorio que al menos aparece en una décima parte de los pacientes con FA. En todos aquellos en los que exista sospecha clínica, esta escala de puntuación puede ser empleada para determinar la probabilidad de IPA. Debe recordarse sin embargo que está diseñado para apoyar a los médicos en su detección y no busca reemplazar el juicio clínico ni obviar la posibilidad de herramientas diagnósticas a las que se pudiera acceder, como los ultrasonidos o la punción-aspiración. Con ello esperamos que, luego de la validación externa, este modelo predictivo de IPA resulte útil a los facultativos a cualquier nivel asistencial en el manejo de los pacientes con dolor de garganta.
FinanciaciónEsta investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesTodos los autores manifiestan que no existe ningún conflicto de intereses en relación con la publicación de este artículo.