Objetivo: El uso de la terapia antiangiogénica intravítrea ha mostrado resultados favorable en las patologías intraoculares dependientes de angiogénesis. En este estudio de serie de casos, se describen los efectos biológicos en la angiogénesis fisiológica y en la angiogénesis patológica de los pacientes con retinopatía de la prematurez (ROP), después de la aplicación de bevacizumab o ranibizumab.
Métodos: Estudio de casos no comparativo, prospectivo, experimental, inyectamos una sola dosis ya sea de bevacizumab o ranibizumab en el vítreo de 20 ojos de 10 pacientes con ROP. Los pacientes incluidos en este estudio fueron prematuros con retinopatía en etapa 3, zona I, o límite posterior de zona II, con o sin enfermedad plus y pacientes con etapa 4 a, cualquier zona. La respuesta clínica y cualquier evidencia de toxicidad ocular fueron documentadas, tanto en el pre como en el postratamiento mediante imágenes de retina tomadas con RetCamII®.
Resultados: Después de la primera semana de la inyección de bevacizumab o ranibizumab, todos los ojos mostraron una significativa inhibición de la angiogénesis patológica sin afectar la angiogénesis fisiológica de los vasos retinianos. Después de seis semanas, todos los ojos mostraron formación completa de la vasculatura retiniana, sin dato alguno de angiogénesis patológica. No encontramos diferencia entre los ojos tratados con bevacizumab o ranibizumab. No ocurrieron efectos adversos locales o sistémicos en 18 ojos; dos ojos con ROP grado 4 a, desarrollaron fibrosis de retina central.
Conclusiones: La terapia intravítrea de bevacizumab o ranibizumab inhibe la angiogénesis patológica y permite el desarrollo de la vasculatura normal de la retina en los pacientes con ROP. Este estudio demuestra que la terapia antiangiogénica intravítrea no causa inhibición de la angiogénesis fisiológica de la retina, y sugiere que este mismo efecto podría ocurrir en el proceso vascular sistémico.
Aim: The use of intravitreal antiangiogenic therapy has showed good results in angio-genesis-dependent intraocular diseases. In this small case series study, the biologic effects on physiological angiogenesis and pathological angiogenesis in the retina of patients with retinopathy of prematurity (ROP) after treatment of either bevacizumab or ranibizumab, is described.
Methods: In this non-comparative, prospective, experimental and interventional case series study, we injected a single dose of either bevacizumab or ranibizumab into the vitreous of 20 eyes of 10 patients with ROP. Patients included in this study were prematures with stage 3, zone I, or posterior zone II with or without plus disease and patients with stage 4 a, any zone. Clinical response and any evidence of ocular toxicities were documented both pre- and post-injection by RetCam retinal images.
Results: After one week of intavitreal injection of bevacizumab or ranibizumab, all eyes had significant inhibition of angiogenesis without affecting the development of normal retina vasculature. After six weeks, all eyes showed completed vasculature of the retina without any sign of pathological angiogenesis. We found no differences between bevacizumab and ranibizumab results. Neither local nor systemic adverse effects occurred in 18 eyes, two eyes with ROP stage 4 a, developed a central retinal fibrosis.
Conclusions: Intravitreal therapy with bevacizumab or ranibizumab inhibits pathological angiogenesis and allows the developement of normal vasculature of the retina in ROP. This study proves that intravitreal antiangiogenic therapy does not cause inhibition of physiological angiogenesis in the retinal vessels and may suggest that the same could happen in the systemic vasculature process.
Introducción
La retinopatía del prematuro (ROP, retinopathy of prematurity) es un trastorno de la retina de los niños prematuros de bajo peso, caracterizado por proliferación de tejido vascular que crece entre la retina vascular y avascular, que potencialmente puede provocar ceguera.1 En 1980 se denominó "retinopatía del prematuro".1 Este problema es prevenible en un 50% con un tratamiento oportuno.1 La vasculogénesis de la retina se inicia en la semana 16 de vida intrauterina, mediante un precursor mesenquimal que aparece en el nervio óptico, la cual va avanzando hacia la periferia, y alcanza de las 36 a 38 semanas el lado nasal y de las 40 a 45 semanas el lado temporal. Existen dos teorías, la primera, es la teoría vasculogénica, la cual se desarrolla a partir de las células fusiformes, las cuales desarrollan las células endoteliales que forman cordones sólidos, los que posteriormente se ahuecan formando los nuevos vasos; la segunda, es la teoría angiogénica, en la cual, a partir de los vasos ya existentes desarrollan brotes que formarán los nuevos vasos.1
Como se ha descrito, ROP es una enfermedad multifactorial, mencionamos entre otros factores etiopatogénicos: la ventilación mecánica asistida, la transfusión con hemoglobina del adulto, hipoxia-hiperoxia, choque de hipoperfusión, apnea, acidosis metabólica, sepsis, uso de esteroide posnatal, sepsis por Candida sp., persistencia del conducto arterioso y el más reciente, el factor de crecimiento endotelial vascular (VEGF, Vascular Endothelial Growth Factor).2 El VEGF es el principal promotor para el desarrollo de la vasculogénesis y de la angiogénesis fisiológica, sin embargo, es también el principal propagador de la angiogénesis patológica.
Se han descrito dos fases para la formación en la ROP, fase hiperóxica y fase hipóxica. Durante la exposición de altos niveles de oxígeno (fase hiperóxica), se reduce la secreción de VEGF, con lo cual se inhibe la angiogénesis fisiológica, sin embargo cuando el recién nacido es regresado a niveles normales de oxígeno (fase hipóxica), da como resultado una estimulación de la secreción del VEGF en retina y cavidad vítrea, estimulando la angiogénesis patológica.2
Clasificación y nomenclatura de ROP
La Clasificación Internacional de la ROP,3 se ha llevado a cabo desde 1984, en la actualidad clasifica la localización de la enfermedad, la extensión de la enfermedad, el grado de la enfermedad, la enfermedad plus, la enfermedad pre-plus y la ROP agresiva posterior.
Localización de la enfermedad: cada zona es centrada en el nervio óptico, debido a que es el origen de los vasos sanguíneos. Zona 1: es la más interna, consiste en un círculo, el radio del cual se extiende desde el centro del nervio óptico al doble de la distancia del centro del nervio óptico al centro de la mácula (30o centrales). Zona II: se extiende del límite de la zona I a la ora serrata nasal, y aproximadamente en la distancia media entre el ecuador y la ora serrata temporal. Zona III: es el espacio residual anterior desde el límite de la zona II hasta la ora serrata. Se registra por horas de reloj o por 30o sectoriales.
Estadificación o grados de la enfermedad. Grado 1: línea de demarcación, es una línea delgada, pero estructuralmente definida, la cual separa la retina vascular de la avascular. Existen vasos anormales, los cuales acompañan al plano retiniano. Grado 2: cresta, es la característica de este grado, se origina en la línea de demarcación, es más ancho y alto, se extiende por arriba del plano de la retina. Grado 3: proliferación fibrovascular extra-retiniana, existe una proliferación fibrovascular o neovascularización que se extiende desde la cresta hacia el vítreo, se subdivide en leve, moderado y severo, dependiendo de su extensión hacia el vítreo. Grado 4: desprendimiento de retina parcial, se divide en extrafoveal (4a) y foveal (4b), por lo regular son cóncavos y con una orientación circunferencial. Grado 5: desprendimiento total de retina, son por general traccionales y pueden ser ocasionalmente exudativos. Por lo regular son en túnel.
Enfermedad plus: Incluye dilatación venosa y tortuosidad arteriolar y conforme avanza la enfermedad, la ingurgitación vascular progresa, con pobre dilatación pupilar y turbidez vítrea. Enfermedad pre-plus: se define como una anormalidad vascular en el polo posterior, que es insuficiente para el diagnóstico de enfermedad plus. ROP agresiva posterior: las características clínicas de esta enfermedad son, la localización posterior, la prominente enfermedad plus y la rápida progresión. Típicamente se extiende circunferencialmente, acompañada de vasos circunferenciales.
Tomando en cuenta que no existe un tratamiento ideal para esta patología y que el bloqueo de la angiogénesis es fisiopatológicamente importante, el objetivo del presente estudio es determinar si el uso de antiangiogénicos intravítreos como monoterapia, puede ser un método eficaz y seguro para el tratamiento de la ROP de alto riesgo en los grados 3 y 4 a, en zonas I y II, con o sin plus.
Método
Estudio descriptivo, experimental, intervencional, no comparativo, prospectivo, longitudinal, no ciego, no randomizado y de eficacia de 20 ojos de 10 pacientes con diagnóstico de ROP de alto riesgo, con indicaciones de tratamiento. El periodo de reclutamiento fue de enero del 2008 a enero del 2010. El periodo de seguimiento mínimo fue de 12 meses.
Previos al tratamiento a todos los ojos se les realizó valoración mediante oftalmoscopía indirecta y fotografías del fondo de ojo con RetCamII®.
En todos los ojos, se aplicó una sola dosis de cualquier medicamento, bevacizumab (0.5 mg/0.02 cc, Avastin®, Roche, México) o ranibizumab (0.20 mg/0.02 cc, Lucentis®, Novartis, México). En ningún caso se combinaron en el mismo paciente los dos antiangiogénicos.
Se realizaron revisiones a los dos, siete, 15, 30, 42 días, y a los tres, seis y 12 meses de aplicado el medicamento.
Criterios de inclusión
Recién nacidos prematuros con ROP de alto riesgo en estadios 3 y 4 a, en zonas I y II con o sin plus, sin opacidad de medios, con el previo consentimiento informado por los padres o tutores respetando la Norma Oficial Mexicana sobre los derechos de los pacientes a conocer todo sobre su enfermedad y los posibles tratamientos para ser atendidos, así como una valoración prequirúrgica que indicara la estabilidad sistémica para la aplicación intravítrea del medicamento. Los pacientes debieron atender a todas las valoraciones durante el periodo mínimo de seguimiento.
Criterios de exclusión
Pacientes con anormalidades sistémicas u oculares, con tratamiento previo de fotocoagulación, crioterapia o esponja escleral, con opacidad de medios, con una valoración prequirúrgica anormal, negación de los padres o tutores a firmar el consentimiento informado o que faltaran a una visita del periodo mínimo de seguimiento.
Técnica de inyección intravítrea
Bajo sedación y control anestésico y pediátrico, la inyección se realizó en cuadrante temporal superior a 2.5 mm del limbo esclerocorneal, previa anestesia tópica con 2 gotas de clorhidrato de proximetacaína, asepsia y antisepsia de párpados con povidona al 10%, instilación conjuntival de 2 gotas de yoduro de povidona al 5%, lavado de fondos de saco con solución fisiológica estéril y aplicación de blefaróstato para mantener parpados abiertos. Después de la inyección, todos los ojos recibieron gotas oftálmicas de moxifloxacino (Vigamoxi®, Alcon México) cada seis horas por tres días.
Resultados
Se inyectaron once ojos con estadio 3, zona I con o sin plus, cinco ojos con estadio 3, zona II posterior con plus, dos ojos con estadio 4 a, zona I y dos ojos con estadio 4 a, zona II, con plus. Ocho ojos recibieron ranibizumab y 12 ojos bevacizumab.
Después de una semana de una sola inyección del antiangiogénico, todos los ojos mostraron una significativa inhibición de la angiogénesis patológica sin afectar la angiogénesis fisiológica. Después de seis semanas, todos los ojos mostraron vascularidad fisiológica completa de retina periférica sin dato de angiogénesis patológica. No se observaron eventos adversos sistémicos o intraoculares propios al medicamento o al procedimiento durante los 12 meses de seguimiento. No encontramos diferencia entre el ranibizumab y el bevacizumab.
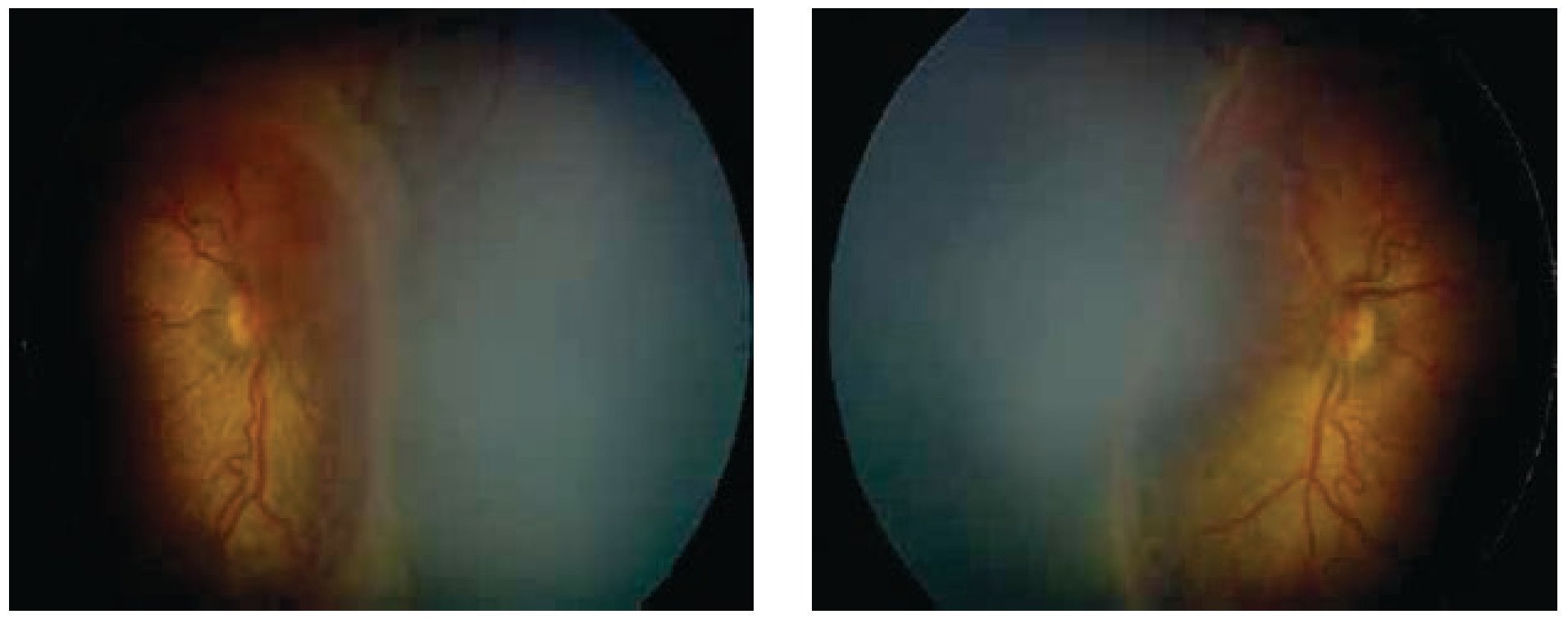
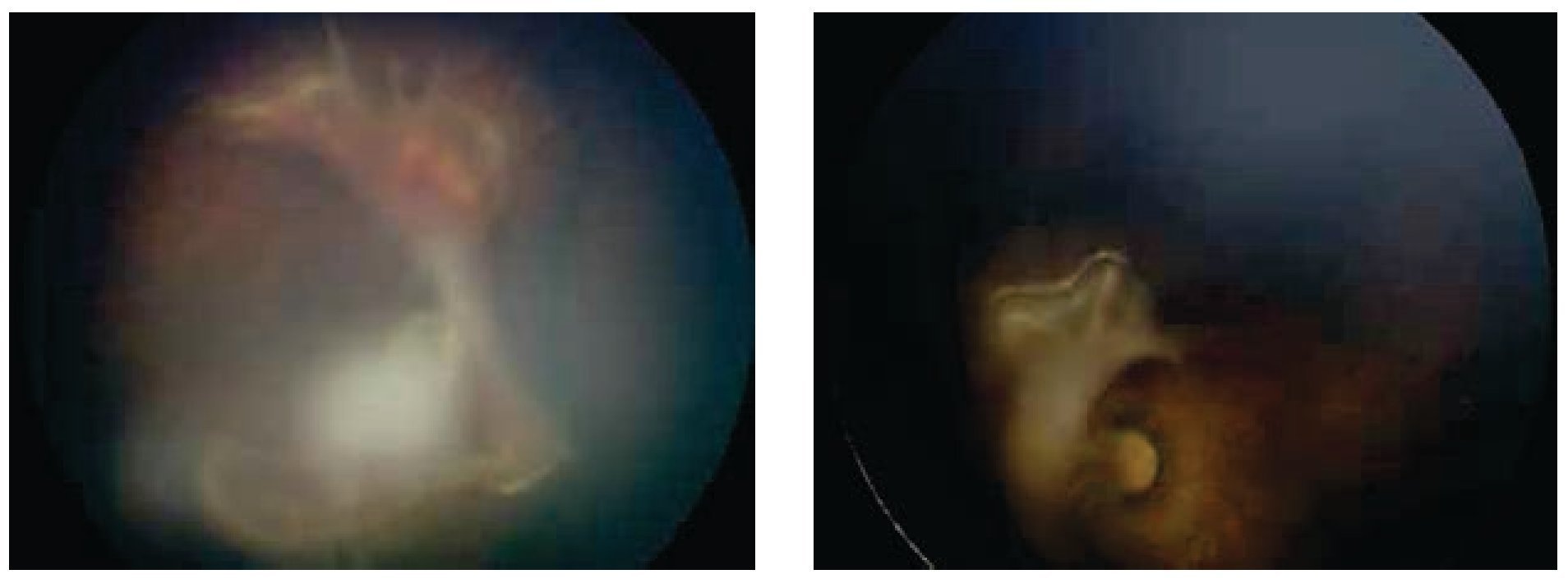
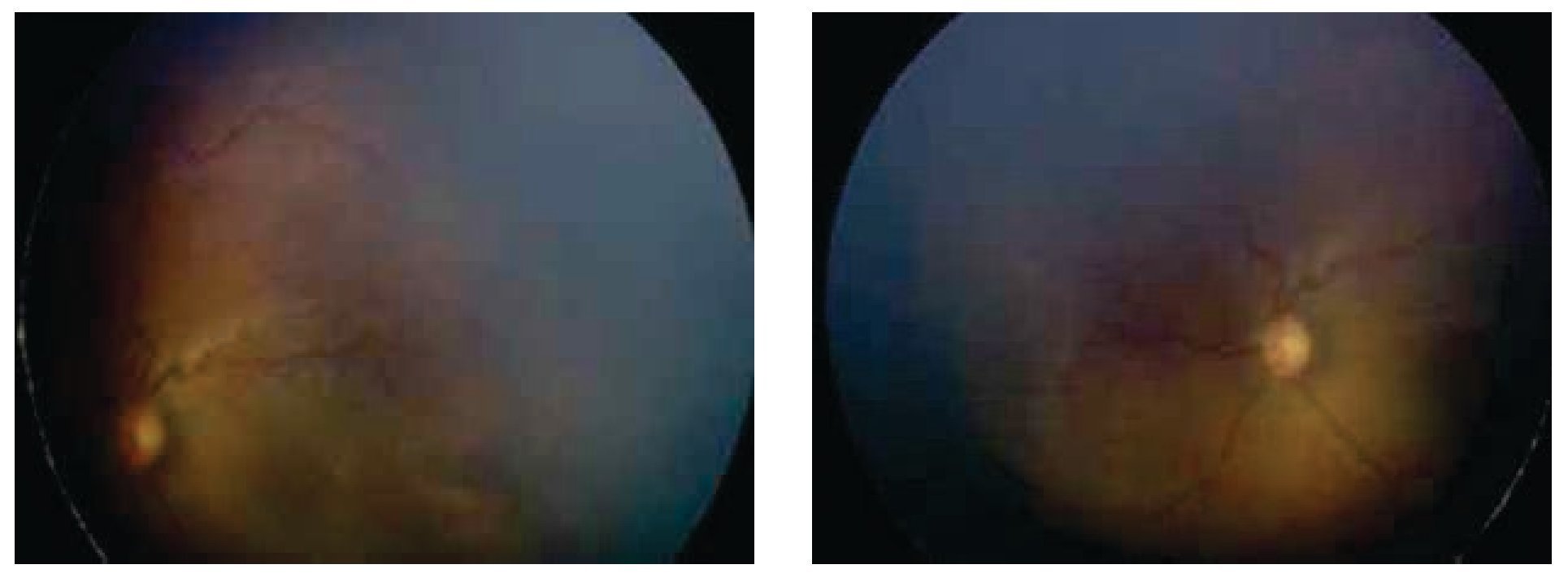
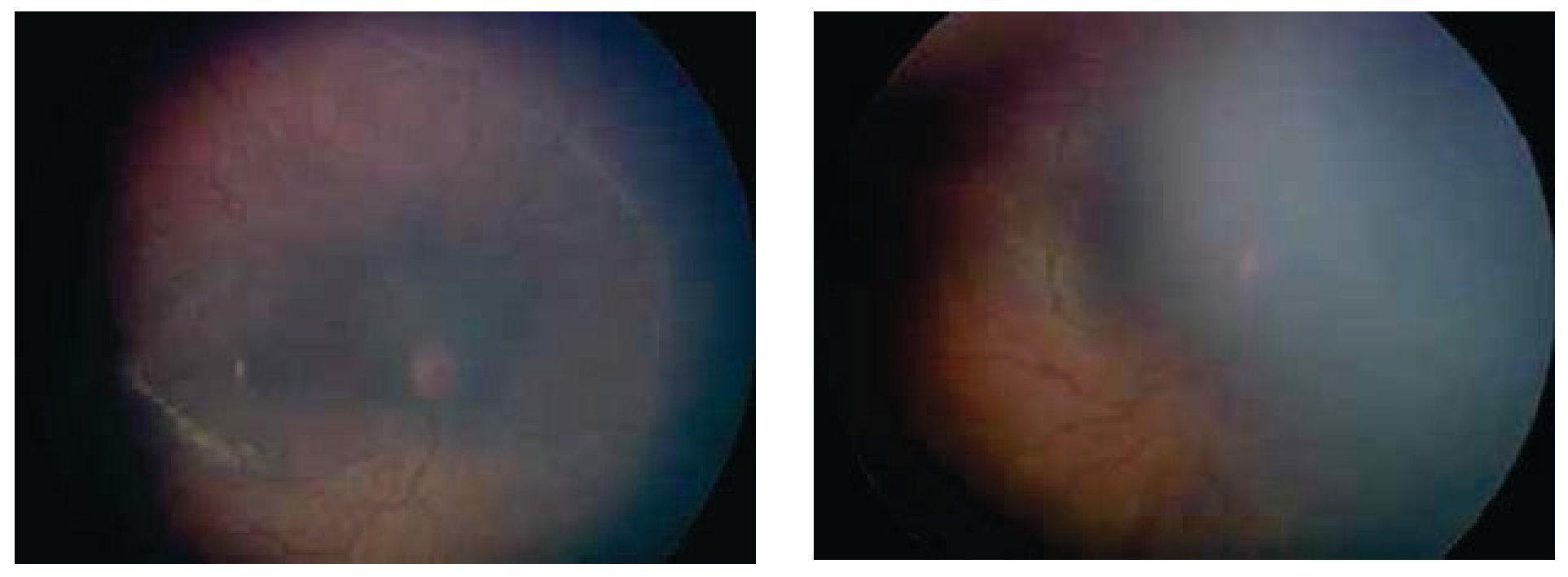
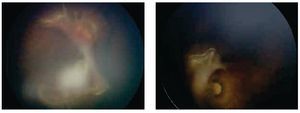
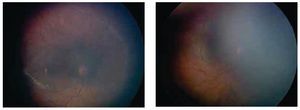
Los dos ojos con grado 4 a, zona I (mismo paciente) desarrollaron un grado importante de fibrosis en retina central con un síndrome de tracción del nervio óptico (Figuras 1 y 2), sin embargo después de 24 meses de seguimiento, no se presentó desprendimiento de retina en alguno de estos ojos.
Figura 1. Ojos derecho e izquierdo estadio 4 a, zona I preinyección.
Figura 2. Ojos derecho e izquierdo estadio 4 a, zona I. Seis semanas postinyección.
Caso clínico
Antecedentes perinatales: paciente pretérmino de 28 semanas de gestación. Primera gesta, sin control prenatal, con actividad uterina y amenaza de parto pretérmino, se realiza ultrasonido reportándose producto único vivo de 875 g. ILA normal. Se aplican dos dosis de betametasona sistémica.
Datos al nacimiento: producto único vivo que requirió intubación endotraqueal, enfermedad de membrana hialina grado 3, displasia broncopulmonar, hernia inguinal bilateral, hipospadias. Frecuencia cardiaca de 400 x min. Apgar de 3-7. Peso de 890 g. Talla 35 cm. PC 25. Silverman Anderson de 3. Por sus condiciones pasa a Unidad de Cuidados Intensivos Neonatal.
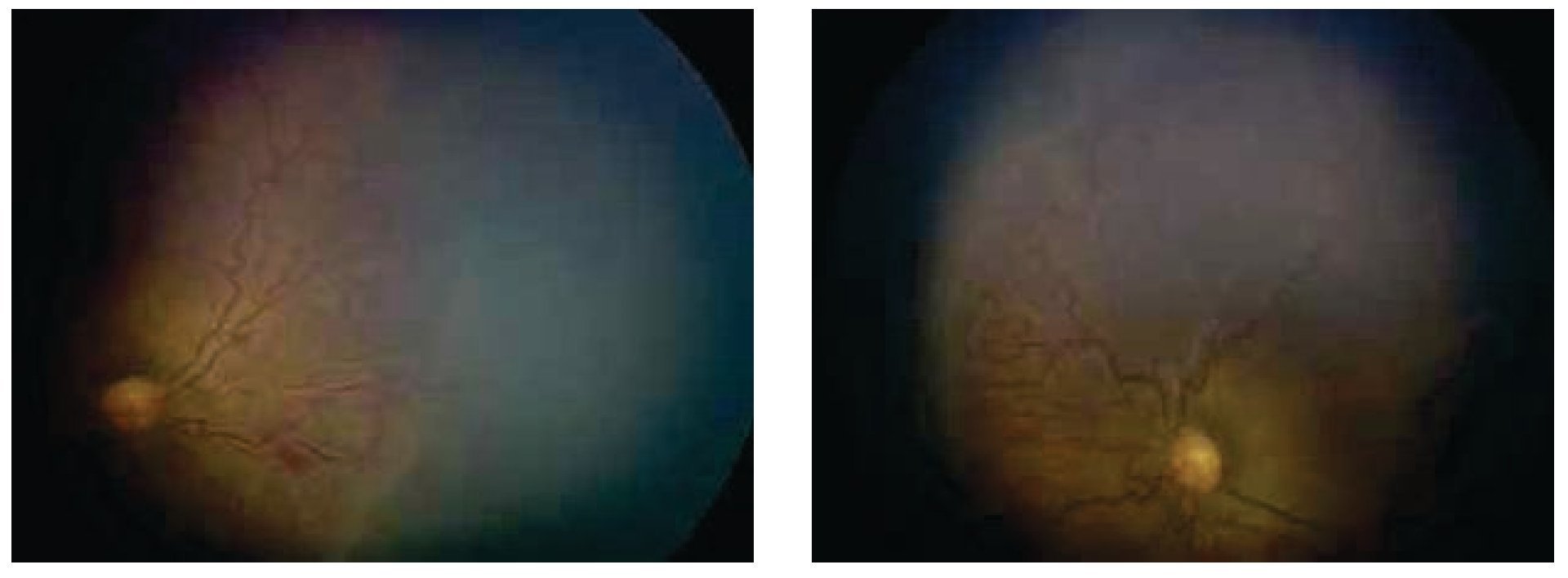
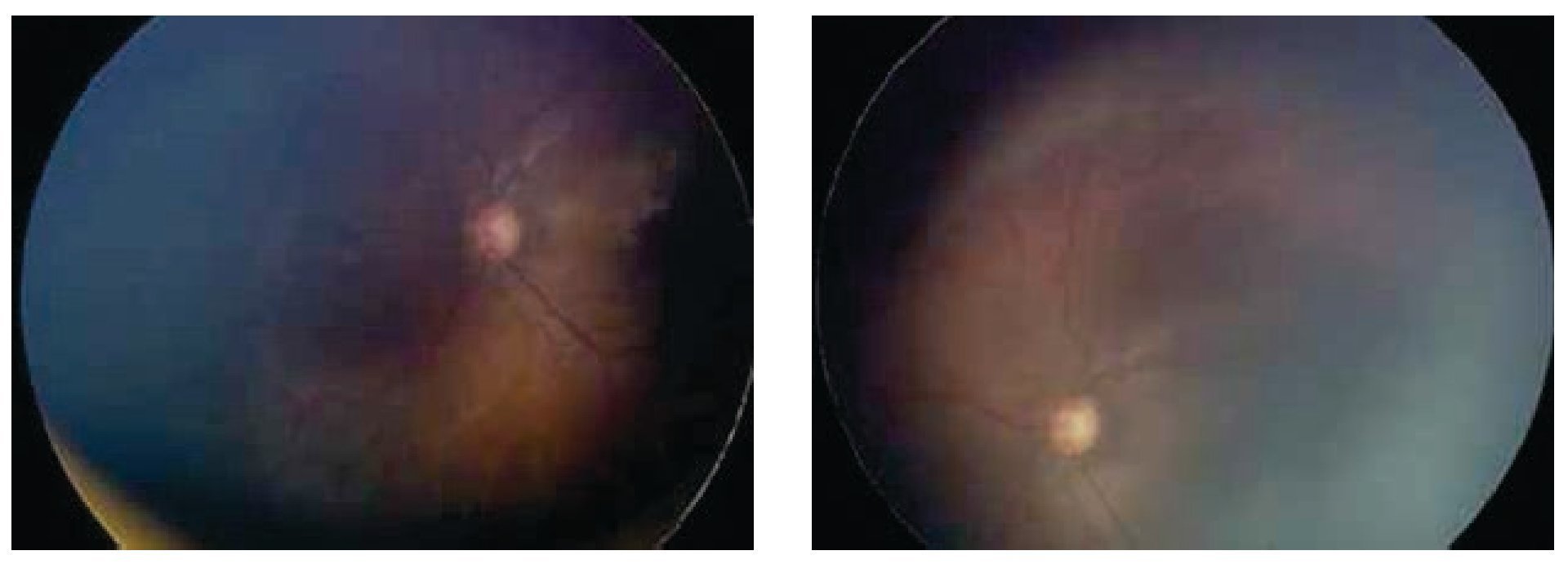
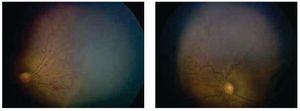
Interconsulta a Oftalmología por primera vez: peso 1680 g. VEU 37.3 semanas (corregida). Diagnóstico: ROP, zona I, estadio 3 con plus en ambos ojos (Figura 3).
Figura 3. Ojo derecho e izquierdo. Engrosamiento con proliferación fibrovascular en zona 1 y enfermedad plus.
Tratamiento a las 48 horas: ranibizumab (0.20 mg/0.02 cc, Lucentis®, Novartis, México) en ambos ojos bajo sedación.
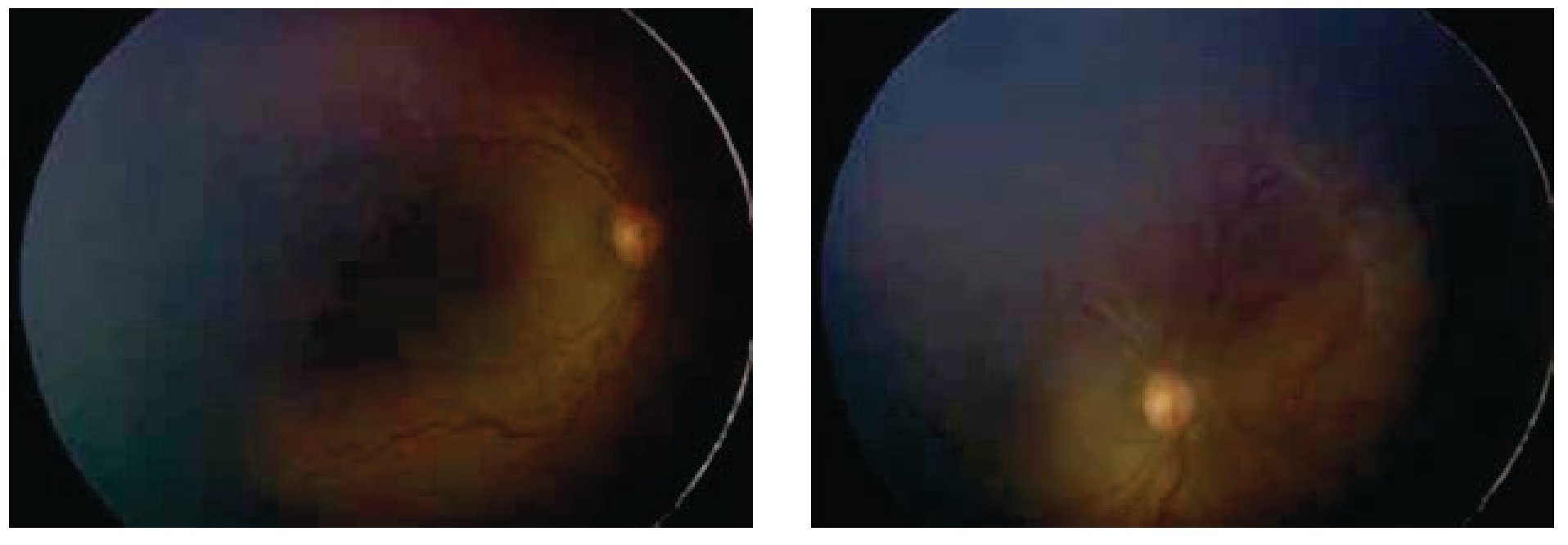
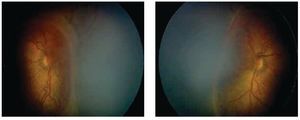
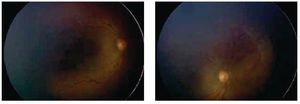
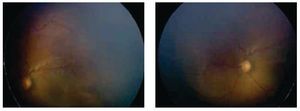
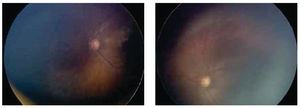
Después de una semana, se observa una inhibición marcada de la angiogénesis patológica, con disminución considerable de la enfermedad plus y crecimiento de la vascularidad retiniana normal (Figuras 4 y 5). La rapidez de este fenómeno permite ver el límite de la retina previamente y recientemente vascularizada. Después de seis semanas, el crecimiento de la vasculatura en retina periférica se ha completado sin datos de angiogénesis patológica (Figuras 6 y 7).
Figura 4. Ojo derecho. Una semana postinyección.
Figura 5. Ojo izquierdo. Una semana postinyección.
Figura 6. Ojo derecho. Seis semanas postinyección.
Figura 7. Ojo izquierdo. Seis semanas postinyección.
Discusión
En relación a la terapéutica de esta patología, el Estudio Multicéntrico de Tratamiento Temprano en la Retinopatía del Prematuro4 (ETROP, por sus siglas en inglés), mostró beneficios anatómicos y visuales en pacientes con ROP de alto riesgo que fueron tratados de forma temprana. Los resultados favorables de este estudio ofrecen la guía de referencia en el tratamiento oportuno para pacientes con ROP, y sugiere iniciar tratamiento de manera urgente (48 a 72 horas del diagnóstico) en cualquiera de las siguientes formas de presentación. ROP zona I, cualquier estadio con plus, ROP zona I, estadio 3 sin plus o ROP zona II, estadio 2 y 3 con plus.
Existen varias alternativas en tratamiento para la ROP, entre ellas se encuentran, la esponja escleral sin o con coagulación con láser en el estadio 4 a en zona II.5 La coagulación con láser en estadios 2 y 3, en zonas II y III,6 y la crioterapia que sólo se ha estudiado para el estadio 3. Sin embargo, en todos estos tratamientos se han observado efectos adversos severos, entre los cuales se enumeran la catarata, la isquemia del segmento anterior, disminución de la agudeza visual y el estrabismo.7
La ROP es la segunda causa de ceguera en los niños, el 50% de los casos la retinopatía regresa por sí sola, sin embargo, el resto puede desarrollar el desprendimiento total de la retina, con la consecuente pérdida visual irreversible. Hasta ahora se habían desarrollado tratamientos en ciertos estadios y zonas, sin embargo en estadios severos como 4 a y en áreas de retina posterior como la zona I y la región posterior de la zona II, no existe tratamiento alguno efectivo.7
Aunque múltiples reportes han demostrado la superioridad de los antiangiogénicos intravítreos sobre las terapias actuales (crioterapia y coagulación con láser), ninguno de ellos analiza el comportamiento de la angiogénesis fisiológica y patológica. Del mismo modo, aunque todos ellos aportan las bases firmes para justificar su uso, ninguno de ellos aclara las dudas para utilizarlo libremente en pacientes con ROP. La principal duda y temor es la posible inhibición en la vasculatura sistémica secundaria a la migración del antiangiogénico intravítreo a circulación sanguínea y sus respectivas consecuencias.
Al observar el comportamiento de la angiogénesis en la retina de nuestros pacientes, nuestro estudio contribuye con posibles respuestas a esta interrogante, al demostrar que los antiangiogénicos intravítreos, causan la inhibición inmediata de la angiogénesis patológica y permite el crecimiento total de la vasculatura normal de la retina periférica (estimulación de la angiogénesis fisiológica).
La circulación que no ha completado su crecimiento en los pacientes con ROP al momento de ser expuestos a la fase hiperóxica es solamente la vasculatura retiniana, por lo tanto es la única que se verá afectada al exponer nuevamente al paciente a la fase hipóxica. Sin embargo, al analizar como primer punto, la posibilidad de que al igual que la circulación en retina, en algún órgano o tejido la vasculatura tampoco hubiese terminado su periodo fisiológico. ¿Qué factor sería el responsable para que el comportamiento de la angiogénesis no fuera el mismo al que ocurre en la retina? Nuestro estudio aporta las bases para creer que este comportamiento sería el mismo y por lo tanto, beneficiaría por igual este órgano o tejido.
La posibilidad de que el antiangiogénico en circulación sistémica pudiera estimular la involución de los vasos que ya completaron su periodo fisiológico generando complicaciones previamente no existentes, genera un segundo temor. Al analizar el comportamiento de la angiogénesis del adulto podremos concluir que esto es imposible, ya que no existe reporte en la literatura de involución en la circulación normal de la retina, en pacientes expuestos por diversas circunstancias a antiangiogénicos intravítreos.
Por último y posiblemente el único temor justificado, serían los efectos tóxicos del antiangiogénico tanto a nivel ocular como a nivel sistémico. Se ha descrito reacción inflamatoria ocular después de siete inyecciones de bevacizumab.8 Un estudio de cortes histopatológicos de ojos de prematuros pequeños (350 g) y 22 semanas de gestación, no mostró efectos tisulares de toxicidad después de ser inyectados en dos ocasiones por bevacizumab.9 Si las concentraciones del antiangiogénico a nivel ocular no causan un efecto tóxico, y tomando en cuenta que la molécula de estos antiangiogénicos es lo suficientemente grande para ser absorbido a circulación sistémica -bevacizumab en muy bajas concentraciones-,10 es cuestionable que cualquiera de los dos causen un efecto tóxico a nivel sistémico. Un estudio multicéntrico reciente, que incluyó una serie de 300 ojos prematuros, indica que para valorar la mortalidad inducida por el uso de bevacizumab en comparación con la terapia convencional de láser, se requiere de más de 2 800 casos.11
Debido a que los antiangiogénicos inhiben de manera temporal al VEGF, estos no son el tratamiento curativo de ninguna patología crónico-degenerativa donde este factor esté presente. Por mencionar las patologías más frecuentes, a la retinopatía diabética proliferativa, el edema macular diabético y la degeneración macular relacionada a la edad. En estos casos, las reaplicaciones del antiangiogénico son indispensables. A diferencia de éstas, ROP no es una enfermedad crónico-degenerativa y debido a las circunstancias hiperóxica-hipóxica, el VEGF se ve importantemente elevado el tiempo necesario para causar la ceguera total de nuestros pacientes. Nuestro estudio demuestra que con una sola aplicación del anti-angiogénico, el control absoluto sobre el VEGF durante el tiempo necesario para concluir la circulación fisiológica de la retina es posible (vida media de los antiangiogénicos en vítreo entre cinco y 10 días),12,13 lo que ofrece las bases para cuestionar si los antiangiogénicos en ROP, a diferencia de las patologías del adulto, son curativos.
Nuestro estudio ofrece una alternativa de tratamiento eficaz y seguro, en ojos donde las opciones actuales de tratamiento no logran prevenir el deterioro visual importante descrito en los casos severos y la posibilidad para ser usado en cualquier estadio de la patología.
Además de las múltiples complicaciones asociadas a las terapias actuales y del largo entrenamiento para adquirir la pericia en la aplicación de las mismas, la aplicación tópica de anestésico bajo sedación -necesaria para la inyección intravítrea-, permite disminuir el riesgo de mortalidad que se presenta con la anestesia general balanceada.
Debido a los conocidos efectos de los antiangiogénicos en la inducción a la fibrosis y a nuestros hallazgos, recomendamos revalorar la inclusión de pacientes con grado 4 a, en especial si se encuentra en zona I.
Conclusión
La inyección intravítrea de ranibizumab y bevacizumab inhibe la angiogénesis patológica y permite el desarrollo de la vascularidad normal de la retina en ROP. Este estudio demuestra que la terapia antiangiogénica intravítrea no causa inhibición de la angiogénesis fisiológica en los vasos sanguíneos de la retina, y sugiere que el mismo comportamiento en el proceso vascular sistémico podría ocurrir. Estudios prospectivos, controlados, randomizados y multicéntricos para corroborar nuestros resultados deben ser realizados.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Financiamiento
Los autores no recibieron ningún patrocinio para llevar a cabo este artículo.
Recibido: Abril 2013.
Aceptado: Octubre 2013
Correspondencia:
Dr. med. Jesús Hernán González Cortés.
Servicio de Oftalmología, Hospital Universitario "Dr. José Eleuterio González", Universidad Autónoma de Nuevo León.
Av. Madero y Gonzalitos s/n, Colonia Mitras Centro, C.P. 66460, Monterrey, N.L., México.
Teléfono: (81) 8346 9259. Fax: (81) 8348 7229.
Correo electrónico: drjesusgzz@gmail.com