Introducción: En la preservación de tejidos, la fijación es obligada para conservar la arquitectura estructural/química lo más semejante al estado in vivo; la sustancia más utilizada con este propósito es el formaldehído. En la literatura y en nuestra experiencia, hemos observado imágenes de embriones/fetos, conservados en este fijador, con una cantidad variable de nódulos blanquecinos (NB) en sus órganos incluida la piel.
Objetivo: Eliminar mediante la deshidratación con alcohol etílico, los NB presentes en la superficie del riñón fetal.
Material y métodos: Mediante fórmula aleatoria, fueron seleccionados productos de aborto, de la colección del Departamento de Embriología, recibidos entre los años 2005-2009. Se determinó su edad, género y presencia o no de anomalía(s), según estándares internacionales. Bajo estereomicroscopía, los riñones con NB fueron sometidos a deshidratación-rehidratación, análisis químico de color para formol o a cortes histológicos coloreados con H-E; para los dos últimos tratamientos se utilizó un control.
Resultados: Después de la deshidratación los riñones no mostraron NB, pero sólo hasta después de la rehidratación su imagen fue más nítida. El análisis químico para formol fue negativo. Histológicamente, la imagen renal entre los especímenes con/sin NB fue semejante.
Conclusiones: Siendo para la biología del desarrollo/embriología la morfología un parámetro importante para determinar calidad del desarrollo intrauterino, se propone esta técnica de deshidratación-rehidratación, que no daña los tejidos, como método efectivo para eliminar artefactos como lo son los NB; al mejorar la imagen macroscópica, la descripción del desarrollo de embriones/fetos será más apegada a la realidad, evitándose incluso la edición fotográfica.
Introduction: Tissue fixation is a must if you want to preserve the structural and chemical conditions similar to those in vivo. The most widely used chemical for this purpose is formaldehyde. In our experience and in the medical literature, we have seen embryo or fetal images that show whitish nodules (WN) on the surfaces of their organs, skin included.
Objective: The purpose of the study was to remove the WN of the surface of the fetal kidneys by dehydration-hydration with ethanol.
Material and methods: The products were selected at random from the sample collection received at the Department of Embryology during the period 2005-2009. Age, gender and the presence or absence of abnormalities were recorded according to international standards. Under Zeiss microscopy the kidneys were visualized, those who had WN were treated with the dehydration-hydration procedure. The chemical analysis of color for formalin was negative. Histological sections and H-E staining were performed. For the last two procedures a control was used.
Results: After dehydration, the kidneys were WN free, but it was until after hydration that the image was sharper. The histological images after the procedure were very similar between the specimens with WN and the control.
Discussion: Therefore, the dehydration-hydration procedure, which does not damage the tissues, is proposed as an effective method to improve the macroscopic aspect of tissues preserved in formaldehyde avoiding a possible photo editing.
Introducción
Para conservar un producto humano que ha sido abortado, la fijación tisular es un paso obligado, ya que ésta mantiene en este tipo de piezas la arquitectura tanto estructural como química, lo más parecida al estado in vivo. Por otra parte, un fijador también prepara a los tejidos para su posterior manipulación (cortes histológicos o algún otro tipo de procesamiento). En la mayoría de los casos, la sustancia utilizada como fijador adecuado para estos propósitos es el formaldehído simple por actuar rápido, tener una mayor capacidad de penetración, además de ser práctico y fácil de manejar.1-6 Sin embargo, en ocasiones al consultar publicaciones idóneas a nuestro quehacer académico, se observa la imagen macroscópica de un embrión/feto ex útero, con una cantidad variable de nódulos blanquecinos (NB) en la superficie de sus órganos, inclusive en la piel.7,8 En nuestra experiencia, al revisar productos como los citados y que se conservan en formaldehído al 10%, utilizando ya sea óptica tradicional o a simple vista, también observamos NB los cuales al intentar retirarlos desafortunadamente se desgarra la superficie donde se encuentran dañándose la pieza, habitualmente de gran valor por la dificultad para volver a obtener otra similar en buenas condiciones.
Al revisar la literatura, donde se citan estudios con diversos enfoques en tejidos embrionarios o fetales y que han sido fijados en formaldehído, no se encontró información que hiciera referencia a la presencia de los depósitos referidos en este trabajo como NB.9-14 Por otro lado, en nuestro laboratorio al elaborar preparaciones de piezas que presentaban estos NB, con la técnica histológica y utilizando hematoxilina y eosina (H-E) como colorantes, se observó que éstos ya no estaban presentes antes de la inclusión en Paraplast (Leica microsystems) o al final del procesamiento (revisión al microscopio óptico). Para descartar que realmente su ausencia no fuera porque las piezas muestran un aspecto homogéneo en el primer caso, o que realmente se perdieran durante el procesamiento de coloración, nos propusimos investigar en cuál de los pasos de la técnica ocurriría esto, particularmente antes de la microtomía y después del montaje. Empezamos a revisar las piezas después de la fijación tisular en formaldehído de la técnica histológica en mención, este paso es la deshidratación.15 Para este trabajo se decidió centrar la investigación a una región en particular, enfocándonos en el riñón por su accesibilidad. El objetivo fue eliminar, mediante la deshidratación con alcohol etílico, los NB presentes en la superficie del riñón fetal de productos de aborto humanos conservados en formaldehído al 10%.
Materiales y métodos
Acervo de productos de aborto del Departamento de Embriología, registrados desde 2005 al 2009 (n=111). Algunas piezas estaban íntegras o presentaban disección torácica, abdominal o pélvica, pues han sido objeto de otras investigaciones. Su edad gestacional en semanas y su género, se determinaron según estándares de longitud cráneo-caudal y por sus genitales externos o gónadas, respectivamente.16,17 Siguiendo la fórmula de la muestra aleatoria para una población finita (obtención del tamaño de la muestra), se seleccionaron 10 productos.18 Se anotó si estaba presente o no algún tipo de anomalía del desarrollo visible.19-24 Los productos fueron revisados bajo un estereomicroscopio Zeiss®, Stemi III B. Una vez que fueron retiradas las vísceras abdominales, se visualizaron los riñones seleccionándose la superficie frontal visible de ambos órganos para la detección de los NB (Figura 1). Aquellos que los presentaban fueron sometidos a deshidratación, iniciando con alcohol etílico 35°, 50°, 70°, 80°, 90° y 100°, por 24 horas en cada uno de estos alcoholes, para luego iniciar su rehidratación en orden inverso. Una vez que se llegaba a los 35°, nuevamente se conservaron los productos en formaldehído al 10%. En cada uno de los pasos de este procedimiento de deshidratación-rehidratación, se guardó registro gráfico mediante fotografías tomadas con una cámara digital Sony®, analizándose los hallazgos. Además, se hizo un análisis histológico y químico de los NB, en otras piezas. En el primer caso, se procesaron muestras representativas con la técnica de H-E; para el segundo caso, previos lavados por 24 horas con agua destilada, se hizo una determinación cualitativa con reacción de color para el formol. En estos dos últimos tratamientos se utilizaron especímenes sin NB, como control.
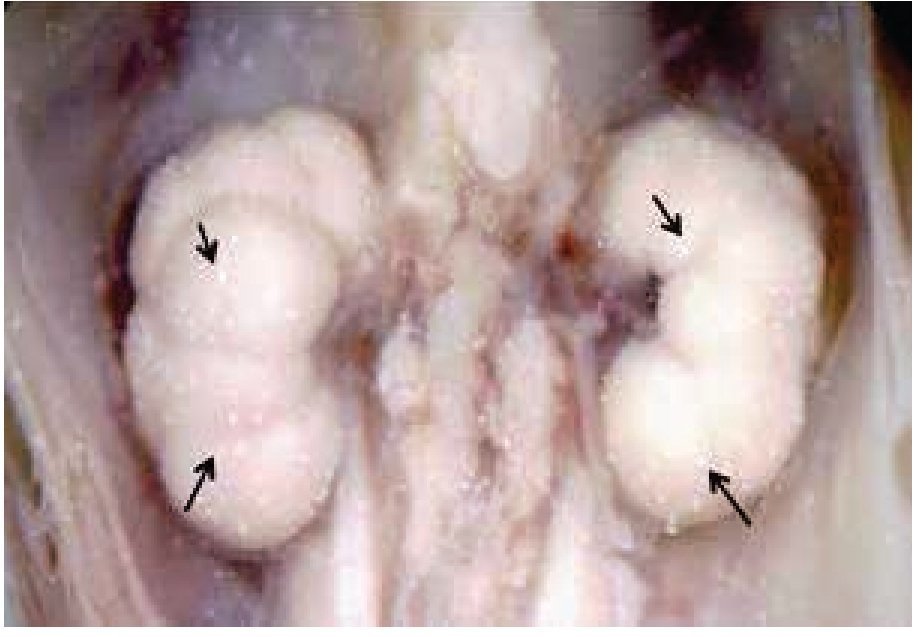
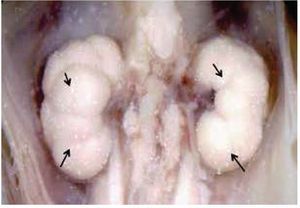
Figura 1. Feto humano masculino, de 12 semanas de gestación. Se han retirado las vísceras abdominales para mostrar la superficie frontal de ambos riñones con los NB (flechas).
Resultados
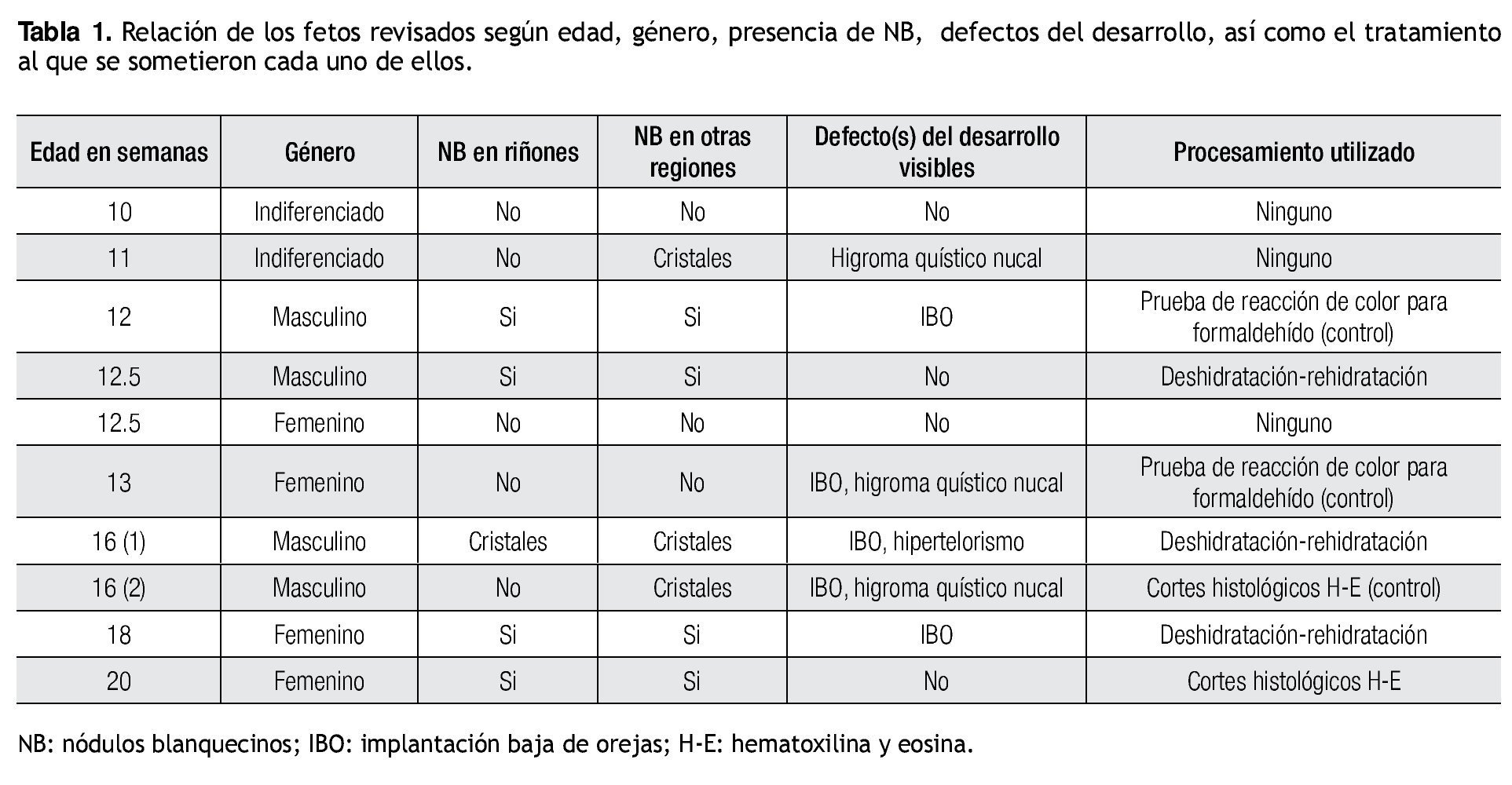
La Tabla 1 muestra las características de los productos revisados, así como también resume el tratamiento al cual fueron sometidos cada uno de ellos.
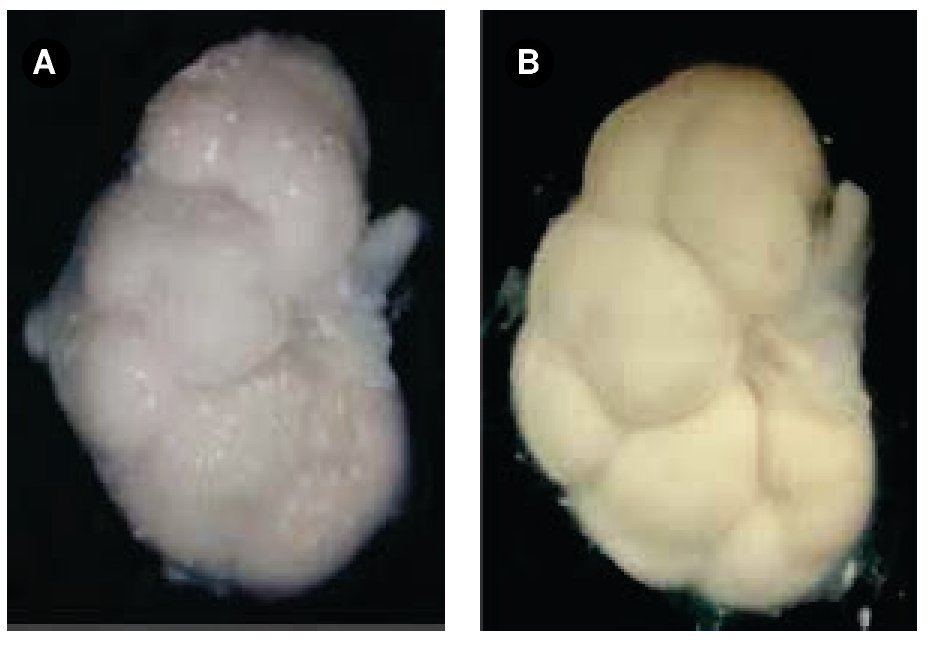
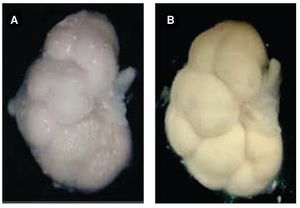
En uno de los productos se observaron precipitados de aspecto de cristal, no nodulares en ambos riñones, pero recordaban a los NB por lo que fueron considerados como tales. Después de la deshidratación con alcohol 70°, los riñones se observaron ya casi libres de los NB y seguían íntegros sin distorsión en su morfología. Sin embargo, consideramos que no es sino hasta el final de la deshidratación-rehidratación de las piezas, en que éstas mostraron la superficie de los riñones más limpia y un aspecto más nítido (Figura 2). Cuando la rehidratación no se lleva a cabo, aunque ya se hayan eliminado los NB con la deshidratación, la imagen fotográfica no es tan clara, probablemente debido a que el tejido está inmerso en soluciones de diferente densidad a la alcanzada después de la rehidratación, hallazgo observado en nuestro laboratorio con otros fetos, fuera de esta serie.
Figura 2. Riñón de un feto masculino de 16 semanas de gestación. A) Muestra la superficie frontal con presencia de NB antes de la deshidratación. B) La misma superficie renal, después del proceso de deshidratación-rehidratación, se observa completamente libre de NB, la imagen es más nítida. Cámara digital Sony®.
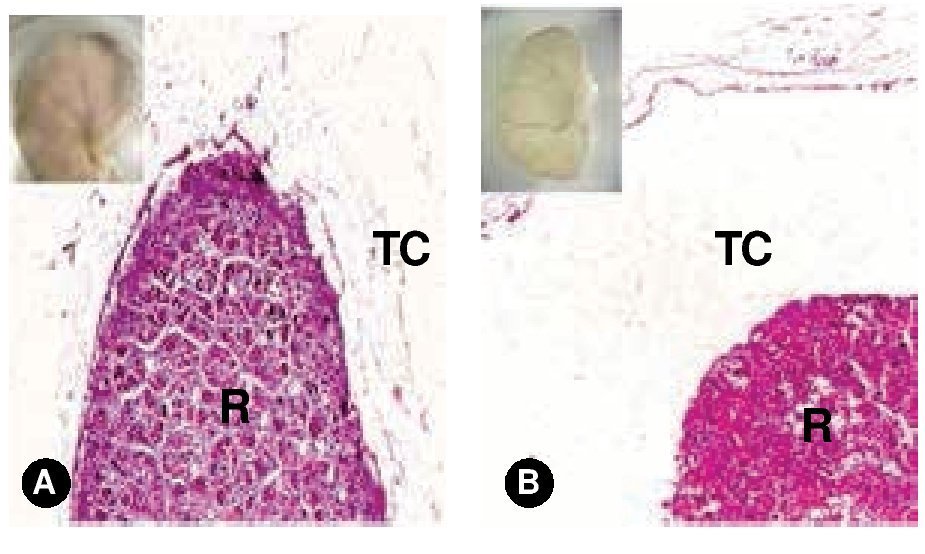
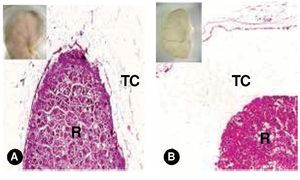
La determinación cualitativa con reacción de color para el formol se reportó negativa. Histológicamente, la revisión de los cortes no mostró diferencia en el tejido perirrenal, observándose una imagen semejante a tejido conjuntivo laxo en los riñones que inicialmente mostraban NB y el de control (Figura 3).
Figura 3. Riñones fetales. A) Corte histológico del riñón de un feto femenino de 20 semanas que presentó NB (recuadro). B) Corte histológico del riñón de un feto masculino de 16 semanas sin NB -control- (recuadro). En ambas microfotografías el tejido conjuntivo que cubre la superficie renal muestra un aspecto muy semejante (H-E, 5X). R: riñón; TC: tejido conjuntivo.
Discusión
Ni la edad, el género, la manipulación, la coexistencia de algún trastorno en el desarrollo o el tiempo de contacto de los productos con el formaldehído al 10% (en este estudio el máximo fue de cinco años), fueron factores que marcaran diferencia en la presencia de los NB.
El reporte negativo de la presencia de formol en el análisis químico descartó la posibilidad de que los NB representaran un precipitado de dicho fijador, lo que inicialmente había sido considerado, por ser este químico, la única sustancia a la cual estuvieron expuestos los fetos por tiempo prolongado, además de no presentarse los NB en el proceso normal de desarrollo intrauterino. Por otro lado, histológicamente tampoco se observó tejido de aspecto nodular en la superficie renal, el cual se pudo haber eliminado durante el proceso de deshidratación inherente a la técnica histológica con H-E.
Cabe señalar también, que después de la deshidratación-rehidratación de los riñones, el resto de los tejidos fetales también mostraron mejoramiento en la imagen. Una vez alcanzado el objetivo inicial del estudio, el resto de los pasos de la técnica histológica en mención ya no fueron revisados, pues como ya se ha mencionado, a la revisión histológica tampoco estarían presentes.
Conclusiones
Aunque está por determinar la naturaleza de los NB, ensayos previos en nuestro laboratorio, también con fetos humanos de edades semejantes, revelan hallazgos y resultados similares a los del presente estudio en otros órganos o regiones corporales. Siendo en nuestro caso, el principal campo de interés la biología del desarrollo/ embriología, la morfología ya sea macro o microscópica, juega un papel muy importante como parámetro para detectar alguna malformación o para señalar el grado de desarrollo de una determinada parte embrionaria o fetal, más tratándose de material humano, por lo que al liberarlas de artefactos como los son los NB, este método representa un gran apoyo para la enseñanza e investigación de nuestra disciplina.
Por lo anterior, al momento se propone esta técnica de deshidratación-rehidratación con alcohol etílico, fácil de realizar y que no daña a los tejidos, como método efectivo para mejorar la imagen macroscópica de productos embrionarios/fetales u órganos, lo que permitiría además una descripción de su desarrollo más apegada a la realidad; e incluso evitaría la edición fotográfica de este tipo de piezas valiosas por la dificultad para su obtención y que requieren de conservarse, incluso por tiempos prolongados, para propósito de complementar el aprendizaje de la biología del desarrollo/embriología.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Financiamiento
Los autores no recibieron ningún patrocinio para llevar a cabo este artículo.
Recibido: Mayo 2012.
Aceptado: Junio 2013
Correspondencia:
Dr. med. María Esthela Morales Pérez.
Departamento de Embriología, Facultad de Medicina, Universidad Autónoma de Nuevo León.
Edificio de Ciencias Morfológicas I. Dr. Eduardo Aguirre Pequeño y Calzada Francisco I.
Madero s/n, Colonia Mitras Centro, C.P. 64460, Monterrey, N. L., México.
Teléfono/Fax: (81) 8329 4187.
Correo electrónico: mariaesthela100@yahoo.com.mx