La obtención del material trombótico en el ictus isquémico desde la generalización de la trombectomía mecánica ha permitido un estudio exhaustivo del mismo y de los posibles mecanismos fisiopatológicos subyacentes a su formación.
DesarrolloLos mecanismos trombóticos implicados en los diferentes lechos vasculares no difieren en exceso, condicionando una heterogeneidad importante que ha dificultado la identificación de patrones asociados al origen o etiología del ictus. Se ha observado, sin embargo, una mayor influencia de factores como el tiempo de desarrollo del coágulo, el estado inflamatorio sistémico o la activación de vías inmunes y de la coagulación (liberación de Neutrophil extracellular traps [NETs], agregación plaquetar, activación endotelial y liberación del factor de von Willebrand). Como resultado, en el seno del trombo conviven en proporciones variables áreas ricas en eritrocitos y áreas ricas en plaquetas/fibrina con una íntima relación entre ellas, y acompañadas con frecuencia de una coraza protectora con alto contenido en fibrina, factor von Willebrand y NETs. La presencia de estos componentes, así como su disposición e interrelación ha demostrado tener efectos en la resistencia a los diferentes tratamientos revascularizadores. El conocimiento de estas vías ha permitido el desarrollo de posibles terapias adyuvantes con capacidad de potenciar los tratamientos fibrinolíticos actuales y/o aumentar la eficacia del tratamiento endovascular.
ConclusiónEl conocimiento de los componentes del trombo y los posibles mecanismos implicados en su formación es una potencial vía de desarrollo en el tratamiento del ictus isquémico con resultados prometedores.
Since mechanical thrombectomy has allowed ischemic stroke thrombi retrieval, its exhaustive study has involved a better knowledge of physiopathological processes implied in its formation.
DevelopmentThrombotic pathways involved in the different vascular beds shared common mechanisms conditioning difficulties in the identification of specific patterns associated with stroke etiology. Other factors as clot formation time, associated inflammatory status or activation of additional immune and coagulation pathways (Neutrophil extracellular traps [NETs] delivery, platelet aggregation, endothelial activation and Von Willebrand Factor release) have been described as determinants in thrombus characteristics. In consequence, variable proportions of fibrin/platelet-rich and erythrocyte-rich areas coexist among the thrombus with a close relation within them, accompanied frequently by a protective outer shell with high concentrations of fibrin, NETs and Von Willebrand Factor. The presence of these components, as well as its distribution and interrelationships have demonstrated to have effect on thrombus resistance to revascularization treatments. An adequate knowledge of this pathways has allowed to develop adjuvant therapies capable of enhance current fibrinolytic drugs and/or increase efficacy of endovascular treatments.
ConclusionThe knowledge of thrombus components and mechanisms involved in its formation open a potential way in ischemic stroke therapeutics with promising perspectives.
El ictus es una de las causas principales de discapacidad y muerte en nuestro entorno1, representando el ictus isquémico, producido por la obstrucción al paso de flujo arterial en las estructuras encefálicas, el 80% de todos los ictus2. El principal agente oclusivo en las arterias cerebrales suele ser material trombótico resultante de procesos de trombosis causados por diversas etiologías. La extracción de este material trombótico con la llegada de procedimientos endovasculares3 ha permitido su análisis detallado y un crecimiento exponencial de estudios referentes al análisis histopatológico del trombo. En esta línea, se han publicado documentos de consenso que buscan la estandarización de los procesos de obtención, manipulación y estudio del trombo4.
En este documento se realiza una revisión del estado actual del estudio del trombo en el ictus isquémico, así como de algunas de sus aplicaciones: el conocimiento del proceso fisiopatológico subyacente a su formación; la identificación de patrones asociados a ictus de distintas etiologías que permitan su identificación en situaciones de incertidumbre (ictus indeterminado); el análisis de factores predictores de respuesta a los tratamientos revascularizadores actuales; o la posibilidad de nuevas terapias que potencien o sustituyan a los tratamientos actuales.
DesarrolloComposición del trombo y conocimiento del proceso fisiopatológico subyacenteEn el proceso de trombosis están implicados un compendio de agentes que interaccionan en distinto grado en cada caso hasta la consecución final en la formación del trombo oclusivo. Los mecanismos implicados en el desequilibrio trombosis/fibrinólisis que conducen hacía la formación del coágulo son variados, lo que explica la gran heterogeneidad observada mediante el análisis histológico del trombo6.
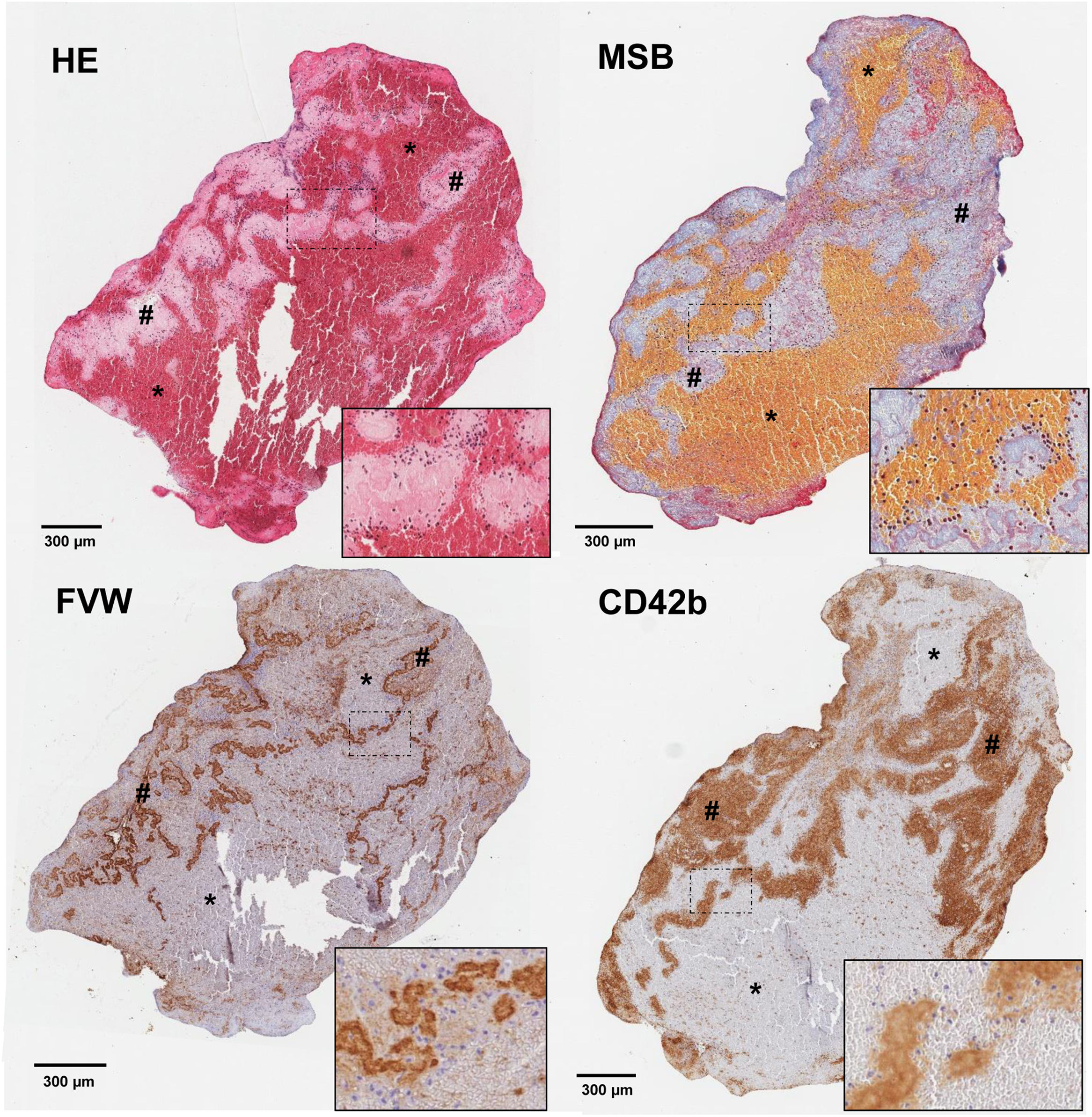
Uno de los factores más estudiados es el lugar y las condiciones de formación del trombo y cómo repercute el ambiente físico/químico en el que se crea en la composición del mismo. En trombos formados en el lecho arterial, secundarios al daño endotelial, la activación plaquetar5 por la vía del factor tisular y la acción del factor de Von Willebrand (FVW)6 conllevan una implicación precoz de la trombina, y la rápida formación de una malla extensa de fibrina cuyo entrecruzamiento está mediado por el factor XIII plaquetar (FXIII) liberado tras su activación7. Este fenómeno se produce en condiciones de flujos rápidos que favorecen la formación de capas con una intrincada interfaz entre zonas ricas en plaquetas/fibrina y zonas ricas en eritrocitos que dan lugar a las conocidas cómo líneas de Zahn8 (fig. 1). Sin embargo, este mecanismo no es único, y la presencia de estasis sanguínea con relación a placas de ateroma o alteraciones anatómicas9, y el ambiente protrombótico asociado al estado inflamatorio propio de la ateromatosis sistémica están también presentes10. A nivel de cavidades cardiacas, los mecanismos involucrados incluyen la activación de la vía extrínseca por una situación de endocardio dañado, un contexto de estasis sanguíneo y la pérdida del equilibrio hemostático a favor de una situación protrombótica11. Los mecanismos implicados en ambos territorios son por tanto similares, y a su vez variados, lo que apoya parte de la heterogeneidad y del solapamiento observados en los estudios realizados12.
Cortes histológicos de trombo de paciente con ictus isquémico con las siguientes tinciones: hematoxilina-eosina (H&E); Martius Scarlet Blue (MSB); inmunotinción específica para el factor de Von Willebrand (FVW); e inmunotinción específica para plaquetas CD42b+. Se marcan con (*) las áreas ricas en plaquetas y con (#) las zonas ricas en eritrocitos. En la esquina inferior derecha de cada imagen se facilita un aumento ×20 de las áreas señaladas.
Fuente: Imágenes cedidas por el Laboratorio de Aterotrombosis, CIMA/Universidad de Navarra.
Muchos autores han intentado asociar el contenido relativo de cada uno de los componentes principales del trombo con la etiología del ictus con resultados dispares (tabla 1). En los últimos años la publicación de series más largas13–15 sugiere una mayor presencia de eritrocitos en trombos de origen ateroesclerótico, y especialmente en los secundarios a procesos de disección vascular o rotura de placa ateromatosa, y una mayor concentración de fibrina y plaquetas en los trombos de origen cardiaco, sin poder descartar, sin embargo, que esto último se deba al uso previo de anticoagulación16. No obstante, la gran variabilidad observada parece imposibilitar una clasificación etiológica factible considerando solo estos parámetros. En esta línea, en base a la serie más amplia publicada hasta la fecha15, Brinjikji et al. reconocen no encontrar diferencias clínicamente significativas que permitan discernir entre etiología cardioembólica y aterotrombótica conforme a las tinciones histológicas habituales, a pesar de encontrar diferencias estadísticamente significativas dado el amplio tamaño muestral (n=1.350 trombos).
Composición del trombo y etiología del ictus
| Clasificación etiológica | Composición del trombo |
|---|---|
| Cardioembólico | ↔ eritrocitos y fibrina entre etiologías N=2591 |
| ↔ eritrocitos y fibrina entre etiologías N=5092 | |
| ↑ eritrocitos con ↔ fibrina entre etiologías N=1793 | |
| ↔ fibrina entre etiologías N=2232 | |
| ↑ eritrocitos y ↓ fibrina con ↔ plaquetas entre etiologías N=3794 | |
| ↑ fibrina y ↑ cels inflamatorias N=3228 | |
| ↑ fibrina y ↑ cels inflamatorias con ↓ eritrocitos N=13713 | |
| ↑ NETs N=6826 | |
| ↑ fibrina y ↑ cels inflamatorias con ↓ eritrocitos N=18770 | |
| ↑ fibrina y ↔ cels inflamatoria entre etiología N=7964 | |
| ↑ eritrocitos N=3766 | |
| ↑ macrófagos N=8595 | |
| ↑ NETs N=8033 | |
| ↑ fibrina y plaquetas y ↓ eritrocitos con ↔ cels inflamatorias N=1.35015 | |
| Aterotrombótico | ↑ fibrina con ↔ plaquetas entre etiologías N=3794 |
| ↑ linfocitos T N=5434 | |
| ↑ eritrocitos y ↓ fibrina N=3228 | |
| ↑ eritrocitos y ↓ fibrina N=7964 | |
| ↑ plaquetas N=10596 | |
| ↑ eritrocitos y ↓ fibrina y plaquetas con ↔ cels inflamatorias N=1.35015 | |
| Ictus asociado a cáncer/estado hipercoagulabilidad | ↑ plaquetas N=3249 |
| ↑ fibrina y plaquetas N=15250 | |
| ↑ fibrina y plaquetas N=1.35015 | |
| Disección arterial | ↑ eritrocitos N=2232 |
| ↑ eritrocitos N=1.35015 |
cels: células; NETs: Neutrophil extracellular traps.
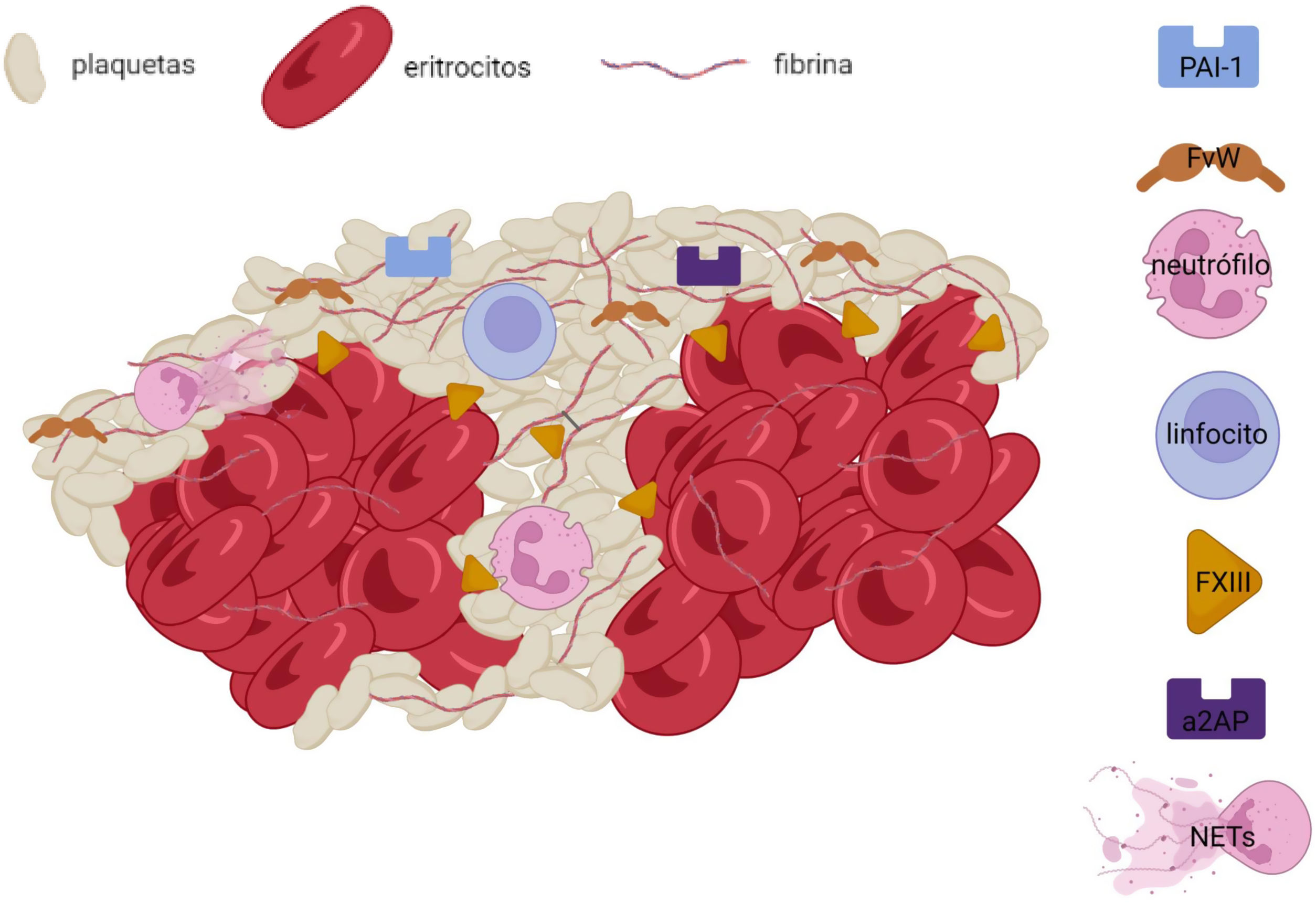
Más allá de los componentes predominantes en el trombo (eritrocitos, plaquetas y fibrina), existen otros constituyentes importantes de la matriz del trombo en el ictus isquémico. Uno de los elementos más estudiados es el FVW, una glicoproteína implicada en la activación y adhesión de las plaquetas entre sí y con la matriz subendotelial. Su presencia se ha asociado con la concentración de plaquetas, leucocitos y fibrina en el trombo17,18 e inversamente con la de eritrocitos19, distribuyéndose especialmente en las áreas ricas en plaquetas y en los límites de las mismas próximos a regiones ricas en fibrina20 (figs. 1 y 2). Está interrelación de la fibrina y el FVW en las regiones ricas en plaquetas sugiere una interacción directa entre estas 2 moléculas, con una potencial acción estabilizadora del trombo, pudiendo influir en la resistencia a la fibrinólisis observada en algunos trombos. Adicionalmente, el FVW está implicado en el proceso de reclutamiento de leucocitos en el trombo y su adhesión al resto de estructuras mediada por integrinas21.
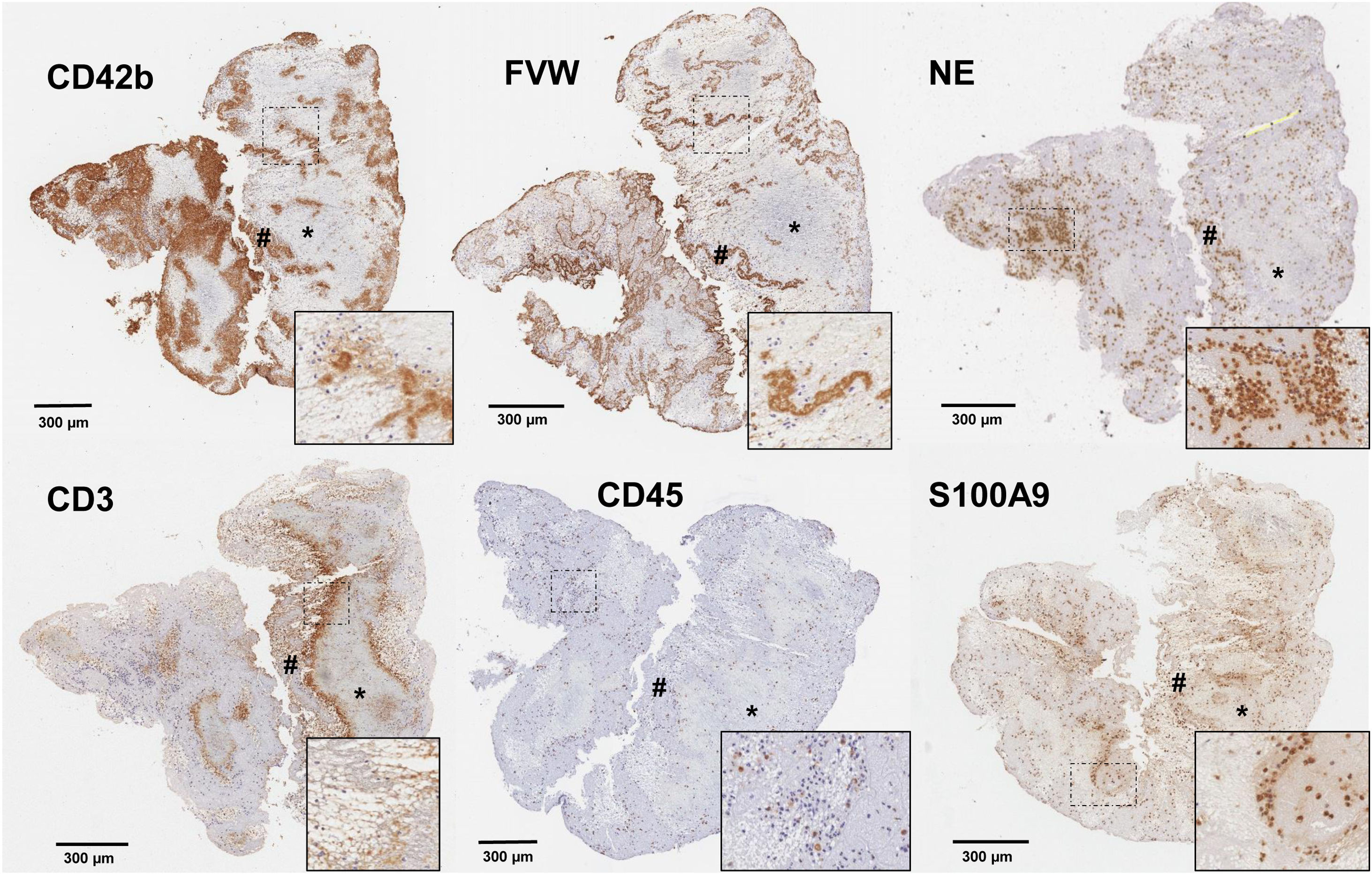
En los últimos años, el concepto de inmunotrombosis ha dirigido el foco sobre los efectos de las células y moléculas inflamatorias sobre los procesos de trombosis y estabilización del coágulo. Así, las principales células inflamatorias, los leucocitos, han demostrado potenciar los mecanismos de trombosis tanto venosa como arterial mediante exposición de factores procoagulantes, liberación de citocinas con capacidad de activación plaquetar y en especial, a través de la liberación de acúmulos de cromatina, histonas y DNA en forma de Neutrophil extracellular traps (NETs)22. La presencia de leucocitos en el trombo se centra en la interfaz entre regiones ricas en plaquetas y las ricas en eritrocitos18,20 (figs. 2 y 3), y una mayor concentración se ha asociado a etiología cardioembólica en algunos estudios (tabla 1), no pudiéndose descartar, sin embargo, la influencia de la edad del trombo en esta asociación. La activación secundaria de plaquetas y reclutamiento de nuevas células inflamatorias por las NETs ha demostrado aumentar la complejidad del trombo, su resistencia al tPA23 y estar implicada en la formación de la capa externa del trombo con capacidad anti-fibrinolítica24. Además, se ha demostrado colocalización de NETs y FVW en el seno de trombos de pacientes con ictus20, sugiriendo una interacción entre ambas moléculas con un efecto proinflamatorio y protrombótico. La presencia de NETs parece reducir la actividad de ADAMTS13, una metaloproteasa implicada en la fragmentación y regulación de la actividad del FVW, favoreciendo la acumulación de FVW y su activación25. Igualmente, se ha descrito la presencia de otros marcadores de actividad neutrofílica, cómo la elastasa de neutrófilo26 o la calprotectina, como presentes en el trombo de pacientes con ictus isquémico y en el caso de la calprotectina (S100A9) asociada a las concentraciones de plaquetas, leucocitos y la propia elastasa de neutrófilo27 (fig. 3).
Cortes histológicos de trombo de paciente con ictus isquémico con las siguientes inmunotinciones específicas para: plaquetas CD42b+; factor de Von Willebrand (FVW); elastasa de neutrófilos (NE); linfocitos CD3+; leucocitos CD45+; y calprotectina (S100A9). Se marcan con (*) las áreas ricas en plaquetas y con (#) las zonas ricas en eritrocitos. En la esquina inferior derecha de cada imagen se facilita un aumento ×20 de las áreas señaladas.
Fuente: Imágenes cedidas por el Laboratorio de Aterotrombosis, CIMA/Universidad de Navarra.
No solo la composición relativa de cada uno de los componentes se ha visto asociada a la etiología del ictus. La disposición de los distintos elementos se ha descrito como uno de los posibles marcadores etiológicos a estudio. Así, la disposición de las plaquetas en la periferia del trombo se ha asociado a etiología aterotrombótica28, mientras que una distribución parcheada con áreas ricas en plaquetas y áreas ricas en eritrocitos se incluye en algunos algoritmos de predicción de etiología cardioembólica29. Esta disposición periférica de las plaquetas se ha asociado a flujos laminares rápidos en situación de estenosis30, habiéndose replicado en sistemas de microfluídica31.
Por otra parte, se han descrito patrones asociados a la «edad» del trombo. Así, se diferencian los trombos frescos, con horas de desarrollo, y que constituyen la gran mayoría de los trombos recuperados32; de los trombos líticos y los trombos organizados en los que una infiltración progresiva de células inflamatorias conlleva una serie de procesos que favorecen la estabilización del mismo28. Existen trabajos que encuentran una mayor presencia de leucocitos en trombos de origen cardiaco33, y los hay que describen una mayor presencia de linfocitos T en pacientes con ictus aterotrombótico34 (tabla 1). Sin embargo, probablemente la evidencia más sólida proceda de aquellos trabajos que sugieren que la presencia de leucocitos es mayor en función de la edad del trombo, y no de su origen, pudiendo ser las cavidades cardiacas el lugar más frecuente de formación de trombos con tiempo de evolución35. En esta línea, la liberación de NETs, por los neutrófilos que infiltran el trombo se ha asociado a etiología cardioembólica36. Sin embargo, de nuevo, parece probable que sea la edad del trombo y no la etiología por sí misma la que condicione el contenido de NETs23. Conforme el tiempo pasa, el trombo responsable de la oclusión vascular se organiza, disminuyendo el componente eritrocítico en pos de la organización de la malla de fibrina y apareciendo fenómenos de retracción del coágulo y organización de la capa externa con fijación a la misma de algunas enzimas con capacidad inhibitoria de la fibrinólisis18,24,37 como el inhibidor del activador del plasminógeno-1 (PAI-1) o la alpha-2-antiplasmina (a2AP) (fig. 2). Otro de los procesos tiempo/dependientes que se producen en el trombo y que condicionan su estructura es la retracción del trombo mediante fuerzas contráctiles mediadas por las plaquetas sobre la red de fibrina38. Este proceso es por el momento un gran desconocido, y serán necesarios más estudios para entender los mecanismos de contracción de la malla de fibrina mediados por las plaquetas y la formación de densos acúmulos de eritrocitos deformados en forma de polihedrocitos39, y cómo afecta esto a la rigidez del trombo, a su permeabilidad y a la resistencia a los mecanismos de trombólisis40.
La presencia de células endoteliales en el seno del trombo se ha descrito hasta en un 16% de los coágulos en algunas series41,42, en probable relación con el daño producido por los dispositivos de extracción en la pared del vaso continente. Estas células endoteliales, sin embargo, podrían ser constituyentes originales del trombo en sus fases más organizadas tras la epitelización del mismo, pudiendo dificultar la acción de los tratamientos fibrinolíticos43. Estos trombos epitelizados se han observado sobre todo con relación a coágulos formados en áreas hipo o aquinéticas del ventrículo izquierdo y en dispositivos intracardiacos44.
En los últimos años, cada vez más estudios dirigen los esfuerzos hacia la identificación de firmas moleculares específicas que puedan predecir características importantes del trombo, y afinar en la suposición del mecanismo fisiopatológico implicado en su formación. Así, mediante la caracterización proteómica del material trombótico se han identificado firmas proteicas presentes en los trombos de pacientes con ictus relacionadas con procesos inmunológicos, remodelación cardiaca y vías como la del TGFβ45. En otro estudio, Suissa et al. realizan un análisis proteómico y una caracterización metabolómica de trombos de origen cardioembólico y aterotrombótico, estableciendo una combinación de marcadores que permiten predecir la etiología implicada con un área bajo la curva de 0,996 (IC 95%: 0,984-1)46. Mediante un array de proteínas, otro grupo encuentra datos de mayor activación de vías de señalización plaquetar en trombos de origen cardioembólico frente a sus homólogos de origen aterotrombótico47. En curso se encuentra un ensayo fundamentado en la secuenciación del RNA presente en trombos de pacientes con ictus isquémico (NCT03490552).
El trombo en el ictus indeterminado y de otras causas incluido ictus asociado a cáncerLa caracterización del proceso subyacente cobra especial interés en el ámbito del ictus isquémico de causa indeterminada en el que tras los estudios iniciales no se ha conseguido identificar la etiología del mismo y, por tanto, no se puede iniciar una prevención secundaria dirigida de eficacia demostrada. Sin embargo, la heterogeneidad observada dentro de los trombos obtenidos en este grupo de pacientes48, y la ausencia de patrones específicos de las etiologías principales tal como se ha comentado, han impedido el desarrollo de esta herramienta dentro del proceso de caracterización etiológica en el ictus de causa indeterminada.
Otros procesos tromboembólicos subyacen con cierta frecuencia en pacientes con ictus isquémico. Así, un porcentaje nada desdeñable de pacientes con ictus asocia una neoplasia activa, con un estado protrombótico y una situación de inflamación sistémica asociada. Park et al.49 estudian un total de 16 trombos de pacientes con cáncer activo, y realizan una comparativa con otros 32 trombos apreciando una mayor concentración de plaquetas y menor de eritrocitos, especialmente en aquellos con endocarditis marántica asociada. Una proporción de plaquetas/fibrina superior al 65% de la composición del trombo ha demostrado predecir de forma relativamente precisa la presencia de un cáncer activo subyacente en una población de 152 trombos analizados (AUC: 0,84; p<0,001)50. Ésta mayor implicación de la activación plaquetar en el ictus asociado a endocarditis marántica es conocida en la literatura51, apreciándose una importante concentración de plaquetas en el análisis patológico post mortem de las vegetaciones52.
Otro de los mecanismos implicados en la oclusión de arterias cerebrales es la disección de arterias extracraneales desencadenando procesos de trombosis a nivel local y embolización distal de los mismos. Estos trombos presentan una mayor concentración de eritrocitos que los originados por otros mecanismos de forma consistente en varios estudios32,53. Este hecho podría tener sus implicaciones y ayudar en la selección del tratamiento más adecuado en estos casos, sin existir en la actualidad evidencias clínicas a favor de la anticoagulación o la antiagregación. Por último, se ha descrito recientemente el análisis histológico de una serie de 3 trombos en ictus secundario a web carotídeo sin encontrar peculiaridades propias de este mecanismo fisiopatológico54.
Composición del trombo y respuesta a terapias revascularizadorasEn la actualidad existen únicamente 2 tratamientos con capacidad revascularizadora aprobados para el ictus isquémico con oclusión de gran vaso: la fibrinólisis endovenosa con activador tisular del plasminógeno (tPA) y el tratamiento endovascular mediante trombectomía mecánica. La composición y la estructura del trombo ha demostrado condicionar en gran medida la respuesta del mismo, tanto al proceso de fibrinólisis activado por el tPA, cómo a los fenómenos físico/mecánicos propios de la extracción del trombo con los dispositivos actuales de trombectomía endovascular55.
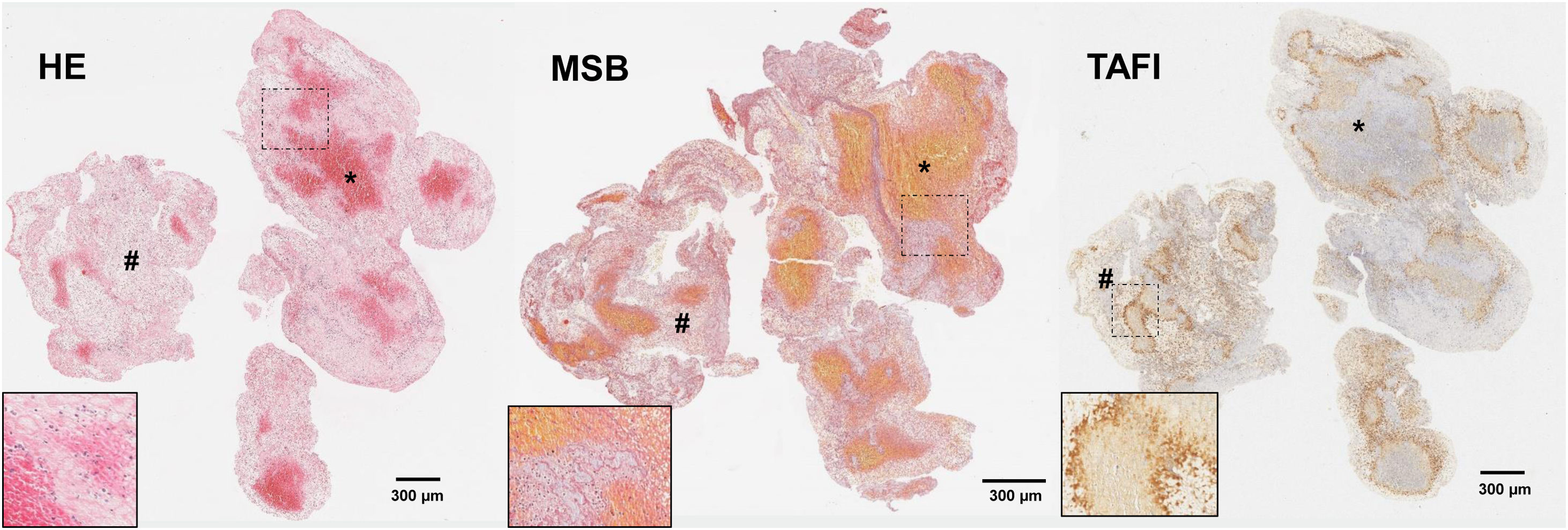
En el trombo, el tPA actúa sobre el plasminógeno unido a la fibrina produciendo su activación en forma de plasmina y activando la fibrinólisis endógena. Esto logra la recanalización arterial en torno al 20-40% de los pacientes, dependiendo su eficacia del retraso en su administración, el nivel de oclusión y las características del trombo56. Así, se ha demostrado que las características de la malla de fibrina son uno de los principales condicionantes de la respuesta a la fibrinólisis57 y su compactación en las capas más externas del trombo conformando una coraza protectora dificulta la penetración del tPA en el seno del trombo24. Ésta capa parece contener, además, una alta concentración de factores capaces de afectar la fibrinólisis, como NETs, FVW o inhibidores de la trombólisis como el PAI-123. Otro inhibidor de la fibrinólisis, el TAFI, se ha visto en proporciones variables en el seno de trombos extraídos de pacientes con ictus pudiendo condicionar la resistencia al tPA de los mismos18 (fig. 4).
Cortes histológicos de trombo de paciente con ictus isquémico con las siguientes tinciones: hematoxilina-eosina (H&E); Martius Scarlet Blue (MSB); e inmunotinción específica para inhibidor de la fibrinólisis activable por trombina (TAFI). Se marcan con (*) las áreas ricas en plaquetas y con (#) las zonas ricas en eritrocitos. En la esquina inferior derecha de cada imagen se facilita un aumento ×20 de las áreas señaladas.
Fuente: Imágenes cedidas por el Laboratorio de Aterotrombosis, CIMA/Universidad de Navarra.
Un buen número de estudios ha demostrado una mayor sensibilidad a la lisis por tPA de aquellos trombos con mayores concentraciones de eritrocitos frente a aquellos ricos en plaquetas32,58–60. En las áreas ricas en plaquetas se ha observado un mayor entrecruzamiento de la fibras de fibrina20 mediado entre otros por el FXIII de origen plaquetar61, que a su vez es el responsable de la unión a la fibrina de otro inhibidor de la fibrinólisis, la a2AP, pudiendo condicionar un aumento de la resistencia a la lisis62. A su vez, la unión a la red de fibrina del FVW63 y las NETs23 condiciona una mayor resistencia de la misma a la lisis mediante fuerzas de unión entre estas moléculas y participando en la retracción del trombo25. Este proceso de retracción del coágulo conlleva la compactación de eritrocitos en el seno de la malla de fibrina en forma de polihedrocitos asociando una menor permeabilidad del coágulo al tPA y menor acción lítica40.
En cuanto a la respuesta al tratamiento endovascular de los trombos, según su composición, se han descrito menores tiempos de procedimiento, menor número de maniobras64,65, así como una mayor proporción de recanalización exitosa66,67 en aquellos trombos con alto contenido en eritrocitos. Estos trombos presentan características más blandas68 y menores tasas de fricción69, pudiendo explicar una mayor facilidad para su extracción con los dispositivos mecánicos. En contraste, los trombos ricos en fibrina con baja presencia de eritrocitos se asociaron con un tiempo de intervención más prolongado70, así como trombos plaquetares con altas concentraciones de FVW asociaron peores tasas de recanalización17,19. Igualmente, una mayor proporción de leucocitos y NETs en el trombo asocia tiempos de recanalización aumentados, menores tasas de recanalización y peor pronóstico23,35. En esta línea, se ha sugerido que una selección de la técnica y el dispositivo, adecuándola a la composición esperada del trombo puede mejorar la interacción coágulo/dispositivo y podría optimizar el tratamiento revascularizador71,72.
En cuanto a complicaciones asociadas al tratamiento endovascular, la fragmentación del trombo y su embolización a territorios distales durante el procedimiento parece ser más frecuente en los trombos con una mayor concentración de leucocitos73, así como en los trombos ricos en fibrina y con menor concentración de eritrocitos70. Por el contrario, algunos estudios in vitro encuentran una mayor fragmentación de estos trombos ricos en eritrocitos74, siendo necesarios más estudios.
Potenciar tratamientos actuales: trombólisis más allá de la fibrinólisisUn mayor conocimiento de la organización y estructura del trombo podría permitir implementar terapias específicas que potenciasen los tratamientos actuales.
Uno de los posibles mecanismos de potenciación de la fibrinólisis es la adyuvancia al tratamiento fibrinolítico de moléculas con capacidad de bloqueo de las vías inhibitorias de la activación del plasminógeno75. Así, en modelos animales de ictus, la inhibición del TAFI logró reducir los procesos de microtrombosis76 y su bloqueo conjunto con el PAI-1 por un dianticuerpo biespecífico demostró un menor tamaño del infarto y mejor pronóstico tras el ictus77,78. Adicionalmente, la inhibición del TAFI mediante administración de matrix metalloproteinase-10 (MMP-10) ha demostrado reducir el tamaño del infarto en modelos experimentales, por si sola79 y en combinación con el tPA80, aunque la ausencia de TAFI en un modelo experimental de ictus isquémico se asoció con un incremento del daño neuronal tras el tratamiento con tPA81. Por último, la inhibición de la a2AP también se ha postulado como otra posible vía de adyuvancia del tPA al tratarse del principal inhibidor de la plasmina in-vivo37.
La importante heterogeneidad observada en el trombo obliga a plantear otras vías de degradación del trombo que faciliten su disolución o ayuden a la revascularización. Algunos de los componentes mencionados previamente se han convertido en dianas terapéuticas a explorar en este campo. Como se ha comentado, la acción del FVW como promotor de la activación y agregación plaquetar, así como su interrelación con la fibrina conllevan una potencial acción estabilizadora del trombo en pacientes con ictus. Así, la adición de moléculas con capacidad de bloqueo sobre la acción del FVW en el trombo como el ADAMTS1363,82 o la N-acetilcisteína83 han demostrado potenciar el efecto fibrinolítico del tPA en modelos animales. En esta línea, niveles más bajos de ADAMTS13 pre-tratamiento se han asociado con menores tasas de recuperación precoz84, y peores tasas de recanalización tras tratamiento fibrinolítico con tPA85. Otro de los mecanismos de inhibición de esta vía es el bloqueo de la interacción entre el receptor GpIbα plaquetar y el FVW. Varios estudios han demostrado eficacia antitrombótica de este mecanismo en modelos animales con un mejor pronóstico tras el ictus86,87.
De la misma forma, la degradación de las NETs mediante la adición de DNasa1 al tratamiento con tPA ha demostrado un efecto coadyuvante con aumento de la lisis del trombo en modelos animales y ex vivo23,26,88. Además, aquellos trombos con mayor concentración de plaquetas mostraron una pérdida mayor de peso tras el tratamiento con DNasa1, reforzando la asociación entre plaquetas y NETs y su potencial efecto procoagulante89. Igualmente, impidiendo la formación de NETs mediante la administración de Cl-amidina, un inhibidor PAD4, se logra inhibir el proceso de trombosis arterial en ratones reduciendo el tamaño del infarto y mejorando el estado funcional tras el ictus90.
ConclusionesLa amplia variabilidad de los mecanismos fisiopatológicos implicados en la formación del trombo en el ictus isquémico explica la importante heterogeneidad observada en los estudios de composición del trombo, dificultando la identificación de patrones asociados a etiologías concretas. Parece claro que en el seno del trombo conviven en proporciones variables áreas ricas en eritrocitos y áreas ricas en plaquetas/fibrina con una íntima relación entre ellas y acompañadas de FVW, NETs e inhibidores de la fibrinólisis, con frecuencia formando una coraza protectora en la superficie del trombo. La presencia de estos componentes, así como su disposición e interrelación ha demostrado tener efectos en la resistencia a los diferentes tratamientos de revascularización. Por ello, se están desarrollando opciones terapéuticas dirigidas a la degradación de algunos de estos componentes en aras de potenciar la acción revascularizadora de los tratamientos actuales. El desarrollo de estudios de proteómica y la identificación de posibles biomarcadores circulantes podría permitir establecer marcadores específicos para la caracterización del trombo y la adecuación del tratamiento fibrinolítico y endovascular a la composición del mismo.
FinanciaciónLa realización de este manuscrito se ha financiado gracias a la Red de Investigación Cooperativa Orientada a Resultados en Ictus (RICORS-Ictus) del Instituto de Salud-Carlos III (RD21/0006/0008) coofinanciado con fondos UE Next Generation y/o fondos FEDER.
Conflicto de interesesNo existen conflictos de intereses respecto a la realización de este manuscrito.