SUPLEMENTO SOBRE NOVEDADES EN CEFALEA E HIPERTENSIÓN INTRACRANEAL
More infoLa neuralgia del trigémino (NT) es un tipo de dolor neuropático que afecta a una o más ramas del nervio trigémino. Aunque su prevalencia poblacional es relativamente baja, la NT supone un problema muy importante tanto en las consultas de neurología como en las urgencias por la dificultad para el diagnóstico y el tratamiento y el elevado impacto sobre la calidad de vida de las personas que la padecen. Por estos motivos, el Grupo de Estudio de Cefaleas de la Sociedad Española de Neurología ha elaborado un documento de consenso sobre el manejo de esta patología.
DesarrolloEste documento ha sido redactado por un comité de expertos utilizando la nomenclatura de la clasificación de la International Headache Society (IHS), analizando la evidencia científica publicada sobre diagnóstico y tratamiento y estableciendo unas recomendaciones prácticas con niveles de evidencia.
ConclusionesEl diagnóstico de la NT es clínico. La International Classification of Headache Disorders en su tercera edición (ICHD-3) clasifica el dolor atribuible a una lesión o enfermedad del nervio trigémino en NT y neuropatía trigeminal dolorosa. A su vez, la NT puede dividirse en tres tipos principales según la etiología del dolor: clásica, idiopática y secundaria. Es recomendable la realización de una resonancia magnética (RM) craneal a todo paciente con diagnóstico clínico de NT para descartar causas secundarias. Para estudiar la presencia de una compresión neurovascular con RM se recomienda la aplicación de los protocolos de imagen FIESTA, DRIVE o CISS. El tratamiento inicialmente será farmacológico. En pacientes seleccionados con respuesta insuficiente o mala tolerancia a fármacos se debe valorar el tratamiento quirúrgico.
Trigeminal neuralgia (TN) is a chronic neuropathic pain disorder affecting one or more branches of the trigeminal nerve. Despite its relatively low global prevalence, TN is an important healthcare problem both in neurology departments and in emergency departments due to the difficulty of diagnosing and treating the condition and its significant impact on patients’ quality of life. For all these reasons, the Spanish Society of Neurology's Headache Study Group has developed a consensus statement on the management of TN.
DevelopmentThis document was drafted by a panel of neurologists specialising in headache, who used the terminology of the International Headache Society. We analysed the published scientific evidence on the diagnosis and treatment of TN and establish practical recommendations with levels of evidence.
ConclusionsThe diagnosis of TN is based on clinical criteria. Pain attributed to a lesion or disease of the trigeminal nerve is divided into TN and painful trigeminal neuropathy, according to the International Classification of Headache Disorders, third edition. TN is further subclassified into classical, secondary, or idiopathic, according to aetiology. Brain MRI is recommended in patients with clinical diagnosis of TN, in order to rule out secondary causes. In MRI studies to detect neurovascular compression, FIESTA, DRIVE, or CISS sequences are recommended. Pharmacological treatment is the initial choice in all patients. In selected cases with drug-resistant pain or poor tolerance, surgery should be considered.
La neuralgia del trigémino (NT) es un dolor facial atribuible a una lesión o patología del nervio trigémino que afecta al menos a una de sus ramas y que se caracteriza por la aparición de paroxismos de dolor de breve duración, que se describen como una descarga eléctrica, punzante o lancinante. Aunque existen unos criterios diagnósticos bien definidos, muchos pacientes con dolor facial intenso sin una causa subyacente evidente son erróneamente diagnosticados de NT. Por otro lado, esta entidad es confundida con frecuencia con el dolor de origen dental, y ello conduce a exploraciones y tratamientos innecesarios.
Desde el Grupo de Estudio de Cefaleas de la Sociedad Española de Neurología (GECSEN) se ha elaborado este documento de consenso sobre la NT, partiendo de una revisión sistemática de la bibliografía e incorporando la experiencia de los participantes. El objetivo de esta revisión es proporcionar al clínico una serie de recomendaciones prácticas para el adecuado manejo diagnóstico y terapéutico de la NT. Para graduar los niveles de evidencia y los grados de recomendación de las actuaciones terapéuticas se han seguido los utilizados en el último manual de práctica clínica en cefaleas del GECSEN (2020).
Anatomía y fisiopatologíaAnatomía del nervio trigéminoEl trigémino es un nervio mixto, aunque con un claro predominio de las fibras sensitivas respecto a las motoras. Las estructuras nucleares se extienden a lo largo del tronco del encéfalo desde el mesencéfalo a los primeros segmentos medulares cervicales. Los núcleos motor y sensitivo principal se localizan en la protuberancia media, y el núcleo espinal, que recoge la información del dolor y la temperatura, se extiende desde la protuberancia hasta la médula cervical alta. La raíz motora procede de las vías masticatorias y emerge desde la región pontina lateral colocándose anteromedial a la raíz sensitiva, integrándose a la tercera rama del trigémino. Posteriormente atraviesa el cráneo por el foramen oval para inervar los músculos de la masticación (masetero, temporal y pterigoideos medial y lateral), además de otros grupos musculares con otras funciones (milohiodeo, vientre anterior del músculo digástrico, tensor del velo del paladar y tensor del tímpano). La raíz sensitiva se engrosa formando el ganglio de Gasser, que contiene los somas de las neuronas sensitivas1.
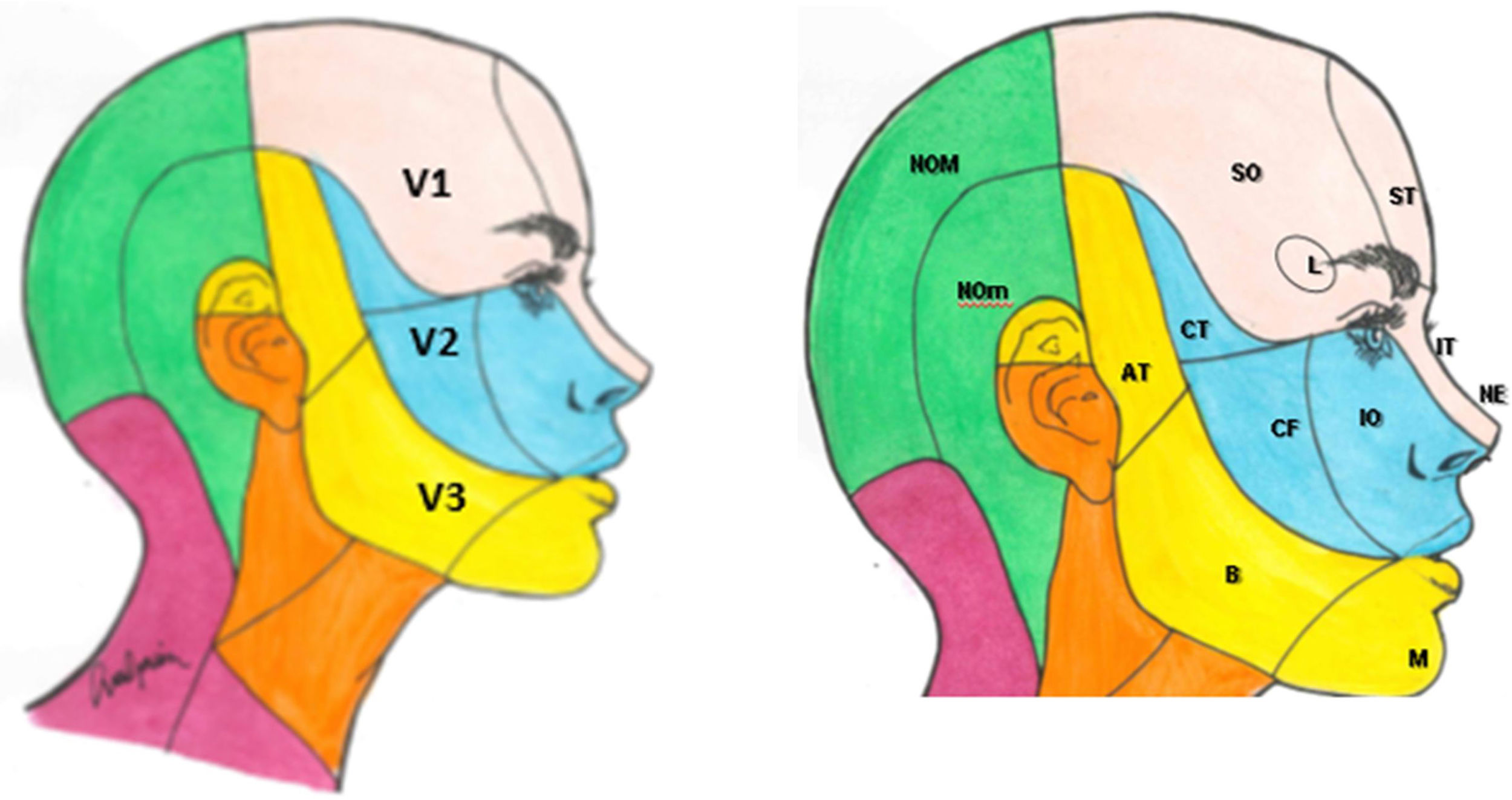
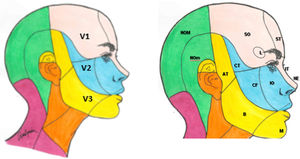
El componente sensitivo tiene tres divisiones: la primera, o rama oftálmica (V1); la segunda, o maxilar (V2), y la tercera, o mandibular (V3). La rama oftálmica proporciona inervación de la piel de la mayor parte de la nariz (puente, laterales, pared lateral de la cavidad nasal y septum), la frente, el párpado superior, el globo ocular y la glándula lacrimal. La segunda rama inerva la zona cigomática, las alas nasales, el labio superior, las encías de la arcada dentaria superior, el paladar, la nasofaringe, la cavidad nasal posterior y las meninges de la fosa craneal anterior y media. Finalmente, la tercera rama inerva la mucosa yugal, la sien y el cuero cabelludo lateral, el meato auditivo externo, la membrana timpánica, la articulación temporomandibular, la mandíbula y la arcada dentaria inferior, dos tercios anteriores de la lengua, el labio inferior y el mentón1,2 (fig. 1).
Ramas del trigémino y dermatomas de cada una de ellas.
V1: primera división del trigémino (oftálmica); V2: segunda división del trigémino (maxilar); V3: tercera división del trigémino (mandibular).
AT: nervio aurículo-temporal; B: nervio bucal; CF: nervio cigomático-facial; CT: nervio cigomático-temporal; IO: nervio intraorbitario; IT: nervio infratroclear; L: nervio lacrimal; M: nervio mentoniano; NE: nervio nasal externo; NOM: nervio occipital mayor; NOm: nervio occipital menor; SO: nervio supraorbitario; ST: nervio supratroclear.
Las fibras se clasifican en nociceptivas (Aδ y fibrasC) y mecanorreceptivas de umbral bajo (fibras Aα y Aβ). De las primeras, las fibrasC son amielínicas, con pequeño diámetro y velocidad de conducción lenta, mientras que las fibras Aδ están poco mielinizadas, tienen un diámetro intermedio y mayor velocidad de conducción. Ambas pueden estimularse por estímulos mecánicos, térmicos o químicos. Las fibras propioceptivas Aα y Aβ están mielinizadas, tienen un diámetro mayor y una conducción rápida, y se estimulan por estímulos indoloros o propioceptivos3.
Fisiopatología. Conflicto vascularEl hecho de que la sintomatología en la NT sea prácticamente igual con independencia de la causa sugiere que debe existir una lesión de la raíz sensitiva en la entrada de la protuberancia (extraaxial) o en el fascículo (intraaxial). Se han descrito numerosas alteraciones en el nervio trigémino secundarias a la compresión por estructuras vasculares, como la desmielinización focal en la raíz de entrada a la protuberancia, la atrofia de los axones y el daño tanto a las células de Schwann/oligodendrocitos como a la mielina3. Aunque existen varias hipótesis fisiopatológicas, la más aceptada fue propuesta por Devor et al.4, que trata de correlacionar las características paroxísticas del dolor y las alteraciones estructurales. Se propone que la desmielinización focal en la zona de entrada de la raíz (ZER) a la protuberancia es la causa de la neuralgia. La ZER incluye la zona transicional (ZT) o de Obersteiner-Redlich, que es el lugar donde cambia la mielina central (sintetizada por los oligodendrocitos) a la mielina periférica (sintetizada por las células de Schwann). Es un segmento de 2-2,5mm incluido en la ZER, especialmente susceptible al daño ante una compresión extrínseca (bucle vascular, meningioma, etc.)5. La compresión local del nervio en la ZT induce la desmielinización focal de las fibras propioceptivas, que transmiten estímulos táctiles de la piel o mucosas de la cara, y facilita que sus axones expuestos entren en contacto con los axones amielínicos de las fibras nociceptivas. Este contacto provoca una transmisión efáptica de los potenciales de acción entre ellos. Esta transmisión a través de la membrana, con reclutamiento de haces de fibras próximos (firing) entre las que vehiculizan información de tacto fino y las que llevan información nociceptiva, podría ser la responsable de que los ataques de dolor se desencadenen tras estímulos táctiles en zonas faciales6. Una segunda hipótesis explicaría el dolor con la idea de que la desmielinización focal causaría cambios en el metabolismo energético y mitocondrial, afectando a la función de la bomba Na-K, que tienen una mayor concentración en los nódulos de Ranvier. Esto causaría una despolarización mantenida y, como consecuencia, una hiperexcitabilidad neuronal continua que desencadena potenciales de acción efápticos5,7.
La crisis de dolor de gran intensidad y sus características hiperagudas podrían deberse a la presencia de descargas prolongadas en el soma de las neuronas sensitivas desencadenadas por el tacto, que se difunde al resto de neuronas adyacentes. Los impulsos efápticos también podrían explicar el dolor continuo de algunos casos, aunque también podría relacionarse con alteraciones en el sistema central de procesamiento del dolor, reduciéndose los mecanismos descendentes inhibitorios. De hecho, los pacientes con NT presentan cambios en el reflejo de parpadeo (blink reflex) o en potenciales evocados troncoencefálicos7.
EpidemiologíaLos estudios epidemiológicos son escasos y, en general, con un número reducido de pacientes. Se estima que la NT tiene una prevalencia del 0,3%8 y una incidencia de 12,6 casos por 100.000 personas/año9. La incidencia va progresando con la edad, desde 17,5 por 100.000 personas/año entre los 60-69años, hasta 25,6/100.000 personas/año después de los 70años9. La edad media de inicio de la enfermedad es de 53,9años y afecta con más frecuencia a mujeres (60%)10. No se han identificado diferencias raciales o geográficas respecto a la incidencia de la enfermedad, pero sí existe más riesgo de NT en algunas enfermedades, como la esclerosis múltiple (EM)11.
Los casos familiares son raros, pero pueden estar presentes entre el 1-2% de los pacientes. Se han publicado casos en familias en las que el patrón de herencia que predomina es el autosómico dominante, con un fenómeno de anticipación genética12. El impacto sobre la calidad de vida de los pacientes que la padecen es muy relevante, debido a la naturaleza y a la intensidad del dolor. El sufrimiento de estos pacientes se relaciona con el retraso diagnóstico, el temor a que los ataques se repitan repentinamente, los efectos secundarios del tratamiento y la falta de apoyo psicológico13. La incidencia de depresión y ansiedad en pacientes con NT es casi tres veces mayor14 que en la población general y se relaciona con la intensidad del dolor y la duración de la enfermedad. Otras manifestaciones que pueden acompañar a la enfermedad son un bajo rendimiento en las actividades de la vida diaria, con aislamiento social, alteración del sueño, fatiga y anorexia. Por todo esto, es importante considerar una aproximación terapéutica multidisciplinar junto a profesionales de salud mental.
Por otra parte, la NT puede llegar a tener un impacto económico considerable, dado que el inicio de la enfermedad se produce a una edad en la que los pacientes suelen estar activos laboralmente, y más del 50% de los pacientes tienen limitaciones laborales13.
Etiología y clasificación. Criterios diagnósticos y diagnóstico diferencialLa International Classification of Headache Disorders en su tercera edición (ICHD-3) clasifica el dolor atribuible a una lesión o enfermedad del nervio trigémino en NT y neuropatía trigeminal dolorosa. A su vez, la NT puede dividirse en tres tipos principales (tabla 1) según la etiología del dolor: clásica, idiopática y secundaria. La forma clásica se define cuando el dolor no tiene una causa aparente, aunque se acepta que pueda ser atribuible a una compresión neurovascular. En la forma idiopática no existen alteraciones en las pruebas neurofisiológicas o en la resonancia magnética (RM), mientras que en la NT secundaria se detecta una causa subyacente. Por otro lado, la neuropatía trigeminal dolorosa puede clasificarse en diferentes tipos de acuerdo con su etiología15. La tabla 2 recoge los criterios diagnósticos de NT.
Clasificación de la neuralgia del trigémino (ICHD-3)
| Neuralgia del trigémino clásica |
| Neuralgia trigeminal clásica exclusivamente paroxística |
| Neuralgia trigeminal clásica con dolor continuo concomitante |
| Neuralgia del trigémino secundaria |
| Neuralgia trigeminal atribuida a esclerosis múltiple |
| Neuralgia trigeminal atribuida a lesión ocupante de espacio |
| Neuralgia trigeminal atribuida a otra causa |
| Neuralgia del trigémino idiopática |
| Neuralgia trigeminal clásica exclusivamente paroxística |
| Neuralgia trigeminal clásica con dolor continuo concomitante |
| Neuropatía trigeminal dolorosa |
| Neuropatía trigeminal dolorosa atribuida a herpes zoster |
| Neuralgia trigeminal postherpética |
| Neuropatía trigeminal dolorosa postraumática |
| Neuropatía trigeminal dolorosa atribuida a otro trastorno |
| Neuropatía trigeminal dolorosa idiopática |
Criterios diagnósticos de neuralgia del trigémino (ICHD-3)
| A. Paroxismos recurrentes de dolor facial unilateral o bilateral en el territorio de distribución de una o más divisiones del nervio trigémino, sin extensión más allá del área de inervación, y que cumple los criterios B y C |
| B. El dolor tiene todas las características siguientes: |
| 1. Dura entre una fracción de segundo y dos minutos |
| 2. Es muy intenso |
| 3. Tiene carácter eléctrico, punzante, o lancinante |
| C. El dolor es precipitado por estímulos inocuos sobre el territorio de distribución del nervio afecto |
| D. Sin mejor explicación por otro diagnóstico de la ICHD-3 |
La categoría NT clásica (tabla 3) hace referencia a los casos en los que el cuadro se produce probablemente por la compresión de la raíz por un vaso tortuoso. En el 58-75% de los pacientes el vaso responsable es la arteria cerebelosa superior16. Las compresiones venosas son menos frecuentes (10%). El contacto simple es frecuente. En autopsias de pacientes que nunca sufrieron NT se encuentran contactos vasculares que no provocan una compresión neurovascular significativa hasta en el 17,5% de los casos16. Las técnicas de imagen permiten identificar la compresión neurovascular significativa17 diferenciándola del simple contacto y contribuirán a seleccionar mejor a los candidatos quirúrgicos, puesto que en series clásicas hasta el 30% de los pacientes intervenidos18 no mejoraron tras una cirugía de descompresión microvascular.
Criterios diagnósticos de neuralgia del trigémino clásica (ICHD-3)
| A. Paroxismos recurrentes de dolor facial unilateral que cumplen los criterios de neuralgia del trigémino |
| B. Demostración con resonancia magnética, o durante el acto quirúrgico, de compresión neurovascular (no simple contacto) con cambios morfológicosa en la raíz trigeminal |
| C. Sin mejor explicación por otro diagnóstico de la ICHD-3 |
La NT secundaria se manifiesta en forma de crisis recurrentes de dolor facial unilateral que cumplen los criterios de NT, bien estrictamente paroxísticos o bien asociados con dolor concomitante continuo o casi continuo, y se ha demostrado la existencia de una enfermedad subyacente documentada como causante del dolor y que explica la neuralgia. Aproximadamente el 15% de las neuralgias trigeminales son secundarias19. Las características clínicas que hacen sospechar una forma sintomática son: a)inicio antes de los 50años; b)afectación bilateral; c)afectación de la primera rama trigeminal, y d)signos y síntomas de disfunción sensitiva (además del dolor). En adultos, la causa más frecuente de NT secundaria es por compresión extraaxial, producida sobre todo por tumores. En cambio, en pacientes jóvenes es típicamente intraaxial por EM. Las causas tumorales representan del 3 al 9,4% de todos los pacientes con NT. El tumor se localiza en el trayecto del nervio (meningioma, neurinoma, carcinomatosis meníngea, tumores epidermoides) o en la fosa posterior (meningioma y neurinoma)20. La EM es también una causa frecuente (2-11% de todos los casos). El riesgo de NT se multiplica por 20 en esta enfermedad y afecta del 2 al 5% de los pacientes21. El 3,6% de NT secundaria se debe a enfermedad ósea craneal (osteomielitis, enfermedad de Paget, osteomas), malformación arteriovenosa, fístula dural, infarto pontino, tuberculoma, colesteatoma, aracnoiditis, hidrocefalia, lipoma, lúes, diabetes mellitus, malaria, etc.19.
Neuralgia del trigémino con dolor continuoLa ICHD-3 admite que los pacientes con formas idiopáticas o clásicas de NT pueden presentar, además de los paroxismos dolorosos, un dolor concomitante continuo o casi continuo entre los ataques en la rama del trigémino afectada. Previamente se denominaba a esta entidad NT tipo2 (Burchiel tipo2, en contraposición a la paroxística pura o tipo1) o NT atípica. Este dolor de fondo puede aparecer hasta en el 24-49% de los pacientes, y puede describirse como urente, quemante o pulsátil22,23. Los datos más recientes no apoyan por completo la hipótesis que establecía que el dolor continuo se desarrollaba como consecuencia de una neuralgia paroxística de larga duración23. El mecanismo fisiopatológico subyacente no ha sido del todo aclarado, pero se han postulado circunstancias relacionadas con la sensibilización central y con el daño de las fibrasC en la raíz del nervio. La pérdida de fibras amielínicas podría causar una actividad anormalmente aumentada en las neuronas de segundo orden del tronco del encéfalo24. Dado que se postula que el dolor continuo es una forma de dolor neuropático, estos pacientes podrían ser tratados con moduladores del dolor como antidepresivos (amitriptilina, duloxetina), antiepilépticos u otros, si bien los niveles de evidencia son normalmente bajos25.
Neuropatía trigeminal dolorosaDe acuerdo con la ICHD-3, la neuropatía trigeminal dolorosa consiste en dolor en el territorio de uno o ambos nervios trigéminos, con demostración de disfunción sensitiva (hiperalgesia, alodinia, hipoestesia, hipoalgesia) presumiblemente expresiva de daño sobre el nervio15 (tabla 4). La neuropatía trigeminal es clasificada como idiopática y como secundaria a herpes zoster y traumatismo, o a otros trastornos (tabla 5). Las neuralgias de las ramas terminales del trigémino son en esta clasificación diluidas en el concepto amplio de la neuropatía trigeminal dolorosa.
Criterios diagnósticos de neuropatía trigeminal dolorosa idiopática (ICHD-3)
| A. Dolor facial unilateral o bilateral en el territorio de uno o ambos nervios trigéminos que cumple el criterio C |
| B. Evidencia clínica de signos de disfunción trigeminal, positivos (hiperalgesia, alodinia) o negativos (hipoestesia, hipoalgesia) |
| C. No se ha identificada una causa |
| D. Sin mejor explicación por otro diagnóstico de la ICHD-3 |
Criterios diagnósticos de neuropatía trigeminal dolorosa atribuida a otro trastorno (ICHD-3)
| A. Dolor facial unilateral o bilateral en el territorio de uno o ambos nervios trigéminos que cumple el criterio C |
| B. Se ha diagnosticado un trastorno distinto de herpes zoster o traumatismo, pero con reconocido potencial de causar neuropatía trigeminal dolorosa, con evidencia clínica positiva (hiperalgesia, alodinia) o negativa (hipoestesia, hipoalgesia) de disfunción del nervio trigémino y que afecta a uno o ambos nervios trigéminos |
| C. Evidencia de la causa demostrada por ambos de los siguientes: |
| 1. El dolor está localizado en el territorio del (de los) nervio (s) afectado (s) por el trastorno |
| 2. El dolor se desarrolla tras el inicio del trastorno o bien conduce a descubrirlo |
| D. Sin mejor explicación por otro diagnóstico de la ICHD-3 |
Aunque no se encuentran recogidas en la actual clasificación, se trata de cuadros relativamente frecuentes que se caracterizan por un dolor en el territorio de una de las ramas terminales de alguna de las divisiones del trigémino. Se han descrito en V1 (neuralgia supraorbitaria, supratroclear, infratroclear o lacrimal), en V2 (neuralgia infraorbitaria) y en V3 (neuralgia del aurículo-temporal, del dentario inferior o del mentoniano) y su etiología puede ser primaria o sintomática a algún proceso, normalmente local (traumatismo, cirugía, tumor, etc.). Entre sus características más importantes destaca que el dolor se circunscribe al área inervada por el nervio afecto, que suele ser continuo (excepto en la neuralgia infratroclear, donde suele ser paroxístico), que hay hipersensibilidad en la emergencia o el trayecto del nervio, que aparecen signos clínicos o subclínicos de disfunción sensitiva en el territorio y que se produce un alivio completo y transitorio con el bloqueo del nervio específico26-30.
NeuroimagenEs recomendable la realización de una RM craneal a todo paciente con diagnóstico clínico de NT para descartar causas secundarias31. Se utilizan técnicas de reconstrucción en 3D que reemplazan a las clásicas secuencias en 2D, permitiendo una óptima evaluación anatómica del nervio. La tomografía axial computarizada (TC) craneal es una exploración que no tiene rendimiento en el estudio de la NT. Para valorar la presencia de una compresión neurovascular en la ZER mediante RM se recomienda la aplicación de los protocolos de imagen FIESTA, DRIVE o CISS, que incluyen secuencias T2 +3D, angioRM con secuencias TOF y T1 con gadolinio y reconstrucciones en 3D, pues su comparación con la presencia del contacto neurovascular en la cirugía muestra una sensibilidad del 98%, una especificidad del 100%, un valor predictivo positivo del 93% y un valor predictivo negativo del 97%20. Los falsos negativos se pueden deber a pequeñas arterias (diámetro <1mm), engrosamientos aracnoideos y causas menos comunes no detectadas usando RM32. La imagen con tensor de difusion (DTI) y la tractografía detectan anormalidades en la raíz de nervio trigémino que se normalizan tras la descompresión o la radiocirugía33-36.
Diagnóstico diferencial de la neuralgia del trigéminoEl diagnóstico de la NT es clínico. Las patologías más frecuentes con las que hay que hacer el diagnóstico diferencial de la NT se enumeran en la tabla 65.
Diagnóstico diferencial de la neuralgia del trigémino
| Cefaleas trigémino autonómicas | Otras neuralgias craneofaciales | Otros dolores craneofaciales |
|---|---|---|
| SUNCT, SUNA | Neuralgia del glosofaríngeo | Dolor secundario a trastornos estructurales craneofaciales (enfermedades odontológicas, patología de la articulación temporomandibular) |
| • Síntomas vegetativos• Mayor duración de los ataques• Sin mejoría con CBZ• Dolor menos intenso que la NT• Siempre en V1 | • Distribución del dolor en territorio sensitivo del nervio glosofaríngeo: base de la lengua, fosa amigdalar, ángulo mandibular y oído• Puede acompañarse de síncope/bradicardia | • Dolor difuso, sin distribución nerviosa específica• Signos y síntomas de inflamación o infección asociados |
| Cefalea en racimos | Neuralgias de ramas terminales trigeminales | Dolor facial idiopático persistente |
| • Síntomas vegetativos• Distribución en V1• Sin paroxismos• Duración 15 a 180 minutos | • Distribución nerviosa restringida a ramas trigeminales terminales (nervio supraorbitario, aurículo-temporal, etc.)• Con frecuencia el bloqueo anestésico en la rama terminal es diagnóstico | • Localización pobremente definida y que no se corresponde con la distribución de un nervio periférico• Cualidad sorda, lancinante o persistente |
| Hemicránea paroxística | Neuralgia del nervio intermediario | Neuropatía del trigémino dolorosa |
| • Síntomas vegetativos• Localización V1• Duración 2 a 30 minutos• Sin paroxismos• Respuesta a indometacina | • Distribución de los paroxismos por conducto auditivo externo y parte del pabellón auricular y de la mastoides• Zona gatillo en parte posterior conducto auditivo externo o región periauricular | • Dolor primario que suele ser continuo• Quemante, urente, opresivo o punzante• Paroxismos de dolor breve no son predominantes• Frecuentes áreas de hipoestesia, alodinia e hiperalgesia |
Se indican las características clínicas más significativas que con más frecuencia diferencian las entidades que figuran en la tabla de la neuralgia del trigémino.
SUNA: cefalea unilateral neuralgiforme, de corta duración, con síntomas autonómicos craneales; SUNCT: síndrome de cefalea unilateral neuralgiforme, de corta duración, con inyección conjuntival y lagrimeo.
Se debe descartar que el dolor facial sea de origen dental, por una cefalea trigémino-autonómica (interrogando sobre la presencia de síntomas autonómicos), secundario a herpes zoster facial o a traumatismo facial ipsilateral37,38. Es necesario excluir una disfunción de la articulación temporomandibular y valorar la posibilidad de que el paciente padezca un dolor facial persistente idiopático. Otras neuralgias también deben ser consideradas, como la neuralgia del glosofaríngeo, la del nervio intermediario o la de ramas terminales.
Semiología y exploraciónEn la exploración debemos intentar identificar los puntos gatillo que, al ser estimulados, son capaces de generar dolor de características similares al que describe nuestro paciente. Los puntos gatillo se localizan tanto en el territorio doloroso como en zonas adyacentes, y pueden ser intraorales (hablar, masticar, lavarse los dientes) o extraorales (tocarse suavemente la cara o una corriente de aire frío)10. La evocación de estos episodios dolorosos nos va a proporcionar mucha información. Nos permiten localizar el dolor, medir su duración y comprobar la existencia del periodo refractario típico de la NT5. Asimismo, evaluaremos la presencia de signos acompañantes, como los autonómicos (inyección conjuntival, lagrimeo, rinorrea), menos pronunciados y más breves que los que aparecen en las cefaleas trigémino-autonómicas de corta duración, como la cefalea neuralgiforme unilateral de breve duración con hiperemia conjuntival y lagrimeo (SUNCT) y la cefalea neuralgiforme unilateral de breve duración con síntomas autonómicos craneales (SUNA)39,40.
La neuropatía trigeminal se define en la anamnesis como un dolor continuo o casi continuo sin que los paroxismos dolorosos sean tan predominantes como en la neuralgia. En la exploración podremos identificar múltiples signos tanto deficitarios (hipoestesia) como irritativos (disestesia), así como alteraciones en el reflejo corneal41. En las neuropatías dolorosas trigeminales postraumáticas y postherpéticas se podrá recoger ese antecedente en la anamnesis. En las debidas a virus herpes, además, se podrían observar restos de las lesiones cutáneas.
Además, en esas formas secundarias pueden aparecer signos de afectación de otros nervios craneales y estructuras del sistema nervioso, así como signos sugerentes de enfermedad sistémica en la inspección general. Se debe llevar a cabo una exploración detallada de la cara, del cuello y de la cavidad oral42,43. Una propuesta de sistemática de esa exploración puede ser: comenzar con una inspección de la piel y la anatomía de orejas, nariz, boca, dientes, encías y faringe, evaluando tanto el color como la inflamación o las posibles asimetrías; posteriormente, palpar los senos paranasales y la articulación temporomandibular, así como los músculos de la masticación, explorando la fuerza y el rango en la apertura mandibular. También es recomendable palpar los tejidos blandos faciales, cervicales e intraorales, incluyendo la presencia de posibles adenopatías; para finalizar, evaluaremos la movilidad cervical44,45 y exploraremos el reflejo corneal y el reflejo maseterino46,47.
Es importante diferenciar entre NT y neuralgia de sus ramas terminales. Para ello es recomendable delimitar de una manera lo más exacta posible la zona dolorosa y delinear el alcance de las alteraciones sensitivas. Esa sistemática, junto a la palpación de los puntos de emergencia de los nervios pericraneales, puede ayudarnos a diagnosticar sus correspondientes neuralgias, cuyo tratamiento se basa en los bloqueos anestésicos30,48. De igual modo, si el dolor se extiende a la zona posterior de la calota, la parte posterior de la oreja o el ángulo de la mandíbula, debemos considerar la afectación de ramas cervicales49,50.
Tratamiento médico de la neuralgia del trigéminoLa carbamazepina es el único fármaco cuya eficacia es claseI (grado de recomendaciónA), por lo que sigue siendo el tratamiento de elección y el único aprobado con esta indicación. Según el grado de certeza, aun siendo esta baja o relativamente baja, se distinguen dos líneas principales de tratamiento (tabla 7).
Tratamiento farmacológico de la neuralgia del trigémino y niveles de evidencia
| Línea de tratamiento | Fármacos |
|---|---|
| Primera línea | Carbamazepina (I, A)Oxcarbazepina (IV, C)Eslicarbazepina (IV, C) |
| Segunda línea | Lamotrigina (II, B)Baclofeno (II, B)Gabapentina (IV, C)Pregabalina (IV, C) |
| Otros | Fenitoína (IV, C)Lidocaína (IV, C)Miscelánea (IV, C)PimozidaTocainidaClonazepamTopiramatoÁcido valproicoLevetiracetamLacosamida |
Se incluyen aquí la carbamazepina y la oxcarbazepina (tabla 8). Con la primera se consigue respuesta en más del 60% de los pacientes, aunque el 30% de ellos desarrollan efectos adversos, que son graves en uno de cada 24 pacientes tratados. En relación con la oxcarbazepina hay estudios abiertos comparativos con carbamazepina que muestran una eficacia similar, mejor tolerancia y menor potencial de interacciones (claseIV, grado de recomendaciónC)3,7,41,51. Se encuentra en curso un estudio con una forma de liberación retardada de oxcarbazepina (ClinicalTrials.gov Identifier: NCT03374709).
Tratamientos de primera línea
| Fármaco | Dosis inicial | Incremento de dosis | Dosis de mantenimiento | Dosis máximas (diarias) | Eficacia (aprox.) | Efectos adversos comunes | Efectos adversos graves |
|---|---|---|---|---|---|---|---|
| Carbamazepina (CBZ) | 100-200mg cada 12h | 100mg cada 24-72h | 100-400mgcada 8h100-600mg/12h | 1.600mg | Reducción de un 50% del nivel del dolor en 60-70% de pacientes | MareoVértigoNáuseasSomnolenciaCefaleaDiplopíaSíntomascognitivosHiperlipemiaCrisisepilépticas (si supresión brusca) | Mielosupresión (controles hematológicos iniciales)HiponatremiaSIADHDaño hepáticoAnafilaxiaNecrólisis epidérmicatóxicaSíndrome de Stevens-JohnsonPensamientos suicidasTeratogénesis |
| Oxcarbazepina (OXC) | 150mg/12h | 150mg cada 24-72h | 150-900mg/12h | 1.800-2.400mg | Comparable a CBZ | Similares a CBZ (menos frecuentes) | Similares a CBZ (hiponatremia más frecuente) |
Sobre el acetato de eslicarbazepina, véase texto.
Del otro fármaco de este grupo actualmente disponible, el acetato de eslicarbazepina, no se dispone de pruebas suficientes para recomendar su uso en la NT o en el dolor neuropático en general (claseIV, grado de recomendaciónC). En estudios abiertos y observacionales con un número bajo de pacientes el acetato de eslicarbazepina es eficaz tanto en la NT como en la neuralgia postherpética, y su empleo en la práctica clínica es creciente por su mejor tolerancia y su mejor posología52,53. Sin embargo, el acetato de eslicarbazepina no está exento de efectos adversos, similares a los de los otros fármacos del grupo. Si uno de estos fármacos no es efectivo o se tolera mal, puede probarse otro del mismo grupo. La tabla 9 muestra recomendaciones para realizar los cambios entre ellos54,55.
Cambios entre bloqueadores de canales de sodio
| Sustitución de carbamazepina (CBZ) por oxcarbazepina (OXC) o viceversa | Se pueden sustituir directamenteDosis de OXC =dosis de CBZ × 1,5 (300mg de OXC =200 mg de CBZ) |
| Sustitución de oxcarbazepina (OXC) por acetato de eslicarbazepina (ESL) | Se pueden sustituir directamente, de un día para otro (cambio nocturno). Primer día: dosis matinal de OXC por la mañana; por la noche solo ESL (dosis completa). A partir del siguiente día, ESL (dosis completa) cada nocheDosis de OXC =dosis de ESL (dosis máxima ESL: 1.600 mg al día) |
| Sustitución de CBZ por ESL | Emplear al menos entre 1 y 4 semanas en efectuar el cambio completoDosis de ESL =dosis de CBZ/1,5 (dosis máxima ESL: 1.600mg al día) |
Lamotrigina o baclofeno son fármacos de segunda línea (claseII, grado de recomendaciónB). Se recomienda el uso de lamotrigina en monoterapia en caso de contraindicación o intolerancia a los fármacos de primera línea. El baclofeno se utiliza habitualmente asociado a otros fármacos, aunque puede ser útil en monoterapia (tabla 10).
Tratamientos de segunda línea
| Fármaco | Dosis inicial | Incremento | Dosis de mantenimiento | Dosis máximas(diarias) | Eficacia | Efectos adversos comunes | Efectos adversos graves |
|---|---|---|---|---|---|---|---|
| Lamotrigina | 25mg/24h | 25mg cada 7 días; 50mg cada 7 días a partir de la 3.ª semana | 100-200mg cada 12h | 600mg | IV/C | MareoNáuseasVisión borrosaAtaxiaInsomnioIrritabilidad | ExantemaNecrólisis epidérmica tóxicaSíndrome de Stevens-Johnson |
| Baclofeno | 5-10mg/8h | 5-10mg cada 24-72h | 25-35mg/8h | 105mg | IV/C | SomnolenciaMareoNáuseas, vómitosDebilidadFatigaEfectos anticolinérgicos | Síndrome de abstinencia (similar al de alcohol o benzodiacepinas, incluidas crisis epilépticas) si retirada brusca |
| Gabapentina | 100mg/8h | 100mg/24h300mg/72h | 600-1200mg cada 8h900-3.600mg al día | 3.600mg | IV/C | MareoSomnolenciaFatigaAtaxiaMiocloníasEdemasAumento de peso | AnafilaxiaPensamientos suicidasDepresión respiratoria |
| Pregabalina | 75mg/12h | 75mg/48-72h150mg cada 7 días | 75-300mg cada 12h | 600 mg | IV/C | Similares a gabapentina (más comunes) | Similares a gabapentina |
Pregabalina y gabapentina requieren ajuste de dosis en caso de enfermedad renal crónica.
Los principales inconvenientes de la lamotrigina son la necesidad de una subida muy lenta de dosis para minimizar el riesgo de exantema y el hecho de que las dosis necesarias para obtener un beneficio suelen ser altas, de modo que sus efectos adversos son más frecuentes.
Gabapentina y pregabalina pueden asociarse a uno de los fármacos de primera o segunda línea, o recomendarlos en monoterapia cuando no pueden utilizarse los anteriores (claseIV, grado de recomendaciónC).
Por su mejor tolerabilidad, la gabapentina puede resultar especialmente útil en pacientes ancianos y en la NT secundaria a EM, grupos en los que es más frecuente la intolerancia a los efectos de los tratamientos de primera y segunda línea sobre el sistema nervioso central. La pregabalina puede tener una eficacia similar, pero en general su tolerancia es peor41,56.
Otros fármacosEn la tabla 11 aparecen otros fármacos que cuentan con resultados favorables en la bibliografía, aunque poco consistentes, por lo que su uso no puede recomendarse de forma generalizada (claseIV, grado de recomendaciónC). Entre ellos aparece la fenitoína, la cual merece consideración aparte (véase la información contenida en la tabla)57. Otro neuromodulador de uso también creciente en la práctica clínica, tanto por vía oral como intravenosa, es la lacosamida58.
Otros fármacos con potencial utilidad en neuralgia del trigémino
| • Fenitoína. Basándose en bibliografía que apoya su uso, algunos autores reclaman que se incluya al menos entre los tratamientos de segunda o tercera línea, a dosis entre 300 y 600mg al día. Mecanismo de acción y perfil de efectos adversos similares a los de carbamazepina (menor frecuencia de mielodepresión). Ambas pueden combinarse |
| • Clonazepam. Beneficio en series cortas de casos. Poco recomendado por su baja relación entre eficacia y efectos adversos (sedación, dependencia) |
| • Topiramato (100-400mg al día). Beneficio en series cortas de casos |
| • Levetiracetam. Beneficio en series cortas de casos |
| • Valproato (600-2.400mg al día). Beneficio en series cortas de casos |
| • Pimozida (4-12mg al día). Muy utilizada en el pasado, actualmente bajo nivel de recomendación por efectos adversos (cardiovasculares [alargamiento QT] y sobre el SNC [sedación, síntomas cognitivos, discinesias]) |
| • Tratamientos con posible utilidad en urgencias por vía parenteral: lidocaína subcutánea, fenitoína o lacosamida intravenosa |
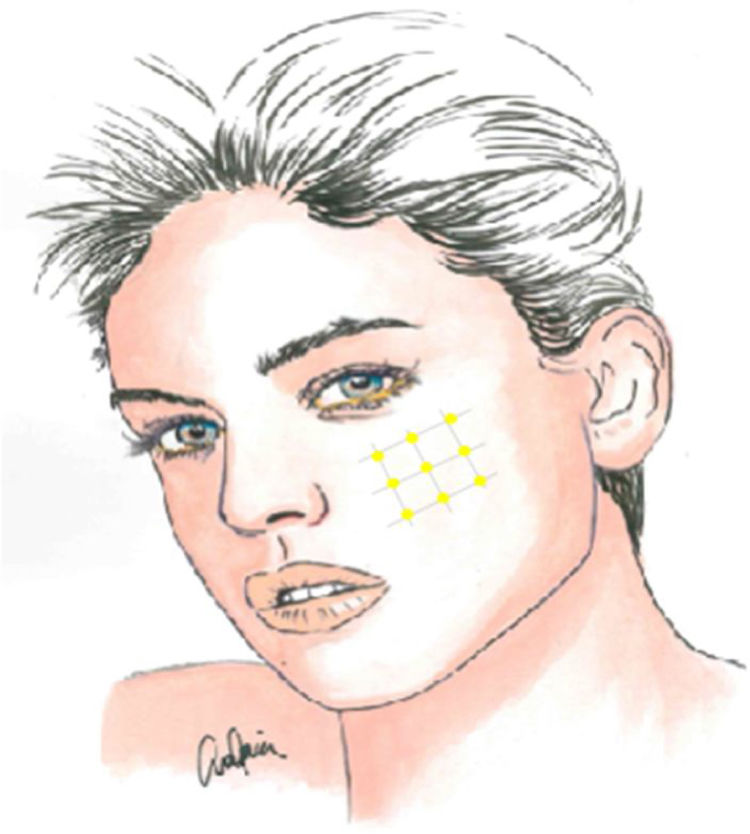
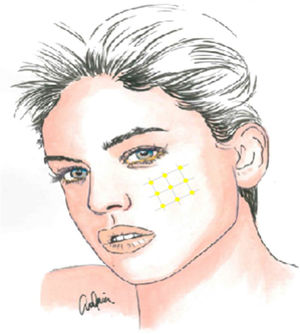
La infiltración local de toxina botulínica tipoA distribuida en el área del dolor podría ser una opción terapéutica interesante, dada la fisiopatología de la NT y el papel de dicho fármaco en modelos de dolor neuropático, pudiendo reducir la transmisión de impulsos efápticos y desensibilizar los puntos gatillo. Además de publicaciones de casos aislados, series de casos y estudios abiertos, desde 2011 se han realizado varios ensayos aleatorizados con metodología y resultados dispares. La recomendación actual es utilizarla en pacientes con NT farmacorresistente, a dosis de 25-75UI (2,5-5UI por punto), separando unos 15mm cada punto en el mapa del área dolorosa, que puede incluir la mucosa oral (claseII, grado de recomendaciónB)59-63 (fig. 2).
Tratamiento agudoLas exacerbaciones graves de la NT se caracterizan por un marcado aumento de la frecuencia, de la intensidad o de la duración de los paroxismos. Además del abordaje de la exacerbación, es necesario replantearse el tratamiento a medio plazo. Entretanto, en esta situación se hace necesario el uso de medicación por vía intravenosa para alivio rápido del dolor. Se desaconseja por completo el uso de opiáceos. Los fármacos más útiles son la fenitoína (o la fosfenitoína, no disponible en España) y la lidocaína (ambos claseIV, grado de recomendaciónC)64,65.
Tratamiento de la neuralgia del trigémino con dolor continuo de baseComo ya se ha mencionado, algunos pacientes pueden tener, entre los paroxismos, un dolor sordo de fondo, potencialmente resultante de la combinación de un daño estructural del nervio por una compresión vascular prolongada con fenómenos de sensibilización a nivel central. La presencia de este dolor continuo suele entrañar menor respuesta a los tratamientos médicos y predecir un peor resultado de los tratamientos quirúrgicos, sobre todo si es de evolución prolongada. Para este dolor persistente puede tener sentido asociar amitriptilina, otros antidepresivos tricíclicos o duloxetina (todos ellos claseIV, grado de recomendaciónC)66. Teniendo en cuenta que la depresión es frecuente en esta población de pacientes, estos fármacos pueden tener valor como tratamiento coadyuvante67.
Duración del tratamiento médicoUn buen número de pacientes experimentan remisiones completas, sobre todo al principio, lo que obliga a considerar una retirada de medicación cuando el paciente se encuentre completamente libre de dolor durante un tiempo suficiente, estimado en alrededor de 6meses (grado de recomendación GECSEN). En cualquier caso, dicha retirada debe realizarse de forma gradual43. El tratamiento quirúrgico se recomienda ante la ineficacia o la intolerancia al tratamiento médico adecuado y en aquellos pacientes en los que los fármacos dejan de ser efectivos con el paso del tiempo. Alrededor del 12% de los pacientes con NT no responden al tratamiento médico y son candidatos a cirugía68. Este porcentaje se eleva hasta el 35% en unidades especializadas69. El momento adecuado para una intervención no está establecido, pero es razonable no demorarla en exceso, y debe considerarse tras el primer año de ausencia de respuesta o intolerancia al tratamiento médico. En general, no cabe esperar un beneficio significativo del tratamiento médico si se han probado ya fármacos de tres grupos terapéuticos distintos, con mecanismo de acción diferente, ya sea por separado o en combinación, a las dosis adecuadas y durante un periodo máximo de 3meses en cada fármaco para determinar la falta de eficacia. En la tabla 12 se establecen las premisas fundamentales para el abordaje quirúrgico de la NT.
Premisas para abordar la cirugía en la neuralgia del trigémino refractaria
| 1. La evidencia sobre la eficacia de la cirugía de la neuralgia del trigémino está basada en estudios observacionales. No hay ensayos |
| 2. La indicación de cirugía debe ser clínica, salvo en la descompresión microvascular, donde hay criterios radiológicos |
| 3. La cirugía es la opción mejor valorada por los pacientes |
| 4. Se aconseja que la cirugía sea desarrollada por equipos de excelencia con curva de aprendizaje superada y aceptable morbimortalidad |
| 5. Es recomendable la creación de un comité de dolor craneofacial que evalúe de forma multidisciplinar e individualmente los pacientes candidatos a cirugía |
¿Qué técnica emplear como primera opción en la NT clásica refractaria?
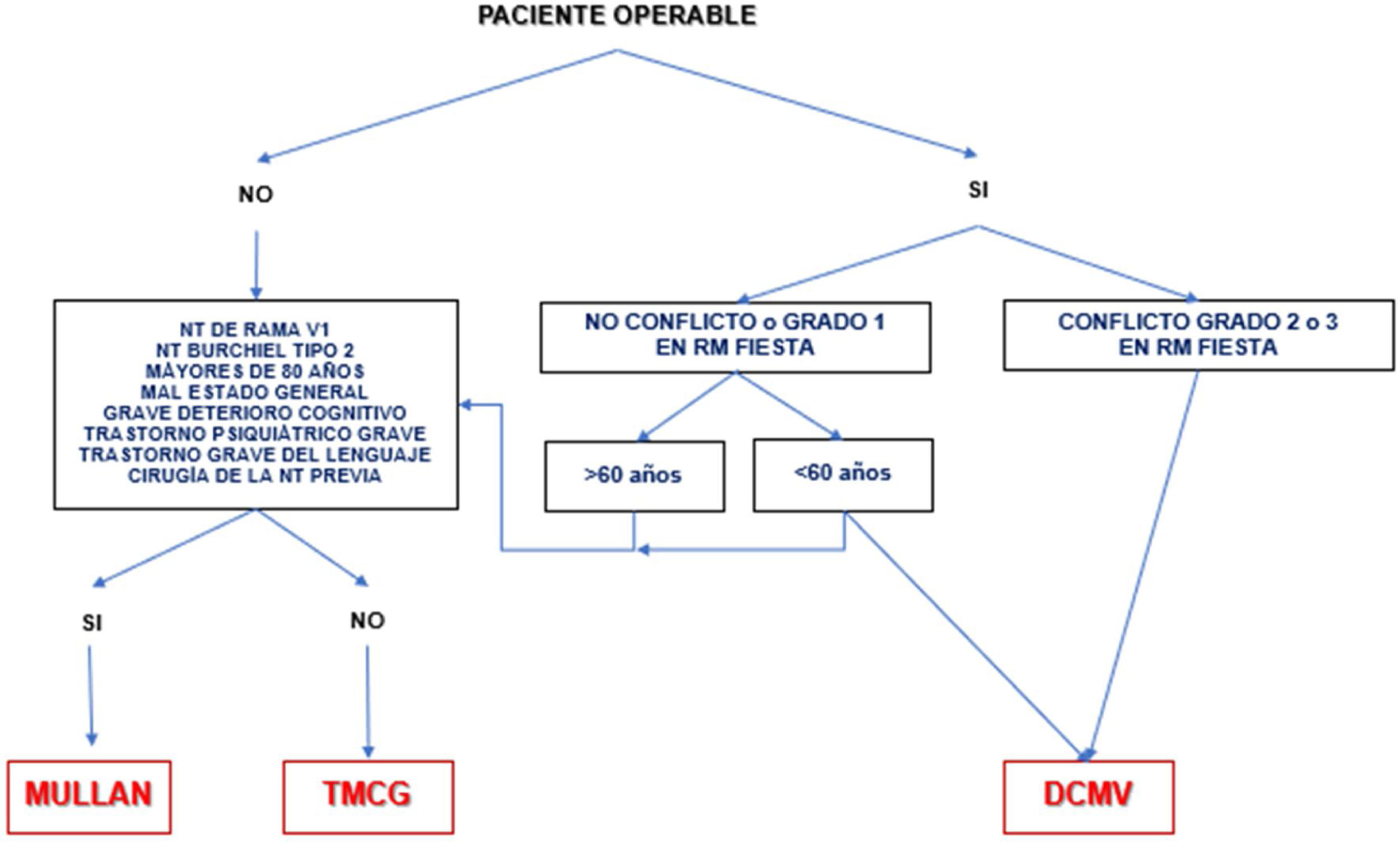
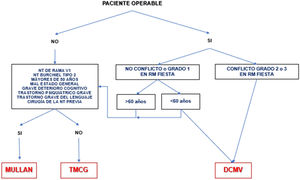
A corto plazo, las diferentes técnicas quirúrgicas son muy similares (tabla 13) en cuanto a eficacia se refiere. Por este motivo, la descompresión microvascular (DCMV) es la opción quirúrgica de elección, especialmente en aquellos pacientes en los que se detecte un contacto neurovascular. En la figura 3 se muestra una propuesta de algoritmo de decisión quirúrgica en la NT clásica e idiopática.
Algoritmo de decisión quirúrgica en la NT clásica e idiopática refractaria. Obsérvese que en pacientes menores de 60años sin conflicto neurovascular o con conflicto de grado1 se puede realizar una cirugía percutánea o una DCMV. Los defensores de la DCMV en casos de RM sin conflicto argumentan que pueden existir pequeños conflictos inadvertidos en RM o bien una aracnoiditis.
DCMV: descompresión microvascular; Mullan: compresión percutánea con balón; NT: neuralgia del trigémino; RM: resonancia magnética; TMCG: termocoagulación.
En todos ellos, el abordaje es similar y se realiza bajo radioscopia intraoperatoria, sedación y monitorización de constantes ante el riesgo de hipertensión arterial. El objetivo es canalizar con una aguja el foramen oval para introducir un electrodo en la termocoagulación (TMC), una sonda para inflar un balón (técnica de Mullan) o una cánula para inyectar sustancias (gangliólisis)25,70,71.
- •
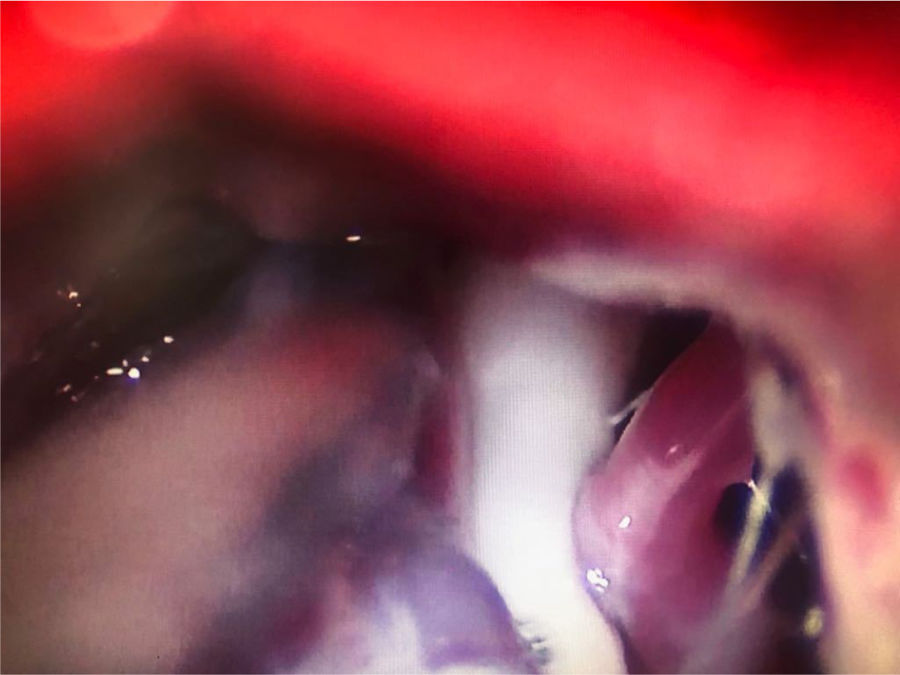
Termocoagulación del ganglio de Gasser. La aguja introducida en el foramen oval porta un electrodo para aplicar una radiofrecuencia térmica en el ganglio de Gasser (fig. 4a). Antes de ejecutar la radiofrecuencia se despierta al paciente, ya que tiene que colaborar en un test sensitivo en el que se realiza electroestimulación provocando parestesias para localizar la rama que se desea tratar. También se puede realizar bajo sedación, realizando una monitorización neurofisiológica intraoperatoria (estimulación antidrómica) que permite localizar las tres ramas del trigémino. En general, no se recomienda en NT de rama V1 por la posibilidad de que provoque un déficit sensitivo que afecte a la córnea.
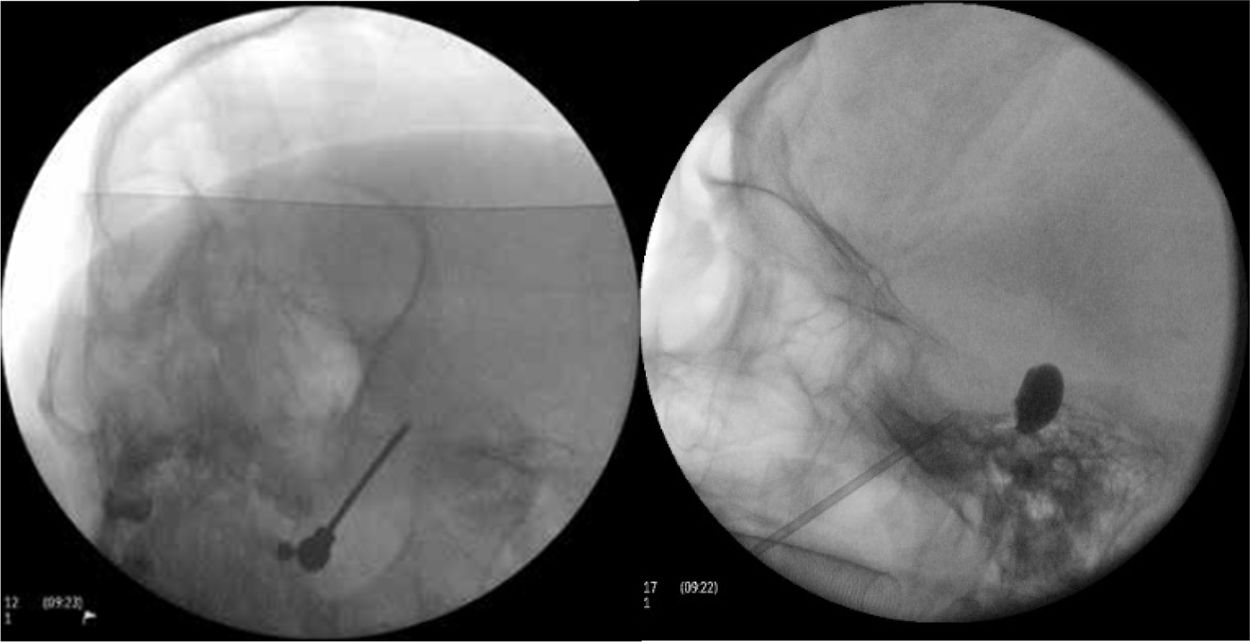
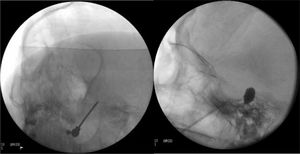
Figura 4.A)Electrodo de radiofrecuencia térmica (termocoagulación) introducido a través del foramen oval en la proyección de Waters en una paciente con neuralgia del trigémino de rama V3 refractaria. B)Cánula provista de sonda de Fogarty n.°4 introducida a través del foramen oval e inflado del balón en una paciente de 84 años con neuralgia del trigémino de rama V2 refractaria (Hospital de la Santa Creu i Sant Pau).
(0.06MB). - •
Compresión percutánea con balón del ganglio de Gasser. Conocida como técnica de Mullan, consiste en la introducción a través del foramen oval de una aguja de 15G provista de una sonda con un balón de Fogarty número4, bajo radioscopia y anestesia general, pues no precisa la colaboración del paciente. A continuación se procede al hinchado del balón con contraste hasta 0,7-0,75cc de volumen y 650-950mmHg de presión, visualizando en radioscopia el balón en forma de pera invertida o de reloj de arena en el cavum de Meckel (fig. 4b). La compresión se mantiene 60-120segundos y después se deshincha. El hinchado del balón puede comportar bradicardia y crisis/emergencia hipertensiva.
- •
Rizotomía percutánea retrogasseriana mediante glicerol. Consiste en la inyección de 0,2-0,5cc de glicerol anhidro al 99,9% tras acceder al ganglio de Gasser con una aguja espinal de 20G a través del agujero oval con anestesia local y realizando previamente una cisternografía con contraste. Sus principales desventajas son que el dolor puede tardar en mejorar de 7 a 19días, los fracasos iniciales son elevados y existe un alto grado de posibilidad de recurrencia. Esta técnica puede indicarse en NT de rama V1 y en NT bilaterales por EM72.
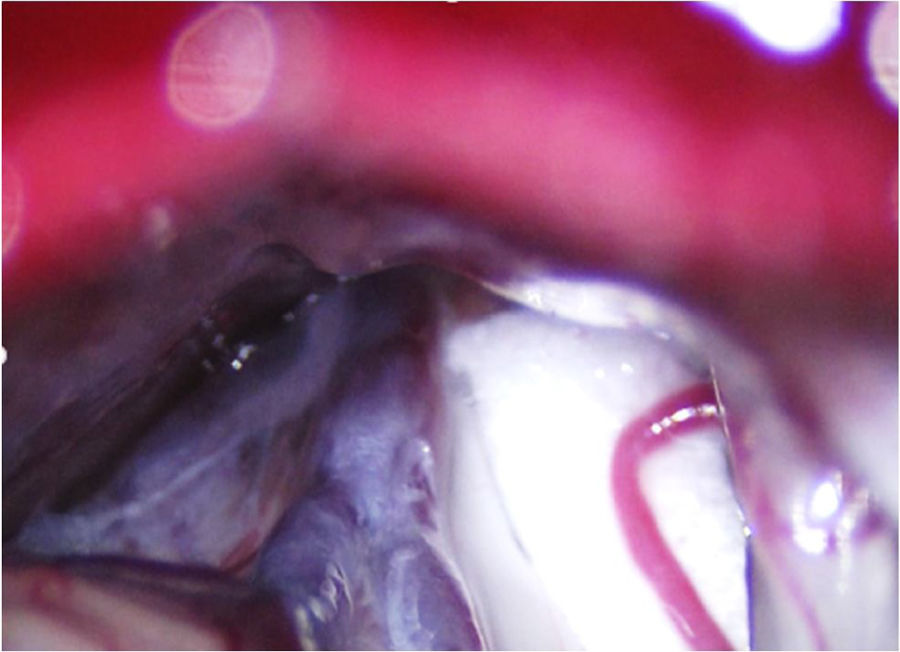
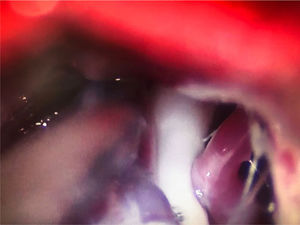
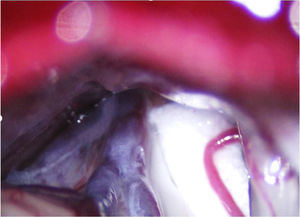
En la NT clásica se ha propuesto la siguiente clasificación del conflicto neurovascular (fig. 5): grado1, contacto simple; grado2, distorsión sin indentación, y grado3, indentación del vaso en el nervio73. Solo los tipos 2 y 3 se pueden considerar auténticas compresiones (fig. 6). La DCMV, propuesta por Gardner y desarrollada por Jannetta, consiste en la realización, bajo anestesia general, de una craneotomía de la fosa posterior de 2-3cm accediendo a la cisterna cerebelopontina mediante abordaje retromastoideo. Utilizando un microscopio quirúrgico se identifican los pares craneales y se puede utilizar la estimulación neurofisiológica para identificar el nervio facial. Una vez localizado el conflicto neurovascular, se procede con microdisectores a desplazar la estructura vascular para transposicionarla y separarla del nervio. Para evitar de nuevo el contacto y mantener ausencia o amortiguación del latido arterial, se colocan fragmentos microquirúrgicos de teflón (fig. 7) y se instila fibrina para evitar su desplazamiento. La tasa general de complicaciones de la DCMV es del 10 al 23%, pero diferentes estudios mostraron que son excepcionales en centros experimentados en cirugía de la NT74,75. La tabla 14 recoge los datos de eficacia y seguridad de la algunas de las técnicas quirúrgicas más empleadas en NT7,41,74-76.
Conflicto neurovascular de grado3 (indentación) entre la arteria cerebelosa superior y la zona de entrada de la raíz en el microscopio quirúrgico durante una descompresión microvascular en un paciente con neuralgia del trigémino V2 refractaria (Hospital de la Santa Creu i Sant Pau).
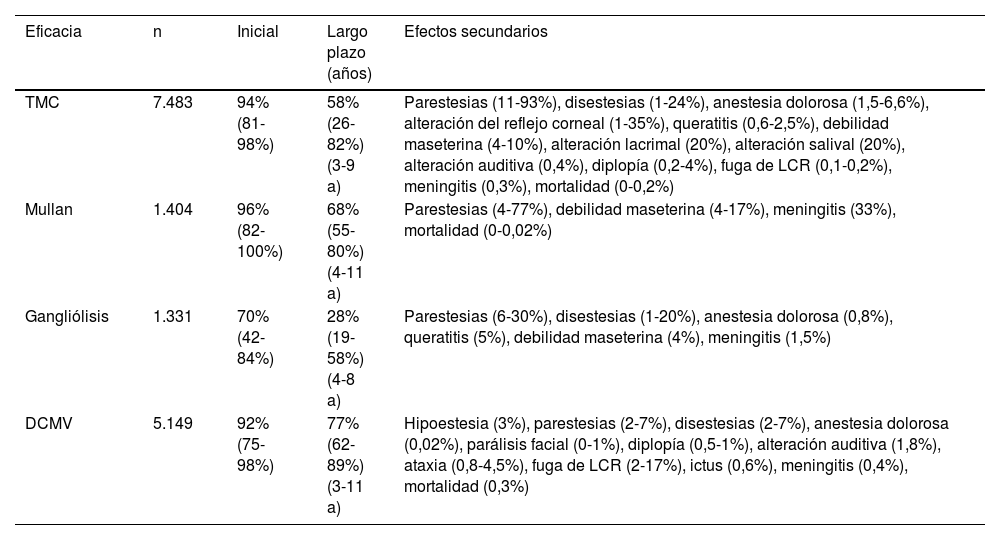
Eficacia y seguridad de las técnicas quirúrgicas más empleadas en la neuralgia del trigémino refractaria
| Eficacia | n | Inicial | Largo plazo (años) | Efectos secundarios |
|---|---|---|---|---|
| TMC | 7.483 | 94% (81-98%) | 58% (26-82%) (3-9 a) | Parestesias (11-93%), disestesias (1-24%), anestesia dolorosa (1,5-6,6%), alteración del reflejo corneal (1-35%), queratitis (0,6-2,5%), debilidad maseterina (4-10%), alteración lacrimal (20%), alteración salival (20%), alteración auditiva (0,4%), diplopía (0,2-4%), fuga de LCR (0,1-0,2%), meningitis (0,3%), mortalidad (0-0,2%) |
| Mullan | 1.404 | 96% (82-100%) | 68% (55-80%) (4-11 a) | Parestesias (4-77%), debilidad maseterina (4-17%), meningitis (33%), mortalidad (0-0,02%) |
| Gangliólisis | 1.331 | 70% (42-84%) | 28% (19-58%) (4-8 a) | Parestesias (6-30%), disestesias (1-20%), anestesia dolorosa (0,8%), queratitis (5%), debilidad maseterina (4%), meningitis (1,5%) |
| DCMV | 5.149 | 92% (75-98%) | 77% (62-89%) (3-11 a) | Hipoestesia (3%), parestesias (2-7%), disestesias (2-7%), anestesia dolorosa (0,02%), parálisis facial (0-1%), diplopía (0,5-1%), alteración auditiva (1,8%), ataxia (0,8-4,5%), fuga de LCR (2-17%), ictus (0,6%), meningitis (0,4%), mortalidad (0,3%) |
DCMV: descompresión microvascular; LCR: líquido cefalorraquídeo; Mullan: compresión percutánea con balón; TMC: termocoagulación del ganglio de Gasser.
- •
Cirugía estereotáxica. Una reciente revisión ha incluido 65 estudios (6.461 pacientes) tratados con diferentes modalidades de radiocirugía estereotáxica (RCE) y ha informado una eficacia similar entre ellas: Gamma Knife, 53%; acelerador lineal, 49%, y CyberKnife, 56%. La tasa de recurrencia es del 24 al 32%. Dos estudios han informado que del 30 al 45% de los pacientes tratados persistieron sin dolor ni fármacos durante un seguimiento de 10años. El efecto adverso más frecuente es la hipoestesia trigeminal (0-68%). Otros son: disestesias, parestesias, sequedad ocular, dolor por desaferentización y queratitis77.
- •
Sin embargo, dos metaanálisis que ha incluido 13 estudios (1.353 pacientes) han mostrado que la DCMV es más eficaz en el control del dolor a corto y a largo plazo (96%) que la RCE (71%), presenta menos complicaciones y un menor índice de reintervención, y es más barata. Por ello, la RCE solo se contempla en pacientes con NT con DCMV contraindicada o en pacientes con EM72.
- •
Terapia con ultasonidos de alta intensidad (High Intensity Focused Ultrasound [HIFU]). Se trata de una terapia no invasiva que se está empezando a aplicar en diferentes patologías que cursan con dolor. En la NT, consistiría en la aplicación de ultrasonidos guiados por RM en el ganglio de Gasser a través del foramen oval. Aunque prometedora, su eficacia está basada en casos aislados78.
- •
Neuromodulación.
- ∘
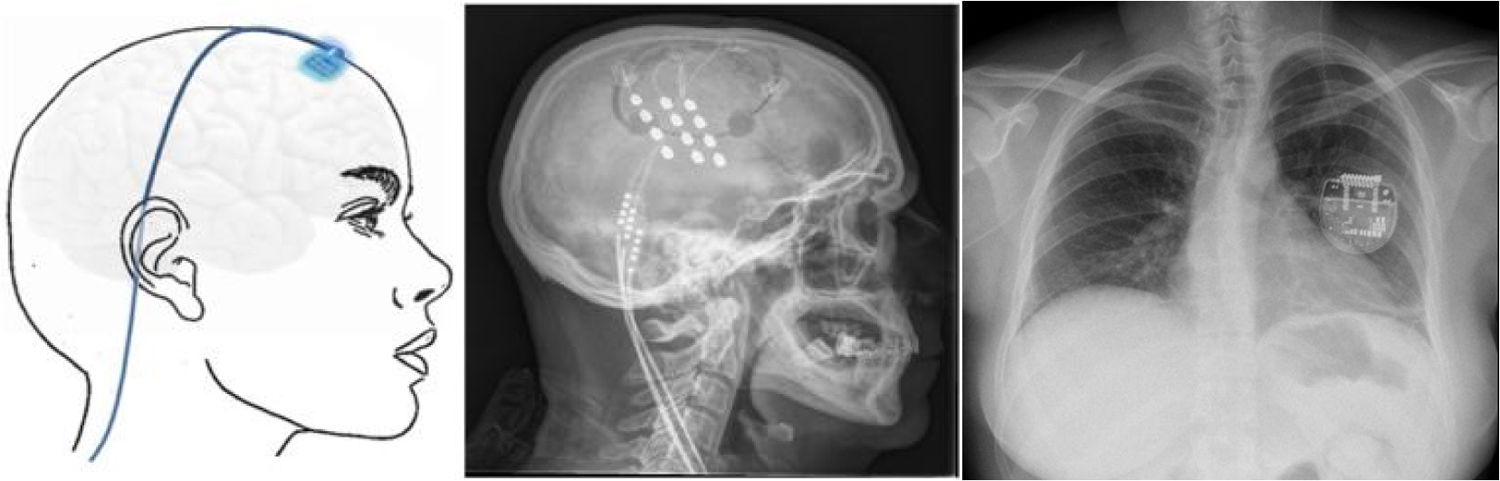
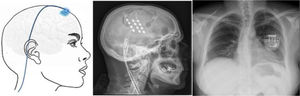
Estimulación cortical motora. Tras localizar el área del dolor facial mediante RM, se realiza una craneotomía guiada por neuronavegador bajo anestesia y se localiza el área de la mano mediante potenciales evocados somatosensoriales intraoperatorios. Los electrodos, generalmente cuatro en una placa, se pueden fijar a nivel epidural o subdural y se conectan a un generador subclavicular mediante tunelización subcutánea del cableado (fig. 8). La eficacia se sustenta en pequeñas series de pacientes que, incluyendo un total de unos 50 pacientes con seguimiento inferior a 40meses, informan una reducción del 50% del dolor en el 45-75% de los pacientes. Las complicaciones observadas son infección, hematoma epidural, convulsiones y efectos adversos cognitivos79.
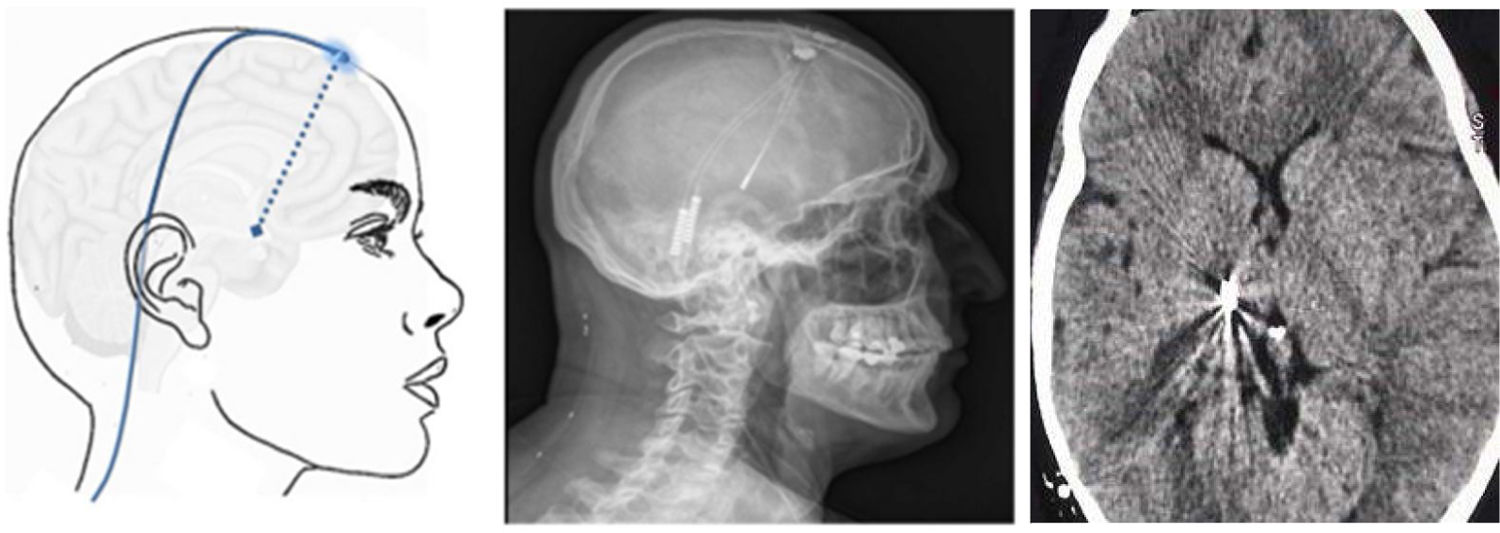
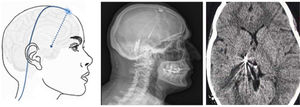
Figura 8.Esquema y radiografía de cráneo de perfil que muestran la ubicación de la placa de electrodos de estimulación en el córtex motor y el generador subclavicular en un dispositivo de estimulación del córtex motor en una paciente con neuralgia del trigémino refractaria a tratamientos farmacológicos, termocoagulación del ganglio de Gasser (TMCG), compresión percutánea con balón (Mullan) y descompresión microvascular (DCMV) (Hospital de la Santa Creu i Sant Pau).
(0.07MB). - ∘
Estimulación talámica. La estimulación cerebral profunda en la NT es excepcional y se ha realizado en casos secundarios a EM y postherpética, o en dolor facial por desaferentización. En otras ocasiones se habla de NT intratable, sin más. El target habitual es el núcleo ventroposteromedial del tálamo (fig. 9) o la sustancia gris periventricular/periacueductal, o ambos. Consigue una reducción del dolor en el 37-75% en 15 casos comunicados con un seguimiento inferior a 30 meses80.
Figura 9.Esquema, radiografía de cráneo en perfil y tomografía axial computarizada craneal que muestran el trayecto, a través de trepanación, del electrodo de estimulación hasta su inserción en el tálamo en una paciente con neuralgia del trigémino refractaria secundaria a esclerosis múltiple (Hospital de la Santa Creu i Sant Pau).
(0.09MB).
El diagnóstico de la NT es clínico. Es necesario realizar una cuidadosa valoración (anamnesis y exploración física) a los pacientes que consultan por dolor facial (paroxístico y/o continuo). La ICHD-3 clasifica el dolor atribuible a una lesión o enfermedad del nervio trigémino en NT y neuropatía trigeminal dolorosa. A su vez, la NT puede dividirse en tres tipos principales según la etiología del dolor: clásica, idiopática y secundaria. Las conclusiones más relevantes de la presente revisión son:
- 1.
En pacientes con NT es obligatorio realizar un estudio de RM (si no existe contraindicación) para valorar adecuadamente el tronco del encéfalo y la fosa posterior y descartar causas secundarias. Para estudiar la presencia de una compresión neurovascular con RM se recomienda la aplicación de los protocolos de imagen FIESTA, DRIVE o CISS.
- 2.
Una vez diagnosticada una NT el tratamiento farmacológico de elección debería ser carbamazepina, a menos que existan contraindicaciones. Otros bloqueadores de canales de sodio como oxcarbazepina podrían ser alternativas con una potencial mejor tolerancia.
- 3.
En pacientes que no respondan y/o no toleren adecuadamente un fármaco de primera línea se pueden plantear otros moduladores de segunda línea o tratamiento en politerapia. En pacientes que junto con las crisis de dolor presenten dolor continuo se puede indicar el uso de antidepresivos como amitriptilina o duloxetina. Las infiltraciones de toxina botulínica local pueden ser una alternativa eficaz en pacientes no respondedores o en politerapia.
- 4.
En pacientes refractarios debe valorarse la realización de un procedimiento quirúrgico. El tipo de técnica a utilizar depende de la presencia o no de una compresión neurovascular, así como de la edad y de otros condicionantes del paciente. La técnica de elección es la DCMV, especialmente en los pacientes en los que se identifique dicha compresión.
Los autores declaran no tener ningún conflicto de intereses.