Se ha demostrado que la terapia manual reduce los síntomas autoreportados en pacientes con cefalea tensional crónica (CTC). Sin embargo, la aplicación simultánea de la técnica de inhibición muscular suboccipital y corriente interferencial no se ha investigado previamente. Este estudio evalúa la efectividad de la inhibición muscular suboccipital y la corriente interferencial en comparación con los cuidados habituales sobre el dolor, la discapacidad y el impacto de la cefalea en pacientes con CTC.
MétodosLos pacientes se asignaron al azar al grupo de cuidados habituales (n = 13) o experimental (n = 12) que consistió en 20 minutos de inhibición muscular suboccipital y corriente interferencial dos veces por semana durante cuatro semanas. El resultado primario fue el dolor, y los resultados secundarios incluyeron la discapacidad producida por el dolor de cabeza y el impacto del dolor de cabeza que se valoraron por un evaluador cegado al inicio y después de cuatro semanas.
ResultadosLos análisis mostraron diferencias entre los grupos a favor del grupo experimental a las cuatro semanas para la discapacidad producida por el dolor de cabeza (Neck Disability Index: g-Hedges = 1,01; p = 0,001; Headache Disability Inventory: g-Hedges = 0,48; p = 0,022) e impacto del dolor de cabeza (HIT-6: g-Hedges = 0,15; p = 0,037) pero no para el dolor autoreportado (Numerical Rating Scale: g-Hedges = 1,13; p = 0,18).
ConclusionesLa aplicación simultánea de inhibición muscular suboccipital y corriente interferencial en pacientes con CTC no reduce significativamente el dolor autoreportado a las cuatro semanas. Sin embargo, mejora la discapacidad y el impacto del dolor de cabeza en la vida diaria. Estas mejoras superaron el mínimo cambio clínicamente importante de las mediciones, destacando su relevancia clínica.
Manual therapy has been shown to reduce self-reported symptoms in patients with chronic tension-type headache (CTTH). However, simultaneous application of suboccipital muscle inhibition and interferential current has not previously been investigated. This study evaluates the effectiveness of combined treatment with suboccipital muscle inhibition and interferential current compared to standard treatment for pain, disability, and headache impact in patients with CTTH.
MethodsPatients were randomly allocated to receive either standard treatment (n = 13) or the experimental treatment (n = 12), consisting of 20 minutes of suboccipital muscle inhibition plus interferential current twice weekly for 4 weeks. The primary outcome was improvement in pain, and secondary outcomes included improvement in headache-related disability and reduction in headache impact, which were assessed at baseline and at 4 weeks by a blinded rater.
ResultsStatistical analysis showed improvements in the experimental treatment group at 4 weeks for headache-related disability (Neck Disability Index: Hedges’ g = 1.01, P = .001; and Headache Disability Inventory: Hedges’ g = 0.48, P = .022) and headache impact (6-item Headache Impact Test: Hedges’ g = 0.15, P = .037) but not for self-reported pain (numerical rating scale: Hedges’ g = 1.13, P = .18).
ConclusionsCombined treatment with suboccipital muscle inhibition and interferential current in patients with CTTH did not significantly improve self-reported pain but did reduce disability and the impact of headache on daily life at 4 weeks. These improvements exceed the minimum clinically important difference, demonstrating the clinical relevance of our findings.
La cefalea tensional crónica (CTC) es caracterizada por episodios recurrentes de dolor de cabeza de 15 días o más al mes durante al menos tres meses (≥180 días por año). El dolor suele ser de presión o tensión (no pulsante), de ubicación bilateral, de intensidad leve a moderada y no agravado por las actividades de la vida diaria1.
La patogenia de la CTC sigue sin estar clara. Algunos autores han sugerido teorías fisiopatológicas gobernadas por la sensibilización central o periférica2. Además, se ha observado un deterioro de la función musculoesquelética cráneo-cervical, una posición adelantada de la cabeza, déficit de movilidad en el cuello o la activación de puntos gatillos miofasciales en la musculatura de la región suboccipital2-4. Aunque las estrategias de tratamientos para la CTC siguen siendo inespecíficas5, una reciente revisión sistemática de seis ensayos clínicos controlados aleatorizados ha destacado las intervenciones de terapia manual como una herramienta efectiva en el manejo de la CTC, la cual es igualmente efectiva que la medicación profiláctica a base de antidepresivos tricíclicos6. Sin embargo, la gran variedad de tratamientos junto con la falta de estudios bien diseñados6,7, hace que sea difícil sacar conclusiones firmes.
La inhibición muscular suboccipital forma parte del espectro de las técnicas de terapia manual dirigidas a aquellas áreas miofasciales comprometidas por restricción8. Se ha podido comprobar que esta técnica aplicada de forma aislada ha mostrado mejoras en el dolor en pacientes con CTC9,10. Sin embargo, desde nuestro conocimiento, la aplicación simultánea de la técnica de inhibición suboccipital junto con la corriente interferencial en pacientes con CTC no se ha investigado previamente. Dado que se ha demostrado que las corrientes interferenciales inducen analgesia a través de una reducción en la actividad eléctrica muscular y en la tensión muscular11, la aplicación simultánea de ambas técnicas podría conducir a una mejora en los síntomas autoreportados de estos pacientes.
El objetivo de este estudio fue analizar la efectividad de la aplicación simultánea de la técnica de inhibición suboccipital junto con corriente interferencial sobre el dolor, la discapacidad y el impacto del dolor de cabeza en la vida diaria en pacientes que sufren CTC. Se planteó la hipótesis de que la terapia simultánea basada en terapia manual y corriente interferencial podría ser más efectiva que los cuidados habituales en pacientes con CTC.
Material y métodosParticipantesEste estudio fue un ensayo clínico controlado aleatorizado simple ciego (registrado prospectivamente el 21 de julio de 2014 en www.clinicaltrials.gov NCT02195648). Todos los procedimientos se ajustaron a la Declaración de Helsinki y fue aprobado por el comité de ética de la Universidad Católica de Murcia, Murcia, España. Los resultados psicosociales secundarios (ansiedad, depresión y calidad de vida relacionada con la salud) se reportarán por separado.
Se realizó un muestreo no probabilístico y de conveniencia. Los pacientes fueron reclutados de un hospital regional (Hospital General Universitario Morales Meseguer, Murcia, España) y diagnosticados por un neurólogo de acuerdo con los criterios de la International Headache Society (IHC-3ª edición beta)12. En la tabla 1 se muestran los criterios de inclusión y exclusión.
Criterios de inclusión y exclusión
| Criterios de inclusión |
| Episodios recurrentes de dolor de cabeza en más de 15 días al mes durante al menos tres meses (≥180 días al año) |
| Episodios de dolor de 30 minutos a siete días |
| Cumplir dos o más de las siguientes características: |
| Localización bilateral de dolor |
| Presión dolorosa no pulsátil |
| Dolor leve a moderado |
| El dolor de cabeza no incrementa con la actividad habitual |
| La cefalea puede estar asociada a la sensibilidad pericraneal |
| Controlado farmacológicamente |
| Criterios de exclusión |
| Pacientes con otro tipo de cefalea primaria o secundaria |
| Dolor agravado por el movimiento de la cabeza |
| Problemas metabólicos o musculoesqueléticos con síntomas similares de dolor de cabeza |
| Traumatismo previo en la columna cervical |
| Vértigo, mareo, tensión no compensada |
| Pacientes con dispositivos cardiacos |
| Sufrir de fotofobia, fonofobia, náuseas o vómitos |
| Embarazo |
Los pacientes podían retirarse del estudio en cualquier momento y revocar su consentimiento sin incurrir en ninguna responsabilidad. Las personas que abandonaron el estudio no se sometieron a un seguimiento adicional ni fueron reemplazadas; sin embargo, se utilizó el análisis por intención de tratar. Los cálculos para determinar el tamaño de la muestra utilizando el modelo ANOVA se basaron en datos de estudios previos9,10 para detectar diferencias en el tratamiento de un tamaño de efecto f de 0,5, una prueba de dos colas, un nivel alfa de 0,05 y una potencia deseada (beta) de 80%. El tamaño estimado de la muestra fue de 13 sujetos por grupo. No obstante, se esperó una tasa de abandono de 10%, por lo que se consideró un tamaño total de 29 sujetos suficiente para la inclusión.
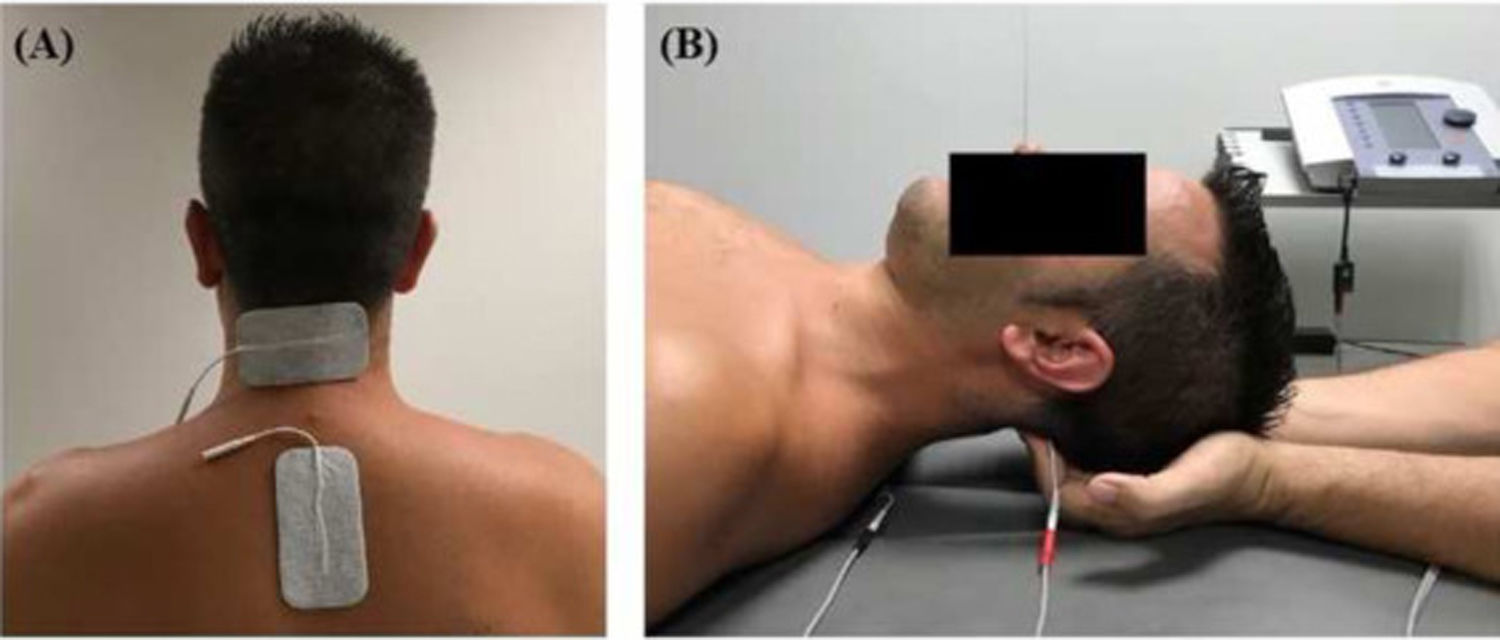
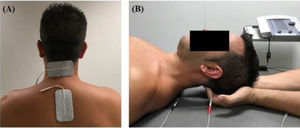
IntervencionesEl tratamiento fue aplicado por un fisioterapeuta con más de 10 años de experiencia en clínica. Los pacientes fueron asignados al grupo intervención o control (cuidados habituales) en orden aleatorio a través de un programa informático aplicado por un investigador cegado. Ambos grupos recibieron un tratamiento farmacológico prescrito por un neurólogo. El grupo de intervención recibió una sesión de 20 minutos (cinco minutos para la recepción del paciente, 10 para el tratamiento y los siguientes cinco minutos para el descanso y la estabilización hemodinámica), dos veces a la semana durante cuatro semanas que consistía en terapia de inhibición suboccipital y terapia interferencial aplicada a la musculatura suboccipital. La técnica de inhibición suboccipital fue aplicada con el paciente en decúbito supino con los ojos cerrados mientras que las manos del fisioterapeuta estaban colocadas bajo la cabeza del paciente contactando con la musculatura suboccipital. La presión del fisioterapeuta fue progresivamente aumentando aplicada durante 10 minutos como se ha descrito previamente9,10. De forma simultánea, se empleó una corriente interferencial generada con el equipo Sonopuls 492® (Sonopuls 492 TM Enraf-Nonius, Rotterdam, Holanda) a través de un canal y dos electrodos autoadhesivos sobre la musculatura suboccipital (fig. 1). Los parámetros seleccionados fueron: frecuencia portadora de 4.000 Hz, frecuencia modulada en amplitud de 100 Hz durante 10 minutos. La intensidad de la corriente fue gradualmente incrementada durante el primer minuto hasta que el fisioterapeuta notaba tensión sobre el tejido del paciente.
ResultadosLos resultados primarios y secundarios se evaluaron al inicio del estudio y tras cuatro semanas (punto final) a través de un formulario en papel por un investigador cegado a la asignación del grupo.
El resultado primario consistió en cambios en el dolor autoreportado medido con una escala de numérica de dolor (NRS) de 0 a 10 puntos. Los resultados secundarios fueron la discapacidad producida por el dolor de cabeza y el impacto del dolor de cabeza sobre la vida diaria. La discapacidad producida por el dolor de cabeza se valoró con los cuestionarios de versión española Headache Disability Inventory (HDI) y Neck Disability Index (NDI), los cuales han mostrado una fuerte consistencia/fiabilidad13-15 así como con el cuestionario Headache Impact Test-6 (HIT-6). El cuestionario HDI consiste en 25 ítems que valoran aspectos emocionales (13 ítems) y funcionales (12 ítems) con cuatro posibles opciones de respuestas. La puntuación total se obtiene en un rango de 0 a 52 puntos para el aspecto emocional y de 0 a 48 puntos para el aspecto funcional, indicando mayor discapacidad a mayor puntuación. El cuestionario NDI consiste en 10 preguntas que miden la discapacidad funcional con seis posibles opciones de respuesta. La puntuación total oscila en un rango de 0 a 50, donde la puntuación de 0 a 4 representa no discapacidad, 5 a 14 discapacidad leve, 15 a 25 discapacidad moderada, 25 a 34 discapacidad severa y 35 a 50 completa discapacidad. El impacto del dolor de cabeza sobre la vida diaria fue medido con el HIT-6 (alfa de Cronbach 0,89; fiabilidad test-retest de 0,78 a 0,90)16. La puntuación total del HIT-6 oscila de 36 a 78 puntos, indicando mayor impacto a mayor puntuación.
Análisis estadísticoEl análisis estadístico fue realizado utilizado el programa SPSS IBM Statistics 19.0 (IBM Corporation, Armonk, NY, USA). Las variables fueron inspeccionadas con el test Shapiro-Wilks para la normalidad y el test de Levene para valorar la homocedasticidad.
El análisis unidireccional de covarianza fue utilizado para comparar las variables clínicas y sociodemográficas. El tamaño del efecto fue calculado con el estadístico g-Hedges que corrige el sesgo que presenta la d-Cohen para muestras pequeñas17 y se complementó con el estadístico CL (common language) para el tamaño del efecto que se interpreta como la probabilidad existente de que un valor extraído al azar de la distribución de un grupo sea mayor que un valor extraído al azar del otro grupo; de manera que valores cercanos al 50% indican similitud entre grupos y valores cercanos al 100%, diferencias importantes entre grupos18. Las variables categóricas fueron inspeccionadas con la prueba X2.
El análisis de medidas repetidas ANOVA fue utilizado para comparar el efecto del tiempo (pre y postratamiento) y el factor intergrupo (grupo control y experimental) sobre las puntuaciones de NRS, NDI, HDI y HIT-6.
Se realizó un análisis de pruebas t post hoc univariantes para cada medida dependiente con respecto a la línea de base (dentro del grupo) y con respecto a los controles (comparación entre grupos). El nivel de significación se fijó en 0,05 (pruebas de dos colas) y se corrigió con el método Duncan-Bonferroni para las comparaciones múltiples. El análisis por intención de tratar se realizó utilizando el método de la última observación llevada a cabo.
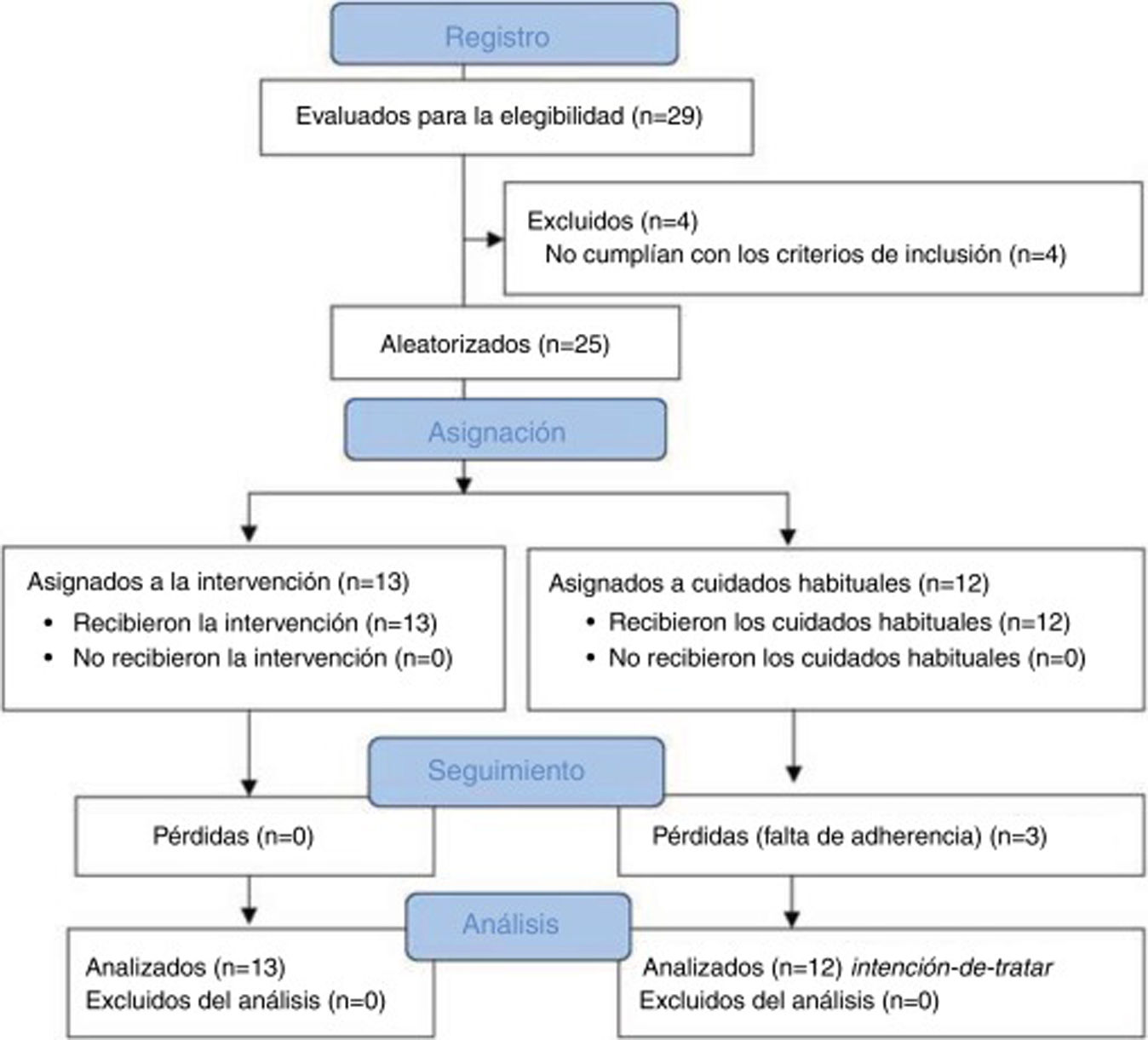
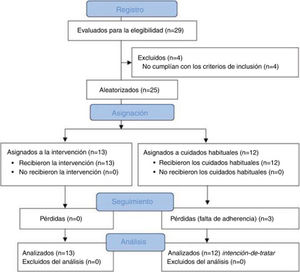
ResultadosMuestraUn total de 29 pacientes con CTC fueron valorados para participar en el estudio, de los cuales 25 cumplieron con todos los criterios de elegibilidad y se asignaron al azar al grupo experimental (n = 13) o control (n = 12). El proceso de aleatorización no mostró diferencias entre grupos en la línea base para las variables sociodemográficas (tabla 2) o clínicas (tabla 3). En relación con la medicación profiláctica y sintomática de los pacientes, fue similar en ambos grupos. En el grupo control seis pacientes tomaban antidepresivos frente a seis del grupo experimental, dos pacientes tomaban antidepresivos y ansiolíticos frente a cinco pacientes del grupo experimental. Por otro lado, cuatro pacientes no reportaron prescripción farmacológica frente a dos del grupo experimental. En cuanto al tipo de fármaco para tratar la sintomatología dolorosa todos tomaban paracetamol y antiinflamatorios no esteroideos (AINE).
Variables sociodemográficas en la línea base
| Variable | Control (n = 12) | Experimental (n = 13) | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Media (DT) | Mínimo | Q1 | Mediana (IQR) | Q3 | Máximo | Media (SD) | Mínimo | Q1 | Mediana (IQR) | Q3 | Máximo | g-Hedges (CL%) | p-valor | |
| Edad (años) | 46,2 (16,37) | 28,7 | 34,3 | 41,4 (24,43) | 58,8 | 82,4 | 43,3 (18,07) | 19,2 | 27,0 | 43 (30,45) | 57,4 | 73,8 | 0,16 (55%) | 0,679 |
| Peso (kg) | 68,9 (11,07) | 50,0 | 62,8 | 67,5 (14,75) | 77,5 | 89,0 | 67,5 (13,12) | 48,0 | 58,0 | 64 (20,5) | 78,5 | 90,0 | 0,11 (53%) | 0,777 |
| Altura (m) | 1,63 (0,109) | 1,45 | 1,54 | 1,63 (0,2) | 1,74 | 1,80 | 1,65 (0,1) | 1,52 | 1,55 | 1,68 (0,18) | 1,73 | 1,81 | 0,19 (55%) | 0,54 |
| IMC (kg/m2) | 26,3 (5,46) | 19,1 | 22,7 | 25,9 (4,19) | 26,9 | 40,5 | 24,7 (4,64) | 18,4 | 21,1 | 24,8 (4,48) | 25,6 | 36,3 | 0,31 (59%) | 0,44 |
| Sexo (Mujeres [%]) | 11(92%) | -- | -- | -- | -- | -- | 10 (77%) | -- | -- | -- | -- | -- | -- | 0,65 |
Desviación Típica (DT); Cuartil 1 (Q1); Cuartil 3 (Q3); Rango Intercuartil (IQR); g-Hedges con desviación típica agrupada. CL%: se interpreta como la probabilidad existente de que un valor extraído al azar de la distribución de un grupo sea mayor que un valor extraído al azar del otro grupo. p-valor para ANOVA de una vía y X2 para la variable Sexo.
Variables clínicas en la línea base
| Variable | Control | Experimental | Total | p-valor | |
|---|---|---|---|---|---|
| Sexo | Femenino | 11 (91,7%) | 10 (76,9%) | 21 (95,5%) | 0,65 |
| Masculino | 1 (8,3%) | 3 (23,1%) | 4 (18,2%) | ||
| Sensibilidad pericraneal | No | 5 (41,7%) | 9 (69,2%) | 14 (63,6%) | 0,33 |
| Sí | 7 (58,3%) | 4 (30,8%) | 11 (50%) | ||
| Dolor con la actividad | No | 4 (33,3%) | 6 (46,2%) | 10 (45,5%) | 0,81 |
| Sí | 8 (66,7%) | 7 (53,8%) | 15 (68,2%) | ||
| Dolor con la movilidad de cuello | No | 6 (50%) | 9 (69,2%) | 15 (68,2%) | 0,57 |
| Sí | 6 (50%) | 4 (30,8%) | 10 (45,5%) | ||
| Dolor a la presión | No | 5 (41,7%) | 7 (53,8%) | 12 (54,5%) | 0,84 |
| Sí | 7 (58,3%) | 6 (46,2%) | 13 (59,1%) | ||
| Restricción de la movilidad del cuello | No | 4 (33,3%) | 7 (53,8%) | 11 (50%) | 0,53 |
| Sí | 8 (66,7%) | 6 (46,2%) | 14 (63,6%) | ||
| Media (DT) | Media (DT) | g-Hedges (CL%) | p-valor | ||
| Dolor último mes (0-10) | 6,9 (1,33) | 6,5 (1,33) | 0,29 (58%) | 0,460 |
Los datos son reportados en valores absolutos y frecuencias relativas; p-valor para el test X2 y ANOVA de una vía para la variable dolor el último mes. g-Hedges: tamaño del efecto con desviación típica agrupada. CL%: se interpreta como la probabilidad existente de que un valor extraído al azar de la distribución de un grupo sea mayor que un valor extraído al azar del otro grupo.
Durante el seguimiento tres pacientes del grupo control que recibieron cuidados habituales se perdieron debido a falta de adherencia al protocolo de estudio. No hubo ningún efecto adverso durante el estudio. La figura 2 proporciona un diagrama de flujo del reclutamiento y seguimiento de los pacientes.
Resultados primariosEl dolor autoreportado disminuyó en 2,6 puntos (p = 0,011) para el grupo experimental mientras que el grupo control no mostró cambios al final de las cuatro semanas de intervención. Sin embargo, en la comparación entre grupos no se observaron diferencias significativas al final del estudio, pero sí un tamaño del efecto grande (g-Hedges = 1,13) y un tamaño del resultado CL del 79% (tabla 4), lo que podría apuntar a un efecto real significativo no detectado por el pequeño tamaño de los grupos.
Efecto dentro del grupo y entre grupos para el dolor, discapacidad y el impacto de dolor de cabeza
| Variables | Experimental (n = 13) | Dentro del grupo | Control (n = 12) | Dentro del grupo | Entre grupos | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Media (DT) | 95% IC | Min | Máx | g-Hedges (CL%) | p | Media (SD) | 95% IC | Min | Máx | g-Hedges (CL%) | p | g-Hedges (CL%) | p | |
| Dolor pre (0-10) | 4,6 (2,87) | 6,4-2,9 | 0 | 9 | 4,7 (2,99) | 6,3-2,6 | 0 | 8 | 0,03 (51%) | 0,96 | ||||
| Dolor post (0-10) | 2 (0,29) | 3,7-2,8 | 0 | 8 | 1,23 (82%) | 0,011 | 3,5 (1,83) | 5,3-2,7 | 0 | 10 | 0,47 (63%) | 0,27 | 1,13 (79%) | 0,18 |
| NDI pre (0-100) | 26,9 (15,74) | 38,1-18,5 | 6 | 68 | 38,8 (28,86) | 48,8-15,7 | 22 | 78 | 0,50 (64%) | 0,097 | ||||
| NDI post (0-100) | 17 (6,99) | 26,9-16,5 | 0 | 40 | 0,78 (72%) | 0,003 | 41,2 (32,63) | 49,7-13,4 | 24 | 66 | 0,08 | 0,46 | 1,01 (77%) | 0,001 |
| HDI emocional pre (0-52) | 24,5 (17,39) | 31,5-11,7 | 4 | 44 | 28,3 (19,58) | 37,1-13,8 | 6 | 50 | 0,20 (56%) | 0,46 | ||||
| HDI emocional post (0-52) | 19 (13,4) | 24,7-9,3 | 6 | 38 | 0,34 (60%) | 0,019 | 28,3 (20,91) | 35,8-11,7 | 6 | 50 | 0,00 (50%) | 0,99 | 0,52 (65%) | 0,037 |
| HDI funcional pre (0-48) | 28,5 (21,95) | 35,0-10,8 | 6 | 44 | 34,7 (28,29) | 41,0-10,0 | 18 | 48 | 0,24 (57%) | 0,15 | ||||
| HDI funcional post (0-48) | 22,6 (16,26) | 28,9-10,4 | 8 | 36 | 0,29 (59%) | 0,005 | 33,3 (26,52) | 40,2-10,7 | 14 | 48 | 0,05 (51%) | 0,51 | 0,48 (63%) | 0,018 |
| HDI total pre (0-100) | 53,4 (39,31) | 67,5-23,3 | 10 | 92 | 62,5 (48,95) | 76,0-21,3 | 26 | 98 | 0,20 (56%) | 0,32 | ||||
| HDI total post (0-100) | 41,7 (29,83) | 53,6-19,6 | 18 | 74 | 0,32 (59%) | 0,006 | 61,5 (48,34) | 74,7-20,8 | 26 | 98 | 0,02 (51%) | 0,81 | 0,48 (64%) | 0,022 |
| HIT-6 pre (36-78) | 62,5 (58,47) | 66,5-6,6 | 43 | 67 | 64,3 (61,02) | 67,5-5,1 | 54 | 70 | 0,029 (51%) | 0,46 | ||||
| HIT-6 post (36-78) | 53,4 (46,25) | 60,5-11,8 | 36 | 78 | 0,167 (55%) | 0,001 | 61,7 (58,17) | 65,1-5,5 | 47 | 68 | 0,04 (51%) | 0,31 | 0,15 (54%) | 0,037 |
Neck Disability Index (NDI); Headache Disability Inventory (HDI); Headache Impact Test-6 (HIT-6); 95% Intervalo de Confianza (IC 95%); Desviación Típica (DT); p-valor con corrección de Duncan-Bonferroni. -Hedges: tamaño del efecto con desviación típica agrupada. CL%: se interpreta como la probabilidad existente de que un valor extraído al azar de la distribución de un grupo sea mayor que un valor extraído al azar del otro grupo.
El grupo experimental mostró mayores mejoras en comparación con el grupo control para la discapacidad producida por el dolor de cabeza al final de las cuatro semanas de intervención. Los resultados mostraron una diferencia de medias entre grupos de 24,2 puntos, 9,3 puntos, 10,7 puntos y 19,8 puntos para las puntuaciones de NDI, HDI emocional, HDI funcional, y HDI total, respectivamente (p <0,05).
Adicionalmente, los resultados mostraron mejoras (diferencia de medias de 8,3 puntos) a favor del grupo experimental sobre el impacto del dolor de cabeza en la vida diaria medido con el cuestionario HIT-6 al final de las cuatro semanas de intervención (p = 0,037) (tabla 4).
DiscusiónEste ensayo clínico controlado aleatorizado evaluó la efectividad de la técnica de inhibición suboccipital y la corriente interferencial sobre el dolor y la discapacidad en pacientes con CTC. Los resultados indicaron mejoras sobre el dolor autoreportado, la discapacidad producida por el dolor de cabeza y el impacto del dolor de cabeza en la vida diaria después de cuatro semanas de tratamiento para el grupo experimental, sin embargo, no se observaron mejoras en el grupo control. Estos resultados apoyan nuestra hipótesis previa sugiriendo que la aplicación simultánea de la inhibición suboccipital y la corriente interferencia podría ser más efectiva a corto plazo que los cuidados habituales para la mejora del dolor y la discapacidad en pacientes con CTC.
Similar a nuestros resultados, Espí-López et al.10 mostraron mejoras en el dolor autoreportado, el impacto del dolor de cabeza y la discapacidad después de la aplicación de la técnica de inhibición suboccipital combinada con una técnica de manipulación cervical osteopática después de cuatro semanas de tratamiento. Además, el grupo que recibió ambos tratamientos mejoraron en mayor medida que los que recibieron únicamente inhibición suboccipital, manipulación cervical o una terapia placebo, sugiriendo que una combinación de tratamientos es a menudo más efectiva que un tratamiento aplicado de forma aislada, lo cual se asemeja más a la práctica habitual de fisioterapia cotidiana. No obstante, los resultados obtenidos en este estudio después de cuatro semanas de inhibición suboccipital combinada con la terapia de manipulación osteopática no superaron el mínimo cambio clínicamente importante (el cambio requerido en la puntuación en un instrumento que refleja cambios en el estado de salud de una persona a lo largo del tiempo) o el cambio mínimo detectable (la cantidad mínima de cambio que probablemente no se deba a la variación fortuita en la medición) para el dolor autoreportado19, el impacto de dolor de cabeza medido con HIT-620, y la discapacidad producida por el dolor de cabeza medido con el cuestionario HDI21 en pacientes con CTC, cuestionando los efectos del tratamiento y la relevancia clínica de estos hallazgos.
En nuestro estudio, mientras que no se observaron diferencias entre grupos para el dolor autoreportado, los resultados mostraron mejoras por encima del mínimo cambio clínicamente importante para la discapacidad medida con NDI (promedio de cambio >3,5 puntos)22, el impacto del dolor de cabeza medido con HIT-6 (promedio de cambio >8 puntos)20 y la discapacidad producida por el dolor de cabeza medida con HDI (promedio de cambio >16 puntos)21. Estos hallazgos son muy prometedores para la práctica diaria en el proceso de rehabilitación de estos pacientes. Sin embargo, los efectos a largo plazo no han sido evaluados en este estudio, por lo que los resultados deben tratarse con precaución.
Según nuestro conocimiento, pocos estudios han investigado las intervenciones de terapia manual y electroterapia analgésica para tratar los síntomas de CTC6,7. Jay et al.23 informaron de mejoras en la frecuencia e intensidad del dolor de cabeza después de la aplicación aislada de estimulación nerviosa eléctrica transcutánea (TENS) o de la combinación de TENS y terapia manual. Además, aunque estas mejoras fueron mantenidas en ambos grupos durante 6 seis de seguimiento, el grupo que recibió ambas terapias obtuvo una respuesta más rápida. Estos resultados resaltan la importancia de las intervenciones de terapia manual combinadas con electroterapia analgésica en el manejo de los síntomas en pacientes con CTC a corto y mediano plazo. Este estudio planteó la hipótesis de que tales mejoras eran el resultado de una reducción en el espasmo muscular y un aumento en los niveles de serotonina, beta-endorfina, ACTH y GABA en sangre23.
La inhibición suboccipital y la corriente interferencial pueden inducir analgesia y disminuir la tensión en los músculos suboccipitales a través de una reducción de la actividad muscular11, disminuyendo así la sensibilización periférica y central. Sin embargo, nuestro estudio no fue diseñado específicamente para identificar qué mecanismo subyacente podría explicar las mejoras informadas en el estudio. Se necesitan estudios futuros para comprender mejor los principales mecanismos responsables de la reducción de los síntomas autoreportados en pacientes con CTC.
Varios estudios han sido diseñados para comparar diferentes enfoques de tratamiento individual, por ejemplo, la comparación entre masaje cervical con terapia de ultrasonido24 o de la terapia de puntos de gatillos miofasciales con la atención habitual25. Sin embargo, la mayoría de los terapeutas en su práctica diaria aplican más de un tratamiento durante el proceso de rehabilitación para cada paciente y los efectos de la combinación de tratamientos suele ser difícil de determinar. Nuestro estudio puede arrojar luz sobre la influencia de la combinación de enfoques de tratamiento utilizados en las sesiones de fisioterapia sobre los resultados del proceso rehabilitador.
La calidad metodológica de los estudios que evalúan las intervenciones de terapia manual para los trastornos de CTC es frecuentemente cuestionada por ser demasiado baja6,7. Es bien sabido que el cegamiento en las investigaciones de fisioterapia es particularmente difícil en comparación con otros campos de la medicina, y que la naturaleza de las intervenciones de fisioterapia, como es la terapia manual, el cegamiento para los terapeutas y los pacientes puede ser complicado o incluso imposible26; sin embargo, el cegamiento del evaluador de resultados es crucial en los ensayos clínicos aleatorizados, especialmente cuando se utilizan resultados subjetivos como los informes autoreportados27. De lo contrario, los resultados sobre el dolor y la discapacidad podrían estar sobreestimándose hasta 25%27.
Limitaciones del estudioNuestro estudio fue un ensayo clínico controlado aleatorizado con cegamiento del evaluador de resultados y del analista para minimizar el riesgo de sesgo. Sin embargo, a pesar de un enfoque riguroso hacia el diseño, la recopilación de datos y la síntesis, el estudio no está exento de limitaciones. En primer lugar, aunque los cálculos para determinar el tamaño de la muestra se basaron en datos de estudios anteriores9,10, el tamaño de la muestra en ambos grupos fue pequeño, lo que limitó el poder estadístico de nuestro análisis y no se observaron diferencias estadísticamente significativas en el análisis entre grupos para el dolor, a pesar de un gran tamaño del efecto (g-Hedges = 1,13). En segundo lugar, como se mencionó anteriormente, sólo se analizaron los efectos a corto plazo de la intervención y se desconocen los efectos a medio y largo plazo. Por otro lado, la frecuencia de cefaleas es una de las variables de resultado primara propuesta por la Sociedad Internacional de Cefaleas (IHS), la cual no fue registrada en nuestro estudio. Sin embargo, esta variable es particularmente útil para evaluar el resultado de tratamientos farmacológicos de ensayos a gran escala y a largo plazo28. Finalmente, la inclusión de un grupo placebo podría haber revelado algunos de los mecanismos subyacentes de las mejoras informadas en el grupo experimental, dado que las intervenciones de terapia manual podrían tener un importante componente placebo, por lo que las mejoras en este estudio podrían no deberse completamente a la intervención aplicada29.
ConclusiónLa aplicación simultánea de inhibición muscular suboccipital y corriente interferencial en pacientes con CTC no reduce significativamente el dolor autoreportado a las cuatro semanas. Sin embargo, mejora la discapacidad y el impacto del dolor de cabeza en la vida diaria de estos pacientes. Estas mejoras superaron el mínimo cambio clínicamente importante de las mediciones, destacando la relevancia clínica del estudio. La inhibición muscular suboccipital junto con la corriente interferencial podría ser más efectiva que los cuidados habituales para mejorar los síntomas en pacientes con CTC. No obstante, son necesarios futuros estudios con muestras más amplias y la inclusión de un grupo placebo para determinar los efectos de esta terapia.
FinanciaciónEste estudio no ha recibido ningún tipo de financiación.
Aprobación del protocolo estándarEste estudio fue aprobado por el comité ético de la Universidad Católica de Murcia, Murcia, España. Este estudio fue diseñado de acuerdo con la normativa CONSORT y registrado prospectivamente en la base de datos ClinicalTrial.gov (NCT02195648).
Conflicto de interesesLos autores declaran no tener conflicto de intereses con el contenido de este manuscrito.
A todos los pacientes por su disposición a participar en este estudio.