Las deficiencias nutricionales son frecuentes en la enfermedad de Alzheimer (EA), incluso en fases iniciales. El deterioro nutricional (DN) puede asociarse con una progresión más rápida de la enfermedad. El objetivo fue describir la frecuencia y los factores de riesgo asociados a DN en el momento del diagnóstico y analizar su influencia en la evolución posterior.
MétodosEstudio observacional, multicéntrico, prospectivo. Se incluyeron sujetos recién diagnosticados de EA prodrómica (EAp) o demencia por EA (EAd). Se realizaron dos evaluaciones en un periodo de 18meses. Para estimar el estado nutricional se empleó el Mini Nutritional Assessment Test (MNA, rango 0-30; DN: MNA<24). El criterio de progresión fue un incremento en la Clinical Dementia Rating-sum of boxes≥3.
ResultadosSe incluyeron 50 sujetos con EAp (edad 76,1±5,3años; 68% mujeres) y 127 con EAd (edad 80±5,9años; 72,4% mujeres); 141 (79,7%) completaron las dos evaluaciones. La prevalencia de DN fue del 28,2% (EAp 24%, EAd 29,9%; p=0,43), la mayoría (92%) en riesgo de desnutrición. El DN se asoció con el sexo femenino (OR:4,2; IC95%: 1,7-10,5; p<0,001) y mayor afectación conductual (OR:5,8; IC95%: 2,6-12,7; p<0,001). Se observó mayor proporción de sujetos con progresión entre los que tenían un DN respecto a estado nutricional normal (50% vs 28,7%, p<0,05; EAd 53,6% vs 31,8%, p<0,05; EAp 41,7% vs 22,9%; p=0,21). Una mayor afectación cognitiva (OR:2,1; IC95%: 1,03-4,4; p<0,05) y un DN (OR:2,4; IC95%: 1,1-5,1; p<0,05) fueron factores de riesgo independientes de progresión.
ConclusionesLa prevalencia de DN en la EA es elevada. La evaluación del estado nutricional en el momento del diagnóstico puede permitir identificar pacientes con mayor riesgo de progresión de la enfermedad.
Nutritional deficiencies are frequent in Alzheimer disease (AD), even in early stages. Nutritional impairment (NI) may be associated with faster disease progression. The objective of this study was to describe the frequency of NI and the associated risk factors at the time of diagnosis and to analyse its influence on subsequent progression.
MethodsWe performed a prospective, multicentre, observational study of patients recently diagnosed with prodromal AD (pAD) or dementia due to AD (ADd). Two clinical assessments were conducted over a period of 18months. The Mini Nutritional Assessment test (MNA; score range, 0-30; cut-off point for NI, <24) was used to estimate nutritional status. Progression was defined as an increase of ≥3points on the Clinical Dementia Rating-sum of boxes test.
ResultsThe sample included 50 patients with pAD (mean [standard deviation] age, 76.1 [5.3] years; 68% women), and 127 with ADd (80 [5.9] years; 72.4% women). A total of 141 (79.7%) completed both evaluations. The prevalence of NI was 28.2% (24% for pAD, 29.9% for ADd; P=.43), with the majority (92%) at risk of malnutrition. NI was associated with female sex (odds ratio [OR]: 4.2; 95% confidence interval [CI]: 1.7-10.5; P<.001) and greater behavioural involvement (OR: 5.8; 95%CI: 2.6-12.7; P<.001). A larger proportion of patients with progression was observed among those with NI than among those with normal nutritional status (50% vs 28.7%, P<.05; ADd: 53.6% vs 31.8%, P<.05; pAD: 41.7% vs 22.9%, P=.21). Greater cognitive impairment (OR: 2.1; 95%CI: 1.03-4.4; P<.05) and NI (OR: 2.4; 95%CI: 1.1-5.1; P<.05) were independent risk factors for disease progression.
ConclusionsNI is highly prevalent in patients with AD. Assessing nutritional status at the time of diagnosis may enable identification of patients at greater risk of disease progression.
Debido a la ausencia de un tratamiento eficaz de la enfermedad de Alzheimer (EA), la investigación de factores modificables de la progresión resulta crucial. La pérdida progresiva de peso y la aparición de signos clínicos de desnutrición son una manifestación frecuente de este proceso. Numerosas investigaciones de los últimos años han puesto de manifiesto la relación existente entre la pérdida de peso, el estado nutricional y la EA1-5 o el síndrome demencial6. Además, la malnutrición se ha asociado con una progresión más acelerada7,8 y con una mayor gravedad y mortalidad de estos procesos9. Algunos estudios que han evaluado la influencia de diferentes patrones dietéticos sobre el deterioro cognitivo leve y la demencia subrayan la importancia de la nutrición en la evolución de esta10.
Entre ancianos institucionalizados la pérdida de peso es más frecuente entre sujetos con demencia que en personas cognitivamente sanas de edad similar, especialmente en las mujeres y de forma independiente de su estado nutricional11. Esta pérdida ponderal puede detectarse hasta en el 40% de los individuos con EA, en cualquier fase de la enfermedad, incluso varios años antes del diagnóstico3,6,12,13. Entre los pacientes con EA o demencia en general la prevalencia de desnutrición o riesgo de desnutrición es también elevada, con cifras variables entre el 14 y el 80% en función de la metodología empleada en su análisis2,5,14,15. En este contexto se ha identificado la «paradoja de la obesidad». Por un lado, el sobrepeso en edades medias de la vida constituye un factor de riesgo de demencia. Por otro, un mayor índice de masa corporal a edades avanzadas podría ser un factor protector16,17.
Se desconoce el mecanismo de interacción entre el estado nutricional y la EA. La pérdida de peso podría estar provocada por una menor ingesta calórica. Sin embargo, algunos estudios han comprobado que esta es incluso mayor que la de los controles sanos4. Algunos fenómenos biológicos, como lesiones subcorticales hipotalámicas18 y del lóbulo temporal medial19, podrían afectar los centros reguladores del apetito. La apraxia y la agnosia propias de la EA podrían provocar un cambio en los patrones de alimentación y alterar la ingesta o la preparación de alimentos en pacientes sin cuidados adecuados. Por otro lado, los trastornos de conducta o la agitación de algunos pacientes podrían a su vez aumentar el gasto energético20,21.
El estudio prospectivo «Evaluación de la demencia por EA en el momento del diagnóstico» (DEMDIAG) fue diseñado para evaluar diferentes variables clínicas, sociodemográficas y nutricionales de la EA en el momento del diagnóstico, así como para analizar la influencia de estas en la evolución posterior de la enfermedad, identificando factores de mal pronóstico de progresión inmediata. En este trabajo se presentan los resultados del análisis de las variables nutricionales del estudio, describiendo la frecuencia de deterioro nutricional, sus factores predisponentes y su influencia en la progresión de la enfermedad.
Pacientes y métodosDiseño del estudioEstudio epidemiológico observacional, multicéntrico, prospectivo, analítico, de cohorte cerrada. Se realizó en las consultas externas de neurología del Hospital Universitario Río Hortega de Valladolid y el Complejo Asistencial de Segovia. Se realizaron dos evaluaciones a los pacientes. Para la evaluación basal se efectuó un reclutamiento prospectivo en un periodo de 16meses. La segunda evaluación se realizó a los 18±1mes de la basal. No se planteó ningún tipo de intervención fuera de la práctica habitual.
Criterios de inclusión de los pacientesLos criterios de inclusión fueron:
- a)
Pacientes de cualquier edad y sexo.
- b)
Residentes en la comunidad.
- c)
Pacientes que consultan por primera vez, en el ámbito de atención especializada, por síntomas de deterioro cognitivo en cualquier grado, con perfil cortical.
- d)
Diagnóstico posterior, confirmado en el seguimiento, de demencia por EA (EAd), según criterios NINCDS-ADRDA de EA probable22, o EA prodrómica (EAp) según criterios IWG-123.
- e)
Existencia de un cuidador o informador fiable.
- f)
Firma del consentimiento informado por el paciente o su representante legal en caso de incapacidad.
Los criterios de exclusión fueron:
- a)
Diagnóstico previo de demencia de cualquier tipo.
- b)
Cuando el resultado de las pruebas complementarias, la evaluación neuropsicológica o el seguimiento confirma la ausencia de EA, o una patología diferente a esta.
Los pacientes fueron sometidos a una evaluación neurológica y neuropsicológica idéntica en dos ocasiones (basal y a los 18meses). Entre estas se realizó el seguimiento habitual a criterio de los neurólogos responsables (MFRS y MATA), expertos en evaluación y tratamiento de la demencia.
En la evaluación basal se realizó una entrevista estructurada y se recogieron distintas variables sociodemográficas, educativas y los años de escolaridad. Se identificaron el síntoma inicial principal y los antecedentes médicos, de forma específica factores de riesgo vascular, hábitos tóxicos y ejercicio físico. Se realizó un estudio diagnóstico diferencial de demencias secundarias que incluyó un estudio analítico completo con determinación de iones, función renal, hormonas tiroideas y vitaminaB12. Se determinó el genotipo ApoE. En todos los casos se realizaron pruebas de neuroimagen, de forma preferente una RM cerebral con cortes coronales potenciados en T1 y estimación de atrofia de hipocampos mediante la escala visual de Scheltens et al.24. Se consideró una atrofia temporal medial significativa para el diagnóstico de EAp una puntuación ≥2. Cuando no fue posible, se realizó una TC cerebral.
Instrumentos de medidaPara evaluar el estado nutricional se empleó la versión española del Mini Nutritional Assessment Test (MNA), herramienta que identifica personas ancianas desnutridas o en riesgo de desnutrición25. Contiene 6 preguntas de cribado y 12 de evaluación. El MNA incluye:
- 1.
Medidas antropométricas: índice de masa corporal (IMC), pérdida ponderal, circunferencia braquial y de la pantorrilla.
- 2.
Evaluación global: estilo de vida, medicación habitual y movilidad.
- 3.
Cuestionario dietético: número de comidas, consumo de alimentos líquidos y sólidos y autonomía para la alimentación.
- 4.
Estado subjetivo de salud y nutrición.
El tiempo habitual de realización es de 10min. Su rango de puntuación es 0-30. Las puntuaciones 24-30 indican un estado nutricional normal; 17-23,5, riesgo de desnutrición, y <17, desnutrición. Con estos rangos de puntuación está validado frente a una evaluación nutricional exhaustiva, mostrando una sensibilidad del 96%, una especificidad del 98% y un valor predictivo positivo del 97%25. A efectos del estudio se consideró «deterioro nutricional» (DN) una puntuación del MNA <24. Como complemento al MNA se determinaron marcadores bioquímicos del estado nutricional: colesterol total, albúmina, prealbúmina y transferrina.
Para la evaluación del estado cognitivo se empleó la versión española del Cambrigde Cognitive Examination-Revised (CAMCOG-R; rango 0-105)26 que incluye la puntuación del Mini-Mental State Examination (MMSE) de Folstein. Se consideró la existencia de una amnesia episódica significativa para los criterios IWG-1 una puntuación en la subescala de memoria (rango 0-27) inferior a la media menos dos desviaciones estándar de los datos normativos para sujetos sin demencia. Para la evaluación funcional se empleó la versión española de la Rapid Disability Rating Scale-2 (RDRS-2; rango 18-72)27. Para la evaluación conductual se empleó la versión española breve del inventario neuropsiquiátrico (Neuropsychiatric Inventory Questionaire [NPI-Q]), que mide la presencia y la gravedad de 12 aspectos patológicos de la conducta, así como el estrés que producen en el cuidador28. Se obtienen dos puntuaciones: gravedad (rango 0-36) y estrés (rango 0-60). Para la evaluación de la carga del cuidador se empleó la escala de Zarit (rango 22-110)29. Como medida global de la gravedad de la demencia se empleó la Clinical Dementia Rating (CDR)30. Adicionalmente, se calculó la CDR «sum of boxes» (CDR-SB) como la suma de las puntaciones individuales de cada uno de los seis dominios que evalúa la escala31. El criterio de progresión de la enfermedad entre las dos evaluaciones del estudio fue un incremento en la CDR-SB ≥332.
Análisis estadísticoLas características clínicas y sociodemográficas fueron analizadas mediante frecuencias absolutas y relativas en el caso de variables cualitativas y con medidas de tendencia central y dispersión para las variables cuantitativas. Se evaluó el ajuste a la curva normal de las variables mediante el test de Kolmogorov-Smirnov, previo a la elección de test paramétricos o no paramétricos. La comparación entre proporciones se realizó con el test χ2. En las pruebas de contraste de hipótesis, para las variables normales se empleó la t de Student para datos independientes o relacionados. Para las variables cuantitativas ordinales o cuantitativas no normales se empleó la U de Mann-Whitney, en el caso de variables independientes, y la prueba de los rangos con signo de Wilcoxon para datos pareados. En el análisis de correlaciones bivariadas se empleó el coeficiente de correlación de Spearman (Ͽ).
En el análisis de variables predictoras del estado nutricional se categorizó la puntuación del MNA según el valor basal fuera <24 o ≥24. En el análisis de variables predictoras de progresión se categorizó la puntuación entre incremento de CDR-SB a los 18meses <3 o ≥3. En ambos casos se realizó un estudio de regresión logística multivariable con el método de pasos hacia delante. Se categorizaron todas las variables cuantitativas incluidas en el modelo según el valor de su mediana en la evaluación basal. Se calcularon las odds ratio crudas (análisis bivariante) y ajustadas (análisis multivariante), con intervalos de confianza del 95%. El análisis estadístico se realizó con el programa SPSS v.22.0 (IBM Corp, Armonk, NY). El nivel de significación empleado fue p<0,05.
Consideraciones éticasEl estudio fue aprobado por los Comités de Ética e Investigación Clínica del Hospital Universitario Río Hortega de Valladolid y el Complejo Hospitalario de Segovia. Se solicitó la firma de un documento de consentimiento informado al paciente o a su representante legal o familiar más próximo en caso de incapacidad.
ResultadosDurante el periodo de reclutamiento se seleccionaron 204 sujetos que consultaron por deterioro cognitivo de perfil cortical. Se excluyeron 27 por no confirmarse el diagnóstico de EA en el seguimiento. La población inicial que completó la evaluación basal fue de 177 sujetos: 50 con EAp y 127 con EAd. Completaron la segunda evaluación 141 sujetos (79,7% de la población basal): 47 con EAp y 94 con EAd. Hubo 24 pérdidas de seguimiento, 9 fallecimientos y 3 exclusiones por enfermedad grave. El análisis de estas pérdidas respecto a la cohorte que completó las dos evaluaciones mostró una edad más alta (81,5 vs 78,2años; p<0,01), una mayor proporción de mujeres (86% vs 67%; p<0,05) y puntuaciones más bajas en MMSE (18,3 vs 21,3; p<0,01), CAMCOG-R (54,3 vs 64,7; p<0,01) y CDR-SB (6 vs 5; p<0,01). No se apreciaron diferencias en la escala MNA, el IMC o las variables bioquímicas.
En la tabla 1 se muestran las principales características sociodemográficas, los hábitos y los antecedentes de la población evaluada en la visita basal. Son destacables una mayor proporción de población urbana y de sujetos que vivían solos, con mayor nivel de estudios, en el grupo EAp respecto al grupo EAd. En la tabla 2 se muestran las características clínicas, bioquímicas, genéticas y los resultados en las escalas de evaluación en la población basal. El porcentaje de portadores del alelo ApoE ɛ4 fue del 48,8%. Según la puntuación en MNA, se encontraron 4 sujetos desnutridos (2,3% del total; 1 en EAp y 3 en EAd) y 46 en riesgo de desnutrición (26% del total; 11 en EAp y 35 en EAd).
Características sociodemográficas, hábitos y antecedentes en la evaluación basal
| Población completa(n=177) | EAp(n=50) | EAd(n=127) | p(EAp vs EAd) | |
|---|---|---|---|---|
| Edad, años (media ±DE; rango) | 78,9±6,0; 55,5-91,0 | 76,1±5,3; 58,6-84,6 | 80,0±5,9; 55,5-91,0 | <0,001a |
| Sexo (n; %) | ||||
| Hombres | 51; 28,8 | 16; 32 | 35; 27,6 | 0,56b |
| Mujeres | 126; 71,2 | 34; 68 | 92; 72,4 | |
| ÿmbito de residencia (n; %) | ||||
| Urbano | 123; 69,5 | 44; 88 | 79; 62,2 | <0,01b |
| Rural | 54; 30,5 | 6; 12 | 48; 37,8 | |
| Vive solo | 38; 21,5 | 13; 26 | 25; 19,7 | 0,36b |
| Estado civil (n; %) | ||||
| Casado | 96; 54,2 | 29; 58 | 67; 52,8 | |
| Viudo | 71; 40,1 | 19; 38 | 52; 40,9 | 0,85b |
| Soltero o separado | 10; 5,7 | 2; 4 | 8; 6,3 | |
| Años de escolaridad (mediana [Q1-Q3]) | 8 [6-8] | 8 [5-11] | 8 [6-8] | <0,05c |
| Nivel de estudios (n; %) | ||||
| Iletrados o primarios incompletos | 95; 53,7 | 21; 42 | 74; 58,3 | <0,01b |
| Primarios | 54; 30,5 | 13; 26 | 41; 32,3 | |
| Secundarios o más | 28; 15,8 | 16; 32 | 12; 9,4 | |
| Actividad actual (n; %) | ||||
| Jubilado sin actividad | 88; 49,7 | 25; 50 | 63; 49,6 | 0,91b |
| Tareas del hogar | 84; 47,5 | 23; 46 | 61; 48 | |
| Activo en su profesión | 5; 2,8 | 2; 4 | 3; 2,4 | |
| Antecedentes médicos y hábitos (n; %) | ||||
| Hipertensión arterial | 92; 52 | 26; 52 | 66; 52 | 0,99b |
| Diabetes mellitus | 35; 19,8 | 8; 16 | 27; 21,3 | 0,43b |
| Ictus | 15; 8,5 | 3; 6 | 12; 9,4 | 0,46b |
| Antecedentes familiares de demenciad | 66; 37,3 | 22; 44 | 44; 34,6 | 0,25b |
| Bebedor activoe | 39; 22 | 18; 36 | 21; 16,5 | <0,01b |
| Tabaquismo actual o previo | 40; 22,6 | 16; 32 | 24; 18,9 | 0,06b |
| Sedentario | 32; 18,1 | 6; 12 | 26; 20,5 | <0,01b |
EAd: demencia por enfermedad de Alzheimer; EAp: enfermedad de Alzheimer prodrómica.
Características clínicas, bioquímicas, genéticas y nutricionales en la evaluación basal
| Población completa(n=177) | EAp(n=50) | EAd(n=127) | p(EAp vs EAd) | |
|---|---|---|---|---|
| Síntoma inicial principal (n; %) | ||||
| Pérdida de memoria | 151; 85,3 | 46; 92 | 105; 82,7 | 0,11a |
| Otros | 26; 14,7 | 4; 8 | 22; 17,3 | |
| Escalas clínicas | ||||
| MMSE (media±DE) | 20,7±4,7 | 24,9±2,7 | 19±4,2 | <0,001b |
| CAMCOG-R (media±DE) | 62,6±15,4 | 78,8±6,2 | 56,2±13,1 | <0,001b |
| CAMCOG-R memoria (media±DE) | 10,2±4,8 | 14,6±3,7 | 8,5±4,1 | <0,001b |
| RDRS-2 (mediana [Q1-Q3]) | 25 [21-31] | 22 [20-25] | 28 [22-35] | <0,001c |
| NPI-Q gravedad (mediana [Q1-Q3]) | 6 [3-10] | 4 [2-6,25] | 7 [3-11] | <0,01c |
| NPI-Q estrés cuidador (mediana [Q1-Q3]) | 7 [3-13] | 4 [1-8,25] | 8 [4-14] | <0,001c |
| Zarit (media±DE) | 27,4±17,2 | 18,2±13,3 | 31±17,3 | <0,001b |
| CDR (n; %) | ||||
| CDR 0,5 (n; %) | 50; 28,2 | 50; 100 | − | − |
| CDR 1 (n; %) | 97; 54,8 | − | 97; 76,4 | − |
| CDR 2 (n; %) | 26; 14,7 | − | 26; 20,5 | − |
| CDR 3 (n; %) | 4; 2,3 | − | 4; 3,1 | − |
| CDR-SB (mediana [Q1-Q3]) | 5 [4-8] | 3 [2,5-3,625] | 6 [5-9] | <0,001c |
| Evaluación nutricional | ||||
| MNA (mediana [Q1-Q3]) | 25,5 [23,5-27] | 26 [23,875-27,625] | 25,5 [23-26,5] | 0,11c |
| DN (n; %) | 50, 28,2 | 12, 24 | 38, 29,9 | 0,43a |
| IMC (media ±DE) | 26,1±4,1 | 27,7±4,1 | 25,4±3,9 | <0,01b |
| Albúmina (media ±DE; muestra evaluada) | 4,1±0,3; 169 | 4,1±0,3; 49 | 4,2±0,4; 120 | 0,09b |
| Prealbúmina (media ±DE; muestra evaluada) | 24±5,7; 153 | 24,2±5,8; 43 | 23,9±5,7; 110 | 0,80b |
| Transferrina (media ±DE; muestra evaluada) | 255,2±40,7; 155 | 258±42,4; 45 | 254±40,2; 110 | 0,58b |
| Colesterol total (media ±DE; muestra evaluada) | 215,3±40,5; 177 | 220,5±40,6; 50 | 213,3±40,4; 127 | 0,30b |
| Genotipo ApoE ɛ4+ (n; %; muestra evaluada) | 79; 48,8; 162 | 24; 51,1; 47 | 55; 47,8; 115 | 0,71a |
CAMCOG-R: prueba cognitiva de Cambridge revisada; CDR: Clinical Dementia Rating; CDR-SB: Clinical Dementia Rating «sum of boxes»; DN: deterioro nutricional (MNA<24); EAd: demencia por enfermedad de Alzheimer; EAp: Enfermedad de Alzheimer prodrómica; IMC: índice de masa corporal; MMSE: Mini-Mental State Examination; MNA: Mini Nutritional Assessment test; NPI-Q: cuestionario del inventario neuropsiquiátrico; RDRS-2: Rapid Disability Rating Scale-2.
La tabla 3 muestra las características sociodemográficas y clínicas según el estado nutricional normal o DN en la evaluación basal. El sexo femenino, una mayor afectación funcional y neuropsiquiátrica y los sujetos con un CDR-SB más alto tenían mayor representación en el grupo de DN. No hubo diferencias en el IMC o los parámetros bioquímicos. La tabla 4 muestra los cambios en las escalas clínicas y parámetros nutricionales entre las dos evaluaciones. La mayoría (n=118; 83,7%) de los sujetos evaluados en dos ocasiones no mostraron cambios en su estado nutricional durante el estudio. Veintitrés sujetos cambiaron su perfil nutricional entre las dos evaluaciones: 11 pasaron de nutrición normal a riesgo de desnutrición y 12 pasaron de riesgo de desnutrición a nutrición normal. El IMC se mantuvo estable.
Características sociodemográficas y clínicas según el estado nutricional normal o deterioro nutricional en la evaluación basal
| Estado nutricional normal (MNA>23,5)(n=127) | Deterioro nutricional (MNA<24)(n=50) | p | |
|---|---|---|---|
| EAp (n; %) | 38; 29,9 | 12; 24 | 0,43a |
| EAd (n; %) | 89; 70,1 | 38; 76 | |
| Factores sociodemográficos | |||
| Edad evaluación basal, años (media ±DE) | 78,7±5,9 | 79,3±3,2 | 0,60b |
| Sexo femenino (n; %) | 83; 65,4 | 43; 86 | <0,01a |
| Vive solo (n; %) | 27; 21,3 | 11; 22 | 0,91a |
| ÿmbito rural (n; %) | 41; 32,3 | 13; 26 | 0,41a |
| Sin estudios (n; %) | 71; 55,9 | 24; 48 | 0,34a |
| Evaluación clínica | |||
| MMSE (media ±DE) | 21±4,6 | 19,7±4,7 | 0,07b |
| CAMCOG-R (media ±DE) | 62,9±15,2 | 61,6±16,2 | 0,61b |
| CAMCOG-R memoria (media ±DE) | 10,1±4,7 | 10,4±5,1 | 0,78b |
| RDRS-2 (mediana [Q1-Q3] | 23 [21-28] | 30 [24,75-38] | <0,001c |
| NPI-Q gravedad (mediana [Q1-Q3]) | 5 [2-8] | 9,5 [6-15,25] | <0,001c |
| NPI-Q estrés cuidador (mediana [Q1-Q3]) | 5 [2-10] | 12 [6-19,25] | <0,001c |
| Zarit (media ±DE) | 25,8±16,6 | 31,3±18,4 | 0,06b |
| CDR | |||
| CDR 0,5 (n; %) | 38; 29,9 | 12; 24 | 0,62a |
| CDR 1 (n; %) | 73; 57,5 | 24; 48 | 0,25a |
| CDR 2 (n; %) | 14; 11 | 12; 24 | <0,05a |
| CDR 3 (n; %) | 2; 1,6 | 2; 4 | 0,36a |
| CDR-SB (mediana; [Q1-Q3]) | 5; [4-7] | 6,75; [4,5-10] | <0,05c |
| Parámetros nutricionales | |||
| MNA (mediana [Q1-Q3]) | 26,5 [25-26,5] | 21,5 [19,875-23] | − |
| IMC (media ±DE) | 26,2±3,7 | 25,7±4,8 | 0,52b |
| Albúmina (media ±DE; muestra evaluada) | 4,1±0,4; 122 | 4,2±0,3; 47 | 0,17b |
| Prealbúmina (media ±DE; muestra evaluada) | 24,1±5,1; 112 | 23,6±6,3; 41 | 0,58b |
| Transferrina (media ±DE; muestra evaluada) | 256,1±42,7; 113 | 252,6±35,3; 42 | 0,63b |
| Colesterol total (media ±DE; muestra evaluada) | 214,4±39,9; 127 | 217,8±42,1; 50 | 0,61b |
| Genotipo ApoE ɛ4+ (n; %; muestra evaluada) | 59; 50,9; 116 | 20; 43,5; 46 | 0,40a |
CAMCOG-R: prueba cognitiva de Cambridge revisada; CDR: Clinical Dementia Rating; CDR-SB: Clinical Dementia Rating «sum of boxes»; EAd: demencia por enfermedad de Alzheimer; EAp: enfermedad de Alzheimer prodrómica; IMC: índice de masa corporal; MMSE: Mini-Mental State Examination; MNA: Mini Nutritional Assessment test; NPI-Q: cuestionario del inventario neuropsiquiátrico; RDRS-2: Rapid Disability Rating Scale-2.
Evolución de las escalas clínicas y los parámetros nutricionales entre las dos evaluaciones de la cohorte
| Visita basal(n=141) | Visita 18 meses(n=141) | p | |
|---|---|---|---|
| Edad (media±DE) | 78,2±6,2 | 79,7±6,2 | − |
| Escalas clínicas | |||
| MMSE (media±DE) | 21,3±4,4 | 19,0±5,7 | <0,001a |
| CAMCOG-R (media±DE) | 64,7±14,7 | 57,3±18,9 | <0,001a |
| CAMCOG-R memoria (media±DE) | 10,8±4,8 | 9,3±5,4 | <0,001a |
| RDRS-2 (mediana [Q1-Q3]) | 24 [21-30] | 29 [23,5-36] | <0,001b |
| NPI-Q gravedad (mediana [Q1-Q3]) | 5 [3-10] | 7 [3-11] | <0,001b |
| NPI-Q estrés (mediana [Q1-Q3]) | 7 [3-12] | 8 [4-13] | <0,001b |
| Zarit (media±DE) | 26,1±16,5 | 32,7±18,1 | <0,001a |
| CDR (mediana [Q1-Q3]) | 1 [0,5-1] | 1 [1-2] | <0,001b |
| CDR-SOB (mediana [Q1-Q3]) | 5 [3,5-7] | 7 [5-10,5] | <0,001b |
| Parámetros nutricionales | |||
| MNA (mediana [Q1-Q3]) | 25,5 [23,5-27] | 25,5 [23,5-27] | 0,08b |
| IMC (media±DE) | 26,2±4,1 | 26,1±4,7 | 0,62a |
| Albúmina (media±DE; muestra evaluada) | 4,2±3,6; 75 | 4,0±0,4; 75 | <0,001a |
| Prealbúmina (media±DE; muestra evaluada) | 24,4±5,5; 63 | 22,9±5,3; 63 | <0,001a |
| Transferrina (media±DE; muestra evaluada) | 257,5±38,8; 66 | 252,3±40,3; 66 | 0,26a |
| Colesterol total (media±DE; muestra evaluada) | 215,4±38,4; 110 | 209,3±40,2; 110 | 0,12a |
CAMCOG-R: prueba cognitiva de Cambridge revisada; CDR: Clinical Dementia Rating; CDR-SB: Clinical Dementia Rating «sum of boxes»; IMC: índice de masa corporal; MMSE: Mini-Mental State Examination; MNA: Mini Nutritional Assessment test; NPI-Q: cuestionario del inventario neuropsiquiátrico; RDRS-2: Rapid Disability Rating Scale-2.
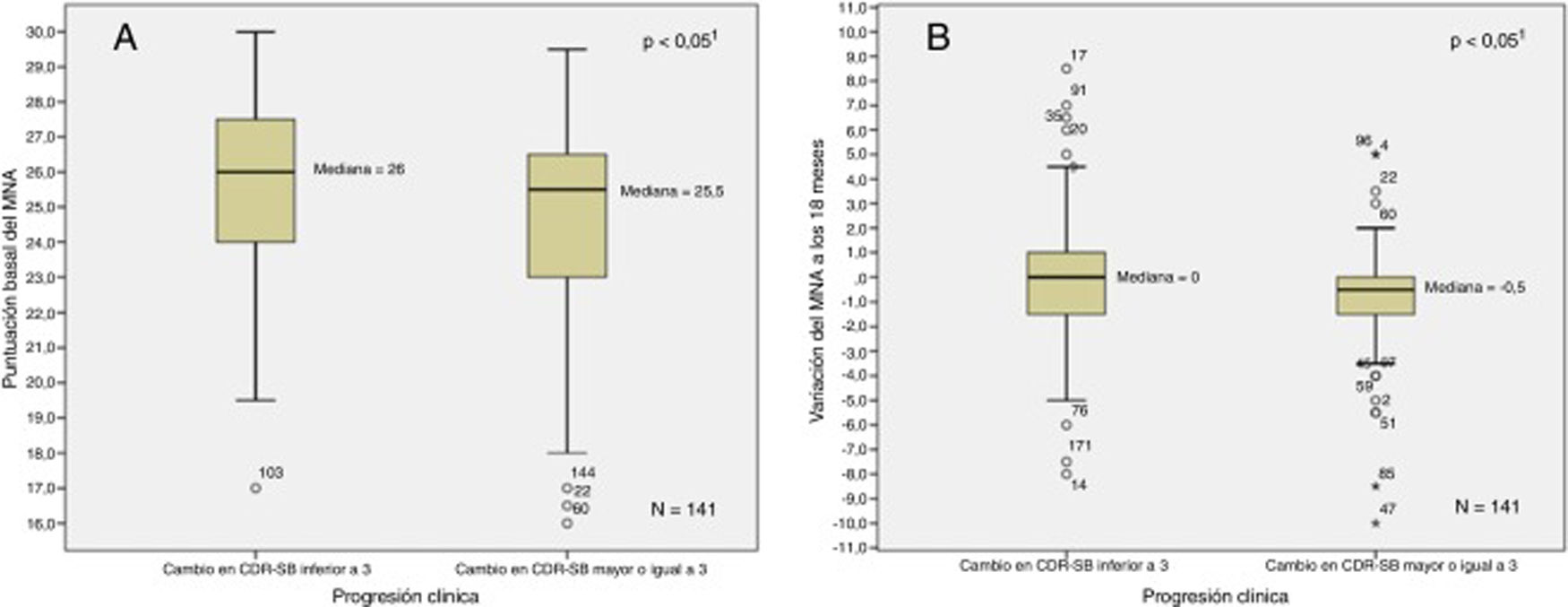
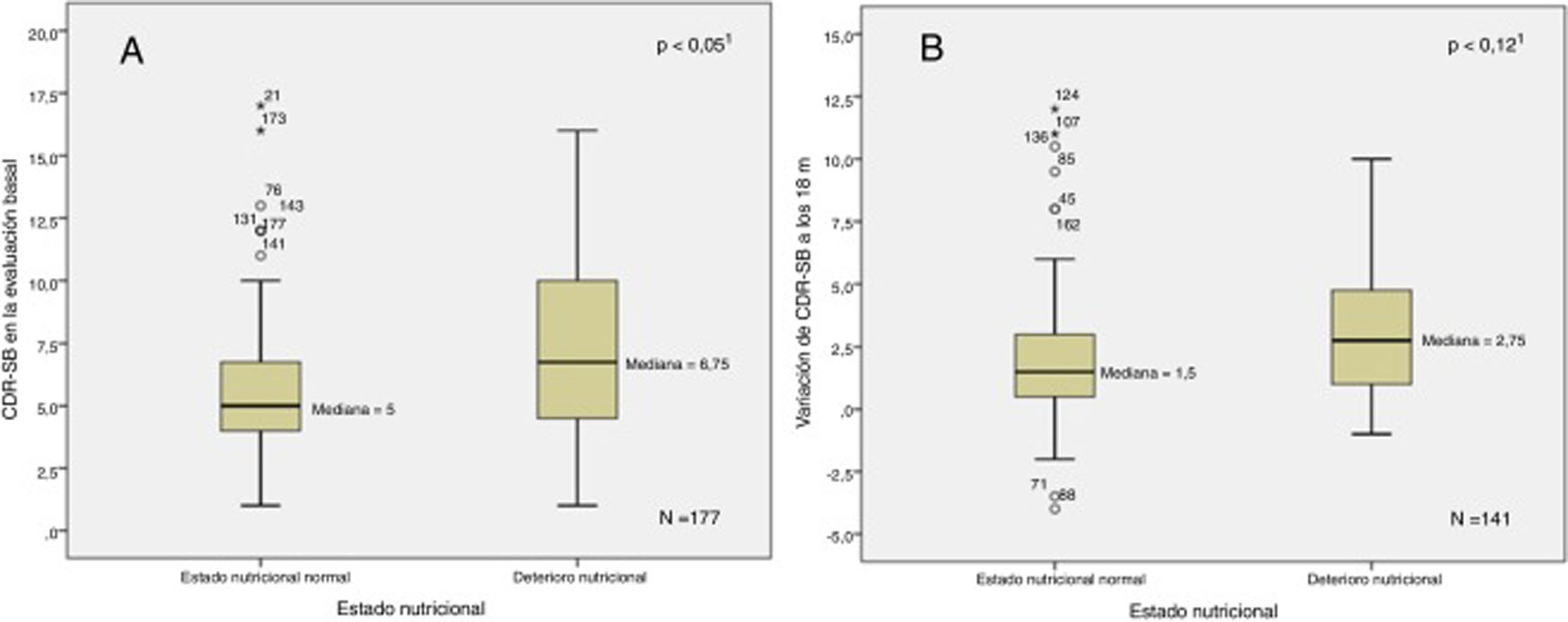
La figura 1 muestra la relación entre el MNA basal y su variación a los 18meses en función del criterio de progresión. La figura 2 muestra la relación entre el CDR-SB basal y su variación a los 18meses en función del estado nutricional. En el análisis bivariante se apreció una correlación positiva entre MNA y MMSE basales (Ͽ=0,15; p<0,05) y negativa entre MNA y NPI-Q gravedad (Ͽ=−0,35; p<0,001), NPI-Q estrés del cuidador (Ͽ=−0,34; p<0,001), RDRS-2 (Ͽ=−0,37; p<0,001) y CDR-SB basal (Ͽ=−0,17; p<0,05). Se apreciaron sendas correlaciones negativas entre la variación en el MNA a los 18meses y las variaciones en RDRS-2 (Ͽ=0,23; p<0,01) y CDR-SB (Ͽ=−0,18; p<0,05) durante el periodo de estudio.
La tabla 5 muestra las diferencias en las características demográficas y clínicas entre el 34,8% de los sujetos que mostraron un empeoramiento significativo entre las dos evaluaciones y el 65,2% que permanecieron estables según el criterio empleado. La proporción de sujetos con DN fue significativamente mayor entre los que empeoraron, que mostraron puntaciones de MNA e IMC significativamente inferiores. El 85,9% de la cohorte estaban en tratamiento con inhibidores de la acetilcolinesterasa, porcentaje similar entre los dos grupos. En esta cohorte con dos evaluaciones (n=141) se apreció una mayor proporción de sujetos con empeoramiento significativo entre los que tenían un DN respecto a estado nutricional normal en la evaluación basal (50% vs 28,7%; p<0,05). En el grupo EAd se apreciaron diferencias similares (53,6% vs 31,8%; p<0,05). En el grupo EAp se apreció la misma tendencia, pero sin alcanzar la significación (41,7% vs 22,9%; p=0,21).
Características demográficas y clínicas basales según evolución
| CDR-SB empeora <3(n=92) | CDR-SB empeora ≥3(n=49) | p | |
|---|---|---|---|
| Factores sociodemográficos | |||
| Edad (media±DE) | 77,6±6 | 79,2±6,5 | 0,19a |
| Sexo femenino (n; %) | 59; 64,1 | 36; 73,5 | 0,26b |
| Sin estudios (n; %) | 49; 53,3 | 24; 49 | 0,63b |
| Evaluación clínica | |||
| MMSE (media±DE) | 21,3±4,6 | 21,1±4 | 0,76a |
| CAMCOG-R (media±DE) | 66,2±15,2 | 61,8±13,3 | 0,09a |
| CAMCOG-R memoria (media±DE) | 11,2±4,7 | 9,8±4,9 | 0,09a |
| RDRS-2 (mediana [Q1-Q3] | 24 [21-30] | 25 [22-30] | 0,28c |
| NPI-Q gravedad (mediana [Q1-Q3]) | 5 [2-9] | 6 [3,5-10,5] | 0,20c |
| NPI-Q estrés cuidador (mediana [Q1-Q3]) | 7 [2-11,75] | 6 [4-13] | 0,40c |
| Zarit (media±DE) | 24,6±16,8 | 28,8±15,6 | 0,15a |
| CDR-SB basal (mediana [Q1-Q3] | 5 [3-6] | 5 [3,5-6,5] | 0,34c |
| Parámetros nutricionales | |||
| DN (MNA <24) (n; %) | 20; 21,7 | 20; 40,8 | <0,05b |
| MNA (mediana [Q1-Q3]) | 26,0 [24-27,5] | 25,5 [22,75-26,5] | <0,05c |
| IMC (media±DE) | 26,7±3,8 | 25,2±4,4 | <0,05a |
| Genotipo ApoE ɛ4+ (n; %; muestra evaluada) | 43; 49,4; 87 | 20; 41,7; 48 | 0,39b |
| Tratamiento con IACE (n; %) | 79; 85,9 | 42; 85,7 | 0,98b |
CAMCOG-R: prueba cognitiva de Cambridge revisada; CDR-SB: Clinical Dementia Rating «sum of boxes»; DN: deterioro nutricional (MNA<24); IACE: inhibidores de la acetilcolinesterasa; IMC: índice de masa corporal; MMSE: Mini-Mental State Examination; MNA: Mini Nutritional Assessment test; NPI-Q: cuestionario del inventario neuropsiquiátrico; RDRS-2: Rapid Disability Rating Scale-2.
Los análisis de factores de riesgo independientes de DN y empeoramiento a los 18meses se muestran en la tabla 6. Los modelos de regresión logística del análisis multivariante identificaron el sexo femenino y mayor afectación conductual como variables asociadas a DN. Una menor puntuación en CAMCOG-R y en la escala MNA fueron factores asociados con empeoramiento a los 18meses.
Análisis de factores asociados a desnutrición y empeoramiento a los 18 meses
| Variable dependiente: MNA basal<24 (DN)a(n=177) | Variable dependiente: CDR-SB≥3 a 18mesesb(n=141) | |||||||
|---|---|---|---|---|---|---|---|---|
| Variable independiente | OR crudas (IC 95%) | p | OR ajustadas (IC 95%) | p | OR crudas (IC 95%) | p | OR ajustadas (IC 95%) | p |
| Edad (>78,9) | 1,20 (0,62-2,32) | 0,59 | Excluida | 1,18 (0,59-2,36) | 0,64 | Excluida | ||
| Años escolaridad (<8) | 1,26 (0,65-2,45) | 0,49 | − | 1,07 (0,53-2,16) | 0,86 | − | ||
| Sin estudios formales | 1,37 (0,71-2,65) | 0,34 | − | 1,19 (0,59-2,38) | 0,63 | Excluida | ||
| Sexo femenino | 3,26 (1,35-7,84) | <0,01 | 4,17 (1,65-10,51) | <0,001 | 1,55 (0,72-3,33) | 0,26 | Excluida | |
| MMSE (<21) | 1,97 (0,99-3,90) | 0,051 | Excluida | 1,28 (0,64-2,57) | 0,48 | − | ||
| CAMCOG-R (<65) | 1,49 (0,76-2,93) | 0,24 | − | 2,24 (1,09-4,59) | <0,05 | 2,13 (1,03-4,43) | <0,05 | |
| CAMCOG-R memoria (<11) | 1,23 (0,62-2,43) | 0,55 | − | 1,58 (0,78-3,20) | 0,20 | − | ||
| NPI-Q gravedad (>5) | 4,95 (2,32-10,55) | <0,001 | 5,79 (2,64-12,66) | <0,001 | 1,59 (0,79-3,19) | 0,20 | − | |
| NPI-Q estrés (>7) | 4,11 (2,03-8,31) | <0,001 | Excluida | 1,10 (0,55-2,21) | 0,79 | − | ||
| Zarit (>24) | 1,54 (0,80-2,99) | 0,20 | − | 1,53 (0,76-3,07) | 0,23 | − | ||
| RDRS-2 (>24) | 4,28 (2,05-8,96) | <0,001 | Excluida | 1,19 (0,59-2,38) | 0,63 | − | ||
| CDR total (>1) | 2,70 (1,20-6,06) | <0,05 | − | 1,01 (0,38-2,73) | 0,98 | − | ||
| CDR-SOB (>5,0) | 2,00 (1,03-3,91) | <0,05 | − | 1,47 (0,73-2,95) | 0,28 | − | ||
| MNA (<25,5) | − | − | − | 1,22 (0,60-2,47) | 0,58 | − | ||
| IMC (<25,6) | − | − | − | 1,34 (0,67-2,69) | 0,41 | − | ||
| Genotipo ApoE ɛ4+c | 0,74 (0,37-1,48) | 0,40 | − | 0,73 (0,36-1,49) | 0,39 | − | ||
| DN (MNA<24) | − | − | − | 2,48 (1,17-5,28) | <0,05 | 2,36 (1,1-5,09) | <0,05 | |
CAMCOG-R: prueba cognitiva de Cambridge revisada; CDR: Clinical Dementia Rating; CDR-SB: Clinical Dementia Rating «sum of boxes»; DN: deterioro nutricional; IMC: índice de masa corporal; MMSE: Mini-Mental State Examination; MNA: Mini Nutritional Assessment test; NPI-Q: cuestionario del inventario neuropsiquiátrico; RDRS-2: Rapid Disability Rating Scale-2.
Nuestro trabajo refleja la elevada frecuencia de deficiencias nutricionales en la EA y confirma una influencia negativa de estas sobre su progresión. Se identifica una asociación, aunque no es posible llegar a ninguna conclusión sobre una relación causa-efecto. En la cohorte DEMDIAG la valoración nutricional se inició tras el diagnóstico de la EA, en fase prodrómica o de demencia. Entre los estudios que utilizan esta referencia temporal es destacable el EACE, que investigó en España el estadio evolutivo de más de 1.700 pacientes con demencia por EA tras el diagnóstico. El 52% de los pacientes mostraron una demencia leve con CDR1, la edad media fue de 78años y el 65% eran mujeres33. Este trabajo no incluyó pacientes en fase de deterioro cognitivo leve. El grupo de pacientes con demencia del estudio DEMDIAG mostró un estadio evolutivo similar, con una edad algo más avanzada y mayor representación de mujeres.
Teniendo en cuenta que la frecuencia de desnutrición franca en nuestro estudio fue muy baja, inferior al 3%, decidimos analizar conjuntamente la prevalencia de desnutrición y riesgo de desnutrición, bajo el concepto de DN, mostrando un valor del 28,2% en la población basal. Aunque esta cifra de prevalencia es objetivamente elevada, distintos estudios en población general de edad avanzada han mostrado cifras incluso superiores, lo que plantea la influencia de numerosos factores sobre el estado nutricional de la población anciana. En 2005, un estudio observacional español que evaluó mediante el MNA el estado nutricional de 22.007 sujetos residentes en la comunidad de más de 65años mostró una prevalencia de DN del 29,7% y una asociación entre esta situación y el sexo femenino, la edad avanzada y la residencia en el sur de España34. En otro extremo, un estudio holandés más reciente mostró cifras de DN mucho más elevadas en población anciana no institucionalizada, llegando a afectar al 75% de sujetos con una edad media de 80años35. Es probable que, al menos en parte, estas diferencias puedan explicarse, entre otros factores, por razones culturales y de modos de vida, así como por la influencia del grado de institucionalización de la población en estos rangos de edad. Con una visión más amplia, incluyendo numerosos escenarios clínicos y países, un metaanálisis en mayores de 60años mostró cifras de DN del 29,6% en la comunidad y del 65% en residencias de ancianos. Este mismo estudio mostró un 30% de DN en pacientes con demencia en la comunidad, muy en línea con nuestros resultados36. En población anciana con un síndrome demencial en cualquier estadio, el estudio NutriAlz evaluó el estado nutricional de 940 residentes en la comunidad, incluyendo sujetos con EA y otros tipos de demencia. La prevalencia de DN fue del 47,8%, siendo mayor en demencia por cuerpos de Lewy y estando asociada a una edad avanzada, mayor deterioro cognitivo y funcional y trastornos conductuales más graves15. La comparación directa de estas investigaciones con nuestro estudio resulta complicada al realizarse en ámbitos diversos, con criterios de selección más o menos restrictivos y con la inclusión o exclusión de población institucionalizada.
Puede resultar más oportuno analizar los resultados del estudio DEMDIAG en el contexto de investigaciones con mayor similitud metodológica. Un estudio retrospectivo holandés mostró una reducida prevalencia de DN de solo el 14% en EA, que se asoció con mayor deterioro cognitivo y, de forma más intensa, con peor estado funcional en pacientes recién diagnosticados14. El estudio prospectivo multicéntrico REAL.FR incluyó 579 pacientes diagnosticados de EA en Francia con un seguimiento de al menos 4años37. La prevalencia de DN, que se asoció con mayor afectación conductual, fue del 25,8% en la evaluación basal. En el primer año, estos pacientes con deficiencias nutricionales mostraron peor evolución cognitiva y funcional y, sorpresivamente, una mejor respuesta a anticolinesterásicos38,39. En el REAL.FR, el análisis de un subgrupo de 160 sujetos con EA muy leve y CDR0,5 identificó como factores independientes de riesgo de progresión al año un mayor deterioro cognitivo y un estado de riesgo de desnutrición40, similar resultado al grupo completo de nuestro trabajo. El Cache County Dementia Progression Study mostró también una clara asociación entre la desnutrición y un declive cognitivo y funcional más rápido, así como con mayor mortalidad7,9.
En el análisis de factores asociados a malnutrición y progresión de la enfermedad se incluyeron numerosas variables clínicas, demográficas, sociales y culturales. Como en otras investigaciones previas, los trastornos conductuales fueron más frecuentes en el grupo malnutrido15,38. Este hecho puede reflejar un factor biológico desconocido común para ambos o, con una visión más simple, que la deficiencia nutricional es una consecuencia de conductas «hiperactivas». Además, en nuestro caso la malnutrición se asoció de forma independiente con el sexo femenino, como en el extenso estudio comunitario de Cuervo et al.34. Culturalmente, entre el grupo de personas de edad avanzada en nuestro medio, las mujeres son habitualmente las responsables de cocinar y preparar los alimentos, lo que podría contribuir a este efecto cuando son ellas las que padecen la enfermedad. Sin embargo, con una lógica similar, los individuos que viven solos deberían sufrir un efecto parecido, pero no fue así. Tampoco se apreciaron tendencias en el caso del nivel cultural o ámbito de residencia urbano o rural. El IMC fue mayor en el grupo de EAp y apenas se modificó a los 18meses, aunque sí fue significativamente menor en los que empeoraron. Una evaluación más amplia del estado nutricional mediante el MNA fue mucho más sensible. El deterioro cognitivo no se relacionó con el estado nutricional, como sí ocurrió en otros estudios, pero sí con la progresión, como en el subgrupo de deterioro cognitivo leve del REAL.FR40, reflejando un mayor grado de neurodegeneración al inicio y un probable agotamiento posterior de la reserva cognitiva41.
El estudio epidemiológico DEMDIAG tiene algunas características metodológicas destacables. La primera es que el periodo de observación de los pacientes comenzó en el momento del diagnóstico de la EA. Esta referencia temporal es irrelevante desde el punto de vista biológico pero tiene un indudable interés práctico, pues representa el primer contacto con el paciente y marca el inicio de la toma de decisiones terapéuticas y de la información sobre el pronóstico de la enfermedad, aspecto generalmente demandado por pacientes y familiares. Otra característica esencial es que refleja la visión actual clínico-biológica de la EA, incluyendo tanto a pacientes en la fase de demencia como en la fase prodrómica. Como criterio de progresión se empleó el incremento en la CDR-SB, que muestra una mayor sensibilidad al cambio y que ha sido propuesta en los últimos años como variable de eficacia en ensayos clínicos o en estudios observacionales32. Por último, se analizó la frecuencia del alelo ApoEɛ4 en más del 90% de los sujetos incluidos, con una frecuencia del 49%, superior a las cifras medias de la población caucásica con EA42. Esta determinación, aunque no aportó ninguna información relevante en el análisis de subgrupos, refleja un adecuado proceso de selección de pacientes.
Entre las limitaciones de nuestro estudio, la principal fue un número más reducido de pacientes en la fase prodrómica que, probablemente, impidió que se alcanzara la potencia estadística suficiente en el análisis de las diferencias evolutivas entre sujetos con nutrición normal o deficitaria, si bien estas diferencias fueron evidentes y en línea con las apreciadas en la fase de demencia. El intervalo de 18meses desde el diagnóstico pudo resultar también reducido para demostrar diferencias entre subgrupos. Además, desde la evaluación basal hubo un 20% de pérdidas, con una mayor representación de mujeres de edad avanzada y con mayor deterioro cognitivo y global, lo cual pudo provocar algún sesgo en los resultados. Aunque se investigaron marcadores bioquímicos del estado nutricional, estos no aportaron ninguna información relevante. Una evaluación multimodal más amplia con estudios de bioimpedancia de tipo vectorial, empleados de forma habitual en unidades de nutrición clínica, hubiera sido un buen complemento a la evaluación proporcionada por el MNA, probablemente con mayor sensibilidad en la detección de malnutrición.
Como conclusión podemos destacar que la prevalencia de DN es elevada en los pacientes con EA en el momento del diagnóstico, fundamentalmente en las mujeres y en los pacientes con mayor afectación conductual. Además de la valoración cognitiva, un cribado nutricional, sencillo y rápido, puede permitir identificar a los pacientes con mayor riesgo de progresión clínica tras el diagnóstico y diseñar eventuales intervenciones terapéuticas.
FinanciaciónEl presente trabajo ha sido financiado por parte de la Gerencia de Salud de Castilla y León, expediente GRS 556/A/10. El patrocinador no participó en el diseño, recolección, análisis o interpretación de los datos, ni en la redacción de este artículo.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.
Los autores desean agradecer la colaboración en la selección de los pacientes a todos los miembros de las Secciones de Neurología del Complejo Hospitalario de Segovia y el Hospital Universitario Río Hortega de Valladolid.
Este trabajo fue presentado de forma parcial en sendas comunicaciones orales en la LXVReunión Anual de la SEN en Barcelona en 2013 y la LXVIReunión Anual de la SEN en Valencia en 2014.
Actualmente, Sección de Neurología, Hospital Nuestra de Sonsoles, Complejo Asistencial de ÿvila, ÿvila. España.