El manejo de la enfermedad de Parkinson en la mujer en edad fértil nos plantea como principal reto el manejo de la enfermedad y los fármacos durante el embarazo y lactancia. El aumento de la edad gestacional de la mujer hace más probable que la incidencia de embarazos pueda incrementarse.
ObjetivoDefinir las características clínicas y los factores que condicionan la vida de la mujer en edad fértil con enfermedad de Parkinson y definir una guía de actuación y manejo del embarazo en estas pacientes.
ResultadosEste documento de consenso se ha realizado mediante una búsqueda bibliográfica exhaustiva y discusión de los contenidos realizados por un grupo de expertos en trastornos del movimiento de la Sociedad Española de Neurología.
ConclusionesLa enfermedad de Parkinson afecta a todos los aspectos relacionados con la salud sexual y reproductiva de la mujer en edad fértil. Se debe planificar el embarazo en las mujeres con enfermedad de Parkinson para minimizar los riesgos teratogénicos sobre el feto. Se recomienda un abordaje multidisciplinar de estas pacientes para tener en cuenta todos los aspectos implicados.
The main challenge of Parkinson's disease in women of childbearing age is managing symptoms and drugs during pregnancy and breastfeeding. The increase in the age at which women are having children makes it likely that these pregnancies will become more common in future.
ObjectivesThis study aims to define the clinical characteristics of women of childbearing age with Parkinson's disease and the factors affecting their lives, and to establish a series of guidelines for managing pregnancy in these patients.
ResultsThis consensus document was developed through an exhaustive literature search and a discussion of the available evidence by a group of movement disorder experts from the Spanish Society of Neurology.
ConclusionsParkinson's disease affects all aspects of sexual and reproductive health in women of childbearing age. Pregnancy should be well planned to minimise teratogenic risk. A multidisciplinary approach should be adopted in the management of these patients in order to take all relevant considerations into account.
Las mujeres en edad fértil presentan una serie de características que definen no sólo su salud si no el curso de las enfermedades que padecen. La enfermedad en las mujeres en edad fértil está influenciada por la biología relacionada con el sexo, el género y otros determinantes sociales.
Los trastornos del movimiento son un grupo heterogéneo de enfermedades que pueden ocurrir desde edades tempranas hasta la senectud. Por lo tanto, su aparición en época fértil en la mujer es un hecho en muchas de ellas y debemos conocer y saber afrontar estas enfermedades en esta etapa de la vida.
Un grupo de expertos del Grupo de Estudio de Trastornos del Movimiento ha elaborado un documento de consenso con el objetivo de facilitar el manejo diagnóstico-terapéutico de los trastornos del movimiento en la mujer durante la edad fértil, y en especial durante el embarazo y lactancia, dado el riesgo que conlleva esta situación y la responsabilidad que genera.
Dicho documento se ha llevado a cabo mediante una revisión exhaustiva de la literatura a través de búsqueda bibliográfica en la que se emplearon las siguientes bases de datos: Brain, PubMed, Web of Science, PEDro, Scopus, CINHAL y ScienceDirect, así como el conocimiento derivado de la práctica clínica. Los artículos relevantes que describen cualquier tema relacionado con la enfermedad de Parkinson (EP) en el embarazo fueron identificados desde las bases de datos anteriores sin ningún tiempo, idioma o estudiar las limitaciones. A partir de esta revisión se han redactado unas recomendaciones consensuadas por todos los autores que pretenden orientar el manejo de los trastornos del movimiento durante el embarazo y la lactancia.
En esta primera parte se plantean las características de la mujer de edad fértil que padece EP. En esta revisión se hace especial hincapié en el manejo de la mujer con EP embarazada, así como el manejo racional y basado en las evidencias de los fármacos utilizados en la enfermedad.
Del 5% al 7% de los pacientes con EP en Occidente (10% al 14% en Japón) son diagnosticados a una edad inferior a los 55 años, siendo estos casos los denominados como EP de inicio precoz (YOPD)1. La incidencia del embarazo en la EP es baja y desconocida, ya que es más frecuente en personas mayores de 50 años. El aumento de la edad gestacional de la mujer hace más probable que la incidencia de embarazos pueda incrementarse. Además, la repercusión en la calidad de vida de las pacientes diagnosticadas con EP es mayor en aquellas pacientes de menos de 45 años, con impacto evidente a nivel familiar, personal y laboral2.
Salud sexual en mujeres con enfermedad de ParkinsonEn la mujer con EP el número de estudios sobre su salud sexual es muy limitado, en parte debido a factores sociales y culturales3. Se trata de un problema complejo, donde juegan un papel importante los síntomas motores y no motores de la enfermedad, los efectos secundarios de algunos fármacos, y la afectación cognitivo-conductual y emocional de la paciente.
Recogiendo los datos de los estudios publicados4, sabemos que en las mujeres con EP la disminución de la libido llega al 84% de los casos, y las dificultades para alcanzar el orgasmo pueden alcanzar el 75%. Algunos de los síntomas y signos que aparecen en la EP como la bradicinesia, la rigidez, la dificultad para girarse en la cama, la sialorrea, la sudoración excesiva, la seborrea y la hipomimia, a menudo hacen que las pacientes se sientan cohibidas. Las alteraciones del sueño, como el trastorno de la conducta del sueño REM, el movimiento periódico de las piernas y el síndrome de piernas inquietas, pueden obligar a la pareja a dormir en camas o habitaciones separadas. La depresión en la EP y el deterioro cognitivo y los delirios, en concreto relacionados con la celotipia, son otros factores que influyen en la salud sexual. En ocasiones es el miedo al rechazo lo que evita que la paciente se acerque sexualmente a su pareja, mientras que su cónyuge siente que está siendo ignorado. Además, en la EP aparece con más frecuencia la sequedad vaginal que resulta en dispareunia y vaginismo. Todos estos factores afectan a la calidad de la vida sexual5. Un porcentaje de pacientes mujeres en tratamiento con agonistas dopaminérgicos puede presentar hipersexualidad (0,5%), es importante estar alerta para hacer un tratamiento de retirada precoz de medicación en caso de que aparezca este problema.
Respecto a los anticonceptivos en la mujer con EP, hay pocos estudios que evalúan el potencial de interacción fármaco-fármaco entre estos y los antiparkinsonianos. En estudios de bioequivalencia con rotigotina y anticonceptivos orales, no se han demostrado interacciones relevantes6. En cualquier caso, hay que recordar que en general algunos fármacos pueden inducir las enzimas hepáticas, como las del citocromo P-450, que aceleran la transformación de los anticonceptivos orales en metabolitos con menor actividad biológica, debiendo plantearse asociar otros métodos de doble barrera.
Podría asociarse el uso de anticonceptivos orales a largo plazo y el uso actual de hormonas posmenopáusicas con el riesgo de padecer EP, pero es necesario realizar más estudios para confirmar estos datos7.
El tratamiento farmacológico y no farmacológico, orientando cada caso en particular, y de modo multidisciplinar, es la clave del éxito. Es interesante seguir un plan de atención individual para ayudar a la paciente y su pareja con soluciones a preocupaciones específicas, que pueden ir cambiando con el tiempo con la progresión de la enfermedad, como pensamientos de pérdida, culpabilidad, cambios en la imagen corporal, o cambios en los roles de la relación.
Salud reproductiva en mujeres con enfermedad de ParkinsonLa salud reproductiva es la condición de bienestar físico, mental y social vinculada al sistema reproductivo.
Características de los factores reproductivos en la EP. Los estudios sobre los hitos reproductivos en la EP son escasos y no concluyentes3. La edad de la menarquia parece ser más tardía en las mujeres con EP que en controles, con más síntomas premenstruales y dismenorrea. La duración de la vida reproductiva, edad y modo de inicio de la menopausia es similar en mujeres con EP y mujeres control, pero las mujeres con EP presentan más sofocos. También, las mujeres con EP tienden a tener menos hijos y abortos, y usan menos los anticonceptivos orales (ACO).
Factores reproductivos y riesgo de padecer EP. Actualmente no existe consenso sobre cómo los factores reproductivos femeninos afectan al riesgo de padecer EP. Un estudio no mostró asociación entre la EP y la edad de menarquia y menopausia, la duración de la vida fértil, la duración acumulada de los embarazos, el reemplazo hormonal y la menopausia quirúrgica, pero sí hubo asociación positiva entre el uso de ACO y la EP8. Sin embargo, en un metaanálisis de 11 estudios observacionales, ni la edad de menarquia o la menopausia, la duración de la vida fértil, la paridad ni el uso de ACO se asociaron al riesgo de padecer EP9.
Factores reproductivos y edad de inicio de la EP. Determinados factores reproductivos -número de embarazos, duración de la vida fértil, duración acumulada de embarazos, número de hijos y edad de la menopausia-, se han asociado con un retraso en el inicio de la enfermedad10,11, lo cual explicaría la menor incidencia de EP en mujeres y el papel protector de los estrógenos.
Implicaciones del embarazo sobre los síntomas y evolución de la enfermedad de ParkinsonSon pocos los datos de EP y embarazo publicados hasta la fecha. La incidencia de embarazo en la EP también es desconocida.
En 1987 se publicó la primera serie12 que incluía 24 embarazos y hasta 1998 no se publicó la siguiente13 de 35 embarazos. En la mayoría de los casos la EP empeoraba durante el embarazo, 65% en la serie de Golbe y 45% en la de Hagell y alguno de estos casos no vuelven a la situación previa después del parto. Casi un cuarto de estas pacientes no tomaba ninguna medicación durante el embarazo.
Una revisión posterior de casos sueltos descritos en la literatura hasta el 20163 incluye 74 embarazos. En el 52% la enfermedad no empeora y en algunos casos mejora. En esto casos, el 83% mantenían su tratamiento antiparkinsoniano y de estos el 64% no mostraba cambios en sus síntomas o incluso mejoraban y hasta el 33% de las que suspendieron el tratamiento se producía también una mejoría. Estos datos, sin embargo, son heterogéneos, cada artículo mide el estado de la enfermedad de diferentes maneras y las pacientes están en estadios distintos de la enfermedad, momentos de la gestación, edades diferentes y con polimedicados.
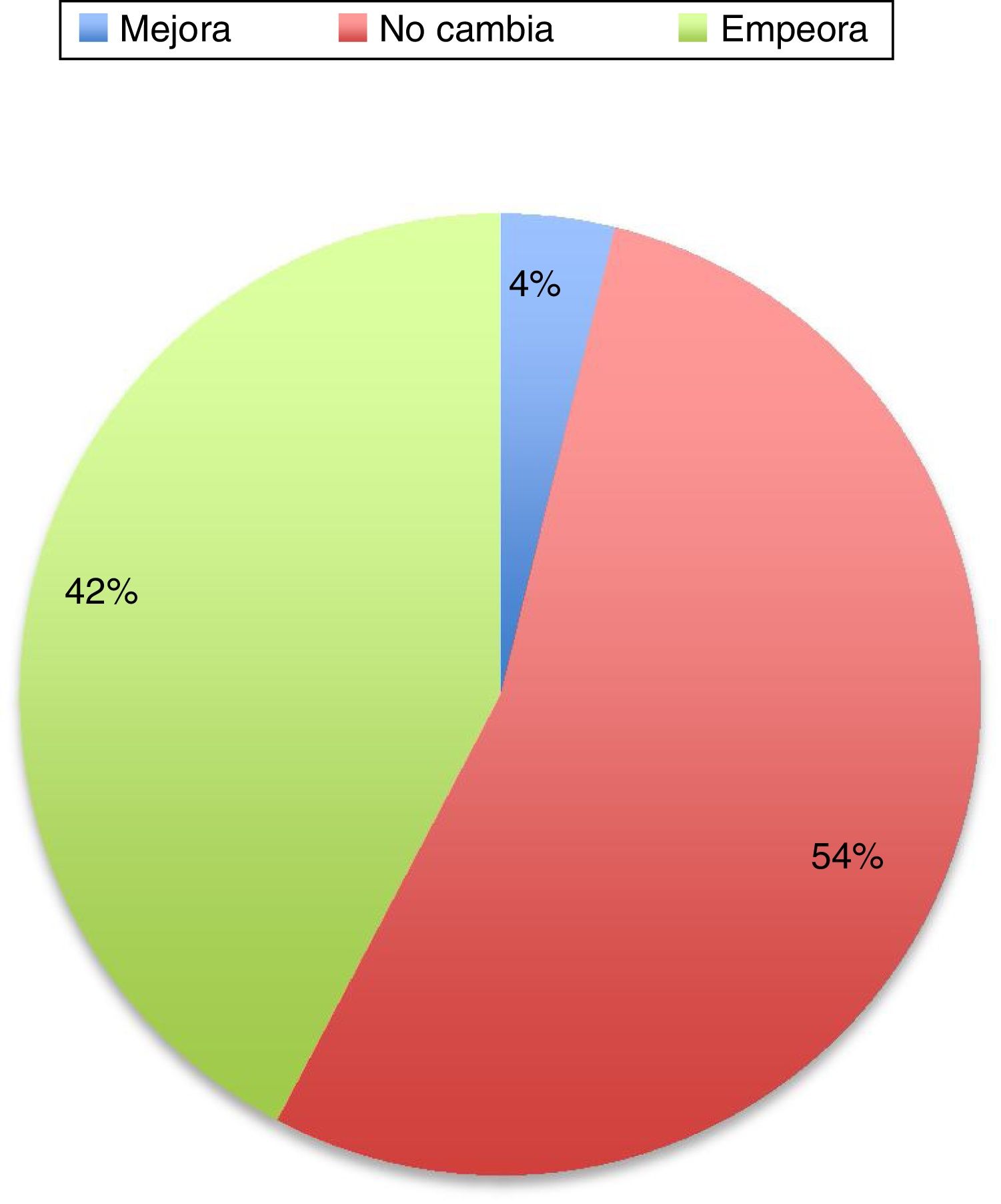
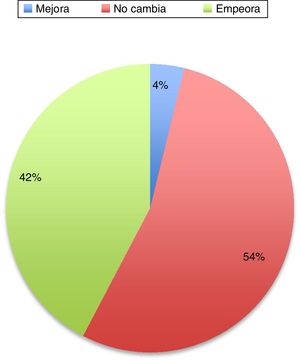
En el 36% de los casos de esta serie, la enfermedad empeora. La causa del empeoramiento, a pesar de seguir con su medicación no está determinado. Podrían ser los cambios fisiológicos, como el aumento de volumen plasmático, volumen de distribución y estado metabólico, que podría resultar en que las dosis fueran subterapéuticas. Cambios en la dieta y en la absorción intestinal también podrían influir. Otro factor podría ser el stress físico y psicológico que conlleva el embarazo. El papel de los estrógenos es complejo de explicar. Los estrógenos parecen tener un papel neuroprotector en las neuronas dopaminérgicas. Durante el embarazo el estriol es el estrógeno dominante, a diferencia del estradiol que es el que predomina durante la edad reproductiva de la mujer, siendo este el que tiene mayor afinidad por los receptores de estrógenos y el que pueda tener un papel neuroprotector3. En el resto de los pacientes 12% la situación de los pacientes no cambia. Hay series más recientes que también han revisado el tema y muestran datos muy similares (fig. 1).
Cambios en el estado motor de la enfermedad de Parkinson durante el transcurso del embarazo29.
En general, sí parece evidente en la literatura que la evolución de la enfermedad es mejor en las mujeres tratadas durante el embarazo que en aquellas que no lo son. La adecuada función motora es fundamental sobre todo en la etapa previa al parto y en el postparto.
Posibles efectos de la enfermedad de Parkinson sobre el embarazoEn una mujer con EP es de suponer que muchos de los síntomas del embarazo se vean exacerbados en estas circunstancias, especialmente aquellos que puedan estar presentes con anterioridad en el contexto de la semiología parkinsoniana. Así, síntomas no motores como la ansiedad o la depresión, la sialorrea, las alteraciones del ritmo del sueño o los problemas del tránsito intestinal, como vómitos o estreñimiento, podrían afectar de forma más notoria a este colectivo, puesto que se trata de síntomas presentes tanto en el embarazo como en la EP. De la misma forma, la inestabilidad que puede estar presente en el contexto del parkinsonismo puede suponer un mayor problema en las gestantes que, de por sí, presentan más problemas de movilidad por el aumento de peso y al cambio del centro de gravedad.
Según la evidencia actual, más allá de las complicaciones durante el embarazo, la propia EP no parece condicionar un impacto en la fertilidad, la concepción o el proceso del parto, habiéndose descrito una menor tasa de cesáreas que en el resto de la población general14.
Tampoco se ha descrito una mayor incidencia de abortos ni malformaciones fetales en las pacientes con EP de forma franca. De hecho, en la literatura únicamente se hace referencia a tres casos de malformaciones (osteomalacia, defecto septal ventricular y hernia inguinal) en una seria de 75 recién nacidos a término3, siendo los tres casos en madres que estaban recibiendo tratamiento antiparkinsoniano.
Podemos por tanto concluir que la EP podría producir un incremento de las quejas habituales durante la gestación, pero sin condicionar un incremento de complicaciones relevantes durante la misma.
Uso adecuado de fármacos antiparkinsonianos en el embarazoExisten pocos estudios que describan los efectos de los fármacos dopaminérgicos sobre el embarazo o los efectos teratogénicos sobre el feto, la literatura se limita a la publicación de casos aislados o series cortas. Además, las muestras son heterogéneas en cuanto a edad, tipo de fármacos y, sobre todo, tiempo de exposición a los fármacos y asociaciones de los mismos, lo que dificulta la obtención de conclusiones. En cuanto al tiempo de exposición, es frecuente la reducción de dosis o la supresión de los fármacos al conocer el embarazo con el consiguiente deterioro motor, frecuentemente ello obliga a la reintroducción del tratamiento (tabla 1).
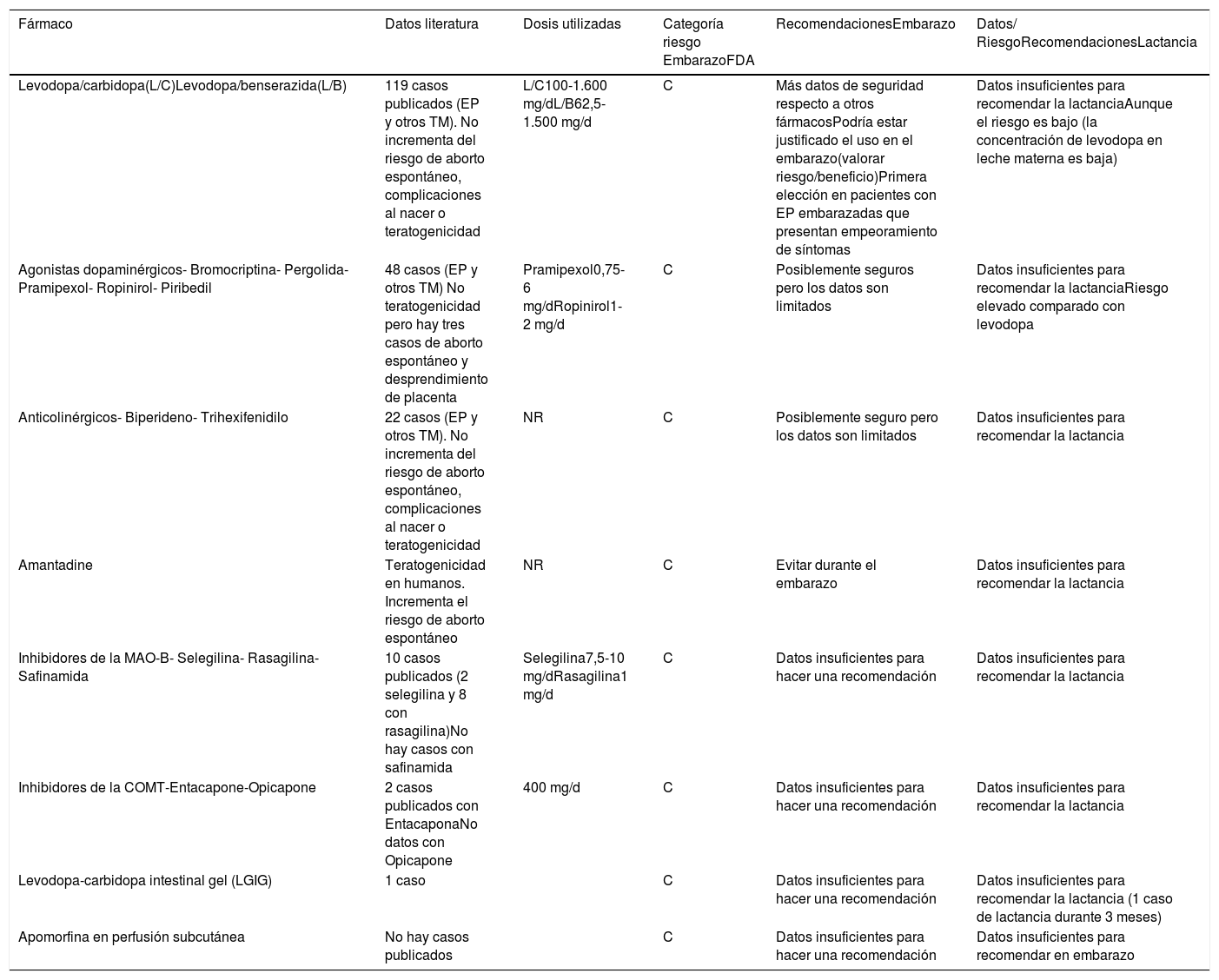
Resumen de recomendaciones de los principales fármacos utilizados en trastornos del movimiento en el embarazo y lactancia3,12,14,30-32
| Fármaco | Datos literatura | Dosis utilizadas | Categoría riesgo EmbarazoFDA | RecomendacionesEmbarazo | Datos/ RiesgoRecomendacionesLactancia |
|---|---|---|---|---|---|
| Levodopa/carbidopa(L/C)Levodopa/benserazida(L/B) | 119 casos publicados (EP y otros TM). No incrementa del riesgo de aborto espontáneo, complicaciones al nacer o teratogenicidad | L/C100-1.600 mg/dL/B62,5-1.500 mg/d | C | Más datos de seguridad respecto a otros fármacosPodría estar justificado el uso en el embarazo(valorar riesgo/beneficio)Primera elección en pacientes con EP embarazadas que presentan empeoramiento de síntomas | Datos insuficientes para recomendar la lactanciaAunque el riesgo es bajo (la concentración de levodopa en leche materna es baja) |
| Agonistas dopaminérgicos- Bromocriptina- Pergolida- Pramipexol- Ropinirol- Piribedil | 48 casos (EP y otros TM) No teratogenicidad pero hay tres casos de aborto espontáneo y desprendimiento de placenta | Pramipexol0,75-6 mg/dRopinirol1-2 mg/d | C | Posiblemente seguros pero los datos son limitados | Datos insuficientes para recomendar la lactanciaRiesgo elevado comparado con levodopa |
| Anticolinérgicos- Biperideno- Trihexifenidilo | 22 casos (EP y otros TM). No incrementa del riesgo de aborto espontáneo, complicaciones al nacer o teratogenicidad | NR | C | Posiblemente seguro pero los datos son limitados | Datos insuficientes para recomendar la lactancia |
| Amantadine | Teratogenicidad en humanos. Incrementa el riesgo de aborto espontáneo | NR | C | Evitar durante el embarazo | Datos insuficientes para recomendar la lactancia |
| Inhibidores de la MAO-B- Selegilina- Rasagilina- Safinamida | 10 casos publicados (2 selegilina y 8 con rasagilina)No hay casos con safinamida | Selegilina7,5-10 mg/dRasagilina1 mg/d | C | Datos insuficientes para hacer una recomendación | Datos insuficientes para recomendar la lactancia |
| Inhibidores de la COMT-Entacapone-Opicapone | 2 casos publicados con EntacaponaNo datos con Opicapone | 400 mg/d | C | Datos insuficientes para hacer una recomendación | Datos insuficientes para recomendar la lactancia |
| Levodopa-carbidopa intestinal gel (LGIG) | 1 caso | C | Datos insuficientes para hacer una recomendación | Datos insuficientes para recomendar la lactancia (1 caso de lactancia durante 3 meses) | |
| Apomorfina en perfusión subcutánea | No hay casos publicados | C | Datos insuficientes para hacer una recomendación | Datos insuficientes para recomendar en embarazo |
C: Estudios de reproducción en humanos ha demostrado efectos adversos en el feto. No existen estudios controlados en embarazadas. Su utilización debe realizarse valorando riesgo/beneficio.
Se destaca como el fármaco más usado y el más seguro. En una revisión realizada en el 2017 se describen 114 mujeres tratadas con levodopa, 46 de ellas con EP con dosis de 100 a 2.500 mg, mantenida desde varias semanas hasta todo el embarazo3. Entre ellas, sólo se describen ocho complicaciones menores como sangrado durante el primer trimestre, crisis epiléptica tras el nacimiento, preeclampsia, osteomalacia, defectos septales ventrales, desprendimiento de placenta e hipotonía transitoria. En la mayoría de los casos la levodopa se asociaba a otros fármacos dopaminérgicos. En 2018 se publicó una serie de 14 pacientes en la que cinco fueron tratadas con levodopa, un recién nacido sufrió un distress respiratorio fetal como única complicación descrita14. Todos los recién nacidos tuvieron un desarrollo posterior completamente normal. La incidencia de aborto espontáneo y preeclampsia no fue mayor que la esperada en la población general14.
Agonistas dopaminérgicosExiste poca evidencia de la seguridad de este grupo de fármacos en la EP. Su uso está muy extendido en el tratamiento de la hiperprolactinemia donde no se han descrito complicaciones durante el embarazo ni riesgo fetal. También disponemos de la información del registro de embarazos alemán, la mayoría de las pacientes tratadas por síndrome de piernas inquietas (SPI), describen 21 embarazos que ocurrieron sin complicaciones5. No obstante, es difícil extrapolar estos datos, ya que las dosis utilizadas en ambos grupos son bajas y el tratamiento se interrumpe al conocer el embarazo en la totalidad de mujeres con hiperprolactinemia y en un gran número de las pacientes con SPI.
Sólo se han publicado una treintena de pacientes con EP tratadas con distintos agonistas dopaminérgicos y sólo se ha descrito un desprendimiento de placenta con cabergolina, una crisis epiléptica en un recién nacido con bromocriptina y un aborto espontáneo, un síndrome de Down y un fallecimiento por fallo hepático grave en un embarazo gemelar en pacientes tratadas con pramipexole3,14. En ningún caso se estableció una clara relación causal.
IMAO-B e ICOMTAún son más limitados los datos que tenemos sobre el resto de los fármacos dopaminérgicos. Dos pacientes han sido publicados con selegilina, en un caso se describió un defecto ventral septal, aunque también estaba en tratamiento con levodopa y entacapone3. En la serie turca, siete pacientes tomaban rasagilina, en uno de los casos el recién nacido falleció por un fallo hepático grave, seis pacientes mantuvieron la rasagilina durante todo el periodo de organogénesis y no hubo malformaciones fetales. La rasagilina se metaboliza vía hepática a través del sistema del citocromo 450 pero no existen casos descritos de fallo hepático14. No se presentan datos sobre el uso de safinamida en mujeres embarazadas.
Se ha reportado un caso con entacapone sin complicaciones a pesar de existir estudios animales que describen teratogénesis15. No hay experiencia ni datos sobre el uso de opicapona en mujeres embarazadas. Los estudios en animales son insuficientes en términos de toxicidad para la reproducción. En ratas, opicapona no afectó a la fertilidad de machos y hembras o al desarrollo prenatal con niveles de exposición 22 veces la exposición terapéutica en humanos. En conejas preñadas, la opicapona no fue tan bien tolerada, dando lugar a unos niveles de exposición sistémica máxima alrededor o por debajo del rango terapéutico. Aunque el desarrollo embrio-fetal no se vio negativamente afectado en los conejos, el estudio no se consideró predictivo para valorar el riesgo.
AmantadinaSe ha publicado su posible embriotoxicidad y teratogenicidad en estudios animales. En humanos se han publicado dos recién nacidos con malformaciones cardíacas congénitas tras ser expuestos a amantadina al menos las semanas de organogénesis16. Por otra parte, también se han publicado varios casos de embarazos llevados a término con recién nacidos sanos14. Con estos datos los autores recomiendan evitar amantadina durante el embarazo.
AnticolinérgicosSe han descrito defectos menores en pacientes tratadas con anticolinérgicos por otros problemas, en las ocho pacientes descritas con EP no ocurrieron complicaciones y los recién nacidos se desarrollaron con normalidad14.
En conclusión, los datos disponibles son muy limitados, aunque permiten orientar sobre el uso de estos fármacos. En primer lugar, está claro que se debe tratar la EP durante el embarazo. En cuanto a la elección del fármaco, la mayor experiencia se tiene con levodopa, siendo además el fármaco más seguro y por ello el más recomendado. Los agonistas dopaminérgicos también parecen seguros y no se han descrito malformaciones fetales. Por el contrario, la experiencia con IMAOs, ICOMT y anticolinérgicos es menor e insuficiente para establecer recomendaciones. Por último, los datos publicados recomiendan evitar el uso de amantadina durante el embarazo.
Uso adecuado de otros fármacos para el manejo de la EP en el embarazoLos antidepresivos tipo SRIs y SNRIs, no parecen aumentar el riesgo de aborto ni ser teratógenos, pero sí se asocian con bajo peso y con un pequeño aumento del riesgo de sufrir una mala adaptación al nacimiento. También se relacionan con un ligero aumento de la aparición de hipertensión pulmonar persistente y de anomalías cardíacas en el recién nacido. Los antidepresivos tricíclicos no parecen asociarse a un mayor número de anomalías congénitas o complicaciones en el embarazo, pero sí con una alteración en la adaptación del recién nacido en los primeros días. El efecto neurológico y psiquiátrico a largo plazo se desconoce, ya que la mayoría de los estudios se han realizado en los primeros años de vida. Deben evitarse las benzodiazepinas durante el embarazo, porque se asocian durante el primer trimestre a labio leporino y defectos del paladar y en el último trimestre a flacidez, hipo o hipertonía, hipotermia, dificultad respiratoria y síndrome de abstinencia en el recién nacido. Se recomienda en su lugar utilizar terapias no farmacológicas como la cognitivo-conductual17,18.
El tratamiento del estreñimiento incluye, igual que en la población general, suplementos de fibra, ingesta abundante de líquidos y laxantes osmóticos como macrogol (polietilenglicol) y lactulosa. El macrogol (categoría C) tiene una mínima absorción sistémica, por lo que es improbable que pueda producir malformaciones fetales. La lactulosa (categoría B) podría también utilizarse durante el embarazo, si fuese necesario19.
Terapias de segunda línea de la enfermedad de Parkinson en el embarazoLas terapias de segunda línea (TSL) se indican sobre todo en fase avanzada de la EP. En este sentido, y teniendo en cuenta la baja incidencia de embarazos en la EP en general3, son todavía más anecdóticos los casos cuya gestación coincide en el tiempo con tales terapias, especialmente en lo que se refiere a los tratamientos de perfusión, pues suelen indicarse en pacientes más evolucionados y mayores. Tener una EP avanzada (EPA) implica una condición todavía más desfavorable para el autocuidado de la mujer durante los tres trimestres, para el trabajo de parto y el cuidado posterior del recién nacido.
En mujeres con una EPA en tratamiento con una TSL que nos expresan en consulta el deseo de tener un hijo se debe informar de manera individualizada de los riesgos, debiéndose valorar la existencia de un adecuado soporte sociofamiliar y/o del cuidador. Sea cual sea la TSL, en una mujer con EP embarazada, el tratamiento deberá optimizarse para reducir las complicaciones motoras en cada etapa, y el embarazo deberá considerarse como «de riesgo», siendo necesario por ello un seguimiento estrecho por Neurología y Ginecología3.
Estimulación cerebral profunda y lesiones ablativasEstimulación cerebral profunda (DBS). La DBS es una terapia eficaz en pacientes con EP avanzada. Los potenciales beneficios en pacientes embarazadas es la reducción de la medicación anti-parkinsoniana y la mejora en el estado de bienestar y calidad de vida de las pacientes con esta terapia.
Las pocas series publicadas, principalmente en pacientes con EP9 o distonia8, muestran que la mayoría de los embarazos fueron llevados a término sin complicaciones para el feto, se realizaron pocas cesáreas y en algunas pacientes se redujeron drásticamente los fármacos, muchos de ellos con evidencia cierta de teratogenicidad (nivel C). Algunos autores aventuran a definir la DBS como una terapia ideal en mujeres jóvenes, ya que en caso de embarazo permitiría un manejo de la enfermedad sin uso de estos medicamentos. Además, se debe tener en cuenta que síntomas como la hipotensión ortostática se puede agravar durante el embarazo en pacientes con parkinsonismo20. La disminución o eliminación de los fármacos anti-parkinsonianos gracias a la cirugía permitiría mejorar este síntoma.
La colocación del generador de impulsos en disposición abdominal o subclavicular tiene consecuencias en estas pacientes. Muchas de las pacientes con colocación en pared abdominal describieron molestias y sensación de «tensión» en la piel de dicha región, por lo que en principio la colocación en pared torácica sería más adecuada. No obstante, hay que tener en cuenta que esta otra disposición puede acarrear molestias y dificultades durante la lactancia. A las pacientes sometidas a cesárea, se les apaga el neuroestimulador antes de la intervención y se enciende inmediatamente después del parto, para evitar interferencias con la monitorización tanto materna como fetal8.
Lesiones neuroablativas. Gamma-knife y high intensity focused ultrasound (HIFU). Los potenciales beneficios en mujeres embarazadas serían los mismos que en el caso de la DBS: disminución o eliminación de fármacos durante el embarazo. Sin embargo, no tendrían los grandes beneficios de ajustes de parámetros de estimulación que sí aporta DBS. Actualmente no existen casos publicados de lesiones ablativas de pacientes con distonia o EP en mujeres embarazadas.
Perfusión continua de levodopa intestinal y de apomorfina subcutáneaPerfusión continua de levodopa intestinal (PCLI). La levodopa es el fármaco más utilizado en pacientes con EP embarazadas, aunque la evidencia sobre su seguridad es débil, pues atraviesa la barrera placentaria3,10. Hemos encontrado sólo un caso publicado de una paciente con EPA con PCLI desde hacía un año, que quedó embarazada con una dosis de levodopa de 1.100 mg/d y fue seguida como embarazo de riesgo11. Las discinesias empeoraron durante el embarazo, posiblemente por el efecto ICOMT del estado estrogénico o por otras causas farmacocinéticas, y hubo que reducir el ritmo de perfusión3,11. Durante el parto fueron necesarios también ajustes para mejorar el trabajo de parto, al alternarse periodos discinéticos con «off» graves. Fue en «on» con discinesias cuando se facilitó un parto vaginal y sin problemas para el recién nacido, aunque en los meses siguientes se documentó un retraso en el crecimiento. La paciente no tuvo complicaciones relacionadas con los dispositivos gastrointestinales ni con el estoma11. Ante una complicación relacionada con la PCLI durante el embarazo se debe considerar que los procedimientos endoscópicos están asociados a un riesgo potencial para el feto21.
Perfusión continua de apomorfina subcutáneao (PCAS). No hemos encontrado ningún caso publicado en el que coincida un embarazo con un tratamiento con PCAS para la EPA. Como previamente se ha referido, siempre habrá que individualizar y priorizar el control de las complicaciones motoras, no obstante, la evidencia acumulada con respecto al uso de agonistas dopaminérgicos durante el embarazo es todavía menor que con la levodopa3.
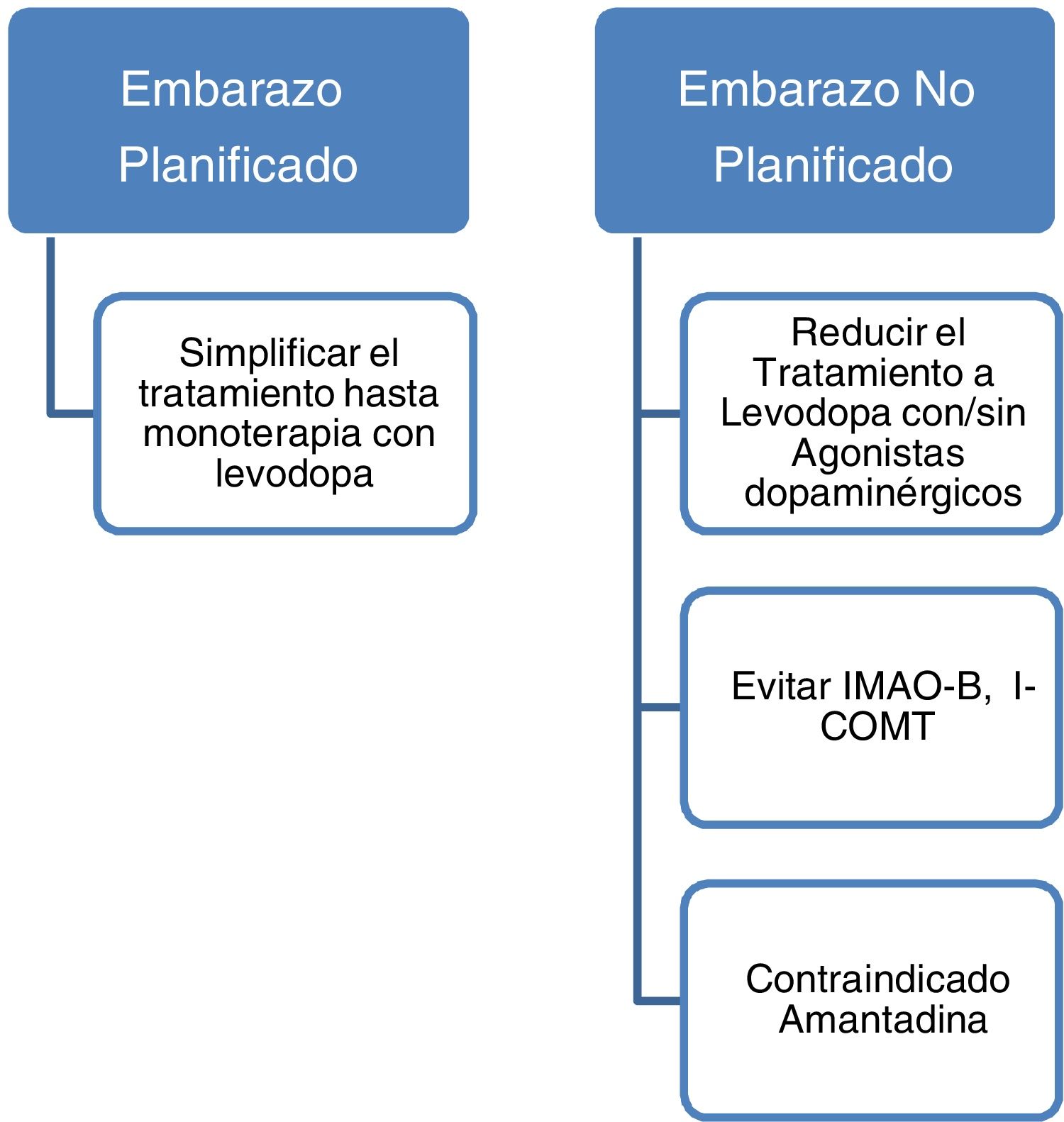
Medidas a adoptar y organización del control neurológico durante un embarazo planificadoAproximadamente el 50% de las mujeres embarazas con EP pueden empeorar de sus síntomas motores durante el embarazo. Las causas por las que se describe este empeoramiento podrían deberse a diversos factores como el estrés social y físico que conlleva el embarazo, la propia progresión de la enfermedad, la presencia de cambios fisiológicos durante la gestación y el efecto de los estrógenos22. El empeoramiento de la sintomatología motora es menor en aquellas mujeres que mantienen y ajustan la medicación dopaminérgica durante el embarazo, por lo que se recomienda el mantenimiento de la misma durante todo el periodo de gestación3. Es necesario un seguimiento estrecho de las pacientes durante esta etapa para ajustes precisos de la medicación dopaminérgica. No existen guías actualmente que marquen la periodicidad de las revisiones durante el embarazo y deberá hacerse de forma individual y ajustada a las necesidades de cada paciente.
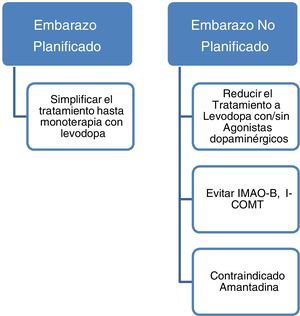
Los datos actuales apoyan el empleo de levodopa como primera opción de tratamiento en pacientes con EP embarazadas que presenten empeoramiento de su sintomatología motora3,23. En caso de embarazo deben evitarse fármacos como la amantadina por ser teratogénico y con mayor riesgo de aborto. En caso de planificar embarazo la amantadina debe interrumpirse previamente o en cuanto se tenga conocimiento del mismo. También deben evitarse por escasa evidencia los inhibidores de la monoaminooxidasa B (IMAO-B) y los inhibidores de la catecol-O-metiltransferasa (ICOMT). Asimismo, los datos actualmente disponibles son insuficientes para recomendar de forma rutinaria el empleo de agonistas dopaminérgicos o anticolinérgicos durante el embarazo a pesar de no haberse descrito efectos teratogénicos3,14. Con todo ello, aunque no existen guías al respecto y dada la evidencia hasta la fecha, podría recomendarse que aquellas mujeres con EP que planeen quedarse embarazadas sería aconsejable dejarlas en monoterapia con levodopa realizándose ajustes en la dosis en función de la evolución. El empleo de otros fármacos dopaminérgicos como los agonistas dopaminérgicos o los anticolinérgicos deberá individualizarse en cada caso.
La EP no incrementa el riesgo de complicaciones durante el parto, y por tanto las mujeres con EP embarazadas que vayan a dar a luz, no tienen por qué programarse una cesárea únicamente por el hecho de tener una EP, pueden dar a luz por vía vaginal. De igual manera, tampoco existe un incremento en el porcentaje de abortos espontáneos en pacientes con EP3 (fig. 2).
Puerperio y lactanciaEl puerperio es el periodo que dura la recuperación completa del aparato reproductor después del parto. Durante el puerperio, algunos aspectos comunes en pacientes con EP en general pueden agravarse. El estreñimiento puede empeorar y aumentar el riesgo de problemas urinarios/hemorroides. Una dieta rica en fibras e ingesta abundante de líquidos parece recomendable. Además, la depresión puede aparecer o acrecentarse en este periodo. Existen casos descritos de debut de la EP durante el puerperio, algunos erróneamente diagnosticados como psicógenos o depresión posparto inicialmente, por lo que parece importante la valoración correcta de los síntomas motores como temblor o lentitud en el posparto, con o sin depresión24, así como un control estrecho de los aspectos psicoafectivos.
La lactancia materna (LM) es el alimento universal indicado hasta los seis meses, y acompañado de otros alimentos hasta los dos años de edad25. La evidencia actual para establecer cómo afecta la EP en la LM o si esta es segura cuando la madre recibe medicación antiparkinsoniana es insuficiente3.
La levodopa, la amantadina, la entacapona y la tolcapona se excretan en la leche y los posibles efectos en el lactante se desconocen. Se recomienda evitar la LM si se toman estos fármacos. No hay datos sobre la excreción en la leche o su efecto en el lactante para la opicapona. Los agonistas dopaminérgicos y la levodopa pueden inhibir la liberación de prolactina y por tanto la LM. Se desconoce el grado en que se excretan por la leche, por lo que la LM no está recomendada si son administrados. Tampoco se conoce el grado de excreción de los IMAO en leche y su efecto en el lactante, es por eso que se desaconseja la LM también con estos fármacos. Se han descrito tres casos de lactancia en mujeres en tratamiento con bromocriptina, levodopa oral y gastroduodenal. En uno de los casos además se determinó que la dosis ingerida por el infante era muy baja24. La domperidona se excreta en pequeñas concentraciones y se desconoce su efecto en el lactante, por eso se recomienda tener precaución al prescribirla.
Hay un caso descrito con tratamiento mediante PCLI durante la lactancia, el cual se mantuvo durante tres meses y aunque el lactante tuvo un retraso de crecimiento no lo hubo en la adquisición de hitos del desarrollo5.
En resumen, se necesitan más datos acerca del embarazo y puerperio en la EP para poder recoger evidencia suficiente que permita mejorar nuestra práctica clínica en este escenario tan poco frecuente. Sin embargo, el desconocimiento de los efectos de estos fármacos en el infante, hacen desaconsejar la lactancia en mujeres con EP.
Consejo genético en enfermedad de ParkinsonLa EP está determinada por factores genéticos y ambientales, aunque la genética sólo explica el 10% de todos los casos26. Para un buen consejo genético es necesario analizar antecedentes familiares de EP para determinar si es esporádica o familiar, definiéndose patrones de herencia dominante o recesiva según el gen implicado y el cuadro clínico asociado. Actualmente se recomienda realizar pruebas genéticas en entorno clínico a mujeres en edad fértil con EP típica y clara historia familiar con herencia dominante o si tienen EP típica esporádica, pero de inicio antes de los 40 años. Conocer el gen responsable de la EP en una familia permite una atención personalizada, y ofrecer asesoramiento genético correcto con riesgos de recurrencia específicos para esa familia27,28. Dado que la penetrancia de algunas mutaciones no es completa, y que en la actualidad no disponemos de tratamientos modificadores de EP ni de terapia génica, las pruebas genéticas en familiares asintomáticos deben realizarse con cautela por sus implicaciones éticas y personales.
ConclusionesLa EP en mujeres jóvenes y en edad fértil afecta a todos los aspectos de la salud sexual y reproductiva de estas pacientes. Se recomienda un abordaje multidisciplinar y tener estos aspectos presentes durante el tratamiento integral de la enfermedad. El embarazo se recomienda que sea planificado previo un ajuste de medicación antiparkinsoniana para minimizar los riesgos teratogénicos potenciales de los fármacos. Se debe hacer un consejo genético y seguimiento por consultas de obstétrica de alto riesgo.
Conflicto de interesesNo existe conflicto de intereses en este artículo