La enfermedad por coronavirus 2019 (COVID-19) se ha propagado de forma rápida, dando lugar a una situación de pandemia, con importante morbimortalidad. En este contexto han surgido un amplio número de vacunas para tratar de hacer frente a la enfermedad.
ObjetivoRevisar los casos reportados de manifestaciones neurológicas tras la aplicación de las vacunas contra COVID-19, describiendo los hallazgos clínicos, analíticos, de neuroimagen y los resultados de salud.
MétodosRevisión bibliográfica estructurada en la base de datos PubMed.
ResultadosEncontramos 86 artículos, que incluyeron 13.809 pacientes con un amplio espectro de manifestaciones neurológicas asociadas temporalmente con la vacunación contra COVID-19. La mayoría ocurrieron en mujeres (63,89%), con una mediana de edad de 50 años. Los eventos adversos publicados con más frecuencia fueron parálisis facial de Bell 4.936/13.809 (35,7%), cefalea (4.067/13.809), eventos vasculares cerebrales 2.412/13.809 (17,47%), síndrome de Guillain-Barré 868/13.809 (6,28%), desmielinización del sistema nervioso central 258/13.809 (1,86%) y trastorno neurológico funcional 398/13.809 (2,88%). La mayoría de casos publicados se produjeron en asociación temporal con la vacuna Pfizer (BNT162b2), seguida de la vacuna de AstraZeneca (ChAdOX1 nCoV-19).
ConclusionesCon los datos existentes actualmente no es posible establecer una relación de causalidad entre estos eventos adversos y las vacunas contra la COVID-19, ni calcular la frecuencia de aparición de estos trastornos. Sin embargo, es necesario que los profesionales de la salud estén familiarizados con estos eventos, facilitando su diagnóstico y tratamiento tempranos. Son necesarios grandes estudios epidemiológicos controlados para establecer una posible relación causal entre la vacunación contra la COVID-19 y los eventos adversos neurológicos.
Coronavirus disease 2019 (COVID-19) has spread rapidly, giving rise to a pandemic, causing significant morbidity and mortality. In this context, many vaccines have emerged to try to deal with this disease.
ObjectiveTo review the reported cases of neurological manifestations after the application of COVID-19 vaccines, describing clinical, analytical and neuroimaging findings and health outcomes.
MethodsWe carried out a review through bibliographic searches in PubMed.
ResultsWe found 86 articles, including 13,809 patients with a wide spectrum of neurological manifestations temporally associated with COVID-19 vaccination. Most occurred in women (63.89%), with a median age of 50 years. The most frequently reported adverse events were Bell's palsy 4936/13809 (35.7%), headache (4067/13809), cerebrovascular events 2412/13809 (17.47%), Guillain-Barré syndrome 868/13809 (6.28%), central nervous system demyelination 258/13809 (1.86%) and functional neurological disorder 398/13809 (2.88%). Most of the published cases occurred in temporal association with the Pfizer vaccine (BNT162b2), followed by the AstraZeneca vaccine (ChAdOX1 nCoV-19).
ConclusionsIt is not possible to establish a causal relationship between these adverse events and COVID-19 vaccines with the currently existing data, nor to calculate the frequency of appearance of these disorders. However, it is necessary for health professionals to be familiar with these events, facilitating their early diagnosis and treatment. Large controlled epidemiological studies are necessary to establish a possible causal relationship between vaccination against COVID-19 and neurological adverse events.
El nuevo SARS-CoV-2, causante de la enfermedad por coronavirus 2019 (COVID-19), se ha propagado rápidamente dando lugar a una pandemia, con un impacto devastador en la salud pública, la economía mundial y la esfera social1,2. En este contexto se ha llevado a cabo un esfuerzo internacional sin precedentes para desarrollar vacunas eficaces y seguras contra COVID-19. Actualmente están disponibles varias vacunas para las que numerosos países han concedido autorizaciones de uso de emergencia1,3.
Las vacunas BNT162b2 (Pfizer y BioNTech) y mRNA-1273 (Moderna) son vacunas basadas en ARNm. La vacuna ChAdOx1 (Oxford y AstraZeneca) utilizan la tecnología de vector viral no replicante de adenovirus, así como las vacunas Ad26.COV2.S (Johnson & Johnson), Convidecia® y Sputnik-V®. Las vacunas de Sinovac y de Sinopharm (BBIBP-CorV) utilizan virus inactivados. La única vacuna disponible de subunidades proteicas es la NVX-CoV2373 (Novavax)1,4,5.
El programa de vacunación contra COVID-19 brinda esperanzas para hacer frente a la pandemia actual. Sin embargo, las vacunas no están exentas de efectos adversos, y es importante identificar y cuantificar estos posibles riesgos. El hecho de que se llevase a cabo un proceso acelerado de desarrollo ha hecho surgir el temor de que se hubiera comprometido su seguridad, de forma que ha pasado a constituir un tema de preocupación para la opinión pública4. En los ensayos clínicos aleatorizados de las vacunas contra el SARS-CoV-2 se obtuvieron datos tranquilizadores de eficacia y seguridad; sin embargo, estos no tuvieron suficiente poder para detectar eventos adversos muy poco frecuentes y, tras su autorización, se están informando una amplia variedad complicaciones neurológicas6.
Los ensayos clínicos aleatorizados de la vacuna Oxford-AstraZeneca (ChAdOX1 nCoV-19) informaron de 3 casos de mielitis transversa en el grupo de la vacuna, entre los 11.636 participantes incluidos7. Solo un caso se creyó finalmente relacionado con la vacunación. Los ensayos de las vacunas ARNm de Moderna (mRNA-1273) y Pfizer/BioNTech (BNT162b2)8,9 informaron de 7 casos de parálisis facial de Bell en 37.000 vacunados. El ensayo de la vacuna de Janssen Ad26.COV2.S10 informó de 3 casos de parálisis de Bell en el grupo de la vacuna, uno de síndrome de Guillain-Barré (SGB) en el grupo vacunado y otro en el grupo placebo, y un episodio de radiculitis braquial. Los eventos tromboembólicos venosos fueron más frecuentes en el grupo vacunado, uno de los cuales fue un evento embólico venoso cerebral acompañado de trombocitopenia3,11.
La mayor parte de los efectos adversos neurológicos graves tras las vacunas contra COVID-19 se informan de manera anecdótica, y su incidencia real se desconoce12. El objetivo de este estudio fue tratar de definir el espectro de manifestaciones neurológicas informadas tras la vacunación contra COVID-19, describiendo las manifestaciones publicadas en la literatura.
Material y métodosEsta revisión se llevó a cabo de acuerdo con las pautas de la declaración PRISMA13 (Preferred Reporting Items for Systematic Reviews and Meta-Analyses). Realizamos búsquedas bibliográficas en PubMed entre el 08/01/2022 y el 21/01/2022, utilizando los siguientes términos en las combinaciones «Y» y «O»: «COVID-19 vaccine», «COVID-19 vaccines», «SARS-CoV-2 vaccine», «SARS-CoV-2 vaccines», «neurological manifestations», «neurologic manifestations», «neurological symptoms», «neurologic symptoms» y «neurology». La estrategia de búsqueda se detalla en la (Tabla 1S del material suplementario). Se examinaron los títulos y resúmenes de los artículos obtenidos mediante búsqueda bibliográfica para valorar su inclusión. Se eliminaron los resultados duplicados.
Se incluyeron estudios publicados y pre-publicación que: 1) informaron al menos de un caso de cualquier manifestación neurológica de nueva aparición asociada temporalmente con la vacunación por SARS-CoV-2 en humanos, no explicada por otra etiología; 2) incluyeron sujetos vacunados contra COVID-19 con cualquiera de las vacunas disponibles, y 3) publicados en inglés. Los artículos incluidos se revisaron a texto completo.
Los estudios se excluyeron ante alguna de las siguientes condiciones: 1) artículos de revisión, y 2) correspondencia o comunicaciones breves a excepción de que informasen algún caso de enfermedad neurológica tras la vacuna contra COVID-19.
Se extrajeron los siguientes datos: número de pacientes que presentaron manifestaciones neurológicas, edad, sexo, complicación neurológica, tipo de vacuna, dosis, país, intervalo de tiempo entre la vacunación y la aparición de la manifestación, presentación clínica, hallazgos de neuroimagen, hallazgos de laboratorio y resultado. Los datos cualitativos se expresaron en porcentajes y números. Los datos cuantitativos se describieron mediante la mediana y el rango.
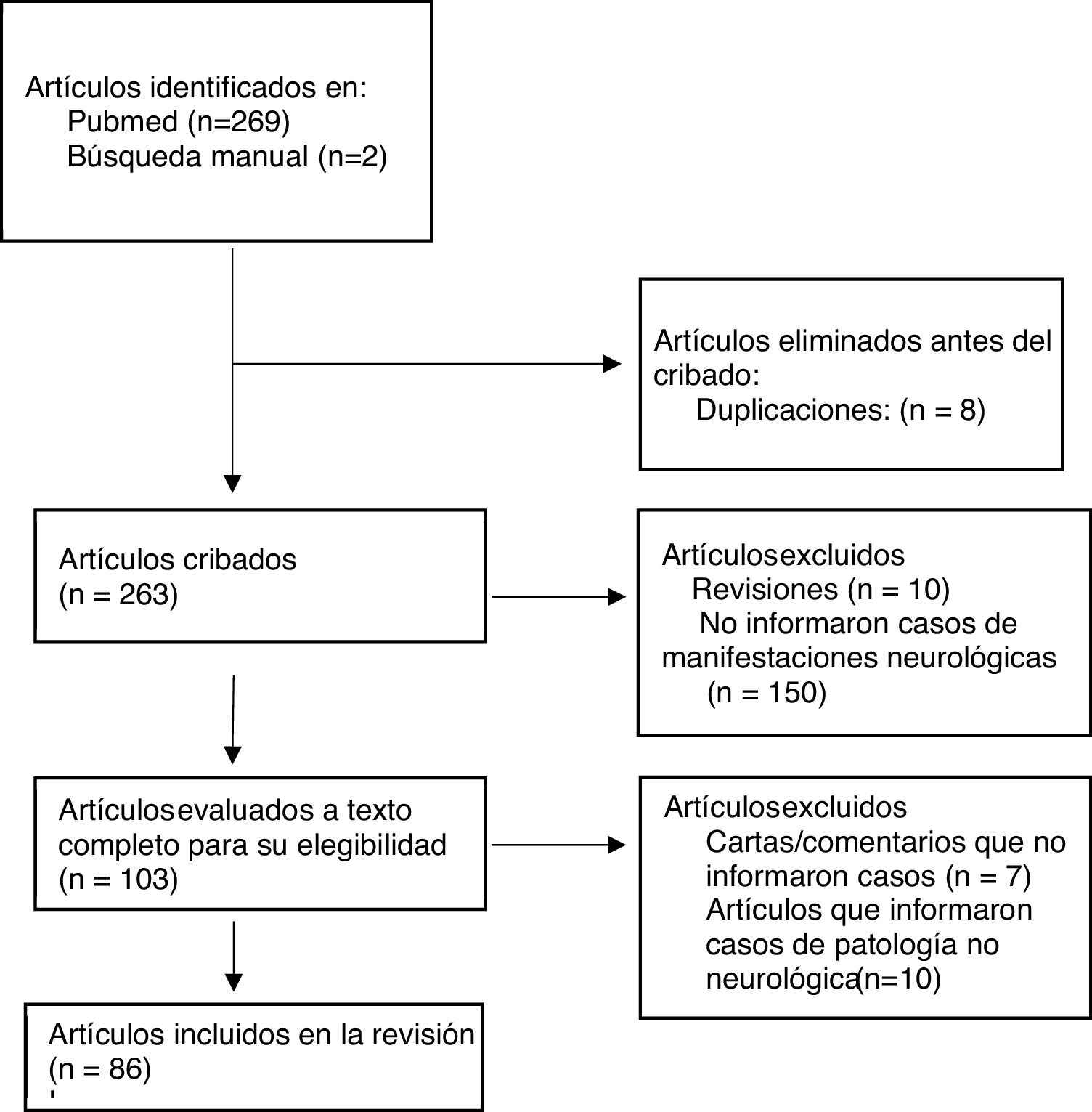
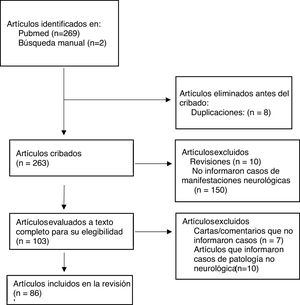
ResultadosNuestra búsqueda arrojó 271 artículos, de los cuales 8 fueron excluidos por duplicación y 263 se cribaron mediante título y resumen. Se excluyeron 10 artículos de revisión y 150 artículos que no informaron casos de manifestaciones neurológicas, y 103 artículos fueron evaluados a texto completo para su elegibilidad. De estos, 7 fueron excluidos por tratarse de cartas/comentarios que no informaron sobre casos de manifestaciones neurológicas, y 10 por ser artículos que informaron sobre casos de enfermedad no neurológica. Finalmente, 86 artículos cumplieron los criterios de inclusión y exclusión, y fueron incluidos en la revisión. El diagrama de flujo para la selección de estudios se muestra en la figura 1.
En total se encontraron 86 artículos, que incluyeron 13.809 pacientes que mostraron algún tipo de manifestación neurológica. La tabla 1 resume los casos de complicaciones neurológicas tras la administración de la vacuna contra COVID-19 incluidos en la revisión. Existió un predominio femenino (63,89%), con 7.910 casos en mujeres y 4.469 en varones, de los 12.379 en los que se informó el sexo. La mediana de edad fue de 50 años (rango: 19-97).
Manifestaciones neurológicas informadas tras la vacunación contra COVID-19
| Complicación | N.° | Complicación | N.° |
|---|---|---|---|
| Sistema nervioso centralEventos vasculares cerebrales | 2.412 | Sistema nervioso periféricoParálisis de Bell | 4.936 |
| Hemorragia intracerebral | 928 | Síndrome de Guillain-Barré | 868 |
| Trombosis venosa cerebral | 706 | Trastorno miasténico | 194 |
| Ictus isquémico | 259 | Síndrome de Parsonage-Turner | 60 |
| Accidente isquémico transitorio | 38 | Compromiso de otros nervios craneales | 12 |
| Desmielinización del sistema nervioso central | 258 | Miositis | 3 |
| Esclerosis múltiple | 15 | Radiculopatía | 2 |
| Mielitis transversa | 11 | Otros | |
| Neuritis óptica | 6 | ||
| Encefalomielitis aguda diseminada | 5 | Cefalea | 4.067 |
| Neuromielitis óptica | 3 | Trastorno neurológico funcional | 398 |
| Signo de la copa de vino | 1 | Herpes zóster | 7 |
| Convulsiones | 50 | Alteraciones del gusto y del olfato | 6 |
| Encefalitis posvacunal | 5 | ||
| Meningitis posvacunal | 3 |
Las manifestaciones más frecuentemente publicadas fueron parálisis de Bell (4.936/13.809; 35,7%), cefalea (4.067/13.809; 29,4%), eventos vasculares cerebrales (2.412/13.809; 17,47%), SGB (868/138.09; 6,28%), desmielinización del sistema nervioso central (SNC) (258/13.809; 1,86%) y trastorno neurológico funcional 398/13.809 (2,88%). Otras complicaciones informadas fueron encefalitis (5/13.809), meningitis (3/13.809), convulsiones (50/13809), síndrome de Parsonage-Turner (60/13.809), compromiso de otros nervios craneales (12/13.809), trastorno miasténico (194/13.809), miositis (3/13.809), radiculopatía (2/13.809), herpes zóster (7/13.809) y alteraciones del gusto y del olfato (6/13.809).
La vacuna BNT162b2 fue el tipo de vacuna informado con más frecuencia, con 8.820 casos reportados. Se informaron de 3.561 casos de enfermedad neurológica después de la vacuna ChAdOX1 nCoV-19, 1.256 después de la vacuna mRNA-1273, 251 después de la vacuna Ad26.CoV2.S, uno después de la vacuna de Sinovac, 2 después de la vacuna Sputnik-V®, uno después de la vacuna de Sinopharm (BBIBP-CorV) y uno después de la vacuna Convidecia® (AD5-nCOV). La mayoría de los casos se produjeron tras la primera dosis, 2.991 de los 3.216 que aportaron este dato (93%), mientras que solo 225 tuvieron lugar tras la segunda dosis. Los síntomas neurológicos se manifestaron tras una mediana de 9 días desde la vacunación (rango: 1-32).
Los casos de trombosis venosa cerebral (TVC) se informaron con mayor frecuencia tras las vacunas de vectores de adenovirus, al igual que los casos de desmielinización del SNC, aunque al desglosar estos por enfermedades, los casos de neuromielitis óptica, encefalomielitis aguda diseminada (EMAD) y esclerosis múltiple (EM) fueron publicados con mayor frecuencia tras las vacunas de ARNm. La enfermedad del sistema nervioso periférico también fue más frecuentemente informada tras la administración de vacunas de vectores virales, salvo la parálisis de Bell que se desencadenó de forma predominante posteriormente a las vacunas basadas en ARNm.
Los estudios incluidos se pueden dividir entre aquellos que informaron distintos tipos de complicaciones neurológicas asociadas a la vacuna contra COVID-19, principalmente estudios sobre bases de datos de farmacovigilancia y estudios multicéntricos (Tabla 2S del material suplementario); y aquellos que informaron una misma complicación neurológica, en su mayoría informes o series de casos. De esta forma, se incluyeron estudios sobre casos publicados en bases de datos de farmacovigilancia como VigiBase5 (base de datos global de farmacovigilancia de la Organización Mundial de la Salud [OMS]), EudraVigilance14,15 (sistema de notificación de farmacovigilancia de la Agencia Europea del Medicamento), VAERS16 (Sistema de Notificación de Reacciones Adversas a las Vacunas de los Centros para el Control y la Prevención de Enfermedades (CDC) de EE. UU., NIMS6 (sistema de registro para el programa de vacunación COVID-19 en Inglaterra), SAEFVIC (sistema de eventos adversos tras la inmunización en Victoria, Australia), además de estudios que incluyeron datos de la Dirección General de Epidemiología del Ministerio de Salud de México17–19 y de los CDC20. Otros estudios incluidos se trataron de estudios prospectivos multicéntricos realizados en varios países (Singapur21, Reino Unido22 y Alemania23). El resto de artículos incluidos fueron series de casos o reportes de uno o varios casos.
Sistema nervioso centralEventos vasculares cerebralesLos estudios que reportaron esta complicación se incluyen en la (Tabla 3S del material suplementario). Se informaron de 2.412 casos. De los 1.615 casos en los que se documentó el sexo de los pacientes, 946 ocurrieron en mujeres (58,57%) y 669 en varones (41,42%). La mediana de edad fue de 46 años (rango: 29-67). La mediana de tiempo transcurrido fue de 8 días. La mayoría de estos eventos se desencadenaron tras las vacunas basadas en vector viral no replicante de adenovirus 1.527/2.294 (66,5%). Se informaron de 767/2.294 casos tras las vacunas de ARNm (33,4%). Entre aquellos casos que tuvieron lugar tras la vacuna con vectores virales, la mayoría se asociaron con trombocitopenia 182/265, valores de dímero D elevados 72/78, e identificación de anticuerpos anti-FP4 positivos (73/78). En pacientes a los que se administró la vacuna ARNm, no se obtuvieron estos hallazgos. Al menos el 65,6% (1.222/1.863) de los pacientes fallecieron.
Trombosis venosa cerebralLa TVC fue el evento vascular cerebral más frecuentemente informado. Se reportó en 706 pacientes, el 74,8% mujeres (217/290) y el 25,17% varones (73/290), con una mediana de edad de 40 años. La mayoría de los casos se asociaron temporalmente a vacunas de vector viral, con 402/511 casos informados después de la vacuna ChAdOx-1, 29/511 casos tras la vacuna Ad26.COV2.S 34 y 48/511 casos después de las vacunas de ARNm. En la mayoría de los casos asociados a las vacunas de vector viral en los que se informaron datos de laboratorio, la TVC se acompañó de trombocitopenia (182/264; 68,9%).
Eventos arterialesEncontramos 259 casos de ictus isquémico, 928 de hemorragia intracerebral y 38 de accidente isquémico transitorio. Los eventos arteriales en el contexto de la vacunación contra COVID-19 también se asociaron frecuentemente con el fenómeno de TTIV. Al menos 807/929 (86,8%) pacientes fallecieron.
Desmielinización del sistema nervioso centralNuestra revisión encontró casos de neuromielitis óptica, mielitis transversa, neuritis óptica, EM de nuevo diagnóstico o recaída y EMAD relacionados temporalmente con la vacuna contra la COVID-19. Identificamos 258 casos de desmielinización del SNC (Tabla 4S del material suplementario), 96/245 en varones (39%) y 149/245 en mujeres (58,6%) con una mediana de tiempo de 9 días (rango: 1-30 días). La mediana de edad fue de 43 años (rango: 19-88). La mayor parte de los casos ocurrieron tras la vacunación con ChAdOX1 nCoV-19 (153/236). Se informaron de 78/236 casos con la vacuna BNT162b2, 7/236 con mRNA-1273, 1/236 tras Ad26.CoV2.S, 2/236 tras Sinovac y 1/236 tras Sinopharm.
Mielitis transversaEncontramos 11 casos de mielitis transversa, un 66,7% en varones (6/9) y un 33,33% en mujeres (3/9), con inicio de los síntomas dentro de las 3 primeras semanas. Ocurrieron con mayor frecuencia tras la vacuna ChAdOX1 nCoV-19 (6/11), seguida de BNT162b2 (3/11), Sinopharm (1/11) y Sinovac (1/11). Cinco de los casos fueron informados como mielitis transversa longitudinalmente extensa. El análisis del LCR evidenció pleocitosis en 3 pacientes e hiperproteinorraquia en 7 pacientes. Se obtuvieron anticuerpos anti-AQP4 y anti-glicoproteína de la mielina de oligodendrocitos (anti-MOG) negativos en 5 pacientes.
Encefalomielitis aguda diseminadaSe reportaron 5 casos, 4 mujeres y un varón, con mediana de edad de 56 años. Los síntomas comenzaron dentro del primer mes desde la vacunación. Tres de los casos se produjeron tras la administración de vacunas de ARNm, otro tras la vacuna Sinovac y otro tras la vacuna ChAdOX1. Los anticuerpos anti-AQP4 y anti-MOG fueron negativos en los 3 pacientes en los que se estudiaron, así como la presencia de bandas oligoclonales. El análisis del LCR mostró pleocitosis en 2/4 casos e hiperproteinorraquia en un caso.
Esclerosis múltipleSe informó una presentación similar a la EM en 13 pacientes, de los cuales, 5 contaban con diagnóstico de EM, mientras que 8 pacientes experimentaron su primer episodio. Hubo un predominio femenino, con 9 casos en mujeres (70%) y 4 en varones (30%). La mediana de edad fue de 41 años (rango: 24-64). Los síntomas comenzaron entre 1 día y un mes desde la administración de la vacuna. Todos los casos fueron desencadenados por vacunas basadas en ARNm. La RMN encontró nuevas lesiones cerebrales en todos los casos, y nuevas lesiones medulares en 7 casos. En el análisis del LCR se evidenció pleocitosis en 8 de 9 pacientes y bandas oligoclonales en 7 de 9 pacientes.
Encefalitis posvacunalEncontramos 5 casos (tabla 5S del material suplementario), que ocurrieron dentro de la primera semana tras la vacuna, 2 varones y 3 mujeres; 4 de los cuales se desencadenaron tras la vacuna de ChAdOX1, y uno tras la vacuna ARNm-1273. Entre los síntomas comunicados se encontraron cefalea, confusión, alucinaciones visuales y táctiles, dificultad de atención y concentración, convulsiones, síndrome opsoclono-mioclono y afasia. Las pruebas de neuroimagen fueron normales en todos los casos y el LCR mostró pleocitosis linfocitaria en todos ellos.
Meningitis posvacunalNuestra revisión identificó 3 casos de meningitis aséptica, todos en mujeres de mediana edad, posteriormente a la vacunación con BNT162b2 (tabla 5S del material suplementario). En todos ellos se demostró pleocitosis linfocitaria con hiperproteinorraquia.
Sistema nervioso periféricoSíndrome de Guillain-BarréEl SGB fue una complicación neurológica informada con relativa frecuencia (Tabla 6S del material suplementario). Encontramos 868 casos, 507 de ellos tras la vacuna ChAdOx1 nCoV-19; 212 con BNT162b2; 77 con mRNA-1273; 59 con Ad26.COV2.S; 4 con CoronaVac® y uno con Sputnik-V®. Hubo un predominio masculino, con 474/861 casos en varones (55%) y 387/861 en mujeres (44,94%), tras una mediana de 12 días. La mediana de edad fue de 61 años (rango: 25-86).
Destaca una elevada frecuencia de fenotipos inusuales en la presentación clínica. De 41 casos en los que se describió la clínica, 12 presentaron la forma clásica de SGB, 11 presentaron una variante con diplejía facial, 3 debilidad facial unilateral, 3 tetraparesia, 2 SGB sensitivo, 2 síndrome de Miller-Fischer y una variante axonal de SGB. El examen del LCR mostró disociación albímino-citológica en 15 pacientes e hiperproteinorraquia en 11 pacientes. La mayoría mostraron una respuesta parcial y progresiva al tratamiento.
Parálisis facial de BellLa parálisis facial de Bell fue la enfermedad neurológica más frecuentemente reportada, con 4.936 casos (Tabla 7S del material suplementario). Fue más frecuente en el sexo femenino, con 1.994 casos en mujeres (60%) y 1.326 en varones (40%). Se informó de forma predominante después de las vacunas de ARNm; 2.538 se desencadenaron tras la vacuna BNT162b2, 1.136 tras mRNA-1273, 1.107 tras ChAdOx1 nCoV-19, 162 tras Ad26.COV2.S, 13 tras CoronaVac®, uno tras Sputnik-V® y uno tras Convidecia®. Se logró la recuperación completa con el tratamiento en la mayoría de los casos.
Neuralgia amiotrófica-síndrome de Parsonage-TurnerEncontramos 60 casos de síndrome de Parsonage-Turner, 41 en mujeres y 17 en varones (tabla 8S del material suplementario). En 3 de ellos se describió la presentación clínica: 2 casos se manifestaron con dolor y debilidad a nivel proximal en MMSS, mientras que el tercero presentó parálisis y parestesias de inicio agudo en MMII. Los hallazgos de neuroimagen y laboratorio fueron normales.
Alteraciones del olfato y del gustoTodos los casos incluidos se informaron en el artículo de Lechien et al.24 (Tabla 9S del material suplementario) con 5 casos de disfunción olfatoria y uno de disfunción gustativa entre 2 y 24 días posteriores a la vacunación con las vacunas ChAdOX1 o BNT162b2, en 5 mujeres y un varón, adultos jóvenes o de edad media (entre: 25-52 años). Se produjo la resolución completa del cuadro en todos los casos.
Herpes zósterTodos los casos de herpes zóster tras la vacunación contra COVID-19 se desencadenaron tras la vacuna BNT162b2. Se informaron de 7 casos, con predominio femenino (6/7), entre la primera y la tercera semana posteriores a la vacunación (Tabla 9S del material suplementario).
Trastorno neurológico funcionalLos casos se resumen en la (tabla 9S del material suplementario). García-Grimshaw et al.18 realizaron un estudio en 10.929 pacientes que informaron un efecto adverso posterior a la vacunación con la primera dosis de la vacuna BNT162b2 en México, encontrando 354 pacientes que experimentaron síntomas sensitivos transitorios (3,4%).
ConvulsionesEncontramos 50 casos de convulsiones. Ghosh et al.25 informaron el caso de un varón de 68 años que a los 4 días de recibir la primera dosis de ChAdOX1 comenzó con un episodio de pérdida de conexión con el medio y alteración de la conducta. Fue diagnosticado de convulsión de inicio focal no motor con alteración de la conciencia y anomalías conductuales episódicas transitorias.
DiscusiónLos ensayos cínicos aleatorizados de las vacunas contra COVID-19 mostraron una frecuencia muy baja de complicaciones neurológicas graves. Sin embargo, estos estudios no tuvieron suficiente poder para detectar efectos adversos muy poco frecuentes, dado el tamaño de muestra y la duración limitada y tras la comercialización de las vacunas cobra un papel clave la monitorización a través de sistemas de farmacovigilancia3.
A pesar de las devastadoras consecuencias de la pandemia y la disponibilidad de vacunas eficaces, el miedo hacia las vacunas sigue siendo considerable3. Los eventos adversos neurológicos de las vacunas contra COVID-19 pueden implicar una morbimortalidad significativas y constituyen un tema de preocupación26. Sin embargo, la asociación temporal entre la vacunación y los eventos adversos no implica necesariamente causalidad. En pacientes que muestren síntomas neurológicos tras recibir la vacuna debe llevarse a cabo un diagnóstico diferencial exhaustivo, aunque es preciso tener presente la vacunación como un posible factor etiológico.
La frecuencia de complicaciones neurológicas graves asociadas a estas vacunas parece ser muy baja si se compara con el impacto de la propia enfermedad y, según la información actual disponible, los beneficios de la vacunación superan los potenciales riesgos1,12,27,28. El elevado número de casos de infección por COVID-19 a nivel mundial y de muertes reportadas ponen de manifiesto la importancia del programa de vacunación, que ha mostrado una muy alta eficacia.
Respecto a los resultados obtenidos en esta revisión, la edad de presentación y el predominio femenino fueron congruentes con estudios previos1,2,4,27. El tiempo transcurrido desde la administración de la vacuna fue también similar al encontrado en estudios anteriores, ocurriendo la mayoría de estos efectos adversos entre una y 4 semanas desde la vacunación2,29. La vacuna informada con más frecuencia fue la de Pfizer (BNT162b2), lo que podría haber estado influido por el hecho de que el estudio que contó con un mayor número de pacientes fue el de García-Grimshaw et al.18, con 4.258 pacientes vacunados con BNT162b2.
Patone et al.6 investigaron los ingresos hospitalarios por complicaciones neurológicas desencadenadas tras la primera dosis de las vacunas ChAdOx1 CoV-19 (n=20.417.752) y BNT162b2 (n=12.134.782), y tras un test de SARS-CoV-2 positivo (n=2.005.280) en esta misma población vacunada. Se observó un mayor riesgo de ingreso hospitalario por ictus hemorrágico en quienes que recibieron la vacuna BNT162b2, y un mayor riesgo de ingreso por SGB, parálisis de Bell y trastornos miasténicos en receptores de la vacuna ChAdOxIn nCoV-19. Aunque encontraron un mayor riesgo de complicaciones neurológicas en los vacunados contra COVID-19, identificaron un aumento mucho mayor en el riesgo de todos los resultados neurológicos después de una prueba SARS-CoV-2 positiva.
Un estudio prospectivo en 704.003 receptores de la primera dosis de la vacuna BNT162b2 en México17 encontró que un 65,1% de los efectos adversos fueron neurológicos. Los eventos neurológicos no graves ocurrieron en menos del 1%, y los graves en solo un 0,005%. Sin embargo, de los eventos graves, el 52% fueron neurológicos. La mayoría de los pacientes experimentaron una recuperación completa en días o semanas, sin aparición de secuelas, lo que parece indicar un desencadenante inflamatorio agudo y transitorio. Recientemente se ha publicado un artículo fuera del periodo analizado, en el que se comunica un 30% más de EA de los que encontrados en nuestro estudio30.
Una de las complicaciones de la vacuna COVID-19 que ha suscitado mayor preocupación son los eventos vasculares cerebrales, reportados principalmente en mujeres en edad fértil, después de la administración de vacunas de vectores virales1. Una característica fundamental de los eventos vasculares cerebrales reportados tras la vacunación contra el SARS-CoV-2 es que frecuentemente se asocian al fenómeno de trombocitopenia trombótica inducida por la vacuna (TTIV). Este tiene características que lo asemejan a la trombocitopenia inducida por heparina, con la presencia de anticuerpos contra el factor plaquetario 4 (FP4)12,20,28.
Los casos de trombosis de senos venosos cerebrales (TSVC) secundarios a las vacunas contra el SARS-CoV-2 se dividen en TSVC en el contexto de TTIV, en relación con las vacunas basadas en vectores de adenovirus, y TSVC sin características de TTIV, reportados posteriormente a cualquier tipo de vacuna. En la TTIV se identifican anticuerpos anti-FP4 que desencadenan la activación plaquetaria12,20,28.
En línea con lo observado en esta revisión, la TSVC por TTIV suele ocurrir entre una y 2 semanas después de la primera dosis de la vacuna de vector viral. Los datos típicos de laboratorio incluyen un recuento de plaquetas disminuido (<100×109/l), dímero D elevado y presencia de anticuerpos anti-FP427,28,31.
Krzywicka et al.14 analizaron los datos clínicos de 213 casos de TSVC tras la vacuna COVID-19 notificados a la Agencia Europea del Medicamento y los compararon con un grupo control de casos de TSVC previos a la pandemia. El estudio mostró que la TSVC que ocurre después de la vacunación con ChAdOx1 nCov-19 tiene un perfil clínico distinto y característico: se asoció con trombocitopenia y anticuerpos anti-FP4 positivos, se acompañó frecuentemente de otros eventos trombóticos venosos y mostró altas tasas de mortalidad. Los casos de TSVC informados tras la aplicación de vacunas de ARNm fueron similares a los casos previos a la pandemia.
El hecho de que las características clínicas de los casos de TSVC que surgen después de las vacunas de vectores virales sean específicas, la identificación de un mecanismo fisiopatológico, junto con la secuencia temporal coherente, respaldan una posible relación de causalidad. Además, el riesgo importante de mortalidad de esta complicación pone de manifiesto la importancia del diagnóstico y tratamiento tempranos15,20,28.
Se sospecha que la vacunación contra COVID-19 podría provocar una respuesta inflamatoria inmunomediada, pudiendo desencadenar fenómenos de autoinmunidad29,32. La desmielinización suele tener una causa autoinmune subyacente. El mecanismo exacto de desmielinización aguda tras las vacunas contra COVID-19 sigue sin comprenderse, existiendo varias teorías. Una de ellas sugiere que se basa en el fenómeno de mimetismo molecular. Otro factor que se plantea es el papel inmunógeno de los adyuvantes que componen algunas vacunas2,33. Un tercer posible mecanismo estaría relacionado con respuestas de células T y B y una activación «by-stander» de linfocitos autorreactivos latentes2.
Nuestra revisión obtuvo un 60% de casos ocurridos en mujeres, con una mediana de edad de 42 años. La mayoría de los casos ocurrieron tras la vacunación con ChAdOX1 nCoV-19. Una revisión sistemática de los casos de desmielinización del SNC reportados tras la vacunación contra COVID-19, encontró datos similares a estos2. Reunió 32 casos con predominio femenino (68,8%) y una mediana de edad de 44 años. Sin embargo, las vacunas basadas en ARNm dieron lugar a un mayor número de síndromes desmielinizantes, seguidas de las vacunas de vectores virales.
Identificamos casos de neuromielitis óptica, mielitis transversa, neuritis óptica, EM y EMAD en relación temporal con la vacunación contra el SARS-CoV-2. Se trata de afecciones relativamente poco frecuentes, y los casos asociados a la vacuna son todavía más raros. La buena respuesta de estos pacientes al tratamiento inmunosupresor parece indicar una reacción inmune transitoria34. Permanece sin aclararse si la vacuna podría ser causa directa de las complicaciones autoinmunes o solo las induce en pacientes con autoinmunidad previamente asintomática29,35.
Encontramos un número considerable de casos de SGB en relación temporal con la vacunación contra el SARS-CoV-2, especialmente con la vacuna de vector viral. Existen informes de este síndrome tras otros tipos de vacunas, aunque únicamente se ha logrado probar una asociación pequeña pero estadísticamente significativa de aumento del riesgo tras la vacunación contra la influenza36–39. Es particularmente interesante el hecho de que muchos de los casos de SGB publicados tras la vacunación contra COVID-19 se presentaron como una variante con debilidad bifacial. Esta presentación parece característica del SGB en el contexto de la vacunación contra COVID-19, lo que, junto con la observación frecuente de otras variantes raras, respalda la sospecha de una relación de causalidad. El SGB asociado a la vacuna contra el SARS-CoV-2 puede mostrar datos atípicos de laboratorio, como ausencia de anticuerpos antigangliósidos40,41.
Osowicki et al.42 observaron un exceso de casos de SGB tras la vacunación con ChAdOx1 y BNT162b2 en Australia en comparación con los casos esperados. Min et al.43 revisaron los casos reportados de SGB. Todos menos uno mostraron fenotipos infrecuentes, como parestesia distal con diplejía facial o tetraparesia. Los anticuerpos antigangliósidos fueron negativos.
La parálisis de Bell fue el evento neurológico informado con más frecuencia, especialmente en relación con las vacunas de ARNm, con predominio femenino. Uno de los estudios incluidos en la revisión con mayor tamaño muestral fue el de Noseda et al.5 que incluyó 3.320 casos de parálisis de Bell.
Un estudio que analizó la frecuencia de síndrome de Parsonage-Turner, parálisis de Bell y SGB en VigiBase, en pacientes que recibieron la vacuna COVID-19 encontró que la incidencia de neuralgia amiotrófica y SGB tras la vacuna fue similar a la observada previamente para otras vacunas virales, pero la parálisis de Bell se informó con una frecuencia desproporcionadamente mayor respecto a otras vacunas virales, especialmente en varones mayores de 75 años5. Por el contrario, previamente Sato et al.16 habían publicado un artículo en el que los casos de parálisis de Bell informados mediante la base de datos VAERS, se notificaron de forma significativamente alta para las vacunas BNT162b2 y mRNA-1273, pero fueron comparables a los casos posteriores a la vacunación contra la influenza previos a la pandemia.
Esta revisión tiene varias limitaciones. La mayor parte de la literatura disponible se encontró en forma de informes de casos y series de casos sin grupo control, existiendo la posibilidad de infranotificación de estos efectos adversos, o bien, de notificación selectiva de los casos más graves. Debido a que la mayor parte de los datos provienen de informes de casos aislados y series de casos, estos deben interpretarse con precaución, y no permiten inferir causalidad, contando únicamente con la relación temporal congruente y la plausibilidad biológica. Los artículos incluidos provinieron de una sola base de datos. Además, para conocer la frecuencia de efectos adversos tras cada vacuna, solo disponemos de los estudios de farmacovigilancia, donde sí se conocen los eventos adversos y el número de individuos vacunados.
Por otro lado, el tipo de vacuna tras la que tuvieron lugar las manifestaciones informadas probablemente sea reflejo de su frecuencia de administración en los distintos territorios, así como del perfil de pacientes a los que se administraron. Posiblemente la vacuna de Pfizer haya resultado la más informada al ser la más empleada. Por ello, los datos de manifestaciones neurológicas informados tras cada una de las vacunas no serían comparables.
Probablemente los casos de cefalea no hayan sido publicados como eventos adversos neurológicos, y nuestro estudió sólo encontramos algunos casos de cefalea recogidos en estudios de farmacovigilancia, cuando se trató de una de las manifestaciones más frecuentes en los ensayos clínicos aleatorizados7–11.
ConclusionesEncontramos un amplio espectro de manifestaciones neurológicas que han sido informadas en relación temporal con la vacuna contra COVID-19, con hallazgos y presentaciones heterogéneas. Las manifestaciones encontradas con más frecuencia fueron parálisis de Bell, cefalea, eventos vasculares cerebrales, SGB, desmielinización del SNC y trastorno neurológico funcional. Sin embargo, no es posible establecer una relación de causalidad ni calcular la frecuencia de estos trastornos en base a los resultados obtenidos en este estudio.
La importancia de estos hallazgos radica en la necesidad de que los profesionales de la salud estén familiarizados con estas complicaciones raras, pero potencialmente graves, ya que su diagnóstico temprano y el inicio rápido de un tratamiento adecuado pueden ayudar a lograr un resultado más favorable. Subrayamos la importancia de la vigilancia posterior a la comercialización de las vacunas para identificar estos eventos adversos infrecuentes y garantizar la seguridad de estas. Son necesarios estudios prospectivos controlados de gran tamaño para probar o refutar, y cuantificar en su caso la asociación causal entre estas vacunas y los eventos adversos neurológicos. Es fundamental contextualizar el riesgo en caso de que se confirme la asociación.
FinanciaciónLos autores declaran que no ha habido fuente de financiación.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.
- Download PDF
- Bibliography
- Additional material