Las hemorragias subaracnoideas corticales (HSAc) tienen numerosas etiologías. No hay estudios prospectivos que indiquen su evolución a largo plazo. El objetivo de este trabajo es describir las características clínicas y etiológicas de los pacientes con HSAc y conocer su pronóstico.
MétodosEstudio observacional, prospectivo y multicéntrico. Se recogieron variables clínicas y radiológicas, y se siguió la evolución al año, observando la mortalidad, dependencia, tasa de resangrado y aparición de demencia.
ResultadosSe incluyeron 34 pacientes (edad media 68,3 años, rango 27-89). Los síntomas más frecuentes fueron el déficit neurológico focal, con frecuencia transitorio y de repetición, y la cefalea. El TAC fue patológico en 28 pacientes (85%). Se realizó RM cerebral en 30 pacientes (88%), con isquemia aguda en 10 (29%), sangrados antiguos en 7 (21%) y siderosis superficial en otros 2 (6%). Se encontró etiología en 26 pacientes (76,5%): angiopatía amiloide (n=8), ictus isquémico (n=5), vasculitis (n=4), encefalopatía posterior reversible (n=2), trombosis venosa (n=2), síndrome de vasoconstricción cerebral reversible (n=2), oclusión carotidea (n=1), síndrome de Marfan (n=1) y carcinomatosis meníngea (n=1). Durante el seguimiento fallecieron 3 pacientes (en 2 de ellos relacionado con la causa de la HSAc). Tres pacientes desarrollaron una demencia, 3 presentaron un hematoma lobar y otro una nueva HSAc.
ConclusionesEn nuestra serie las causas más frecuentes de HSAc fueron la angiopatía amiloide, el ictus isquémico y la vasculitis. La HSAc tiene peor pronóstico que otras HSA no aneurismáticas. Puede tener numerosas causas y su pronóstico depende de la etiología subyacente. En el anciano existe una frecuente asociación con hemorragia intracraneal y deterioro cognitivo.
Cortical subarachnoid haemorrhage (cSAH) has multiple aetiologies. No prospective study has reported the long-term progression of the condition. The objective of this study is to describe the clinical and aetiological characteristics of patients with cSAH and to gain insight into prognosis.
MethodsWe performed a prospective, observational, multi-centre study. Data on clinical and radiological variables were collected; during a one-year follow-up period, we recorded data on mortality, dependence, rebleeding, and the appearance of dementia.
ResultsThe study included 34 patients (mean age, 68.3 years; range, 27-89). The most frequent symptoms were headache and focal neurological deficits, which were frequently transient and recurrent. CT scans returned pathological findings in 28 patients (85%). Brain MRI scans were performed in 30 patients (88%), revealing acute ischaemia in 10 (29%), old haemorrhage in 7 (21%), and superficial siderosis in 2 (6%). Aetiology was identified in 26 patients (76.5%): causes were cerebral amyloid angiopathy in 8, ischaemic stroke in 5, vasculitis in 4, reversible posterior encephalopathy in 2, venous thrombosis in 2, reversible cerebral vasoconstriction syndrome in 2, carotid occlusion in 1, Marfan syndrome in 1, and meningeal carcinomatosis in 1. Three patients died during follow-up (2 due to causes related to the cause of cSAH). Three patients developed dementia, 3 had lobar haemorrhages, and one had a second cSAH.
ConclusionsThe most frequent causes of cSAH in our series were cerebral amyloid angiopathy, ischaemic stroke, and vasculitis. This type of haemorrhage has a worse prognosis than other non-aneurysmal cSAH. There are numerous possible causes, and prognosis depends on the aetiology. In elderly patients, intracranial haemorrhage is frequently associated with cognitive impairment.
La causa más frecuente de hemorragia subaracnoidea (HSA) no traumática es la rotura de un aneurisma cerebral intracraneal, que se produce en el 85% de los casos. En estos pacientes existe una predisposición familiar y unos factores de riesgo bien conocidos como el tabaquismo, la hipertensión arterial o el consumo excesivo de alcohol. Su pronóstico no es bueno puesto que se produce el fallecimiento de aproximadamente la mitad de los pacientes y un tercio de los supervivientes queda dependiente1.
En segundo lugar se sitúan las hemorragias perimesencefálicas (10% del total), donde la arteriografía cerebral casi siempre es normal y la evolución suele ser satisfactoria1.
El 5% restante lo constituye fundamentalmente la HSA cortical (HSAc), que se define por la presencia de sangre en uno o pocos surcos de la convexidad cerebral. La HSAc se ha relacionado con numerosas causas2: angiopatía amiloide cerebral (AAC)3–6, vasculitis7,8, síndrome de vasoconstricción cerebral reversible (RCVS)9, síndrome de encefalopatía posterior reversible (PRES)10, malformaciones vasculares11, aneurismas micóticos12, ictus isquémico13, disección o estenosis arterial14, o trombosis venosa cerebral (TVC)15–17.
El pronóstico de los pacientes que sufren una HSAc no está bien establecido, con datos procedentes únicamente de pequeñas series de casos clínicos18–23. Además no disponemos de estudios prospectivos que indiquen su evolución a largo plazo.
El objetivo del presente trabajo es describir las características clínicas y etiológicas de los pacientes con HSAc, así como conocer su pronóstico y evolución.
Pacientes y métodosSe trata de un estudio observacional, prospectivo y multicéntrico, con pacientes procedentes de 6 hospitales de la Comunidad Valenciana (España). Este estudio fue autorizado por la Comisión de Investigación del hospital de Sagunto. En todos los casos se firmó un consentimiento informado. El período de inclusión comprendió entre junio de 2011 y abril de 2016. Se realizó un seguimiento a los 3 meses y al año. La evolución de los pacientes se evaluó mediante la escala de Rankin modificada, considerando que fue favorable con puntuación≤2 y desfavorable si>2.
Todos los pacientes incluidos ingresaron en su hospital de referencia. Se excluyeron las hemorragias traumáticas y aquellas en las existía hematoma intraparenquimatoso asociado o sangre en la cisura interhemisférica, cisternas basales o ventrículos. Se recogieron datos clínicos y demográficos, electrofisiológicos, de laboratorio y estudios de imagen.
Se hizo tomografía axial computarizada (TAC) cerebral a todos los pacientes. De forma individualizada se consideró durante el ingreso la realización de otras pruebas de imagen como angio-TAC, resonancia magnética (RM) cerebral con estudio vascular o arteriografía cerebral convencional. Se recogió la presencia de siderosis superficial, sangrados antiguos o isquemia aguda en las secuencias de difusión. Se utilizaron los criterios de Boston modificados24 para el diagnóstico de AAC y los criterios de Calabrese25 para el RCVS. Durante el seguimiento no se realizó pruebas de neuroimagen a los pacientes que permanecieron clínicamente estables.
A criterio de cada centro y en función de las características del paciente, en algunos casos se realizó estudio de líquido cefalorraquídeo y/o electroencefalograma.
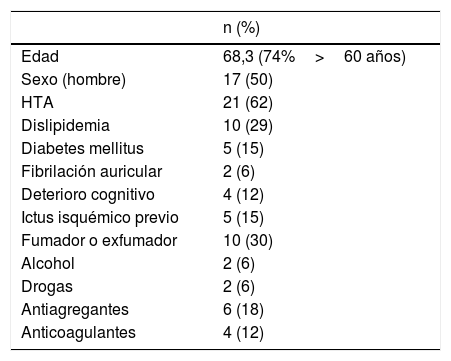
ResultadosDurante el período de estudio se incluyeron un total de 34 pacientes, con una edad media de 68,3 (rango 27-89). Veinticinco pacientes (73,5%) tenían más de 60 años de edad. Diecisiete pacientes fueron mujeres. Los datos demográficos y antecedentes detallados de los pacientes se recogen en la tabla 1.
Características de los pacientes
| n (%) | |
|---|---|
| Edad | 68,3 (74%>60 años) |
| Sexo (hombre) | 17 (50) |
| HTA | 21 (62) |
| Dislipidemia | 10 (29) |
| Diabetes mellitus | 5 (15) |
| Fibrilación auricular | 2 (6) |
| Deterioro cognitivo | 4 (12) |
| Ictus isquémico previo | 5 (15) |
| Fumador o exfumador | 10 (30) |
| Alcohol | 2 (6) |
| Drogas | 2 (6) |
| Antiagregantes | 6 (18) |
| Anticoagulantes | 4 (12) |
Varios pacientes presentaron más de un síntoma. El inicio fue agudo en todos los casos excepto en un paciente con carcinomatosis meníngea que desarrolló cefalea y focalidad neurológica de instauración progresiva. El síntoma más frecuente fue el déficit neurológico focal (n=21, 62%): 10 pacientes (29%) como déficits estereotipados de repetición y 11 pacientes (33%) como déficit establecido. Once pacientes (33%) tuvieron cefalea, con inicio explosivo solo en 4 (12%). Tres casos (9%) presentaron confusión, siendo en uno de ellos los síntomas similares a un episodio de amnesia global transitoria. Tres pacientes (9%) sufrieron crisis epilépticas como síntoma inicial, que fueron generalizadas en 2 casos. Dos pacientes (6%) refirieron alteraciones visuales inespecíficas acompañando a otros síntomas. Se apreció rigidez de nuca solo en un paciente.
Hallazgos radiológicosLa hemorragia se identificó en el TAC en 28 casos (85%), en el resto por RM. Se realizó RM cerebral en 30 pacientes (88%) y arteriografía cerebral en 12 (35%). La mayoría de los sangrados fueron unilaterales, siendo su localización más frecuente parietal y frontal. Las secuencias de RM ponderadas en difusión mostraron hiperseñal cortical en 10 pacientes (33% del total a los que se hizo RM), que en la mayoría de casos fue adyacente a la HSAc. Se detectaron sangrados antiguos en 7 casos (23%) y siderosis superficial en otra localización en 2 (7%). Se realizó estudio vascular extra- e intracraneal –mediante angio-TAC, angio-RM o arteriografía convencional– en 30 casos (88%), sin encontrar ningún aneurisma o malformación arteriovenosa, excepto un paciente con un pequeño aneurisma de 1,2mm de diámetro en una localización alejada del sangrado. Cinco pacientes tenían patología carotidea homolateral al sangrado (2 estenosis significativas, 2 obstrucciones completas y un trombo intrastent). En 2 casos se detectaron estenosis intracraneales múltiples y un paciente tenía una oclusión de la arteria cerebral media homolateral.
Otros estudiosSe realizó electroencefalograma en 10 pacientes (29%), que mostró actividad epileptiforme solo en 3 casos. Se hizo punción lumbar a 14 pacientes. El estudio citobioquímico del líquido cefalorraquídeo fue habitualmente normal. En ningún caso se detectó xantocromía. Hubo pleocitosis linfocitaria en 3 pacientes, un discreto aumento de proteínas en 2 y presencia de bandas oligoclonales en uno. La citología para células malignas fue positiva en un caso. En 7 pacientes se determinó el cociente tau/amiloide, que fue patológico en 3.
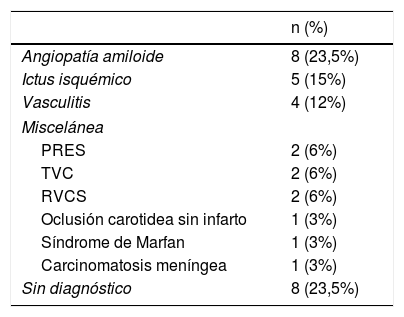
EtiologíasEn la tabla 2 se exponen las causas del sangrado, que se pudo establecer en 26 pacientes (76,5%).
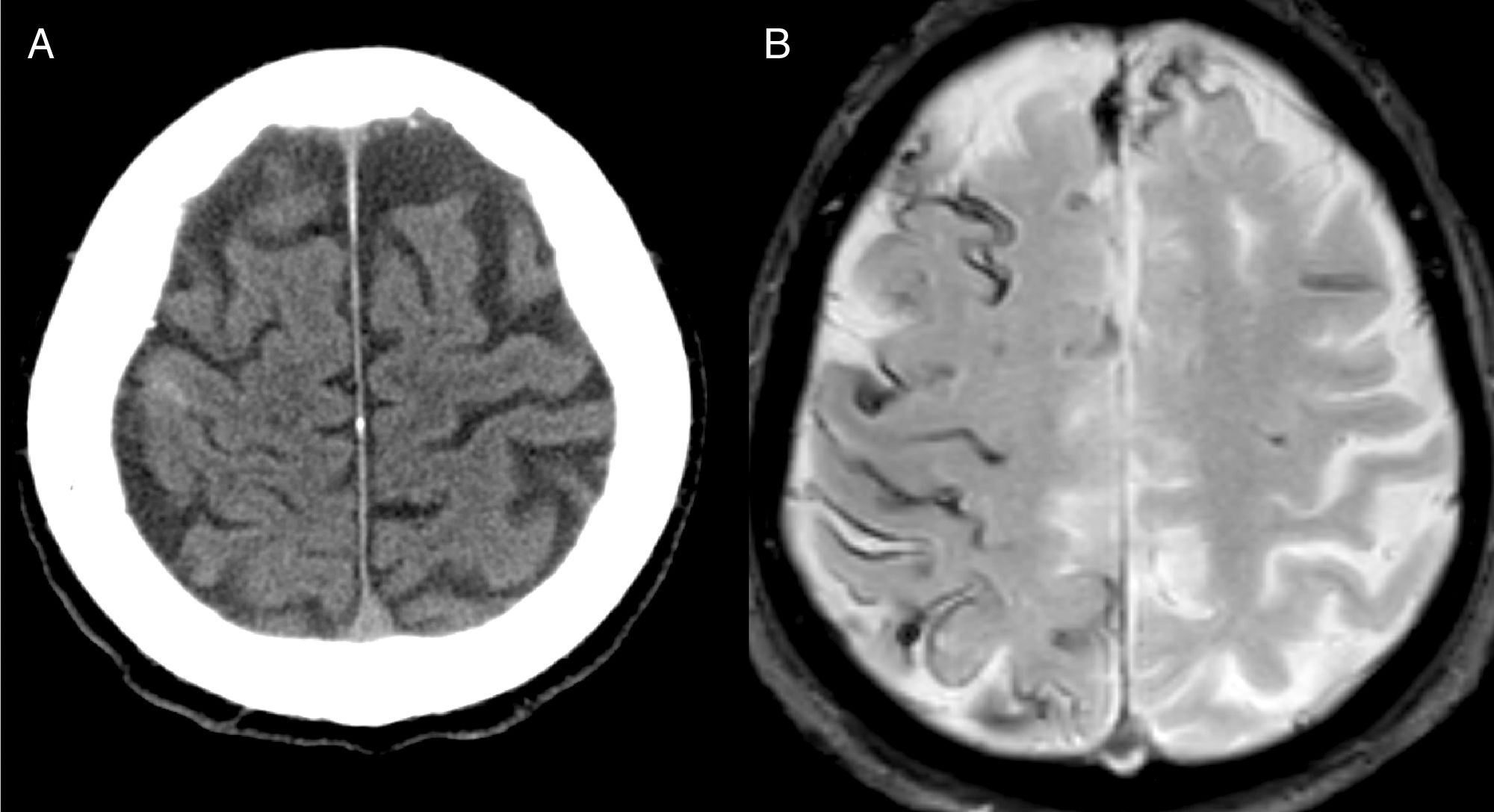
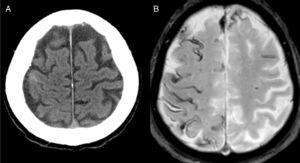
El diagnóstico más frecuente fue AAC (fig. 1) con un total de 8 casos. Tres fueron diagnosticados durante el año de seguimiento, uno de ellos por la recurrencia de HSAc y presencia de siderosis superficial en la RM, y los otros 2 por la aparición de un hematoma lobar.
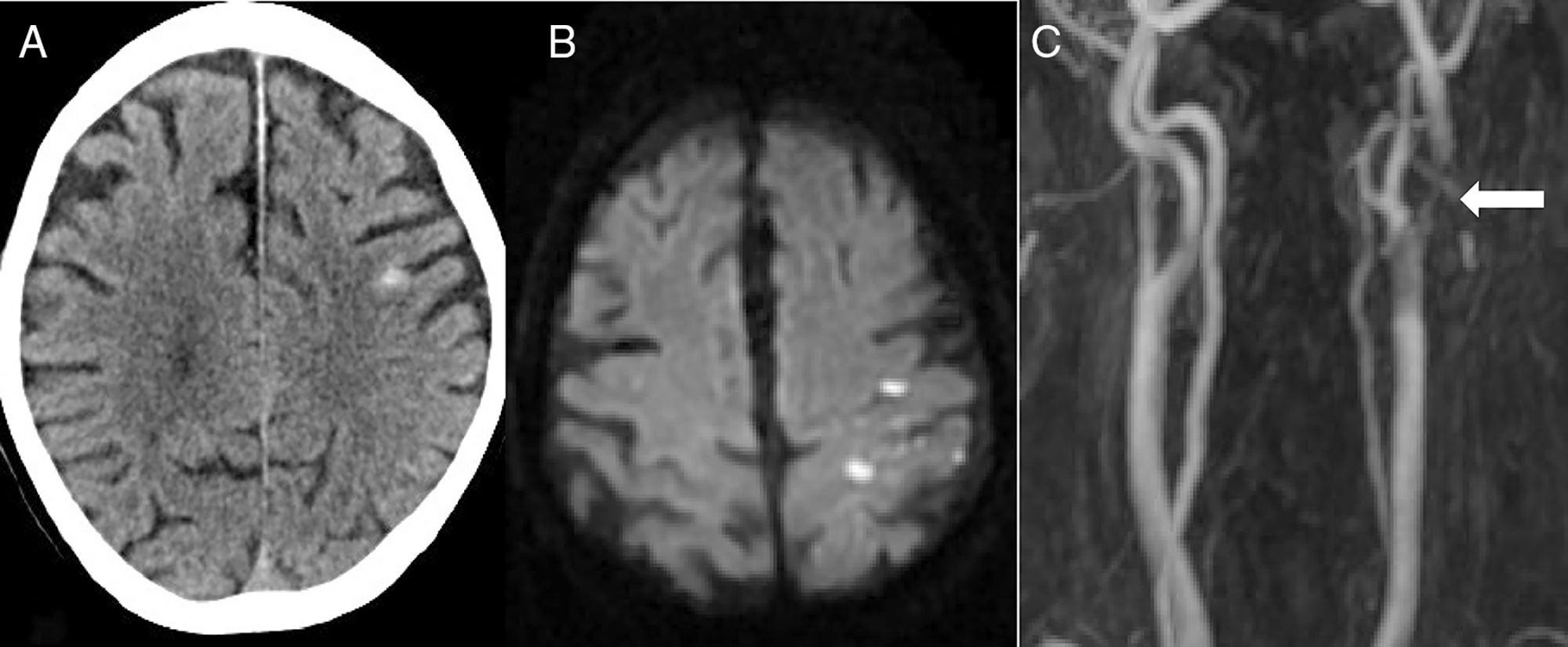
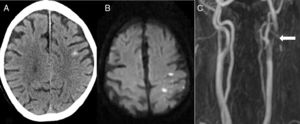
La segunda causa más frecuente fue el ictus isquémico (n=5): 2 ictus cardioembólicos, un infarto aterotrombótico, un ictus secundario a obstrucción carotidea y una trombosis de un stent carotideo (fig. 2).
Paciente de 82 años que, 6 días después de colocar un stent carotideo izquierdo, presenta pérdida de fuerza y sensibilidad en brazo derecho de inicio brusco. En el TAC cerebral (A) se aprecia una HSAc en la convexidad del lado izquierdo. La RM en secuencia de difusión (B) identifica un infarto agudo adyacente al sangrado. La angio-RM (C) muestra una trombosis del stent (flecha).
El tercer lugar lo ocuparon las vasculitis (n=4). Tres de ellas fueron secundarias (síndrome de Sjögren, Churg-Strauss, neurosífilis) y el cuarto caso fue una vasculitis primaria del sistema nervioso central. El resto de etiologías incluyeron: PRES (n=2), TVC (n=2), RCVS (n=2), oclusión carotidea sin infarto asociado (n=1), síndrome de Marfan (n=1) y carcinomatosis meníngea (n=1).
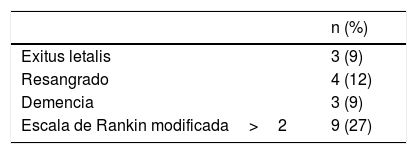
EvoluciónUn paciente diagnosticado de TVC y cáncer de próstata avanzado falleció durante el ingreso por un hematoma cerebral masivo. Durante el año de seguimiento fallecieron otros 2 pacientes, uno de ellos por la carcinomatosis meníngea que había originado la HSAc y otro paciente diagnosticado de AAC por una causa no relacionada. La mortalidad global fue del 9% (tabla 3).
Del resto se pudo realizar seguimiento en 32/33 pacientes (97%). La evolución al año fue favorable en 24 pacientes (73%) y desfavorable en 9 pacientes (27%).
El porcentaje de resangrado al año de seguimiento fue del 12% (3 hematomas lobares y una nueva HSAc). Tres pacientes desarrollaron una demencia.
DiscusiónAdemás de presentar una de las series más amplias de pacientes que han sufrido una HSAc, con 34 casos, según nuestro conocimiento este trabajo es el primero en hacer un estudio pronóstico, con seguimiento prospectivo y evolución al año.
Al comparar con la HSA aneurismática existen varios aspectos diferenciadores. En primer lugar, el síntoma de presentación más frecuente no fue la cefalea sino la focalidad neurológica, que en nuestra serie se produjo en cerca de 2 tercios de los casos. La mitad de ellos sufrieron déficits neurológicos transitorios de carácter recurrente, estereotipado (sobre todo parestesias hemicorporales) y de corta duración; en estos casos, la AAC fue la causa subyacente más frecuente. La tercera parte de los pacientes comenzó con cefalea, que fue de inicio explosivo en pocos casos. La rigidez de nuca, un signo típico de la HSA aneurismática, fue excepcional. También es destacable que ningún sangrado fue debido a la rotura de un aneurisma, que los pacientes no tenían antecedentes familiares de HSA o aneurisma intracraneal, y que el porcentaje de fumadores o consumidores de alcohol (factores de riesgo bien establecidos en la HSA aneurismática) fue bajo.
En nuestro trabajo se demuestra que la HSAc puede tener numerosas etiologías, que van más allá de la dicotomía planteada en estudios previos entre RCVS para jóvenes o AAC en ancianos19,23. Las 3 causas que se diagnosticaron con más frecuencia fueron la AAC, el ictus isquémico y las vasculitis.
Una posible explicación de que la causa más frecuente de HSAc sea la AAC es que, de forma similar a trabajos anteriores20,22,26, la mayoría de los casos recogidos tenían más de 60 años. Casi todos presentaron déficits neurológicos transitorios, recurrentes y estereotipados, también llamados amyloid spells. Se ha sugerido que la HSAc puede preceder en varias semanas a la aparición de un hematoma lobar3,4,27. De hecho 4 de nuestros pacientes sufrieron un nuevo sangrado en los meses siguientes al ingreso. Por tanto se debe ser cauto a la hora de prescribir antitrombóticos. Si el diagnóstico inicial es incierto, la realización de una RM cerebral diferida puede establecer el diagnóstico de AAC si aparecen nuevos sangrados o siderosis superficial4,5,24.
Respecto al ictus isquémico, una revisión retrospectiva de casi 5.000 pacientes con ictus agudo o AIT encontró una baja incidencia de HSAc (8 casos; 0,14%)13. En este trabajo se propone como mecanismo subyacente más probable la coexistencia de una AAC. Otra publicación sin embargo encuentra una incidencia inusualmente elevada de HSAc asociada a isquemia cerebral entre pacientes cardiópatas portadores de desfibrilador28. Destaca que la edad media fue de 39 años, lo que hace bastante improbable una AAC. En estos casos el mecanismo más plausible es la transformación hemorrágica de un infarto cardioembólico, favorecido además porque muchos de los pacientes estaban anticoagulados. También se han publicado algunos casos de HSAc asociada a estenosis u obstrucción carotidea. El mecanismo de nuevo podría ser la transformación hemorrágica de una pequeña isquemia cerebral o la rotura de una circulación colateral muy frágil, incluso en ausencia de infarto14, como ocurrió en uno de nuestros pacientes. Es posible que la estenosis carotidea esté infradiagnosticada porque muchas veces no se explora la arteria carótida extracraneal.
La HSAc es una manifestación frecuente de la vasculitis cerebral primaria o secundaria a enfermedades sistémicas autoinmunes7,29,30. En el trabajo de Boulouis et al.8, que incluyó 60 pacientes diagnosticados de angeítis primaria del sistema nervioso central, apareció en el 26% de los casos. En nuestra serie el diagnóstico de vasculitis se sospechó por los antecedentes en 3 de los 4 pacientes, y se apoyó en la presencia de múltiples estenosis arteriales en el estudio vascular. La presencia de captación meníngea en la RM ayudó además a establecer el diagnóstico diferencial con el RCVS. Las alteraciones del líquido cefalorraquídeo y la respuesta al tratamiento inmunosupresor apoyan el diagnóstico.
Es importante identificar la causa subyacente del sangrado, no solo para orientar el tratamiento sino también para establecer un pronóstico. La rentabilidad del proceso diagnóstico aumenta con un estudio etiológico inicial amplio y con en el seguimiento del paciente. La RM cerebral es la prueba complementaria más útil. La secuencia FLAIR es más sensible que el TAC cerebral para identificar el sangrado agudo, mientras que el ecogradiente ayuda a identificar sangrados antiguos, siderosis superficial y TVC cortical3,17,31,32. Se debería realizar en todos los pacientes un estudio vascular tanto extra- como intracraneal. La arteriografía cerebral quedaría reservada para los casos que tras realizar estas pruebas permanezcan sin diagnóstico, o en aquellos donde se sospeche vasculitis o RCVS.
En este trabajo se pudo diagnosticar durante el ingreso a 23 pacientes (68%). Queremos subrayar la importancia del seguimiento tras el alta puesto que permitió aumentar este número a 26 (76,5%).
El pronóstico de los pacientes que han sufrido una HSAc difiere según las series publicadas. Aquellos trabajos que observan una buena evolución suelen incluir a pacientes más jóvenes diagnosticados de PRES, TVC o RCVS9,15,16,18. El resto establece un mal pronóstico que se relaciona sobre todo con la edad4,19,22,26,33. Solo el estudio de Martínez-Lizana et al.4, que incluye a pacientes diagnosticados de AAC, hace un seguimiento ambispectivo. Nuestro trabajo es el primero con un seguimiento prospectivo, que se pudo realizar en más del 95% de los casos. Todos los pacientes que al año tenían una escala de Rankin modificada>2 (27% de los casos) eran mayores de 65 años. Además, tanto el deterioro cognitivo como todos los sangrados tras el alta se produjeron en pacientes diagnosticados de AAC. Por tanto, el pronóstico va a depender de la edad y la etiología, siendo más sombrío en ancianos con AAC.
Nuestro trabajo tiene varias limitaciones. En algunos pacientes no se realizaron todas las pruebas diagnósticas disponibles, sobre todo en aquellos muy ancianos y con una situación basal deteriorada. En concreto, no se hizo RM cerebral a todos los pacientes y en algunos no se exploró la arteria carótida extracraneal. Tampoco se realizó arteriografía cerebral en todos los casos con diagnóstico incierto.
Se puede concluir que la HSAc es una rara patología cerebrovascular con numerosas etiologías. En nuestra serie las causas más frecuentes son la angiopatía amiloide, el ictus isquémico y las vasculitis. Su pronóstico es peor que otras HSA no aneurismáticas. En el anciano existe mayor riesgo de hemorragia intracraneal y deterioro cognitivo por su frecuente relación con la AAC.
Conflicto de interesesEste trabajo no ha recibido ninguna financiación y los autores declaran no tener conflicto de intereses.
Este trabajo fue presentado en la LXVIII Reunión Anual de la SEN.