Determinar la frecuencia de pacientes con NORSE y FIRES tratados con inmunoterapia (IT) que lograron un buen pronóstico funcional.
MétodosRealizamos una revisión sistemática de la literatura a través de MedLine y EMBASE. Se incluyeron aquellos estudios con≥5 pacientes con NORSE o FIRES, al menos un paciente tratado con IT y donde pudiera extraerse información sobre el buen pronóstico funcional. Un buen pronóstico funcional se definió como una puntuación en la escala Rankin modificada≤2 o equivalente (i. e. independiente) en el último seguimiento disponible. Solo se incluyeron para el análisis los pacientes con pronóstico funcional conocido.
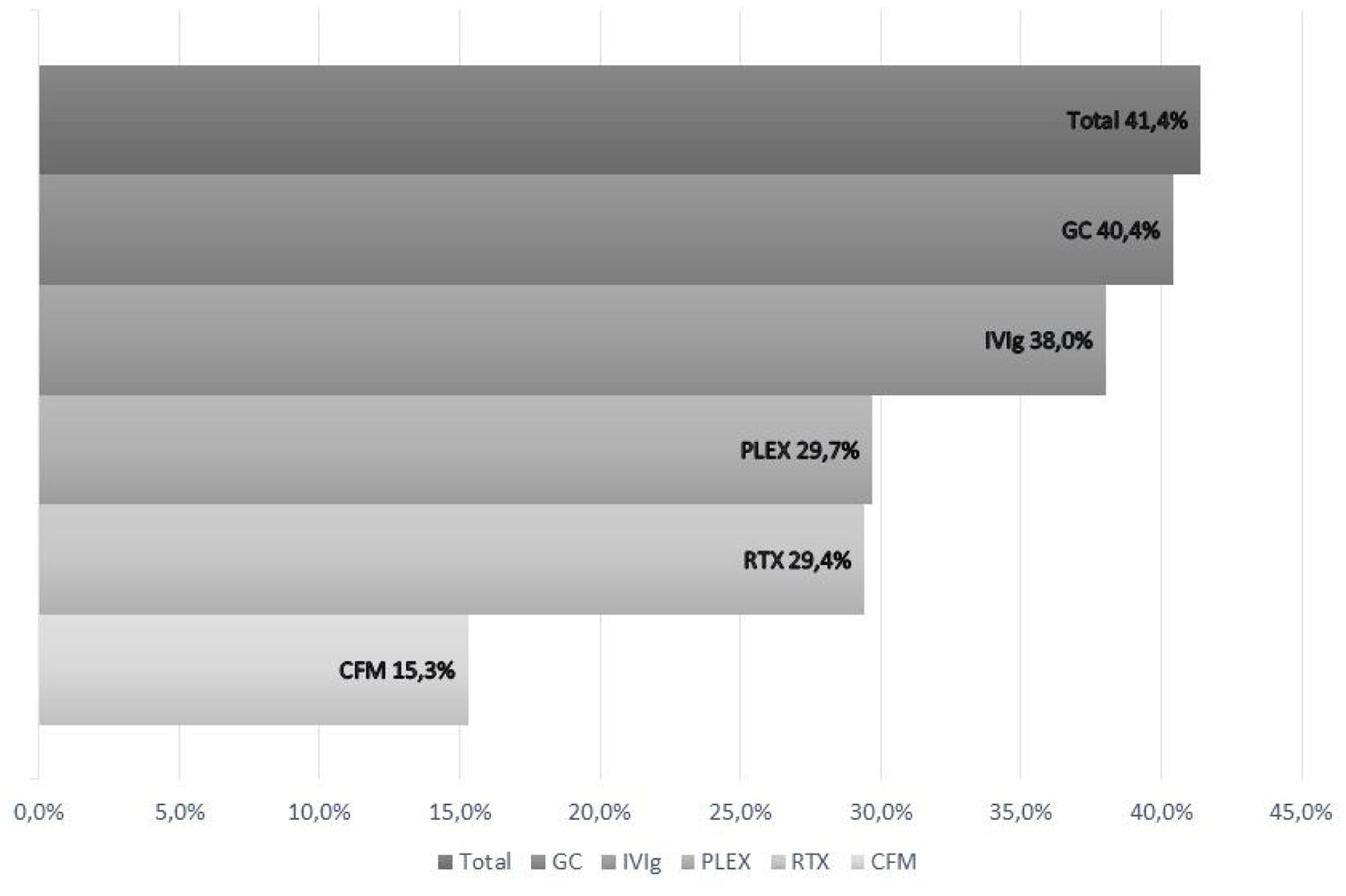
ResultadosSe incluyeron 16 estudios (FIRES 6/16 estudios) con un total de 161 pacientes, de los cuales 141 (87,5%) recibieron IT. De un total de 135 pacientes que recibieron IT y pudo obtenerse datos sobre el pronóstico 56 (41,4%) lograron un buen pronóstico funcional. Los pacientes tratados con IT de los estudios de FIRES lograron un buen pronóstico funcional en 24/58 (41,3%). La mortalidad en los pacientes tratados con IT de los estudios NORSE y FIRES fue de 20/121 (16,5%) y 6/58 (10,3%) respectivamente. Para cada tipo de IT se logró un buen resultado funcional en 36/89 (40,4%) para glucocorticoides, 27/71 (38%) IgIV, 11/37 (29,7%) recambio plasmático, 5/17 (29,4%) rituximab y 2/13 (15,3%) ciclofosfamida.
ConclusiónAunque en el momento actual no existan ensayos clínicos aleatorizados el uso de IT en NORSE y FIRES es frecuente. Sin embargo, a pesar de su uso la mayoría de los pacientes con NORSE y FIRES permanecen en situación de dependencia y la mortalidad es alta. Las terapias de segunda línea obtuvieron una menor frecuencia de buen pronóstico, probablemente porque se utilizaron en pacientes con enfermedad más grave y refractaria.
To determine the frequency of good functional outcomes in patients with NORSE and FIRES treated with immunotherapy.
MethodsWe performed a systematic search of the MedLine and EMBASE databases to gather studies including at least 5 patients with NORSE or FIRES and at least one patient treated with immunotherapy, and reporting functional outcomes. Good functional outcome was defined as a modified Rankin Scale (mRS) score ≤ 2 (or an equivalent measure) at the last available follow-up assessment. Only patients with known functional outcomes were included in the analysis.
ResultsWe analysed 16 studies, including a total of 161 patients with NORSE (10 studies) and 64 patients with FIRES (6 studies). Of the 161 patients with NORSE, 141 (87.5%) received immunotherapy. Outcome data were available for 135, 56 of whom (41.4%) achieved good functional outcomes. Twenty-four of the 58 patients with FIRES treated with immunotherapy and for whom outcome data were available achieved good functional outcomes (41.3%). Mortality rates in patients with NORSE and FIRES treated with immunotherapy were 20/121 (16.5%) and 6/58 (10.3%), respectively. By type of immunotherapy, good functional outcomes were achieved in 36/89 patients receiving glucocorticoids (40.4%), 27/71 patients receiving IV immunoglobulins (38%), 11/37 patients treated with plasma exchange (29.7%), 5/17 patients receiving rituximab (29.4%), and 2/13 patients receiving cyclophosphamide (15.3%).
ConclusionDespite the lack of randomised clinical trials, immunotherapy is frequently prescribed to patients with NORSE and FIRES. However, rates of functional dependence and mortality remain high in these patients. Second-line therapies achieved lower rates of good outcomes, probably because they were administered to patients with more severe, refractory disease.
El estatus epiléptico refractario de inicio reciente, new onset refractory status epilepticus (NORSE), se trata de una forma de presentación clínica y no de una enfermedad en concreto, pudiendo tener diversas etiologías1. En 2018 se publicó un documento de consenso2 en el cual se definió NORSE como aquel estatus epiléptico refractario que aparece en un paciente sin epilepsia activa o enfermedad neurológica previa, y en el que no es posible identificar una causa mediante la «batería inicial» de pruebas diagnósticas realizadas durante las primeras 72horas. Cuáles son las pruebas complementarias consideradas como «iniciales» aún es motivo de debate3. Tras una batería de pruebas diagnósticas más extensa en hasta en un 50% de los casos de NORSE puede finalmente alcanzarse un diagnóstico etiológico, siendo las causas más frecuentes las de origen autoinmune (encefalitis autoinmunes) y paraneoplásicas4. Los casos en los que no puede encontrarse una causa son los denominados NORSE criptogénicos (C-NORSE). El C-NORSE presenta ciertas características clínicas que lo diferencian del NORSE de origen autoinmune, como es la alta frecuencia de proceso febril prodrómico y en varios estudios un peor pronóstico a largo plazo5.
El síndrome epiléptico relacionado con infección febril, febrile infection-related epilepsy syndrome (FIRES), se trataría de un subtipo de NORSE6 con unas características especiales que permiten considerarlo como una entidad. La característica principal y necesaria para su diagnóstico es que el estatus epiléptico debe precederse de una enfermedad febril (por ejemplo cuadro gripal) y en el que la fiebre haya tenido lugar entre 14 días y 24 horas previas al comienzo del estatus2. Este rango de tiempo hace posible distinguirlo en la práctica clínica de un estatus epiléptico febril7. Otra característica es que suele presentarse en edad pediátrica (media de 8 años de edad) y es más frecuente en varones. Varios estudios le confieren un mal pronóstico, de modo que un 90% de los que sobreviven desarrollan una epilepsia refractaria, menos de un 20% queda libre de secuelas6 y más de un 10% fallece en la fase aguda8. En la mayoría de los casos de FIRES no es posible encontrar una etiología. La baja frecuencia de anticuerpos antineuronales, y una respuesta subóptima a la inmunoterapia (IT)9 hace más probable que el FIRES se trate de un proceso autoinflamatorio10.
Dado que un gran porcentaje de NORSE son debidos a encefalitis autoinmunes y que en los casos de C-NORSE y FIRES se presupone una etiología autoinflamatoria, esta entidad suele tratarse de manera precoz con IT una vez descartada una infección11. No obstante, la evidencia sobre su eficacia se basa en estudios retrospectivos o case reports dada la ausencia actual de ensayos clínicos, siendo el método para medir su eficacia variable entre los diferentes trabajos, muchas veces basándose en el cese del estatus, pero sin valorar el pronóstico funcional a largo plazo9. El objetivo de esta revisión sistemática fue sintetizar la evidencia actual para determinar cuántos pacientes con NORSE y FIRES tratados con IT alcanzan un buen pronóstico funcional (independencia funcional, mRS≤2 o equivalente).
MétodosEstrategia de búsqueda y selección de los estudiosSe realizó una búsqueda sistemática en Medline y Embase hasta el 1 de diciembre de 2021, sin restringir la búsqueda a ningún idioma. La estrategia de búsqueda incluyó los términos MeSH y texto libre: “NORSE” OR “New Onset Refractory Status Epilepticus” OR “FIRES” OR “Febrile Infection-Related Epilepsy Syndrome” AND “Immunotherapy” OR “Immunotherapies”OR “Therapeutic” OR “Therapy” OR “Therapies” OR “Treatment” OR “Treatments” (tabla suplementaria 1). Además, se realizó una búsqueda secundaria libre en Medline y Embase con los términos NORSE, outcome y treatment. También se incluyó como revisión secundaria artículos detectados en la lectura de los artículos seleccionados. El protocolo de revisión fue desarrollado de acuerdo con la declaración Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA). Las estrategias de búsqueda fueron realizadas por 2 investigadores (C-G, P y M-V, N) que independientemente revisaron los títulos, resúmenes de artículos y los criterios de selección. Los desacuerdos entre los revisores sobre la inclusión/exclusión de estudios se resolvieron mediante consenso o con la ayuda de un tercer revisor (S-C, P).
Criterios de inclusión y exclusiónSe incluyeron tan solo estudios originales en forma de ensayos clínicos, estudios observacionales (transversales, cohortes, estudio caso-control y series de casos) y casos clínicos con≥5 pacientes y en los que se pudiera obtener datos pronósticos en forma de independencia funcional. Dependiendo del tipo de participante se incluyeron los estudios con pacientes con diagnóstico de NORSE y/o FIRES según el documento de consenso de la ILAE de 20182; se excluyeron aquellos estudios con falta de datos de respuesta a la misma en forma de pronóstico funcional. Según el tipo de intervención se seleccionaron los estudios en los que al menos un paciente hubiera recibido algún tipo de inmunoterapia IT.
Objetivo y variablesLa medida de resultado principal fue respuesta a IT, medida como el número (porcentaje) de pacientes con un pronóstico funcional en la escalada modificada de Rankin≤2 o equivalente (paciente independiente, a pesar de las secuelas) en el último seguimiento disponible.
Como desenlaces secundarios se incluyó respuesta a IT en el subgrupo de FIRES (subgrupo formado por los pacientes incluidos en el estudio exclusivo de FIRES), porcentaje de fallecimientos en pacientes tratados con IT y respuesta por cada tipo individual de IT. Además, se comparó mediante análisis Chi cuadrado el porcentaje de buen pronóstico y mortalidad entre pacientes tratados con IT y no tratados con IT.
Extracción de datos y evaluación de sesgosLos artículos cuyos títulos o resúmenes coincidían con los criterios de inclusión fueron leídos en su totalidad. El fallo de alguno de los criterios de elegibilidad fue suficiente para excluir un estudio. Cualquier desacuerdo en la inclusión de un estudio fue resuelto por consenso entre los 2 revisores y con la ayuda de un tercer revisor. Dos revisores extrajeron los datos de los documentos de forma independiente en forma de informe. El nivel de la evidencia se evaluó mediante el sistema de calificación Scottish Intercollegiate Guidelines Network.
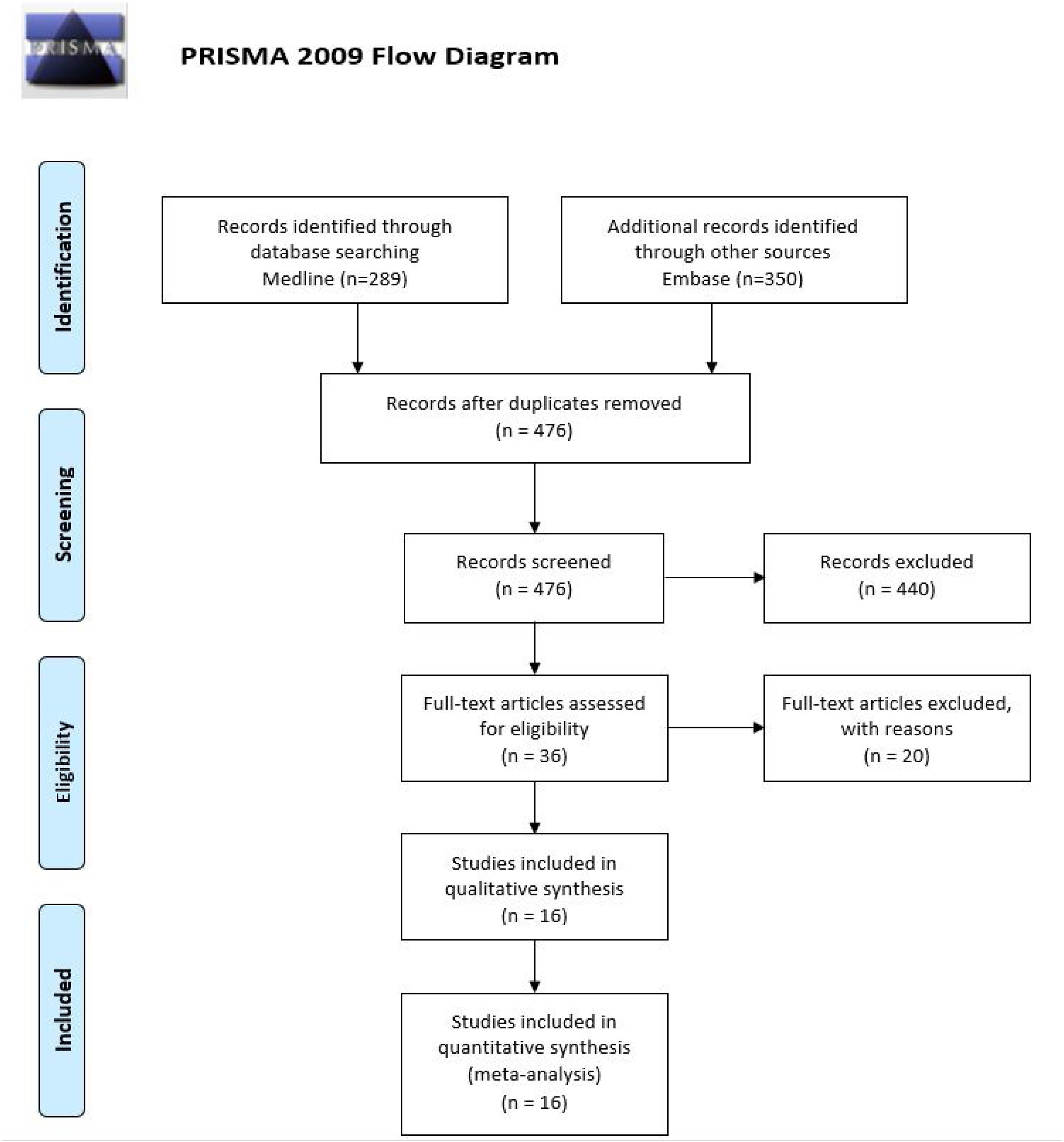
ResultadosBúsquedaSe identificaron mediante la búsqueda sistemática 639 artículos publicados entre 1988 y 2021; se eliminaron 163 duplicados, 440 tras la lectura del título y el resumen y 20 tras la lectura completa del artículo reflejándose la causa de exclusión (tabla suplementaria 2). Quedaron finalmente 16 artículos que cumplieron los criterios de selección establecidos y que constituyeron el foco de esta revisión sistemática (fig. 1).
Todos los estudios incluidos fueron series de casos retrospectivos. Un total de 6/16 estudios fueron realizados exclusivamente en pacientes con FIRES. De los 161 pacientes con NORSE que estaban descritos en los diferentes estudios seleccionados, un total de 141 (87,5%) pacientes habían recibido IT, de los cuales se incluyeron 135/141 (95,7%) pacientes en los cuales se podían obtener datos sobre el pronóstico funcional. De los 20/161 pacientes (12,4%) incluidos que no habían recibido inmunoterapia, en todos los casos se podían obtener datos sobre el pronóstico funcional. De los estudios realizados exclusivamente en pacientes con FIRES se incluyeron un total de 64 pacientes, de los cuales 63/64 (98,4%) recibieron IT y se incluyeron en el estudio 58/63, de los que se podían obtener datos sobre pronóstico funcional (tabla 1).
Características de los estudios incluidos
| Estudio | Población | Inmunoterapia (IT) | Resultado | CE |
|---|---|---|---|---|
| Horino et al.12, 2021 | FIRESN=6 pacientesVarones: 5/6 pacientes (83,3%)Rango de edad entre 4 y 8 años | N=6/6 pacientes (100%)Por tipo IT:GC=6/6 pacientes (100%)IVIg=6/6 pacientes (100%)Dexametasona intratecal=6/6 pacientes (100%) | Buen pronóstico total IT=1/6 pacientes (16,6%)Buen pronóstico por tipo IT:GC=1/6 pacientes (16,6%)IVIg=1/6 pacientes (16,6%)Dexametasona intratecal=1/6 pacientes (16,6%)Mortalidad IT=0/6 (0%) | 2- |
| Nass et al.13, 2021 | FIRESN=6 pacientesVarones: 1/6 pacientes (16,6%)Rango de edad entre 17 y 51 años | N=6/6 pacientes (100%)Por tipo IT:GC=6/6 pacientes (100%)IVIg=5/6 pacientes (83,3%)PLEX=3/6 pacientes (50,0%)RTX=1/6 pacientes (16,6%)CFM=1/6 pacientes (16,6%) | Buen pronóstico total IT=4/6 pacientes (66,6%)Buen pronóstico por tipo IT:GC=4/6 pacientes (66,6%)IVIg=3/5 pacientes (60,0%)PLEX=2/3 pacientes (66,6%)RTX=1/1 pacientes (100%)CFM=1/1 pacientes (100%)Mortalidad IT = 0/6 (0%) | 2- |
| Suchdev et al.14, 2021 | NORSEN=5 pacientesVarones=2 (40%)Edad entre 20 y 56 años | N=3/5 pacientes (60%)Por tipo IT:GC=3/5 pacientes (60%)IVIg=1/3 pacientes (33,3%)PLEX=2/3 pacientes (66,6%)CFM=2/3 pacientes (66,6%) | Buen pronóstico total IT=1/3 pacientes (33,3%)Buen pronóstico por tipo IT:GC=1/3 pacientes (33,3%)IVIg=0/1 pacientes (0%)PLEX=0/2 pacientes (0%)CFM=0/2 pacientes (0%)Mortalidad IT=1/3 (33,3%)Buen pronóstico no IT=1/2 pacientes (50%)Mortalidad no IT=0/2 (0%) | 2- |
| Aurangzeb et al.15, 2020 | NORSEN=7 pacientesVarones=4/7 pacientes (57,1%)Media de edad (DS) 43 años (23,8) | N=6/7 pacientes (85,7%)Por tipo IT:GC=6/6 pacientes (100%)IVIg=3/6 pacientes (50%)PLEX=3/6 pacientes (50%) | Buen pronóstico total IT=0/5 pacientes (0%)Buen pronóstico por tipo IT:GC=0/5 pacientes (0%)IVIg=0/2 pacientes (0%)PLEX=0/3 pacientes (0%)Mortalidad IT=3/5 (50%)Buen pronóstico no IT=0/1 pacientes (0%)Mortalidad no IT=0/1 (0%) | 2- |
| Gugger et al.16, 2020 | NORSEN=20 pacientesVarones=10/20 pacientes (50%)Mediana (RIC) de edad en años=50,5 (29,0-69,5) | N=14/20 pacientes (70%)Por tipo IT:GC=14/14 pacientes (100%)IVIg=3/14 pacientes (15%)PLEX=11/14 pacientes (55%)RTX=1/14 pacientes (5%)CFM=2/14 pacientes (10%) | Buen pronóstico total IT=6/14 pacientes (42,8%)Buen pronóstico por tipo IT=N/AMortalidad IT=N/ABuen pronóstico no IT=2/6 pacientes (33,3%)Mortalidad no IT=N/A | 2+ |
| Lai et al.17, 2020 | FIRESN=25 pacientesVarones=17/25 pacientes (68%)Mediana (RIC) de edad en años=8 (5,0-11,0) | N=25/25 pacientes (100%)Por tipo IT:GC=22/25 pacientes (88%)IVIg=23/25 pacientes (92%)PLEX=11/25 pacientes (44%)RTX=5/25 pacientes (2%)CFM=2/14 pacientes (10%)Anakinra=25/25 pacientes (100%) | Buen pronóstico total IT=6/20 pacientes (30%)Buen pronóstico por tipo ITAnakinra=6/20 pacientes (30%)Resto tipos de IT=N/AMortalidad IT=3/20 (15%) | 2+ |
| Perea et al.18, 2020 | NORSEN=5 pacientesVarones= 1/5 pacientes (25%)Rango de edad entre 17 y 79 años | N=3/5 pacientes (60%)Por tipo IT:GC=2/3 pacientes (75%)PLEX=3/3 pacientes (100%)RTX=1/3 pacientes (25%)CFM=1/3 pacientes (25%) | Buen pronóstico total IT=1/3 pacientes (25%)Buen pronóstico por tipo ITGC=0/2 pacientes (0%)PLEX=1/3 pacientes (25%)RTX=0/1 pacientes (0%)CFM=0/1 pacientes (0%)Mortalidad IT=1/3 pacientes (25%)Buen pronóstico no IT=0/2 pacientes (0%)Mortalidad no IT=1/2 pacientes (50%) | 2- |
| Strohm et al.19, 2019 | NORSEn=12 pacientesVarones=2/12 pacientes (16,6%)Rango de edad entre 14 y 78 años | n=12/12 pacientes (100%)Por tipo IT:GC=12/12 pacientes (100%)IVIg=8/12 pacientes (66,6%)PLEX=7/12 pacientes (58,3%)RTX=3/12 pacientes (25%)CFM=1/12 pacientes (8,3%) | Buen pronóstico total IT = 7/12 pacientes (58,3%)Buen pronóstico por tipo ITGC=7/12 pacientes (58,3%)IVIg=5/8 pacientes (62,5%)PLEX=3/7 pacientes (42,8%)RTX=0/3 pacientes (0%)CFM=0/1 pacientes (0%)Mortalidad IT=1/12 pacientes (8,3%) | 2- |
| Choi et al.20, 2019 | NORSEN=13 pacientesVarones=7/13 pacientes (53,8%)Mediana (RIC) de edad en años=45,0 (33,0-50,5) | N=13/13 pacientes (100%)Por tipo IT:GC=13/13 pacientes (100%)IVIg=13/13 pacientes (100%)PLEX=6/13 pacientes (46,2%)RTX=2/13 pacientes (15,3%) | Buen pronóstico total IT=6/13 pacientes (46,1%)Buen pronóstico por tipo ITGC=6/13 pacientes (46,1%)IVIg=6/13 pacientes (46,1%)PLEX=2/6 pacientes (33,3%)RTX=2/2 pacientes (100%)Mortalidad IT=3/13 pacientes (23,1%) | 2- |
| Peng et al.21, 2019 | FIRESn=7 pacientesVarones=4/7 pacientes (57,1%)Rango de edad entre 1,5 y 13 años | N=7/7 pacientes (100%)Por tipo IT:GC=5/7 pacientes (71,4%)IVIg=7/7 pacientes (100%)PLEX=2/7 pacientes (28,5%) | Buen pronóstico total IT=4/7 pacientes (57,1%)Buen pronóstico por tipo ITGC=3/5 pacientes (60%)IVIg=4/7 pacientes (57,1%)PLEX=1/2 pacientes (50%)Mortalidad IT=0/7 pacientes (0%) | 2- |
| Jun et al.22, 2018 | NORSEn=7 pacientesVarones=3/7 pacientes (42,8%)Rango de edad entre 19 y 61 años | IT=7/7 pacientes (100%)Por tipo IT:GC=7/7 pacientes (100%)IVIg=7/7 pacientes (100%)RTX=6/7 pacientes (85,7%)CFM=2/7 pacientes (28,5%)Tocilizumab=7/7 pacientes (100%) | Buen pronóstico total IT=1/7 pacientes (14,2%)Buen pronóstico por tipo ITGC=1/7 pacientes (14,2%)IVIg=1/7 pacientes (14,2%)RTX=1/6 pacientes (16,6%)CFM=0/2 pacientes (0%)Tocilizumab=1/7 pacientes (14,2%)Mortalidad IT=2/7 pacientes (28,5%) | 2- |
| Farias-Moeller et al.23, 2018 | FIRESN=5 pacientesVarones=3/5 pacientes (60%)Rango de edad entre 4 y 16 años | N=5/5 pacientes (100%)Por tipo IT:GC=5/5 pacientes (100%)IVIg=5/5 pacientes (100%)PLEX=4/5 pacientes (80%)RTX=4/5 pacientes (80%)CFM=1/5 pacientes (25%)Anakinra=4/5 pacientes (80%) | Buen pronóstico total IT=2/5 pacientes (40%)Buen pronóstico por tipo ITGC=2/5 pacientes (40%)IVIg=2/5 pacientes (40%)PLEX=1/4 pacientes (25%)RTX=1/4 pacientes (25%)CFM=0/1 pacientes (0%)Anakinra=1/4 pacientes (25%)Mortalidad IT = 0/5 pacientes (0%) | 2- |
| Iizuka et al.5, 2017 | NORSEn=11 pacientesVarones=4/11 pacientes (36,3%)Mediana (RIC) de edad en años de 27,0 (17,0-59,0) | N=10/11 pacientes (91%)Por tipo IT:GC=10/10 pacientes (100%)IVIg=9/10 pacientes (90%)PLEX=6/10 pacientes (60%)CMF=5/10 pacientes (50%) | Buen pronóstico total IT=2/10 pacientes (20%)Buen pronóstico por tipo ITGC=2/10 pacientes (20%)IVIg=2/9 pacientes (22,2%)PLEX=0/6 pacientes (0%)CFM=1/5 pacientes (20%)Mortalidad IT=1/10 pacientes (10%)Buen pronóstico no IT=1/1 pacientes (100%)Mortalidad no IT=0/1 pacientes (0%) | 2- |
| Patil et al.24, 2016 | FIRESN=15 pacientesVarones=12/15 pacientes (80%)Mediana (RIC) de edad en años de 6,0 (3,0-15,0) | N=14/15 pacientes (93,3%)Por tipo IT:GC=13/14 pacientes (92,8%)IVIg=7/14 pacientes (50%) | Buen pronóstico total IT=7/14 pacientes (50%)Buen pronóstico por tipo ITGC=7/13 pacientes (53,8%)IVIg=2/7 pacientes (28,5%)Mortalidad IT=3/14 pacientes (21,4%)Buen pronóstico no IT=1/1 pacientes (100%)Mortalidad no IT=0/1 pacientes (0%) | 2+ |
| Khawaja et al.25, 2015 | NORSEN=11 pacientesVarones=2/11 pacientes (18,1%)Media (DS) de edad en años de 48,0 (21,9) | N=8/11 pacientes (72,7%)Por tipo IT:GC=7/8 pacientes (87,5%)IVIg=7/8 pacientes (87,5%)PLEX=4/8 pacientes (50%)RTX=2/8 pacientes (25%)CFM=1/8 pacientes (12,5%) | Buen pronóstico total IT=6/8 pacientes (75%)Buen pronóstico por tipo IT=N/AMortalidad IT=2/8 pacientes (25%)Buen pronóstico no IT =0/3 pacientes (100%)Mortalidad no IT=1/3 pacientes (33%) | 2- |
| Costello et al.26, 2009 | NORSEN=6 pacientesVarones=2/6 pacientes (33,3%)Rango de edad entre 24-36 años | N=2/6 pacientes (33,3%)Por tipo IT:GC=2/2 pacientes (100%)IVIg=1/2 pacientes (50%)PLEX=1/2 pacientes (50%) | Buen pronóstico total IT=2/2 pacientes (100%)Buen pronóstico por tipo ITGC=2/2 pacientes (100%)IVIg=1/1 (100%)PLEX=1/1 (100%)Mortalidad IT=0/2 pacientes (0%)Buen pronóstico no IT=1/4 pacientes (25%)Mortalidad no IT=1/4 pacientes (25%) | 2- |
CE: calidad de la evidencia mediante el sistema de calificación Scottish Intercollegiate Guidelines Network; CFM: ciclofosfamida; GC: glucocorticoides sistémicos; IVIg: inmunoglobulinas intravenosas; PLEX: plasmaféresis; RTX: rituximab.
Hubo un mayor número (%) de pacientes que habían recibido IT en comparación con los que no tomaron IT que presentaron buen pronóstico (56/135 [41,4%] vs. 6/20 [30,0%]; p=0,328), así como una menor mortalidad (20/121 [16,5%] vs. 3/14 [21,0%]; p=0,644), aunque estas diferencias no alcanzaron la significación estadística.
Por tipo de inmunoterapia recibida obtuvieron un buen pronóstico 36/89 pacientes (40,4%) que recibieron glucorticoides sistémicos (GC); 27/71 (38,0%) inmunoglobulinas intravenosas (IVIg); 11/37 (29,7%) plasmaféresis (PLEX); 5/17 (29,4%) rituximab y 2/13 (15,3%) ciclofosfamida (CFM) (fig. 2).
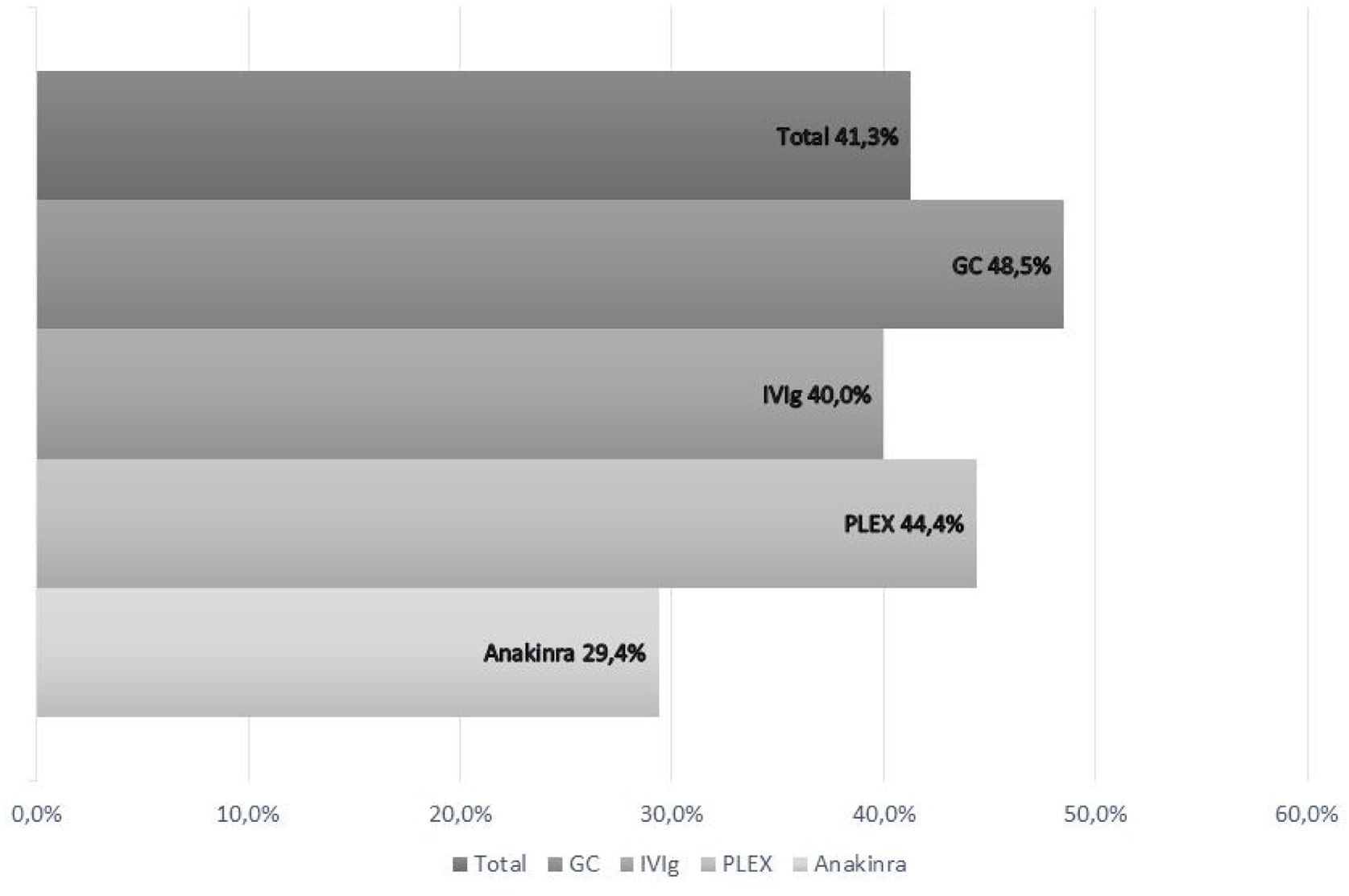
Pronóstico tras inmunoterapia en febrile infection-related epilepsy syndromeDel total de los pacientes incluidos que habían recibido IT (n=58) 24/58 pacientes (41,3%) presentaron buen pronóstico, 34/58 (58,6%) mal pronóstico y 6/58 (10,3%) presentaron mortalidad.
Por tipo de inmunoterapia recibida obtuvieron un buen pronóstico 17/35 pacientes (48,5%) que recibieron GC sistémicos; 12/30 (40,0%) IVIg; 4/9 (44,4%) PLEX; 7/24 (29,1%) anakinra (fig. 3).
DiscusiónEn esta revisión sistemática hemos tratado de conocer el pronóstico funcional de los pacientes con NORSE y FIRES que han sido tratados con IT. En este sentido, la mayoría de los pacientes con NORSE presentaron un mal pronóstico funcional a pesar del uso de IT (58,5%). El porcentaje de pacientes que consiguió un buen pronóstico fue mayor con IT que sin ella (41,4% vs. 30%), aunque estas diferencias no fueron significativas probablemente en parte debido a que el número de pacientes que no recibió IT fue bajo.
La mayoría de los pacientes incluidos en nuestro estudio (87,5%) había recibido algún tipo de IT. Este porcentaje, algo mayor de pacientes tratados con IT en comparación con otros estudios con un amplio número de pacientes4, puede ser debido en parte a que en nuestros criterios de inclusión para los estudios debía haber al menos un paciente con IT. Sin embargo, es objetivo que existe un frecuente uso de IT en NORSE sin disponer de evidencia de alta calidad, lo que pone de manifiesto la necesidad de realizar ensayos clínicos bien diseñados sobre la eficacia y seguridad de IT en NORSE y FIRES, sobre todo porque son varios los trabajos retrospectivos donde no se ha objetivado beneficio en el pronóstico. Por ejemplo, en el trabajo de Gaspard et al.4, donde el 62% de los pacientes había recibido algún tipo de IT, no se encontraron diferencias pronósticas en su uso, pero existía una tendencia a no tratar a pacientes con C-NORSE que podrían haber tenido una base inflamatoria y haberse beneficiado de IT. Tampoco se encontraron diferencias en una serie de 92 pacientes con NORSE pediátrico27. En un trabajo sobre NORSE en edad pediátrica en el que se incluyeron 40/46 pacientes con NORSE criptogénico, de los cuales 16 correspondían a FIRES7, el uso de IT se asoció a un peor pronóstico, explicado por el hecho de que la mayoría de pacientes que recibió IT estaba en el grupo de FIRES, considerándose esta categoría de mal pronóstico. En cambio, otros trabajos sí han objetivado un mejor desenlace con el uso de IT25, que junto al hecho de que muchos casos se deban o presupongan de origen inmunomediado ha contribuido al uso extendido de IT en NORSE.
Por otro lado, hemos observado que la mortalidad en pacientes tratados con IT es de aproximadamente un 50% mayor en aquellos con NORSE (16,5%) respecto aquellos con FIRES (10,3%). El FIRES se considera una subcategoría homogénea de causa autoinflamatoria, mientras que la etiología del NORSE es variable. Se podría por tanto pensar que esta menor mortalidad en el FIRES en parte sea debido a la eficacia de un tratamiento dirigido. Diferencias similares en la mortalidad entre NORSE en edad pediátrica y edad adulta se han descrito en la literatura, siendo del 12% y 16-27% respectivamente, y pudiendo ser una explicación que el FIRES suele ser la forma de presentación del NORSE en población pediátrica11.
En cuanto a los tipos individuales de IT cualquiera de las terapias de segunda línea obtuvo una probabilidad de pronóstico favorable menor que las de primera línea (corticoides sistémicos, IVIg y PLEX). Esto probablemente se deba a que se recurre a terapias de segunda línea para pacientes más graves y refractarios, y por lo tanto con un peor pronóstico de base. Por ejemplo, en el estudio de Lai et al.17 se analiza la eficacia de anakinra en 25 pacientes con FIRES refractarios a varias IT de primera línea, obteniéndose un buen pronóstico solo en el 30% de los sujetos. También debemos tener en cuenta un posible aumento de complicaciones infecciosas con el uso de terapias de segunda línea como contribuyente a una menor probabilidad de buen pronóstico, aunque esto no ha sido analizado en nuestro estudio.
Nuestro trabajo tiene varias limitaciones. En primer lugar, debido a nuestros criterios de inclusión no hemos seleccionado estudios que contaban con un número considerable de pacientes, por ofrecer datos suficientes para obtener nuestra variable principal sobre pronóstico funcional4,7,27. Esto pone de manifiesto que se requiere un futuro consenso para establecer las variables más relevantes para determinar la eficacia de las terapias en NORSE, y en concreto qué escalas y puntaciones utilizar para obtener desenlaces sobre pronóstico. Por otro lado, de la mayoría de los estudios incluidos no ha sido posible obtener la secuencia ni los tipos individuales de IT utilizadas por cada paciente, que ha impedido realizar análisis estadísticos para determinar si existen diferencias significativas entre los diferentes tipos de IT, ni tampoco poder extraer los datos de manera individual de pacientes con FIRES en estudios de NORSE. Por último, el período de seguimiento no ha sido homogéneo entre los diferentes estudios, y por tanto el momento de obtención del dato de pronóstico funcional entre los diferentes estudios ha sido variable. Sin embargo, se ha tenido en cuenta en todos ellos el dato más reciente disponible, al tratarse del más fiable a la evolución pronóstica del paciente.
En conclusión, el uso de IT en NORSE y FIRES es muy frecuente a pesar de la ausencia de ensayos clínicos bien diseñados que avalen su eficacia y seguridad. Asimismo, la IT podría proporcionar una mayor probabilidad de independencia funcional comparado con aquellos que no lo han recibido, pero es prioritario disponer de estudios con un mayor nivel de evidencia. Las terapias de segunda línea han obtenido una menor probabilidad de un buen pronóstico, probablemente porque se utiliza en pacientes refractarios y con una enfermedad más grave. A pesar del uso de IT la mayoría de los pacientes con NORSE y FIRES quedan en una situación de dependencia y la mortalidad es elevada.
Conflicto de interesesLos autores no presentan conflicto de intereses relacionados con esta publicación.