El síndrome de piernas inquietas (SPI) es un trastorno caracterizado por la necesidad imperiosa de mover las piernas, estando a menudo acompañado de sensaciones desagradables. Su frecuencia es superior en pacientes con esclerosis múltiple (EM) que en la población general.
ObjetivosEvaluar la prevalencia del SPI, según el cumplimiento de los 4 requisitos esenciales incluidos en los criterios diagnósticos propuestos por la International Restless leg syndrome study group (IRLSSG, 2003), en una cohorte de pacientes con EM e identificar posibles factores de riesgo y repercusión clínica.
ResultadosSe incluyeron 120 pacientes con EM, con una edad media de inicio de 40 años y un tiempo medio de evolución de 46 meses. La prevalencia de SPI, según el cumplimiento de criterios diagnósticos de la IRLSSG, fue del 23,3%. El tiempo de evolución de EM, desde la aparición de los primeros síntomas, fue significativamente menor en pacientes con SPI (p=0,001). La presencia de un brote reciente, así como de síntomas de ansiedad, depresión y dolor neuropático se asociaron de forma significativa con el riesgo de SPI (p=0,001, p<0,001, p<0,001 y p=0,001, respectivamente). Además, los pacientes con SPI y EM presentaron mayor riesgo de mala calidad de sueño, fatiga, somnolencia diurna y peor calidad de vida, que aquellos sin SPI (p=0,002, p=0,017, p=0,013 y p=0,009, respectivamente).
ConclusionesEl SPI debe ser considerado en la evaluación neurológica de pacientes con EM, cuyo diagnóstico y tratamiento precoz mejoraría la calidad de vida de estos sujetos.
Restless legs syndrome (RLS) is a disorder characterised by an irresistible urge to move the legs, usually accompanied by unpleasant sensations. It is more frequent in patients with multiple sclerosis (MS) than in the general population.
ObjectivesTo evaluate the prevalence of RLS, defined according to the 4 essential requirements included in the diagnostic criteria proposed by the International Restless Leg Syndrome Study Group, in a cohort of patients with MS; and to identify potential risk factors and the clinical impact of RLS.
ResultsThe sample included 120 patients with MS, with a mean age of symptom onset of 40 years and an average disease duration of 46 months. The prevalence rate of RLS was 23.3%. MS progression time was significantly shorter in patients with RLS (P = 0.001). A recent relapse, and symptoms of anxiety, depression, and neuropathic pain were significantly associated with risk of RLS (P = 0.001, P < 0.001, P < 0.001, and P = 0.001, respectively). In addition, patients with RLS had a greater risk of poor sleep quality, fatigue, daytime sleepiness, and poor quality of life than those without RLS (P = 0.002, P = 0.017, P = 0.013, and P = 0.009, respectively).
ConclusionsRLS should be considered in the neurological evaluation of patients with MS; early diagnosis and treatment would improve the quality of life of patients with MS presenting RLS.
La esclerosis múltiple (EM) es la enfermedad desmielinizante, crónica y multifocal del sistema nervioso central más frecuente1, que afecta a adultos jóvenes, siendo la segunda causa de discapacidad en este grupo de edad2. Clínicamente se caracteriza por síntomas y signos variables, según la localización de las lesiones en el neuroeje3. Sin embargo, existen otra serie de síntomas cuya topografía se desconoce y a los que suele atribuirse un origen multifactorial. Entre ellos destacan el deterioro cognitivo, el dolor, la fatiga y el síndrome de piernas inquietas (SPI)4,5.
El (SPI) es una patología frecuente, con una prevalencia que oscila entre el 4 y el 10% en la población general5,6, caracterizada por la necesidad imperiosa de mover las piernas, generalmente acompañada por una sensación desagradable, de dolor o malestar, cuyos síntomas aparecen en situaciones de inactividad y predominantemente durante la noche, mejorando con el movimiento. Su patogenia no está aclarada. Actualmente se diferencia entre SPI idiopático (familiar o esporádico) y secundario (asociado a situaciones que inducen déficit de hierro o alteración de su metabolismo, embarazo, insuficiencia renal crónica, enfermedad de Parkinson, etc.).
La prevalencia del SPI en la EM varía, según las series, oscilando entre un 12,1-57,5%7–15. Sin embargo, a pesar de los numerosos estudios que demuestran su mayor prevalencia en sujetos con EM, esta no ha sido aún considerada como una causa secundaria de SPI.
La identificación de los posibles factores de riesgo para el desarrollo de SPI en individuos con EM, así como la repercusión de su padecimiento, han sido objeto de varios trabajos en los últimos años. Se ha observado una tendencia de asociación entre el sexo femenino y la edad avanzada, sin llegar a alcanzar significación estadística11,14,16. También se ha descrito una asociación entre el desarrollo de discapacidad global y el riesgo de padecer SPI, y en particular, cuando existe una afectación de los sistemas piramidal y sensitivo11,17. La depresión y la ansiedad han sido consideradas igualmente como factores de riesgo para desarrollar SPI en pacientes con EM7. Así, se ha demostrado un mayor consumo de fármacos antidepresivos entre pacientes con EM y SPI frente a aquellos que no padecen esta última dolencia11. Sin embargo, existen otros trabajos en los que no se han reproducido estos resultados9. Por otro lado, se ha demostrado de manera consistente una mayor prevalencia de insomnio y somnolencia diurna en aquellos pacientes con EM que, además, sufren un SPI11.
A pesar del creciente interés suscitado en los últimos años sobre la probable relación del SPI y la EM, hasta el día de hoy solo se ha publicado un trabajo español que no confirmó dicha asociación18. Por este motivo, planteamos el desarrollo de un estudio con el fin de analizar la prevalencia del SPI en otra cohorte española de pacientes diagnosticados de EM, revisados en nuestro centro. Además, en el presente trabajo se ha pretendido evaluar la severidad del SPI e identificar los posibles factores de riesgo para su aparición en enfermos con EM, así como examinar su posible repercusión clínica en este grupo concreto de sujetos.
Sujetos y métodosEstudio observacional analítico, transversal, realizado en una cohorte de pacientes diagnosticados de EM según los criterios de McDonald 201019, llevado a cabo en la Unidad de Enfermedades Desmielinizantes del Hospital Universitario Virgen del Rocío entre octubre de 2014 y abril de 2016, en el que se evalúa la prevalencia de SPI, de acuerdo al cumplimiento de los 4 requisitos recogidos en los criterios diagnósticos propuestos por la International Restless leg syndrome study group (IRLSSG) en 2003, y actualmente vigentes5 (tabla 1).
Criterios diagnósticos de SPI propuestos por la International Restless leg syndrome study group (IRLSSG) en 2003
| 1. Necesidad imperiosa de mover las piernas con sensación de dolor o malestar |
| 2. Los síntomas aparecen y se agravan con la inactividad, sentado o tumbado |
| 3. Los síntomas desaparecen o mejoran con el movimiento |
| 4. Ritmo circadiano, de predominio al atardecer y anochecer |
Invitamos a participar a pacientes con diagnóstico de EM que acudían a la consulta, con edad superior a 14 años y de ambos sexos. Excluimos del estudio a aquellos sujetos con diagnóstico reciente de EM (menos de 1 mes), los que padecían además otra enfermedad neurológica, recibían tratamiento con fármacos dopaminérgicos o antidopaminérgicos, o sufrían alguna otra condición que pudiera causar SPI secundario (ferropenia conocida, insuficiencia renal, embarazo, etc.). Todos los pacientes participaron de forma voluntaria y anónima, previa firma del consentimiento informado. El estudio fue aprobado por el comité ético de nuestro centro.
En la misma visita y, con ayuda de un cuestionario elaborado específicamente para el desarrollo del estudio, examinamos los potenciales factores de riesgo de SPI y, finalmente, su posible repercusión clínica. Como factores de riesgo analizamos variables demográficas (edad en el momento de inclusión, sexo, tabaquismo), variables clínicas relacionadas con la EM (edad de comienzo de EM, forma evolutiva, duración de la enfermedad, presencia de brotes en los tres meses previos, grado de discapacidad según la escala EDSS, presencia de dolor neuropático, tratamiento con corticoides en los 3 meses previos, tratamiento modificador de la enfermedad y su horario de administración), y variables clínicas relacionadas con alteraciones del estado de ánimo. Para registrar la intensidad del dolor de tipo neuropático, que el paciente padecía basalmente, hicimos uso de una escala visual analógica (EVA) en la que «0» suponía ausencia de dolor y «10» definía el dolor máximo posible. Respecto a la evaluación de los trastornos del estado de ánimo, empleamos el inventario de depresión de Beck20 en el cual se establece el punto de corte en 14 para definir la existencia de depresión; y el inventario de ansiedad de Beck21, cuyo resultado superior a 21 se considera como indicativo de ansiedad. También recopilamos información sobre el uso de psicofármacos.
Evaluamos la repercusión clínica del SPI mediante la escala de severidad del SPI de la IRLS22,23 que mide los síntomas subjetivos de SPI. Consta de diez apartados puntuables cada uno de ellos en una escala de 0 a 4, que reflejan los siguientes aspectos: 1) intensidad de las molestias en miembros inferiores y superiores; 2) necesidad de movimiento; 3) mejoría con el movimiento; 4) trastornos del sueño por SPI; 5) fatiga y somnolencia diurna debido al SPI; 6) valoración global del SPI; 7) frecuencia de síntomas; 8) duración de los síntomas a lo largo de un día habitual; 9) impacto de los síntomas sobre las actividades diurnas; y 10) impacto de los síntomas sobre el estado de ánimo. Mediante la suma de estos apartados se obtiene una puntuación total que oscila entre 0 y 40. Los sujetos cuya puntuación está entre 1 y 10 sufren un SPI leve, entre 11 y 20 un SPI moderado, entre 21 y 30 un SPI intenso, y entre 31 y 40 un SPI muy intenso. Igualmente elaboramos un registro de la frecuencia semanal de aparición de sintomatología de SPI.
Para examinar la repercusión clínica del SPI realizamos el cuestionario de calidad de sueño de Pittsburgh (PSQI)24, en el cual una puntuación de al menos 5 puntos identifica a los sujetos con insomnio. La posible aparición de somnolencia diurna fue evaluada mediante la escala de Epworth (ESS)25, en la que un resultado entre 10 y 24 puntos se considera como marcador de hipersomnia. Con el fin de identificar la posible presencia de fatiga, empleamos la escala modificada del impacto de la fatiga (MFIS)26 cuyo punto de corte para discriminar su aparición es de 38. Finalmente, el impacto global del SPI en los pacientes del estudio fue analizado utilizando la escala de calidad de vida EuroQol5D (EQ-5D)27 con sus 5 dimensiones (movilidad, autocuidado, actividades habituales, dolor/malestar y ansiedad/depresión).
Los análisis estadísticos se llevaron a cabo mediante el programa SPSS versión 19. Las variables cuantitativas continuas que seguían una distribución normal se describieron mediante medias y desviación estándar, mientras que las que no lo hacían se expresaron, además, mediante medianas y rango intercuartílico (P25-P75). Las variables cualitativas categóricas se describieron mediante frecuencia y porcentaje. Comparamos las distintas variables demográficas y clínicas entre los pacientes con EM con SPI y sin SPI mediante el test chi-cuadrado en el caso de variables cualitativas, la prueba t de Student en el de variables cuantitativas continuas con distribución normal, y la prueba U de Mann Whitney en el caso de variables cuantitativas continuas que no seguían dicha distribución normal. Para el cálculo de los odd ratios (OR) de las variables identificadas como factores de riesgo de la presencia de SPI, con sus correspondientes intervalos de confianza (IC) al 95%, se realizó un análisis de regresión de Cox univariante. Finalmente, para definir las condiciones que se asociaban con la aparición de SPI en los pacientes con EM de manera independiente, se realizó un análisis de regresión logística multivariante (método por pasos hacia atrás de Wald), incorporando aquellas variables que demostraron asociación significativa en el modelo univariante. Para todos los análisis realizados se consideraron niveles de significación estadística a una p≤0,05.
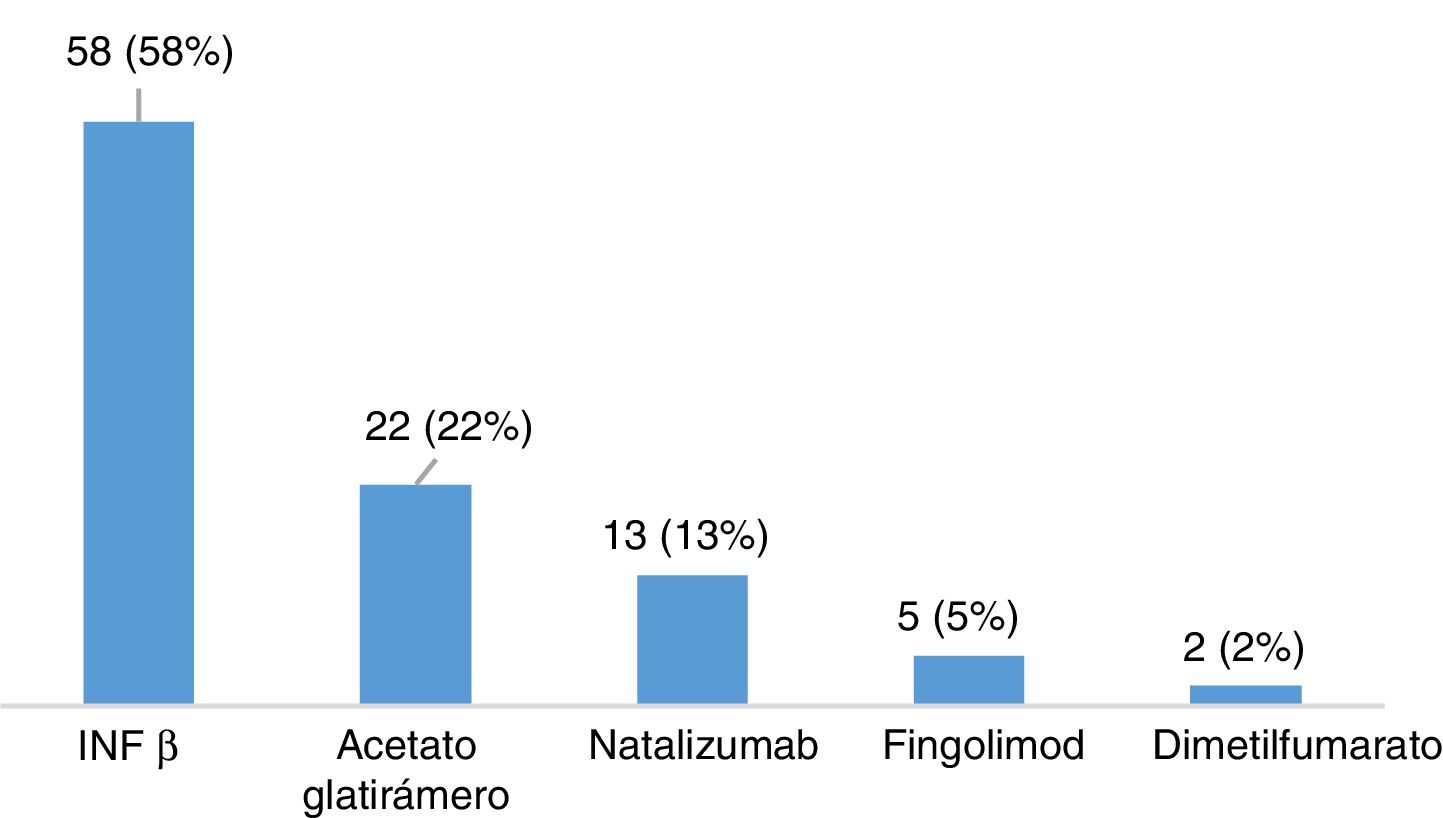
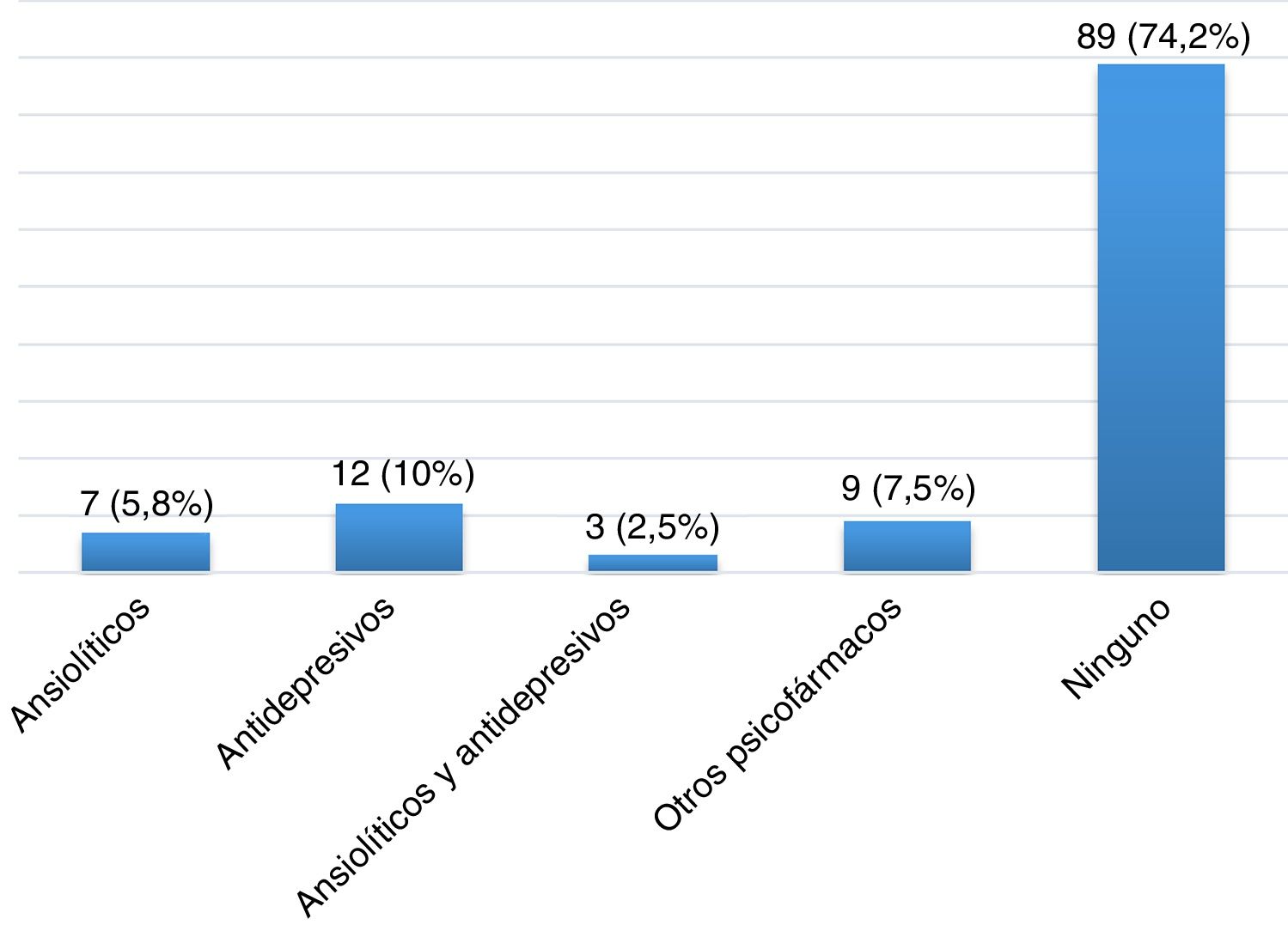
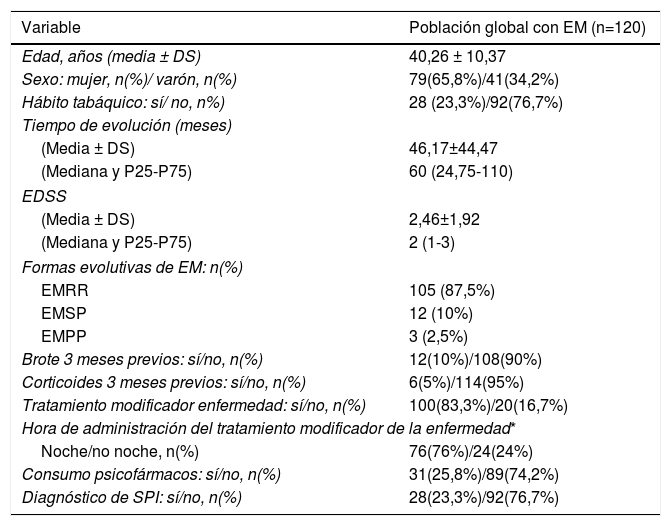
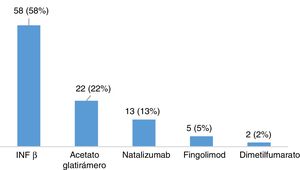
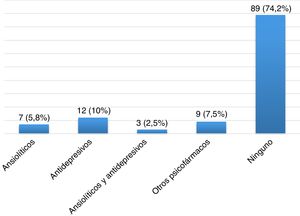
ResultadosDescripción de la población global y prevalencia de síndrome de piernas inquietasSe incluyeron un total de 120 pacientes con EM, la mayoría mujeres (65,8%), con una edad media en el momento de inclusión de 40,26 ± 10,37 años y un tiempo medio de evolución de 46,17 ± 44.47 meses (tabla 2). Veintiocho pacientes (23,3%) fumaban tabaco. Un total de 105 pacientes (87,5%) padecían una EM remitente recurrente (EMRR), 12 (10%) una EM secundaria progresiva (EMSP) y 3 (2,5%) una EM primaria progresiva (EMPP). La puntuación media en la escala EDSS en el momento de inclusión fue de 2,46±1,92. Doce pacientes (10%) presentaron un brote en los 3 meses previos a la realización del cuestionario, de los cuales 6 recibieron corticoides. Cien pacientes (83,3%) realizaban algún tratamiento modificador de la enfermedad (fig. 1), la mayoría de los cuales (76%) llevaban a cabo su administración por la noche. Y 31(25,83%) consumían algún tipo de psicofármaco (fig. 2).
Características demográficas y clínicas de la población global
| Variable | Población global con EM (n=120) |
|---|---|
| Edad, años (media ± DS) | 40,26 ± 10,37 |
| Sexo: mujer, n(%)/ varón, n(%) | 79(65,8%)/41(34,2%) |
| Hábito tabáquico: sí/ no, n%) | 28 (23,3%)/92(76,7%) |
| Tiempo de evolución (meses) | |
| (Media ± DS) | 46,17±44,47 |
| (Mediana y P25-P75) | 60 (24,75-110) |
| EDSS | |
| (Media ± DS) | 2,46±1,92 |
| (Mediana y P25-P75) | 2 (1-3) |
| Formas evolutivas de EM: n(%) | |
| EMRR | 105 (87,5%) |
| EMSP | 12 (10%) |
| EMPP | 3 (2,5%) |
| Brote 3 meses previos: sí/no, n(%) | 12(10%)/108(90%) |
| Corticoides 3 meses previos: sí/no, n(%) | 6(5%)/114(95%) |
| Tratamiento modificador enfermedad: sí/no, n(%) | 100(83,3%)/20(16,7%) |
| Hora de administración del tratamiento modificador de la enfermedad* | |
| Noche/no noche, n(%) | 76(76%)/24(24%) |
| Consumo psicofármacos: sí/no, n(%) | 31(25,8%)/89(74,2%) |
| Diagnóstico de SPI: sí/no, n(%) | 28(23,3%)/92(76,7%) |
DS: desviación estándar.
La prevalencia de SPI en la población de pacientes con EM examinada, según el cumplimiento de los 4 requisitos incluidos en los criterios diagnósticos de la IRLSSG5, fue del 23,3% (28 casos).
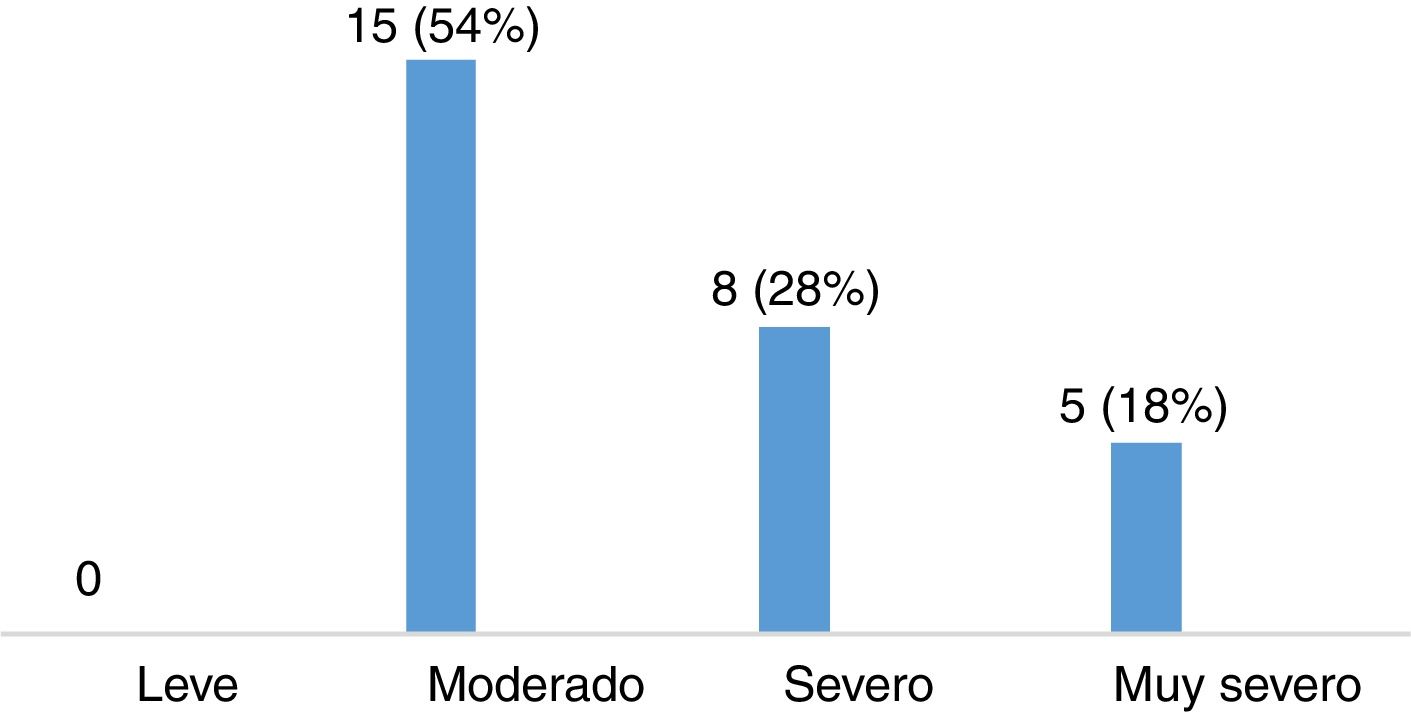
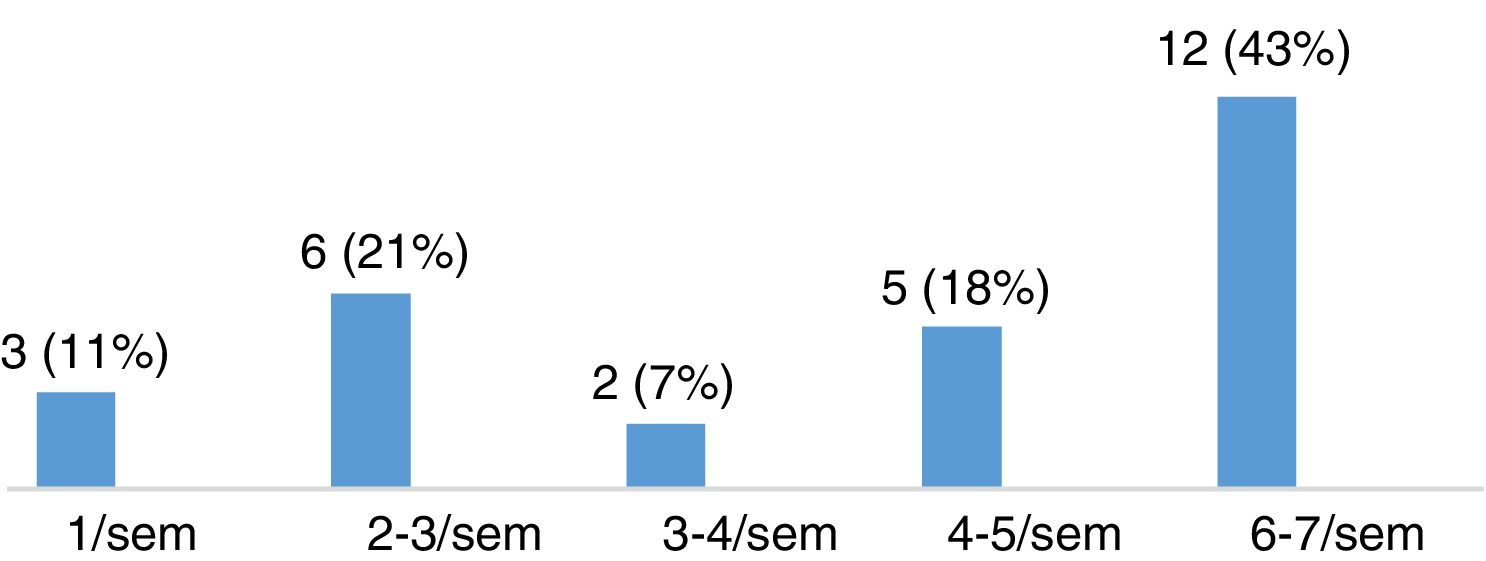
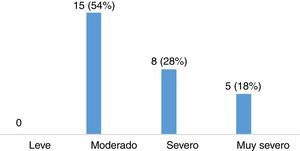
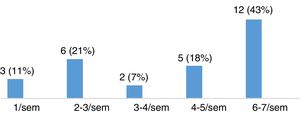
Evaluación de la severidad del síndrome de piernas inquietas en pacientes con esclerosis múltipleLa puntuación media en la escala de severidad de IRLS, en el grupo de 28 pacientes con EM diagnosticados de SPI, fue de 22,11 ± 8,01. De ellos, 15 pacientes (53,57%) presentaban un grado de severidad moderado, 8 (28,57%) severo y 5 (17,86%) muy severo (fig. 3). La mayoría de los pacientes presentaban SPI a diario, como queda reflejado en la figura 4.
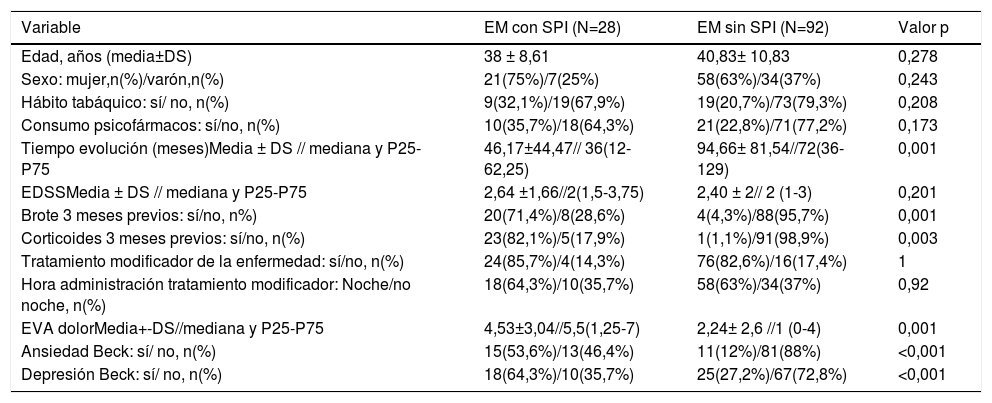
Evaluación de los potenciales factores de riesgo de síndrome de piernas inquietas en pacientes con esclerosis múltipleAl comparar los dos subgrupos de pacientes en función del padecimiento o no de SPI, no se identificaron diferencias significativas en la edad y el género (p=0,278 y p=0,243; respectivamente). Tampoco respecto al hábito tabáquico (p= 0,208), ni al evaluar el consumo de psicofármacos (p=0,173) (tabla 3).
Potenciales factores de riesgo de SPI en pacientes con EM. Características demográficas y clínicas
| Variable | EM con SPI (N=28) | EM sin SPI (N=92) | Valor p |
|---|---|---|---|
| Edad, años (media±DS) | 38 ± 8,61 | 40,83± 10,83 | 0,278 |
| Sexo: mujer,n(%)/varón,n(%) | 21(75%)/7(25%) | 58(63%)/34(37%) | 0,243 |
| Hábito tabáquico: sí/ no, n(%) | 9(32,1%)/19(67,9%) | 19(20,7%)/73(79,3%) | 0,208 |
| Consumo psicofármacos: sí/no, n(%) | 10(35,7%)/18(64,3%) | 21(22,8%)/71(77,2%) | 0,173 |
| Tiempo evolución (meses)Media ± DS // mediana y P25-P75 | 46,17±44,47// 36(12-62,25) | 94,66± 81,54//72(36-129) | 0,001 |
| EDSSMedia ± DS // mediana y P25-P75 | 2,64 ±1,66//2(1,5-3,75) | 2,40 ± 2// 2 (1-3) | 0,201 |
| Brote 3 meses previos: sí/no, n%) | 20(71,4%)/8(28,6%) | 4(4,3%)/88(95,7%) | 0,001 |
| Corticoides 3 meses previos: sí/no, n(%) | 23(82,1%)/5(17,9%) | 1(1,1%)/91(98,9%) | 0,003 |
| Tratamiento modificador de la enfermedad: sí/no, n(%) | 24(85,7%)/4(14,3%) | 76(82,6%)/16(17,4%) | 1 |
| Hora administración tratamiento modificador: Noche/no noche, n(%) | 18(64,3%)/10(35,7%) | 58(63%)/34(37%) | 0,92 |
| EVA dolorMedia+-DS//mediana y P25-P75 | 4,53±3,04//5,5(1,25-7) | 2,24± 2,6 //1 (0-4) | 0,001 |
| Ansiedad Beck: sí/ no, n(%) | 15(53,6%)/13(46,4%) | 11(12%)/81(88%) | <0,001 |
| Depresión Beck: sí/ no, n(%) | 18(64,3%)/10(35,7%) | 25(27,2%)/67(72,8%) | <0,001 |
En cuanto a las variables clínicas, no se registraron diferencias significativas al comparar las formas evolutivas de EM. El tiempo de evolución de la EM, desde la aparición de sus primeros síntomas, fue significativamente menor en los pacientes con EM y SPI (p= 0,001), pero con una OR próxima a 1 (OR: 0,98; IC 95%:0,97-0,99). Se observó una mayor puntuación en la escala EDSS en el grupo de EM y SPI, sin llegar a alcanzar significación estadística. La presencia de un brote clínico en los 3 meses previos a la inclusión en el estudio, se asoció de manera significativa con el riesgo de sufrir SPI (p=0,001; OR: 8,8; IC 95%: 2,21-32,1), al igual que el tratamiento con corticoides en los 3 meses previos (p=0,003). En este caso, no se pudo calcular el OR debido al escaso número de pacientes incluidos en algunos de los subgrupos de análisis, lo que confería un amplio rango de dispersión de los datos. Finalmente, el tratamiento con fármacos modificadores de la enfermedad y su administración a última hora del día no se relacionaron con un mayor riesgo de padecimiento de SPI (p= 1 y p=0,92, respectivamente) (tabla 3).
Además, se valoraron los trastornos del estado de ánimo y el padecimiento de dolor neuropático como otros posibles factores de riesgo independientes para la aparición de SPI. De esta manera, una mayor puntuación en las escalas de ansiedad (p<0,001; OR=8,49; IC 95%: 3,2-22,49) y depresión de Beck (p<0,001; OR=4,82, IC 95%: 1,96-11,85) se relacionaron de manera estadísticamente significativa con un mayor riesgo de tener SPI. También se observó una asociación significativa entre la presencia de SPI y el padecimiento de dolor medido por la escala EVA (p=0,001; OR=1,31, IC 95%: 1,12-1,53).
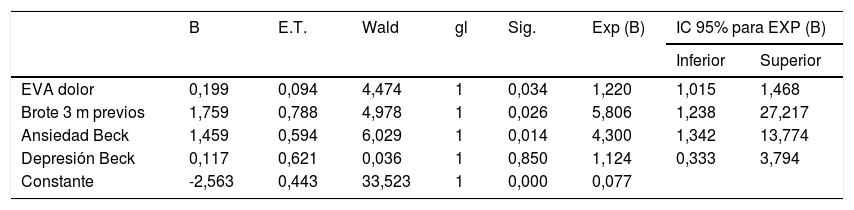
En el análisis de regresión logística multivariante para la elaboración de un modelo predictivo de padecimiento de SPI en sujetos diagnosticados de EM se incorporaron las variables «brote en los tres meses previos», «ansiedad», «depresión», y «dolor» que demostraron asociación significativa en el análisis univariante. De estas, la presencia de ansiedad, brotes en los 3 meses previos a la participación en el estudio y la intensidad del dolor, se identificaron como variables independientes para predicción de la aparición de SPI en los individuos con EM (p=0,014, p=0,026 y p=0,034, respectivamente) (tabla 4).
Análisis de regresión logística multivariante para el cálculo de factores independientes asociados a SPI en pacientes con EM
| B | E.T. | Wald | gl | Sig. | Exp (B) | IC 95% para EXP (B) | ||
|---|---|---|---|---|---|---|---|---|
| Inferior | Superior | |||||||
| EVA dolor | 0,199 | 0,094 | 4,474 | 1 | 0,034 | 1,220 | 1,015 | 1,468 |
| Brote 3 m previos | 1,759 | 0,788 | 4,978 | 1 | 0,026 | 5,806 | 1,238 | 27,217 |
| Ansiedad Beck | 1,459 | 0,594 | 6,029 | 1 | 0,014 | 4,300 | 1,342 | 13,774 |
| Depresión Beck | 0,117 | 0,621 | 0,036 | 1 | 0,850 | 1,124 | 0,333 | 3,794 |
| Constante | -2,563 | 0,443 | 33,523 | 1 | 0,000 | 0,077 | ||
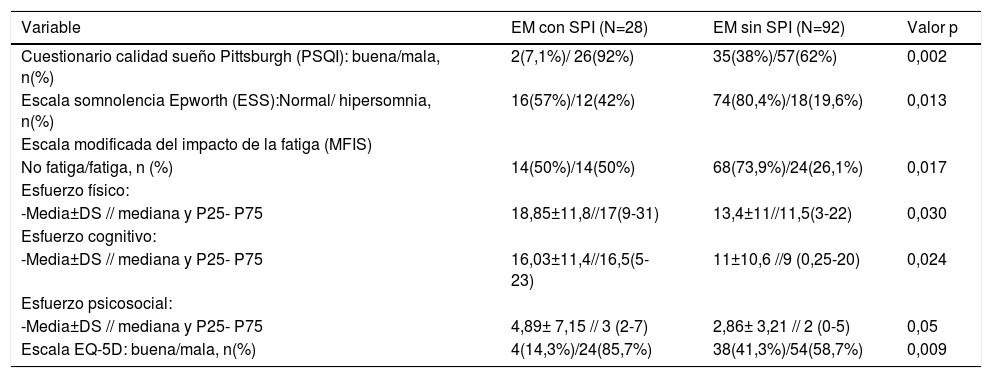
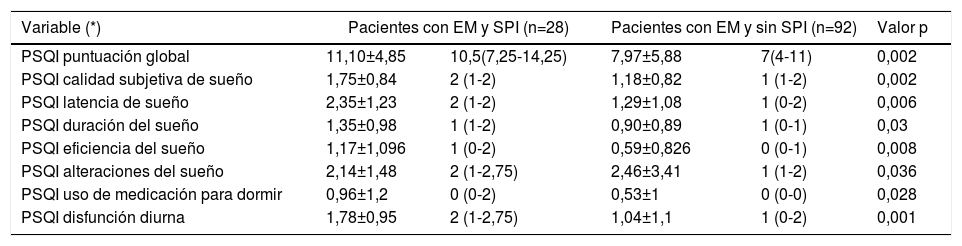
Al comparar ambas cohortes de individuos con EM respecto a la presencia o no de SPI, se evidenciaron diferencias estadísticamente significativas en la frecuencia de aparición de mala calidad de sueño en ambos grupos de sujetos examinados. Así, la puntuación global en el PSQI evidenció que en los pacientes con EM y SPI el insomnio (mala calidad de sueño) era significativamente más prevalente (p=0,002) (tabla 5). Como se observa en la tabla 6, al comparar las diferentes subescalas de valoración de este cuestionario, los pacientes con EM y SPI presentaron peor puntuación en todas ellas salvo en el epígrafe correspondiente a las alteraciones del sueño. La puntuación media en la ESS mostró que los pacientes con EM y SPI presentaban mayor grado de somnolencia diurna (p=0,013). La fatiga, tanto en su puntuación global en la escala MFIS (p=0,017) como en sus subescalas de esfuerzo físico (p=0,03), cognitivo (p=0,024) y psicosocial (p=0,05), también se asociaron con la presencia de SPI. Finalmente, la estimación del paciente de su estado de salud, evaluado mediante el cuestionario de calidad de vida EQ-5D, resultó significativamente peor en los pacientes con SPI (p= 0,009) (tabla 5).
Comparación de variables de repercusión clínica del SPI en pacientes con EM
| Variable | EM con SPI (N=28) | EM sin SPI (N=92) | Valor p |
|---|---|---|---|
| Cuestionario calidad sueño Pittsburgh (PSQI): buena/mala, n(%) | 2(7,1%)/ 26(92%) | 35(38%)/57(62%) | 0,002 |
| Escala somnolencia Epworth (ESS):Normal/ hipersomnia, n(%) | 16(57%)/12(42%) | 74(80,4%)/18(19,6%) | 0,013 |
| Escala modificada del impacto de la fatiga (MFIS) | |||
| No fatiga/fatiga, n (%) | 14(50%)/14(50%) | 68(73,9%)/24(26,1%) | 0,017 |
| Esfuerzo físico: | |||
| -Media±DS // mediana y P25- P75 | 18,85±11,8//17(9-31) | 13,4±11//11,5(3-22) | 0,030 |
| Esfuerzo cognitivo: | |||
| -Media±DS // mediana y P25- P75 | 16,03±11,4//16,5(5-23) | 11±10,6 //9 (0,25-20) | 0,024 |
| Esfuerzo psicosocial: | |||
| -Media±DS // mediana y P25- P75 | 4,89± 7,15 // 3 (2-7) | 2,86± 3,21 // 2 (0-5) | 0,05 |
| Escala EQ-5D: buena/mala, n(%) | 4(14,3%)/24(85,7%) | 38(41,3%)/54(58,7%) | 0,009 |
Cuestionario de calidad de sueño de Pittsburg (PSQI)
| Variable (*) | Pacientes con EM y SPI (n=28) | Pacientes con EM y sin SPI (n=92) | Valor p | ||
|---|---|---|---|---|---|
| PSQI puntuación global | 11,10±4,85 | 10,5(7,25-14,25) | 7,97±5,88 | 7(4-11) | 0,002 |
| PSQI calidad subjetiva de sueño | 1,75±0,84 | 2 (1-2) | 1,18±0,82 | 1 (1-2) | 0,002 |
| PSQI latencia de sueño | 2,35±1,23 | 2 (1-2) | 1,29±1,08 | 1 (0-2) | 0,006 |
| PSQI duración del sueño | 1,35±0,98 | 1 (1-2) | 0,90±0,89 | 1 (0-1) | 0,03 |
| PSQI eficiencia del sueño | 1,17±1,096 | 1 (0-2) | 0,59±0,826 | 0 (0-1) | 0,008 |
| PSQI alteraciones del sueño | 2,14±1,48 | 2 (1-2,75) | 2,46±3,41 | 1 (1-2) | 0,036 |
| PSQI uso de medicación para dormir | 0,96±1,2 | 0 (0-2) | 0,53±1 | 0 (0-0) | 0,028 |
| PSQI disfunción diurna | 1,78±0,95 | 2 (1-2,75) | 1,04±1,1 | 1 (0-2) | 0,001 |
El SPI es frecuente en pacientes con EM y puede contribuir de forma importante a la reducción en la calidad de vida de estos pacientes. En España, solo hay un estudio realizado en una cohorte de pacientes con EM en Cataluña18 que indicó que la prevalencia de SPI en pacientes con EM era igual que en la población general (13,2 vs. 9,3%), siendo mayor en mujeres que en hombres.
Los resultados de nuestro estudio confirman, sin embargo, los hallazgos de otros grupos independientes, observándose una mayor prevalencia de SPI en los pacientes con EM que en la población general. Así, nuestro análisis revela una prevalencia de SPI en pacientes de raza caucásica con EM de un 23,3%, cifra similar a la recogida en trabajos previos7,9,11,15,16,28,29. A diferencia de otros estudios18,23, no hemos introducido un grupo control de voluntarios sanos, tomándose como referencia la prevalencia de SPI en la población general ampliamente descrita en diversas publicaciones18,28. Respecto a la severidad del SPI, en nuestra serie esta ha sido habitualmente moderada-grave, como también ha sido previamente reportado por otros autores7,10,30.
En nuestra cohorte, hemos identificado como potenciales factores de riesgo para padecer SPI el padecimiento de brotes recientes, un menor tiempo de evolución de la enfermedad, así como la presencia de alteraciones del estado de ánimo y de dolor intenso. No se identificaron diferencias en cuanto a la edad y género de los pacientes con SPI, respecto a los que no lo presentaban, lo que concuerda con estudios previos30. Tampoco encontramos asociación entre la forma clínica de EM y el riesgo de sufrir SPI, pero sí con formas activas de la enfermedad, al igual que lo indicado en otras series7,11,14,17. Así, la aparición de sintomatología de SPI fue más prevalente entre los individuos con brotes recientes. Por el contrario, no encontramos diferencias en el grado de discapacidad al comparar ambos grupos de pacientes, siendo este último resultado similar al de otras series de pacientes examinadas9. Algunos trabajos han demostrado un mayor riesgo de aparición de SPI en fases avanzadas de la EM11. En nuestro caso, ha ocurrido al contrario, siendo más prevalente este trastorno en los pacientes con menor tiempo de evolución. De tal manera que, este resultado podría sugerir que aquellos pacientes con EM que padecerán SPI lo harán desde las fases tempranas de la enfermedad.
Varios estudios defienden que los trastornos del sueño de los pacientes con EM pueden deberse, al menos en parte, a los efectos de los tratamientos inmunomoduladores (especialmente si se administran por la noche), así como al uso de corticoides31,32. Sin embargo, hasta la fecha no existe ninguna publicación que haya evaluado específicamente el posible impacto de estas terapias en el desarrollo del SPI en pacientes con EM. En nuestro estudio, ninguno de los fármacos modificadores de la enfermedad se asoció de manera significativa con una mayor prevalencia de SPI. En cuanto al tratamiento con corticoides, si bien se relacionó con un mayor riesgo de sufrir SPI, no se pudieron extraer conclusiones definitivas a este respecto, ya que el escaso número de sujetos incluidos en uno de los grupos examinados no permitió completar los análisis estadísticos confirmatorios.
Es bien conocido que algunas alteraciones del ánimo, como la depresión y la ansiedad, son prevalentes en la población con EM7. En este sentido, hemos observado que la frecuencia de estos trastornos del humor es superior en pacientes con SPI, estableciéndose una estrecha relación bidireccional en la que los pacientes con EM y peor estado anímico (mayor grado de depresión y ansiedad) tienen más riesgo de sufrir SPI y viceversa7,11.
Respecto a la repercusión clínica del SPI en la población con EM analizada, se evidenció que los pacientes con SPI presentaban a su vez peor calidad de sueño, mayor grado de fatiga e hipersomnia diurna, y peor calidad de vida respecto a los que no presentaban SPI. Tanto la puntuación global del PSQI, como la de sus diferentes subescalas, fue superior en este grupo de pacientes, con excepción de la subescala «alteraciones del sueño». Teniendo en cuenta que esta subescala puntúa todas aquellas interrupciones que han provocado despertar en la noche (ir al baño, tos, ronquido, etc.), es de suponer que los pacientes sin SPI padecen otras comorbilidades responsables de este resultado, no recogidas en nuestro análisis. Varios autores han señalado que la prevalencia de fatiga es superior en pacientes con EM y SPI7. Los resultados de nuestro trabajo confirman esta asociación, viéndose además afectadas las tres esferas (física, cognitiva y psicosocial) de manera destacada. Por otro lado, y como se ha concluido en otros trabajos14, la presencia de SPI conlleva un mayor grado de somnolencia diurna en el grupo de pacientes con EM y SPI. Al evaluar la estimación que realizan los pacientes de su calidad de vida, hemos obtenido puntuaciones significativamente peores en el grupo de individuos con EM y SPI. Por lo que podemos concluir que, el SPI puede contribuir a la reducción en la calidad de vida de los pacientes con EM.
Se conoce que algunos psicofármacos, en concreto los antidepresivos y ansiolíticos, pueden empeorar la sintomatología del SPI11,33,34. Sin embargo, al analizar la posible relación entre el empleo de esta medicación en nuestra cohorte de pacientes con EM y la presencia de SPI no hemos encontrado diferencias significativas. Una posible explicación sería el mayor consumo de psicofármacos que realizan los enfermos con EM frente a la población general, por distintas comorbilidades que no han sido analizadas en este trabajo. Así, consideramos necesarios más estudios para poder aclarar esta cuestión.
En conclusión, los resultados de este estudio confirman la elevada prevalencia del SPI en la población española con EM, en concreto, en una cohorte andaluza. No hemos identificado ninguna variable demográfica ni tratamiento empleado como factor de riesgo para la aparición de SPI. Por el contrario, una EM actividad, con brotes recientes, se relacionó con un mayor riesgo de padecimiento de SPI. Por otro lado, los trastornos del estado del ánimo y la presencia de dolor neuropático también se han asociado de manera significativa con el SPI. Finalmente, en este proyecto también hemos observado un mayor riesgo de mala calidad de sueño, fatiga, somnolencia diurna y peor calidad de vida en pacientes con EM y SPI que en aquellos que no presentan SPI. Por este motivo, consideramos que el SPI debe ser considerado en la evaluación neurológica de pacientes con EM, y así, su identificación precoz y tratamiento adecuado podría mejorar de manera sustancial la calidad de vida global de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.