Realizamos un análisis retrospectivo de los pacientes evaluados en nuestra unidad de memoria en los que se realizó determinación de biomarcadores licuorales de enfermedad de Alzheimer (EA). Se seleccionaron aquellos casos con diagnóstico de deterioro cognitivo leve debido a EA según criterios clínicos (criterios NIA-AA), déficit neuropsicológico comprobado, una puntuación igual a 3 en la escala GDS y un perfil alterado de biomarcadores en líquido cefalorraquídeo. De los 588 casos revisados, 110 cumplieron los criterios de inclusión. Durante el seguimiento, 50 de estos 110 casos (45,45%) progresaron a demencia por EA. Se observaron diferencias significativas en los niveles basales de tau total y tau fosforilada entre los casos que evolucionaron a demencia y los que permanecieron estables como deterioro cognitivo leve, siendo los niveles más altos en el grupo que progresó a demencia. Después del ajuste por edad, sexo, antecedentes de hipertensión, diabetes y nivel educativo, un aumento del 10% en los valores de proteína tau total se asoció con un aumento del 7,60% en el riesgo de progresión a demencia (HR = 2,22, IC 95% [1,28, 3,84], p = 0,004). En pacientes con deterioro cognitivo leve debido a EA un perfil alterado de biomarcadores licuorales, concentraciones progresivamente mayores de tau-t y tau-p se asocian a un mayor riesgo de conversión a demencia.
We performed a retrospective analysis of the patients assessed at our memory unit for whom Alzheimer disease (AD) cerebrospinal fluid biomarker results were available. We selected patients diagnosed with mild cognitive impairment due to AD (National Institute on Aging-Alzheimer's Association clinical criteria), confirmed neuropsychological deficit, a Global Deterioration Scale score of 3, and an abnormal profile of cerebrospinal fluid biomarkers. Of the 588 cases reviewed, 110 met the inclusion criteria. During follow-up, 50 cases (45.45%) progressed to dementia due to AD. Baseline levels of total and phosphorylated tau were higher in the group of patients that progressed to dementia than in those remaining with mild cognitive impairment. After adjusting for age, sex, history of hypertension, diabetes, and educational level, a 10% increase in total tau protein values was associated with a 7.60% increase in the risk of progression to dementia (hazard ratio: 2.22; 95% confidence interval, 1.28-3.84]; P = .004). Among patients with mild cognitive impairment due to AD and abnormal cerebrospinal fluid biomarker profiles, progressively higher concentrations of total or phosphorylated tau were associated with increased risk of progression to dementia.
La enfermedad de Alzheimer (EA) es la causa más frecuente de demencia a nivel mundial1. El concepto de esta enfermedad ha evolucionado hacia el de una entidad biológicamente definida con diferentes etapas: estadio preclínico, deterioro cognitivo leve y demencia2. Entre los biomarcadores, los niveles de las proteínas amiloide β-42 (Aβ-42), tau total (tau-t) y tau fosforilada (tau-p) en líquido cefalorraquídeo (LCR) proporcionan información sobre el estatus biológico del cerebro del paciente, añadiendo especificidad y precisión al diagnóstico clínico, con una alta capacidad de discriminar pacientes con y sin evidencia biológica de EA, independientemente de la gravedad clínica. Se consideran positivos para el continuum Alzheimer los casos con concentraciones bajas de proteína Aβ-42, presentando niveles de proteínas tau-t y tau-p elevados, aquellos casos que constituyen la denominada forma licuoral de la enfermedad. En 2011, la NIA-AA (National Institute on Aging y la Alzheimer's Association) publicaron guías para el diagnóstico de los estadios sintomáticos de la EA (DCL y demencia). En estas guías se propuso el uso de biomarcadores con el fin de incrementar la certeza de que los déficits cognitivos son atribuibles a los cambios biológicos de la EA3,4. De este modo, la EA se puede identificar con precisión en fases levemente sintomáticas (DCL debido a enfermedad de Alzheimer o EA prodrómica) e incluso asintomáticas (EA preclínica) con ayuda de biomarcadores3–5.
El diagnóstico de EA en fases evolutivas tempranas hace que sea más interesante aún disponer de herramientas pronósticas apropiadas que permitan predecir la aparición de incapacidad en cada caso, tanto desde el punto de vista asistencial como para la planificación y desarrollo de métodos terapéuticos. En el caso del deterioro cognitivo leve debido a EA, resultaría muy conveniente disponer de herramientas que puedan predecir con exactitud el riesgo de progresión a demencia o el momento en el que ocurrirá dicha conversión. En pacientes con evidencia clínica y biológica de EA en fases tempranas (DCL y demencia leve), se ha observado que niveles más altos de proteína tau-t en LCR se asocian a una progresión más rápida a etapas avanzadas de la enfermedad (demencia moderada y grave) y mayor mortalidad6–8.
El objetivo de este estudio fue corroborar observaciones previas sobre la utilidad de los niveles de tau-t en LCR como predictor independiente de progresión a etapas avanzadas de EA en casos de DCL debido a EA. Analizamos la capacidad predictiva de los niveles de biomarcadores licuorales, especialmente t-tau al momento del diagnóstico para estimar el tiempo y riesgo de progresión a demencia en pacientes con DCL y evidencia biológica de EA.
Materiales y métodosPoblación estudiadaSe realizó una revisión retrospectiva de los pacientes evaluados en la unidad de trastornos cognitivos de un hospital terciario que incluyeron en su evaluación diagnóstica la práctica de una punción lumbar para determinación de biomarcadores de EA en LCR. El período analizado fue desde agosto de 2013 hasta octubre de 2017, etapa en la cual se utilizó un único método de laboratorio. Se recogieron variables demográficas, clínicas y funcionales de los pacientes estudiados. Las variables demográficas incluidas fueron sexo, edad y nivel educativo. Los antecedentes médicos considerados como relevantes fueron los factores de riesgo cardiovascular clásicos: hipertensión arterial, diabetes mellitus y dislipemia.
Evaluación y clasificación de los pacientesLa evaluación clínica incluyó de forma rutinaria una entrevista con un informante y el paciente, en la cual se caracterizó la sintomatología y su repercusión sobre las actividades de la vida diaria. Las herramientas empleadas para la evaluación cognitiva y funcional incluyeron la versión en castellano del MMSE (Mini mental state examination de Folstein)9,10 y la escala de deterioro global de Reisberg (GDS)11. Además, de modo individualizado se administraron algunos test neuropsicológicos más específicos para evaluar la memoria (T@M)12 y la función ejecutiva (test del trazo)13. Tras la evaluación inicial, los pacientes fueron clasificados en tres categorías: quejas subjetivas de memoria, deterioro cognitivo leve o demencia. Los diagnósticos sindrómicos de DCL y demencia debieron cumplir los criterios propuestos por la NIA-AA3,4. Tras la valoración clínica se realizaron, si no estaban practicadas recientemente, una prueba de neuroimagen (resonancia magnética o tomografía computarizada) y análisis de laboratorio en sangre para excluir causas secundarias de deterioro cognitivo (niveles de hormonas tiroideas, vitamina B12 y en determinados casos, serologías de VIH y sífilis). En la primera visita de seguimiento se comunicó el diagnóstico y se propuso punción lumbar para determinación de biomarcadores. En nuestro centro, proponemos el estudio licuoral a pacientes preseniles de modo prácticamente sistemático; en mayores de 65 años se propone a aquellos pacientes con suficiente esperanza y calidad de vida desde el punto de vista del médico evaluador, con diagnóstico sindrómico de DCL o demencia leve. Se excluyen pacientes con contraindicaciones para punción lumbar, como ejemplo, uso de anticoagulantes o trastornos de las plaquetas o coagulación. La existencia patología concomitante como hidrocefalia o encefalopatía de origen vascular no es criterio de exclusión en nuestra práctica clínica habitual. En las visitas de seguimiento los neurólogos eran conocedores de los resultados de los biomarcadores licuorales.
Clasificación de los pacientes según biomarcadores licuoralesSeleccionamos aquellos casos que cumplieron criterios NIA-AA3 de DCL en la visita basal con una puntuación igual a 3 en la escala GDS y que además tuvieran un perfil de biomarcadores alterado. Como requisito, la muestra de LCR debió ser obtenida en un período inferior a seis meses tras la primera valoración en nuestra unidad. Las concentraciones de Aβ-42 se clasificaron en las siguientes categorías: 1) anormal (< 700 pg/mL), 2) zona de incertidumbre (700-1.000 pg/mL) y 3) normal (> 1.000 pg/mL). Los niveles de tau se consideraron anormales si tau-p ≥ 70 pg/mL y/o t-tau ≥ 350 pg/mL. Los pacientes fueron agrupados en categorías según su perfil de biomarcadores licuorales2: 1) Categoría continuum Alzheimer: alteración del biomarcador amiloide con o sin alteraciones en los niveles de proteína tau-p o tau-t. 2) Categoría SNAP (suspected non-Alzheimer pathophysiology): concentraciones de Aβ42 en la zona de incertidumbre con niveles elevados de tau fosforilada y/o tau total.
Fueron excluidos los casos que en la visita basal no cumplieran criterios NIA-AA para DCL (demencia o quejas cognitivas), antecedentes de accidente cerebrovascular isquémico o hemorrágico, lesiones cerebrales estructurales clínicamente relevantes (neoplasias, hidrocefalia, etc), trastornos psiquiátricos distintos de ansiedad o depresión leves o bien controladas y pacientes con historias clínicas incompletas. Se realizaron visitas de seguimiento cada seis a 12 meses.
En las visitas de seguimiento, los pacientes fueron clasificados en dos categorías según su evolución clínica: 1) Grupo DCL sin progresión: pacientes que, a pesar los síntomas, se mantenían autónomos para las actividades básicas e instrumentales de la vida diaria según lo reportado por un informante y además cumplían criterios NIA-AA para DCL por EA y tenían una puntuación igual a 3 es la escala GDS. 2) Grupo DCL con progresión: pacientes que durante el seguimiento experimentaron un empeoramiento clínico lo suficientemente relevante como para interferir en las actividades básicas o instrumentales de la vida diaria según lo referido por un informante; los pacientes cumplían criterios NIA-AA de demencia y tenían una puntuación GDS ≥ 4. Para el análisis los pacientes del grupo DCL sin progresión se consideró el MMSE de la visita basal y el de la última visita de seguimiento, mientras que en el grupo DCL con progresión se consideró el MMSE de a visita basal y el de la visita de seguimiento en la cual se efectuó el cambio de diagnóstico de DCL a demencia.
Procesamiento y análisis de las muestrasLa extracción, transporte y análisis de muestras de LCR es un proceso estandarizado en nuestro centro. El LCR se obtuvo mediante punción lumbar realizada entre las 9 am y las 11 am. Se recogieron muestras de 6 mL utilizando un tubo de polipropileno, que se almacenó inmediatamente en un recipiente refrigerado y luego se trasladó a nuestro laboratorio local dentro de los 30 minutos posteriores a la obtención de la muestra. Una vez en el laboratorio, las muestras se centrifugaron a 4°C y 3.000 revoluciones por minuto durante 10 minutos. Dos alícuotas que contenían un mínimo de 800 μL del sobrenadante se almacenaron en tubos de polipropileno y se congelaron a -80°C. La cuantificación de biomarcadores de LCR se realizó mensualmente para las muestras recibidas durante ese mes. El día del análisis se dejó descongelar una parte alícuota de cada paciente a temperatura ambiente. La determinación de los niveles de Aβ-42, t-tau y p-tau se realizó utilizando un kit de inmunoensayo comercial (Innotest® Fujirebio). Las concentraciones de los distintos biomarcadores se expresan en picogramos por mililitro (pg/mL).
Análisis estadísticoLas variables cuantitativas continuas se expresan mediante la media y la desviación estándar. Las variables categóricas se describen empleando frecuencias absolutas y relativas. Se aplicó una transformación logarítmica a los valores de amiloide y t-tau para minimizar la influencia de las observaciones extremas. Para evaluar la asociación entre el riesgo de progresión a demencia y los valores de amiloide y t-tau, se realizó un modelo de regresión de riesgos proporcionales de Cox, incluyendo variables como hipertensión, diabetes, edad y años de educación como potenciales factores de confusión. Los supuestos del modelo se verificaron utilizando residuos de Schoenfeld y parcelas log (-log). Todos los análisis estadísticos se realizaron con el software estadístico «R» versión 3.5.1 (R Foundation for Statistical Computing; Viena, Austria).
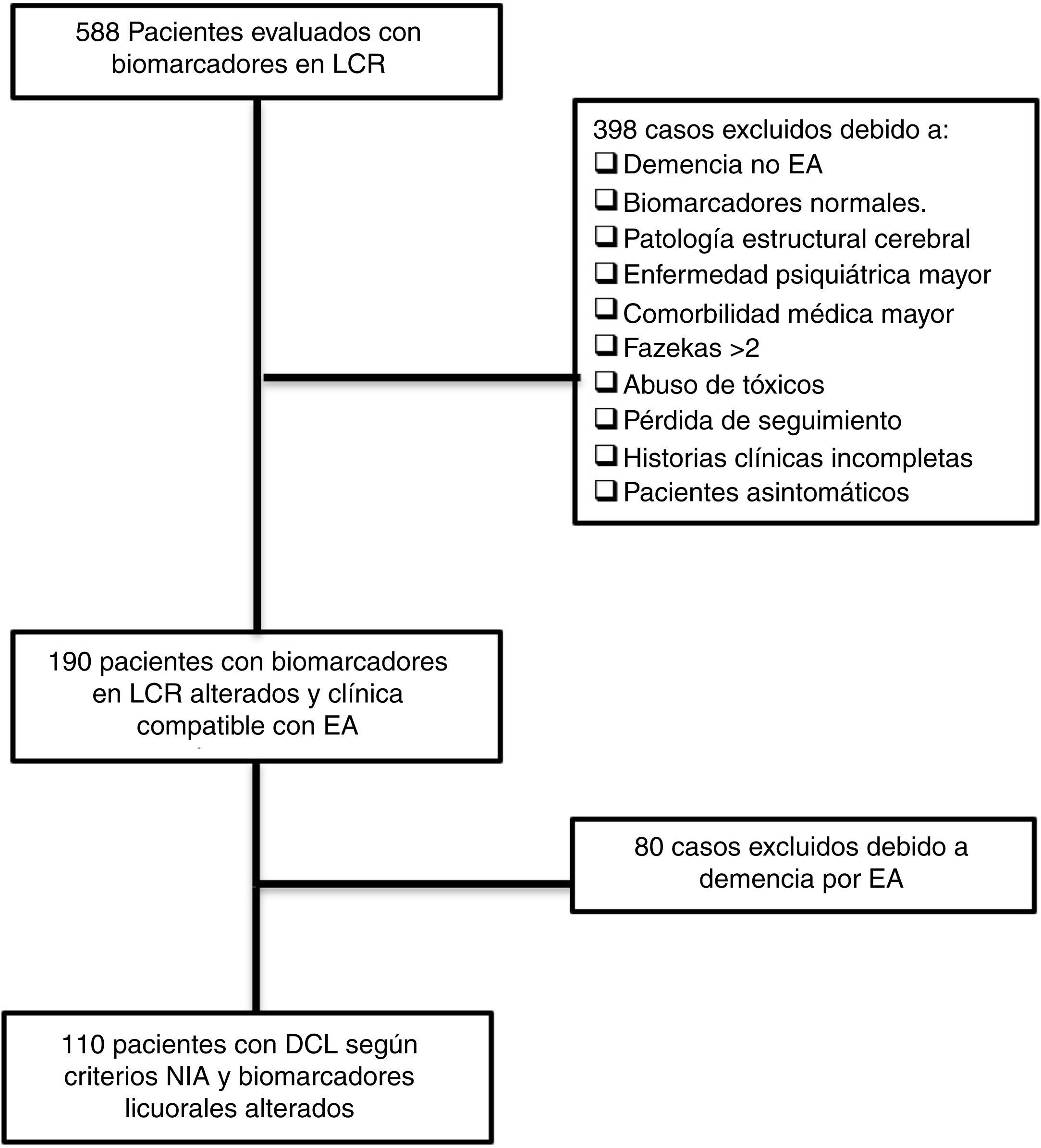
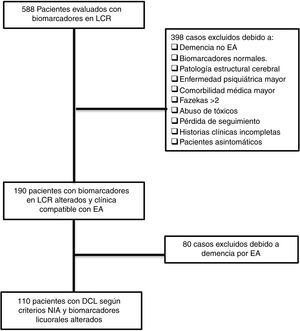
ResultadosPacientes incluidosTras la revisión de 588 historias clínicas, 110 pacientes cumplieron todos los criterios de inclusión y ninguno de los de exclusión. El proceso de revisión y selección de los casos se muestra en el diagrama de flujo (fig. 1).
Progresión a demenciaEn la tabla 1 se puede ver que, durante el seguimiento, 60 pacientes permanecieron estables, sin progresión a demencia (grupo DCL sin progresión). Los otros 50 pacientes progresaron a demencia (grupo DCL con progresión). Hubo predominio de mujeres en ambos grupos, sin diferencias significativas. Tampoco hubo diferencias con respecto a los antecedentes de hipertensión, diabetes, hipercolesterolemia, nivel educativo ni tiempo de seguimiento. En la visita basal, la puntuación media en el MMSE fue significativamente superior en el grupo DCL sin progresión que en el grupo DCL con progresión (25,0±3,1 vs. 22,7±2,0, p = 0,001). En la última visita de seguimiento del grupo DCL sin progresión la diferencia en este mismo parámetro fue aún más marcada cuando se comparó con la puntuación obtenida en la visita de cambio de diagnóstico del grupo DCL con progresión (23,0±5,0 vs. 19,0 ±, p = 0,0001).
Características clínicas y demográficas de los pacientes agrupados según el curso evolutivo (DCL sin progresión vs. DCL con progresión)
| DCL sin progresión (n = 60) | DCL con progresión (n = 50) | Valor p | |
|---|---|---|---|
| Mujeres, n (%) | 37 (61,7) | 33 (66,0%) | 0,638 |
| Edad en basal (años), media (DE) | 69,8 (5,5) | 70,9 (6,5) | 0,379 |
| Hipertensión, n (%) | 26 (43,3%) | 28 (56,0) | 0,186 |
| Diabetes, n (%) | 6 (10,0) | 8 (16,0) | 0,347 |
| Hipercolesterolemia, n (%) | 34 (56,7) | 25 (50,0) | 0,478 |
| Años de educación, media (DE) | 9,7 (5,3) | 9,43 (5,0) | 0,823 |
| MMSE en basal, media (DE) | 25,0 (3,1) | 22,7 (2,0) | <0,001* |
| MMSE en seguimiento, media (DE) | 23,0 (5,0) | 19,0 (3,8) | < 0,001* |
El signo (*) corresponde a valores p estadísticamente significativos (p < 0,05)
En el grupo DCL sin progresión, la media de tiempo desde la visita basal hasta la última visita de seguimiento fue de 2,5±1,3 años. En el grupo DCL con progresión, la media de tiempo desde la visita basal hasta la visita de seguimiento en la que se realizó el cambio de diagnóstico sindrómico fue de 1,4±0,7 años, mientras que la media de tiempo desde la visita basal hasta la última visita de seguimiento fue de 3,0±1,1 años.
Perfiles licuoralesEn la tabla 2 se aprecia que el perfil licuoral de 78 pacientes se clasificó en el continuum Alzheimer, mientras que los otros 32 pacientes tuvieron características de patrón SNAP. El sexo femenino fue el predominante en ambos perfiles, sin diferencias entre grupos. La edad media, años de educación y porcentaje de pacientes con hipertensión, diabetes e hipercolesterolemia fue similar en ambos grupos. No hubo diferencias significativas en la puntuación del MMSE basal y de seguimiento entre grupos. La tasa de progresión a demencia en los pacientes del continuum Alzheimer y con patrón SNAP fue similar (46,2% vs. 43,8%, p >0,05).
Características clínicas y demográficas de los pacientes agrupados según el perfil licuoral de los biomarcadores
| Continuum Alzheimer (n = 78) | Patrón SNAP (n = 32) | Valor p | |
|---|---|---|---|
| Mujeres, n (%) | 53 (67,9) | 17 (53,0) | 0,142 |
| Edad en basal (años), media (DE) | 70,2 (5,8) | 70,7 (6,4) | 0,686 |
| Hipertensión, n (%) | 35 (44,9) | 19 (59,3) | 0,167 |
| Diabetes, n (%) | 8 (10,3) | 6 (18,8) | 0,225 |
| Hipercolesterolemia, n (%) | 38 (48,7) | 22 (68,8) | 0,114 |
| Años de educación, media (DE) | 9,8 (5,0) | 8,9 (5,3) | 0,417 |
| MMSE en basal, media (DE) | 23,9 (3,1) | 24,6(3,5) | 0,459 |
| MMSE en seguimiento, media (DE) | 20,4 (4,6) | 22,3 (5,3) | 0,132 |
| Conversión a demencia, n (%) | 36 (46,2) | 14 (43,8) | 0,818 |
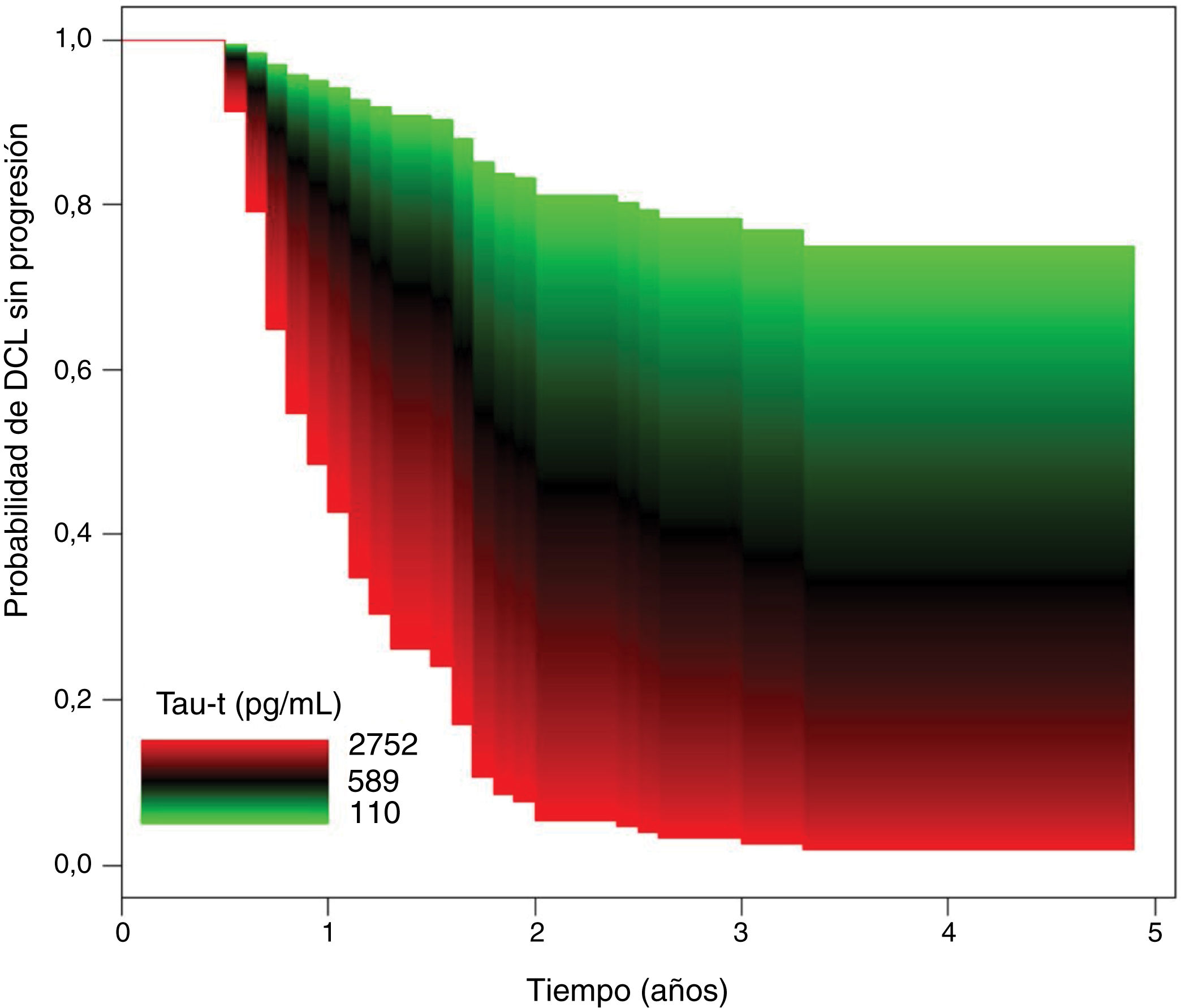
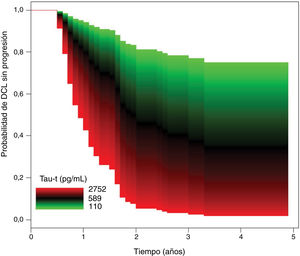
En la tabla 3 se muestra que no hubo diferencias significativas entre grupos en las concentraciones de Aβ-42 en LCR. Los niveles de proteínas tau total y fosforilada fueron significativamente mayores en el grupo DCL con progresión que en el grupo DCL sin progresión. Los ratios tau-t/Aβ-42 y tau-p/Aβ-42 fueron significativamente superiores en el grupo DCL con progresión. En el modelo de Cox, el riesgo de progresión a demencia fue independiente de las concentraciones de Aβ-42. En el modelo de regresión de los niveles de proteína tau total, después del ajuste por edad, sexo, antecedentes de hipertensión o diabetes y nivel educativo, un aumento del 10% en los valores de t-tau se asoció con un aumento del 7,60% en el riesgo de progresión a demencia (HR = 2,22, IC 95% [1,28, 3,84], p = 0,004) (fig. 2).
Niveles de biomarcadores en líquido cefalorraquídeo según grupos clínicos (pacientes con DCL sin progresión y DCL con progresión)
| Biomarcadores | DCL sin progresión (n = 60) | DCL con progresión (n = 50) | Valor p |
|---|---|---|---|
| Aβ-42, media (DE) | 647,3 (141,4) | 614,6 (164,4) | 0,265 |
| Tau-t, media (DE) | 577,3 (277,0) | 844,2 (607,7) | 0,006* |
| Tau-p, media (DE) | 91,2 (37,2) | 109,9 (56,2) | 0,039* |
| Ratio tau-t/Aβ-42, media (DE) | 0,94(0,55) | 1,56 (1,50) | 0,008* |
| Ratio tau-p/Aβ-42, media (DE) | 0,14 (0,07) | 0,20 (0,14) | 0,029* |
Las concentraciones están expresadas en picogramos por mililitro (pg/mL). El signo (*) corresponde a valores p estadísticamente significativos (p < 0,05)
La utilidad diagnóstica de los biomarcadores de EA en LCR está bien establecida y permite clasificar a los pacientes de acuerdo con la positividad o negatividad de los diferentes marcadores biológicos de la enfermedad2,14–16. La positividad de biomarcadores de EA en LCR se ha asociado a una mayor tasa de progresión de DCL de causa indeterminada a demencia en comparación a pacientes con DCL con biomarcadores negativos, lo que es mero reflejo de un diagnóstico etiológico apropiado16.
También se ha estudiado el valor pronóstico de los biomarcadores licuorales en pacientes con demencia por EA. Concentraciones mayores de proteína tau-t o tau-p se asocian a un deterioro cognitivo más rápido, que en pacientes con concentraciones menores6,17,18. En estos pacientes la probabilidad de institucionalización y la mortalidad también son mayores8,19. También se ha descrito que concentraciones mayores de proteína tau en pacientes con demencia por EA se asocian a un mayor grado de atrofia, especialmente en el hipocampo20,21. A pesar de un adecuado diseño y metodología, en muchos de estos estudios no se consideraron criterios licuorales para la inclusión de los casos, por lo que es posible que se incluyeran pacientes con biomarcadores negativos.
La utilidad pronóstica de las concentraciones de tau en LCR en el DCL con evidencia biológica de EA es menos conocida que en pacientes con demencia debida a EA. En nuestra serie, analizamos un total de 110 pacientes con diagnóstico de DCL según criterios NIA-AA más un perfil anormal biomarcadores en LCR (perfil continuum Alzheimer o SNAP). Encontramos una clara asociación entre niveles elevados de tau-t y tau-p y la probabilidad de progresión a demencia durante el seguimiento. Las ratios tau-t/Aβ-42 y tau-p/Aβ-42 también fueron predictores de progresión a demencia. Nuestros hallazgos confirman las observaciones realizadas por van Rossum et al.22,23, quienes demostraron que en pacientes con DCL y evidencia de amiloidosis, concentraciones mayores de tau-t y tau-p en LCR se asociaban a un mayor deterioro cognitivo y una progresión más acelerada a demencia. A diferencia de la serie de van Rossum, la nuestra es una serie que procede de un único centro y de un único laboratorio, eliminando así la posible interferencia de la variabilidad interlaboratorio o de distintos protocolos clínicos de trabajo, cuestiones descritas como causas relevantes de variabilidad de los resultados de biomarcadores licuorales de enfermedad de Alzheimer24–26.
Nuestra serie está formada por dos grupos de pacientes desde el punto de vista licuoral. Por un lado, los pacientes con un perfil «continuum Alzheimer», definido por niveles bajos de Aβ-42 independientemente de los valores de tau-t y tau-p. El segundo grupo lo constituyeron pacientes con niveles de Aβ-42 en la zona de incertidumbre más niveles anormales de tau-t o tau-p; según algunos puntos de vista2, este grupo podría representar lo que se conoce como SNAP (suspected non-Alzheimer disease pathophysiology) en fase de DCL (grupo DCL-SNAP). Estudios longitudinales previos han mostrado tasas variables de progresión a demencia en pacientes con DCL con patrón SNAP. Las frecuencias de conversión son ampliamente variables según las series (3,6-56%), atribuible en parte a distintos tiempos de seguimiento27–32. En nuestra serie la tasa de progresión a demencia fue similar en ambos perfiles licuorales (46,2% en el grupo continuum Alzheimer y 43,8% en el grupo SNAP), tras un seguimiento de aproximadamente tres años. Otra posible explicación a tal variabilidad es el empleo de diferentes puntos de corte para separar lo normal de lo patológico. Puntos de corte más exigentes permiten clasificar a los pacientes de una forma más específica, lo cual es especialmente útil en entornos de investigación. En la práctica clínica también es prioritario evitar de forma razonable los falsos negativos, por lo que establecer puntos de cortes demasiado exigentes podría disminuir la sensibilidad de la prueba. Los denominados patrones SNAP deben analizarse cuidadosamente en la práctica clínica, ya que algunos de estos pacientes podrían en realidad tener cambios biológicos de EA al igual que aquellos con niveles más bajos de amiloide.
A pesar de su naturaleza retrospectiva, este estudio estuvo constituido por un grupo de pacientes muy bien definido basado en parámetros clínicos y biológicos, procedente de un único centro con unos sesgos de selección y sistemática de actuación uniformes. La exclusión de sujetos con comorbilidades o factores que podrían haber agravado el rendimiento cognitivo también contribuyó a la selección final de una muestra muy homogénea. La principal limitación fue la falta de una única herramienta o prueba utilizada para definir la progresión de DCL a demencia, que se realizó mediante el juicio clínico, pruebas neuropsicológicas y funcionales individualizadas. Una peculiaridad, más que una debilidad, fue el método de selección de casos, diseñado para identificar casos con DCL debido a EA sobre otras consideraciones, puesto que es la población que se pretende estudiar. A pesar de la heterogeneidad en la evaluación clínica, cada paciente incluido en este análisis cumplió con todos los criterios de NIA-AA para ser clasificados como DCL al inicio y para determinar la progresión a demencia durante el seguimiento. Otro a punto para tener en cuenta es que el resultado de los biomarcadores era conocido por los neurólogos durante el seguimiento, aunque creemos improbable que esto haya influido a la hora de determinar la progresión del cuadro a demencia, pues esta decisión se basó exclusivamente en aspectos clínicos y no en parámetros biológicos.
Nuestros resultados sugieren que en pacientes con deterioro cognitivo leve debido a EA según criterios clínicos y un perfil licuoral alterado de biomarcadores, existe una correlación entre los niveles de tau total o fosforilada y el riesgo de progresión demencia que va más allá de la discriminación entre valores normales y alterados: concentraciones progresivamente mayores de estos biomarcadores se asocian a un mayor riesgo de progresión a demencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.