La demencia (D) se presenta con alta prevalencia en los adultos mayores con gran repercusión personal y socioeconómica. El objetivo de este trabajo fue determinar en los pacientes, del mundo real, que consultaron por trastornos cognitivos conductuales (TCC), las condiciones de diagnóstico y las medidas terapéuticas previas y posteriores a la evaluación.
Material y métodoEstudio naturalístico de corte horizontal que incluyó pacientes que realizaron su primera consulta por TCC en un centro de referencia de Mendoza, Argentina.
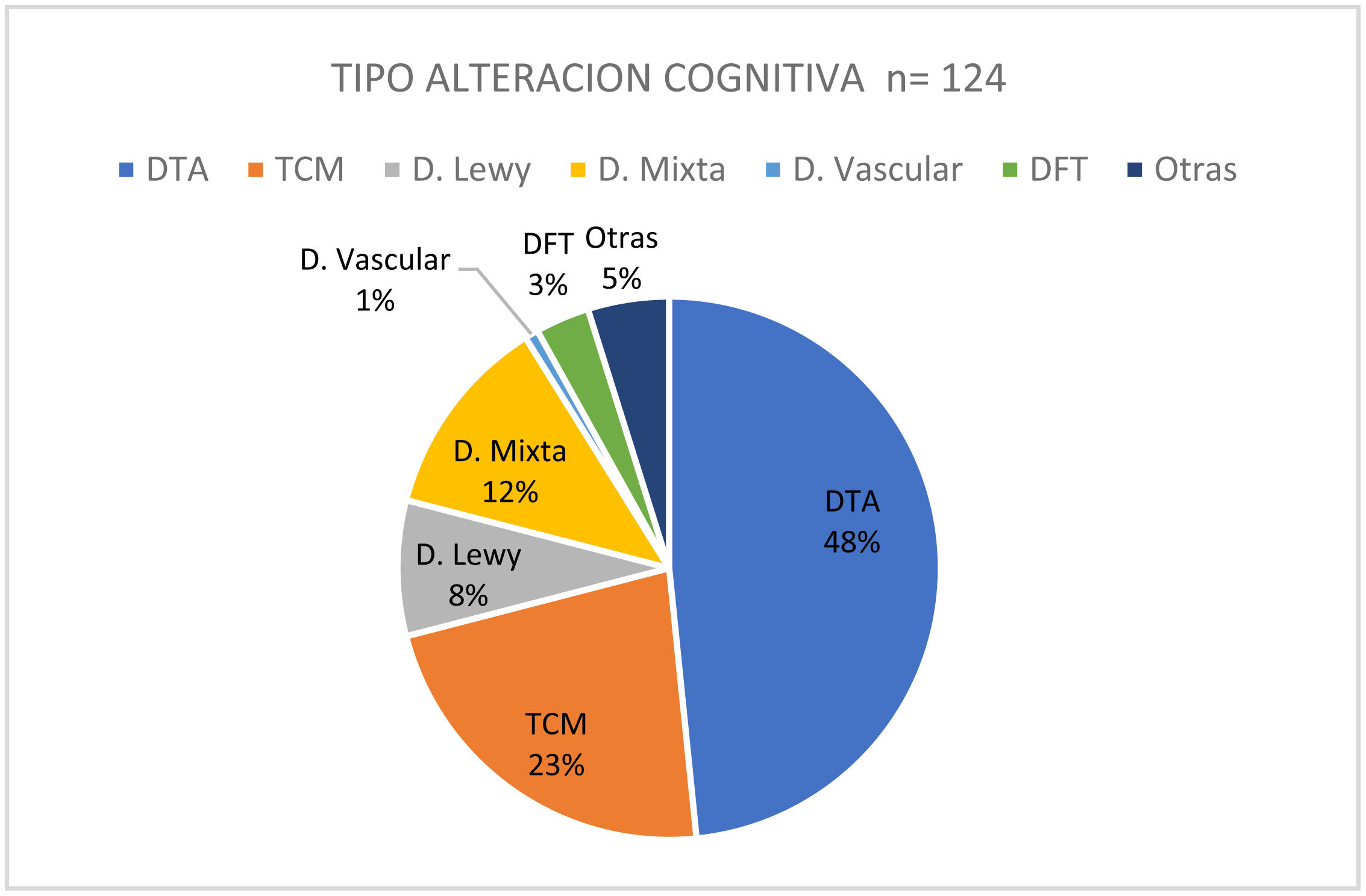
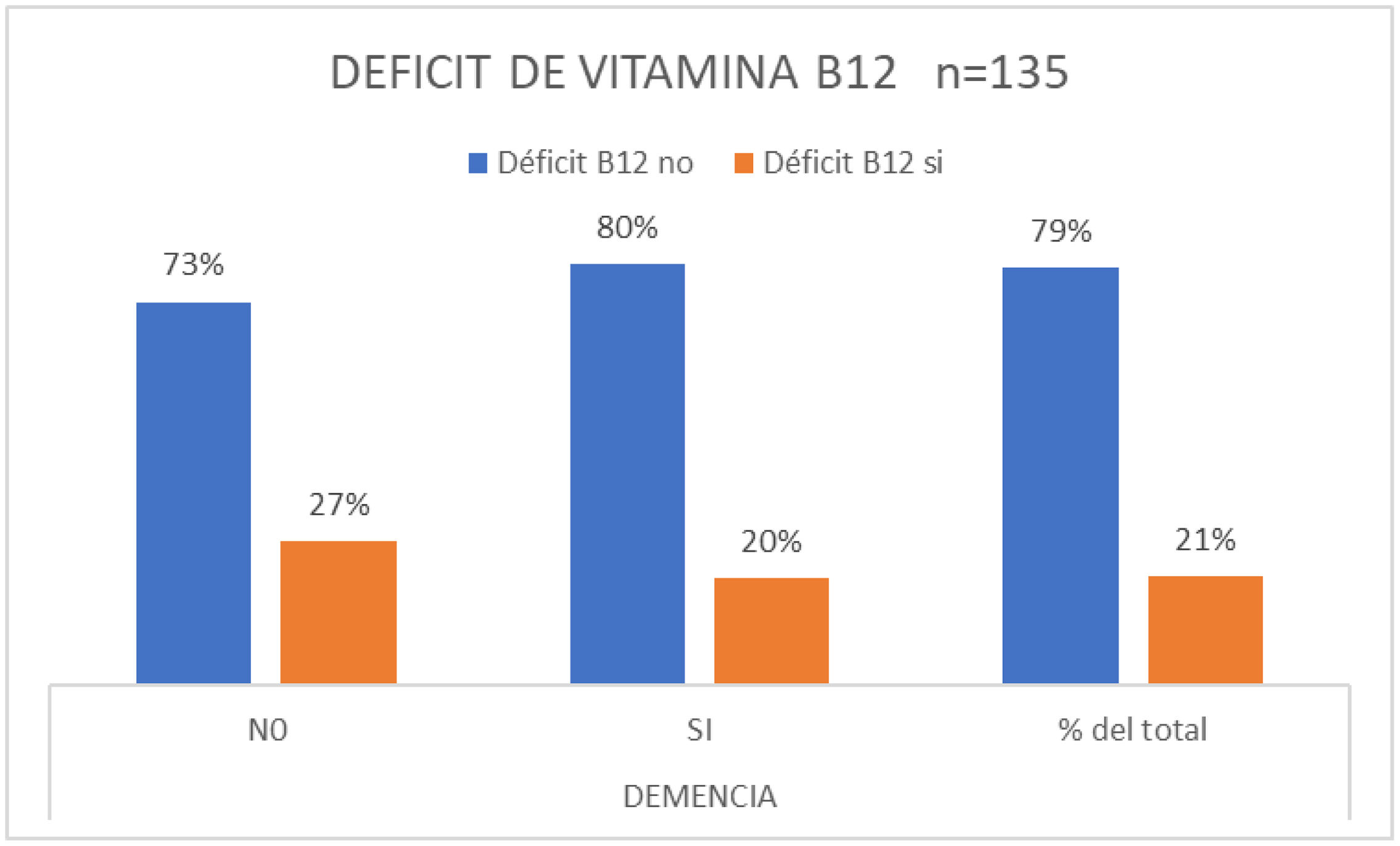
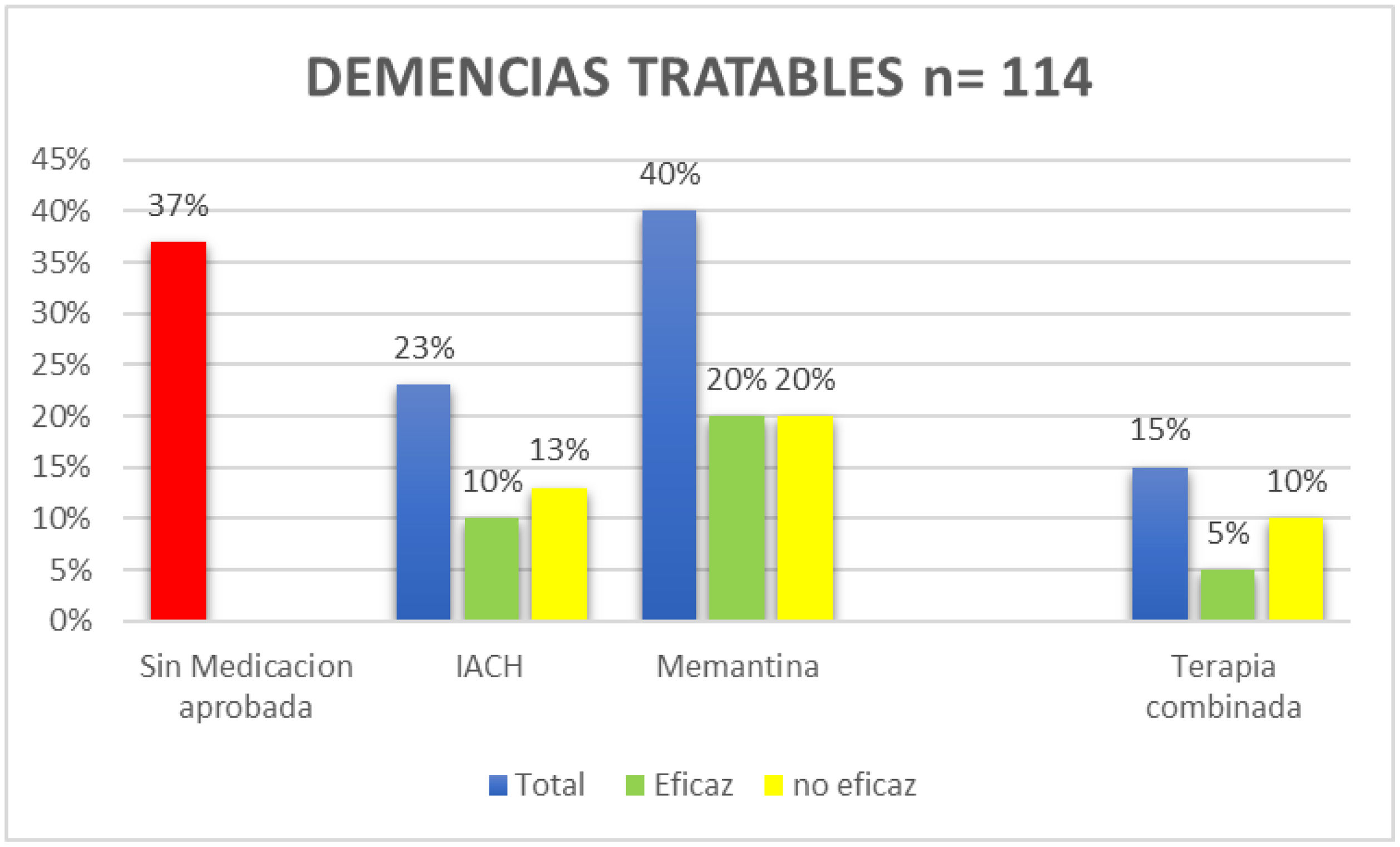
ResultadosSe incluyeron 135 pacientes, edad media de 76 años. Se diagnosticó un TCC definido en 124 pacientes (92%). El 48% correspondió a D enfermedad de Alzheimer (DTA), el 23% al trastorno cognitivo menor (TCM), el 12% a D mixta, el 8% a D de Lewy (DCL), el 3% a D frontotemporal (DFT) y el 6% a otros deterioros. Ciento quince pacientes tenían una o más consultas previas por TCC (ULT), los restantes lo hacían por primera vez (PV). En el grupo ULT el 74% fueron evaluados por médicos de atención primaria (cabecera o de familia). La presencia de D/TCM se relaciona a mayor edad (76/69 años; p=0,009) y a duración de los síntomas (2,6/1,4 años; p=0,014). Un 29% de los pacientes ULT habían sido sometidos a laboratorio de rutina y el 56% a neuroimagen. Se detectó déficit de vitamina B12 (D-B12) en el 21%. Con respecto al diagnóstico previo: el 48% no traían un diagnóstico definido, el 26% referían diagnósticos tales como senilidad, D senil, ateroesclerosis, D asociada a la edad, etc. En el grupo de D tratables el 37% no recibía ningún tipo de medicación, el 16% recibía medicaciones sin ningún grado de recomendación para su uso, el 40% tomaba memantina (el 20% dosis óptimas), el 23% un IACH (el 10% dosis óptimas), un 15% estaba con terapia combinada y de ellos solo el 5% en dosis eficaces. Al 20% del grupo total se le había indicado, mencionado y/o realizaba actividad física regular, el 17% estimulación cognitiva y el 14% dieta saludable.
ConclusionesSe hace imperioso implementar enérgicas y sostenidas medidas educativas a fin de difundir algoritmos diagnósticos y terapéuticos para el correcto manejo de los TCC. Las mismas deberían incluir el uso de terapias no farmacológicas también en el área de la prevención. Lo anterior permitirá optimizar y homogeneizar el manejo integral de estas devastadoras enfermedades.
Dementia (D) are presented with high prevalence in older adults with great personal and socioeconomic impact. The objective of this study was to determine in patients, from the real world, who consulted for cognitive behavioral disorders (CBD), the diagnostic conditions and the therapeutic measures before and after the evaluation.
Material and methodNaturalistic horizontal study that included patients who made their first consultation for CBD in a reference center in Mendoza, Argentina.
ResultsA total of 135 patients were included, mean age 76 years. A definite CBD was diagnosed in 124 patients (92%). The 48% corresponded to Alzheimer's (AD), 23% Mild Neurocognitive Disorder, 12% D. Mixed, 8% D. Lewy (DL), 3% D. Frontotemporal (DFT) and 6% other impairments. 115 patients had one or more previous consultations for CBB (ULT), the rest did so for the first time (PV). In the ULT group, 74% were evaluated by primary care physicians (general or family). The presence of D/TCM is related to older age (76/69 years P=.009) and duration of symptoms (2.6/1.4 years P=.014). 29% of ULT patients had undergone routine laboratory and 56% neuroimaging. Vitamin B12 (D-B12) deficiency was detected in 21%. Regarding the previous diagnosis: 48% did not have a definite diagnosis, 26% reported diagnoses such as senility, Senile D, atherosclerosis, age-related D, etc. In the group of treatable D. 37% did not receive any type of medication, 16% received medications without any degree of recommendation for use, 40% were taking memantine (20% optimal doses), 23% an anticholinesterases drugs (10% optimal doses), 15% were on combination therapy and of them only 5% in effective doses. 20% of the total group had been indicated, mentioned and/or performed regular physical activity, 17% cognitive stimulation and 14% healthy diet.
ConclusionsIt is imperative to implement energetic and sustained educational measures to disseminate diagnostic and therapeutic algorithms for the correct management of CBD. These should include the use of non-pharmacological therapies, also around prevention. This will optimize and homogenize the comprehensive management of these devastating diseases.
Las demencias (D) en general y la enfermedad de Alzheimer (DTA) en particular son un grupo de enfermedades que afectan a personas adultas mayores, aunque también puede afectar a personas más jóvenes (cuarta, quinta o sexta década), por ejemplo, cuando existen formas neurodegenerativas de índole familiar o son secundarias a procesos autoinmunes (D potencialmente reversibles.) Este tipo de enfermedades tienen un alto impacto en la salud y en la calidad de vida del paciente, de sus familiares y/o de sus cuidadores. También implican un gran efecto negativo desde el punto de vista social, económico y sanitario1–6.
Se estima que su incidencia y prevalencia aumentará significativamente en el futuro de tal forma que para el año 2050 se espera que se multiplique por 3 o por 4 la cantidad de pacientes con D en la mayoría de los países subdesarrollados1. El impacto podría ser menor en los países del primer mundo probablemente debido a un mejor control de los factores modificables para este tipo de padecimientos (prevención) como así también a una mayor eficiencia en el manejo de las primeras etapas de la enfermedad1,7.
Si bien no contamos actualmente con terapias farmacológicas que puedan detener o modificar significativamente la evolución natural de las D existen medidas farmacológicas y no farmacológicas que han demostrado claros beneficios para los que cursan por ejemplo una DTA y en menor medida otras como en la D tipo Lewy (DCL) o D vascular7–10.
Un adecuado y temprano diagnóstico descartando causas potencialmente reversibles o factores modificables que puedan coexistir son también medidas muy importantes para el correcto manejo de las alteraciones cognitivas/conductuales1,11.
El objetivo principal del presente trabajo fue tratar de determinar en un grupo de pacientes, del mundo real, que consultaron por TCC, las condiciones de diagnóstico y las medidas terapéuticas previas y posteriores a la evaluación.
Material y métodosEl presente estudio naturalístico prospectivo de corte horizontal incluyó a todos los pacientes que realizaron su primera consulta por trastornos cognitivos y/o conductuales en un centro de referencia privado de la provincia de Mendoza, Argentina durante el periodo comprendido entre el mes de junio del año 2021 y mismo mes del 2022. Para ser incluidos debieron completar la valoración y al menos realizar una segunda consulta de devolución. No se incluyeron pacientes que consultaban solamente por prevención, no dieron su consentimiento y/o su idioma primario fuera otro que el español.
La evaluación consistió en una entrevista semiestructurada con la determinación de antecedentes de la enfermedad actual, examen clínico y neurológico, evaluación neuropsicológica, escalas de depresión y funcionalidad. Se agregaron estudios neuro radiológicos y análisis de rutina, que incluyó dosaje de vitamina B12, ácido fólico, perfil tiroideo, VDRL y eventualmente HIV. Los exámenes complementarios se ampliaron según la necesidad diagnóstica de cada caso. La evaluación neuropsicológica incluyo el Mini-Mental de Folstein (MMST), el test ACE-III, y un protocolo abarcativo y semi estructurado, que incluyo pruebas de memorias en sus diferentes formas, función ejecutiva, atención, velocidad de procesamiento, visuo espacialidad, funciones frontales, lenguaje, praxias (todos en su versiones adaptadas y validadas para la población estudiada), para los analfabetos o iliteratos se les aplicó la batería Neuropsi y como complemento el Fototest (versión online de Dr. Cristóbal Carnero Pardo et al.).
También se incluyeron escalas para evaluar ánimo, trastornos conductuales y funcionalidad de los pacientes.
Se registró en forma detallada consultas, diagnósticos, estudios y tratamientos previos a la visita inicial al centro, también se asumió como paciente con consulta cognitiva ulterior aquellos que recibían alguna medicación destinada a tal fin. Se incluyeron preguntas sobre realización y/o prescripción previa de terapias blandas no farmacológicas (TBNF) a saber actividad física regular, estimulación cognitiva rutinaria y/o dieta saludable.
El diagnóstico de la alteración cognitiva final fue hecho siguiendo los criterios clínicos según DSM-V y el agregado de criterios específicos para cada patología especial: trastorno cognitivo menor (TCM), DTA, D vascular, DCL, D frontotemporal, D en enfermedad de Parkinson, D mixta, etc.
Todos los pacientes o su tutor legal firmaron un consentimiento Informado para el uso de la información resguardando siempre la identidad de estos.
ResultadosDe acuerdo con los criterios de inclusión se lograron registrar 135 pacientes. La edad media fue de 76 años con desviación estándar (DE): 7. El 62% (83) correspondieron al sexo femenino.
Del total se diagnosticó finalmente una alteración cognitiva en 124 pacientes (92%). De ellos el 48% correspondían a DTA, un 23% a TCM, seguido del 12% para D mixta, del 8% de DCL, del 3% de DFT, del 1% D vascular pura y del 5% de otros deterioros (fig. 1).
Del total 110 pacientes tenían una o más visitas previas por alteraciones cognitivas conductuales (ULT) y los 20 restantes lo hacían por primera vez (PV).
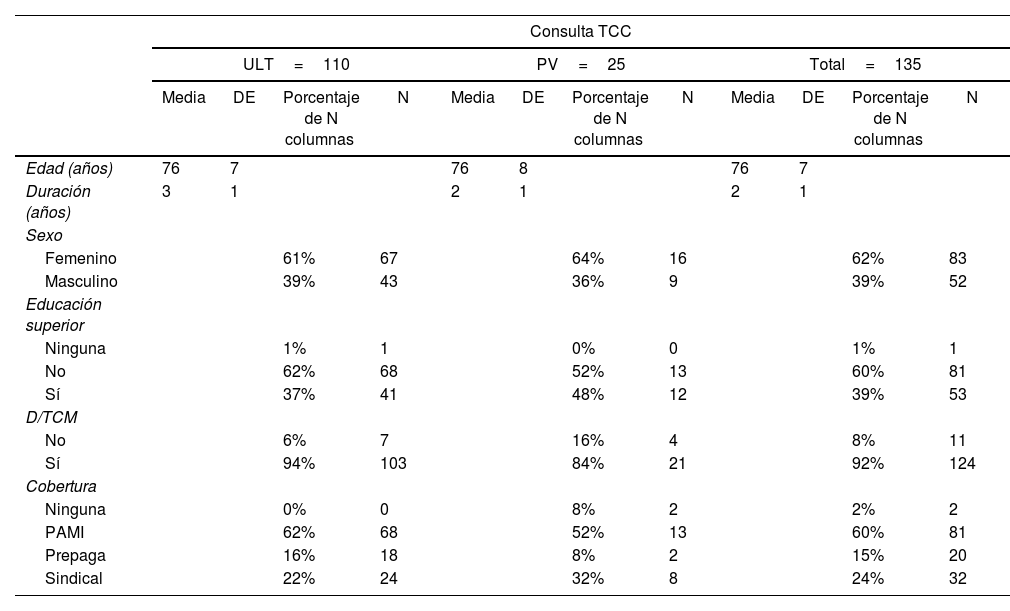
Los datos demográficos de la serie total y de los subgrupos ULT y PV quedan contenidos en la tabla 1.
Datos demográficos de la muestra que consultaron por TCC
| Consulta TCC | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ULT=110 | PV=25 | Total=135 | ||||||||||
| Media | DE | Porcentaje de N columnas | N | Media | DE | Porcentaje de N columnas | N | Media | DE | Porcentaje de N columnas | N | |
| Edad (años) | 76 | 7 | 76 | 8 | 76 | 7 | ||||||
| Duración (años) | 3 | 1 | 2 | 1 | 2 | 1 | ||||||
| Sexo | ||||||||||||
| Femenino | 61% | 67 | 64% | 16 | 62% | 83 | ||||||
| Masculino | 39% | 43 | 36% | 9 | 39% | 52 | ||||||
| Educación superior | ||||||||||||
| Ninguna | 1% | 1 | 0% | 0 | 1% | 1 | ||||||
| No | 62% | 68 | 52% | 13 | 60% | 81 | ||||||
| Sí | 37% | 41 | 48% | 12 | 39% | 53 | ||||||
| D/TCM | ||||||||||||
| No | 6% | 7 | 16% | 4 | 8% | 11 | ||||||
| Sí | 94% | 103 | 84% | 21 | 92% | 124 | ||||||
| Cobertura | ||||||||||||
| Ninguna | 0% | 0 | 8% | 2 | 2% | 2 | ||||||
| PAMI | 62% | 68 | 52% | 13 | 60% | 81 | ||||||
| Prepaga | 16% | 18 | 8% | 2 | 15% | 20 | ||||||
| Sindical | 22% | 24 | 32% | 8 | 24% | 32 | ||||||
DE: desviación estándar; D/TCM: demencia/trastorno cognitivo menor; PAMI: programa de atención médica integral; PV: consulta por primera vez; TCC: trastornos cognitivos conductuales; ULT: con consultas previas.
Los pacientes que tenían educación media o superior alcanzaron al 39% del total. La mayoría correspondió a escolarización primaria completa e incompleta y un porcentaje del 0,6% fue analfabeta. En cuanto a la cobertura para atención médica el 2% refirió no tener cobertura alguna, el grupo mayoritario (60%) pertenecía a PAMI (Instituto Nacional de Servicios Sociales para jubilados y pensionados) y el resto cobertura con una prepaga u obra social sindical (15 y 24%, respectivamente) (tabla 1). En el grupo ULT el 74% había sido evaluado por médicos de atención primaria ya sea médico de cabecera o médico de familia.
En el grupo de pacientes con TCC se encontró valor medio del MMST de 21,6 puntos (DE: 4,2) con un rango de 7 a 30 y una valoración clínica de D (versión española del CDR) de 1,2 (desvío estándar de 0,9) y rango de 0,5 a 3.
Respecto al diagnóstico final, el 92% de los que consultaron recibieron el diagnóstico de D/TCM, el 94% del grupo ULT y el 84% en primera consulta siendo la diferencia no significativa (tabla 1).
Se detectó D-B12 en el 21% de todos los pacientes, el 27% en el grupo sin D/TCM y en el 20% con alteración cognitiva (fig. 2).
La realización de biomarcadores de amiloide o Tau (PET/PIT y/o LCR) fueron realizados en 4 pacientes de la cohorte total equivalente al 3%.
Etapa diagnóstica previaLa presencia de D/TCM en el grupo total se relaciona a mayor edad (76 vs. 69 años; p=0,009) y a la duración de los síntomas (2,6 vs. 1,4 años; p=0,014).
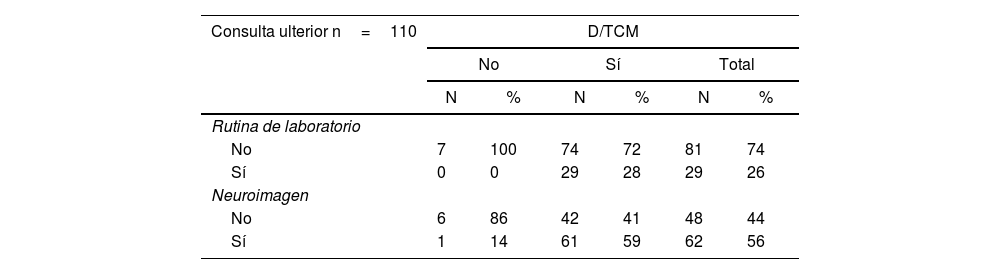
Entre los estudios previamente realizados destaca que un 29% de los pacientes del grupo ULT había sido sometido a análisis de laboratorio de rutina, mientras que el 56% a una neuroimagen (tabla 2).
Detalle de la realización de estudios de laboratorio y neuroimágenes en el grupo de consulta ulterior según la presencia de D/TCM
| Consulta ulterior n=110 | D/TCM | |||||
|---|---|---|---|---|---|---|
| No | Sí | Total | ||||
| N | % | N | % | N | % | |
| Rutina de laboratorio | ||||||
| No | 7 | 100 | 74 | 72 | 81 | 74 |
| Sí | 0 | 0 | 29 | 28 | 29 | 26 |
| Neuroimagen | ||||||
| No | 6 | 86 | 42 | 41 | 48 | 44 |
| Sí | 1 | 14 | 61 | 59 | 62 | 56 |
D/TCM: demencia/trastorno cognitivo menor.
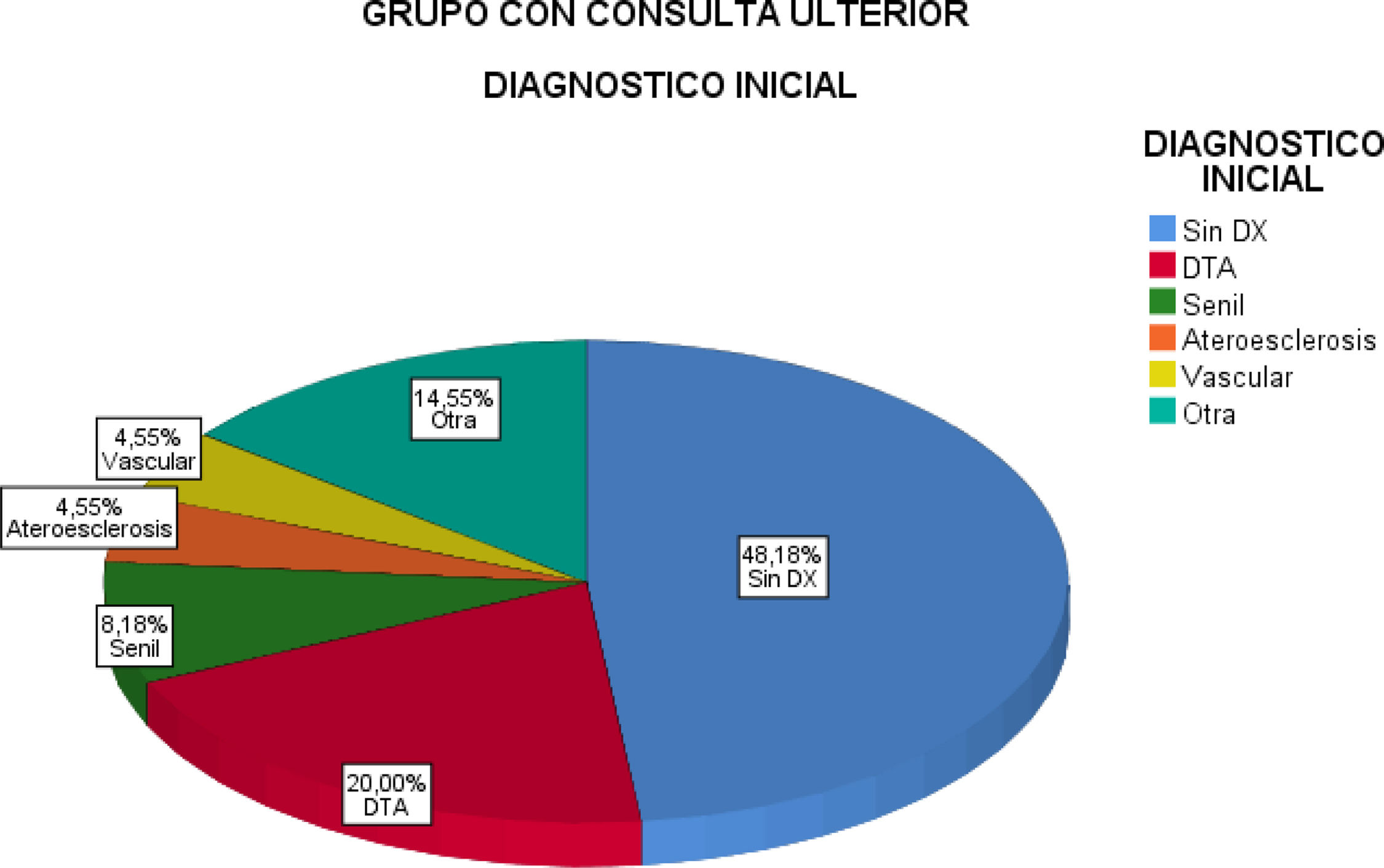
Con respecto al diagnóstico etiológico previo se destaca que el 48% no traía un diagnóstico definido, un 26% referían diagnósticos tales como senilidad o D senil, ateroesclerosis y otros incluidos D asociada a la edad, etc. Un 20% de DTA. Ninguno había recibido el diagnóstico de TCM (fig. 3).
Tratamiento farmacológico previoPara el análisis del tratamiento previo se agrupó a los trastornos cognitivos con recomendaciones de potencial tratamiento farmacológico (TCM, DTA, D de Lewy, mixta y vascular) obteniendo una n=114.
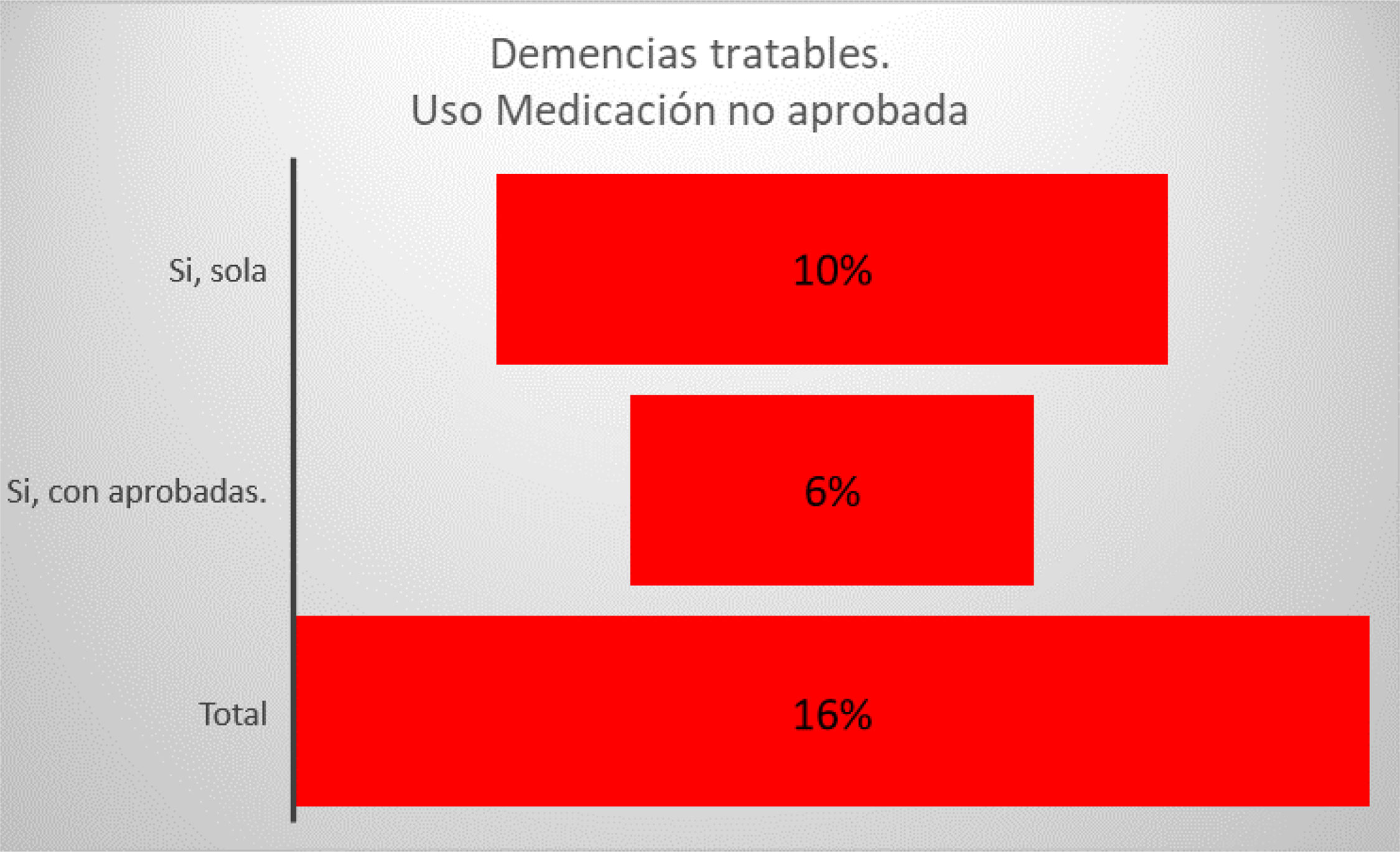
Los resultados en este grupo mostraron que: el 37% no recibía ningún tipo de medicación aprobada, el 16% recibía medicaciones sin ningún grado de evidencia para su uso en estas enfermedades, el 40% recibía memantina (20% en dosis óptimas), 23% con un IACH (10% en dosis óptimas), de estos un 15% estaba con terapia combinada, solo el 5% en dosis eficaces (figs. 4 y 5).
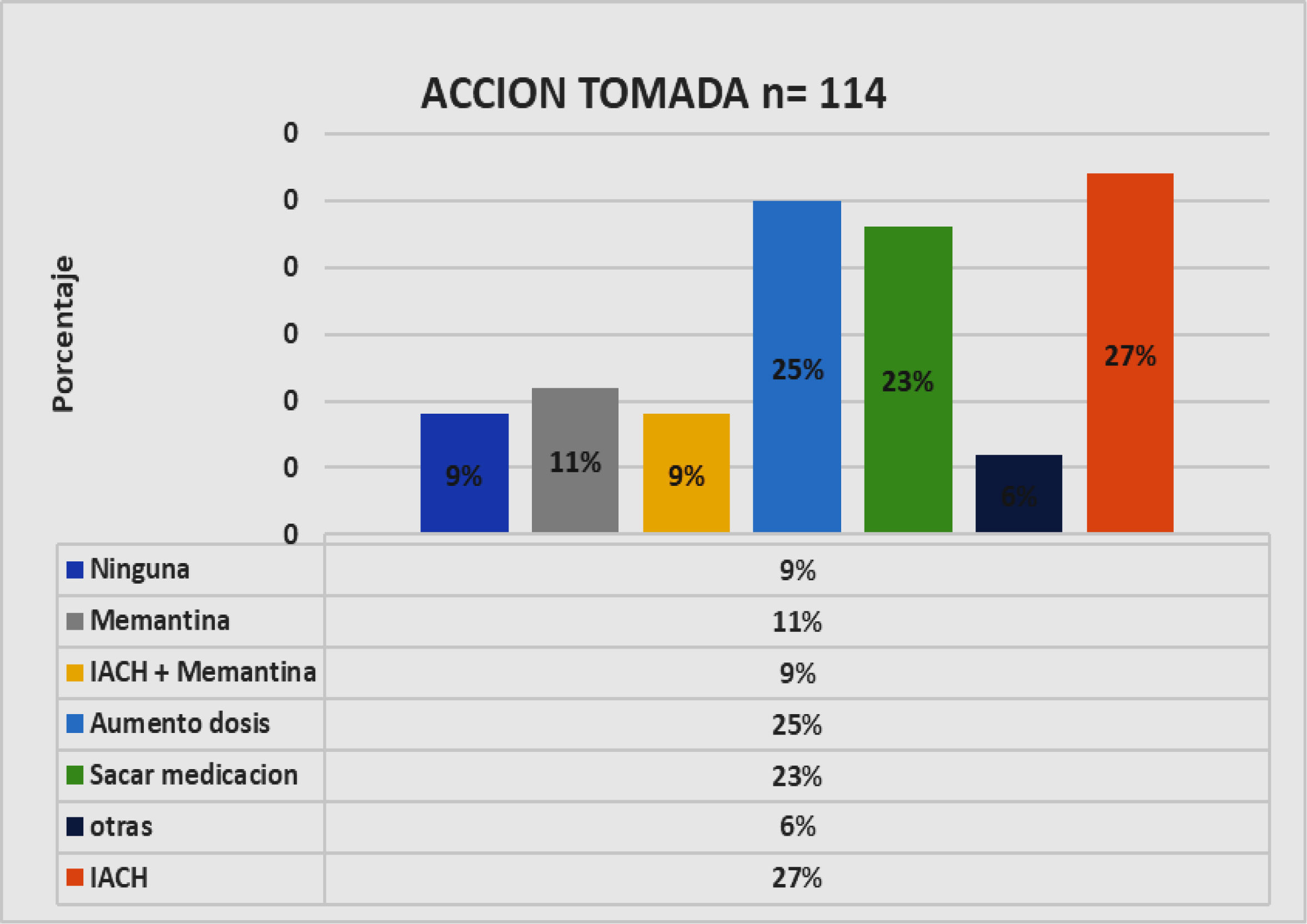
En cuanto a la acción tomada después de la evaluación completa en nuestro centro y con relación a su terapia previa para la D, en este grupo de pacientes, se destaca el uso de un inhibidor de la acetilcolinesterasa (IACH) en un 27%, el aumento de la dosis en el 25% ya sea del IACH o la memantina ya utilizados, iniciación de memantina 11%, asociación de IACH más memantina 9%. Se enfatiza que al 23% se le discontinuó una o más medicación, generalmente correspondió a aquellas que no tenían recomendación alguna para su uso (tipo nimodipina, Ginkgo biloba, dihidroergotoxina, citicolina, piracetam, bifemelano, cannabis, entre otras) y también discontinuación de fármacos aprobados por efectos secundarios (figs. 5 y 6).
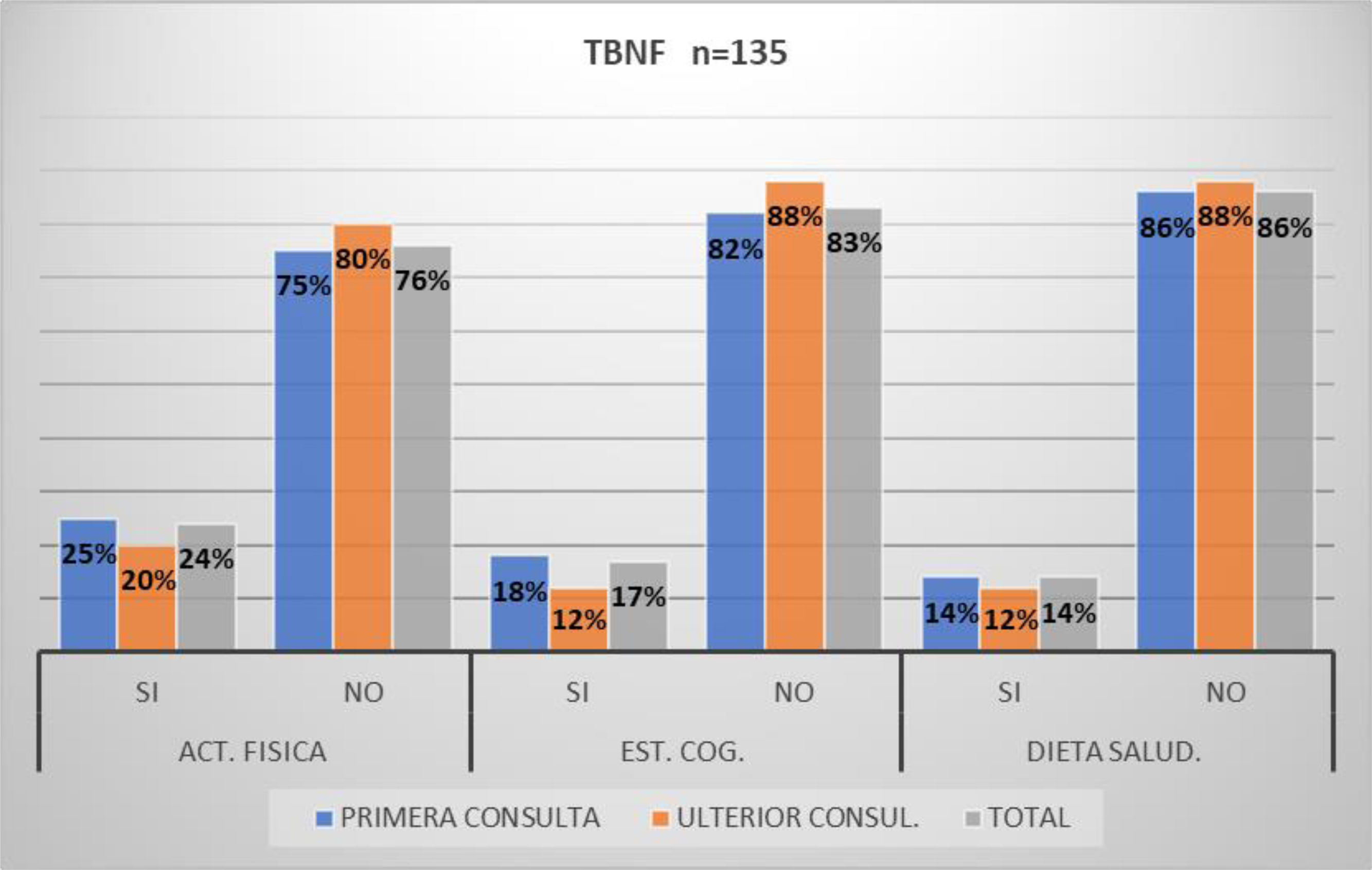
Tratamiento no farmacológicoCon respecto a la TBNF en el grupo total de consulta inicial (n=135) se menciona que un 20% realizaba, se le había indicado y/o mencionada actividad física regular, el 17% estimulación cognitiva y/o un 14% dieta saludable. Los anteriores porcentajes no varían significativamente para los que consultaron por PV o de ULT, tampoco para los pacientes portadores de D/TCM vs. normales (fig. 7).
DiscusiónEsta serie de pacientes de la práctica clínica habitual que consultó a nuestro centro neurológico sub-especializado del ámbito privado, por alteraciones cognitivas conductuales muestra que la mayoría (85%) lo hacían luego de haber recibido una o más consultas por esa problemática. Las mismas habían sido efectuadas en mayor proporción en el ámbito de la atención primaria.
En el 92% se diagnosticó una alteración cognitiva consistente con D o TCM, una mayor edad y duración de los síntomas se correlacionó estadísticamente con la presencia de estas.
En el grupo ULT se destaca la baja tasa (26%) de realización de estudios de laboratorio de rutina como así también que solo un 56% fue sometido a una neuroimagen, en los pacientes con D/TCM un 72 y un 40%, respectivamente no tenían efectuado estos exámenes complementarios siendo que los mismos son altamente recomendados en el estudio sistemático de los problemas cognitivos12,13.
Ante lo anterior no fue una sorpresa encontrar que el D-B12 estuviese presente en el 21% del total y fuera aún mayor en el grupo de consulta sin D/TCM con el 27%. Estos hallazgos resultan ser más elevados si se los compara con los mencionados en la literatura. Por ejemplo, recientemente Asako Ueno et al.14 refieren la presencia de déficit de vitamina B12 en una proporción del 4,5% para una cohorte de 1.716 pacientes externos que consultaron en una clínica cognitiva en Japón. Existen claras evidencias que el D-B12 y de folatos puede influir negativamente en el funcionamiento cognitivo a través de distintos mecanismos12,14. Más controvertidos son los resultados que se obtienen de los estudios sobre las respuestas obtenida con la suplementación sostenida y rutinaria de la vitamina B12 en pacientes con D (D potencialmente reversibles) o de manera preventiva en personas normales. Sin embargo, está bien establecido que todos los pacientes con alteraciones cognitivas deben ser evaluados para déficit de B12 y suplementados si se constata el mismo12–16.
El bajo número de pacientes en los que se realizaron biomarcadores específicos para amiloide o Tau fue influido por la falta de disponibilidad y/o accesibilidad de estos en nuestro medio, escenario que se repite en casi todo el territorio de la República Argentina.
Destacamos la falta de diagnóstico definitivo, que habían recibido los pacientes con consultas previas (grupo ULT), o la utilización de una nomenclatura diagnóstica no pertinentes u obsoletas tales como D senil, ateroesclerosis, D asociada a la edad, senilidad, entre otros (fig. 3). Ningún paciente traía diagnóstico de trastorno cognitivo menor o mínimo pese a que luego un significativo porcentaje de esa condición fue establecida. El 23% determinado en nuestra muestra, para esa condición, está muy cercano al máximo de la prevalencia referida en distintos estudios. Por ejemplo, varios estudios latinoamericanos, incluido uno en Argentina, refieren prevalencias de TCM que oscilan entre 6, 8 y 25,5%17, En esos reportes se enfatiza que estos guarismos son superiores a los encontrados en otros países especialmente en aquellos de los llamados del primer mundo. En nuestra cohorte es probable que estos resultados tengan que ver en parte con algunos de los sesgos de selección, especialmente en lo que respecta al grado de especialización de nuestro centro en este tipo de enfermedad y las características socioeconómicas de la población atendida.
Todo lo antes expuesto denota claramente la falta de conocimiento o en su defecto de implementación de los algoritmos diagnósticos para alteraciones cognitivas como así también la confusión o desinformación que existe sobre la correcta nomenclatura de las distintas entidades que conforman las alteraciones cognitivas de los adultos mayores.
Está bien determinado que la falta, el error y/o el retardo diagnóstico tienen implicancias en el tratamiento, la evolución y el impacto socioeconómico de este tipo de enfermedades. La ausencia de un adecuado y correcto diagnóstico influye negativamente en la relación costo beneficio de las terapias empleadas para la Enfermedad de Alzheimer como pudo determinarse en el estudio de Darshan Zala et al. entre otros7,13.
Con respecto al tratamiento antidemencial que tenía prescrito el grupo ULT, y tomando como referencia al grupo de pacientes con D potencialmente tratables, se destaca que una proporción muy importante (37%) no recibían tratamiento alguno, mientras que otro (16%) recibían alguna medicación con eficacia no demostrable (fig. 5). En nuestra muestra la droga antidemencial más utilizada fue la memantina con un 40%, solo el 20% en dosis óptimas, de igual manera un 23% recibió un IACH y en su mayoría en dosis subóptimas. La asociación de ambas se utilizaba en el 15% pero solo un 5% en dosis óptimas. Solo el 30% de los pacientes tratados recibía un tratamiento con dosis óptimas en cualquiera de sus opciones. En resumen, solo 63% recibían tratamientos farmacológicos aprobados. En este sentido llama poderosamente la atención el alto porcentaje de pacientes sin medicación o el uso de tratamientos sin ningún grado de evidencia que recomienden su uso (figs. 4 y 5).
También es interesante destacar que la medicación más utilizada fue la memantina, droga recomendada y autorizada generalmente para etapas moderadas a severas. La mayoría de los datos etiopatogénicos, los ensayos clínicos, las guías y las autorizaciones de parte de los entes reguladores recomiendan a los IACH como droga de primera línea con indicación en todas las etapas de la enfermedad siempre que no existan contraindicaciones o intolerancia para las mismas7–10,12,18–22. En concordancia a lo anterior varios de los estudios previamente publicados revelan que los IACH especialmente el donepecilo serían en muchos países la medicación antidemencial más utilizada en la enfermedad de Alzheimer1,8,18–20. Sin embargo, una gran encuesta en los EE. UU. (año 2006) mostró que a menos del 50% de los pacientes con Alzheimer se les recetaron IACH hecho que se observa también en nuestra muestra con mayor intensidad ya que accedieron a un IACH solo o combinado el 23% de los pacientes y de ellos solo el 10% en dosis eficaces. En otra encuesta, los médicos de atención primaria de EE. UU. tenían puntos de vista ambivalentes (51%) o negativos (31%) sobre el tratamiento de la D con IACH23. Los datos clínicos respaldan el uso del tratamiento con IACH en todas las etapas de la enfermedad, a pesar de ello y como ya se mencionó a menudo se aplican en dosis subóptimas o no se usan en absoluto19–21.
Desafortunadamente, con demasiada frecuencia, una interpretación incorrecta de la gravedad de los efectos secundarios de los IACH y/o la utilización de dosis subóptimas conducen a una infra dosificación, al cese abrupto de la terapia o a la clasificación de los pacientes como no respondedores, lo que priva a muchos enfermos al tratamiento con este tipo de drogas24. Una dosis más alta de IACH produce una mejoría significativa tanto en la cognición como en la función global en individuos con una disfunción cognitiva más grave25.
También existen estudios que revelan que la combinación de un IACH y memantina tienen un sustento biológico como así también evidencias clínicas para su uso en la DTA12,26,27. En nuestra muestra la combinación de IACH y memantina fue realmente baja para los pacientes que ya cursan una D establecida llegando al 15% y solo en el 5% con dosis óptimas de los 2 fármacos (fig. 5).
Por último, se menciona que el porcentaje de pacientes/familiares/cuidadores que practicaban activamente y/o conocían los efectos beneficiosos de las llamadas terapias blandas no farmacológicas fue realmente muy bajo tanto para el grupo de consulta de PV como de ulterior (fig. 7). No se encontraron referencias nacionales respecto al relevamiento de la implementación sistemática de este tipo de terapias. A nivel internacional la búsqueda bibliográfica revela que existen datos alentadores en cuanto a los resultados de la utilización de este tipo de intervenciones, sin embargo, las mismas también exponen la necesidad de nuevos estudios sistemáticos que unifiquen conceptos en cuanto al tipo de terapia aplicada, su intensidad, frecuencia como así también las formas de medir su impacto sobre la enfermedad o su prevención28,29,13.
Un minucioso metaanálisis efectuado por María Julieta Russo et al.30 con respecto al papel de la actividad física y cognición plantea claramente esta situación dual, por un lado los beneficios sobre los aspectos cognitivos/conductuales/funcionales pero por otro el grado de incertidumbre en cuanto a los distintos tipos de intervenciones aplicadas,desde el punto de vista cuali o cuantitativo, como así también la dificultad para comparar los resultados debido a la heterogeneidad de los métodos empleados para medir sus eficacias. Los mismos comentarios valen a la hora de evaluar la estimulación o rehabilitación cognitiva, dieta saludable o control estricto de factores de riesgo vascular en pacientes con trastornos cognitivos constituidos30. Sin embargo, diversos estudios poblacionales y al menos uno de intervención preventiva parecen indicar claramente los beneficios de la intervención multimodal no farmacológica31–36.
Estamos conscientes que nuestra muestra no representa al universo total de pacientes con D de nuestra región por varios motivos: el número de pacientes reclutados seguramente es bajo, no hubo pacientes de la esfera pública, se incluyeron solo los que tuvieron acceso a un centro privado (sesgo por conveniencia) y además seguramente también estén sobrerrepresentados aquellos que no anduvieron bien o no recibieron adecuada atención en las consultas previas. Sin embargo, a pesar de estas restricciones, creemos que esta cohorte puede ser representativa de un gran número de pacientes con D provenientes del mundo real, especialmente aquellos que tienen cobertura médica y accedieron previamente a la atención primaria vía médico de cabecera o de familia.
En resumen, deseamos enfatizar las importantes falencias que se revelan en este grupo de pacientes con alteraciones cognitivas en cuanto al manejo de la faz diagnóstica como así también en la aplicación de pautas terapéuticas farmacológicas y no farmacológicas (terapias blandas).
En esta segunda década del siglo XXI se avizoran nuevas y prometedoras moléculas terapéuticas para el tratamiento de las D especialmente para la enfermedad de Alzheimer, pero debemos enfatizar que aún no se terminan de reunir claramente pautas de eficacia, eficiencia y seguridad para difundir su uso en la práctica clínica habitual37–40.
En ese contexto se hace imperioso la necesidad de implementar enérgicas y sostenidas medidas educativas a fin de difundir algoritmos diagnósticos y terapéuticos que incluyan terapias no farmacológicas, estas últimas también en el área de la prevención de estas devastadoras enfermedades. Las mismas permitirían homogeneizar el manejo integral de las alteraciones cognitivas desde su nomenclatura hasta su prevención mitigando en parte su impacto en un futuro no muy alejado. También mejorar la calidad de vida de los pacientes, sus familias y cuidadores sin omitir el beneficio a nivel de los costos sociales y económicos. Por último, también se generará un terreno más fértil a la hora de promover ensayos clínicos aleatorizados o estudios desde el mundo real (naturalísticos) intentando buscar nuevas pautas terapéuticas o preventivas para los trastornos cognitivos y/o conductuales1–5,11–13.
Estas tareas especialmente de educación y divulgación seguramente deberían recaer, al menos en nuestro país, en las autoridades de salud pública, como así también partir de los claustros de enseñanzas de pregrado (universidades) y de postgrado (tales como asociaciones o sociedades vinculadas a la formación de especialista y a la educación médica continua). Deben además llegar con más énfasis y con mensajes claros a los prestadores de la salud que se ocupan de la atención primaria como así también a toda la sociedad en general.
FinanciaciónEl presente estudio no ha recibido financiación externa de ningún tipo. Ha sido realizada en el seno de la Fundación Cerebro y Mente.
Conflicto de interesesEl Dr. Daniel Raul Zuin refiere haber recibido honorarios por disertaciones, educación continua, ensayos clínicos y/o apoyo para asistencia a congresos de parte de los laboratorios Bago, Richmond, Casasco, Baliarda, Biosidus y Gador.
El Dr. Francisco Peñalver refiere no tener conflicto de intereses.
La Lic. María Paula Zuin refiere no tener ningún conflicto de intereses.