La estimulación cerebral profunda (ECP) ha demostrado ser una terapia eficaz en el tratamiento de la enfermedad de Parkinson avanzada (EPA), aunque no está claramente establecido su efecto sobre la sintomatología no motora (SNM).
ObjetivoAnalizar la prevalencia de la SNM post-ECP y evaluar posibles factores relacionados.
Pacientes y métodosSe reclutaron pacientes intervenidos en nuestro centro entre los años 2005 y 2019, y se les aplicaron las siguientes escalas: del sueño de la enfermedad de Parkinson (PDSS), evaluación cognitiva de Montreal (MoCA), inventario de depresión de Beck, escala de severidad de hiposmia y dolor y un cuestionario de sintomatología disautonómica.
ResultadosSe analizaron 32 pacientes, obteniéndose una puntuación media de 83,56±30,3 en la PDSS, de 18,48±7,4 en la MoCA y de 18,53±8,8 en el inventario de Beck. El 93,7% de los pacientes presentaban tanto hiposmia como dolor, y todos ellos, algún síntoma disautonómico. El análisis estadístico reveló que tanto ser mujer (OR: 0,072; IC 95%: 0,007-0,713; p=0,025), como un menor tiempo de enfermedad (0R: 0,834; IC 95%: 0,692-0,999; p=0,05), se asociaban a una mejor calidad del sueño. Los peores resultados en la MoCA se relacionaron en el análisis bivariante con el tiempo de enfermedad (OR: 3,741; IC 95%: 3,7-12,5; p=0,01), perdiéndose dicha asociación en el multivariante. La presencia de síntomas premotores se asoció en el análisis univariante con una peor puntuación en el inventario de Beck (OR: 4,81; IC 95%: 1,001-25,65; p=0,05).
ConclusiónLos pacientes con EPA presentan importante SNM, a pesar de que hayan sido sometidos a ECP.
Deep brain stimulation (DBS) has proven to be an effective therapy in the treatment of advanced Parkinson's disease (APD), although its effect on non-motor symptomatology (NMS) is not clearly established.
ObjectiveTo analyze the prevalence of post-DBS NMS and evaluate possible related factors.
Patients and methodsPatients underwent surgery at our center between 2005 and 2019 were recruited and the following scales were applied: Parkinson's disease sleep scale (PDSS), MoCA (Montreal Cognitive Assessment), Beck Depression Inventory, severity scale of hyposmia and pain and questionnaire of dysautonomic symptomatology.
ResultsThirty-two patients were analyzed, obtaining a median of 86.56±30.3 in the PDSS, 18.48±7.4 in the MoCA and 18.53±8.8 in the Beck inventory. 93.7% of the patients presented both hyposmia and pain, and all of them, some dysautonomic symptom. Statistical analysis revealed that both being a woman [0.072 95% CI (0.007-0.713), P=.025], and a shorter illness time [0.834, 95% CI (0.692–0.999), P=.05], were related to better sleep quality. The worst results in the MoCA were related in the bivariate analysis with the time of illness [3741 (95% CI 3.7-12.5), P=.01), however, in the multivariate the association was lost. The presence of premotor symptoms was associated only in the univariate analysis with a worse score in Beck's inventory [OR: 4.81, 95% CI (1.001-25.65), P=.05].
ConclusionPatients with APD present important NM symptoms, despite having undergone DBS.
La enfermedad de parkinson (EP) es la segunda enfermedad neurodegenerativa más frecuente1. Su incidencia es de 10-50 personas por cada 100.000 habitantes/año y su prevalencia es de 100-300/100.000 habitantes2, siendo ambas más frecuentes en los varones3. Está causada fundamentalmente por un déficit dopaminérgico manifestado principalmente con la aparición de síntomas motores1: bradicinesia, rigidez, temblor de reposo e inestabilidad postural. Sin embargo, el déficit no es exclusivamente dopaminérgico, y además este tiene su efecto sobre otros sistemas, incluso 20 años antes de la aparición de las primeras manifestaciones motoras4. Por ello, pueden hallarse síntomas premotores como alteración de la olfacción o el estreñimiento4 de inicio insidioso, en pacientes sin el diagnóstico. Y, a lo largo de los años de la enfermedad, más del 88% de los afectos de EP desarrolla sintomatología no motora (SNM), que incluye afectación neuropsiquiátrica, alteración del sueño, disfunción autonómica o sensorial y alteraciones de la olfación. La SNM, con la fatiga y la depresión como síntomas más frecuentes2, condiciona una reducción en la calidad de vida de los pacientes5 y contribuye a la institucionalización de los mismos en estadios avanzados de la enfermedad2.
La fisiopatología del origen de la SNM no está claramente establecida y se cree que contribuye a su desarrollo la concurrencia de una disfunción tanto de sistemas dopaminérgicos (el sistema nigroestriado modula circuitos asociativos de la corteza y del sistema límbico, así como otros centro con funciones no motoras como el hipotálamo), como no dopaminérgicos6 (sistema noradrenérgico del locuscoeruleus, serotoninergico del rafe, colinérgicos del núcleo basal de Meynert y otros núcleos colinérgicos del tronco del encéfalo)7.
Enfermedad de Parkinson avanzadaDiversos fármacos con diferente mecanismo de acción se utilizan, en combinaciones múltiples, para el tratamiento sintomático de la EP con la finalidad de incrementar los niveles de dopamina cerebrales. Sin embargo, el uso a largo plazo de estos fármacos provoca la aparición de complicaciones motoras como fluctuaciones y discinesias8. Es en esta etapa, cuando la terapia convencional no proporciona un control motor adecuado, hablándose entonces de enfermedad de Parkinson avanzada (EPA) y el paciente puede ser candidato a terapias avanzadas9 como bombas de infusión continua de apomorfina o de levodopa/carbidopa intestinal o estimulación cerebral profunda (ECP) de los núcleos subtalámicos9.
La estimulación cerebral profunda del núcleo subtalámico y sus efectosLa ECP ha demostrado eficacia frente al tratamiento médico en pacientes con EPA, con relación a complicaciones motoras secundarias al tratamiento a largo plazo con levodopa, y a la mejoría en la calidad de vida e independencia en las actividades de la vida diaria8. La SNM asociada a estadios avanzados de la enfermedad, ha sido evaluada y parece estar presente tanto en pacientes sometidos o no a terapias avanzadas, jugando un papel crucial en la calidad de vida de estos individuos6.
Los efectos neuropsicológicos de la ECP han sido evaluados en pequeñas cohortes10. Aunque inicialmente no se encontraron cambios subjetivos, ni objetivos11, estudios posteriores revelaron deterioros en la función cognitiva; fluencia verbal (Funkiewiez et al. y Contarino et al.) y memoria de trabajo (Rodriguez-Oroz et al. y Schupbach et al.). En un metaanálisis, el 41% de los pacientes presentaron problemas cognitivos; desde deterioro moderado en memoria verbal, hasta cambios importantes en la función ejecutiva10.
Los estudios que evaluaban la SNM en pacientes con EPA sometidos a ECP tenían grandes limitaciones metodológicas; unas cohortes de pacientes muy pequeñas y un tiempo de seguimiento reducido12,13. El primer estudio prospectivo multicéntrico que utilizó un score validado de SNM para evaluar la mejoría tras la ECP, con un seguimiento a 6 meses, concluyó que la terapia disminuía en un 40% la SNM, siendo significativa la reducción en alteraciones del sueño, disfunción urinaria y fatiga14. A principios del año 2019, se publicó el estudio «Euroinf2» que analizaba los síntomas motores, la SMN y la calidad de vida de los pacientes con EPA sometidos a terapias avanzadas. Concluyó que la ECP producía una mejora en el sueño y la fatiga, el humor y la cognición y la disfunción urinaria y sexual, mientras que la bomba de apomorfina aportaba beneficios en el ámbito neuropsiquiátrico y la bomba de Duodopa® a nivel de alteraciones gastrointestinales15.
El objetivo de este trabajo es describir la frecuencia de aparición, en una cohorte de pacientes con EPA que han sido intervenidos de ECP del núcleo subtalámico bilateral en una unidad especializada de trastornos de movimiento, de determinados ítems seleccionados relativos a la presencia de SNM: alteración del sueño, disfunción cognitiva, alteración del estado de ánimo, hiposmia, dolor y disautonomía.
Pacientes y métodosTras la aprobación por el comité de ética hospitalario, se extrajeron datos clínico-demográficos de las historias clínicas de los 43 pacientes intervenidos de ECP en el Hospital Clínico Virgen de la Arrixaca entre los años 2005-2019, que en la actualidad no han fallecido, con previo consentimiento de los mismos o de sus familiares.
Posteriormente, se concertó una entrevista para cada paciente, con un neurólogo y una neuropsicóloga del equipo. Siete pacientes presentaban un estatus motor muy limitado con imposibilidad para su desplazamiento, 2 de ellos se encontraban en el extranjero, y otros 2 no se pudieron localizar. Así, se obtuvieron datos de las entrevistas de 32 pacientes en la mayoría de categorías, 27 relativos a la situación cognitiva (3 de ellos presentaba un deterioro cognitivo avanzado y 2 de ellos no tenían suficiente conocimiento del idioma). A estos pacientes se les realizaron los siguientes test: escala de sueño de la enfermedad de Parkinson (PDSS), evaluación cognitiva Montreal (MoCA), inventario de la depresión de Beck, escala de gravedad de hiposmia y dolor y cuestionario de sintomatología disautonómica. La escala de hiposmia y dolor recogieron las categorías: leve, moderada o severa. La escala de sintomatología disautonómica se elaboró en base a escalas validadas como SCOPA-AUT y la NMS questionnaire.
Se analizaron de forma retrospectiva los datos obtenidos de las historias clínicas y se describieron los datos obtenidos de las entrevistas clínicas, eliminado los datos identificativos.
Análisis estadísticoEn el estudio descriptivo, las variables cuantitativas se agruparon en cualitativas siendo expresadas como porcentajes, a excepción de la duración de la enfermedad, que se presentó con la media y desviación típica (Med, DE). Se analizó la distribución de las medias de las puntuaciones de PDSS, MoCA y Beck frente a las variables cualitativas dicotómicas mediante la t de Student. Las variables hiposmia, dolor y síntomas disautonómicos se transformaron en dicotómicas y se analizaron con la Chi-cuadrado. Para realizar análisis multivariante se utilizó regresión logística. La odds ratio (OR) cruda se calculó con un intervalo de confianza del 95%. El nivel de significación estadística se situó en p<0,05. El estudio se realizó mediante el uso de Statistical Package for the Social Sciences software version 22.0. Para la realización de los gráficos se utilizó Microsot Excel®.
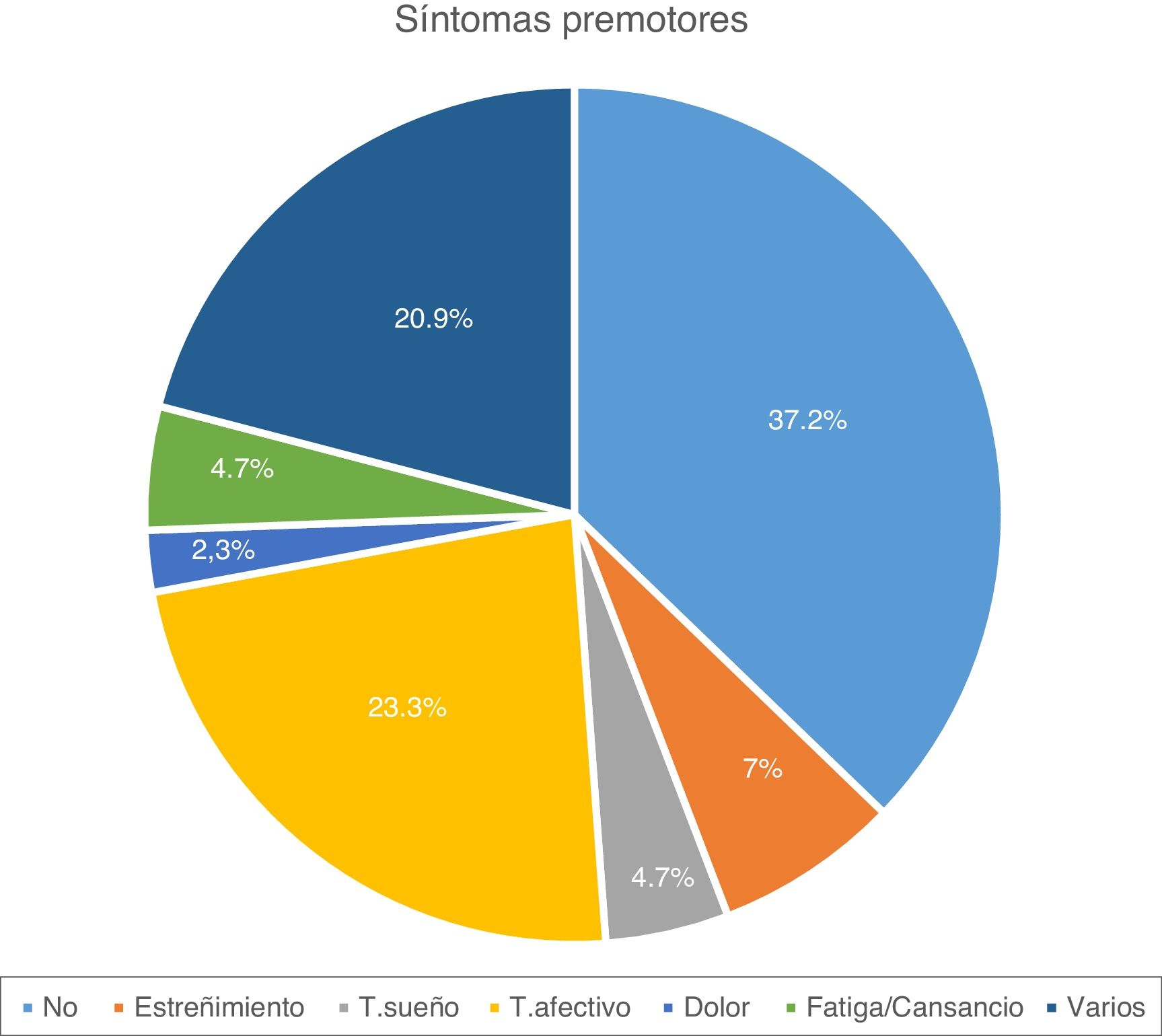
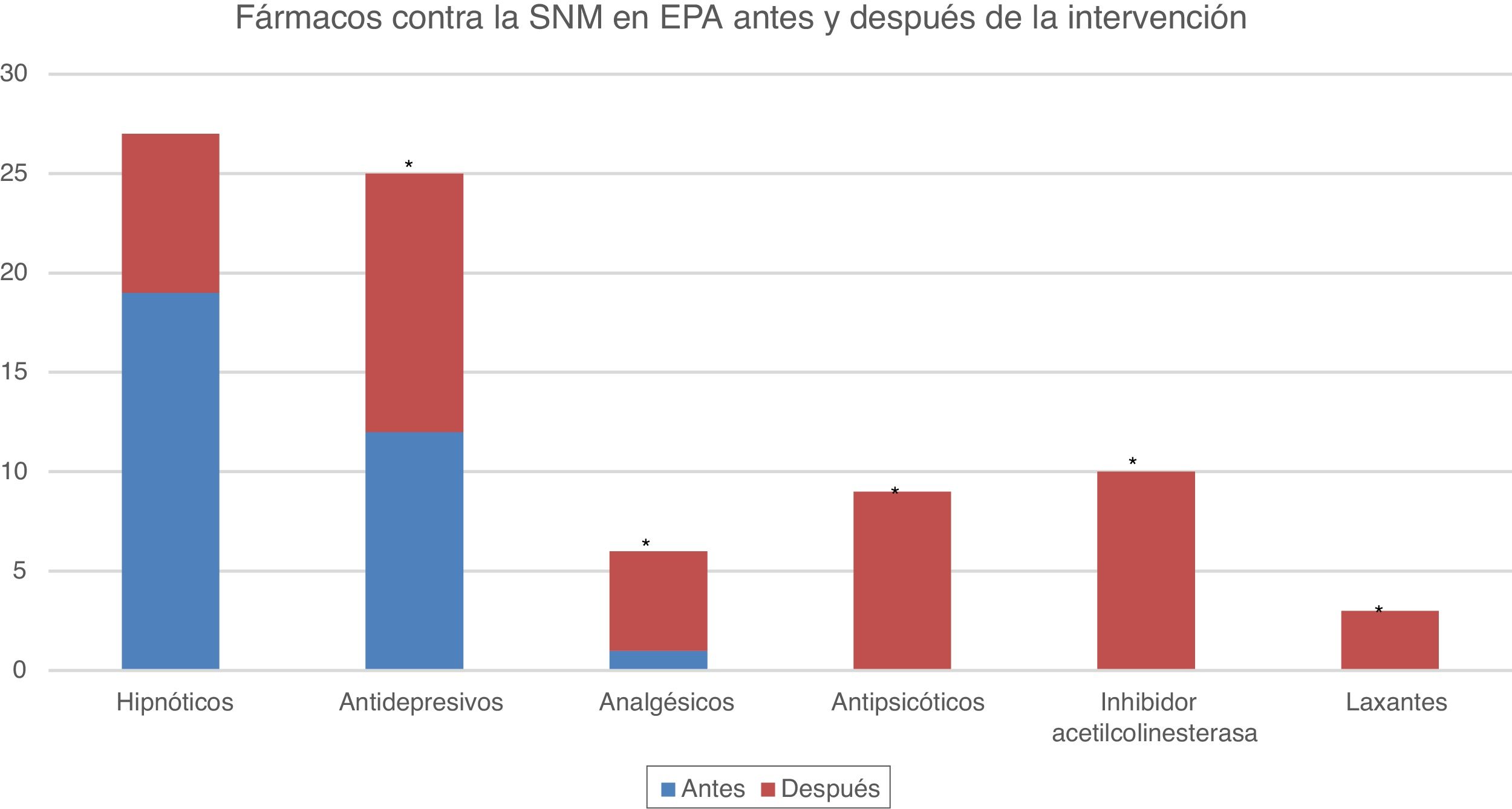
ResultadosSe obtuvieron datos clínico-demográficos de 43 pacientes. En la tabla 1 se muestra el análisis descriptivo de estas características. El 53,5% de los pacientes son varones, habiéndose diagnosticado de EP la mayoría en la franja de edad de 50 a 70 años (55,8%), aunque 4 casos comenzaron por debajo de los 40 años. La mayoría de los pacientes (51,2%) son mayores de 70 años, y el tiempo medio de duración de la enfermedad es de 13 años. Siete pacientes (16,3%) revelaron antecedentes familiares de EP. La mayoría de los enfermos (81,4%) no son activos laboralmente. En relación con el fenotipo de EP, lo más frecuente es el rígido-acinético (60,8%), de predominio izquierdo (46,5%), con frecuente afectación axial a lo largo de la evolución de la enfermedad. La mayoría de pacientes presentaron algún síntoma premotor, siendo lo más frecuente la presencia de trastorno afectivo (fig. 1). Un 69,8% presentó complicaciones motoras en forma de discinesias y el 41,9% como distonías. A 4 pacientes se les implantó la bomba de infusión subcutánea de apomorfina previamente a la ECP y a 3 se les estuvo administrando inyecciones subcutáneas de apomorfina durante varios años. Tras la intervención se obtuvo una reducción significativa de número de fármacos antiparkinsonianos utilizados, requiriendo el 88,3% de los pacientes ≤2 fármacos (vs. 42,2%; p<0,01). Previamente a la ECP el 44,2% de los pacientes consumían hipnóticos, un 27,9% antidepresivos y un 2,3% analgésicos mayores. En la actualidad, el consumo de hipnóticos es del 62,8%, antidepresivos del 58,1%, analgésicos mayores del 14%, antipsicóticos del 23,3%, inhibidores de acetilcolinesterasa del 20,9% y laxantes del 6,9%, siendo estadísticamente significativo el aumento del consumo de todos estos fármacos (p>0,05), salvo el de hipnóticos (p=0,087) (fig. 2).
Características clínico-demográficas de la muestra
| Características | Frecuencia: n, (%) |
|---|---|
| Sexo | |
| Varón | 23 (53,5) |
| Mujer | 20 (46,5) |
| Edad de inicio | |
| <40 años | 4 (9,3) |
| 40-50 años | 15 (34,9) |
| 50-70 años | 24 (55,8) |
| >70 años | 0 (0) |
| Edad actual | |
| <40 años | 0 (0) |
| 40-50 años | 6 (14) |
| 50-70 años | 15 (34,9) |
| >70 años | 22 (51,2) |
| Duración de la enfermedad (mediana, DE) | 13 (11) |
| (mediana, RIQ) | 15,7 (13,2-18,2) |
| Antecedentes familiares | |
| No | 36 (83,7) |
| Sí | 7 (16,3) |
| Activo laboralmente | |
| No | 35 (81,4) |
| Sí | 8 (18,6) |
| Fenotipo inicial | |
| Tremórico | 11 (25,6) |
| Rigido-acinético | 26 (60,5) |
| Mixto | 6 (14) |
| Localización apendicular | |
| Derecha | 17 (39,5) |
| Izquierda | 20 (46,5) |
| Bilateral | 1 (2,3) |
| Fenotipo actual | |
| Tremórico | 0 (0) |
| Rigido-acinético | 24 (55,8) |
| Mixto | 19 (44,2) |
| Afectación axial | |
| No | 19 (44,2) |
| Sí | 24 (55,8) |
| Complicaciones motoras | |
| Freezing | 21 (48,8) |
| Discinesias | 30 (69,8) |
| Distonías | 18 (41,9) |
| Fluctuaciones | 42 (97,7) |
| N.° de fármacos tras ECP | |
| 0 | 3 (6,9) |
| 1 | 16 (37,2) |
| 2 | 19 (44,2) |
| 3 | 3 (6,9) |
| 4 | 2 (4,7) |
DE: desviación estándar; ECP: estimulación cerebral profunda; RIQ: RIQ: rango intercuartil.
Medicamentos que controlan la SNM antes y después de la intervención. Se representa gráficamente la frecuencia o número de pacientes (ordenadas) que consumían los diferentes fármacos (abscisas) antes de la intervención (azul) y los que los consumían después de ella (rojo). El 44,2% de los pacientes consumían hipnóticos, ascendiendo el consumo al 62,8% tras ECP. El consumo de antidepresivos se duplica tras la intervención y se inician inhibidores de la acetilcolinesterasa y antipsicóticos para el control sintomático. El aumento del consumo de estos fármacos es estadísticamente significativo para todos, excepto los hipnóticos.
*valor significación p<0,05.
Se aplicó la PDSS a los 32 pacientes, obteniéndose una media de 83,56±30. Estableciéndose 3 categorías en función de la puntuación, el 25% presentó una puntuación mayor a 103, siendo el 43,7% inferior a 86 puntos y estando el 31,3% entre ambas puntuaciones. Actualmente, el 75% de los pacientes del grupo con mayor puntuación, el 80% de los del grupo de puntuación intermedia y el 57% de los de peor puntuación, consumen hipnóticos. Evaluándose la posible asociación entre consumo de hipnóticos y puntuación PDSS, se estableció una relación estadísticamente significativa (p=0,011). En la regresión logística se encontraron como variables protectores de una peor calidad de sueño: ser mujer frente a ser varón (OR: 0,072; IC 95%: 0,007-0,713; p=0,025) y un menor tiempo de enfermedad (OR: 0,834; IC 95%: 0,692-0,999; p=0,05).
CogniciónLa MoCA fue completada por 27 pacientes, obteniéndose una puntación media de 18,48±7,4. El 15,6% de los pacientes presentaron un resultado compatible con la normalidad, mientras que un 40,7% tenían puntuaciones por debajo de 20 puntos, sugestivos de demencia. A 5 pacientes con puntuaciones menores [rango de puntuaciones entre 8 y 17] se le están administrando parches de rivastigmina. Los peores resultados en la MoCA se relacionaron en el análisis bivariante con el tiempo de enfermedad (OR: 3,741; IC 95%: 3,7-12,5; p=0,01), sin encontrarse asociación con otras variables. Sin embargo, en el análisis multivariante, se perdió la asociación.
ÁnimoTreinta y dos pacientes rellenaron el inventario de depresión de Beck, consiguiéndose una puntuación media de 18,53±8,8. Clasificando a los pacientes según la severidad, el 18,75% de los pacientes no presentaban sintomatología depresiva, el 21,87% obtuvieron puntuaciones relacionadas con «leve depresión», el 27,5% con «moderada depresión» y el 21,87% con «severa depresión». Actualmente, el 60% de los pacientes toman algún fármaco antidepresivo, estando el 59% dentro de las categorías «moderada o severa depresión». El consumo de antidepresivos se ha visto aumentado de forma significativa a lo largo del transcurso de enfermedad, tras la ECP (37,04 vs. 74,1; p=0,03). En el análisis bivariante se obtuvo que la presencia de síntomas premotores se asociaban a una puntuación peor en el inventario (OR: 4,81; IC 95%: 1,001-25,65; p=0,05), pero no se consiguieron asociaciones estadísticamente significativas en el análisis multivariante.
OlfacciónDe los 32 pacientes entrevistados, solo 2 negaron problemas de olfacción. Uno de estos los había presentado previamente a la ECP. Doce pacientes (37,5%) se clasificaron dentro de hiposmia leve, 5 (15,6%) en moderada y 13 (40,6%) en severa. No se encontraron variables clínico-demográficas relacionadas con este ítem.
DolorSolo 2 pacientes afirmaron estar libres de dolor «inespecífico/generalizado» relacionado con EP. Según el grado de afectación, 10 (31,3%) se englobaron en dolor leve, 13 (40,6%) en moderado y 7 (21,9%) en severo. El 18% de los pacientes son consumidores crónicos de analgésicos mayores. No se encontraron variables clínico-demográficas relacionadas con el dolor.
DisautonomíaNinguno de los 32 pacientes está exento de algún síntoma disautonómico. En la tabla 2 se muestra la distribución de síntomas, siendo más frecuente la aparición de estreñimiento (68,8%), disfunción urinaria y sexual (ambos 65,6%). No se encontraron variables clínico-demográficas relacionadas con ninguno de los síntomas estudiados.
Prevalencia de SNM en nuestra muestra
| Sintomatología no motora | Frecuencias: n, (%) |
|---|---|
| Sueño (PDSS) | |
| >103 | 8 (25) |
| 103-86 | 10 (31,3) |
| <86 | 14 (43,7) |
| Cognición (MoCA) | |
| ≥26 | 5 (15,6) |
| 21-25 | 9 (28,1) |
| 14-20 | 7 (21,9) |
| <14 | 6 (18,8) |
| Ánimo (inventario de Beck) | |
| No depresión | 6 (18,8) |
| Depresión leve | 7 (21,9) |
| Depresión moderada | 12 (37,5) |
| Depresión severa | 7 (21,9) |
| Dolor | |
| No | 2 (6,3) |
| Leve | 10 (31,3) |
| Moderado | 13 (40,6) |
| Severo | 7 (21,9) |
| Hiposmia | |
| No | 2 (6,3) |
| Leve | 12 (37,5) |
| Moderado | 5 (15,6) |
| Severo | 13 (40,6) |
| Disautonomía | |
| Mareo | 4 (12,5) |
| Hipotensión ortostática | 4 (12,5) |
| Intolerancia al frío/calor | 11 (34,4) |
| Raynauld | 10 (31,3) |
| Palidez | 9 (21,9) |
| Xerostomía | 12 (28,1) |
| Ojo lloroso | 7 (37,5) |
| Disminución sudoración | 9 (37,5) |
| Diaforesis | 12 (28,1) |
| Boca seca | 18 (56,3) |
| Sialorrea | 12 (37,5) |
| Disfunción sexual | 21 (65,6) |
| Disfunción urinaria | 21 (65,6) |
| Estreñimiento | 22 (68,8) |
| Diarrea | 2 (6,3) |
| Náuseas/vómitos | 3 (3,1) |
MoCA: evaluación cognitiva de Montreal; PDSS: sueño de la enfermedad de Parkinson; SNM: sintomatología no motora.
Al igual que el estudio «Priamo», que recoge la SNM en la mayor cohorte de EP hasta el momento, encontramos al menos un sistema alterado en todos los pacientes estudiados. Nuestro estudio difiere de este, en que nuestros pacientes fueron sometidos a ECP, y que el tiempo de enfermedad es de 6 a 28 años.
La mayoría de estudios recientes que analizan la evolución de la SNM tras ECP, utiliza escalas como Non-Motor Symptons Scale (NMSS) y miden cambios a corto plazo en las medias de los diferentes ítems14-16, sin poder establecer prevalencias de las diferentes afectaciones. Esto resulta en una difícil traducción clínica, que tratan de solventar mediante cuestionarios de calidad de vida. El más importante es «EuroInf2», que demuestra reducciones significativas en las medias de la afectación del sueño/fatiga, humor/cognición, problemas de percepción, disfunción sexual y urinaria, 6 meses tras la ECP. En nuestro estudio, se eligieron escalas específicas para cada dominio para obtener las prevalencias exactas en la muestra, por lo que no tenemos datos para comparar las frecuencias obtenidas.
Más del 96% de pacientes con EP tienen problemas con el sueño a consecuencia de una combinación de cambios neuroquímicos y neurodegenerativos del centro regulatorio del sueño17. El estudio que avaló el uso de la PDSS en EP, evidenció puntuaciones inferiores en pacientes con EPA (86) que en EP incipiente (103), y mayores en controles sanos17. Por este motivo, hemos establecido estos límites en las categorías en las que hemos distribuido nuestra muestra. Dado que encontramos un menor consumo de fármacos hipnóticos en el grupo de peor calidad de sueño, y además el tiempo de evolución de la enfermedad es un factor de riesgo para ello (resultado coincidente con el estudio «Priamo»), convendría evaluar de forma periódica la necesidad de ayuda farmacológica en estos pacientes. Aunque se estableció que la melatonina podría regular el sueño en pacientes con EP, un ensayo clínico ha concluido que no existen mejorías18, pero podría tratarse de una molécula con propiedades beneficiosas a otros niveles en las en la EP19. No se han encontrado hasta ahora diferencias en la calidad del sueño en pacientes con EPA en función del género, que avale nuestro resultado, aunque hay alguna referencia antigua a una mayor calidad de sueño relacionada con el sexo femenino20.
Existe evidencia de que, en comparación con controles sanos, los pacientes con EP presentan un más rápido declinar en el dominio cognitivo, incluso algunos estudios sugieren el desarrollo de demencia después de 10 años de enfermedad21. Esto es debido a la conjunción de depósitos de α-synucleina, disfunción mitocondriales, cambios inflamatorios y factores genéticos21. No existen tratamientos preventivos, aunque se ha aprobado el uso de inhibibidores de acetilcolinesterasa22. El estudio «Priamo» muestra un 25,1% de problemas de memoria a corto plazo y, aunque algunos estudios demuestren mejoría tras ECP, otros revelan un descenso en las funciones ejecutivas tras la terapia23. En nuestra cohorte, casi la mitad de los pacientes presentan puntuaciones compatibles con el diagnóstico de demencia. Aunque no se ha podido establecer una relación estadística independiente con el tiempo de enfermedad, probablemente se deba a una pequeña población, puesto que ya lo han demostrado otros autores.
El estudio «Priamo» objetiva una relación entre EP y síntomas neuropsiquiátricos: la ansiedad (55,8%), la apatía (21%) la anhedonia (10,6%), que se ha relacionado, en parte, con la disfunción del sistema serotoninérgico «EuroInf2» concluye que a 6 meses de la intervención existe una mejoría en el estado de ánimo. En nuestro estudio, obtenemos un 18,75% de pacientes sin síntomas depresivos y un 21,8% con síntomas severos. Los antidepresivos son los fármacos cuyo uso se ha incrementado más durante la evolución de la enfermedad.
En 2005 se publicó un estudio de 11 pacientes que encontró mejorías tras ECP en la discriminación del olor en periodos «on» en 2 pacientes con anosmia24. En nuestra muestra, solamente un paciente joven, intervenido en el último año, relata mejoría en este dominio.
La existencia de dolor asociado a EP se conoce desde hace años. El estudio «Priamo» establece su prevalencia en el 20%. En 2014 se publicó un artículo en el que se evaluaba la presencia de dolor en pacientes con EPA antes y después de la ECP25. Se constató una reducción de un 70% a un 21% de pacientes con dolor un año tras ECP, así como un incremento en puntuaciones de calidad de vida. Tales efectos no se asemejan a nuestros resultados, obteniendo un 93,7% de pacientes que tras la intervención se quejan de dolor, aunque solo un 18% toman analgesia mayor de forma crónica.
La mayoría de los pacientes con EP tienen síntomas de disautonomía debido a perdida de inervación periférica a múltiples niveles, incluso antes de presentar la sintomatología motora26. La frecuencia de aparición de esta sintomatología varía según las series, siendo muy característica la disfunción urinaria y el estreñimiento. «EuroInf 2» mostró la mejoría en disfunción sexual y urinaria tras ECP, esta última también demostrada por el «grupo de estudio de síntomas no motores». En nuestra muestra todos los pacientes presentaron algún síntoma de disautonomía, siendo los más frecuentes los más habituales en los demás estudios (estreñimiento, disfunción urinaria y sexual).
A pesar de que no poder valorar el efecto de la ECP por ser el estudio retrospectivo y por ausencia de datos clínicos previos a la intervención, podemos concluir que en nuestra muestra encontramos una prevalencia alta de SNM. No podemos, por tanto, atribuir un efecto beneficioso sobre dicha sintomatología tras la terapia. Una posibilidad podría ser que los efectos beneficiosos de la ECP sobre la SNM (evidenciados en otros estudios) desaparezcan con el tiempo (puesto que nuestra mediana de tiempo de enfermedad es 15,7 años, mientras que la de «EuroInf 2» es de 10,7 y la del «grupo de estudio de síntomas no motores» de 10,4) o bien que éstos sean menores en pacientes con una enfermedad de mayor duración, o bien se necesite un tamaño de muestra mayor para conseguir tal asociación.
ConclusionesLos pacientes con EPA presentan SNM a pesar de haber sido sometidos a ECP. Esto puede ser debido a que la acción mecánica/estimuladora sobre los núcleos subtalámicos no sea suficiente para reparar el daño generado o que se debiera además actuar sobre otros sistemas diferentes al dopaminérgico, o bien, a que el efecto se perdiera con el tiempo o fuera menor para pacientes con una enfermedad de mayor duración.
Se necesitan estudios prospectivos que clarifiquen la evolución de la SNM durante el curso natural de la enfermedad y el ensayo de tratamiento sintomáticos o nuevas dianas que tengan un efecto coadyuvante en el tratamiento de la EP.
FinanciaciónNo se han requerido fuentes de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.