Los niños y adolescentes con parálisis cerebral (PC) tienen mayor riesgo de desnutrición y deficiencias de micronutrientes. Dos de los que podemos estudiar y tratar son la vitaminaD (VD) y el hierro. No disponemos de estudios que describan estas deficiencias en Chile.
ObjetivoDescribir el estado de ambos micronutrientes y evaluar la asociación con algunos factores que favorecen su déficit.
Pacientes y métodoEstudio descriptivo, corte transversal. Se estudiaron 69 sujetos, de entre 2 a 21años de edad, de dos hospitales públicos. Se obtuvieron datos demográficos, función motora, uso de sonda de alimentación y fármacos en uso. Se realizó evaluación nutricional según patrones para PC, y se determinó 25-hidroxivitaminaD (25OHD), ferritinemia y albuminemia.
ResultadosEdad promedio 11,1±4,9años, 43 (62,3%) varones, 56 (81,2%) tenían PC moderada-severa. Utilizaban sonda nasogástrica y/o gastrostomía 35 (50,7%), el 15,4% estaban con peso bajo y el 73,8% eutróficos, todos con talla normal. Recibían suplementación de VD 20 (29%), y de hierro, 4 (6,1%). La albuminemia fue normal en todos. El promedio de 25OHD fue 24,3±8,8ng/ml, 33 (47,8%) presentaron insuficiencia y 21 (30,4%) deficiencia. Tuvieron ferritina baja 36 (52,2%). No se encontró asociación entre 25OHD y variables estudiadas. Se encontró asociación entre ferritina baja y mayor edad (p=0,03), ser hombre (p=0,006) y uso de sonda de alimentación (p=0,006).
ConclusionesEl grupo estudiado fue principalmente PC moderada-severa, con alta frecuencia de valores subóptimos de VD y baja ferritina plasmática, además de escasa suplementación de ambos. Sugerimos realizar seguimiento de 25OHD y ferritina, por su alta frecuencia de deficiencia y por contar con fármacos para su tratamiento en los hospitales públicos.
Children and adolescents with cerebral palsy (CP) are at a greater risk of malnutrition and micronutrient deficiencies. Two deficiencies that we can study and treat are vitaminD (VD) and iron deficiencies; however, no studies have described these deficiencies in Chile.
ObjectiveTo describe the status of VD and iron in patients with CP and evaluate the relationship with certain factors associated with deficiencies of these micronutrients.
Patients and methodWe performed a descriptive, cross-sectional study including 69 patients aged between 2 and 21years, from two public hospitals. Data were obtained on demographic variables, motor function, use of feeding tube, and pharmacological treatment. We performed a nutritional assessment according to patterns of CP and determined 25-hydroxyvitaminD (25[OH]D) ferritin, and albumin levels.
ResultsPatients’ mean age was 11.1±4.9years; 43 (62.3%) were male; and 56 (81.2%) had moderate-to-severe CP. Thirty-five (50.7%) used a nasogastric tube and/or gastrostomy; 15.4% were underweight and 73.8% were eutrophic, all with normal height. Twenty (29%) and 4 patients (6.2%) received VD and iron supplementation, respectively. Albuminaemia was normal in all patients. Mean 25(OH)D level was 24.3±8.8ng/mL; 33 patients (47.8%) had insufficiency and 21 (30.4%) deficiency; 36 patients (52.2%) had low ferritin levels. There was no association between 25(OH)D level and the other variables studied. Low ferritin levels were found to be associated with older age (P=.03), being male (P=.006), and feeding tube use (P=.006).
ConclusionsThe patients studied mainly had moderate-to-severe CP, with a high frequency of suboptimal VD values and low plasma ferritin; few patients received VD and/or iron supplementation. We suggest monitoring 25(OH)D and ferritin levels due to the high rate of deficiency of these nutrients; public hospitals should be equipped with drugs to treat these deficiencies.
Los niños con parálisis cerebral (PC) poseen un riesgo mayor de presentar desnutrición que los niños sanos, y la desnutrición se asocia a mayor déficit cognitivo y más severidad de su discapacidad motora gruesa1.
La dificultad para alimentarse es otro factor que influye en su estado nutricional, y es así como un alto porcentaje requiere la asistencia de un cuidador. A mayor compromiso motor grueso, mayor será dicha dificultad2-4.
Sumado a estas dificultades, la vía alimentaria —ya sea oral, por sonda nasogástrica (SNG) o gastrostomía (GTT)— y el tipo de alimentación recibida influyen en que tengan menor ingesta de energía y de algunos micronutrientes, como potasio, hierro, magnesio, zinc, selenio, calcio, niacina, cobre, folato y vitaminasA, D y E4-8.
Las deficiencias nutricionales han quedado en evidencia no sólo al estudiar su ingesta alimentaria, sino también al realizar el estudio de laboratorio, encontrándose concentraciones menores a los valores normales o menores que niños sanos para hierro, vitaminaD (VD), cobre, magnesio, folato, vitaminaE, B6, zinc y selenio5,8. Existen diversos factores asociados a cada deficiencia que dependen del nutriente específico9.
En Chile, los niños con PC del sistema público tienen acceso a una atención multidisciplinaria, pero no al estudio de micronutrientes mediante el cual se puede evaluar una deficiencia nutricional específica. No disponemos de información sobre deficiencias nutricionales en niños con PC de nuestro medio, y dada su mayor sobrevida general, es necesario entregar una atención nutricional completa y específica a sus necesidades.
Dos micronutrientes que han sido reportados frecuentemente como deficientes en PC que podemos estudiar y suplementar son la VD y el hierro. El objetivo del presente estudio es describir el estado de ambos micronutrientes y evaluar la asociación con algunos de los principales factores que favorecen su déficit.
Pacientes y métodoEstudio descriptivo de corte transversal, con reclutamiento prospectivo realizado entre abril de 2014 y marzo de 2015. El muestreo fue por conveniencia, estudiando 69 sujetos entre 2 a 21años de edad. Fueron invitados a participar los pacientes con PC que se controlan ambulatoriamente en el Programa de Niños y Adolescentes con Necesidades Especiales de Atención en Salud (NANEAS) de los hospitales Padre Hurtado y Sótero del Río, ambos del Servicio de Salud Metropolitano Sur Oriente (SSMSO). La invitación fue realizada al cuidador principal vía telefónica o en su control rutinario. Previo al ingreso se hizo lectura del consentimiento informado por el cuidador, resguardando su completa comprensión, y se solicitó la firma. No se solicitó asentimiento informado de los participantes dada su discapacidad cognitiva y/o motora, que impedía comprender o firmar.
Los criterios de inclusión al estudio fueron: tener el diagnóstico de PC por neurólogo infantil y estar en control en los centros NANEAS mencionados. Como criterios de exclusión se consideró hospitalización durante el último mes y/o estar con una enfermedad aguda, difiriendo su entrada al estudio un mes posterior a la resolución del cuadro.
Se obtuvieron datos demográficos, cuidador principal, vía de alimentación (oral, uso de SNG o GTT), antecedente de fractura ósea, uso de antiepilépticos u otros fármacos y de suplementos nutricionales.
En el examen físico se evaluó la actividad motora gruesa por la escala internacional de Gross Motor Function Classification System (GMFCS)10, definiendo gradoi: paciente camina sin dificultades; gradoii: camina con limitaciones; gradoiii: camina usando apoyo; gradoiv: presenta autovalencia limitada, podría usar silla de rueda con motor, y gradov: el paciente es transportado en silla de rueda. Se definió como GMFCS leve los gradosi aiii, y moderada-severa, los gradosiv yv.
En la evaluación antropométrica se obtuvo el peso utilizando balanza o silla-balanza ante la imposibilidad de bipedestación. La talla fue medida en podómetro o por estimación a partir de la longitud de la tibia, utilizando la ecuación de Stevenson [talla=(longitud desde la tuberosidad anterior de la tibia hasta el borde superior del maléolo interno, en cm)×3,26)+30,8]11. Después de considerar el GMFCS y la utilización de sonda de alimentación, se evaluó el estado nutricional según los patrones de referencia específicos para PC, expresados en percentiles, para cada sexo12. Se clasificó talla para la edad (T/E) normal entre p5 y p95 y se estableció el estado nutricional según índice de masa corporal para la edad (IMC/E): bajo peso si el IMC/E era ≤p10; eutrofia o normalidad si IMC/E estaba entre p10 y p75, y exceso de peso si IMC/E era ≥p75.
Se tomó una muestra de sangre en ayunas para la medición de 25-hidroxivitaminaD plasmática (25OHD), albuminemia y ferritinemia por una enfermera del policlínico NANEAS. Se definió suficiencia de VD si 25OHD ≥30ng/ml, insuficiencia de VD si 25OHD entre 21-29ng/ml y deficiencia de VD si 25OHD era ≤20ng/ml. El método para determinación de 25OHD fue cromatografía líquida con espectrometría de masa en tándem.
Para determinar la ferritina sérica se utilizó inmunoanálisis electroquimioluminiscente/Cobas/Roche, cuyos valores de normalidad para mujeres se sitúan entre 13 y 150ng/ml y para hombres entre 30 y 400ng/ml.
La albuminemia sérica se realizó por el método colorimétrico, considerándose normal si ≥3,5g/dl. Todos los exámenes fueron realizados en el Laboratorio Central de la Red de Salud UC-Christus.
Análisis estadísticoSe realizó una base de datos anonimizada, y el análisis se hizo con el programa estadístico STATA versión 12. Se realizó estadística descriptiva. Para las variables continuas se aplicó la prueba de normalidad de Shapiro Wilk; todas las variables tuvieron distribución normal, por lo que se expresaron como promedio y desviación estándar. Para estadística analítica se realizó test de Student, correlación de Pearson, prueba de asociación de χ2 y test exacto de Fisher. Se fijó un valor de significación de p<0,05.
En este estudio se respetaron las normas éticas concordantes con la Declaración de Helsinki (2013) y se obtuvo la aprobación del Comité Ético Científico del Servicio de Salud Metropolitano Sur Oriente (22 de agosto de 2013) y del Comité Ético Científico de la Pontificia Universidad Católica de Chile (N.°14-124).
ResultadosSe estudiaron 69 niños. La tabla 1 muestra las características demográficas y los resultados de exámenes. En 66 sujetos se obtuvo el antecedente de edad gestacional; 19 (28,8%) nacieron antes de las 37 semanas.
Características demográficas
| Variable | Valores |
|---|---|
| Sexo masculino, n (%) | 43 (62,3) |
| Edad en años, promedio ± DE | 11,1 ± 4,9 |
| Función motora (GMFCS), n (%) | |
| I a III | 13 (18,8) |
| IV a V | 56 (81,2) |
| Vía de alimentación, n (%) | |
| Oral exclusivamente | 34 (49,3) |
| SNG-GTT | 35 (50,7) |
| Evaluación nutricional, IMC/E, n (%) | |
| < p10 | 10 (15,4) |
| p10 a p75 | 48 (73,8) |
| > p75 | 7 (10,8) |
| 25OHD (ng/ml) | |
| Promedio ± DE | 24,3 ± 8,8 |
| Suficiencia, n (%) | 15 (21,8) |
| Insuficiencia, n (%) | 33 (47,8) |
| Deficiencia, n (%) | 21 (30,4) |
| Ferritina, n (%) | |
| Normal | 33 (47,8) |
| Baja | 36 (52,2) |
| Albúmina (g/dl) | |
| Promedio ± DE | 4,6 ± 0,4 |
Ferritina: valores de normalidad para mujeres, entre 13-150ng/ml, y para hombres, entre 30-400ng/ml.
GMFCS: Gross Motor Function Classification System10.
IMC/E: índice de masa corporal según edad12.
25OHD: 25-hidroxivitaminaD (suficiencia de VD si 25OHD ≥30ng/ml, insuficiencia de VD si 25OHD entre 21-29ng/ml y deficiencia de VD si 25OHD ≤20ng/ml).
Se alimentaban por boca 34 niños (49,3%), exclusivamente por SNG 4 (5,8%), exclusivamente por GTT 26 (37,7%), por boca más SNG 2 (2,9%) y por boca más GTT 3 (4,3%). Para efecto de los análisis se agrupó en alimentación por boca (34 [49,3%]) y aquellos que utilizaban SNG o GTT en forma exclusiva o mixta (35 [50,7%]).
El cuidador principal fue la madre en 58 niños (84,1%), la abuela en 7 (10,1%) y otra persona en 4 (5,8%).
Ingresaron al estudio durante los meses de otoño-invierno 26 niños (37,7%) y en primavera-verano 43 (62,3%).
Se obtuvo el antecedente de fractura en uno de los centros estudiados, encontrándose que 4 de los 32 niños (6,6%) habían tenido una fractura. Los sitios de fractura fueron: fémur 2 niños, costillas un niño y pie un niño.
En cuanto a fármacos, el 7,6% de los niños no los utilizaba, el 33,3% utilizaban 1-2 fármacos al día, el 43,9% entre 3-5 fármacos y el 15,2% 6 o más fármacos al día. En relación con el uso de antiepilépticos, el 16,1% no los utilizaba, el 62,9% utilizaban 1-2 y el 21% entre 3-5 al día.
Recibían suplemento de VD 20 niños (29%), 14/20 dosis ≤400UI/día de VD y 6/20 >400UI/día de VD. La dosis mínima indicada era de 200UI/día y la dosis máxima, 800UI/día de VD. En relación a suplementación de hierro, 4 niños (6,1%) lo tenían indicado y ninguno estaba en tratamiento por anemia ferropriva.
La albuminemia tuvo un promedio de 4,6±0,4g/dl, siendo normal en todos los sujetos. El valor mínimo fue de 3,6g/dl y el máximo, de 5,4g/dl.
El promedio de 25OHD fue de de 24,3±8,8ng/ml, el valor mínimo fue de 5,4ng/ml y el máximo, de 48,7ng/ml. Presentaron rango de suficiencia de VD 15niños (21,8%), 33 (47,8%) insuficiencia y 21 (30,4%) deficiencia, es decir, el 78,2% de los pacientes estaban en rango subóptimo de VD.
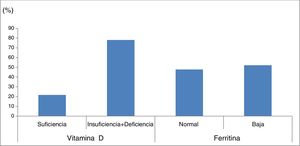
La ferritina estuvo baja en 36 niños (52,2%) y normal en 33 (47,8%) (fig. 1).
Porcentaje de deficiencia de vitaminaD y ferritina en niños y adolescentes con parálisis cerebral.
VitaminaD: suficiente, 25-hidroxivitaminaD (25OHD) ≥30ng/ml; insuficiencia +deficiencia de VD 25OHD <30ng/ml.
Ferritina: valores de normalidad para mujeres, entre 13-150ng/ml; para hombres, entre 30-400ng/ml.
No se encontró asociación entre el diagnóstico nutricional y el sexo, el antecedente de prematuridad, el GMFCS, la vía de alimentación y el uso de suplementos de VD o de hierro.
Al estudiar factores de riesgo para fractura no se encontró asociación con GMFCS. No se analizaron otras variables, ya que no estarían siendo evaluadas en el momento de la fractura.
No hubo asociación entre grado de PC y número de fármacos, pero sí entre antiepilépticos y grado de PC, en donde los niños con PC moderada-severa utilizaban más número de antiepilépticos al día (p=0,04).
Al analizar los factores que pueden influir en el estado de VD no se encontró asociación entre las concentraciones de 25OHD y sexo, GMFCS, estado nutricional, prematuridad, estacionalidad (otoño-invierno versus primavera-verano), vía de alimentación, suplementación de VD, ni con el número de fármacos y antiepilépticos usados al día, incluso subdividiendo en aquellos que son inductores y no inductores del metabolismo de VD. No hubo correlación entre concentraciones de 25OHD y edad de los sujetos (tabla 2).
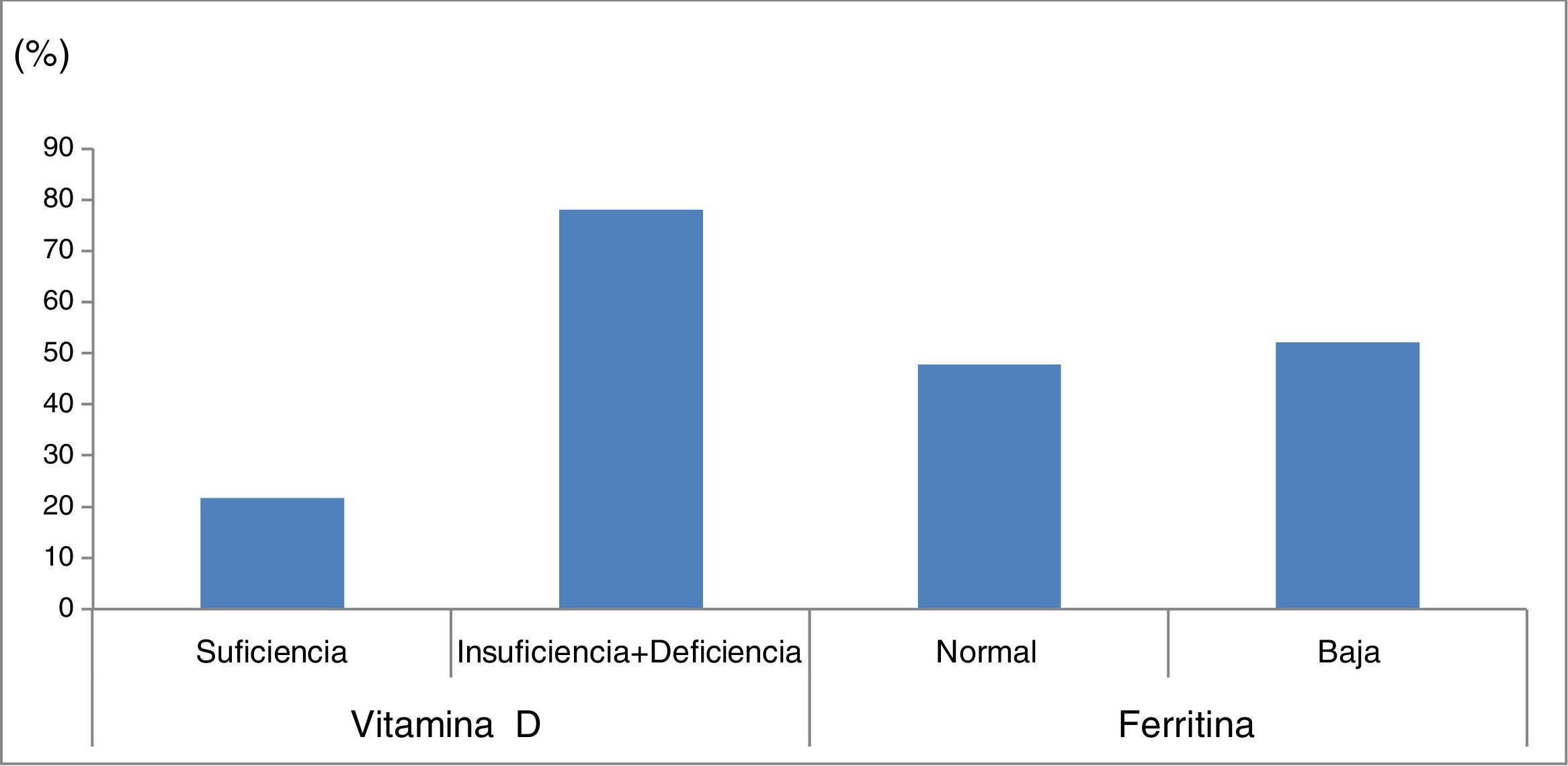
Factores asociados al estado de vitamina D y de hierro en 69 niños y adolescentes con parálisis cerebral
| Variable | Vitamina D | Ferritina | ||||
|---|---|---|---|---|---|---|
| Suficiencia | Insuficiencia±Deficiencia | p | Normal | Baja | p | |
| n (%) | 15 (21,8) | 54 (78,2) | NA | 33 (47,8) | 36 (52,2) | NA |
| Edad (años), promedio ±DE | 10,5±4,7 | 11,3±5 | 0,6 | 9,8±4,4 | 12,3±5,1 | 0,03 |
| Sexo masculino, n (%) | 11 (73,3) | 32 (59,2) | 0,4 | 15 (45,5) | 28 (77,8) | 0,006 |
| GMFCS | 0,7 | 0,1 | ||||
| Leve, n | 2 | 13 | 9 | 4 | ||
| Moderada-severa, n | 13 | 43 | 24 | 32 | ||
| Vía de alimentación | 0,08 | 0,006 | ||||
| Oral | 4 | 30 | 22 | 12 | ||
| Uso de SNG-GTT | 11 | 24 | 11 | 24 | ||
| Diagnóstico nutricional | 0,5 | 0,8 | ||||
| Bajo peso | 1 | 9 | 6 | 4 | ||
| Eutrofia | 13 | 35 | 23 | 25 | ||
| Exceso de peso | 1 | 6 | 3 | 4 | ||
Diagnóstico nutricional: IMC/E (índice de masa corporal según edad)12, bajo peso si IMC/E <p10, eutrofia o normalidad si IMC/E entre p10 y p75 y exceso de peso si IMC/E >p75.
Ferritina: valores de normalidad para mujeres, entre 13-150ng/ml, y para hombres, entre 30-400ng/ml.
GMFCS (Gross Motor Function Classification System)10, leve: grados i a iii; moderada-severa: grados iv y v.
Vitamina D: suficiente 25-hidroxivitaminaD (25OHD) ≥30ng/ml, insuficiencia ±deficiencia de VD 25OHD <30ng/ml.
Se encontró asociación entre ferritina y edad del sujeto, siendo un promedio de 12,3±5,1años en niños con ferritina baja versus 9,8±4,4años en niños con ferritina normal (p=0,03). También se encontró asociación entre ferritina baja y ser hombre (p=0,006) y con el uso de SNG o GTT (p=0,006). No se encontró asociación de ferritina con las otras variables estudiadas (tabla 2).
DiscusiónEl grupo estudiado presentó un alto porcentaje de PC moderada a severa, correspondiente al 81% de la muestra; estos pacientes son los que tienen un riesgo conocido de presentar más problemas de salud, dificultades para alimentarse y deficiencias nutricionales4,12. Los micronutrientes estudiados presentaron una alta frecuencia de deficiencia, tanto de VD como de hierro.
La prevalencia de PC está inversamente asociada a la edad gestacional13,14. Un tercio de los niños estudiados fueron prematuros, siendo una cifra mayor a los nacimientos prematuros en Chile, que corresponde al 8,4%, e incluso a estudios en niños y adolescentes con PC, en que presentan prematuridad entre el 11 y el 14%8,15,16.
El cuidador principal fue la madre, seguida por la abuela, es decir, el 95% estaban siendo cuidados por familiares directos. Este dato nos parece relevante, y concuerda con lo reportado en estudios de Estados Unidos4.
La mitad de nuestros pacientes utilizaban SNG o GTT, porcentaje similar al de otras publicaciones de niños con PC moderada-severa3,7. Las dificultades en la alimentación están estrechamente asociadas al mayor grado de discapacidad motora; en esta muestra un alto porcentaje tenía PC moderada-severa, por lo cual este resultado era esperable2-4.
Los participantes de este estudio corresponden a NANEAS de complejidad mediana y alta, por tener necesidades mayores en varios ámbitos de salud, lo que puede verse reflejado en que la mayoría requería fármacos de forma crónica, y aproximadamente el 60% más de 3fármacos al día17.
La albuminemia fue normal en todo el grupo, lo cual ha sido descrito en otras publicaciones, como también que la ingesta alimentaria cubre adecuadamente los requerimientos proteicos4,5,18,19.
Estos pacientes tienen un mayor riesgo de presentar deficiencia de VD20-24. En este estudio hemos descrito el estado de VD en niños y adolescentes con PC que se atienden en unidades NANEAS de dos hospitales públicos, donde no se realiza la medición de 25OHD en forma rutinaria ni existen protocolos de suplementación de VD; esto último pudiera explicar el bajo porcentaje de niños suplementados. El grupo estudiado presentó concentraciones promedio de 25OHD menores y un alto porcentaje tuvo valores subóptimos de VD, si se compara con escolares sanos que viven en Santiago de Chile. En esta última población se han reportado promedios entre 25,2±8,3 y 32,1±9,2ng/ml, destacando en un estudio que el 39,7% presentaba concentraciones subóptimas de VD, lo cual es mucho menor al 78,2% encontrado en nuestro estudio25,26.
Sin embargo, al comparar con niños y adolescentes con PC con similar GMFCS de Estados Unidos, Turquía y Noruega, nuestra muestra tuvo menor deficiencia de VD, siendo de entre el 52,6 al 72% en esos estudios versus el 30,4% en el presente7,19,27.
No encontramos asociación con los factores de riesgo conocidos de deficiencia de VD, como el mayor grado de discapacidad motora gruesa, el uso de antiepilépticos o la insuficiente suplementación de VD. Ello puede explicarse porque es un grupo con elevada representación de PC moderada-severa y baja suplementación de VD19,27-29. Es importante recalcar que la ingesta alimentaria de VD de estos pacientes es insuficiente, incluso utilizando fórmulas lácteas fortificadas5,6,29.
Como en otras publicaciones realizadas en pacientes con PC, no hubo diferencia de 25OHD en las distintas estaciones del año, lo cual indica su permanente baja exposición solar6,7,27.
Los niños con PC poseen menor densidad mineral ósea que población sana, con el consecuente mayor riesgo de presentar fracturas; se han descrito factores como el mayor compromiso motor grueso, la menor ingesta de calcio, el uso de antiepilépticos, la mayor dificultad para alimentarse y la desnutrición7,19,27,30. Existen limitados estudios de prevalencia de fractura en niños con PC, encontrándose en un estudio estadounidense de 418 niños un 12% y en otro de 297 niños un 15,5%. Nuestra muestra es pequeña, lo que no permite compararnos31,32. No realizamos análisis de factores para fractura dado que las variables a estudiar no coincidían con el momento de fractura.
No hay asociación entre densidad mineral ósea (DMO) y 25OHD, aunque con la suplementación de VD se produce mejoría de la DMO7,19,27,33-35. Frente a esta evidencia, grupos de expertos consideran la suplementación de VD como un «posible efecto» sobre DMO y recomiendan suplementar con calcio y VD23,24. Las dosis de VD utilizadas en los pacientes suplementados estuvieron más cercanas a las recomendaciones para población pediátrica general (400-600UI/día), dado que para población de riesgo se recomiendan 600-1.000UI/día36. El objetivo principal de la suplementación es lograr concentraciones de suficiencia de VD realizando el seguimiento con 25OHD23,24. Otro factor que puede mejorar o mantener la DMO es la acción de la carga del peso corporal como es la bipedestación apoyada, pero aún está en estudio su efectividad y/o las indicaciones específicas de su uso en estos pacientes23,24,37.
Existen otros posibles efectos beneficiosos de tener concentraciones suficientes de 25OHD, como es disminuir el riesgo de infecciones respiratorias, que se ha estudiado en población pediátrica general38.
En relación con el hierro, la ferritina plasmática refleja los depósitos de hierro y es un marcador precoz de ferropenia, pero no está siempre disponible en hospitales públicos. Ningún paciente en nuestra muestra tenía diagnóstico de anemia, pero la mitad tuvo ferritina baja, lo cual coincide con otros estudios; se ha encontrado que presentan menor ingesta alimentaria de hierro, hierro sérico bajo, ferritina baja y anemia ferropriva. Dentro de los factores estudiados están: sexo masculino, mayor edad, uso de GTT y mayor proporción de ingesta de fórmulas lácteas; los tres primeros factores estuvieron presentes en nuestro estudio1,4,8,39. Otro factor que se ha asociado a anemia es la presencia de reflujo gastroesofágico (RGE) por el cual pudieran producirse pérdidas crónicas hemáticas por esofagitis: en un estudio en pacientes con PC se encontró más anemia en aquellos con RGE versus los que no lo presentaban, pero los niños con RGE también tuvieron más malnutrición por déficit, por lo que se sugiere evaluar este factor considerando el manejo integralmente40.
Una limitación de este estudio fue la muestra relativamente homogénea en cuanto a función motora, y al ser pacientes con GMFCS moderada-severa pudo haberse limitado la asociación de grado de PC y deficiencias nutricionales. Otra limitación es la procedencia socioeconómica y el nivel socioeconómico medio-bajo y bajo, lo que limita la generalización de los resultados.
A modo de conclusión, esta investigación describe una alta frecuencia de deficiencia de VD y bajos depósitos de hierro en niños y adolescentes con PC moderada a severa, analizando algunos factores de riesgo. Sugerimos incorporar el estudio de estos micronutrientes, ya que se cuenta con fármacos para su tratamiento, con lo que se puede mejorar la salud global de este grupo de pacientes de alta vulnerabilidad.
FinanciaciónEsta investigación fue financiada con fondos concursables de la Rama de Nutrición de la Sociedad Chilena de Pediatría y FONDECYT 1131012 Alvarez-Lobos M.
Conflicto de interesesLos autores declaran no presentar conflicto de intereses.
Artículo presentado en modalidad de póster en el 55.° Congreso de Pediatría de la Sociedad Chilena de Pediatría, Puerto Varas, Chile, 2015.