La evidencia científica durante las últimas 2décadas respalda que la aplicación de técnicas de cribado de cáncer de pulmón mediante tomografía computarizada (TC) de tórax de baja dosis de radiación contribuye a una reducción significativa de la mortalidad, gracias al diagnóstico en estadios potencialmente curativos. En referencia a dicho diagnóstico, existen además métodos novedosos en estudio, como la biopsia líquida, la identificación del microbioma pulmonar y la utilización de técnicas de inteligencia artificial, que desempeñarán un papel clave en un futuro próximo. En la actualidad, existe una tendencia hacia el tratamiento con cirugías cada vez menos invasivas (segmentectomía vs. lobectomía) basada en 2ensayos clínicos recientes en tumores periféricos menores de 2cm. A pesar de mostrar similar supervivencia, todavía existe controversia debido a la incertidumbre en cuanto a la tasa de recidiva y reserva funcional. En cuanto a la terapia adyuvante, la inmunoterapia sola o combinada con quimioterapia ofrece resultados alentadores en estadios resecables del cáncer de pulmón localmente avanzado, con respuestas patológicas completas y mejoría en la supervivencia. Tras el tratamiento con cirugía, a pesar de que no hay evidencia sólida del seguimiento a largo plazo de estos pacientes, en la práctica clínica se recomienda la realización de TC periódicas durante los primeros años.
En conclusión, en el cáncer de pulmón existen avances importantes, que han mejorado las técnicas diagnósticas utilizando nuevas tecnologías y programas de cribado. Además, el tratamiento de este cáncer cada vez es más personalizado y todo ello se traduce en una mejora de la supervivencia de los pacientes.
Over the past 2decades, scientific evidence has strongly supported the use of low-radiation dose chest computed tomography (CT) as a screening technique for lung cancer. This approach has resulted in a significant reduction in mortality rates by enabling the detection of early-stage lung cancer amenable to potentially curative treatments. Regarding diagnosis, there are also novel methods under study, such as liquid biopsy, identification of the pulmonary microbiome, and the use of artificial intelligence techniques, which will play a key role in the near future. At present, there is a growing trend towards less invasive surgical procedures, such as segmentectomy, as an alternative to lobectomy. This procedure is based on 2recent clinical trials conducted on peripheral tumors measuring less than 2cm. Although these approaches have demonstrated comparable survival rates, there remains controversy due to uncertainties surrounding recurrence rates and functional capacity preservation. With regard to adjuvant therapy, immunotherapy, either as a monotherapy or in conjunction with chemotherapy, has shown encouraging results in resectable stages of locally advanced lung cancer, demonstrating complete pathologic responses and improved overall survival.
After surgery treatment, despite the lack of solid evidence for long-term follow-up of these patients, clinical practice recommends periodic CT scans during the early years.
In conclusion, there have been significant advances in lung cancer that have improved diagnostic techniques using new technologies and screening programs. Furthermore, the treatment of lung cancer is increasingly personalized, resulting in an improvement in the survival of patients.
A día de hoy, el cáncer de pulmón (CP) sigue siendo el tumor más letal del mundo. Debido a este gran impacto, durante las últimas 2décadas se han realizado importantes contribuciones y avances científicos en dicha enfermedad. Por este motivo, el objetivo de esta revisión narrativa es describir los nuevos enfoques y las novedades en el cribado, diagnóstico y tratamiento del CP. El formato elegido es de preguntas y respuestas. Para ello, los autores han seleccionado los artículos publicados en inglés en revistas indexadas que se han considerado más relevantes en cada campo, utilizando bases de datos electrónicas, como PubMed y Medline. Intentando aportar información novedosa, el marco temporal se ha centrado en los artículos publicados en los últimos 5-7 años, aunque para documentar mejor el cribado de CP los autores han utilizado literatura de hace 2décadas.
¿Es posible realizar un programa de cribado de cáncer de pulmón?El cribado del CP es una estrategia que permite diagnosticar el cáncer en sus etapas iniciales, cuando es tratable quirúrgicamente y la tasa de supervivencia es mayor1. A pesar de ser el cáncer que mayor número de muertes produce en el mundo2, en España, a diferencia de otros países, como Estados Unidos o China, todavía no existe un programa de cribado establecido.
El método de cribado más utilizado es la realización de una tomografía computarizada de tórax de baja radiación (TCBD) anual. Esta técnica utiliza radiofrecuencia en bajas dosis en individuos seleccionados por sus características de riesgo (edad, índice de tabaquismo, comorbilidad asociada, como enfisema y enfermedad pulmonar obstructiva crónica…).
En el año 2006, la publicación de los resultados del estudio International Early Lung Cancer Action Program (I-ELCAP)3 mostró que el 85% de los CP cribados fueron detectados en estadio I y, por lo tanto, con posibilidades de curación, lo que indicaba por primera vez la potencial utilidad de esta técnica en el cribado en pacientes de alto riesgo. Posteriormente, en noviembre de 2011, el estudio National Lung Cancer Screening Trial (NLST)4 del Instituto Nacional de Salud de los Estados Unidos, evidenció una disminución del 20% de la mortalidad atribuible a la TCBD en comparación con la radiografía de tórax4.
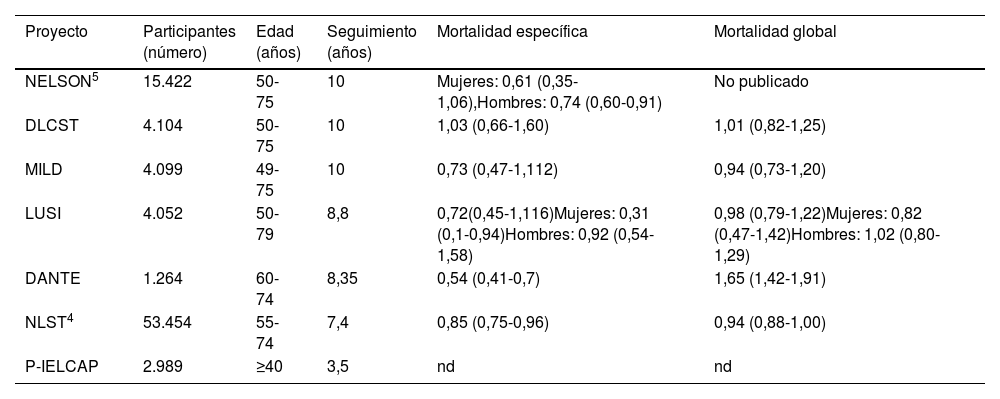
Sin embargo, estudios europeos realizados hasta hace unos años mostraban resultados conflictivos debido a errores en el diseño, lo que dificultaba demostrar una clara reducción de la mortalidad por CP. Por eso, existían muchas expectativas con los resultados del estudio NELSON (Dutch-Belgian Randomized Lung Cancer Screening Trial)5, ya que este estudio sí que contaba con la suficiente potencia estadística para detectar una reducción de la mortalidad de CP de, al menos, el 25%. El estudio se centra de nuevo en población de riesgo, con un total de 15.000 pacientes (7.892 grupo control, 7.900 grupo cribado) seguidos a lo largo de 10 años. Alrededor del 50% de los cánceres diagnosticados en el grupo de cribado fueron en estadios iniciales, con un 65-70% de estadios IA-II. Por el contrario, el 70% de los cánceres del grupo control diagnosticados en el momento del estudio fueron estadios III/IV. Al final del estudio, la reducción de la tasa de mortalidad en varones fue del 26% y del 61% en mujeres5. El resumen de estos y otros programas de cribado de CP se describe en la tabla 1.
Resumen de programas de cribado del cáncer de pulmón
| Proyecto | Participantes (número) | Edad (años) | Seguimiento (años) | Mortalidad específica | Mortalidad global |
|---|---|---|---|---|---|
| NELSON5 | 15.422 | 50-75 | 10 | Mujeres: 0,61 (0,35-1,06),Hombres: 0,74 (0,60-0,91) | No publicado |
| DLCST | 4.104 | 50-75 | 10 | 1,03 (0,66-1,60) | 1,01 (0,82-1,25) |
| MILD | 4.099 | 49-75 | 10 | 0,73 (0,47-1,112) | 0,94 (0,73-1,20) |
| LUSI | 4.052 | 50-79 | 8,8 | 0,72(0,45-1,116)Mujeres: 0,31 (0,1-0,94)Hombres: 0,92 (0,54-1,58) | 0,98 (0,79-1,22)Mujeres: 0,82 (0,47-1,42)Hombres: 1,02 (0,80-1,29) |
| DANTE | 1.264 | 60-74 | 8,35 | 0,54 (0,41-0,7) | 1,65 (1,42-1,91) |
| NLST4 | 53.454 | 55-74 | 7,4 | 0,85 (0,75-0,96) | 0,94 (0,88-1,00) |
| P-IELCAP | 2.989 | ≥40 | 3,5 | nd | nd |
nd: no disponible.
Fuente: Modificado de Cervera Deval et al.62
En nuestro país, existen datos descriptivos sobre la efectividad y eficiencia del programa de I-ELCAP en Pamplona (P-IELCAP), con una tasa estimada de supervivencia a 10 años del 70%6. Además, el mismo grupo ha publicado recientemente los datos quirúrgicos, que muestran que el 80% de los CP operables tenían una tasa de supervivencia a los 5 y 10 años del 93% y del 83%, respectivamente7. Debido a todo lo anterior y para acabar de demostrar la posibilidad de implementar un programa de cribado de CP en nuestro país, se está desarrollando un proyecto piloto nacional multicéntrico de cribado de CP con validez científica probada, denominado proyecto CASSANDRA. Consiste en implementar un programa de cribado de CP en la sanidad pública española mediante TCBD en combinación con prevención primaria, deshabituación tabáquica y evaluación respiratoria.
Aunque todavía existen desafíos para su implementación definitiva en el sistema nacional de nuestro país, el cribado de CP con TCBD es una estrategia que acabará marcando un antes y un después en la historia española del CP∫.
¿Pueden ayudar la biopsia líquida y el microbioma pulmonar al diagnóstico del cáncer de pulmón?La biopsia líquida es uno de los biomarcadores más estudiados en los últimos años en el diagnóstico del CP. Se trata de un procedimiento que realiza un análisis del material genético en fluidos biológicos corporales de manera poco invasiva. Permite obtener muestras de ADN tumoral circulante con muestras de fácil acceso, como la extracción venosa, y emplear técnicas como la genotipificación tumoral integral, la identificación de mecanismos de resistencia emergentes y el seguimiento de la enfermedad residual mínima8. Uno de sus beneficios en el diagnóstico del CP se puede observar en el estudio piloto ACCELERATE9, que demostró que el uso de la biopsia líquida para el diagnóstico inicial del CP de células no pequeñas (CPCNP) avanzado conduce a resultados moleculares más rápidos y acorta el tiempo hasta el tratamiento respecto a los programas de diagnóstico habituales en la práctica clínica. También se ha demostrado su papel en estadios precoces de la enfermedad, como se ha observado en un artículo reciente utilizando el estudio de la fragmentómica. En este estudio se analizan fragmentos de ADN libre de células en plasma en un grupo de 350 pacientes sin cáncer y en otro de 432 pacientes con CP, con el que se obtiene un modelo de identificación de enfermedad temprana con un 83,2% de sensibilidad para el estadio I del CP10. En la misma línea, también se han llevado a cabo ensayos clínicos con mediciones de los perfiles de actividad metabólica de las células inmunitarias (principalmente linfocitos T y B) en respuesta a los estímulos antigénicos de CP, con plataformas para realización de la prueba que muestran niveles de especificidad y sensibilidad del 94% y 97%, respectivamente, para la detección del estadio I del CP11. Todavía hacen falta más estudios para implementar el uso de la biopsia líquida en la práctica clínica habitual, pero, sin duda, será el método diagnóstico del futuro.
Otro método diagnóstico novedoso del CP en creciente investigación es el estudio del microbioma pulmonar. Diversos estudios han demostrado que la mucosa pulmonar presenta una microbiota muy diversa respecto al tracto respiratorio superior12 y que existen múltiples factores, como las condiciones locales, la migración de microorganismos desde el tracto respiratorio superior o la eliminación de microorganismos por diferentes vías, que afectan a esta composición13. Existen cambios en esta microbioma pulmonar que derivan en inflamación local y promoción de tumores, y se ha demostrado que la disbiosis y la inflamación crónica mediante vías como el aumento de citocinas inflamatorias o la producción de toxinas bacterianas están relacionadas con la carcinogénesis del CP14. Estos cambios pueden llevar a la diferenciación específica de comunidades bacterianas en sujetos con CP, como se ha demostrado en estudios que comparan muestras de lavados bronquioalveolares en sujetos con CP y sin CP15. Así mismo, la medición conjunta de la microbioma pulmonar y metabolómica de las muestras de lavados bronquioalveolares se ha demostrado útil en el diagnóstico y progresión del CP16. Estos hallazgos indican que la microbioma pulmonar puede desempeñar un papel como potencial herramienta diagnóstica futura en el estudio del CP.
¿Qué aplicaciones tiene la inteligencia artificial en el cáncer de pulmón?En la actualidad, se están potenciando cada vez más los sistemas de inteligencia artificial (IA) que ayudan a los clínicos a mejorar la precisión de la detección de nódulos pulmonares con el análisis de imágenes radiológicas. El estudio mediante IA de las imágenes radiológicas es conocido como radiómica, término introducido por primera vez por Lambin et al.17. Sin embargo, no solo se utiliza en la detección de nódulos, sino también en el cribado y estadificación del CP, analizando además imágenes del PET-TAC y determinando si las lesiones se corresponden o no a tumores potencialmente malignos18.
En un ensayo clínico reciente, se describe un algoritmo de IA que presenta mayor precisión que la lectura del médico general y del radiólogo para la detección de nódulos pulmonares en radiografías digitales, lo que aumenta la precisión del diagnóstico del CP y evita, además, exploraciones complementarias innecesarias19. Del mismo modo, se ha investigado la aplicación de la IA en la TC de tórax. Se ha comprobado que la lectura radiológica asistida por IA en la TC de tórax mejora la precisión y sensibilidad para la detección de nódulos sospechosos en comparación con los informes radiológicos habituales realizados sin dicha ayuda20, con una precisión del 98,8% y una sensibilidad del 99,1%.
La IA también podría servir para obtener información acerca del pronóstico y predicción de mutaciones del CP. Se ha observado en un estudio reciente cómo, aplicando métodos de IA en la combinación de información radiológica de la TC de tórax y clínica, se puede predecir de manera no invasiva el genotipo de epidermal growth factor receptor (EGFR) del CP21. De esta manera se identificará a pacientes con mutaciones de EGFR de mal pronóstico de cara a que se beneficien de tratamientos más específicos de una manera más rápida y menos invasiva.
De manera complementaria, la IA también tiene un papel importante en el ámbito de la histopatología: se utiliza para distinguir tejidos sanos de tejidos tumorales malignos, así como para diferenciar el adenocarcinoma de pulmón del carcinoma de células escamosas (AUC>0,75)22.
Los sistemas de IA han avanzado de manera muy rápida en los últimos años y se están integrando cada vez más en el diagnóstico y manejo del CP. Esto obligará a los médicos a adaptarse y a integrar dichos métodos en su práctica clínica habitual en un futuro no muy lejano.
¿Continúa siendo la lobectomía la resección pulmonar indicada en el cáncer de pulmón no microcítico en estadios precoces?La resección quirúrgica completa continúa siendo el gold standard dentro de los tratamientos establecidos para el CP en estadio temprano. Desde el estudio clásico del Lung Cancer Study Group de 1995, se considera que la lobectomía es la resección mínima necesaria para un tratamiento adecuado debido a su menor tasa de recurrencia y metástasis en comparación con las resecciones sublobares (RSL) y a su menor morbimortalidad postoperatoria respecto a las neumonectomías23. El desarrollo de técnicas de preservación pulmonar, como el sleeve con reconstrucción vascular o bronquial, ha reducido el porcentaje de neumonectomías realizadas en los servicios de cirugía torácica, lo cual es considerado un marcador de calidad en los programas de benchmarking de la especialidad24.
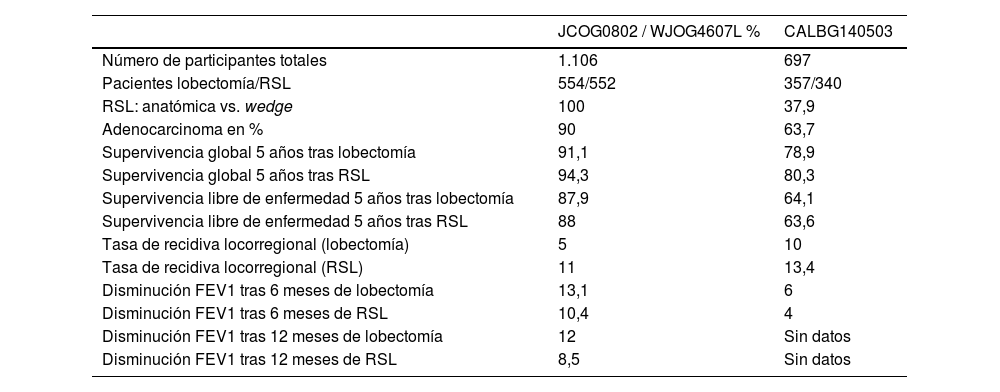
Sin embargo, existe una tendencia actual hacia la realización de RSL, las cuales pueden tener resultados oncológicos similares a la lobectomía en ciertos pacientes, teniendo en cuenta factores tumorales como la histología, el tamaño, la estadificación ganglionar y los márgenes de resección25. Recientemente, se han publicado los resultados de 2ensayos clínicos aleatorizados que respaldan esta tendencia y cuyos resultados se resumen en la tabla 2.
Resultados de los ensayos clínicos aleatorizados fase 3 lobectomía vs. RSL
| JCOG0802 / WJOG4607L % | CALBG140503 | |
|---|---|---|
| Número de participantes totales | 1.106 | 697 |
| Pacientes lobectomía/RSL | 554/552 | 357/340 |
| RSL: anatómica vs. wedge | 100 | 37,9 |
| Adenocarcinoma en % | 90 | 63,7 |
| Supervivencia global 5 años tras lobectomía | 91,1 | 78,9 |
| Supervivencia global 5 años tras RSL | 94,3 | 80,3 |
| Supervivencia libre de enfermedad 5 años tras lobectomía | 87,9 | 64,1 |
| Supervivencia libre de enfermedad 5 años tras RSL | 88 | 63,6 |
| Tasa de recidiva locorregional (lobectomía) | 5 | 10 |
| Tasa de recidiva locorregional (RSL) | 11 | 13,4 |
| Disminución FEV1 tras 6 meses de lobectomía | 13,1 | 6 |
| Disminución FEV1 tras 6 meses de RSL | 10,4 | 4 |
| Disminución FEV1 tras 12 meses de lobectomía | 12 | Sin datos |
| Disminución FEV1 tras 12 meses de RSL | 8,5 | Sin datos |
En el año 2022 se publicaron los resultados del ensayo clínico aleatorizado fase 3 japonés JCOG0802/WJOG4607L26, que incluyó a 1.106 pacientes con CP en estadio IA, con tumores periféricos menores de 2cm. De estos, 554 fueron intervenidos con lobectomía y 552 con segmentectomía anatómica. A pesar de que el grupo de RSL mostró una mayor tasa de recidivas locales, se observó una mayor supervivencia global en este grupo, aunque no se encontraron diferencias significativas en la supervivencia específica por cáncer. Además, no se demostró un beneficio funcional respiratorio significativo a pesar de la mayor preservación del parénquima pulmonar. Es importante destacar que el 87,5% de los tumores extirpados se identificaron como adenocarcinomas.
En 2023, se publicaron los resultados del ensayo clínico aleatorizado fase 3 CALBG140503, en el cual participaron 697 pacientes con CPCNP T1N027. De ellos, 357 pacientes fueron intervenidos con lobectomía y 340 con RSL (129 sublobares anatómicas y 201 tipo wedge). Después de 7 años de seguimiento, no se encontró inferioridad en la supervivencia global ni en la supervivencia específica por cáncer en el grupo de RSL en comparación con el de las lobectomías. Sin embargo, el porcentaje de recidivas locorregionales fue significativamente mayor en el grupo de RSL (13,4% frente al 10%). La reserva funcional después de la resección pulmonar fue ligeramente mayor en el grupo de RSL. Aún faltan por publicar las características de los pacientes tratados con resección tipo wedge en cuanto a los márgenes de resección libres de tumor, así como una interpretación de la supervivencia obtenida en la muestra (el 80% a 5 años), que es inferior a la mostrada en este estadio en la serie de la IASLC28.
Por tanto, se puede seguir considerando la lobectomía como la resección pulmonar estándar en pacientes con CP y plantear como alternativa la RSL en tumores menores de 2cm periféricos, especialmente en pacientes frágiles o con alta comorbilidad. Sin embargo, aún existen puntos de incertidumbre en relación con los resultados de los ensayos clínicos publicados hasta la fecha.
¿Pueden ayudar la inmunoterapia o la terapia dirigida al tratamiento de cáncer de pulmón incluso en etapas más tempranas de la enfermedad? ¿Existen otras terapias adyuvantes?Una de las principales novedades en el tratamiento de CP es la inmunoterapia, especialmente en el CPCNP. Los inhibidores de PD-1 (proteína de muerte celular programada: pembrolizumab, nivolumab), los inhibidores de PD-L1 (ligando de proteína de muerte celular programada: atezolizumab, durvalumab) y CTLA-4 (antígeno 4 de linfocitos T citotóxicos: ipilimumab) se están utilizando en etapas tempranas como primera línea perioperatoria debido a los avances recientes en estas terapias.
El tratamiento neoadyuvante con inmunoterapia en estadios localmente avanzados (IIIA) se tratará con más profundidad más adelante. De manera complementaria, el ensayo controlado en fase III CheckMate 816, que evalúa la eficacia del nivolumab más quimioterapia doble con platino como tratamiento neoadyuvante en pacientes con CPCNP resecable en el estadio II-IIIA, mejoró la respuesta patológica completa (RPC) con respecto a la quimioterapia sola, así como la supervivencia libre de eventos, de manera segura y tolerable29. El estudio IMpower010 comparó la adyuvancia del atezolizumab con la quimioterapia en pacientes con CPCNP en estadio IB-IIIA resecables, con mejoría significativa en la supervivencia libre de enfermedad en tumores con una expresión de PD-L1 ≥50%30. Acorde con estos estudios, el ensayo KEYNOTE-091 muestra preliminarmente que el pembrolizumab mejora de forma significativa la supervivencia libre de enfermedad y disminuye el riesgo de recurrencia y muerte en pacientes con CPCNP resecable en estadio IIB-IIIA con respecto al placebo, con independencia del nivel de expresión de PD-L131.
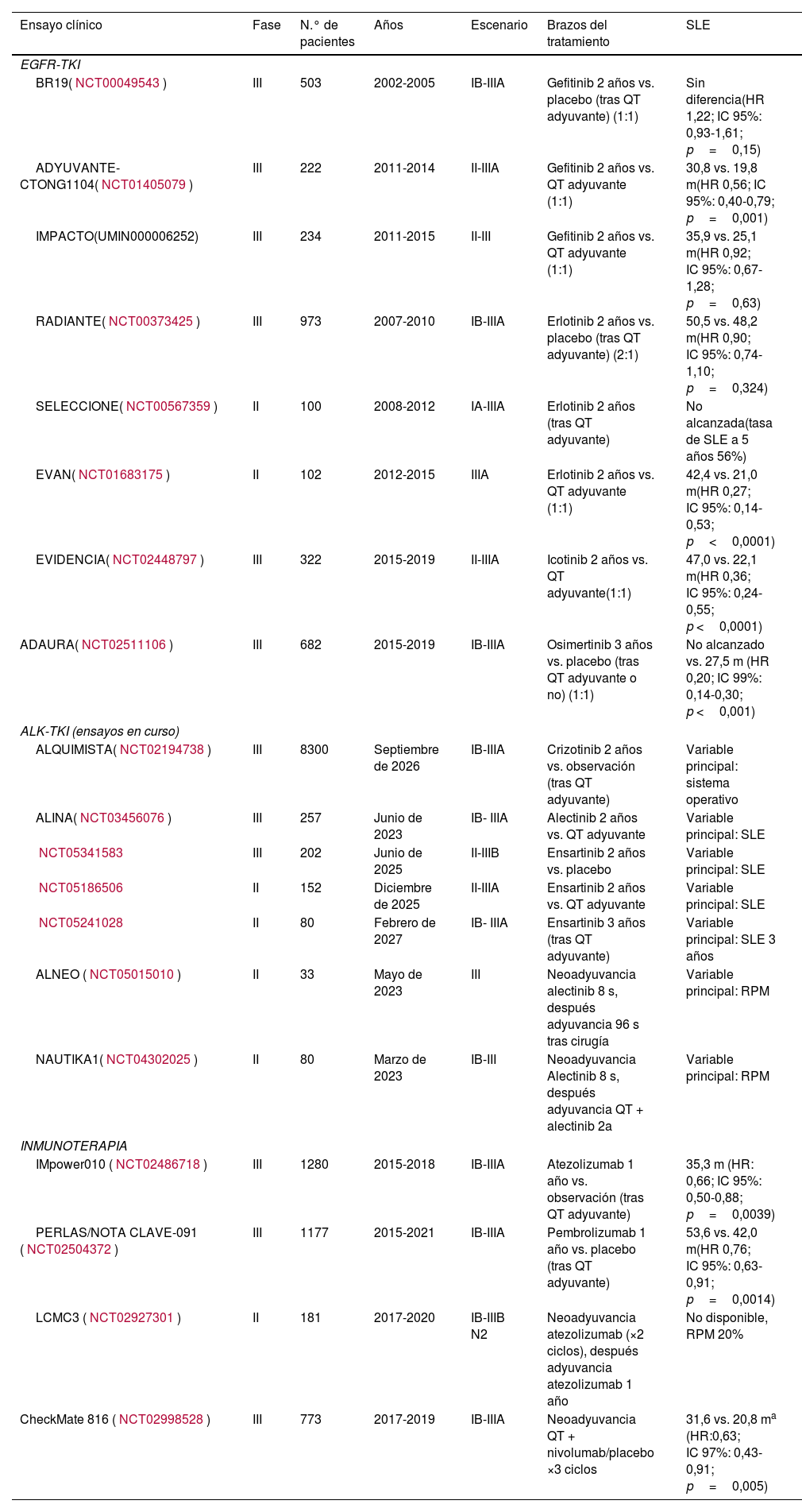
Otra novedad en el CP es la terapia dirigida con fármacos específicos para tratar mutaciones genéticas, como EGFR, ALK, ROS1 y BRAF. El estudio en fase III controlado con placebo ADAURA avala el tratamiento con osimertinib adyuvante en CPCNP con mutación EGFR en estadios IB-IIIA tras la cirugía32. El ensayo EVIDENCE también muestra una mejoría significativa en la supervivencia libre de enfermedad en comparación con la quimioterapia en el mismo perfil de pacientes, al utilizar icotinib33. Sin embargo, en los análisis por subgrupos de los ensayos IMpower01030 y KEYNOTE-09131 mencionados, la respuesta a dichos fármacos fue mayor en los pacientes sin las mutaciones EGFR/ALK. En la tabla 3 se muestran los ensayos clínicos disponibles en el entorno adyuvante.
Ensayos clínicos disponibles en el entorno adyuvante del cáncer de pulmón
| Ensayo clínico | Fase | N.° de pacientes | Años | Escenario | Brazos del tratamiento | SLE |
|---|---|---|---|---|---|---|
| EGFR-TKI | ||||||
| BR19(NCT00049543) | III | 503 | 2002-2005 | IB-IIIA | Gefitinib 2 años vs. placebo (tras QT adyuvante) (1:1) | Sin diferencia(HR 1,22; IC 95%: 0,93-1,61; p=0,15) |
| ADYUVANTE-CTONG1104(NCT01405079) | III | 222 | 2011-2014 | II-IIIA | Gefitinib 2 años vs. QT adyuvante (1:1) | 30,8 vs. 19,8 m(HR 0,56; IC 95%: 0,40-0,79; p=0,001) |
| IMPACTO(UMIN000006252) | III | 234 | 2011-2015 | II-III | Gefitinib 2 años vs. QT adyuvante (1:1) | 35,9 vs. 25,1 m(HR 0,92; IC 95%: 0,67-1,28; p=0,63) |
| RADIANTE(NCT00373425) | III | 973 | 2007-2010 | IB-IIIA | Erlotinib 2 años vs. placebo (tras QT adyuvante) (2:1) | 50,5 vs. 48,2 m(HR 0,90; IC 95%: 0,74-1,10; p=0,324) |
| SELECCIONE(NCT00567359) | II | 100 | 2008-2012 | IA-IIIA | Erlotinib 2 años (tras QT adyuvante) | No alcanzada(tasa de SLE a 5 años 56%) |
| EVAN(NCT01683175) | II | 102 | 2012-2015 | IIIA | Erlotinib 2 años vs. QT adyuvante (1:1) | 42,4 vs. 21,0 m(HR 0,27; IC 95%: 0,14-0,53; p<0,0001) |
| EVIDENCIA(NCT02448797) | III | 322 | 2015-2019 | II-IIIA | Icotinib 2 años vs. QT adyuvante(1:1) | 47,0 vs. 22,1 m(HR 0,36; IC 95%: 0,24-0,55; p <0,0001) |
| ADAURA(NCT02511106) | III | 682 | 2015-2019 | IB-IIIA | Osimertinib 3 años vs. placebo (tras QT adyuvante o no) (1:1) | No alcanzado vs. 27,5 m (HR 0,20; IC 99%: 0,14-0,30; p <0,001) |
| ALK-TKI (ensayos en curso) | ||||||
| ALQUIMISTA(NCT02194738) | III | 8300 | Septiembre de 2026 | IB-IIIA | Crizotinib 2 años vs. observación (tras QT adyuvante) | Variable principal: sistema operativo |
| ALINA(NCT03456076) | III | 257 | Junio de 2023 | IB- IIIA | Alectinib 2 años vs. QT adyuvante | Variable principal: SLE |
| NCT05341583 | III | 202 | Junio de 2025 | II-IIIB | Ensartinib 2 años vs. placebo | Variable principal: SLE |
| NCT05186506 | II | 152 | Diciembre de 2025 | II-IIIA | Ensartinib 2 años vs. QT adyuvante | Variable principal: SLE |
| NCT05241028 | II | 80 | Febrero de 2027 | IB- IIIA | Ensartinib 3 años (tras QT adyuvante) | Variable principal: SLE 3 años |
| ALNEO (NCT05015010) | II | 33 | Mayo de 2023 | III | Neoadyuvancia alectinib 8 s, después adyuvancia 96 s tras cirugía | Variable principal: RPM |
| NAUTIKA1(NCT04302025) | II | 80 | Marzo de 2023 | IB-III | Neoadyuvancia Alectinib 8 s, después adyuvancia QT + alectinib 2a | Variable principal: RPM |
| INMUNOTERAPIA | ||||||
| IMpower010 (NCT02486718) | III | 1280 | 2015-2018 | IB-IIIA | Atezolizumab 1 año vs. observación (tras QT adyuvante) | 35,3 m (HR: 0,66; IC 95%: 0,50-0,88; p=0,0039) |
| PERLAS/NOTA CLAVE-091 (NCT02504372) | III | 1177 | 2015-2021 | IB-IIIA | Pembrolizumab 1 año vs. placebo (tras QT adyuvante) | 53,6 vs. 42,0 m(HR 0,76; IC 95%: 0,63-0,91; p=0,0014) |
| LCMC3 (NCT02927301) | II | 181 | 2017-2020 | IB-IIIB N2 | Neoadyuvancia atezolizumab (×2 ciclos), después adyuvancia atezolizumab 1 año | No disponible, RPM 20% |
| CheckMate 816 (NCT02998528) | III | 773 | 2017-2019 | IB-IIIA | Neoadyuvancia QT + nivolumab/placebo ×3 ciclos | 31,6 vs. 20,8 ma (HR:0,63; IC 97%: 0,43-0,91; p=0,005) |
a: años; ALK-TKI: inhibidores de la tirosina cinasa de la cinasa del linfoma anaplásico; EGFR-TKI: inhibidores de la tirosina cinasa del receptor del factor de crecimiento epidérmico; HZ: hazard ratio; m: meses; QT: quimioterapia; RPM: respuesta patológica mayor; s: semanas; SLE: supervivencia libre de enfermedad.
Paralelamente se está investigando la terapia génica denominada inmunoterapia citotóxica mediada por genes. Consiste en administrar un vector adenoviral no replicante para inducir la muerte de células cancerosas inmunogénicas. Un estudio reciente ha observado actividad inmunológica significativa tras la inyección antitumoral de adenovirus por broncoscopia en pacientes con CPCNP resecable34.
Por último, como opciones de tratamiento en estadios tempranos no operables del CP, se ha agregado a la ya clásica radiocirugía estereotáctica35, la radioterapia de intensidad modulada. Ensayos clínicos como RTOG 0236 y RTOG 1106 en pacientes con CP estadio III36,37 han demostrado que esta radioterapia combinada con quimioterapia o terapia de protones reduce la toxicidad pulmonar.
¿Qué podemos esperar de la neoadyuvancia con quimioinmunoterapia en estadios localmente avanzados (IIIA) de cáncer de pulmón de células no pequeñas?Para los pacientes con enfermedad resecable, las tasas de supervivencia a los 5 años pueden variar desde el 68% en estadios IB hasta el 36% en estadios IIIB28. Aproximadamente, el 20% de los CPCNP se diagnostican en el estadio IIIA38, que es un grupo heterogéneo en el que la cirugía como único tratamiento conlleva riesgo de recurrencia locorregional y de metástasis a distancia39. Por esta razón, existe un consenso general sobre la necesidad de un tratamiento multimodal en este subconjunto de pacientes.
En los últimos años, la aparición de inhibidores de puntos de control inmunológico (ICI) como anti-PD-1, anti-PD-L1 o anti-CTLA-4, ha cambiado la estrategia de tratamiento en el CPCNP. La evidencia de que la terapia con ICI puede generar respuestas duraderas en algunos pacientes con CPCNP metastásico40 ha llevado al desarrollo de múltiples ensayos clínicos que incorporan la neoadyuvancia con ICI en monoterapia o con quimioinmunoterapia en el tratamiento del CPCNP resecable (tabla 3).
La administración de terapias de inducción tiene el potencial de inducir una RPC, mejorar la resecabilidad y disminuir las tasas de metástasis a distancia41,42. Los resultados de los ensayos NADIM y SAKK 16/14 señalan que la adición de ICI a la quimioterapia en neoadyuvancia es factible en pacientes con enfermedad en estadio IIIA. En la mayoría de estos pacientes pudo llevarse a cabo la resección quirúrgica con altas tasas de RPC sin grandes demoras en el tiempo hasta la cirugía29,43-45. De hecho, los datos del CheckMate 816 han demostrado mayores tasas de RPC con nivolumab más quimioterapia que con quimioterapia sola, sin incrementar los eventos adversos29. Además, la supervivencia libre de enfermedad y la supervivencia global parecen ser superiores a los resultados obtenidos con el tratamiento estándar. NADIM reportó una supervivencia global a los 36 meses del 82% en el grupo de análisis por intención de tratar y del 91% en el grupo que completó el protocolo de nivolumab más quimioterapia46.
Por otro lado, las principales preocupaciones quirúrgicas después del tratamiento de inducción están relacionadas con el potencial retraso de la cirugía, la posibilidad de resección completa, la mayor complejidad quirúrgica o una mayor tasa de eventos adversos postoperatorios47. NEOSTAR evaluó la complejidad quirúrgica y la función pulmonar tras ICI neoadyuvante y reveló su escaso impacto en la tasa de resección y su dificultad, sin efectos adversos que afecten al pronóstico perioperatorio48,49. En la misma línea, en el 89% de los pacientes en estadio IIIA resecable incluidos en NADIM pudo llevarse a cabo la cirugía y en el 85%, lobectomía, con un 51% de abordaje por videotoracoscopia y resección completa (R0) en todos ellos, con una tasa de complicaciones postoperatorias aceptables y sin mortalidad a 30 y 90 días46,50.
Aunque estos resultados son alentadores, muchos factores siguen sin determinarse, como la identificación de predictores de respuesta, la determinación de los pacientes que se beneficiarán más y la exploración de los mecanismos de resistencia primaria y secundaria a la inmunoterapia. Nuevos ensayos clínicos en curso son esenciales para determinar la mejor forma de integrar la inmunoterapia en el tratamiento del CPCNP en etapas tempranas. Ha cambiado en la actualidad el paradigma del tratamiento del CPCNP en el estadio IIIA.
¿Cuál es el mejor seguimiento a largo plazo de los pacientes operados de cáncer de pulmón de células no pequeñas?A pesar del tratamiento quirúrgico con intención curativa de los pacientes diagnosticados de CPCNP, su tasa de supervivencia a 5años después de la resección pulmonar oscila entre el 41% y el 90%, según el estadio patológico21, debido al alto riesgo de recurrencia de la enfermedad y de desarrollo de un segundo cáncer primario de pulmón51. Debido a la necesidad de diagnosticar de forma precoz estos casos, la TC52 se ha convertido en la prueba de seguimiento radiológico estandarizada de los pacientes oncológicos tratados quirúrgicamente por CP, aunque la evidencia científica disponible es limitada53.
En la literatura, dependiendo de la institución o sociedad involucrada, existen múltiples recomendaciones sobre la frecuencia de seguimiento radiológico en estos pacientes, si bien todas ellas tienen un nivel de evidencia bajo y se basan en recomendaciones de expertos. Aún no existen datos sólidos sobre la influencia de la periodicidad del seguimiento en la supervivencia.
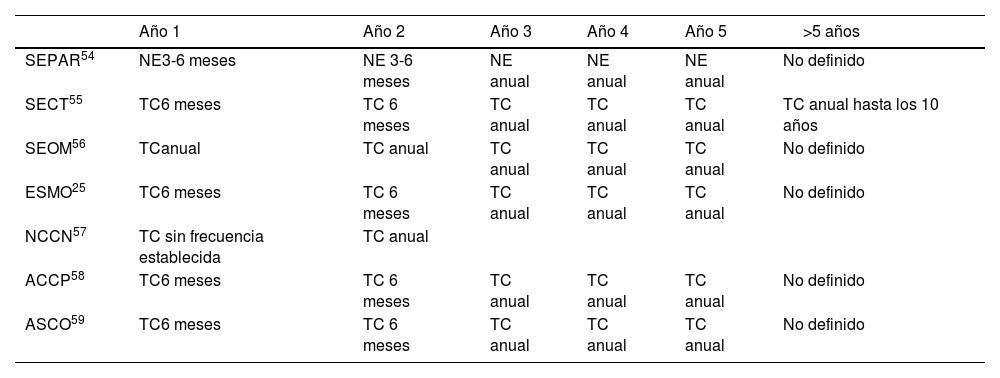
La Sociedad Española de Neumología y Cirugía Torácica (SEPAR)54, la Sociedad Española de Cirugía Torácica (SECT)55, la Sociedad Española de Oncología Médica (SEOM)56 o instituciones internacionales como la European Society of Medical Oncology (ESMO)25, el National Comprehensive Cancer Network (NCCN)57, el American College of Chest Physicians Evidence (ACCP)58 o la American Society of Clinical Oncology (ASCO)59 recomiendan diferentes frecuencias de seguimiento radiológico, que varían desde la realización de TC con frecuencia trimestral hasta anual (tabla 4). Esta frecuencia de seguimiento se mantiene de forma generalizada durante los 2 primeros años después de la resección, intervalo temporal en el que se observa una mayor incidencia de recidiva. Posteriormente, es común la adopción de una frecuencia de seguimiento menor, como la periodicidad anual.
Recomendaciones de seguimiento por diferentes sociedades científicas
| Año 1 | Año 2 | Año 3 | Año 4 | Año 5 | >5 años | |
|---|---|---|---|---|---|---|
| SEPAR54 | NE3-6 meses | NE 3-6 meses | NE anual | NE anual | NE anual | No definido |
| SECT55 | TC6 meses | TC 6 meses | TC anual | TC anual | TC anual | TC anual hasta los 10 años |
| SEOM56 | TCanual | TC anual | TC anual | TC anual | TC anual | No definido |
| ESMO25 | TC6 meses | TC 6 meses | TC anual | TC anual | TC anual | No definido |
| NCCN57 | TC sin frecuencia establecida | TC anual | ||||
| ACCP58 | TC6 meses | TC 6 meses | TC anual | TC anual | TC anual | No definido |
| ASCO59 | TC6 meses | TC 6 meses | TC anual | TC anual | TC anual | No definido |
NE: no especificada prueba de imagen; TC: tomografía computarizada.
A pesar de las recomendaciones descritas, en estudios recientes se advierte que una vigilancia radiológica postoperatoria más frecuente mediante TC después de la resección del CP no se asocia con mejores resultados oncológicos en pacientes con estadios iniciales60, lo que abre la puerta a la necesidad de individualizar la frecuencia de seguimiento según las características del paciente y el tumor61.
FinanciaciónLos autores declaran no haber recibido ninguna financiación económica para la elaboración de este artículo.
Contribuciones de los autoresTodos los autores han colaborado en la preparación, revisión y aprobación del documento.
Conflictos de interésLos autores declaran no tener conflicto de intereses respecto al tema tratado.