La ventilación mecánica a domicilio (VMD) presenta un objetivo claro: el tratamiento de la insuficiencia respiratoria crónica de pacientes en fracaso ventilatorio crónico, impactando este tratamiento tanto en la calidad de vida como en la supervivencia de los pacientes. La idea motriz que en su día impulsó la habilitación de la VMD fue la posibilidad de que los pacientes abandonaran el hospital, manteniendo la calidad de vida en sus propias casas.
La transición del hospital al domicilio es un acto complejo que depende de muchos factores médicos y no médicos y que debe ser abordado por un equipo multidisciplinario de profesionales de la salud. Una adaptación efectiva y una estrecha vigilancia resultan esenciales para el éxito del programa.
La gestión de todo el proceso en su conjunto se debe sustentar en protocolos o guías clínicas que garanticen la aplicación de la mejor evidencia científica disponible y, además, construyan un «paraguas» científico-técnico que no solo sirva para los profesionales en su trabajo diario, sino también a las administraciones públicas, así como a las empresas del sector salud para guiar los concursos de terapias domiciliarias, en este complejo mundo de la salud público-privada.
Home mechanical ventilation (VMD) presents a clear objective; the treatment of chronic respiratory failure in patients with chronic ventilatory failure, impacting this treatment not only on quality of life but also on patient survival. The idea that give impulse the empowerment of MV at home was, the possibility that patients leave the hospital, maintaining the quality of life in their own homes.
The transition from hospital to home is a complex act that depends on many medical and non-medical factors and must be addressed by a multidisciplinary team of health professionals. Effective adaptation and close monitoring are crucial to the success of the program.
The management of the entire process as a whole must be based on protocols or clinical guidelines that guarantee the application of the best scientific evidence available, and also, build a scientific-technical «umbrella» that not only serves professionals in their daily, but also to public administrations, and even companies in the health area, to guide home therapy companies, in this complex world of public-private health.
La ventilación mecánica domiciliaria (VMD) consiste en el uso intermitente o continuo de un sistema de ventilación administrado a través de una interfase, nasal, facial o pieza bucal en la ventilación no invasiva, o de traqueostomía para la invasiva. El objetivo de este tratamiento en la insuficiencia respiratoria crónica (IRC) es disminuir el trabajo de los músculos respiratorios y corregir la hipoxemia y/o hipercapnia, a través del aumento de la ventilación alveolar, mejorando así el intercambio gaseoso. La VMD constituye un tratamiento bien establecido de la IRC de pacientes con fallo ventilatorio. La VMD mejora la supervivencia de pacientes con enfermedades neuromusculares y de la caja torácica1,2, y las anomalías en el intercambio gaseoso y la calidad de vida en pacientes con síndrome de hipoventilación-obesidad (SHO)3,4. Su papel en la enfermedad pulmonar obstructiva crónica (EPOC) es controvertido y recientes metanálisis no parecen mostrar mejoría de la supervivencia5. Sus efectos sobre otros componentes distintos, como los ejercidos sobre la mecánica pulmonar, la disnea o la calidad de vida están en constante investigación, siendo una de las áreas de mayor desarrollo de la neumología en los últimos años.
Aunque España también sufrió las epidemias de poliomielitis que afectaron al norte de Europa, a diferencia del progreso que se produjo en las técnicas de ventilación, tanto por traqueostomía como por presión negativa6-8, el avance de la VMD en nuestro país ha tenido lugar durante los últimos 20 años. En 1985 se publicaron los primeros nueve casos consistentes en pacientes restrictivos ventilados mediante poncho o a través de traqueostomía9,10. Al propio tiempo se iniciaron programas en Barcelona, Cáceres y Valencia, entre otros11-15. A partir de 1995 el número de centros donde se practica la VMD se incrementó progresivamente.
En 1998, el 77% de los centros que efectuaban VMD atendía a menos de 50 pacientes. El estudio de De Lucas Ramos et al.16, mostró que en 1999 la ventilación mecánica no invasiva (VMNI) domiciliaria estaba ampliamente introducida en nuestro país, pero los datos correspondían a 43 hospitales que respondieron a la encuesta, de los 200 a los que se les solicitó. En estos años, el número de pacientes ventilados era aproximadamente de 2.000, afectando a enfermedad restrictiva toracógena en el 44%, enfermedades neuromusculares en el 25%, SHO en el 15%, EPOC en el 9% y otras enfermedades en el 7%, siendo la interfase más frecuentemente utilizada la nasal (90%), 6% a través de traqueostomía, 2% facial y menos de un 1% a través de piezas bucales. El porcentaje de ventiladores volumétricos era del 50%, al igual que en el resto de Europa, donde en 1994 la mayor parte de los pacientes con VMD utilizaban este tipo de ventiladores17. Esto contrasta con la realidad actual donde prácticamente todas las indicaciones se hacen con ventiladores limitados por presión. La tasa de uso media de VMD en las 14 comunidades autónomas, con mayor o menor diferencia entre ellas, era en 1999 de 4,59 pacientes con VMD/100.000 habitantes.
El estudio Eurovent puso de manifiesto una amplia variación de la tasa de uso entre los distintos países y notables diferencias en la proporción relativa de pacientes con enfermedad obstructiva y restrictiva. En este estudio, publicado en 2001, las cifras menores corresponden a Polonia (0,1/100.000) y las más elevadas a Francia (17/100.000), con una media europea de 6,6/100.00018.
Desde nuestro punto de vista, varios aspectos deben ser reseñados en relación con la VMD, que pasaremos a analizar: aumento de su tasa de uso, cambios en el tipo de paciente susceptible de VMD, variabilidad en la práctica clínica y control de calidad. Por último, algunos aspectos organizativos serán desarrollados con mayor amplitud en apartados sucesivos.
Respecto a la tasa de uso, esta ha aumentado considerablemente en los últimos años. Un estudio en la Comunidad Valenciana mostró en 2009 una prevalencia de 29/100.00019, cifras muy similares a las reportadas por el Observatorio de terapias respiratorias domiciliarias (TRD) en Cataluña20 o de Castilla La Mancha21. Este mismo proceso se ha producido en Europa, incluso en países que exhibían las tasas más bajas, como son los casos de Polonia22, Suiza23 y Holanda24, o las más altas, como Francia, con cifras procedentes del ANTADIR25, pero también en otros países como Australia y Nueva Zelanda (9,9-12/100.000)26. En Francia, 60.000 pacientes se encontraban en 2011 bajo VMD, lo que supondría una tasa de uso de 90/100.00025,27. La ausencia de un registro nacional nos impide conocer datos actualizados, pero la puesta en marcha de programas de eficiencia en distintas Comunidades Autónomas, como consecuencia de la mejoría en las TRD y la interacción entre las empresas prestadoras de TRD, los clínicos y las Consejerías de Salud, nos inclinan a considerar que las cifras globales son muy similares a las de Francia. De hecho, en departamentos de salud donde la VMD se ha desarrollado tradicionalmente, se informaron en 2014 cifras de 82/100.00028.
Un estudio reciente en la Comunidad de Madrid mostró, en 2018, una tasa de uso de VMD de 74/100.000 habitantes, muestra de esta deseable evolución29.
Uno de los aspectos que ha aumentado la prevalencia de la VMD es el envejecimiento de la población y el aumento de las enfermedades crónicas, como la EPOC o la obesidad. En este sentido, la edad no es un criterio para indicar o contraindicar la VMD. Algunos autores consideran que no es razonable el uso a largo plazo en ancianos, especialmente en aquellos mayores de 75 años, debido a la menor esperanza de vida de este grupo de edad, mayor riesgo de deterioro neuropsicológico y menor potencial de adaptación a la VMD30. Sin embargo, varios estudios procedentes de grupos españoles han demostrado que la VMD es eficaz en este grupo de pacientes, señalando mejoría en la gasometría arterial y la desaturación nocturna, disminución de los ingresos hospitalarios y duración de la estancia hospitalaria, con una supervivencia media de casi cinco años, siendo el cumplimiento y la tolerancia comparables a la población general31-33. Janssens et al.32, en un estudio descriptivo, evaluaron la tolerancia, el cumplimiento y el impacto en la calidad de vida de VMD en pacientes mayores de 75 años mostrando, además de la mejoría gasométrica, una disminución en el consumo de recursos hospitalarios y mejor calidad de vida después de la iniciación de VMD.
La decisión de iniciar VMD puede ser muy compleja ya que entran en juego consideraciones como la edad del paciente, la naturaleza y la historia natural del proceso subyacente, la gravedad del deterioro fisiológico, el entorno, que puede condicionar la capacidad de desarrollarla de manera integral, y la voluntad de pacientes y cuidadores. En esta línea, se considera una contraindicación relativa para iniciar VMD la falta de motivación o de cooperación y la ausencia de apoyo familiar o social. Sin lugar a dudas, estos factores están asociados con la edad, ya que se ven más a menudo en las personas mayores, y aunque es probable que en este grupo coexistan uno o más de ellos, y que juegue un papel importante en el éxito o fracaso de la ventilación, no hay estudios que evalúen esta posibilidad34.
Independientemente de los factores psicológicos y sociales involucrados, los cambios morfológicos y fisiológicos que ocurren en el pulmón con la edad avanzada también podrían contribuir a la peor adaptación33.
Aunque la VMD se ha generalizado, se ha publicado poca información respecto a cifras de empleo real y cumplimiento, distribución geográfica, servicios básicos, coordinación, etc. Algunos trabajos parecen mostrar que existen carencias importantes de personal, infraestructuras, de consultas monográficas, diversidad de las enfermedades atendidas y de las modalidades de ventilación, así como variabilidad en el número de pacientes atendidos por hospitales. Esto refleja una realidad presente también en otros países europeos19,35.
Respecto al tipo de pacientes atendidos, a lo largo de los años ha cambiado y es la EPOC y el SHO, al igual que en Europa, el principal grupo de pacientes con VMD, constituyendo el 70%19,20,23. La patología que más frecuentemente justificaba en la Comunidad de Madrid la VMD, fue el síndrome de obesidad hipoventilación 41% (25-70%, según centro). En menor medida les siguen las enfermedades restrictivas de la caja torácica y las enfermedades neuromusculares; entre estas se incluye una baja proporción, en razón de la patología de base y su supervivencia, de pacientes tratados a través de traqueostomía.
La conferencia de consenso de 199936 estableció criterios para inicio de la VMD en pacientes neuromusculares o con patología de la caja torácica, debiendo básicamente iniciarla ante la presencia de síntomas como disnea, cefalea matutina y uno de los siguientes criterios: PaCO2 > 45 mmHg y SpO2 < 88% durante 5 minutos consecutivos en la oximetría nocturna. Además, en pacientes con enfermedad neuromuscular progresiva, la existencia de una presión inspiratoria máxima < 60 cmH2O o capacidad vital forzada < 50% del valor predicho, son criterios de inicio de la VMD. En pacientes con EPOC, la indicación de la ventilación se basa en los síntomas y la alteración de uno de los siguientes parámetros: PaCO2 > 55 o cuando la PaCO2 se sitúa entre 50-54 mmHg y se acompaña de desaturación nocturna inferior al 88% durante 5 minutos consecutivos mientras se administra oxigenoterapia a 2 L/min, o cuando existan episodios recurrentes de insuficiencia respiratoria hipercápnica (> 2 en un período de 12 meses)36.
La escasez de estudios clínicos controlados deja un número de preguntas sin respuesta, como qué tipo de ventilador es más adecuado para cada patología, cuáles pueden ser las configuraciones óptimas del ventilador y, sobre todo, cuándo debería iniciarse la VMD. Debido a que la VMD es el tratamiento de elección en estos pacientes, un estudio prospectivo, controlado no sería factible. Sin embargo, una alternativa para minimizar el sesgo potencial podría ser plantear un estudio prospectivo observacional que incluyera a todos los pacientes que reciben VMD, de acuerdo con las indicaciones actuales37.
La variabilidad de la VMD, tanto geográfica como entre centros de la misma ciudad, es uno de los temas clave, ya que la VMD requiere equipos expertos y el número de pacientes atendidos es un elemento muy importante. De hecho, un porcentaje elevado de centros aplican la VMD a un escaso número de pacientes, y a un mayor porcentaje de pacientes menos complejos19,35,38. Esta variabilidad no puede atribuirse, excepto en casos muy concretos, a la prevalencia de la patología de base, sino a la propia variabilidad de la práctica clínica, actitud de los profesionales o a la ausencia de recursos para desempeñar con criterios de calidad38,39. También en el estudio del 2018, de la CAM, se encontró mucha variabilidad intercentro, tanto en la tasa de VMD como en la patología que justificaba la indicación.
Otros estudios han puesto de manifiesto, tanto en España como en Europa, las carencias en el control de calidad de los sistemas de VMNI a domicilio, fundamentalmente cuando no hay equipos multidisciplinarios y dicho control se halla casi de forma exclusiva en manos de personal técnico o de las empresas prestadoras de servicios. Así, un estudio europeo llevado a cabo en 16 países, que incluyó a más de 20.000 pacientes ventilados, mostró que los servicios prestados a los pacientes los realizaban compañías externas en el 62% de los centros, con una frecuencia de mantenimiento entre 3 y 12 meses; que la interacción con las compañías prestadoras de servicios era limitada; que la participación de los centros en el control de calidad de los equipos era escasa; que los centros carecían en su mayoría de sistemas de vigilancia y que había considerables diferencias no solo entre países, sino dentro del propio país40.
Otro trabajo mostró importantes discrepancias entre los parámetros prescritos en el ventilador y los datos reales obtenidos en el domicilio, con considerables diferencias individuales, concluyendo sobre la importancia de evaluar periódicamente el uso real de los ventiladores en el domicilio del paciente, con el fin de mejorar el cumplimiento y los resultados de la VMD41.
Estudios multicéntricos en la misma línea, llevados a cabo en hospitales de Barcelona, mostraron hallazgos semejantes, con discrepancias de 20-30% en volumen minuto o en la presión inspiratoria, observando incluso mal funcionamiento en algunos casos en el sistema de alarmas, aunque el número de ingresos hospitalarios no programados en el año previo al estudio no se correlacionó con el índice de error del ventilador42.
Parece evidente que el número total de pacientes con VMD va a seguir aumentando, por lo que deben establecerse estrategias para mejorar la accesibilidad y las curvas de aprendizaje de los distintos centros, probablemente actuando como una red no jerárquica, aunque coexistan centros especializados en patologías más complejas o en pacientes altamente dependientes. Cada uno a su nivel desempeñaría su papel asistencial, docente e investigador, asumiendo distintos papeles en función de las necesidades o de la toma de decisiones, basadas más en la pericia o el conocimiento que en la centralización37,43. Se ha señalado que un equipo experto es el que controla a más de 100 pacientes y tiene por lo menos más de 10 casos nuevos al año43.
Si el número de pacientes con VMD ha crecido exponencialmente, dentro de su aparente simplicidad, ha crecido la complejidad y las posibilidades técnicas de los respiradores, incorporando progresivamente diferentes modalidades ventilatorias, alarmas sofisticadas, posibilidad de regular trigger, ciclado, volúmenes y presiones, capacidad de asegurar o garantizar volúmenes y, más recientemente, disponer de herramientas de supervisión. Pantallas con curvas, estimación, medición o regulación de la FiO2, registro integrado de la saturación de hemoglobina o del CO2 espirado, son algunas de las posibilidades que los respiradores de última generación ponen a nuestra disposición, haciendo más compleja la VMNI44. Existe posibilidad de monitorización con telemedicina y monitorización con software para suministrar información de cumplimiento, patrones de uso, asincronías, etc. El tipo de paciente ventilado a domicilio ha cambiado, se plantea cada vez con más frecuencia la VMNI hospitalaria y domiciliaria en pacientes de edad avanzada, pacientes con orden de no intubar o con comorbilidad grave asociada, así como con finalidad paliativa45-48.
Desde el punto de vista docente, deben ponerse en marcha planes de formación continuada no solo para neumólogos sino para enfermería, e incluso medicina primaria, liderando la integridad del proceso, desde el servicio de urgencias al domicilio del paciente, pasando por los distintos especialistas implicados, que en el ámbito hospitalario incluyen Medicina Interna, Cardiología, Cuidados Intensivos y Pediatría, entre otros; en el ámbito extrahospitalario, los servicios de Urgencias y Emergencias. Planes docentes internos y externos, compartidos con especialidades afines, pueden ser necesarios para alcanzar consensos y acuerdos. Este proceso, dirigido por neumólogos, necesariamente debe adaptarse al modelo organizativo de cada hospital, ya que ello tiene la mayor influencia en el abordaje del paciente: disponibilidad de guardias o no de neumología, existencia de unidad de sueño y nivel de acreditación, disponibilidad de recursos y de personal, etc. Debe tenerse en cuenta además que estos modelos deben revisarse, ya que son cambiantes a lo largo del tiempo, dependientes tanto de los profesionales como de los administradores.
Desde el punto de vista investigador, sin duda la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) es una de sus principales impulsoras, y buena prueba de ello es la creación en su seno de un grupo potente de ventilación que ya está dando sus frutos. SEPAR ha impulsado la acreditación de Unidades de Ventilación Mecánica no Invasiva Domiciliaria. A fecha de elaboración de esta guía existen 32 unidades acreditadas, 13 de ellas como Unidades Especializadas de Alta Complejidad. Cada una de las Unidades acreditadas deberá contribuir de forma activa y esencial a la prestación de un servicio sanitario de calidad y eficiencia cercano al paciente.
La estructura en distintos niveles no supondrá en modo alguno categorías de mayor o menor rango, sino la expresión de diferentes grados de complejidad en el abordaje diagnóstico y terapéutico de los pacientes, por lo que deberá reflejarse la forma de coordinación entre Unidades de distintos niveles. La unidad multidisciplinar de alta complejidad está dotada de suficientes recursos materiales y humanos que le capacita para realizar cualquier tipo de actividad asistencial, docente o investigadora relacionada con la prevención, diagnóstico y tratamiento de cualquier patología tributaria de tratamiento con ventilación crónica domiciliaria. Debe facilitar la consulta y derivación de pacientes desde las unidades de menor nivel, así como la atención de pacientes con exacerbación ambulatoria. Siguiendo en este proceso, la unidad especializada consiste en un centro de menor complejidad que las Unidades Multidisciplinares, que disponen de recursos humanos y materiales que les posibilitan brindar una atención especializada de alto nivel, a la mayoría de los pacientes con patología tributaria de tratamiento con ventilación domiciliaria, pero que necesita apoyo complementario o derivación para aquellos pacientes con elevada complejidad y necesidades asistenciales multidisciplinares. Son centros capacitados para llevar a cabo actividad asistencial, docente y de investigación en los aspectos relacionados con la prevención, el diagnóstico y el tratamiento con ventilación crónica domiciliaria, así como la atención de pacientes que presenta una exacerbación ambulatoria. Para finalizar, las unidades básicas son unidades cuyo responsable es un especialista en neumología, que dedica gran tiempo de su trabajo a la ventilación crónica domiciliaria, aunque no necesariamente con exclusividad, pero que destaca por esa labor específica en su centro. Estas unidades disponen de los recursos básicos y un número mínimo de pacientes para mantener un nivel adecuado de experiencia en ventilación domiciliaria. Deben mantener una fluida relación con unidades de mayor complejidad para consulta y derivación de pacientes más complejos.
Los cambios generados en los últimos años permiten augurar lo que podríamos denominar una «era de la ventilación inteligente» en la que se producirá (de hecho ya se está produciendo) una evolución a conceptos técnicos, de monitorización, interacción médico-paciente, alianzas, nuevas indicaciones y modelos de organización diferentes, pero con grandes perspectivas de futuro desde el punto de vista profesional y de la atención al paciente.
La calidad en el tratamiento domiciliario con VMMedir los resultados de la asistencia es un elemento crucial para determinar la calidad de la asistencia prestada. Sin embargo, no existe todavía un desarrollo suficiente de indicadores de resultados que sean aceptados y validados de forma general. Junto a ello se encuentra la dificultad de monitorizar externamente estos datos debido a la heterogeneidad de los programas informáticos u otros registros utilizados en los distintos centros hospitalarios de nuestro país. Es por ello por lo que hemos diseñado una escala de baremación buscando una aproximación a una adecuada calidad de la asistencia en Ventilación Domiciliaria de forma indirecta. Sabemos que es fundamental el desarrollo de indicadores de resultados de la asistencia en nuestros pacientes en las distintas Unidades definidas y pensamos que estos criterios actuales pueden ser objeto de una revisión posterior, una vez que se desarrollen nuevos instrumentos que permitan incorporar otros nuevos indicadores en un futuro.
La VMD es una disciplina compleja porque requiere la colaboración de expertos en diferentes ramas, que deben garantizar el cuidado continuo a domicilio a pacientes crónicos que con frecuencia son graves y dependientes. Los hechos se complican más si tenemos en cuenta que se trata de una disciplina novedosa que se soporta en una evidencia científica limitada y que incluye enfermedades muy diversas.
No sorprendió encontrarnos, en el año 2009, con un escenario estatal con una alarmante variabilidad en la implementación de esta disciplina, que ya fue comentado al detalle por Chiner et al.19 en un artículo publicado en el 2009. Sin embargo, el inicio de la acreditación SEPAR de unidades de ventilación, basadas en una acreditación de perfil check list ha condicionado que se haya generado una estructura sólida y más ordenada.
La idea motriz que en su día impulsó la habilitación de la VMD fue la posibilidad de dejar el hospital manteniendo la calidad de vida en sus propias casas. La aparición de la tecnología necesaria lo hizo factible y, sin duda, también contribuyó la reducción de los elevados costes que suponían estos cuidados facilitados en el medio hospitalario. Por tanto, el objetivo fundamental de esta disciplina es asegurar el cuidado continuo a domicilio centrándose en conseguir calidad de vida y no tanto en reducción de costes.
Lo que pretende este apartado es lanzar algunas reflexiones sobre los criterios básicos de calidad en el tratamiento con VMD. Con fines didácticos seguiremos el modelo de Donabedian49: estructura, proceso y resultado.
- -
Criterios básicos de calidad en la estructura
La dimensión y complejidad de la estructura que debe dar soporte a la VMD depende de muchos factores, pero que se han conseguido estructurar en tres grandes bloques entre los que podríamos destacar tres componentes: 1) el volumen de pacientes; 2) su ubicación dentro del organigrama de un Servicio de Neumología. Salvo excepciones, es muy probable que esta disciplina esté ubicada bajo el paraguas de una Unidad de Sueño. También podría plantearse como una Unidad independiente dentro de un Servicio de Neumología. En todo caso, parece razonable asumir que va a tener que compartir recursos estructurales con el resto del Servicio o con la Unidad de la que dependa; 3) el compromiso docente e investigador.
Es muy importante el espacio físico que disponga el centro, que podrá ir desde una sala de consulta destinada a la atención de pacientes, hasta diferentes habitáculos. Se valorará que el Servicio de neumología disponga de camas propias asignadas. Además, de dotación de sistemas informáticos, bases datos, archivos de documentación y protocolos de actuación.
El centro deberá disponer de una sala de consultas con el material y mobiliario apropiado (mesa de despacho, armarios, sillas, camilla de exploración, software de imágenes radiológicas, ordenador, tensiómetros, fonendoscopios) además de la posibilidad de realizar pulsioximetría nocturna, espirometría e incluso valoración de capnografía trasnscutánea.
Sólo se exige que la actividad esté desarrollada por un Especialista de Neumología con formación en ventilación mecánica domiciliaria. El personal de enfermería y auxiliar puede ser compartido por otras actividades de la Sección o Servicio. En cualquier caso, es evidente la necesidad de disponer de neumólogos y personal de enfermería especializado, que manejen un número suficiente de casos y que demuestren experiencia en el tema. Al igual que debería ocurrir en todas las disciplinas complejas como la que tratamos, convendría habilitar un procedimiento que avalase y garantizase la cualificación del personal dedicado a estas tareas.
Aunque el liderazgo lo ejerza el neumólogo en estrecha colaboración con enfermería, resulta imprescindible trabajar en coordinación con neurólogos, rehabilitadores, asistentes sociales y psicólogos. Tal como está organizada la prestación de las terapias respiratorias en nuestro país debemos considerar a las empresas prestadoras de TRD como socios estratégicos. Su labor debería ir más allá de la importante tarea de garantizar a domicilio en tiempo y calidad la dotación tecnológica necesaria, implicándose con más contundencia en el control integral del paciente. Debe así cambiar el viejo concepto empresarial con aspectos de servidumbre, por el de empresas proveedoras de cuidados de salud, que colaboran estrechamente con los profesionales sanitarios y el entorno social.
Un Servicio de Neumología comprometido con la VMD obliga a disponer de una Unidad de Sueño y un laboratorio de exploración funcional con coordinación suficiente para analizar y dar respuesta a cuantos problemas surjan.
- -
Criterios básicos en la calidad del proceso
Aunque parezca obvio, este apartado trata básicamente de que la manera de cómo organizamos el cuidado de estos pacientes debe sustentarse en dos herramientas genéricas: 1) la gestión por proceso. Se trata de organizar al detalle y cronológicamente los aspectos claves en los que se soporta el cuidado de estos pacientes desde su inclusión hasta su fallecimiento en la mayoría de casos; 2) las bases de datos. Para poder abordar la gestión de la calidad de cualquier proceso es imprescindible registrar sistemáticamente las variables clínicas más interesantes, las relacionadas con la utilización de recursos sanitarios, las económicas, además de los indicadores de calidad que previamente se hayan seleccionado.
La gestión del todo el proceso en su conjunto se debe sustentar en protocolos o guías clínicas50 que garanticen la aplicación de la mejor evidencia científica disponible. La aplicación de esta herramienta en el caso de la VMD debe dejar muy pormenorizado aspectos claves como son el aclaramiento de la vía aérea, especialmente importante en pacientes con enfermedades neuromusculares o con disfunción glótica51,52, la transición del hospital al domicilio y el periodo de adaptación al aparato53,54 y la forma de controlar la cumplimentación o el control evolutivo, entre otros.
La transición del hospital al domicilio es un acto complejo que depende de muchos factores médicos y no médicos55,56 y que debe ser abordado por un equipo interdisciplinario de profesionales de la salud. Una adaptación efectiva y una estrecha vigilancia durante el primer mes resulta esencial para el éxito del programa.
El control evolutivo indefinido, imprescindible en un proceso crónico como este, es laborioso porque exige un liderazgo contundente por parte del neumólogo que debe tener la capacidad de armonizar, controlar y evaluar las visitas en consultas externas con una línea de teléfono «abierta»; la labor de enfermería, incluyendo la atención a domicilio; la actuación de la empresa suministradora supervisando la idoneidad y el mantenimiento de todos los dispositivos, etc. Y lo que es más importante, garantizando la innovación/investigación. Además de coordinarse con neurólogos, rehabilitadores, psicólogos, etc., es imprescindible en un paciente crónico, complejo, multipatológico en ocasiones, como es el caso, habilitar canales de comunicación con el médico de familia responsable de cada caso, que garanticen un trabajo conjunto sustentado en protocolos de actuación consensuada, información detallada y sistemática, así como programas de formación adecuados.
- -
Criterios básicos de calidad en resultados
Para evaluar este apartado, el de los resultados, debemos considerar aspectos básicos que son comunes a cualquier especialidad médica. A modo de ejemplo podríamos abordar los siguientes: aspectos relacionados con la ganancia en salud medido a través de encuestas sobre actividades de la vida diaria, calidad de vida o grado de satisfacción; la supervivencia; aspectos directa o indirectamente relacionados con el coste, que como en el caso del número de atenciones sanitarias no programadas, de los ingresos hospitalarios o de las atenciones en urgencias, también tienen consistencia clínica.
Además de los indicadores básicos y genéricos, deberíamos ser capaces de identificar indicadores de calidad específicos de la VMD que estén vinculados al buen hacer profesional. Seleccionar la información que más nos interese en este sentido es difícil y requiere la colaboración y el consenso de los expertos y, por lo tanto, es un ejercicio no realizado hasta el momento. Recoger de forma sistemática toda esta información resulta muy laborioso y es labor del líder habilitar los recursos pertinentes o por lo menos plantearlo a las autoridades correspondientes.
La tarea no es fácil; sin embargo, conocer los resultados de lo que uno hace es el primer e imprescindible paso para compararse consigo mismo, identificar áreas de mejora, compararse con los mejores; en definitiva, introducirse en lo que se ha denominado «círculos de mejora continua».
Indicaciones de la VMDIndicaciones de ventilación mecánica no invasiva (VMNI) en domicilioLa ventilación mecánica puede definirse como el cambio cíclico de volumen alveolar producido en respuesta a un gradiente de presión, generado por la acción de un ventilador mecánico externo. La aplicación de una presión por encima de la atmosférica en el acceso a la vía aérea, a través de un mecanismo neumático de compresión o a través de un acelerador de flujo, provoca una diferencia entre la presión positiva y la presión alveolar, originando una corriente de flujo hacia el interior de la vía aérea, dando lugar a la inspiración57,58.
La epidemia sufrida por la infección del virus de la polio en los años 50, que afectó a muchos países (Escandinavia, Reino Unido y EE. UU.) dio lugar a una de las primeras indicaciones de tratamiento con VMNI mediante ventiladores de presión negativa (pulmón de acero) y posteriormente a través de otros dispositivos más sencillos, como la coraza, el poncho, etc. Estos dispositivos usaban presión extratorácica negativa como método ventilatorio para la expansión de la caja torácica. Los ventiladores de presión negativa presentan grandes limitaciones e inconvenientes derivados de su tamaño, la imposibilidad de movilidad y provocan efectos adversos, como obstrucción de la vía aérea superior.
En 1984, Delaubier59 y Rideau introdujeron la ventilación a presión positiva intermitente nasal para el tratamiento de los pacientes con distrofia muscular. Desde entonces, la VMNI ha sido usada para el tratamiento del fallo respiratorio agudo y crónico, siendo sus indicaciones ampliadas a otras enfermedades. Su expansión coincide con el uso de las mascarillas nasales y faciales introducidas por Sullivan et al. en el tratamiento del síndrome de apneas-hipopneas del sueño (SAHS), inicialmente modeladas y con posterioridad, con una gran disponibilidad, gracias a los avances en el diseño de nuevos ventiladores portátiles y mascarillas confortables comerciales.
La IRC secundaria a enfermedad neuromuscular y a enfermedad restrictiva de la caja torácica son indicaciones clásicas de ventilación mecánica a largo plazo, ya que ha demostrado mejorar la calidad de vida, aumentar la supervivencia, mejorar el intercambio de gases y conseguir una mayor calidad de sueño en estos pacientes (grado de evidencia A)60.
Los objetivos perseguidos con la VMD a largo plazo son: a) corregir la hipoventilación alveolar en pacientes en situación de IRC hipercápnica; b) disminuir el trabajo de la ventilación y c) mejorar la función de los músculos respiratorios. Así, el incremento de la ventilación alveolar y la obtención de un patrón ventilatorio eficaz durante el período en el que el paciente se encuentra en soporte ventilatorio, explica la corrección de las anomalías del intercambio gaseoso, durante el tiempo en que aquel se mantiene. Por otra parte, la mejoría o la normalización de las cifras de PaCO2 que se observan durante el día es la consecuencia que el soporte ventilatorio puede tener en la función pulmonar, los músculos respiratorios y el control de la ventilación57,61,62.
La afectación de la musculatura respiratoria se produce en la evolución de múltiples enfermedades neuromusculares; en algunos casos, de forma aguda (síndrome de Guillain-Barré, crisis miasténica, fase aguda de la poliomielitis), aunque en la mayoría se presenta de forma progresiva. Para un correcto manejo de las complicaciones respiratorias es importante distinguir las enfermedades rápidamente progresivas, como la esclerosis lateral amiotrófica (ELA), de las de evolución más lenta, como la enfermedad de Duchenne o la distrofia miotónica (Steinert), ya que en las primeras es en las que será más relevante una actuación respiratoria temprana. En la aparición de complicaciones respiratorias se ven implicados tres grupos musculares: musculatura inspiratoria, musculatura espiratoria y musculatura orofaríngea63.
Los mecanismos fisiopatológicos implicados en el desarrollo de insuficiencia respiratoria son diversos y complejos, aunque se pueden resumir en los siguientes: hipoventilación alveolar, tos ineficaz y alteración en la protección de la vía aérea. Fundamentalmente el fracaso diafragmático, secundario a la causa intrínseca de la enfermedad muscular, conduce a un patrón respiratorio con volúmenes corrientes bajos y frecuencia alta (respiración superficial). La debilidad muscular también conduce a cambios en la mecánica del sistema respiratorio con disminución de la compliance pulmonar y de la caja torácica, con el consiguiente aumento en la carga de trabajo y riesgo de fatiga muscular.
Todo ello provoca hipoventilación alveolar, que se manifiesta inicialmente durante la noche, en las fases de sueño REM. Además, hay que considerar las alteraciones en el control central de la ventilación, ya sea por la pérdida de sensibilidad de los quimiorreceptores centrales y periféricos o por lesión directa de los centros respiratorios, como ocurre en la distrofia miotónica (Steinert) o en el déficit de maltasa ácida63.
La hipoventilación nocturna mantenida, las alteraciones en el control de la ventilación y el cambio de patrón respiratorio, finalmente conducirán a la hipoventilación diurna, que habitualmente se desarrolla de forma progresiva, aunque en ocasiones puede aparecer de forma aguda en el contexto de una infección respiratoria, secundaria a la retención de secreciones por tos ineficaz o por broncoaspiración. La tos ineficaz es secundaria fundamentalmente a la debilidad de la musculatura espiratoria (intercostales internos y musculatura abdominal), aunque en esta alteración también participa el resto de los grupos musculares. La alteración de la musculatura orofaríngea, además de contribuir a la tos ineficaz, causará trastornos de la fonación y la deglución, con riesgo de broncoaspiración, que puede llevar a insuficiencia respiratoria aguda63.
Los factores adicionales que han condicionado los avances en la ventilación domiciliaria han sido la mejora en la tecnología, que ha contribuido a facilitar los cuidados médicos tanto del profesional como de sus cuidadores para el manejo de pacientes complejos, además de la aceptación social de las personas con discapacidad, la gestión de la cronicidad y la mejoría en los sistemas organizativos.
En las tablas 1 y 2 se recogen las condiciones médicas en el adulto y en la edad pediátrica, susceptibles de VMNI domiciliaria.
Indicaciones de ventilación mecánica domiciliaria en el adulto
| Enfermedades SNC y neuromusculares |
| Malformación de Arnold-Chiari |
| Traumatismos del sistema nervioso central |
| Enfermedades cerebrovasculares |
| Trastornos congénitos y adquiridos del control respiratorio |
| Mielomeningocele |
| Traumatismos de la médula espinal |
| Esclerosis lateral amiotrófica |
| Síndrome de Guillain-Barré |
| Parálisis del nervio frénico |
| Poliomielitis y síndrome pospolio |
| Atrofia espinal |
| Distrofia muscular de Duchenne |
| Distrofia miotónica de Steinert |
| Otras distrofias musculares |
| Miastenia gravis |
| Deformidades de la caja torácica |
| Toracoplastia |
| Cifoscoliosis |
| Trastornos musculoesqueléticos secundarios |
| Síndrome de obesidad-hipoventilación |
| Enfermedades obstructivas de las vías aéreas inferiores |
| Displasia broncopulmonar |
| EPOC |
| Fibrosis quística |
| Otras |
| Trastornos de la vía aérea superior |
| Síndrome de Pierre-Robin |
| Traqueomalacia |
| Parálisis de cuerdas vocales |
Enfermedades susceptibles de ventilación mecánica domiciliaria en la edad pediátrica
| Displasia broncopulmonar |
| Trastornos restrictivos del parénquima pulmonar |
| Anomalías de la caja torácica |
| Enfermedades de motoneurona |
| Miopatías primarias (p. ej., enfermedad de Duchenne) |
| Trastornos de la médula espinal |
| Síndromes de hipoventilación alveolar congénita |
| Síndrome de hipoventilación alveolar adquirida (p. ej., tumores o hemorragia del troncoencéfalo) |
| Mielomeningocele |
| Trastornos del desarrollo o del control neurológico de los centros respiratorios (p. ej., apnea del prematuro) |
A continuación, señalamos las enfermedades más frecuentes en la práctica clínica, con las recomendaciones establecidas a la luz de la evidencia.
- -
Enfermedades neuromusculares
Esclerosis lateral amiotrófica (ELA)
En el momento actual, en pacientes con ELA, el beneficio en cuanto a supervivencia es modesto en comparación con otros diagnósticos para los cuales se recomienda VMD, ya que la mayoría de los estudios publicados son de cohortes observacionales64,65. No obstante, estos han obtenido mejoría, o no deterioro, en la calidad de vida, principalmente en las dimensiones de cansancio y somnolencia. La VMNI debe considerarse la opción preferente incluso cuando se requiere ventilación 24 h al día. Puede considerarse la ventilación por traqueostomía de forma electiva, en función de los recursos disponibles y un cuidadoso planteamiento con el paciente y sus cuidadores (grado de recomendación 1C)50.
Distrofia muscular de Duchenne
La distrofia muscular de Duchenne se produce en aproximadamente uno de cada 3.500 varones nacidos vivos y es causada por mutaciones en el gen de la distrofina, y conduce a la necrosis generalizada de fibras musculares, junto con fibrosis e infiltración de células grasas del sistema músculo-esquelético, incluyendo los músculos respiratorios. Cuando la capacidad vital (CV) cae a < 40% del valor predicho, los pacientes tienen riesgo significativo para el desarrollo de hipercapnia nocturna. La evidencia disponible sugiere que una vez que aparece hipercapnia diurna, se reduce la calidad de vida y el riesgo de mortalidad en el plazo de un año es alto sin apoyo ventilatorio66. En estas condiciones, la VMNI nocturna puede ser eficaz para mejorar los síntomas y reducir el grado de hipercapnia diurna en respiración espontánea. El fracaso para corregir la hipoventilación nocturna aislada (PtCO2 equivalente a > 50 mmHg), incluso en pacientes asintomáticos, es un indicador de deterioro a corto plazo. Se debe ofrecer VMNI nocturna a los pacientes con hipercapnia diurna (PCO2 arterial diurna > 45 mmHg), o cuando hay hipercapnia nocturna documentada y síntomas compatibles con hipoventilación (grado de recomendación 1B). Se debe iniciar VMNI durante el sueño a los pacientes que muestran un importante grado de hipoxemia nocturna, aunque sea asintomática (grado de recomendación 2C). Cuando se emplee binivel, se recomienda una frecuencia de rescate durante la VMNI nocturna, para reducir el trabajo respiratorio (grado de recomendación 1C). Se debe individualizar la decisión acerca de la transición de la VMNI nocturna a diurna mediante la evaluación cuidadosa del paciente, los factores asociados (síntomas, afectación bulbar, preferencia del paciente, etc.) y la disponibilidad de recursos. En los pacientes que requieren ventilación diurna se debe considerar la posibilidad de ventilación con pieza bucal como alternativa a la traqueostomía (grado de recomendación 1B)50.
Distrofia miotónica
La distrofia miotónica (DM) (también conocida como enfermedad o DM de Steinert) es un trastorno autosómico dominante, resultado de una inestabilidad del gen de la miotoninquinasa. Es la más frecuente de inicio en el adulto y tiene una prevalencia mundial de 14 por cada 100.000 habitantes. La hipoventilación en la DM puede estar relacionada con la debilidad de los músculos respiratorios, la obstrucción de la vía aérea superior, la disminución de la compliance torácica o, en algunos pacientes, debido a una reducción de la respuesta al CO267. La VMD a largo plazo debe ser ofrecida a pacientes con hipercapnia o hipoventilación nocturna sintomática como en otras enfermedades neuromusculares (grado de recomendación 1C), aunque se debe evaluar cuidadosamente la motivación y la adherencia con pacientes y cuidadores antes de iniciarla, debido a las altas tasas de abandono en estos pacientes50.
Otras miopatías
Otras miopatías y distrofias musculares representan un gran grupo de enfermedades con diferentes modos de herencia y distintas características clínicas. Muchas de ellas se complican con insuficiencia respiratoria y muerte57,58. Las causas de la insuficiencia respiratoria incluyen debilidad de la musculatura respiratoria, junto con debilidad en las extremidades, pudiendo afectar selectivamente al diafragma, como en la distrofia facioescapulohumeral o en la deficiencia de maltasa68,69.
Pueden asociarse dismorfias del sistema esquelético como pectus excavatum y cifoescoliosis, así como alteraciones de la orden central, contribuyendo así a la hipoventilación alveolar, como en la distrofia miotónica. Algunas enfermedades pueden asociar afectación pulmonar intersticial como en las miopatías inflamatorias (polimiositis y dermatomiositis). Existen pocos estudios que hayan analizado el soporte ventilatorio a largo plazo en este tipo de miopatías, ya que a menudo se incluyen con otras enfermedades neuromusculares y trastornos de la pared torácica, representando una pequeña fracción del global.
Basados sobre las recomendaciones existentes en otras enfermedades neuromusculares, la VMNI domiciliaria se recomienda cuando hay hipercapnia, síntomas durante el día y signos de hipoventilación nocturna. La medida de la función pulmonar y el seguimiento por parte del especialista debe ser por lo menos cada seis meses, pero individualizando en función de la progresión de la enfermedad (grado de recomendación 1C)50.
- -
Enfermedades de la caja torácica
Cifoscoliosis
La cifoscoliosis es una causa bien conocida de insuficiencia respiratoria y su causa más común es la idiopática, que comienza en la infancia, aunque puede ser secundaria a otros trastornos que incluyen enfermedades neuromusculares, enfermedades de la columna vertebral, anormalidades del tejido conectivo y las secuelas de la toracoplastia. El grado de deformidad de la columna torácica es el factor de riesgo más importante para la aparición de insuficiencia respiratoria, ya que los pacientes no tratados quirúrgicamente, con una VC < 45% del predicho y un ángulo de Cobb > 110% presentan especial riesgo. Este riesgo es más elevado si coexisten otras enfermedades. Una vez que se desarrolla insuficiencia respiratoria o cor pulmonale, la esperanza de vida con terapia conservadora es pobre, ya que hasta 50% de los pacientes no tratados fallecerán en el plazo de uno a dos años si no se inicia la asistencia respiratoria57,58,70.
En los pacientes con cifoscoliosis debe realizarse periódicamente una espirometría, y si la CV es < 50%, debe evaluarse la presencia de hipercapnia, debiendo iniciar VMNI (grado de recomendación 1C). La VMNI nocturna se debe ofrecer a todos los pacientes con cifoscoliosis que han desarrollado fallo respiratorio hipercápnico (grado de recomendación 1B). Los pacientes con hipoxemia pero sin hipercapnia pueden ser manejados con precaución con oxigenoterapia mientras se monitoriza la aparición de hipercapnia (grado de recomendación 1C)50.
- -
Síndromes de hipoventilación
Síndrome de hipoventilación-obesidad
El SHO se define como la coexistencia de obesidad (índice de masa corporal > 30 kg/m2), hipercapnia diurna (PaCO2 > 45 mmHg), en ausencia de otras causas de hipoventilación. La mayoría de los pacientes con SHO (80-90%) también presentan SAHS, mientras que la hipoventilación sin SAHS asociado es menos frecuente. A la vista de los estudios recientemente publicados71, la presión positiva continua en las vías respiratorias (continuous positive airway pressure, CPAP) vía nasal sería el tratamiento de elección para los pacientes con SHO y SAHS grave asociado (>30 apneas-hipopneas/hora), reservando la VMNI para aquellos casos con fallo respiratorio no controlado, pacientes con ingresos por descompensación del fallo respiratorio y aquellos pacientes con SHO sin SAHS grave asociado (grado de recomendación 1A). En estos casos, la polisomnografía es útil para valorar y confirmar la eficacia de presiones binivel (grado de recomendación 1C)50.
Hipoventilación alveolar central congénita
Los pacientes con hipoventilación alveolar central congénita que requieren soporte ventilatorio solo de manera nocturna pueden ser mantenidos con VMNI con una frecuencia de rescate o mediante marcapasos diafragmático (grado de recomendación 1C). Los casos graves, principalmente congénitos, requieren ventilación invasiva, pero la estimulación diafragmática diurna puede mejorar notablemente la movilidad y ser transferidos a ventilación no invasiva (grado de recomendación 1C)50.
- -
EPOC
Durante años se ha considerado que no había evidencia suficiente para generalizar la indicación de VMNI en los pacientes con EPOC e hipercapnia, a pesar de constituir una de las indicaciones más frecuentes de VMD a largo plazo. Los estudios publicados mostraban resultados contradictorios o negativos. En este sentido, el metanálisis de Struik et al., publicado en 2013, centrado en pacientes con EPOC estables, hipercápnicos, que recibieron VMD durante al menos tres meses, no mostró ningún efecto, clínica o estadísticamente significativo, sobre el intercambio gaseoso, la tolerancia al ejercicio, la calidad de vida, la función pulmonar, la fuerza muscular respiratoria o la eficiencia del sueño; aunque los autores concluyeron que el pequeño tamaño muestral de estos estudios no permitía extraer consecuencias al respecto68.
Tras la introducción de la ventilación de alta intensidad, la discusión sobre la VMD en EPOC hipercápnicos ha cambiado significativamente. Basado en los resultados positivos encontrados por Meecham-Jones et al.69, empleando presiones inspiratorias más altas que en los estudios negativos, se postuló que para tener buenos resultados era necesario asegurar una buena ventilación alveolar. En este sentido, el grupo de Windisch comenzó a ventilar pacientes EPOC hipercápnicos con una nueva estrategia ventilatoria, usando altas presiones inspiratorias y una frecuencia respiratoria elevada. Los primeros resultados, procedentes de una cohorte retrospectiva, mostraron una mejoría del intercambio de gases, de la función pulmonar y de la calidad de vida relacionada en salud (CVRS)67,72.
Posteriormente, realizaron un ensayo aleatorizado, cruzado, en el que demostraron que la ventilación de «alta intensidad», término acuñado para esta estrategia ventilatoria, mejoraba el intercambio de gases y la CVRS en comparación con la VMNI tradicional o de «baja intensidad» utilizada habitualmente en estudios anteriores73. Demostraron que el cumplimiento y la calidad del sueño no eran peores con la ventilación de alta intensidad e incluso mostraron que podría ser mejor en comparación con la VMNI tradicional74,75. En 2014, Köhlein et al.76 analizaron el papel de la VMNI de alta intensidad en pacientes con EPOC GOLD IV hipercápnicos (PCO2 >51.9 mmHg). Para ello diseñaron un estudio prospectivo, multicéntrico, aleatorizado y controlado, donde la VMNI se ajustó para conseguir reducir la PCO2 al menos un 20% o hasta alcanzar valores inferiores a 48.1 mmHg. La duración del estudio fue de 12 meses y la variable principal fue la mortalidad por todas las causas al año. Los resultados se analizaron por intención de tratar. Participaron 36 hospitales y se reclutaron 195 pacientes, 102 en el grupo VMNI y 93 en el grupo control. La mortalidad por todas las causas al año fue del 12% en el grupo VMNI y del 33% en el grupo control. Los autores concluyeron que la VNI a largo plazo, en pacientes con EPOC estables hipercápnicos, mejora la supervivencia cuando se aplica con el objetivo de reducir la cifra de PCO2.
Otra aproximación al papel de la VMNI a largo plazo, en pacientes con EPOC, se centra en su indicación en aquellos pacientes que han sufrido una exacerbación con acidosis respiratoria y han precisado VMNI durante la agudización. El estudio de Struik et al.77 encontraron resultados negativos en pacientes que se mantenían hipercápnicos a las 48 horas de haber retirado el soporte respiratorio utilizado durante la agudización. No hubo diferencias en cuanto al tiempo hasta el reingreso o muerte al año, aunque encontraron mejoría de la PCO2 diurna y de la presión transcutánea de CO2 nocturna, así como una tendencia a la mejoría de la CVRS relacionada con el uso de VMNI.
Más recientemente, Murphy et al.78 diseñaron un estudio aleatorizado en pacientes con hipercapnia persistente (PCO2 > 53 mmHg) a las 2-4 semanas de haber sufrido una exacerbación con acidosis respiratoria. Excluyeron a los pacientes con IMC > 35 y aquellos con síndrome de apnea del sueño o con otras causas responsables del fallo respiratorio. El grupo control (59 pacientes) recibió tratamiento con oxigenoterapia domiciliaria (flujo medio de O2: 1 L/min), mientras que el grupo experimental (57 pacientes) recibió tratamiento con VMNI y oxigenoterapia (flujo medio de O2: 1 L/min). La IPAP media empleada fue de 24 cm H20 (22-26), la EPAP media fue de 4 cm H20 (4-5) y la frecuencia respiratoria de rescate fue de 14 rpm (14-16). De los 116 pacientes analizados, 64 (28 grupo control y 34 grupo VMNI), finalizaron 12 meses de seguimiento. El tiempo medio hasta reingreso o muerte fue de 4,3 meses en el grupo VMNI frente a 1,4 meses en el grupo control (HR 0,49 (95% CI, 0,31-0,77; P = 0,002). El riesgo de reingreso o muerte a los 12 meses fue de 63,4% en el grupo VMNI frente a 80,4% en el grupo control, con una reducción absoluta del riesgo del 17% (95% CI, 0,1%-34,0%). Estos resultados nos muestran que en pacientes EPOC con hipercapnia persistente tras una exacerbación aguda, añadir VMNI a la oxigenoterapia domiciliaria, prolonga el tiempo hasta el reingreso hospitalario o muerte.
A la luz de la evidencia disponible, se recomienda la VMNI de alta intensidad a largo plazo en los pacientes con EPOC estable hipercápnicos (grado de recomendación 2A) o en aquellos que se mantienen hipercápnicos a las 2-4 semanas tras un episodio de insuficiencia respiratoria hipercápnica que requiere soporte ventilatorio hospitalario (grado de recomendación 2A).
El síndrome overlap y el SHO se deben diferenciar de la IRC atribuible únicamente a la EPOC avanzada (grado de recomendación 1C) (tabla 3).
Niveles de evidencia en la patología médica más frecuente, susceptible de ventilación mecánica domiciliaria
| Patología | Nivel de evidencia |
|---|---|
| Esclerosis lateral amiotrófica (ELA) | 1B (ortopnea, hipercapnia diurna) |
| 1C (trastorno de sueño sintomático, FVC < 50%, sniff test < 40 cmH2O o PI máx.< 40 cmH2O). | |
| Enf. Duchenne | 1B (PCO2 diurna > 45 mmHg, hipercapnia nocturna junto con síntomas de hipoventilación) |
| 2C (hipoxemia nocturna, aun asintomática) | |
| Distrofia miotónica | 1C (hipercapnia nocturna junto con síntomas de hipoventilación) |
| Otras miopatías | 1C (hipercapnia nocturna junto con síntomas de hipoventilación) |
| Cifoscoliosis | 1C (FVC < 50%, hipercapnia diurna) |
| 1B (evidencia de un episodio de insuficiencia respiratoria hipercápnica) | |
| S. Hipoventilación-obesidad | 1A (CPAP es el tratamiento de elección en pacientes con SHO y SAHS grave asociado) |
| 1cA (VMNI es el tratamiento de elección de pacientes con SHO puro, con SAHS leve asociado o con SAHS grave con agudizaciones o fallo respiratorio no controlado) | |
| S. Hipoventilación alveolar central congénita | 1C (VMNI en pacientes que requieren solo apoyo nocturno, con frecuencia de rescate o MP diafragmático, VM invasiva en los más graves) |
| EPOC | 2A (VMNI de alta intensidad recomendada en pacientes con EPOC estables hipercápnicos) |
| 2A (VMNI de alta intensidad en pacientes que se mantienen hipercápnicos a las 2-4 semanas tras un episodio de insuficiencia respiratoria hipercápnica que requiere soporte ventilatorio hospitalario) |
Significado:
- 1.
A) Recomendación fuerte, evidencia de alta calidad (ensayos clínicos aleatorizados sin limitaciones importantes o estudios observacionales de evidencia abrumadora).
- 1.
B) Recomendación fuerte, evidencia de calidad moderada (ensayos clínicos aleatorizados con limitaciones importantes: resultados inconsistentes, fallos metodológicos, indirectos o imprecisos) o estudios observacionales excepcionalmente de fuerte evidencia.
- 1.
C) Recomendación fuerte, procedente de estudios de baja calidad o de baja calidad de evidencia (estudios observacionales o series de casos).
- 2.
A) Recomendación débil, evidencia de alta calidad (ensayos clínicos aleatorizados sin limitaciones importantes o estudios observacionales de evidencia abrumadora).
- 2.
B) Recomendación débil, calidad moderada (ensayos clínicos aleatorizados con limitaciones importantes (resultados inconsistentes, fallos metodológicos, conclusiones indirectas o imprecisos) o excepcionalmente fuerte evidencia de estudios observacionales.
- 2.
C) Recomendación de baja calidad o evidencia de muy baja calidad (estudios observacionales o series de casos).
La VMNI permite mantener un adecuado intercambio gaseoso en la mayoría de los pacientes que requieren soporte ventilatorio. En pacientes con enfermedades neuromusculares progresivas y afectación bulbar y en aquellos con otras enfermedades en las que el acceso no invasivo es ineficaz, la realización de una traqueostomía es la única alternativa para mantener la ventilación a largo plazo60,79-81.
El consentimiento informado en estos casos es esencial y es necesario siempre respetar las voluntades anticipadas del paciente, por lo que deberían obtenerse antes de que la afección bulbar sea grave. En nuestro país su respaldo jurídico se encuentra expresado mediante la ley 41/2002 reguladora de la autonomía del paciente, que argumenta que los pacientes pueden ejercer siempre su autonomía moral y tomar las decisiones que estimen convenientes respecto a su cuerpo o su salud82. En el Appendix B se presenta un modelo de voluntades anticipadas.
La ventilación mecánica a través de traqueostomía en domicilio (VMTD) puede prolongar la supervivencia en algunas enfermedades neuromusculares y es el procedimiento de elección para los enfermos que desean seguir viviendo cuando las ayudas no invasivas resultan inadecuadas (tabla 4). No suele haber dilemas en el caso de pacientes con distrofia muscular, más de 12 horas de uso de VMNI y cierto grado de autonomía vital. Sin embargo, en el caso de enfermedades rápidamente progresivas la toma de decisiones debe ser individualizada debido a la posibilidad de presentarse situaciones no deseadas como el síndrome de «enclaustramiento» (locked-in) sin olvidar la elevada sobrecarga tanto para la familia como para el sistema sanitario. Cuando contemplamos la posibilidad de recomendar a un paciente la VMTD, es necesario tener en cuenta otros factores adicionales a los propiamente técnicos. Es importante saber quién se va a hacer cargo de los cuidados en domicilio y si disponemos de un equipo multidisciplinario para garantizar el manejo de la traqueotomía en un entorno de seguridad para el paciente. La decisión de realizar VMTD debe ser fruto de un proceso en el que de forma conjunta participen paciente y familia, junto con su equipo sanitario multidisciplinario que le atiende, resolviendo con la antelación suficiente todas las dudas e incertidumbres que aparezcan. El resultado final de tal decisión será la voluntad del paciente respecto a aceptar ventilación mecánica invasiva por traqueotomía, y es una decisión PERSONAL e INTRANSFERIBLE que va a estar influenciada por muchos factores, individuales de la persona afectada, con sus características propias y sus circunstancias, de la fase evolutiva de su enfermedad y de su entorno socio-familiar siendo el factor económico otro a tener en cuenta.
Indicaciones de traqueostomía en pacientes que requieren ventilación mecánica domiciliaria
| Ventilación mecánica no invasiva ineficaz |
| Afectación bulbar intensa (p. ej., ELA) |
| Progresión enfermedad de base |
| Requerimientos de ventilación más de 12 horas (p. ej., tetrapléjicos) |
| Patología neurológica grave (Guillain-Barré, coma profundo) |
| Necesidad de proteger la vía aérea |
| Secreciones copiosas |
| Aspiraciones de repetición |
| Compromiso mecánico |
| Parálisis cuerdas vocales bilateral |
| Patología traqueal (malacia, granulomas, malformaciones) |
| Estenosis laríngea o subglótica |
| Intubación orotraqueal prolongada |
| Deseo expreso del paciente de prolongar la supervivencia |
Los objetivos de la VMTD son: mantener y prolongar la vida, mejorar la calidad de vida, reducir la morbilidad y mejorar y mantener las funciones físicas y psicológicas, favoreciendo el crecimiento y desarrollo del paciente en los casos pediátricos80.
Denominamos ventilación de soporte vital a la que se utiliza en los pacientes que no pueden prescindir del respirador. Si bien puede realizarse por vía no invasiva, habitualmente requiere la realización de traqueostomía. La traqueostomía es una vía artificial e invasiva de acceso a la vía aérea que puede mantenerse durante un largo periodo de tiempo y permite no solo proporcionar una ventilación adecuada, sino también el acceso directo a las secreciones respiratorias. En este sentido las cánulas de traqueostomía deben ser bien toleradas, no interferir en el habla y en la deglución si aún están conservadas y lesionar lo menos posible la mucosa traqueal60,79-81.
Equipos y sistemas de administración y accesoriosCondiciones técnicas de los equipos de VMDTodos los equipos deberán cumplir los requisitos establecidos en el Real Decreto 1591/2009, de 16 de octubre, la normativa internacional de seguridad para aparatos eléctricos de uso médico (IEC-601-1), así como la normativa legal local, autonómica y estatal vigente en cada momento. Esto incluye la directiva 93/42/CEE del Consejo de las Comunidades Europeas.
Desde el punto de vista técnico, la fabricación de los dispositivos de VMD ha evolucionado desde los primitivos ventiladores que únicamente podían funcionar en una única modalidad, a los modernos y mucho más versátiles que permiten diversos modos ventilatorios y de configuración de fungible en un único dispositivo. Así pues, el clínico debería poder escoger entre diferentes modalidades y configuraciones que se detallan a continuación:
- -
Ventilación asistido-controlada limitada por flujo (volumen)
Proporciona un volumen programado y fijo durante la fase inspiratoria, también llamado volumen corriente. Idealmente, deberían estar dotados de los siguientes requisitos:
Posibilidad de funcionar con corriente 125/220 voltios alterna, y posibilidad de conexión a sistema de batería externa, batería interna con un mínimo de 4 a 6 horas de autonomía.
- •
Deben poder facilitar volúmenes por minuto elevados, ya que en muchos casos de ventilación no invasiva es necesario utilizar volúmenes corrientes superiores a los de los pacientes intubados. Para pacientes pediátricos deben poder administrar de forma estable volúmenes corrientes mínimos de 50 mL.
- •
Es necesario que dispongan de los mecanismos necesarios para añadir oxígeno, bien en el mismo aparato en forma de mezclador interno, bien a lo largo de la tubuladura o de la interfase. En caso de añadir oxígeno al mismo aparato, deberían incorporar sensores de medida de fracción inspirada de oxígeno (FiO2).
- •
Los parámetros ajustables obligatorios serían los siguientes: volumen corriente, frecuencia respiratoria, perfil de la curva de flujo (desacelerada constante), tiempo inspiratorio (o en su defecto relación inspiración/espiración) y sensibilidad del trigger.
- •
Se debe poder añadir una presión positiva espiratoria final (PEEP) e incorporar la posibilidad de respiraciones manuales a demanda y/o suspiros.
- •
Alarmas independientes de fuentes externas de suministro eléctrico, de descarga de la batería interna, alarmas de alta y baja presión, así como indicadores de activación de la inspiración por parte del paciente y de alimentación (red eléctrica, batería externa e interna).
- •
El peso y el tamaño del ventilador deben permitir el transporte del aparato y la movilidad del paciente.
- •
En pacientes pediátricos deben haber demostrado efectividad clínica (sensibilidad) del trigger inspiratorio en lactantes de 5 kg de peso.
- •
De forma generalizada, deberían disponer de algún sistema que permita obtener información estructurada en forma de informe pre-configurado de cómo utiliza el paciente el ventilador (información sobre las horas de uso, las fugas, el volumen minuto ventilatorio, etc.) mediante el acceso a los datos almacenados en su memoria interna o sistemas de transmisión de datos a distancia. Idealmente, la información debería contener la posibilidad de acceso a las curvas de presión y flujo/tiempo respiración a respiración.
Ventilación limitada por presión y sus variantes (sistemas de control dual, presión espiratoria automática)
Modalidad que mantiene una presión positiva prefijada en la vía aérea del paciente en dos niveles seleccionados en el dispositivo, uno de presión positiva inspiratoria (IPAP) y el segundo de espiratoria (EPAP). La diferencia entre ambos valores se conoce como presión de soporte (PS). Existen, además, de forma opcional, sistemas más complejos que responden de manera automática ante interacciones no deseadas del ventilador con el paciente mediante algoritmos desarrollados por los fabricantes, si bien es importante destacar que el beneficio clínico de tales sistemas o el tipo de pacientes que se benefician de su aplicación está aún por demostrar. Los dos sistemas más utilizados son:
- a)
Los sistemas de volumen asegurado. De forma genérica, son sistemas limitados por presión pero que responden a la entrega de un volumen corriente inferior al deseado con los parámetros seleccionados. Dicho volumen corriente debe por tanto programarse también en el ventilador, además de los niveles de presión inspiratoria y espiratoria anteriormente citados. La respuesta ante dicho evento puede ser a su vez de dos tipos:
- -
Incrementos de presión soporte (PS) con respecto a la programada inicialmente en los ciclos posteriores a la detección del descenso de volumen corriente (o volumen minuto en determinados fabricantes). Así pues, deben programarse también unos valores máximos y mínimos de IPAP o PS entre los cuales actuará el algoritmo en función del volumen corriente estimado entregado al paciente. Genéricamente se conocen como sistemas inter-respiración (interbreath).
- -
Cambios de variable limitante en el mismo ciclo, en otras palabras, paso de ventilación limitada por presión a ventilación volumétrica a flujo constante. Genéricamente se conocen como sistemas intrarrespiración (intrabreath) y son mucho menos utilizados que los anteriores por la tendencia natural de estos sistemas a prolongar excesivamente el tiempo inspiratorio.
- b)
Los sistemas de presión espiratoria variable. Responden principalmente a obstrucciones de vía aérea superior, incrementando el valor de presión espiratoria de manera análoga a como lo hacen los sistemas de CPAP automática.
Las características técnicas de los ventiladores que incorporen modos de presión serían las siguientes.
- •
Posibilidad de funcionar con corriente 125/220 voltios alterna, posibilidad de conexión a sistema de batería externa, batería interna con un mínimo de 2 horas de autonomía.
- •
Rango de presiones hasta 30 cm de presión, ajustables, a intervalos de 0,5 cmH2O y con fluctuación dinámica de la presión menor de 1 cm de agua.
- •
Capacidad de funcionamiento en modalidades de presión soporte (ciclada por flujo) y presión control (ciclada por tiempo).
- •
Posibilidad de modificación del tiempo de presurización (rampa de presurización o Rise time).
- •
Posibilidad de introducir una frecuencia respiratoria de seguridad.
- •
Trigger ajustable.
- •
Posibilidad de ajustar tiempo inspiratorio mínimo y máximo como criterios de ciclado de seguridad en modalidad de presión de soporte.
- •
En caso de disponer de modo regulado por presión con volumen asegurado interbreath (entre respiraciones), posibilidad de delimitar un nivel de presión inspiratoria máximo/mínimo.
- •
En caso de disponer de modo regulado por presión con volumen asegurado intrabreath (dentro de la misma respiración), posibilidad de delimitar un tiempo inspiratorio máximo.
- •
En caso de disponer de modo con EPAP automática, posibilidad de delimitar valores máximos y mínimos de EPAP.
- •
Capacidad de compensación de fugas (superior a 100 L/min).
- •
Alarmas independientes de fuentes externas de suministro eléctrico que avisen de desconexión del paciente (presión mínima) o fuga muy importante, de fallo de funcionamiento, de desconexión o corte del suministro eléctrico, de descarga de la batería interna; con indicador de activación de la parte del paciente e indicador de conexión a batería externa e interna.
- •
De forma generalizada deberían disponer de algún sistema que permita obtener información estructurada en forma de informe pre-configurado de cómo utiliza el paciente el ventilador (información sobre las horas de uso, las fugas, el volumen minuto ventilatorio, etc.) mediante el acceso a los datos almacenados en su memoria interna o sistemas de transmisión de datos a distancia. Idealmente, la información debería contener la posibilidad de acceso a las curvas de presión y flujo/tiempo respiración a respiración.
Accesorios (material fungible)
Se incluirán los accesorios que se especifican a continuación, en la cantidad necesaria para la correcta prestación del servicio y según indique el facultativo en su prescripción:
- •
Sistema de filtros que aseguren la calidad de aire que llega al paciente (como mínimo antibacteriano, de polen y polvo).
- •
Sistemas antirreinhalación (antirebreathing), en función de la configuración de tubuladuras usada. En casos de tubuladura doble no debe incorporarse válvula espiratoria. En casos de tubuladura simple puede optarse por un sistema de fuga controlada (intencional) que puede ir incorporado a la mascarilla o ser un accesorio externo o por un sistema de válvula neumática (activa) colocado entre la interfase y la tubuladura. Dicha tubuladura deberá ser anticolapsable, de baja distensibilidad para minimizar el volumen compresible y tendrá una longitud estándar de 2 metros y un diámetro de 15 a 22 mm.
- •
En caso de ventilación no invasiva, es deseable una variedad de interfases (nasales, nasobucales, faciales totales, pieza bucal, etc.) de diferentes medidas y modelos de fabricantes. Asimismo, deberá proporcionarse un sistema de sujeción adecuado de la interfase para cada modelo
- •
Banda submentoniana en caso de necesidad.
- •
Posibilidad de añadir humidificador térmico.
- •
Piezas conectoras para oxígeno en caso de no incorporar mezclador interno.
- •
Ventilador apropiado a la patología y acceso a la vía aérea, con las características detalladas en el apartado anterior y el material fungible pertinente.
- •
En los pacientes con ventilación de soporte vital (24 h) por traqueostomía, se recomienda instalar dos respiradores en domicilio y disponer de un resucitador manual (Ambu®).
- •
Ante la posibilidad de desconexiones accidentales o de averías del sistema, es imprescindible disponer de alarmas efectivas para evitar episodios graves o fatales (alarma de baja presión o bajo volumen exhalado y alarma de alta presión). Puede ser necesaria disponer de una alarma secundaria basada en variables biológicas tales como la medición de la saturación de la oxihemoglobina por pulsioximetría. Las alarmas deben ser audibles en todas las zonas del hogar.
- •
Batería auxiliar para el respirador, si existe dependencia absoluta de ventilación (soporte vital o 24 h), para que actúe en caso de corte de energía eléctrica y para ofrecer un mayor grado de autonomía y movilidad al paciente.
- •
Aspirador de secreciones con dispositivo de regulación de la presión de aspiración. Sondas de aspiración (se recomiendan de tres a seis unidades/día).
- •
Otros equipos: en pacientes seleccionados se debería complementar la VMD con otras prestaciones complementarias y/o adicionales, mismas que deberán ser reguladas específicamente de manera independiente según las necesidades de cada caso.
- -
Humidificador activo si se precisa.
- -
Intercambiador de humedad y calor (se recomienda 1 unidad/día) entre la cánula y la tubuladura.
- -
Dispositivo de aerosolterapia con sistema de adaptación a traqueostomía.
- -
Dispositivos suministradores de oxígeno acoplables al ventilador.
- -
Asistente mecánico a la tos.
- •
Otras prestaciones complementarias ajenas a las TRD (sillas de ruedas adaptadas al respirador, camas articuladas para el adecuado descanso del paciente, grúas para su movilización).
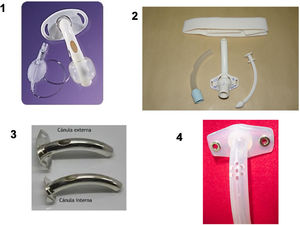
Interfases en ventilación por traqueostomía: cánulas
Las cánulas de traqueostomía pueden ser de diversos materiales (metálicas, plástico o silicona), con y sin neumotaponamiento o balón y, a su vez, con y sin fenestración (tabla 5). Tanto en unas como en otras lo recomendable es que dispongan de cánula interna extraíble fácilmente para limpiar y evitar la necesidad de retirar toda la cánula en caso de obstrucción por un tapón mucoso. Las cánulas fenestradas están indicadas para facilitar la fonación en aquellos pacientes con ventilación mecánica a tiempo parcial; en estos casos durante los periodos libres de ventilación se colocará la cánula interna fenestrada, se deshinchará el balón si lo lleva, y se colocará un tapón o un filtro a boca de cánula84-86.
Cánulas de traqueostomía según el material de fabricación y sus propiedades
| Plástico:Polivinilo o PVC | Las más utilizadasDesechables | Con balón: evita el desprendimiento accidental y la broncoaspiración.Sin balón: mínimo riesgo de lesión traquealPermite el paso del aire alrededor de la cánula | No fenestradasFenestradasCon/sin balón |
| Silicona | DesechablesAjustan mejor a tráquea | Es el material más suave y adaptado a la mucosaCaras | Con/sin balón |
| Metálicas:de acero inoxidable o de plata | Pacientes con traqueostomía permanente que no necesitan ventilación | Menos reacciones alérgicas y cutáneasMejor toleranciaReutilizables | |
| Fonatorias | DesechablesPermiten la fonación | Caras |
La elección del tipo de cánula dependerá de las características del paciente. Por defecto, y a fin de evitar lesiones por decúbito ocasionadas por el neumotaponamiento, es preferible realizar la ventilación domiciliaria con cánulas sin balón, siempre y cuando el grado de afectación bulbar y las características del paciente lo permitan. Entre los principales inconvenientes está el hecho de favorecer las fugas. Por el contrario, el uso de cánulas sin balón puede facilitar la fonación en pacientes portadores de VMTD las 24 h si mantienen una correcta función bulbar. En cuanto al modo, aunque suelen preferirse los volumétricos, no existe contraindicación para utilizar modalidades de presión.
En aquellos casos en que la ventilación a través de una cánula sin balón resulte inefectiva o las fugas aéreas hacia la vía aérea superior generan gran incomodidad en el paciente, las diferentes alternativas que se proponen son: cambio a una cánula de mayor diámetro, ventilación a través de cánula con balón deshinchado o como último recurso, ventilación con cánula con balón parcial o totalmente hinchado87. El uso de cánulas fenestradas, aunque fue muy popular hace algún tiempo, ha tendido a caer en desuso por la tendencia a desarrollar granulomas en la zona de la fenestración88.
Tras la realización de la traqueostomía, el primer cambio de cánula no se debe realizar hasta pasados 7-10 días, tiempo necesario para la consolidación del estoma. En los pacientes con VMTD no existen datos objetivos relativos a la periodicidad del cambio de las cánulas. No obstante, con el objetivo de reducir el riesgo de infección de la vía aérea, disminuir el riesgo de formación de granulomas y disminuir el riesgo de oclusión por secreciones adheridas a la cánula, la experiencia clínica sugiere cambiarlas cada 1 y 2 meses aproximadamente. Las cánulas internas se esterilizarán sumergiéndolas en productos de limpieza para material que contenga clorhexidina u otro tipo de antiséptico. Es aconsejable, antes de introducir las cánulas en el recipiente para esterilización, su lavado con agua corriente y mediante un cepillo para desprender las secreciones que queden adheridas a la pared interna de la cánula87.
Por último, es importante no olvidar la limpieza y desinfección diaria del estoma, además de la colocación de unas gasas limpias alrededor del estoma para evitar que la posible salida de secreciones macere e irrite la piel, evitando en la medida de lo posible el empleo de apósitos que favorezcan la humedad alrededor del estoma. El sistema de sujeción de la cánula también debe ser cambiado con la periodicidad necesaria, incluso diaria si fuera preciso (fig. 1).
Servicio de la prestación en el domicilio. Papel de la empresa prestadora de TRDCriterios técnicos de calidad en VMDLa prestación de servicios de las TRD es una actividad en crecimiento, que puede superar en ocasiones un incremento del 10% anual. Entre los principales motivos cabe destacar la reducción de la duración de la hospitalización (que genera un aumento de la actividad de cuidados domiciliarios), el incremento de los tratamientos vinculados a estas enfermedades y el progresivo envejecimiento de la población.
La prestación de las diferentes TRD, en concreto de la VMD, para los centros dependientes de los diferentes servicios de salud, previa prescripción de los facultativos autorizados, depende en su mayoría de pliegos autonómicos o provinciales, con cláusulas administrativas particulares y prescripciones técnicas donde se describen los requisitos a seguir por las empresas. Los adjudicatarios tienen la obligación de prestar la actividad asistencial concertada a todos los pacientes a los que se les remita la autorización desde los diferentes servicios de salud89,90.
Esta actividad concertada incluye tanto el transporte, la instalación, la puesta en marcha y el adiestramiento en el uso del equipamiento como la realización de controles a los pacientes y el mantenimiento de los equipos. En los últimos años se ha potenciado la implicación de la empresa prestadora de terapias en el manejo integral de este tipo de pacientes, incluyendo la educación y control evolutivo de los mismos.
Recursos humanos
Para garantizar que se realice el adiestramiento necesario del paciente o de sus cuidadores/familiares, la comprobación periódica de la correcta aplicación del tratamiento y el mantenimiento permanente del dispositivo, las empresas deben contar con la presencia de personal experto asistencial (al menos uno por cada 700 pacientes ventilados con dispositivos binivel, de volumen o mixtos).
La empresa prestadora es responsable de que este personal experto cuente con la formación necesaria para el manejo de este tipo de pacientes y equipos, siendo capaces de resolver las distintas circunstancias que se puedan presentar en el desempeño de su actividad.
Equipos y sistemas de administración
Como norma general, para todas las modalidades de ventilación (volumétrica, soporte de presión o binivel) las empresas deben al menos disponer de dos modelos de dispositivos, a fin de poder adaptarse a los requerimientos de cada paciente. En caso necesario, el prestador del servicio debe asumir el compromiso de suministrar cualquier ventilador de uso domiciliario disponible en el mercado que se considere adecuado para un paciente concreto.
- -
Para pacientes con tratamiento de 24 horas, se suministrará un segundo equipo de iguales características y prestaciones en su domicilio como equipo de emergencia.
- -
Se facilitará un resucitador manual (tipo Ambu®) con sus correspondientes instrucciones de uso.
- -
Se suministrará una batería auxiliar y una alarma auxiliar/externa en los casos en que así sea requerido.
Es recomendable disponer de equipos médicos con software de descarga que permitan al médico visualizar los datos continuos de registro de la terapia o su posibilidad de volcado a otros sistemas. Se facilitará al médico prescriptor los sistemas de apoyo necesarios para la visualización de registros de parámetros clínicos si así lo solicita91.
Para todos los tipos de mascarillas (nasales y nasobucales) se dispondrá al menos de tres modelos en tres tamaños distintos. Debe asumirse el compromiso de suministrar otras mascarillas adaptables en casos concretos y justificados que así lo requieran. Todas las mascarillas serán de material hipoalergénico (silicona) y estarán diseñadas a efectos de minimizar las complicaciones locales (úlceras de presión). Se renovará el material fungible (interfase y otros accesorios) siempre que sea necesario por deterioro.
Servicios de valor añadido
La existencia en estas empresas de TRD de una central telefónica (call center) 24 horas al día, 7 días a la semana, 365 días al año, ofrece una oportunidad inmejorable para facilitar la accesibilidad del paciente al sistema de atención, lo que añade un plus en seguridad y confianza al paciente92.
Instauración de la terapia
De forma general se procederá a la instauración de la VMD, independientemente del grado de dependencia a la misma por parte del paciente, en las primeras 24 h siguientes a la recepción de la solicitud, o dentro de las 6 h siguientes en caso de urgencia, tanto en el domicilio como en el hospital (si se solicita iniciar el programa de VMD dentro del propio ingreso), según lo requiera el médico prescriptor.
Educación para la salud
Se debe asegurar la existencia de un programa educativo para el tratamiento y control de este tipo de pacientes, siempre dentro de los marcos actuales de evidencia.
Debe incidir especialmente en cómo identificar las alarmas y cómo responder a cada una de ellas, e informar de cómo realizar cada quince días el ciclo de carga de la batería interna.
Regulación de prestaciones complementarias a la VMD y/o adicionales
Técnicas de tos asistida manuales y mecánicas
Los pacientes que tienen alterado el mecanismo de la tos precisan incorporar al tratamiento ventilatorio técnicas de tos asistida que garanticen un adecuado drenaje de secreciones. Desde un punto de vista clínico, valores de pico flujo de tos (PFT) inferiores a 270 L/min indican un elevado riesgo de complicaciones respiratorias, principalmente retención de secreciones e infecciones, dada la ineficacia de la tos que ello implica. Esto ocurre fundamentalmente en pacientes con enfermedades neuromusculares. Las técnicas de tos asistida pueden ser manuales y mecánicas93-98.
Tos asistida manual
Se inicia con una inspiración máxima seguida de retención del aire cerrando la glotis. Habitualmente aplicamos técnicas de hiperinsuflación previamente para conseguir una inspiración máxima. Al iniciarse la espiración, el cuidador del paciente o el fisioterapeuta aplica compresiones con sus manos en tórax, abdomen o ambos, con el fin de aumentar la presión intratorácica, el PFT y la efectividad de la tos. Es imprescindible que el paciente mantenga una función bulbar normal que permita el cierre de la glotis al final de la insuflación.
Tos asistida mecánica
Está indicada cuando no se alcanza una tos efectiva con las técnicas manuales. Habitualmente esto ocurre cuando la CV es menor de 1.500 mL o del 50% del teórico. Se realiza con un dispositivo mecánico de insuflación-exuflación. Dicho dispositivo genera una presión positiva (insuflación) que va seguida de una presión negativa (exuflación), provocando un flujo de aire que permite arrastrar las secreciones.
Las indicaciones del asistente de la tos son93:
- -
Pacientes con enfermedades neuromusculares y PFT < 270 L/min.
- -
Pacientes con otras enfermedades que cursan con debilidad muscular puesta de manifiesto por un PFT < 270 L/min.
Esta terapia sólo puede ser prescrita por neumólogos responsables del control de estos pacientes.
Procedimiento de manejo y utilización (criterios de calidad)99
- -
Puede aplicarse a través de una máscara nasobucal o cánula traqueal.
- -
Se recomiendan presiones > 40 cmH2O tanto de insuflación como de exuflación para que la técnica sea efectiva.
- -
El tiempo recomendado de aplicación de cada fase es de 2-3 s en la insuflación y 3 s en la exuflación, con una pausa corta entre ciclos.
- -
Se recomiendan varias sesiones diarias, aplicando 5-6 ciclos en cada sesión, ajustando el número de sesiones a la situación clínica del paciente y con utilización a demanda en fases agudas.
- -
Cuando la afección bulbar es importante, la utilidad de este tratamiento es muy limitada.
- -
Se recomiendan varias sesiones diarias, aplicando 5-6 ciclos en cada sesión, ajustando el número de sesiones a la situación clínica del paciente y con utilización a demanda en fases agudas.
- -
Cuando la afección bulbar es importante, la utilidad de este tratamiento es muy limitada.
- -
Nunca se debe terminar el tratamiento al final de una exuflación: aplicar siempre la insuflación siguiente, así el paciente quedará con el pulmón lleno de aire y evitaremos complicaciones.
- -
Si se utiliza boquilla, se puede necesitar las pinzas nasales.
- -
Para eliminar posibles fugas, es importante utilizar una mascarilla de sello suave bien ajustada.
- -
Algunos pacientes necesitan tener la cabeza apoyada por detrás para evitar fugas. Para que sea eficaz, es necesario que la presión sea firme.
Procedimiento de manejo y utilización en pacientes traqueostomizados
- –
Si el paciente tiene colocado un tubo de traqueostomía con balón, inflar el manguito del tubo durante el tratamiento.
- –
Deben aplicarse por regla general, si no existe contraindicación, 6-8 ciclos de in-exuflación mecánica a través de la cánula de traqueostomía, con el fin de acercar a las vías aéreas centrales las secreciones de ambos árboles bronquiales, tanto de las vías más centrales como de las periféricas. Se utilizará el dispositivo en modo automático con una presión de insuflación de + 40 cmH2O, una presión de exuflación de -40 cmH2O, un tiempo de insuflación de 2 s, un tiempo de exuflación de 3 s y una pausa de 1 s.
Los pacientes con enfermedades neuromusculares y sus cuidadores deben haber sido instruidos en las técnicas de tos asistida. Además de disponer de un dispositivo de in-exuflación mecánica es necesario complementarlo con un aspirador para el manejo de las secreciones y una bolsa de resucitación (Ambu®) para ventilación manual49,51-53.
La combinación de los dispositivos de in-exuflación mecánica y la aspiración superficial con sonda permite un manejo óptimo de las secreciones en estos pacientes.
Aspiración de secreciones
La aspiración mecánica de secreciones implica la aspiración potencial de secreciones nasofaríngeas, orofaríngeas y bronquiales, a través de un catéter conectado a una toma de succión. Las personas que utilicen esta técnica (profesionales sanitarios, cuidadores y pacientes) deben estar formadas para su correcta aplicación, ya que está asociada a un importante riesgo de complicaciones a menudo subestimadas.
En los pacientes con dependencia del ventilador, incluidos en programas de VMD, es esencial el entorno sociofamiliar y el adiestramiento de la familia en todo lo que se refiere a cambios de cánula, tratamiento del respirador y aspiración de secreciones, así como a la actitud a tomar ante problemas y complicaciones que puedan presentarse. Debe instruirse cuidadosamente al paciente (si es autónomo) o a los cuidadores, no solo en el funcionamiento y aspectos técnicos del aspirador, sino también en la técnica de aspiración para garantizar que sea efectiva y evitar o minimizar los efectos secundarios (lesiones en la mucosa traqueal).
Sus objetivos principales son mantener la permeabilidad de las vías aéreas, favorecer o restaurar la ventilación y prevenir las infecciones y atelectasias ocasionadas por el acúmulo de secreciones. La aspiración orofaríngea y nasofaríngea se aplica para eliminar, mediante aspiración, las secreciones de boca, nariz y faringe, mientras que la traqueal se aplica, en el caso de la ventilación mecánica domiciliaria, a través de la cánula de traqueostomía.
Los signos y síntomas que indican la necesidad de aspiración en los pacientes portadores de traqueostomía incluyen el aumento de la frecuencia respiratoria, intranquilidad y ansiedad, posible hipotensión, secreciones visibles, ruidos respiratorios, tos excesiva durante la fase inspiratoria del respirador, aumento de la presión pico, disminución del volumen minuto, desadaptación del enfermo a la ventilación mecánica y disminución de la saturación de oxígeno medida por pulsioximetría. La aspiración de secreciones bronquiales sólo debe realizarse cuando sea estrictamente necesario93.
Las guías internacionales, basadas en el Grading of Recommendations Assessment, Development and Evaluation (GRADE), recomiendan lo siguiente100:
- -
Cuando se aspira a través de una vía aérea artificial, el diámetro del catéter no debería sobrepasar la mitad del diámetro interno de la misma, ni más del 70% en niños, evitando así crear altas presiones negativas en el interior de la vía aérea.
- -
La presión negativa generada por el sistema de aspiración debe controlarse previamente, ocluyendo la conexión que se conectará a la sonda de aspiración (nunca ocluir la parte de la sonda que introduciremos).
- -
Son eficaces presiones negativas inferiores a 150 mmHg (200 cmH2O aprox.). Se recomienda una presión negativa de 120-150 mmHg en adultos, 80-120 mmHg en adolescentes, 80-100 mmHg en niños y 60-80 mmHg en neonatos.
- -
La inserción poco profunda de la sonda de aspiración en la vía aérea es igualmente eficaz y evita efectos adversos, como el daño de la mucosa traqueal o atelectasias.
- -
Una vez la sonda de aspiración se encuentra en la vía aérea inferior, el proceso de aspiración no debería sobrepasar los quince segundos.
- -
La aspiración de secreciones debe ser lo más higiénica posible. Una vez terminada la aspiración, el catéter debe ser desechado o, en su defecto, su interior debe ser limpiado con agua bidestilada (o similar) y su exterior con alcohol. No utilizar el mismo catéter durante más de 24 horas.
- -
La instilación de suero salino en la vía aérea artificial solo debe realizarse bajo indicación clínica, pero no de manera rutinaria, debido a su alto riesgo de complicaciones (tos excesiva, desaturación, broncoespasmo o dispersión bacteriana hacia el interior de los pulmones).
- -
La fluidificación de las secreciones debe procurarse previamente mediante la humidificación de los gases que provienen del ventilador mecánico y la hidratación sistémica.
- -
El uso de la hiperinflación con el balón de resucitación para la hiperoxigenación no está recomendado de manera rutinaria.
- -
Se sugiere que la suplencia de oxígeno o el aumento de la fracción inspiratoria previa se apliquen sólo cuando el paciente presente una desaturación importante durante la succión.
- -
En cuanto a los requisitos técnicos del equipamiento, deberá poseer una capacidad de aspiración superior a 500 mmHg, un flujo de succión superior a 15 lpm, disponibilidad de recipiente colector de al menos 0,5 L, posibilidad de batería interna con autonomía mínima de 30 min y un peso menor de 3 kg.
- -
Además, se suministrará el material fungible necesario, como tubuladuras, circuito de aspiración y sondas de aspiración.
El papel de la educación sanitaria de las empresas prestadoras en el domicilio es fundamental en lo que respecta a adiestramiento, comprensión de la aplicación del sistema y estado óptimo de funcionamiento, así como a la comprobación del estado de los equipos y accesorios a instalar (cable de alimentación, vaso recolector, válvula antirrebosamiento y estado de la batería, si dispusiese de ella), comprobación de las fechas de revisión, comprobación de las prestaciones correctas del equipo (presión de aspiración, vacuómetro, ruido, etc.) y valoración del estado de los circuitos, del material fungible y del material accesorio, sustituyéndolos en caso necesario101.
Pulsioximetría y otros sistemas de monitorización
La medida de la saturación de oxígeno mediante pulsioximetría (SpO2) es clave en la monitorización de la VMD ya que, sin al menos un control adecuado de la oxigenación, los parámetros del ventilador no se pueden considerar correctamente ajustados55,56,102. La monitorización de la VMD permite verificar el cumplimiento, la comodidad, los efectos adversos y la efectividad del tratamiento.
A pesar de que no existen documentos de consenso sobre el método más apropiado para llevar a cabo esta monitorización, los datos clínicos, junto con la gasometría diurna y la pulsioximetría nocturna son los instrumentos más ampliamente usados en la práctica clínica55,56. La desaturación nocturna se considera uno de los principales determinantes de los trastornos neurocognitivos y de las consecuencias cardiovasculares que ocurren durante la IRC. La pulsioximetría tiene la ventaja de su simplicidad, de requerir poco tiempo de preparación y de respuesta en breve periodo de tiempo (segundos), aunque sus desventajas vienen derivadas de los artefactos de movimiento y por estar influenciada por el estado de perfusión tisular. La información proporcionada también depende del tipo de dispositivo y del entorno, particularmente de la frecuencia de muestreo, ya que la magnitud de las desaturaciones disminuye cuando la frecuencia de muestreo es larga. La frecuencia de muestreo y el tiempo de respuesta de la señal pueden variar considerablemente entre dispositivos (2-21 s). La precisión de la SpO2 reportada en los estudios del sueño es del 2-6% en comparación con la derivada de la gasometría arterial. Cuando la SpO2 es > 90%, la exactitud de las lecturas es ± 2%; para valores < 80% la precisión puede disminuir considerablemente56.
Durante la monitorización nocturna, la principal limitación de la pulsioximetría es la baja especificidad de las variaciones de SpO2, ya que las desaturaciones recurrentes pueden reflejar distintas situaciones, como inestabilidad de la vía aérea superior, eventos obstructivos residuales, disminución de la orden ventilatoria con o sin cierre de la glotis o fugas repetitivas interrumpidas por microdespertares. Igualmente pueden indicar disminución de la orden ventilatoria como expresión de eventos residuales insuficientemente corregidos por la VNI en sujetos con síndromes de apnea central del sueño o inducidos por la propia ventilación. Durante la respiración espontánea, las desaturaciones prolongadas siempre representan desequilibrios ventilación/perfusión, tanto en pacientes con obstrucción grave como en trastornos restrictivos, o por persistencia de la hipoventilación alveolar. Desaturaciones prolongadas acompañadas de aumento de la frecuencia cardíaca ocurren aproximadamente cada 90-120 min durante la noche, típicas de la hipoventilación del sueño REM en pacientes ventilados. Sin embargo, también puede suceder como consecuencia de fugas prolongadas o de presión insuficiente, con independencia de la fase del sueño en la que se encuentre el paciente82. Por otra parte, en sujetos con oxígeno suplementario, la pulsioximetría no es fiable para la detección de hipoventilación. A pesar de estas limitaciones, la pulsioximetría es una herramienta de evaluación útil, entre cuyas ventajas se cuentan su bajo coste, su facilidad de interpretación y su posible uso en programas de telemedicina y transmisión de datos56. Es imprescindible explicar al paciente y familiares las limitaciones de la pulsioximetría, cómo interpretar los valores obtenidos y establecer un plan de actuación frente a las desviaciones de la saturación que consideremos anormales para ese paciente.
Curiosamente, no existen pautas precisas sobre lo que debe ser considerado como satisfactorio en términos de oxigenación nocturna durante la ventilación domiciliaria. Un objetivo razonable es ajustar el ventilador para obtener una media nocturna de SpO2 > 90%, con < 10% del tiempo con SpO2 < 90% después de la corrección de fugas55. Hay trabajos que señalan la importancia de monitorizar, en pacientes neuromusculares, la PaCO2 transcutánea (PtcCO2) junto con la SpO2 nocturna, para ajustar la VMD y estar así seguros de que no existe hipoventilación, ya que la medida continua de la PtcCO2 muestra buena concordancia con la PaCO256,102-104, desaconsejando el uso de sistemas portátiles de monitorización de CO2 espirado (PETCO2), ya que la relación entre la PaCO2 y la PETCO2 depende del espacio muerto fisiológico, del volumen corriente y del modo ventilatorio, y en gran manera del tipo y extensión del trastorno parenquimatoso subyacente56.
En la instalación de equipos para monitorización continua en el domicilio debe disponerse de adaptadores a dedo de carácter universal, alarmas regulables según el porcentaje de saturación y frecuencia cardiaca deseada, con una tolerancia de ± 2% para saturaciones de entre el 50 y el 100%. Los pulsioxímetros quedan sujetos a revisión con las mismas condiciones que los equipos de soporte ventilatorio.
Seguimiento y control de los pacientes con VMDContinuidad asistencial en VMD. Modelos integrados de atención al paciente ventilado
Los pacientes que reciben tratamiento con VMNI a largo plazo suponen, desde un punto de vista organizativo, un reto para los clínicos responsables de su manejo. Pacientes que requieren VMD solo nocturna se suman a otros que necesitan soporte ventilatorio más prolongado, a veces durante las 24 horas del día. Pacientes que reciben VMNI por mascarilla nasal o buconasal conviven con otros que la reciben por traqueostomía. La carga de cuidados puede ser muy variable, mientras que la complejidad de dichos cuidados, relacionada con los requerimientos tecnológicos, puede llegar a transformar la casa del paciente en una unidad de cuidados intensivos. Todas las combinaciones son posibles: desde pacientes con necesidades bajas de cuidados y solo ventilación nocturna hasta pacientes ventilo-dependientes con alta carga de cuidados y gran complejidad44.
La VMNI se realiza fundamentalmente en el domicilio del paciente, aunque algunos pacientes precisan cuidados prolongados en unidades especiales o en hospitales de larga estancia. Problemas relacionados con la complejidad de los cuidados, el grado de dependencia, la ausencia de cuidador en el domicilio, el exceso de tecnología que desborda el ambiente familiar, ansiedad al asumir la tarea de cuidar a un ser querido, la inseguridad, los miedos, la necesidad de monitorización o situaciones de fragilidad, agotamiento o claudicación son solo algunos de los factores que hacen que haya pacientes que no puedan ser controlados en su domicilio.
En el momento actual es necesario definir circuitos y recursos que garanticen la correcta atención de los pacientes con VM a largo plazo en los diferentes escenarios posibles.
Domicilio
Es el lugar donde realizan la VMNI la mayor parte de los pacientes. Generalmente, aquellos con baja carga de cuidados y ventilación exclusivamente nocturna no requieren una infraestructura compleja.
Habitualmente, el paciente es capaz de autocuidarse. En pacientes con requerimientos tecnológicos mayores, o mayor grado de fragilidad, el mantenimiento en casa conlleva una sobrecarga del cuidador elevada, a menudo inaceptable. En este contexto, se han desarrollado estrategias aisladas con el objetivo de proporcionar unos cuidados de calidad en el domicilio y no abandonar a su suerte al paciente y su familia. Frente a modelos de atención centrada en el hospital, el programa de atención domiciliaria para pacientes con VMNI del Servicio de Neumología del Hospital de Bellvitge ha sido un referente en nuestro país y un ejemplo de cómo se pueden mejorar los resultados de la VMNI a través de la visita domiciliaria por parte de personal del hospital105.
Otras opciones incluirían un rol más activo de la atención primaria en el control domiciliario de estos pacientes, como parte de una estrategia de integración de cuidados liderada por el neumólogo. También se podría considerar la colaboración de los equipos de hospitalización domiciliaria y los de soporte y cuidados paliativos, capaces de ofertar unos cuidados a domicilio para determinados pacientes complejos, como es el caso de pacientes con ELA106.
De hecho, la realidad muestra que los hospitales adoptan distintos modelos de atención en función de sus propios recursos.
Juegan un papel clave en este proceso de control del tratamiento las empresas de TRD. Su actuación coordinada con el hospital posibilita que personal cualificado de la empresa realice actividades de control y monitorización de pacientes con VM en su domicilio, informando al médico responsable de aquellas incidencias que requieran su participación o implementando actuaciones concretas bajo las directrices de protocolos consensuados por ambas partes.
Hospitalización a largo plazo
A pesar de las posibilidades de soporte domiciliario que teóricamente se pueden ofertar, algunos pacientes claudican en el domicilio, siendo necesario su traslado a un centro hospitalario. En este escenario, el hospital de agudos, sea la planta de hospitalización, sea la UVI, no es el lugar adecuado para que estos pacientes permanezcan durante periodos prolongados de tiempo. Sí se puede utilizar como centro de apoyo para solventar problemas agudos, o incluso como centro de descanso del cuidador, facilitando el ingreso del paciente unos días para que su familiar se libere de la carga de cuidados diaria en periodos donde la situación se torna insostenible. Pero lo razonable es que estos pacientes sean trasladados a centros de larga estancia, habilitados para proporcionar los cuidados necesarios en un entorno de menor complejidad tecnológica. Podemos encontrar experiencias de este tipo de centros con diferentes denominaciones, como centros de weaning o destete, centros de ventilo- dependientes u hospitales de crónicos107,108. Existen también experiencias privadas empresariales donde se ofertan centros asistenciales con internamiento que están diseñados para ayudar a que los pacientes ventilados y sus familiares se sientan como en casa, mientras que proporcionan todo el equipamiento técnico necesario para los cuidados ventilatorios, así como otras prestaciones complementarias (fisioterapia respiratoria).
Los hospitales de referencia suelen ser centros donde se concentran los pacientes más complejos y problemáticos, y deben dar soporte a los hospitales generales básicos, donde pueden controlarse pacientes más sencillos en su manejo. Estos centros de referencia pueden recibir pacientes con VMNI que presenten un problema agudo relacionado o no con la VM, ya procedan de su domicilio o de algún centro de larga estancia. La colaboración en estos casos de los dispositivos de transporte sanitario, cualificados y entrenados en VM, permite que haya continuidad de cuidados en los desplazamientos de estos pacientes, lo cual puede llegar a ser crucial en el caso de pacientes ventilo-dependientes. Los servicios de urgencias que reciben a estos pacientes deben estar igualmente formados en aspectos relacionados con la VMNI y capacitados para poder asumir la ventilación con garantías en el área de urgencias109,110.
Telemonitorización/telemedicina
El mundo de las tecnologías de la información y la comunicación (TIC) avanza a gran velocidad y cada vez disponemos de más facilidades para poder controlar la VMD de un paciente a distancia111-117. El software de los respiradores más modernos posibilita que se puedan controlar desde el hospital las alarmas o el reglaje de un respirador, como en el caso de los equipos binivel, que se encuentran en la casa del paciente. Algunos ofrecen una capacidad de monitorización avanzada que puede incluir pulsioximetría y capnografía. A través de la red, estas señales se pueden ver en tiempo real en un centro de control ubicado en el hospital, en el call center de la empresa de TRD o en un dispositivo smartphone. Existen equipos que permiten la monitorización remota de pacientes en VMD, pudiendo acoplarse a cualquier respirador existente en el mercado. La telemonitorización podría contemplarse hoy como una herramienta más para objetivar el cumplimiento en ciertos grupos de pacientes ventilados.
Para concluir, las palabras clave que resumirían el control de los pacientes con VMD serían: integración de cuidados, protocolización de procesos, formación de los profesionales implicados y establecimiento de circuitos de pacientes y centros de referencia, sin olvidar la importantísima tarea de cuidar al cuidador.
Algoritmos de trabajo para el control y seguimiento de los pacientes en ventilación domiciliaria por parte de los servicios de neumología
En el marco de este documento, donde se propone buscar marcadores de excelencia que sirvan para tomar decisiones operativas a corto plazo, y estratégicas a largo plazo, se enmarca el control objetivo de los pacientes que se encuentran dentro de los programas de ventilación domiciliaria.
Este grupo ha diseñado unos diagramas de trabajo para iniciar pautas de excelencia en ventilación, sin olvidar lo básico, que es entender que la ventilación domiciliaria es un tratamiento con indicaciones claras, basadas en la medicina de la evidencia, y que todos los servicios, secciones o unidades de neumología deben, en este momento de la historia, incluirlo en sus carteras de servicios.
Se han diseñado dos planes, un módulo de trabajo para las unidades básicas (fig. 2) y un módulo avanzado para las unidades de referencia de ventilación y sueño (fig. 3). Este diagrama solo refleja el primer paso, por escrito, conociendo que podrá ser desarrollado o mejorado por el grupo de trabajo de ventilación no invasiva de SEPAR.
Seguimiento y control del paciente con VMD por la empresa prestadora de TRD
Para adecuar y diferenciar a los pacientes en función de la dependencia a la ventilación mecánica, se hace necesario conocer el número de horas de uso, con objeto de ajustar las visitas de seguimiento por parte del personal asistencial de las empresas prestadoras91. Es necesario establecer perfiles de enfermos en función de todas aquellas esferas que influyen en la atención del paciente (distancia a los centros de atención sanitaria, necesidad de cuidados profesionales), estableciendo niveles de complejidad. A cada nivel se debe aplicar un protocolo de actuación diferente que facilitará la personalización del servicio prestado. El manejo de los pacientes de menor complejidad irá orientado a acciones encaminadas a la autogestión de su enfermedad, mientras que en los de mayor complejidad la atención irá orientada a una gestión integral del caso, a través de cuidados avanzados profesionales. No todos los pacientes necesitan la misma complejidad tecnológica ni frecuencia de seguimiento clínico. Esto es especialmente relevante en el caso de los pacientes con ventilación, en los que sería necesario establecer qué pacientes requieren respiradores de alta complejidad (ventilo-dependientes, neuromusculares, etc.) y qué pacientes solo precisan de respiradores más básicos (EPOC, SHO). Los datos necesarios que la empresa debe conocer en el momento de la prescripción son:
- -
Diagnóstico: el diagnóstico de la enfermedad de base es fundamental para prestar una asistencia de calidad. El desconocimiento del proceso diagnóstico que indica la terapia respiratoria impide ser más eficiente en su prestación y compromete los beneficios para el paciente en términos de seguridad y control clínico.
- -
Tipo de ventilador: en la elección de un dispositivo es importante destacar que se realice por sus características técnicas y prestaciones necesarias para el perfil del paciente. No es lo mismo la prestación, ni el control y seguimiento de los pacientes con VMD por síndrome de hipoventilación obesidad (SHO) que por una esclerosis lateral amiotrófica (ELA). La rápida evolución de la segunda recomienda iniciar una ventilación con equipamientos más sofisticados y un seguimiento clínico en domicilio más exhaustivo, para permitir una mejor adaptación al progreso de la enfermedad y a las necesidades ventilatorias, en oposición al SHO con una evolución mucho más estable, pudiendo incluso revertirse a un soporte ventilatorio a presión constante (CPAP) por indicación de su médico prescriptor.
- -
Parámetros de prescripción: para seguridad de los pacientes, deben existir unos mínimos requisitos de prescripción que deben ser obligatorios y sin los cuales no debería instaurarse la terapia, tal y como se señalan en el epígrafe “Condiciones técnicas de los equipos de VMD” para cada uno de los modos ventilatorios.
- -
Dependencia de ventilación: en general establece el grado de complejidad de la patología de base. Se entenderá como pacientes dependientes de la ventilación, aquellos cuya indicación de ventilación sea superior a 12 h/día.
- •
Dependencia inferior a 12 horas: pacientes que requieren VMD menos de doce horas al día. Incluye a aquellos que usan los equipos durante la noche.
- •
Dependencia mayor de 12 horas: pacientes que requieren VMD más de doce horas al día. Incluye a aquellos que usan los equipos durante la noche y alguna hora durante el día.
- •
VMD 24 horas: pacientes que requieren VMD durante el día completo y portadores de traqueostomía.
En general, al igual que con el tratamiento de pacientes diagnosticados de SAHS con CPAP, todos los pacientes con VMD deben tener parámetros básicos monitorizados/telemonitorizados (horas de cumplimiento, adaptación) y volcado de los datos en portal informático que incluirá tipo de ventilador, parámetros ventilatorios, otras terapias asociadas (oxigenoterapia, aspirador de secreciones, sistemas mecánicos de asistencia a la tos, pulsioximetría, etc.). En el portal informático deben incluirse las fechas de revisiones y las acciones emprendidas (cambios de parámetros, mascarillas, etc.).
- –
Las visitas de seguimiento serán a las 24 h del alta, luego en la 1ª, 2ª y 3ª semanas telefónicamente y, posteriormente, de forma mensual (siempre en el domicilio) a los pacientes con tratamiento de 24 horas, trimestral a los pacientes con tratamiento entre 12 y 24 horas, y semestral a pacientes con tratamiento de menos de 12 horas, con independencia de la monitorización/telemonitorización antes mencionada.
- –
De cada visita por el personal asistencial se emitirá informe al servicio hospitalario prescriptor, en las circunstancias y formato que éste determine y siempre que observe hallazgos o incidencias significativas.
Cumplimiento y adhesión a la terapia
Las comunidades autónomas han incluido en sus pliegos condiciones acerca del cumplimiento, dejando el paciente constancia por escrito de que ha sido informado adecuadamente de los niveles mínimos para la consideración de cumplimiento con el tratamiento de la terapia respiratoria, quedando reflejado en la historia clínica del paciente89,90. La accesibilidad de la información a través de los portales informáticos de las empresas de TRD se considera un punto básico de la prestación.
Indicadores de calidad de la prestación a domicilioComo norma general, en cada uno de los centros donde se tengan pacientes con VMD se deberá realizar una evaluación de la calidad de los servicios prestados por la empresa prestadora del servicio, valorándose, entre otros, los siguientes indicadores, estableciendo de una manera habitual un porcentaje como objetivo118:
- -
Número de servicios realizados fuera de plazo/total de servicios realizados < 10%.
- -
Número de seguimientos fuera de plazo/total de seguimientos a efectuar en un periodo < 10%.
- -
Número de registros de cumplimiento/total de tratamientos > 90%.
- -
Número de reclamaciones escritas recibidas/n° de pacientes < 5%.
- -
Tiempo de resolución de quejas y reclamaciones < 7 días.
Terapia de alto flujo con cánulas nasales
En los últimos años se ha incorporado la terapia de alto flujo por cánula nasal (TAFCN) como una alternativa para tratar pacientes con insuficiencia respiratoria de diferente origen119. Consiste en la administración de un gas a través de unas cánulas nasales específicas, a flujos que superen la demanda de flujo inspiratorio del paciente, habitualmente mayores de 30 L/min, con una FiO2 controlada, estable y conocida, y en condiciones óptimas de temperatura (37°C) y humedad (100% de humedad relativa, 44 mgH20/L de humedad absoluta). El paciente recibe de una forma fácil y confortable un gas eficiente, optimizado y que asegura una FiO2 constante en vía aérea, entre 21 y 100%120.
Se han descrito diversos mecanismos por los que la TAFCN actúa en los pacientes con insuficiencia respiratoria121. Muchos de ellos nos recuerdan los mecanismos de acción de la ventilación mecánica no invasiva (VMNI) y existe una tendencia cada vez mayor a considerar la TAFCN dentro de los dispositivos de soporte respiratorio122. La tabla 6 muestra los principales mecanismos de acción de la TAFCN.
Mecanismos de acción de la TAFCN
| FiO2 controlada y estable entre 21-100% al no existir dilución con aire ambiente |
| Reducción resistencia nasofaríngea |
| Lavado de CO2 del espacio muerto anatómico |
| Mejora oxigenación |
| Genera presión positiva en la vía aérea que produce |
| Reclutamiento alveolar con disminución del shunt |
| Efectos beneficiosos a nivel hemodinámico (EAP cardiogénico) |
| Reducción del trabajo muscular respiratorio al mejorar la distensibilidad pulmonar y contrarrestar auto PEEP en pacientes con patología respiratoria obstructiva |
| Mejora del patrón ventilatorio |
| Mejora el aclaramiento mucociliar facilitando el manejo de secreciones |
| Disminución del coste metabólico de acondicionar el gas |
| Aumenta tolerancia y comodidad del paciente |
La TAFCN es utilizada principalmente en entorno hospitalario (servicios de urgencias, unidades de críticos, semicríticos y planta de hospitalización). La principal indicación de la TAFCN es el paciente con fallo respiratorio agudo hipoxémico, siendo el tratamiento de elección en ausencia de criterios de intubación123. Existe evidencia limitada para su uso en pacientes con fallo respiratorio agudo hipercápnico124,125 y algunos estudios han mostrado efectos fisiológicos en pacientes con EPOC estable hipercápnicos126,127.
En el momento actual, la TAFCN se ha utilizado en el domicilio a largo plazo únicamente en tres estudios. Rea et al.128 estudiaron 108 pacientes (63 pacientes con EPOC y 35 con bronquiectasias) durante un año, demostrándose durante el período de seguimiento una reducción de las exacerbaciones (8% en el grupo de oxigeno convencional no presentaron exacerbaciones, frente a 20% en el grupo TAFCN), y del tiempo hasta la primera exacerbación (27 frente a 52 días en el grupo intervención). A destacar que el cumplimiento medio fue únicamente de 1,6 horas al día. Storgaard et al.129, analizaron 200 pacientes EPOC con insuficiencia respiratoria crónica hipoxémica, aleatorizados a grupo control y grupo intervención en tratamiento con TAFCN una media de 7,7 horas/día. Los resultados mostraron una reducción significativa en el número de exacerbaciones y en el número de ingresos hospitalarios, en el grupo tratado con TAFCN. Nagata et al.130, analizaron 32 pacientes con EPOC y fallo respiratorio hipercápnico crónico, en un estudio multicéntrico, aleatorizado y cruzado. Los pacientes fueron asignados al azar para recibir dos periodos de seis semanas de tratamiento con TAFCN junto a oxigenoterapia convencional (TAFCN/OCD) utilizando el dispositivo myAIRVO 2®, o bien oxigenoterapia convencional (OCD). El grupo A recibió TAFCN/OCD (periodo 1) seguido por OCD (periodo 2) y el grupo B, OCD (periodo 1) seguido por TAFCN/OCD (periodo 2). Los pacientes fueron instruidos para usar la TAFCN al menos durante cuatro horas durante las horas de sueño con flujos de 30-40 L/min, con O2 añadido ajustado para mantener una SpO2 > 88%. Los resultados mostraron que la TAFCN mejoró significativamente la calidad de vida y la hipercapnia frente al tratamiento con oxigenoterapia convencional.
En el caso de pacientes hipoxémicos, hay que tener en cuenta las limitaciones de las fuentes de O2 domiciliarias en pacientes que requieren FiO2 elevadas. En estas circunstancias, quizás sea más apropiada la prescripción de una mascarilla reservorio. En el caso de pacientes hipercápnicos, la ventilación mecánica no invasiva es el tratamiento de elección.
La evidencia disponible en relación con la indicación domiciliaria de TACFN en el domicilio, a largo plazo, es insuficiente, para justificarla como una indicación contundente. Los actuales conciertos de terapias respiratorias domiciliarias mayoritariamente no incluyen esta prestación, sin embargo, en alguno existe la posibilidad de instaurar TAFCN en el domicilio de pacientes seleccionados. Para ello se deberá justificar su eficacia tras un periodo de prueba hospitalario, y cuando se hayan demostrado beneficios clínicos y fisiológicos fehacientes, no siendo factibles otras alternativas de tratamiento como la ventilación no invasiva o la oxigenoterapia domiciliaria131, reconociendo que esto supone una nueva actividad asistencial distinta de las prestaciones de TRD definidas en la Orden Ministerial de 3 de marzo de 1999 del Sistema Nacional de Salud. Esta nueva terapia conlleva una serie de recursos humanos y materiales que presupuestariamente no están reconocidos en los actuales concursos de TRD, por lo que es necesario proporcionar un marco adecuado y sostenible que atienda a esta necesidad.
Recomendaciones
Como recomendaciones (opinión de expertos) para la TAFCN en domicilio a largo plazo, se pueden considerar los siguientes aspectos:
- –
Valorar TAFCN en pacientes hipoxémicos en los que no se consiga una saturación adecuada con mascarilla reservorio a 15 L/min de O2, y tras comprobar que la TAFCN con flujos de O2 máximos de 15 L/min, consigue una saturación > 90%. La terapia será indicada de forma continua.
- –
Valorar TAFCN en pacientes procedentes de áreas de críticos tratados con TAFCN en los que no es posible retirar esta terapia por deterioro clínico y se plantea el alta hospitalaria con TAFCN como única forma de mantener al paciente estable, sin posibilidad de utilizar oxigenoterapia o ventilación no invasiva. La terapia será indicada de forma continua.
- –
No existe evidencia para la indicación de TAFCN de forma discontinua.
Características técnicas
Tres son los componentes básicos de todo sistema de alto flujo, a saber:
- -
Una interfase tipo cánula nasal, cómoda y eficiente, con un diseño capaz de ofrecer flujos de hasta 60 lpm, disponibles para pacientes adultos y pediátricos, con diferentes tamaños y capaces de soportar, sin incomodidad para el paciente, el peso de la tubuladura de conexión.
- -
Generador de flujo capaz de ofrecer flujos altos mediante el mismo mecanismo que lo hace un ventilador mecánico desde aire ambiente.
- -
Un sistema de humidificación-calentamiento activo que es clave para un dispositivo que suministra flujos elevados de un gas a través de cánulas nasales.
- -
Otros complementos necesarios son las tubuladuras de conexión. Estas incorporan una resistencia interior que mantiene la temperatura del gas y evita fenómenos de condensación. En general, se recomienda usar agua desionizada o de lavado simple, en envase de plástico, como fuente de humidificación.
Lo quenose debe hacer en ventilación mecánica domiciliaria
Tabla. Qué no hacer en VMD
- -
Indicar VMD si NO se cumplen los requisitos establecidos por consenso, tanto en lo que se refiere a la patología del paciente como a los criterios de indicación.
- -
Indicar VMD si faltan exploraciones complementarias imprescindibles (principalmente estudio de sueño, pulsioximetría nocturna, exploración funcional respiratoria) que documenten la indicación.
- -
Indicar VMD sin que se reúnan unos criterios mínimos que garanticen los cuidados en domicilio.
- -
Indicar VMD con modos ventilatorios complejos sin los conocimientos necesarios de la técnica.
- -
Si no se dispone de monitorización y seguimiento suficientes, no derivar pacientes en VMD a unidades de superior nivel.
- -
Iniciar VMD con ventiladores e interfases no adecuados al perfil del paciente y su situación clínica.
- -
Iniciar VMD sin haber adaptado al paciente al ventilador que va a utilizar en el domicilio.
- -
No identificar al cuidador principal del paciente o la persona que se responsabilizará de la VMD.
- -
No formar adecuadamente al cuidador principal para que quede garantizado un entorno de seguridad en el domicilio.
- -
Instalar una VMD, por parte de la empresa, si no se dispone de los parámetros del ventilador prescritos por el médico responsable.
- -
Instalar una VMD, por parte de la empresa, con un modelo de ventilador diferente al prescrito por el médico responsable sin haberlo consensuado previamente.
- -
No facilitar al paciente el modelo de interfase (nasal, nasobucal, cánula traqueostomía, pipeta), prescrito por el médico responsable.
- -
No realizar el seguimiento protocolizado del paciente ventilado.
- -
Una vez descartadas complicaciones susceptibles de corrección, mantener la VMD en pacientes no cumplidores (< 4 h/día)
Salvador Diaz Lobato, desde el 1 de mayo de 2019, ocupa el cargo de Director Médico de Nippon Gases Healthcare.
El resto de autores declaran no tener ningún conflicto de intereses.