El síndrome inflamatorio multisistémico pediátrico vinculado a la COVID-19 (SIM-PedS) es, según la Organización Mundial de la Salud, un nuevo síndrome descrito en pacientes menores de 19 años con historia previa de exposición a SARS-CoV-2. La presentación inicial de este síndrome se caracteriza por fiebre persistente que asocia debilidad, dolor abdominal, vómitos y/o diarrea. Menos frecuentemente los pacientes pueden presentar también erupción cutánea y conjuntivitis. El cuadro clínico tiene expresividad y evolución variables, por lo que algunos pacientes pediátricos afectados pueden empeorar rápidamente, desarrollando desde hipotensión y shock cardiogénico a daño multiorgánico. Los hallazgos analíticos característicos del síndrome consisten en elevación de marcadores inflamatorios y disfunción cardíaca. Los hallazgos radiológicos más frecuentes son cardiomegalia, derrame pleural, signos de insuficiencia cardíaca, ascitis y cambios inflamatorios en la fosa ilíaca derecha. En la pandemia actual por COVID-19 es necesario que el radiólogo conozca las características clínico-analíticas y radiológicas de este síndrome para realizar un correcto diagnóstico.
The World Health Organization defines the multisystem inflammatory syndrome in children (MIS-C) as a new syndrome reported in patients aged <19 years old who have a history of exposure to SARS-CoV-2. The onset of this syndrome is characterized by persistent fever that is associated with lethargy, abdominal pain, vomiting and/or diarrhea, and, less frequently, rash and conjunctivitis. The course and severity of the signs and symptoms vary; in some children, MIS-C worsens rapidly and can lead to hypotension, cariogenic shock, or even damage to multiple organs. The characteristic laboratory findings are elevated markers of inflammation and heart dysfunction. The most common radiological findings are cardiomegaly, pleural effusion, signs of heart failure, ascites, and inflammatory changes in the right iliac fossa. In the context of the current COVID-19 pandemic, radiologists need to know the clinical, laboratory, and radiological characteristics of this syndrome to ensure the correct diagnosis.
En diciembre de 2019 se describió el brote de un nuevo coronavirus en Wuhan, provincia de Hubei, China. El 11 de febrero de 2020 la Organización Mundial de la Salud (OMS) pasó a denominar al nuevo virus SARS-CoV-2, por su similitud con el causante del síndrome respiratorio agudo grave que brotó en 2003, y COVID-19 (Coronavirus Infectious Disease 2019) a la nueva enfermedad. El 11 de marzo de 2020 la OMS declaró el brote como una pandemia1.
Desde entonces, la COVID-19ha sido descrita como una enfermedad que afecta menos a la población pediátrica que a la adulta, tanto en incidencia como en gravedad, con un cuadro clínico más leve y una rápida recuperación posterior en la gran mayoría de niños2,3. Hay estudios que sugieren que los niños tienen menor carga viral4, de manera que mientras el 18,5% de los adultos con COVID-19 tienen enfermedad grave, solo entre el 6% y el 8% de los niños muestran síntomas graves5–7. Los datos indican que el 45% de los pacientes pediátricos son asintomáticos8, y cuando muestran síntomas su manifestación más común es la fiebre en el 95-98% de los casos y la tos en el 86-95%9–11. Desde abril de 2020, cuando la pandemia de COVID-19 estaba ya ampliamente extendida en los países occidentales, se han documentado cada vez más casos de niños que han desarrollado un síndrome multisistémico hiperinflamatorio asociado con la infección por el SARS-CoV-2. La mayoría de estos pacientes tenían anticuerpos IgG frente al SARS-CoV-2, con PCR ya negativa12–18, es decir, unos hallazgos de laboratorio demostrativos de haber superado la infección.
Los pacientes afectados presentaban un amplio espectro de hallazgos clínicos consistentes en fiebre (38-40°C), dolor de cabeza y en extremidades; dolor abdominal, vómitos y diarrea; erupción cutánea, conjuntivitis y edema periférico, con gravedad variable, evolucionando un porcentaje significativo a daño miocárdico y shock tanto de tipo cardiogénico como séptico o tóxico18–23. Las alteraciones analíticas fueron parecidas a las observadas en la enfermedad de Kawasaki (EK), en el síndrome de shock tóxico (SST) o en el síndrome de activación macrofágica, aunque de mayor gravedad18,19.
Este síndrome inflamatorio sistémico de expresividad variable ha recibido varios nombres. En Reino Unido/Europa se le ha denominado “síndrome inflamatorio multisistémico pediátrico temporalmente vinculado al SARS-CoV-2” (PIMS-TS)24 y en EE.UU. síndrome inflamatorio multisistémico en niños vinculado al SARS-CoV-2 (MISC-C, MIS-C)25, coincidiendo con la denominación que le ha dado la OMS26. El reciente documento de consenso de la Asociación Española de Pediatría (AEP) ha decidido referirse al mismo como “síndrome inflamatorio multisistémico pediátrico vinculado a SARS-CoV-2” o SIM-PedS18.
En España se considera que la franja de edad de pediatría abarca hasta los 15 años, si bien varios organismos oficiales como la OMS y los Centers for Disease Control and Prevention (CDC) de EE. UU. han incluido en sus criterios a pacientes menores de 19 y 21 años, respectivamente25,26, y algunos estudios incluyen también pacientes mayores de 15 años19. Por ello, los autores proponemos considerar este síndrome no solo en menores de 15 años, que pueden ser atendidos por el pediatra o radiólogo pediátrico, sino también en pacientes de entre 15 y 20 años, que serán evaluados por los médicos de familia o de urgencias y radiólogos generales o no dedicados específicamente a la radiología pediátrica. Dado que la manifestación clínica del SIM-PedS es inespecífica, las pruebas de imagen tienen un papel muy importante en su diagnóstico. En este artículo se revisan los hallazgos clínicos y radiológicos de este nuevo síndrome.
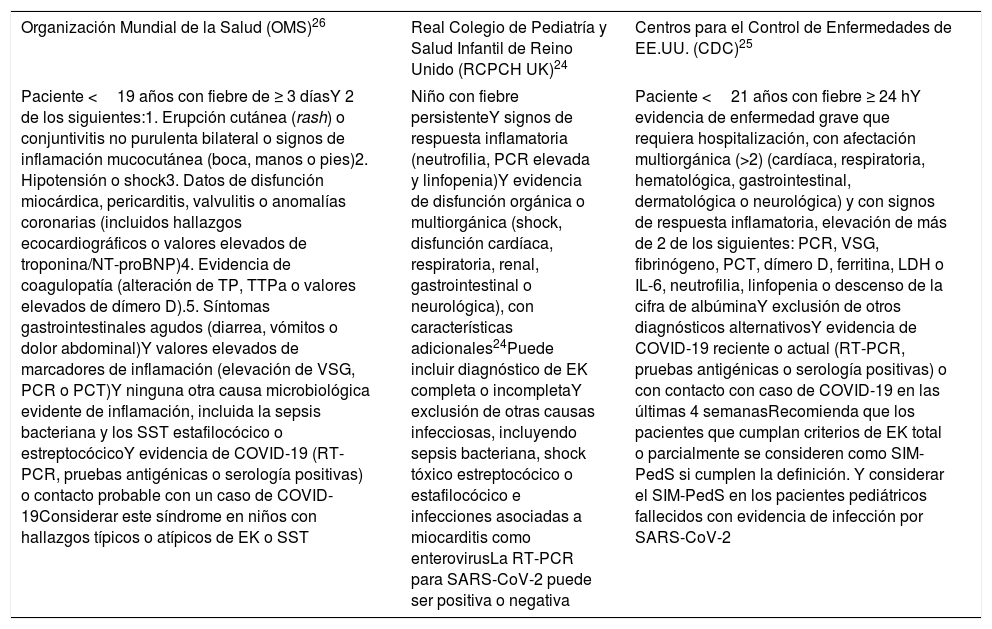
Definiciones y hallazgos clínico-analíticosLos criterios de inclusión definidos por los distintos organismos sanitarios antes mencionados para establecer el diagnóstico del SIM-PedS muestran ligeras diferencias y se resumen en la tabla 1.
Definiciones de SIM-PedS por la OMS, RCPCH, CDC
| Organización Mundial de la Salud (OMS)26 | Real Colegio de Pediatría y Salud Infantil de Reino Unido (RCPCH UK)24 | Centros para el Control de Enfermedades de EE.UU. (CDC)25 |
|---|---|---|
| Paciente <19 años con fiebre de ≥ 3 díasY 2 de los siguientes:1. Erupción cutánea (rash) o conjuntivitis no purulenta bilateral o signos de inflamación mucocutánea (boca, manos o pies)2. Hipotensión o shock3. Datos de disfunción miocárdica, pericarditis, valvulitis o anomalías coronarias (incluidos hallazgos ecocardiográficos o valores elevados de troponina/NT-proBNP)4. Evidencia de coagulopatía (alteración de TP, TTPa o valores elevados de dímero D).5. Síntomas gastrointestinales agudos (diarrea, vómitos o dolor abdominal)Y valores elevados de marcadores de inflamación (elevación de VSG, PCR o PCT)Y ninguna otra causa microbiológica evidente de inflamación, incluida la sepsis bacteriana y los SST estafilocócico o estreptocócicoY evidencia de COVID-19 (RT-PCR, pruebas antigénicas o serología positivas) o contacto probable con un caso de COVID-19Considerar este síndrome en niños con hallazgos típicos o atípicos de EK o SST | Niño con fiebre persistenteY signos de respuesta inflamatoria (neutrofilia, PCR elevada y linfopenia)Y evidencia de disfunción orgánica o multiorgánica (shock, disfunción cardíaca, respiratoria, renal, gastrointestinal o neurológica), con características adicionales24Puede incluir diagnóstico de EK completa o incompletaY exclusión de otras causas infecciosas, incluyendo sepsis bacteriana, shock tóxico estreptocócico o estafilocócico e infecciones asociadas a miocarditis como enterovirusLa RT-PCR para SARS-CoV-2 puede ser positiva o negativa | Paciente <21 años con fiebre ≥ 24 hY evidencia de enfermedad grave que requiera hospitalización, con afectación multiorgánica (>2) (cardíaca, respiratoria, hematológica, gastrointestinal, dermatológica o neurológica) y con signos de respuesta inflamatoria, elevación de más de 2 de los siguientes: PCR, VSG, fibrinógeno, PCT, dímero D, ferritina, LDH o IL-6, neutrofilia, linfopenia o descenso de la cifra de albúminaY exclusión de otros diagnósticos alternativosY evidencia de COVID-19 reciente o actual (RT-PCR, pruebas antigénicas o serología positivas) o con contacto con caso de COVID-19 en las últimas 4 semanasRecomienda que los pacientes que cumplan criterios de EK total o parcialmente se consideren como SIM-PedS si cumplen la definición. Y considerar el SIM-PedS en los pacientes pediátricos fallecidos con evidencia de infección por SARS-CoV-2 |
EK: enfermedad de Kawasaki; IL-6: interleucina 6; PCR: proteína C reactiva; PCT: procalcitonina; SST: síndrome de shock tóxico; TP: tiempo de protrombina; TTPa: tiempo de tromboplastina parcial activada; VSG: velocidad de sedimentación globular.
Como se comentaba previamente, el SIM-PedS es un síndrome descrito en relación con la COVID-19, por lo que esta nueva enfermedad debe considerarse en áreas con alta incidencia actual o reciente de COVID-19. A diferencia de la COVID-19 del adulto que presenta inicialmente síntomas respiratorios y neumonía, el SIM-PedS se manifiesta típicamente con daño multiorgánico, afectando predominantemente al sistema cardiovascular. El comienzo del SIM-PedS se caracteriza por fiebre persistente, que a menudo se asocia a debilidad y síntomas gastrointestinales. Menos frecuentemente los pacientes pueden presentar también erupción cutánea, conjuntivitis y otras manifestaciones mucocutáneas.
Se ha descrito que algunos pacientes pediátricos afectados pueden mostrar un empeoramiento rápido con aparición de hipotensión, shock cardiogénico y daño multiorgánico. El lapso entre los primeros síntomas y estas manifestaciones cardiovasculares graves es de aproximadamente una semana12–15,18,27.
Dada la similitud entre las diversas formas de la EK y el SIM-PedS, y el contexto de pandemia en el que nos encontramos, se recomienda que en los pacientes que cumplan criterios de las diversas variantes de la EK (clásica o completa, incompleta o EK con shock) se considere valorar el posible diagnóstico de SIM-PedS18,28,29. A modo de breve recordatorio, la EK es una enfermedad sistémica autoinmunitaria caracterizada por una inflamación sistémica de las arterias de mediano calibre durante la fase febril aguda, suele afectar a niños menores de 5 años, siendo un hallazgo predominante y característico la aparición de dilatación o aneurismas coronarios28.
Los hallazgos analíticos característicos del SIM-PedS consisten en elevación de marcadores inflamatorios (PCR, VSG, ferritina, fibrinógeno, LDH, IL-6), disfunción cardíaca (NT-Pro-BNP, enzimas), dímero D y transaminasas; hiponatremia e hipoalbuminemia12,16,18. Los cuadros clínicos que podrían ser compatibles y el diagnóstico diferencial propuestos por la AEP se recogen en la tabla 2.
Cuadros clínicos compatibles con SIM-PedS y diagnóstico diferencial propuesto por la Asociación Española de Pediatría en su documento de consenso18
| Cuadros clínicos compatibles con SIM-PedS | Diagnóstico diferencial |
|---|---|
| 1. Cuadro clínico compatible con miocarditis, shock séptico o shock tóxico2. Cuadro clínico compatible con EK completa/incompleta3. Fiebre y dolor abdominal o exantema o conjuntivitis, con alteración analítica (reactantes de fase aguda muy elevados, alteración de enzimas cardíacas) | 1. Sepsis de causa bacteriana2. Otras infecciones víricas (adenovirus, enterovirus, sarampión en población no inmunizada)3. Abdomen agudo simulando peritonitis/apendicitis4. Síndrome de shock tóxico estreptocócico o estafilocócico5. Miocarditis por otros microorganismos6. EK no relacionada con SARS-CoV-27. Reacción de hipersensibilidad a fármacos (síndrome de Stevens Johnson)8. Otras enfermedades reumatológicas sistémicas (artritis idiopática juvenil sistémica y otras enfermedades autoinflamatorias o autoinmunitarias)9. Linfohistiocitosis hemofagocíticas primarias o secundarias (síndrome de activación macrofágica) |
EK: enfermedad de Kawasaki; SIM-PedS: síndrome inflamatorio multisistémico pediátrico vinculado a SARS-CoV-2.
Dado que la mayoría de los pacientes tienen infección previa por SARS-CoV-2, se ha planteado que el SIM-PedS afectaría a niños con una susceptibilidad genética de base, aún no caracterizada27,30, responsable de una respuesta inmunitaria retardada al virus (tanto no específica como adaptativa), en la que las citoquinas tendrían un papel importante12,13,16,20,31. Algunos autores han descrito que los hallazgos de los pacientes con SIM-PedS coinciden con la tormenta de citoquinas, la hiperinflamación y el daño multiorgánico que se observan en la fase final de los adultos con COVID-19 grave13,31. Así pues, los anticuerpos del SARS-CoV-2 serían los responsables de provocar el síndrome14, siendo predominantes los pacientes con anticuerpos IgG positivos e IgM negativos, y en menor proporción tanto con IgG como con IgM positivos17,32.
Se han descrito casos de pacientes afectados desde menos de 1 año hasta los 20 años de edad, aunque predomina en niños de entre 7,3 y 10 años13,14,32–34. Algunos estudios han documentado mayor frecuencia de la enfermedad en varones, mientras que otros muestran igual afectación en ambos sexos, no existiendo tampoco un predominio claro en unas razas u otras13,14,16,33, ni evidencia de que la obesidad o el asma sean factores de riesgo, pese a los resultados de varios estudios12,14,16.
Hallazgos radiológicosLos hallazgos radiológicos más frecuentes en las exploraciones de radiografía, ecografía o tomografía computarizada (TC) en pacientes diagnosticados de SIM-PedS son: cardiomegalia, derrame pleural y atelectasias pasivas, variando la incidencia de estos hallazgos en función de la técnica de imagen utilizada12,16,27.
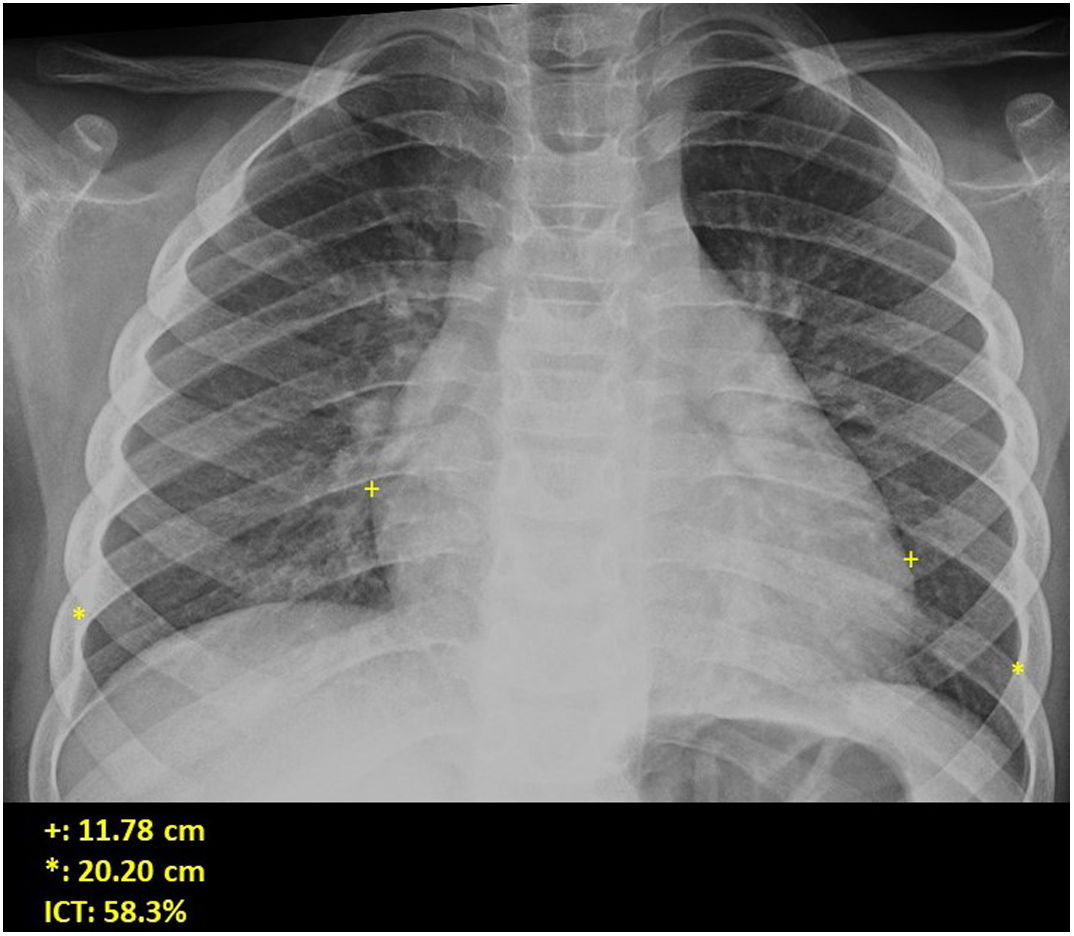
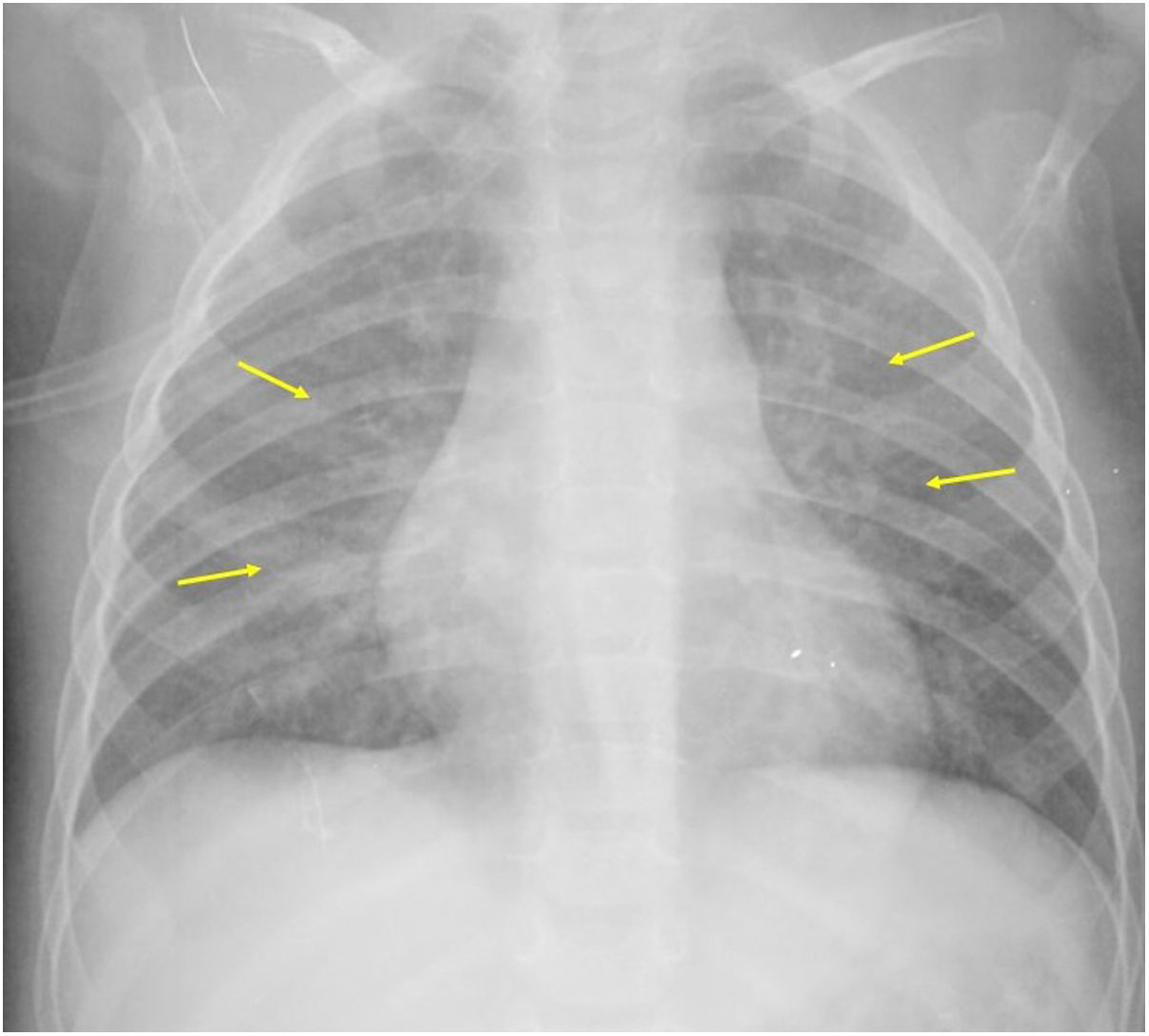
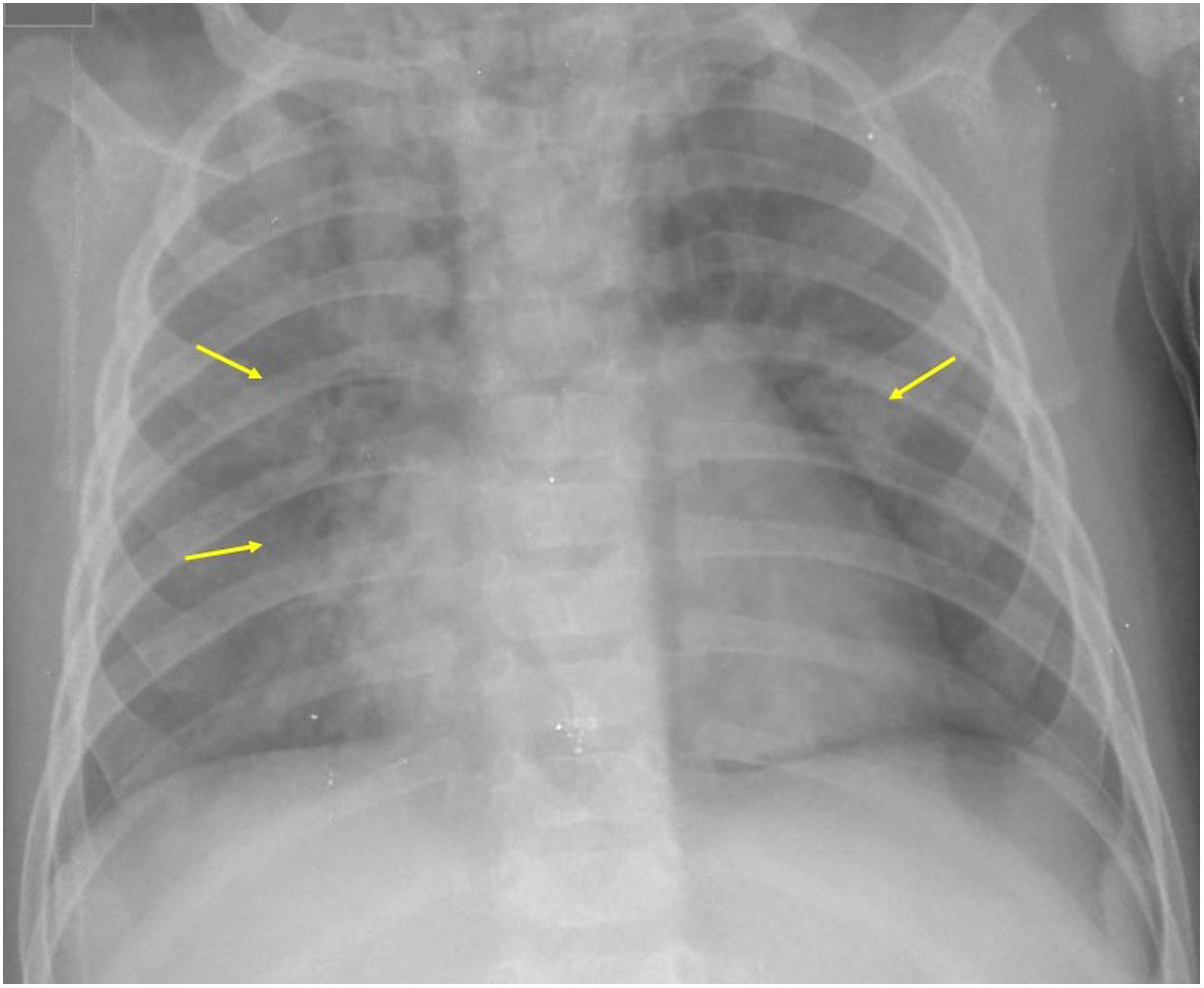
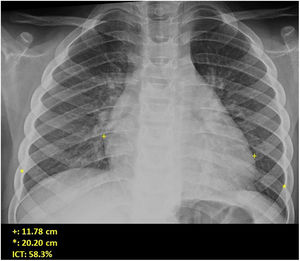
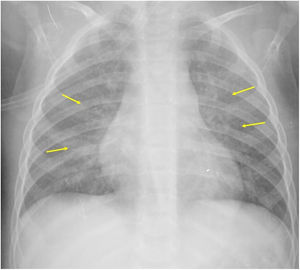
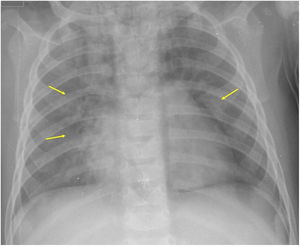
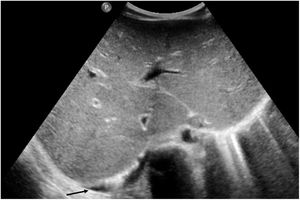
Si se analizan los hallazgos según la técnica de imagen empleada, en la radiografía de tórax puede observarse: cardiomegalia (43-62,5%) (fig. 1), signos de insuficiencia cardíaca congestiva como engrosamiento peribronquial y patrón intersticial perihiliar (34-56%) (figs. 1 y 2), con rápida aparición de consolidaciones perihiliares por edema pulmonar cardiogénico (31-56%) (fig. 3), opacidades basales por atelectasia pasiva (20-56%) y derrame pleural (11-44%). Menos frecuentemente se observan áreas confluentes de opacidad en vidrio deslustrado y consolidaciones por síndrome del distrés respiratorio agudo (SDRA), que pueden ser asimétricas, y consolidaciones bibasales correspondientes a neumonía12,19.
Varios autores han planteado que estos hallazgos son consecuencia del fallo cardíaco, la hipoalbuminemia, la sobrecarga de fluidos o una combinación de todo ello19. No obstante, hay que tener en cuenta que la radiografía torácica inicial puede ser normal hasta en el 44-46% de los casos12,19. Hallazgos similares se han descrito también en la EK, atribuibles, según la teoría más aceptada, a la arteritis pulmonar y/o la inflamación del tracto respiratorio inferior35.
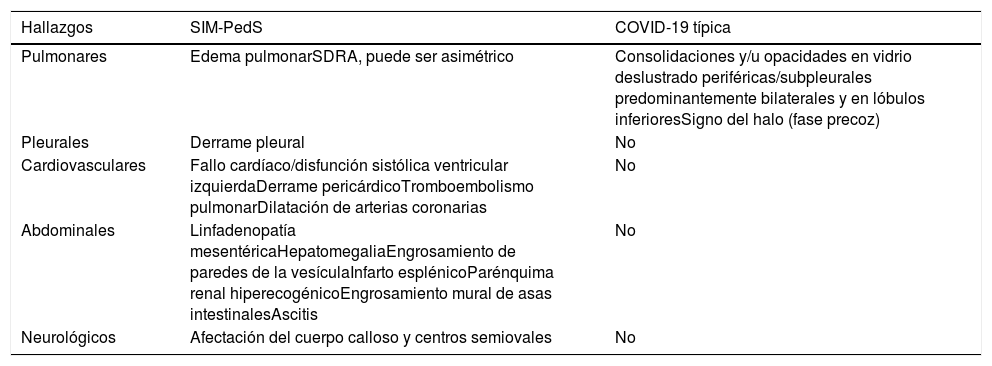
Entre estos hallazgos torácicos cabe destacar la incidencia mucho menor de consolidaciones correspondientes a neumonía en pacientes con SIM-PedS respecto a pacientes con COVID-19, tanto adultos como pediátricos. Las opacidades en vidrio deslustrado extensas son también menos habituales y de distribución atípica respecto a las características de la COVID-19, que predominan en localización periférica12,36–38, por lo que en los pacientes con SIM-PedS estas opacidades en vidrio deslustrado son más sugestivas de corresponder a edema pulmonar19. Las diferencias entre las manifestaciones torácicas descritas en el SIM-PedS y en la COVID-19 en pacientes pediátricos figuran en la tabla 3.
Diferencias entre los hallazgos en las pruebas de imagen del SIM-PedS y los típicos de la COVID-19 pediátrica27
| Hallazgos | SIM-PedS | COVID-19 típica |
|---|---|---|
| Pulmonares | Edema pulmonarSDRA, puede ser asimétrico | Consolidaciones y/u opacidades en vidrio deslustrado periféricas/subpleurales predominantemente bilaterales y en lóbulos inferioresSigno del halo (fase precoz) |
| Pleurales | Derrame pleural | No |
| Cardiovasculares | Fallo cardíaco/disfunción sistólica ventricular izquierdaDerrame pericárdicoTromboembolismo pulmonarDilatación de arterias coronarias | No |
| Abdominales | Linfadenopatía mesentéricaHepatomegaliaEngrosamiento de paredes de la vesículaInfarto esplénicoParénquima renal hiperecogénicoEngrosamiento mural de asas intestinalesAscitis | No |
| Neurológicos | Afectación del cuerpo calloso y centros semiovales | No |
SDRA: síndrome del distrés respiratorio agudo; SIM-PedS: síndrome inflamatorio multisistémico pediátrico vinculado a SARS-CoV-2.
La ecografía pulmonar es una técnica de imagen interesante para el estudio de los pacientes pediátricos con COVID-19 y SIM-PedS, dada su disponibilidad, movilidad hasta las UCI pediátricas sin necesidad de trasladar al paciente, en ocasiones inestable, y seguridad por la ausencia de radiación ionizante. Los hallazgos ecográficos pulmonares son similares a los descritos en pacientes adultos con COVID-1939,40. Se han descrito patrones de neumonía, aumento del agua pulmonar o derrame pleural con líneas B en los segmentos pulmonares inferiores y posteriores, que pueden ir aumentando (síndrome intersticial ecográfico difuso), consolidaciones subpleurales, engrosamiento y desflecamiento de la línea pleural, así como derrame pleural en variable cuantía en los senos costofrénicos. La neumonía establecida muestra imágenes de consolidación con broncograma aéreo, especialmente en bases y segmentos posteriores pulmonares18,39,40.
No se recomienda la realización de TC torácica de forma rutinaria18. En varios trabajos se realizó TC, bien con protocolo de angio-TC pulmonar por sospecha de tromboembolismo pulmonar (TEP)12 o menos frecuentemente por existencia de sepsis o fiebre de causa desconocida19, mientras que en el trabajo de Hameed y colaboradores se optó por realizar TC de arterias coronarias al 80% de los pacientes para descartar afectación coronaria, dada la similitud de este síndrome con la EK que ocasiona dilatación y aneurismas coronarios. En este estudio se incluyó la mayor parte del parénquima pulmonar (excluyendo únicamente los extremos apicales y basales)19.
En el trabajo de Blumfield en el que se realizó angio-TC pulmonar, se identificó TEP segmentario en el 25% de los niños, sin signos de sobrecarga ventricular derecha ni infartos pulmonares12. Esta incidencia de TEP es similar a la observada en adultos con COVID-19, que según diferentes estudios oscila entre el 22% y el 30%41–44.
Algunos autores han sugerido que el estado hiperinflamatorio que caracteriza al SIM-PedS, con elevación de marcadores inflamatorios como fibrinógeno, dímero D, ferritina e IL-6, podría predisponer a una coagulopatía protrombótica y complicaciones tromboembólicas, incluido el TEP, de forma similar a lo observado en los últimos estadios de mayor gravedad de la COVID-19 de los adultos13,31,44. Sin embargo, la importancia clínica del TEP segmentario no está clara, ya que algunos investigadores han demostrado que no existen diferencias significativas en la necesidad de ingreso en UCI, intubación o duración de la intubación entre los pacientes adultos COVID-19 que desarrollan TEP segmentario y los que no lo hacen44.
En el trabajo de Hameed y colaboradores, ya comentado y en el que se realizó TC para el estudio de las arterias coronarias, no se detectó TEP incidental pese a que todos los pacientes tenían cifras elevadas de dímero D19.
Los hallazgos más frecuentemente observados en el parénquima pulmonar mediante TC fueron: las atelectasias de lóbulos inferiores (50%)12, la asociación de consolidaciones y atelectasias (39%), las opacidades en vidrio deslustrado asociadas a consolidaciones parcheadas (9%) y solamente se ha descrito un paciente con pequeños focos de consolidaciones con halo periférico en vidrio deslustrado19, hallazgo que se considera típico de la COVID-19 y más frecuentemente descrito en niños37. Se ha sugerido la posibilidad de que estos hallazgos puedan ser secundarios a una vasculitis similar a la de la EK19. El derrame pleural se observó en el 17-30% de los casos. La presencia de adenopatías hiliares de tamaño significativo detectadas por TC varía entre un 0% y un 15% según varios trabajos12,19 y no se han identificado alteraciones tímicas19.
Las alteraciones cardiológicas más frecuentes son las propias del fallo cardíaco (en algunas series se describen hasta en el 51% de los casos)19, con miocarditis aguda que suele manifestarse una semana después de la aparición de la fiebre y los síntomas gastrointestinales17. En la ecocardiografía, el hallazgo más frecuente es la disfunción sistólica ventricular izquierda, observada en varios estudios entre el 25% y el 63% de los casos12,13,16,27. En el 71% de estos pacientes se describen fracciones de eyección entre el 30% y el 50%, y fracciones menores del 30% en un 28% de los casos16. Otros hallazgos detectados por ecocardiografía son la dilatación de las arterias coronarias observada entre el 17% y el 25% y el derrame pericárdico entre el 9% y el 40%12,14,16,17, así como signos de pancarditis e insuficiencia mitral17,19. Una posible causa de la variabilidad en la detección de anomalías coronarias en los diferentes estudios es la distinta técnica de imagen utilizada para su detección: ecografía, TC o resonancia magnética (RM), de manera que en los trabajos en los que se realizó TC de arterias coronarias se detectaron aneurismas en el 20% de los pacientes19, mientras que por RM no se detectaron17.
En la RM cardiaca se pueden observar signos de hiperemia y edema miocárdico difuso en T2 y en el mapa de T1 nativo, sin asociar realce tardío de gadolinio que sugiera sustitución fibrótica o necrosis focal17. Estos datos sugieren que la afectación cardiovascular del SIM-PedS es más agresiva que la observada en la EK13,14,19,20 y más frecuente que en la COVID-19, a pesar de que también se ha descrito en la infección aguda grave por SARS-CoV-2, tanto en adultos como en niños, con desarrollo de daño miocárdico y fallo cardíaco17,45,46. La explicación de estos hallazgos más aceptada es que la miocarditis vírica ocasiona daño por infiltración vírica y respuesta inmunitaria a la misma47,48, mientras que la miocarditis posinfecciosa relacionada con el SIM-PedS correspondería a una infiltración inflamatoria del intersticio miocárdico en respuesta a la cascada inmunológica desencadenada frente a un antígeno y no frente al propio SARS-CoV-217. En ella tendrían un importante papel las citoquinas (síndrome de la tormenta de citoquinas)49, de forma similar a lo que ocurre en la EK, en la que los análisis histopatológicos de corazones muestran un predominio de infiltración por macrófagos y neutrófilos en el intersticio miocárdico con escasa degeneración celular miocárdica o necrosis50. La recuperación relativamente rápida de la función cardíaca que muestran los pacientes tras recibir el tratamiento correcto, con normalización de la señal en RM, apoya la teoría anteriormente expuesta y por la que varios investigadores sugieren que la disfunción sistólica ventricular se debería más a un aturdimiento miocárdico o edema que a daño miocárdico16,17.
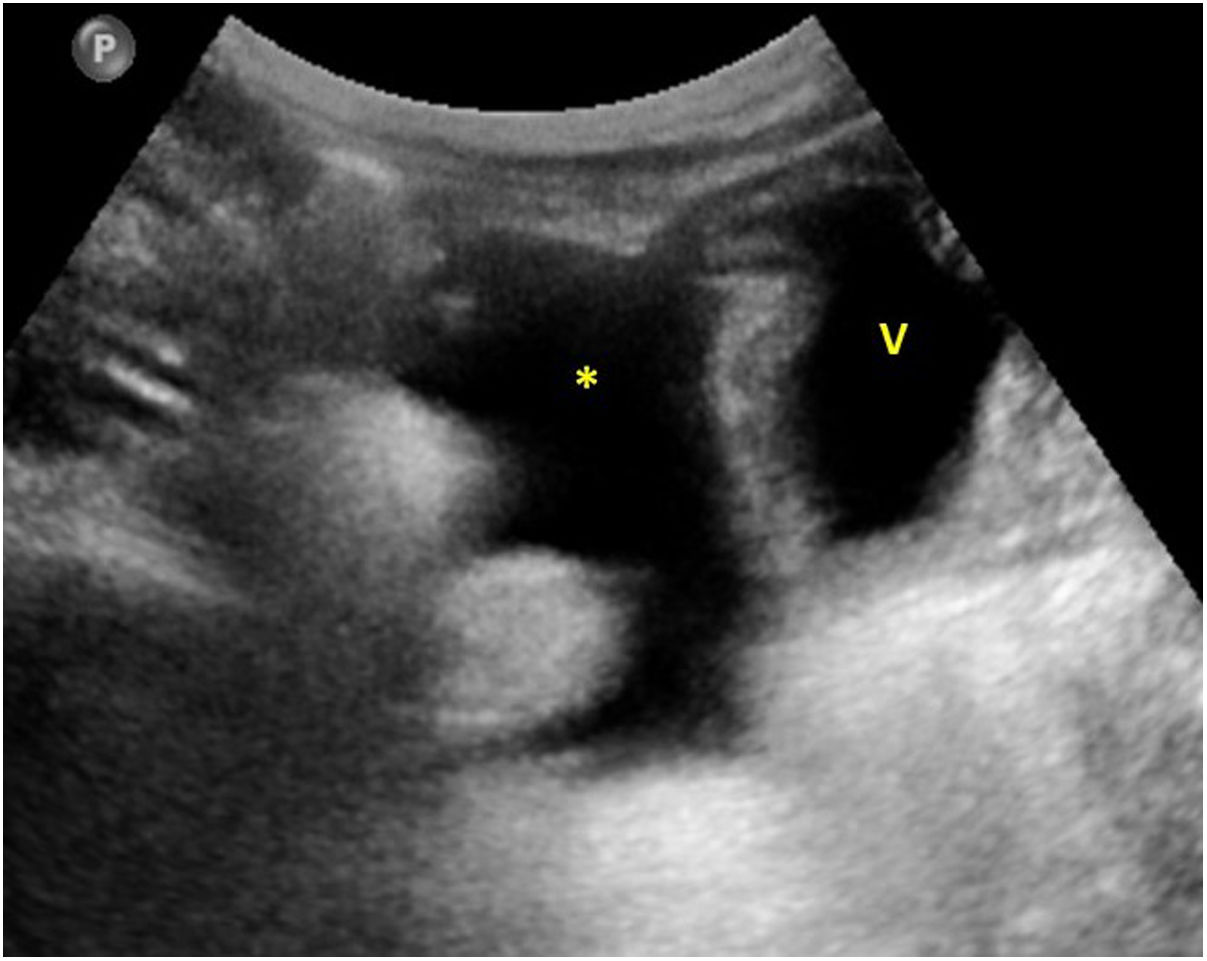
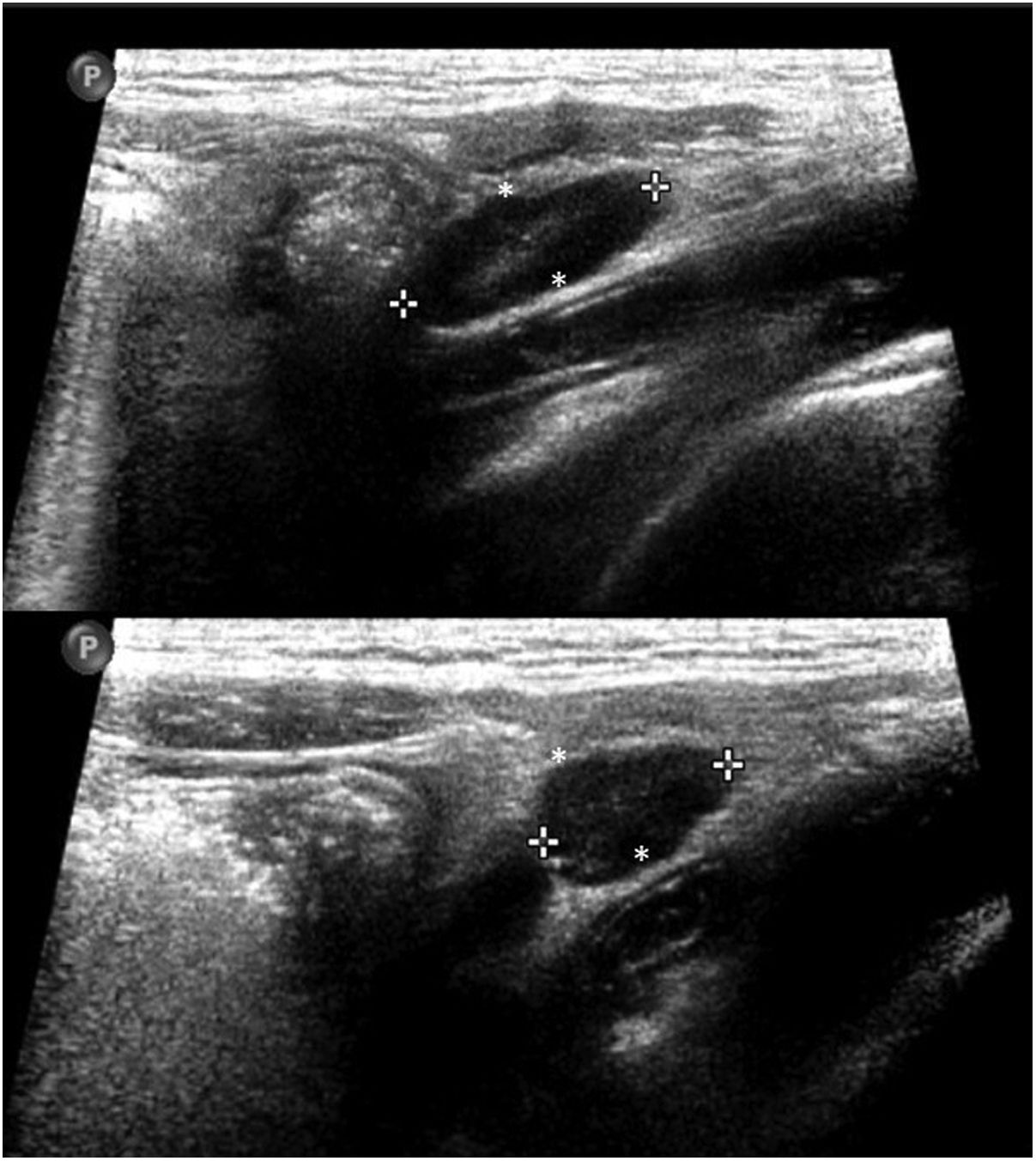
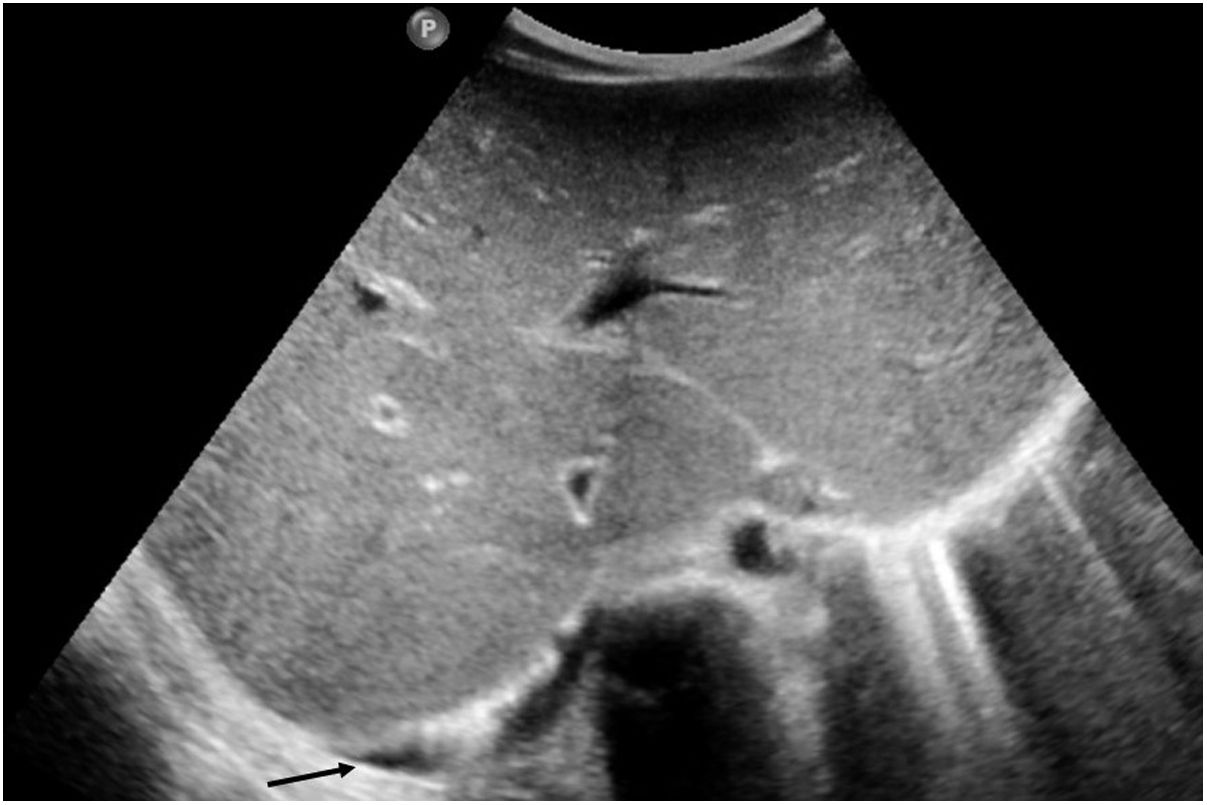
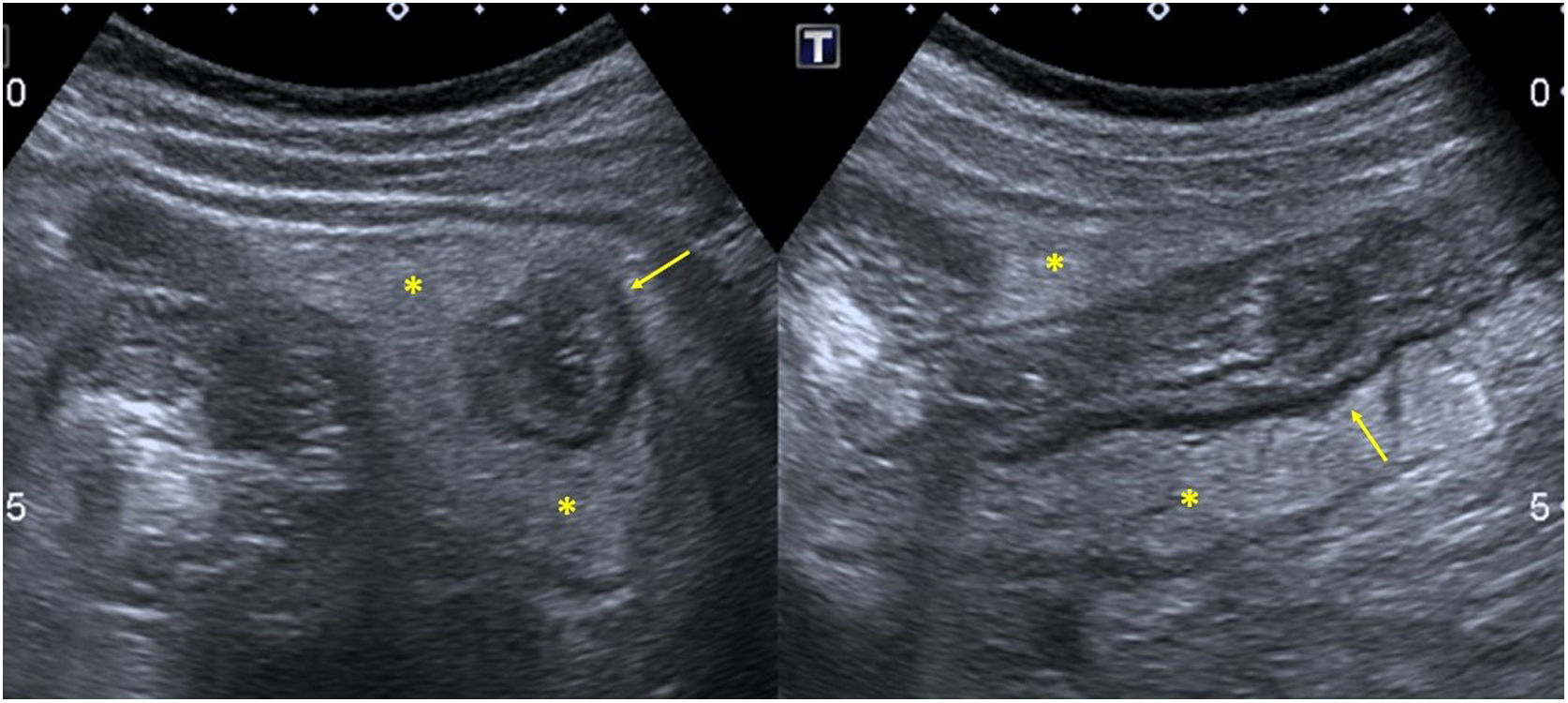
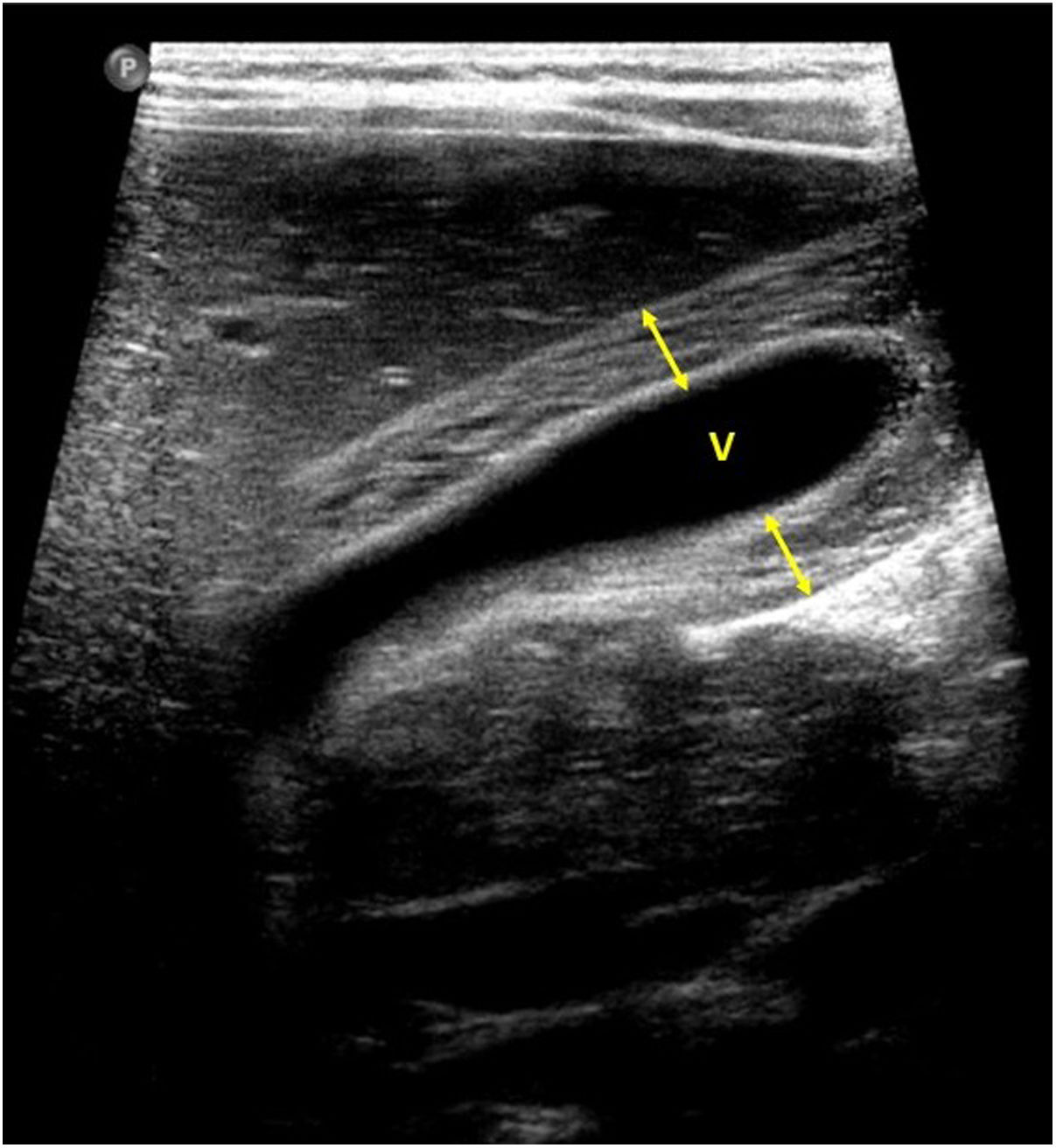
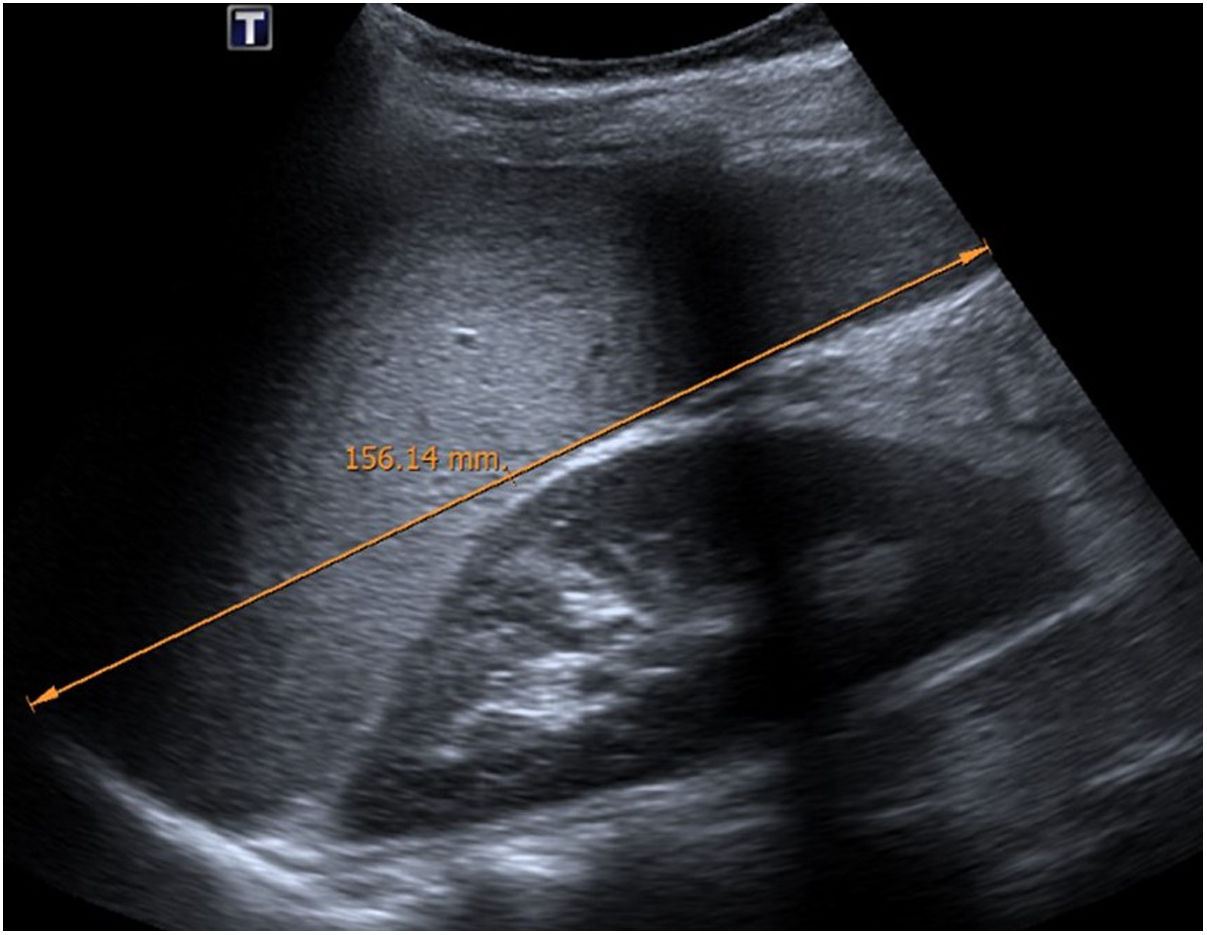
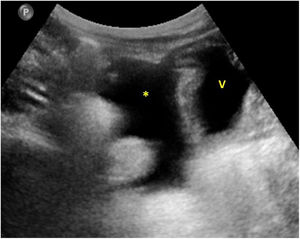
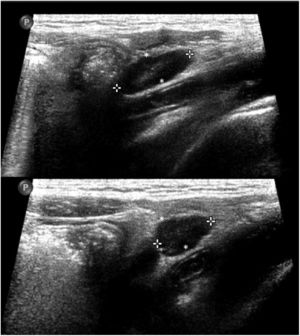
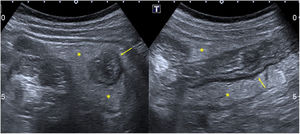
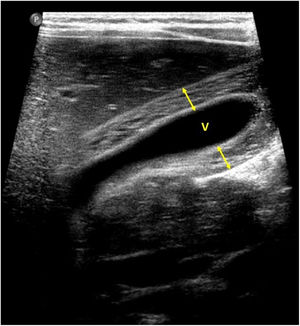
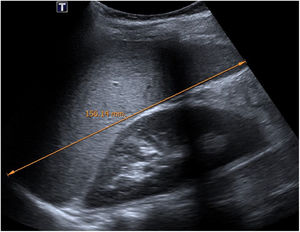
En cuanto a la afectación abdominal, los hallazgos más frecuentemente observados en la ecografía son: ascitis (38-53%) (fig. 4), cambios inflamatorios en la fosa ilíaca derecha (FID) con adenopatías de morfología similar a las observadas en la adenitis mesentérica (13-47%) (fig. 5), hepatomegalia (10-38%) (fig. 6), aumento de la ecogenicidad del parénquima cortical renal (5-31%), engrosamiento parietal intestinal (19-21%) (fig. 7) sobre todo del íleon distal y en segundo lugar del ciego, aumento de la ecogenicidad periportal (16%), edema perivesicular y engrosamiento de las paredes de la vesícula biliar (16-19%) (fig. 8), barro biliar (16%), infartos esplénicos (10%), esplenomegalia (6%) (fig. 9) y engrosamiento de las paredes de la vejiga (6%)12,14,16,19.
Se ha propuesto la hipótesis de que los síntomas gastrointestinales puedan explicarse por la linfadenopatía mesentérica27 y por la isquemia parietal intestinal secundaria a la vasculitis, a la vez que el fallo cardíaco y/o shock contribuirían al engrosamiento de las paredes ileocecales al ser la arteria ileocólica la rama más distal de la arteria mesentérica superior19. Una de las teorías propuestas para explicar la fisiopatología de la linfadenitis mesentérica es que sea secundaria a hiperplasia linfoide51. La FID estaría más frecuentemente afectada por su abundante tejido linfático y por la presencia de las placas de Peyer en el íleon distal. En esta línea, los casos de adenitis mesentérica observados corresponderían a los pacientes descritos con SIM-PedS que presentaron cuadros simuladores de apendicitis aguda52.
En pacientes con síntomas gastrointestinales y estudios ecográficos no concluyentes, en los que no se han podido excluir apendicitis o colecciones intraabdominales, en función de la sospecha clínica puede optarse por realizar TC abdominal preferiblemente con administración de contraste intravenoso18,19, siendo más dudoso el beneficio que puede aportar el uso de contraste oral. En los casos en los que se realizó TC se observó: ascitis (80%), cambios inflamatorios en FID con aumento de la atenuación de la grasa y adenopatías (60%), edema periportal y perivesicular (40%), engrosamiento de la pared intestinal (20%) e infarto esplénico (20%)19. El infarto esplénico se ha descrito en pacientes con EK y otras vasculitis inflamatorias, por lo que en el SIM-PedS también se atribuye a la inflamación de la arteria esplénica19,53. La diferencia en su detección, 10% de los pacientes mediante ecografía abdominal y hasta en el 20% de los casos en los que se realizó TC, podría justificar la realización de TC únicamente si se sospecha infarto esplénico masivo o complicado (abscesos, hemorragia o rotura) que necesitaría un manejo terapéutico diferente18,54 y que no ha sido descrito en los casos de SIM-PedS19. Se sugiere además que la ascitis, el engrosamiento de las paredes vesiculares, el edema periportal y perivesicular sean secundarios a la inflamación sistémica, hipoalbuminemia, serositis, sobrecarga de fluidos y/o fallo cardíaco19.
En los pacientes con SIM-PedS a los que se les realizan pruebas de imagen por presentar manifestaciones neurológicas se han observado alteraciones en el esplenio y la rodilla del cuerpo calloso y en los centros semiovales, con hipodensidad en la TC, y en la RM hiperintesidad en T2 y restricción en difusión en el 75% de los casos55. Aunque otros investigadores han informado de que no se observaron hallazgos patológicos en TC ni RM19. Dada la similitud con la EK, sigue siendo una posibilidad el desarrollo de infarto isquémico como complicación de una vasculitis, y también se ha descrito como una complicación de los pacientes con COVID-19 que reciben tratamiento con inmunoglobulinas intravenosas56.
Evolución y pronósticoLos pacientes con SIM-PedS pueden desarrollar shock cardiogénico y requerir ingreso en UCI pediátricas, con una estancia media de entre 4 y 7 días. En este grupo, entre el 80% y el 100% necesitarán apoyo inótropo/vasopresor, y hasta un 66-88% ventilación mecánica para conseguir una estabilización cardiovascular14,16,33. Aproximadamente un 25% de los pacientes que presenten fallo cardíaco necesitarán ventilación mecánica con sistema de oxigenación por membrana extracorpórea (ECMO)16,34. A pesar de esto, una amplia mayoría de los pacientes mejora clínicamente con el tratamiento adecuado tras un correcto diagnóstico, y la respuesta de la disfunción cardíaca al tratamiento con inmunoglobulinas intravenosas se ha mostrado muy satisfactoria, con una recuperación completa de la función ventricular en el 71% de los pacientes16,17. Esta recuperación de la función cardíaca apoya la teoría de que el fallo cardíaco no se produce por daño miocárdico como en los adultos con COVID-19. Aunque no se han descrito secuelas pulmonares ni neurológicas, se necesitan más estudios para evaluar las posibles secuelas a largo plazo que este síndrome podría ocasionar12,16,55.
LimitacionesLos estudios publicados hasta la realización de este trabajo tienen limitaciones. La más importante, el reducido número de pacientes pediátricos presentados en muchos de ellos, por lo que generalizar los resultados puede conducir a error. Las manifestaciones clínicas de este síndrome tienen una gravedad muy variable, y en los estudios publicados puede haber una representación en exceso de los casos más graves32. Futuros estudios necesitarían incluir un mayor número de pacientes y ser idealmente multicéntricos para poder correlacionar los hallazgos radiológicos con el complejo curso clínico de estos pacientes, precisar su especificidad y la patogénesis subyacente19,57.
ConclusionesEl SIM-PedS es un síndrome inflamatorio multisistémico posviral en el que los pacientes se presentan con fiebre alta sostenida, síntomas gastrointestinales y mucocutáneos, con una rápida progresión a shock cardiogénico y daño multisistémico12–15. Dado que la manifestación clínica del SIM-PedS no es específica, las pruebas de imagen tienen un papel muy importante en su diagnóstico12, y los hallazgos radiológicos se correlacionan correctamente con la presentación clínica del SIM-PedS y con los datos analíticos. Los síntomas gastrointestinales, que incluyen dolor abdominal, vómitos y diarrea, son probablemente un reflejo del compromiso multiorgánico del SIM-PedS16. En este grupo de pacientes, la ecografía abdominal puede ser la primera técnica de imagen solicitada, orientada para excluir apendicitis u otra patología abdominal aguda12. Aunque los hallazgos de imagen tampoco son específicos y la radiografía de tórax inicial es con frecuencia normal, la presencia de hepatomegalia, riñones hiperecogénicos, ascitis, derrame pleural, engrosamiento de las paredes intestinales, de la vesícula o adenopatías mesentéricas, en pacientes con historia previa de exposición a SARS-CoV-2, debe alertar a los radiólogos para sugerir el diagnóstico de SIM-PedS, ya que los pacientes pueden empeorar rápidamente12. Tanto los radiólogos pediátricos como los no pediátricos deben conocer y sospechar este síndrome dado que se han descrito casos en jóvenes entre 15 y 20 años.
Aunque muchos niños con SIM-PedS están gravemente enfermos y requieren ingreso en UCI pediátrica, una gran mayoría mejora clínicamente con tratamiento adecuado tras el diagnóstico correcto. Sin embargo, las posibles secuelas a largo plazo de este síndrome están aún por determinar12.
Autoría- 1.
Responsable de la integridad del estudio: RSO, MLFB, EGM.
- 2.
Concepción del estudio: RSO, MLFB.
- 3.
Diseño del estudio: RSO, MLFB, EGM, MÁEP, EMAM.
- 4.
Obtención de los datos: N/A.
- 5.
Análisis e interpretación de los datos: N/A.
- 6.
Tratamiento estadístico: N/A.
- 7.
Búsqueda bibliográfica: RSO, EGM, MÁEP, EMAM.
- 8.
Redacción del trabajo: RSO, MLFB, EGM, MÁEP, EMAM.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: RSO, MLFB, EGM, MÁEP, EMAM.
- 10.
Aprobación de la versión final: RSO, MLFB, EGM, MÁEP, EMAM.
Los autores declaran no tener ningún conflicto de intereses
Los autores queremos mostrar nuestro agradecimiento a los Dres. J. Torres Nuez, G. Martínez Sanz, S.P. Alandete Germán, M.A. Meseguer Ripollés y L. Oro.