Los pacientes con COVID-19 presentan una evolución muy variable: desde enfermos con síntomas leves de corta duración a pacientes con enfermedad grave que desarrollan un síndrome de distrés respiratorio agudo, con ingresos prolongados en unidades de críticos. Desde el punto de vista radiológico, la etapa inicial se caracteriza por una neumonía viral poco expresiva. No obstante, en algunos pacientes, con el inicio de la respuesta inmunitaria se produce un daño pulmonar agudo con patrones radiológicos de neumonía organizada y daño alveolar difuso.
La enfermedad moderada-grave se asocia con una incidencia alta de tromboembolismo pulmonar, generalmente de distribución periférica y asociado al daño endotelial, encamamiento prolongado y coagulopatía de la enfermedad. Otras complicaciones relativamente frecuentes son: el neumotórax y el neumomediastino espontáneos por rotura de paredes alveolares, y el barotrauma en pacientes con ventilación mecánica. La sobreinfección es más frecuente en pacientes graves, generalmente de origen bacteriano y menos frecuente fúngico.
Outcomes vary widely in patients with COVID-19. Whereas some patients have only mild symptoms of short duration, others develop severe disease that leads to acute respiratory distress syndrome requiring prolonged stays in intensive care units. Radiologically, the initial stage is characterized by viral pneumonia with mild expression. In some patients, however, the onset of the immune response results in acute lung damage with organizing pneumonia and diffuse alveolar damage.
Moderate-severe disease is associated with a high incidence of pulmonary embolisms, generally peripherally distributed and associated with endothelial damage, prolonged stays in bed, and coagulopathy. Other relatively common complications are spontaneous pneumothorax and pneumomediastinum due to the rupture of alveolar walls and barotrauma in mechanically ventilated patients. Superinfection, generally bacterial and less commonly fungal, is more common in patients with severe disease.
El espectro clínico de los pacientes infectados por SARS-CoV-2 varía desde sujetos asintomáticos, con afectación clínica leve, hasta enfermos con hipoxemia grave e infiltrados pulmonares característicos que pueden evolucionar a síndrome de distrés respiratorio agudo (SDRA). La mayoría de las personas con COVID-19 con una presentación clínica leve no requieren inicialmente hospitalización, y muchos pacientes podrán controlar su enfermedad en casa1.
Los pacientes con COVID-19 y una enfermedad grave requerirán hospitalización para su manejo, con tratamiento de apoyo de las complicaciones más comunes de la COVID-19 grave: la insuficiencia respiratoria hipoxémica, la lesión renal aguda y las complicaciones de la hospitalización prolongada, como la hemorragia gastrointestinal y la polineuropatía/miopatía de la enfermedad crítica. De manera específica, comentaremos las complicaciones torácicas más frecuentes, como el tromboembolismo pulmonar, el neumotórax y el neumomediastino, las infecciones secundarias, el barotrauma y las miopericardiopatías2.
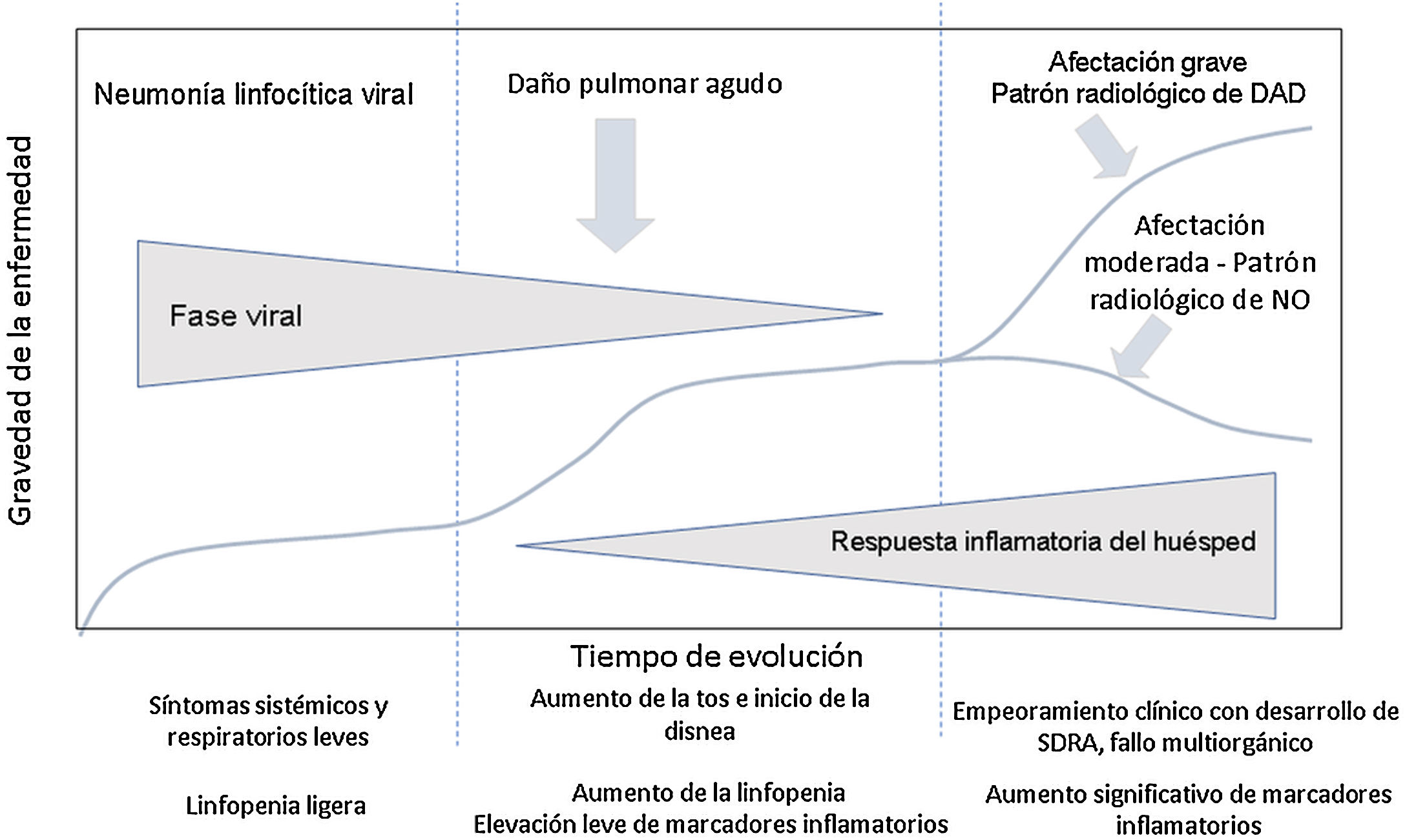
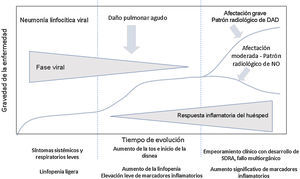
Evolución clínica de los pacientes con infección por SARS-CoV-2. Parámetros analíticosEn la evolución clínica y analítica de los pacientes con COVID-19 se ha descrito la existencia de tres fases de la enfermedad, superpuestas entre sí y condicionadas por dos sustratos patológicos diferentes3 (fig. 1).
Evolución de los pacientes con COVID-19. La fase inicial se caracteriza por una neumonía linfocítica viral con síntomas leves. Los pacientes con afectación moderada presentan en las pruebas de imagen un patrón radiológico de neumonía organizada. Los pacientes que desarrollan enfermedad grave presentan un síndrome de distrés respiratorio y radiológicamente un patrón de daño alveolar difuso. Adaptada de Siddiqi et al.3.
En la fase inicial-infección precoz, las manifestaciones clínicas son secundarias al virus en sí mismo, con síntomas sistémicos y respiratorios leves. Durante este período, el virus se replica y se une a los receptores de la enzima convertidora de la angiotensina II (ECA-II)4, que se localizan en mayor cuantía en el epitelio pulmonar y el endotelio vascular. Suele haber linfopenia ligera, sin otras anomalías analíticas. La mayoría de los pacientes presentan únicamente esta fase de la enfermedad3, y justifica que alrededor del 80% de los casos de infección presenten síntomas leves5.
En algunos casos, a la fase inicial le sigue una fase intermedia, en la que se inicia la respuesta inmunitaria del huésped. Comienza la inflamación pulmonar y se desarrolla una neumonía viral con tos y disnea. El tiempo medio desde los primeros síntomas hasta el inicio de la disnea es de 5-8 días6,7. En esta fase suele producirse el ingreso hospitalario, requerido en el 14% de los pacientes8. El tiempo medio entre el inicio de los síntomas y la hospitalización es de 7 días6.
El factor de riesgo más importante para el ingreso hospitalario es una edad superior a los 65 años. Otros factores de riesgo son las enfermedades cardiovasculares, el sexo masculino, la obesidad, la diabetes y la enfermedad renal crónica8,9.
Durante esta fase intermedia, se identifica un aumento de la linfopenia3, con un recuento linfocitario menor de 1500/μL en el 90% de los pacientes10. Otros hallazgos analíticos frecuentes son la trombocitopenia, la prolongación del tiempo de protrombina, el aumento de enzimas hepáticas y la elevación leve de marcadores inflamatorios sistémicos3, con aumento de la enzima lactato deshidrogenasa, la ferritina, la proteína C reactiva y la velocidad de sedimentación globular6,10.
La fase tardía o grave se caracteriza por un síndrome de hiperinflamación sistémica3,7, con marcada afectación pulmonar y mal pronóstico. Así, de los pacientes ingresados, hasta un 26% puede requerir ingreso en unidades de cuidados intensivos y ventilación mecánica invasiva6,8,9,11. Un 5% de los casos presentan enfermedad crítica, con SDRA, shock o disfunción multiorgánica12.
El SDRA es la mayor complicación en pacientes con enfermedad grave11 y la principal causa de ingreso en unidades de cuidados intensivos en el 61% de los casos6. En esta fase, los marcadores de inflamación sistémica se encuentran muy elevados, incluidas las citoquinas proinflamatorias, la proteína C reactiva, la ferritina y el dímero D3,7. Puede observarse también elevación de troponinas9. La disminución progresiva del recuento linfocitario, el aumento progresivo del dímero D y el deterioro de la función renal se asocian a mayor mortalidad6. Los pacientes que requieren ventilación mecánica invasiva presentan una alta mortalidad, entre el 60% y el 88%9–11.
Evolución radiológica de los pacientes con infección por SARS-CoV-2La evolución radiológica de los pacientes con COVID-19 se puede clasificar en tres fases/grados de afectación (tabla 1).
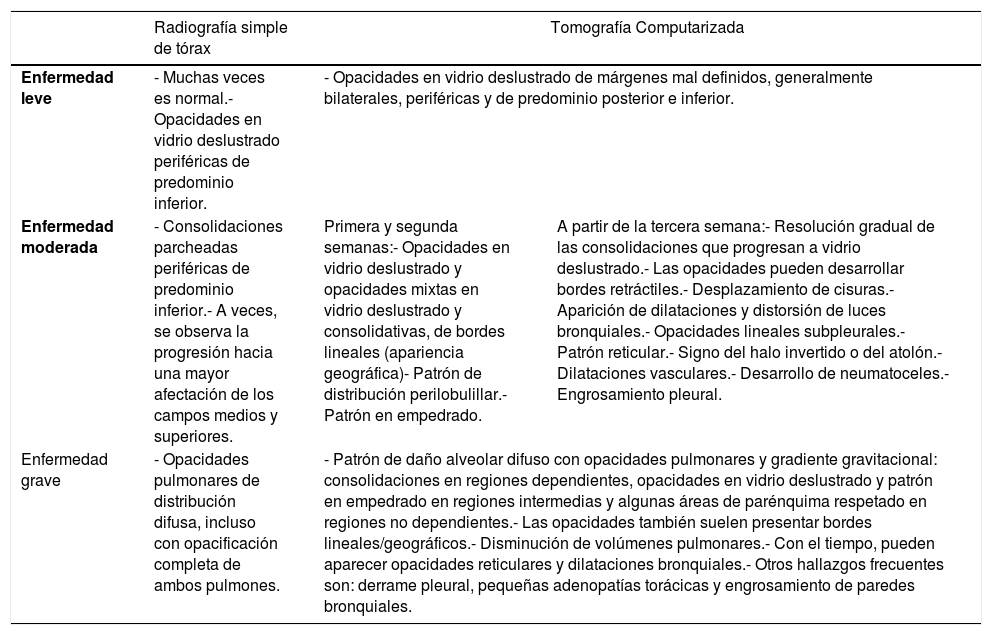
Principales hallazgos radiológicos según la gravedad de la enfermedad COVID-19
| Radiografía simple de tórax | Tomografía Computarizada | ||
|---|---|---|---|
| Enfermedad leve | - Muchas veces es normal.- Opacidades en vidrio deslustrado periféricas de predominio inferior. | - Opacidades en vidrio deslustrado de márgenes mal definidos, generalmente bilaterales, periféricas y de predominio posterior e inferior. | |
| Enfermedad moderada | - Consolidaciones parcheadas periféricas de predominio inferior.- A veces, se observa la progresión hacia una mayor afectación de los campos medios y superiores. | Primera y segunda semanas:- Opacidades en vidrio deslustrado y opacidades mixtas en vidrio deslustrado y consolidativas, de bordes lineales (apariencia geográfica)- Patrón de distribución perilobulillar.- Patrón en empedrado. | A partir de la tercera semana:- Resolución gradual de las consolidaciones que progresan a vidrio deslustrado.- Las opacidades pueden desarrollar bordes retráctiles.- Desplazamiento de cisuras.- Aparición de dilataciones y distorsión de luces bronquiales.- Opacidades lineales subpleurales.- Patrón reticular.- Signo del halo invertido o del atolón.- Dilataciones vasculares.- Desarrollo de neumatoceles.- Engrosamiento pleural. |
| Enfermedad grave | - Opacidades pulmonares de distribución difusa, incluso con opacificación completa de ambos pulmones. | - Patrón de daño alveolar difuso con opacidades pulmonares y gradiente gravitacional: consolidaciones en regiones dependientes, opacidades en vidrio deslustrado y patrón en empedrado en regiones intermedias y algunas áreas de parénquima respetado en regiones no dependientes.- Las opacidades también suelen presentar bordes lineales/geográficos.- Disminución de volúmenes pulmonares.- Con el tiempo, pueden aparecer opacidades reticulares y dilataciones bronquiales.- Otros hallazgos frecuentes son: derrame pleural, pequeñas adenopatías torácicas y engrosamiento de paredes bronquiales. | |
Fuente: Dra. G. Buitrago Weiland.
Los primeros días, los hallazgos representan una neumonía linfocítica viral13. Posteriormente, entra en juego un estado proinflamatorio con producción de citoquinas, que condicionan un daño pulmonar agudo junto al daño viral14. La respuesta pulmonar al daño agudo es limitada y se traduce en patrones histológicos y radiológicos idénticos, independientemente de la causa, que incluyen la neumonía organizada y el daño alveolar difuso15. Los hallazgos en pacientes con afectación moderada-grave probablemente corresponden a la respuesta al daño pulmonar16, con patrones radiológicos de neumonía organizada17,18 y daño alveolar difuso (patrón radiológico del SDRA)18. Esto coincide con los resultados de autopsias de pacientes fallecidos con COVID-19, en los que el patrón histológico predominante es el daño alveolar difuso19,20, asociado a focos de neumonía organizada y neumonía organizada aguda fibrinosa19.
Primeros días de la enfermedad y afectación leveEs frecuente que la radiografía de tórax no muestre alteraciones. Esto puede deberse a la escasa extensión de la afectación y a que los hallazgos pueden ser muy sutiles para ser detectados, especialmente en exploraciones portátiles18. Cuando la radiografía inicial es positiva, el hallazgo más frecuente son opacidades “en vidrio deslustrado”18 de distribución periférica y predominio en campos inferiores18,21.
Las exploraciones de tomografía computarizada (TC) realizadas al inicio de la enfermedad pueden ser normales. Se describe ausencia de hallazgos en la mitad de los pacientes valorados mediante TC en los dos primeros días16, porcentaje que disminuye al 14-21% si se incluyen pacientes con menos de 5 días de síntomas22–24..
El hallazgo predominante en la TC en la primera semana son las opacidades “en vidrio deslustrado”22–27, generalmente bilaterales5,14,22,25,26,28–30. En la fase precoz, la afectación puede ser unilateral en mayor proporción que en fases tardías22. La distribución es predominantemente periférica-subpleural5,22,24,26,28–30, con mayor afectación de la región posterior de los lóbulos inferiores14,16,25,31.
Las opacidades “en vidrio deslustrado” muestran inicialmente márgenes mal definidos y probablemente representan exudados inflamatorios5 en el contexto de una neumonía linfocítica viral, como se ha demostrado en autopsias realizadas en los primeros 5 días de la enfermedad13.
Los pacientes con afectación leve suelen mostrar menor extensión de las opacidades “en vidrio deslustrado” en la TC respecto a pacientes con enfermedad moderada-grave24. El mayor grado de afectación pulmonar se alcanza en los primeros 3 días y disminuye de forma gradual con resolución prácticamente completa a los 15 días24.
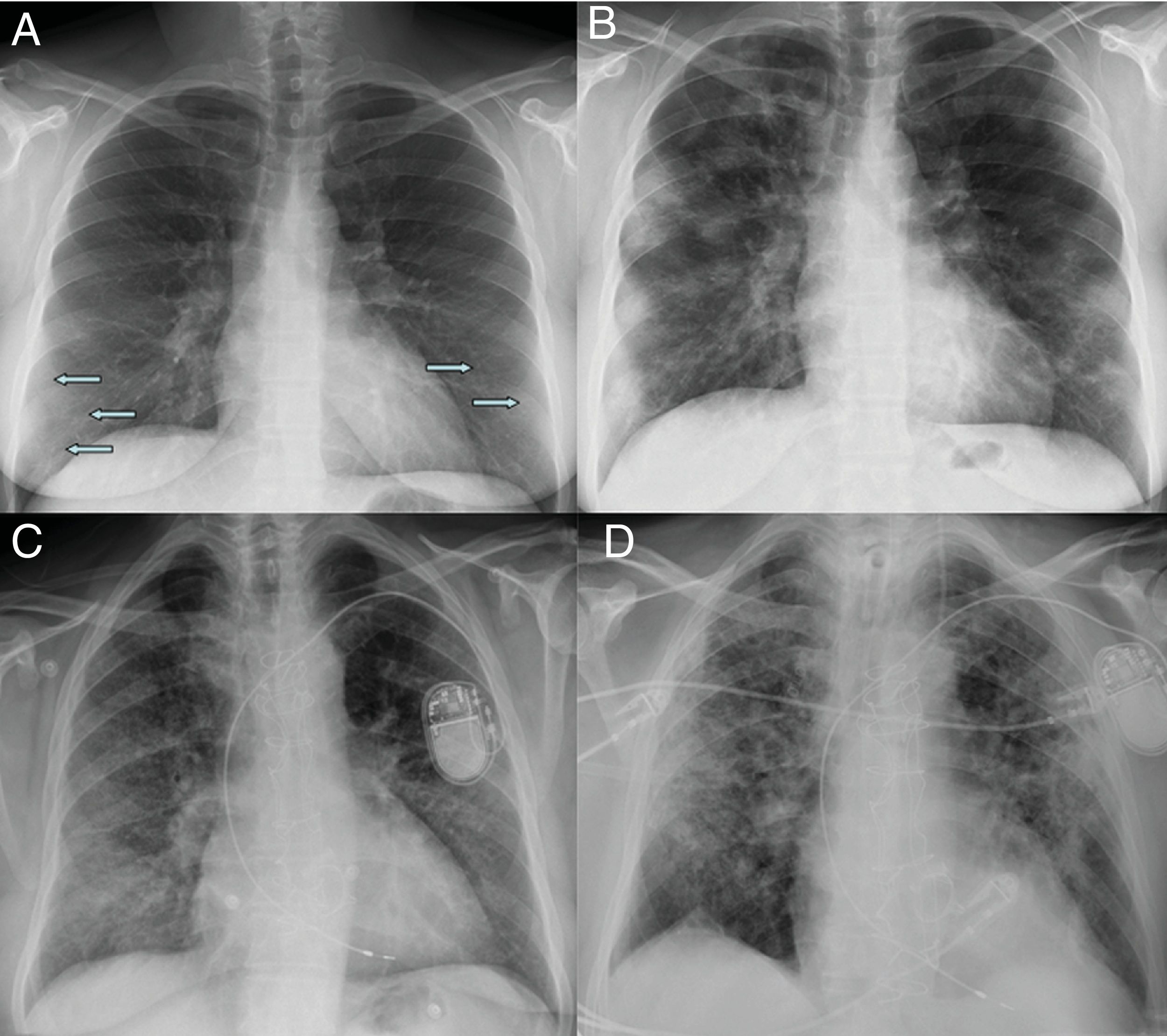
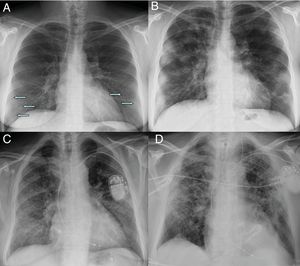
Afectación moderada. Patrón radiológico de neumonía organizadaA medida que progresa la enfermedad, las opacidades tienden a aumentar, agruparse y mostrar mayor densidad en la radiografía de tórax, evolucionando a consolidaciones parcheadas, con un pico a los 10-12 días del inicio de síntomas18,21. En algunos casos, se observa una progresión hacia una mayor afectación de los campos pulmonares medios y superiores18 (fig. 2).
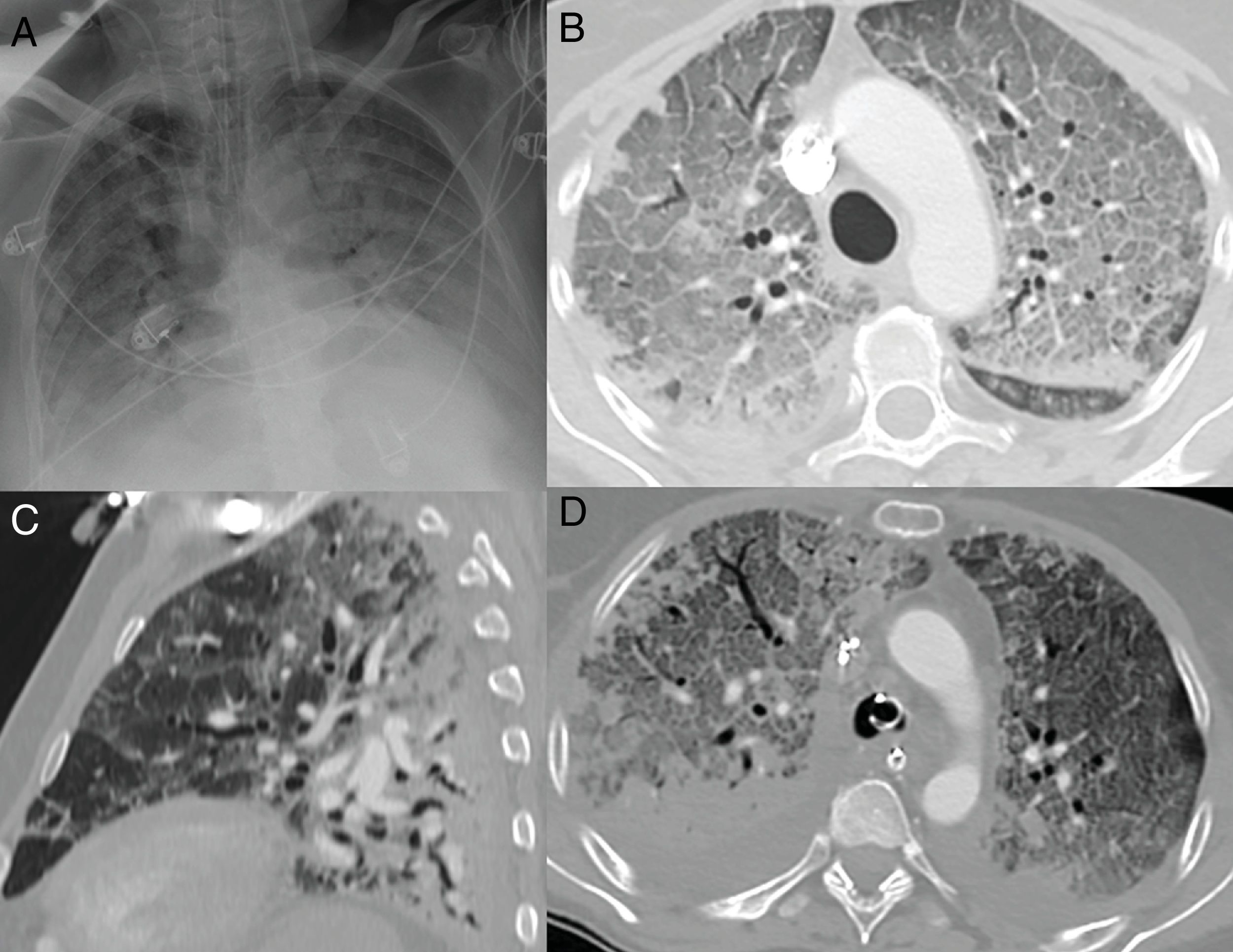
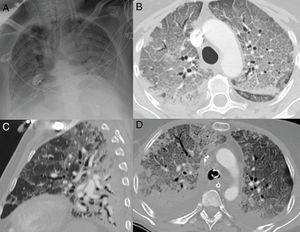
Radiografía inicial (A) y a los 12 días (B) en paciente con COVID-19 y enfermedad moderada. En la radiografía inicial se aprecian opacidades sutiles “en vidrio deslustrado” de localización periférica en campos pulmonares inferiores (flechas). A los 12 días, se observan consolidaciones multifocales de predominio periférico. Radiografía inicial (C) y a los 20 días (D) de otro paciente con COVID-19 y enfermedad moderada, en la que se observan inicialmente opacidades “en vidrio deslustrado” en bases y región periférica de campos medios y superiores, que progresan a un patrón alveolointersticial grosero que predomina en la región periférica de campos medios y superiores.
En la TC es raro encontrar pacientes sin hallazgos, y a partir del sexto día, solo el 1% de los estudios son normales22. Aumenta la extensión de las opacidades “en vidrio deslustrado”27, que son bilaterales hasta en el 90% de casos tras la primera semana16,26, casi siempre con afectación de varios lóbulos5,16,23,25,29,30.
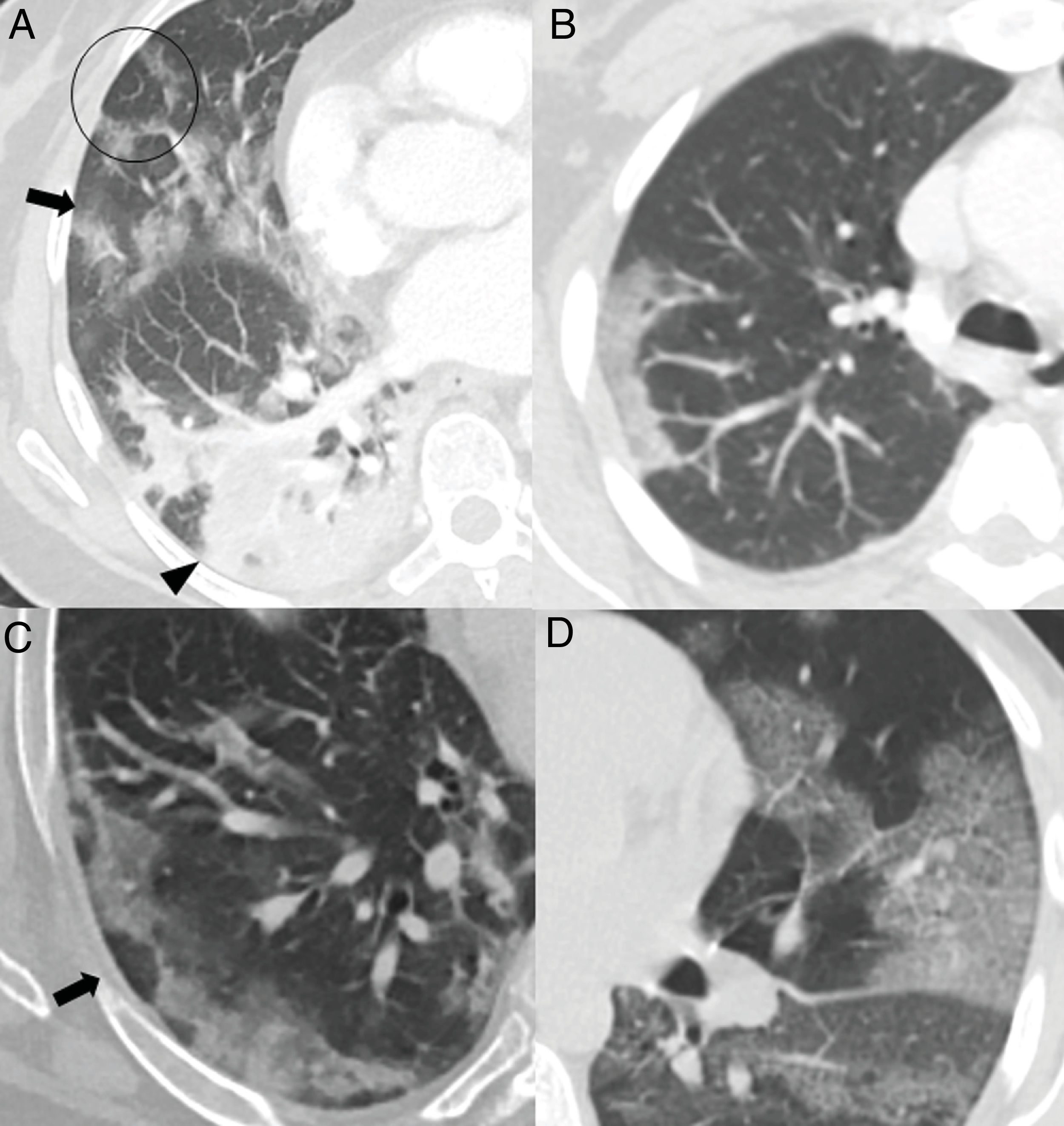
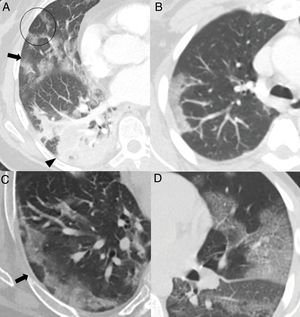
El mayor grado de afectación pulmonar suele darse alrededor del décimo día22,25,27,30 o segunda semana24,26,28, cuando se observa un aumento progresivo de las consolidaciones23,25–28,30, sobre todo en pacientes mayores de 50 años32. Las consolidaciones se asocian a opacidades “en vidrio deslustrado” casi siempre; las consolidaciones aisladas son muy poco frecuentes31. En esta etapa, las consolidaciones y opacidades “en vidrio deslustrado” suelen mostrar bordes lineales que adoptan una apariencia geográfica5 (fig. 3A y B). Este hallazgo es típico del patrón radiológico de neumonía organizada5,15. También es frecuente que las opacidades “en vidrio deslustrado” y las consolidaciones presenten un patrón de distribución perilobulillar subpleural, con opacidades curvilíneas-poligonales que rodean a un lobulillo pulmonar secundario15,33 (fig. 3A y C). Este hallazgo también sugiere neumonía organizada secundaria15,22,34.
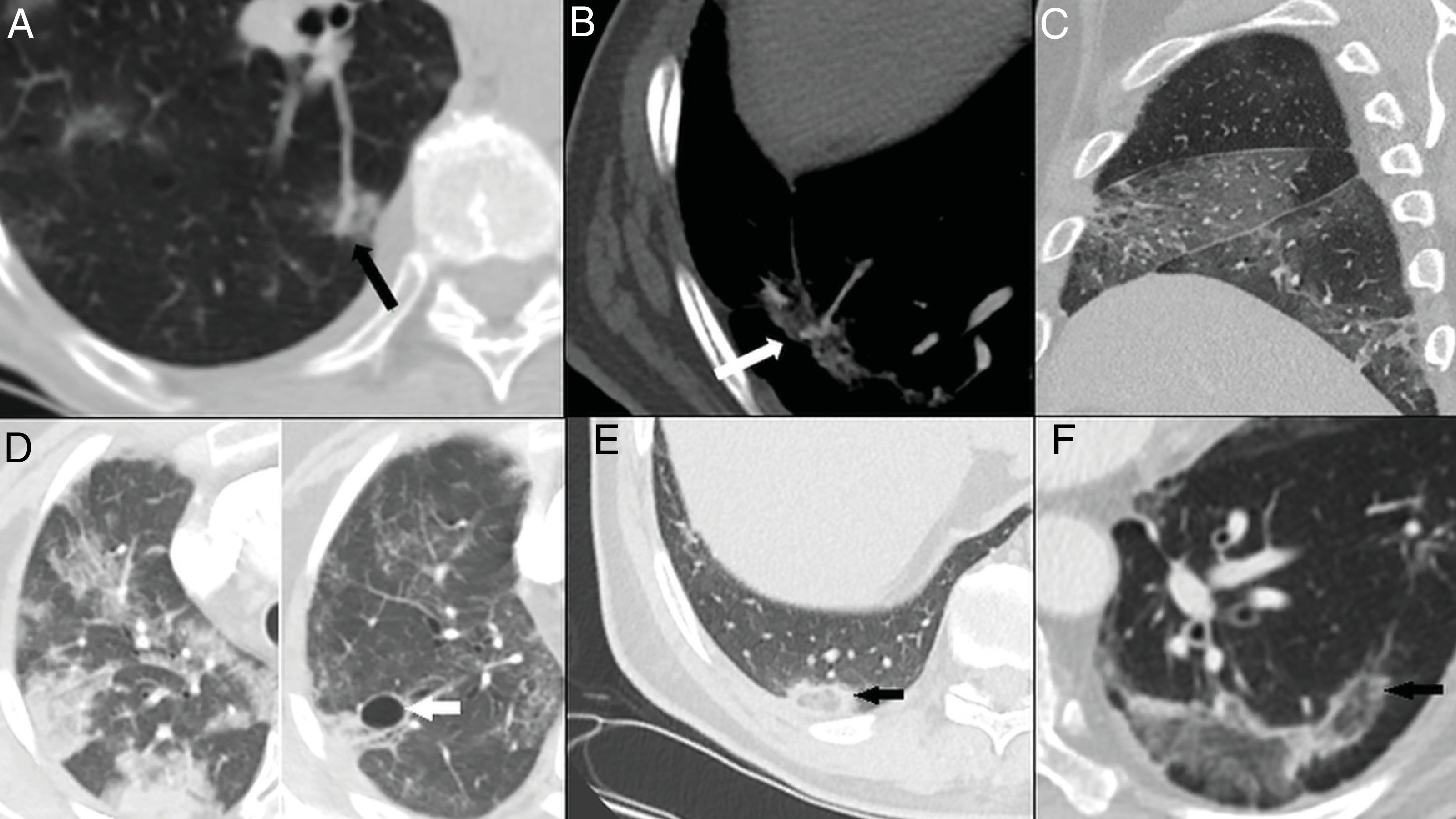
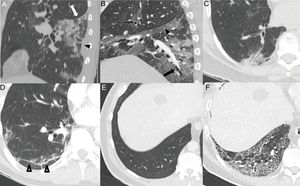
Hallazgos habituales en las dos primeras semanas de la enfermedad. A) Opacidades mixtas “en vidrio deslustrado” (flecha) y consolidativas (cabeza de flecha), de predominio posterior, con bordes lineales que muestran un aspecto geográfico. Se observa también alguna opacidad de distribución perilobulillar (círculo). B) Opacidad consolidativa periférica de bordes lineales. C) Opacidades periféricas de distribución perilobulillar (flecha). D) Patrón “en empedrado”, con opacidades “en vidrio deslustrado” y patrón reticular superpuesto secundario al engrosamiento de septos inter e intralobulillares.
El patrón “en empedrado” se describe en una proporción muy variable, entre el 15% y el 77% de los pacientes5,16,28,29, con un pico durante la segunda semana28,30 y disminución durante la tercera25; en fases más tardías es infrecuente28 (fig. 3D).
En la tercera semana se observa una resolución gradual de las consolidaciones, con progresión nuevamente a vidrio deslustrado22,23,25,27,28. En esta etapa, las opacidades pueden desarrollar bordes retráctiles-cóncavos en un 18% de los casos. Se interpreta como un proceso organizativo-reparativo de los cambios inflamatorios5.
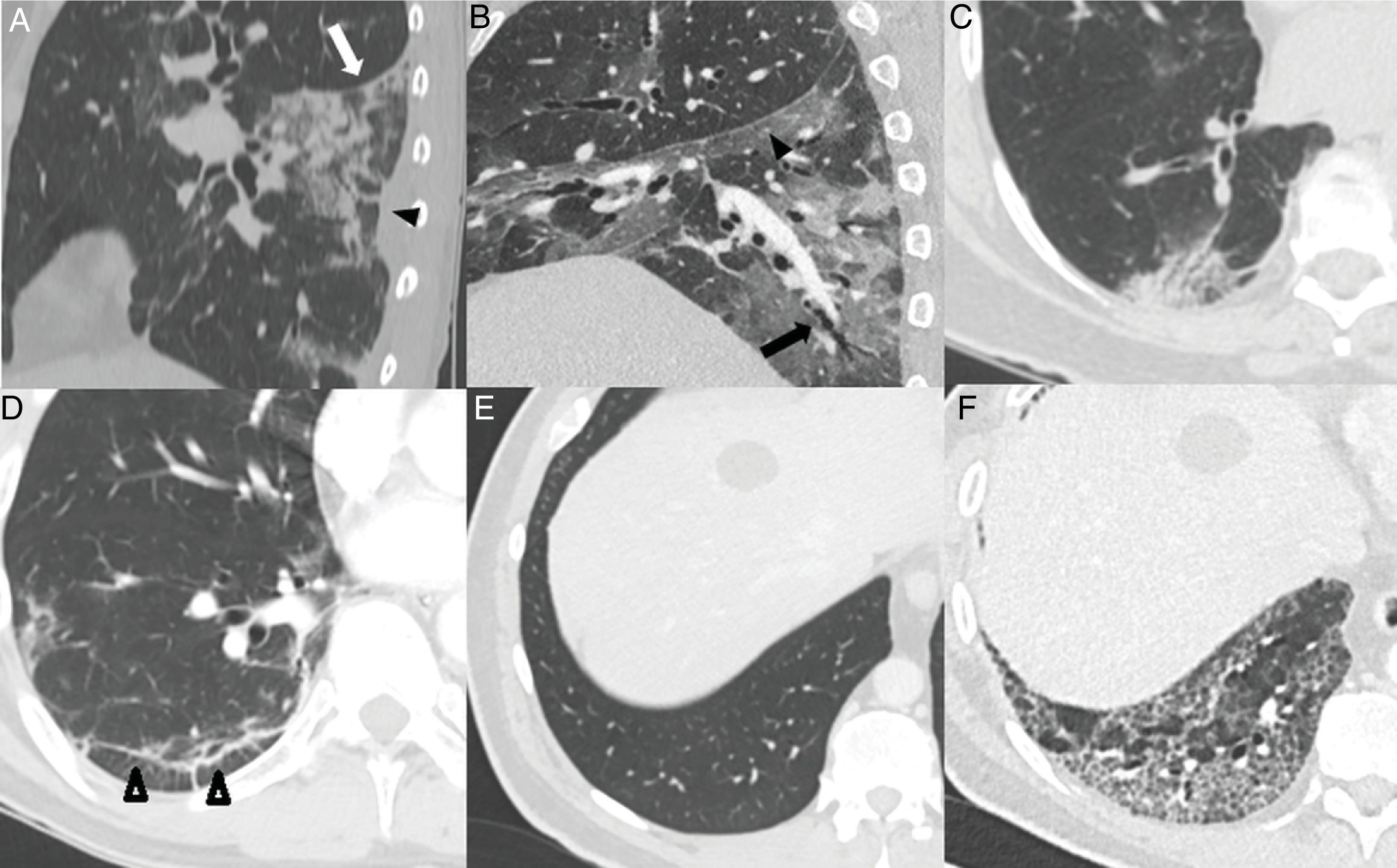
Puede visualizarse desplazamiento de cisuras28 (24%) y dilataciones bronquiales en proporción muy variable (5-45%)5,23,26,28–30 (fig. 4A, B y C). La historia natural de la infección no ha sido estudiada y es prematuro definir estos cambios como irreversibles28.
Hallazgos habituales en la tercera y cuarta semanas de la enfermedad. A) Foco consolidativo con distorsión arquitectural que condiciona retracción de la cisura (flecha blanca) y de la pleura adyacente (cabeza de flecha negra). B) Opacidades “en vidrio deslustrado” y consolidativas asociadas a bronquiectasias (flecha) y engrosamiento pleural de la cisura oblicua (cabeza de flecha). C) Foco consolidativo subpleural con dilataciones bronquiales asociadas. D) Línea subpleural paralela a la pleura, asociada a distorsión arquitectural (puntas de flecha). Paciente con un parénquima pulmonar previamente sano (E) que desarrolla un extenso patrón reticular secundario a engrosamiento de septos intralobulillares con alguna dilatación bronquial asociada (F).
Las opacidades “en vidrio deslustrado” con opacidades lineales subpleurales o signo de la pleura paralela suelen visualizarse tardíamente, alrededor de la tercera-cuarta semana14,23,25,27,30 en el 60-75% de los casos5,28 (fig. 4D). Pueden representar atelectasias subsegmentarias o neumonía organizada secundaria22,34. También puede desarrollarse un patrón reticular de forma tardía14,26,27, que se observa en el 6% de los pacientes, posterior a la cuarta semana de la enfermedad22 (fig. 4E).
Otros hallazgos tardíos son:
- •
El signo del halo invertido o del atolón, visualizado en el 4-5% de los casos5,16. Es un hallazgo que sugiere la presencia de neumonía organizada15,34, aunque también debe hacer sospechar la posibilidad de infartos pulmonares18 (fig. 5E y F).
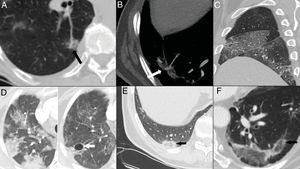
Figura 5.Hallazgos tardíos. A y B) Dilatación vascular, con aumento focal en el calibre de arterias subsegmentarias en el seno de las opacidades pulmonares. C) Engrosamiento pleural evidente a nivel de cisuras mayor y menor derechas. D) Resolución de los focos consolidativos que evolucionan a opacidades “en vidrio deslustrado” en la fase tardía y desarrollo de neumatoceles (flecha). E y F) Signo del halo invertido o del atolón, consistente en una opacidad “en vidrio deslustrado” rodeada de un anillo completo o incompleto de consolidación (flechas).
(0.34MB). - •
La dilatación o congestión vascular, referida en el 77% de casos5,14,28. Podría indicar infiltración de los vasos por células inflamatorias28 o hiperemia inducida por factores proinflamatorios35 (fig. 5A y B).
- •
Cambios quísticos, observados hasta en un 10% de los casos5,26. Podrían ser secundarios al daño de las paredes alveolares con desarrollo de neumatoceles26 (fig. 5D).
A medida que progresa la enfermedad, las consolidaciones se van resolviendo y pasan nuevamente a opacidades “en vidrio deslustrado”, que es el patrón tardío más frecuente (60%). Hasta el 98% de los pacientes continúa presentando alteraciones pasados los 28 días del inicio de síntomas23.
En la evolución de la enfermedad, están descritos los cambios dinámicos en aproximadamente un tercio de los casos, con mejoría de algunas opacidades y empeoramiento o aparición de otras5.
En cuanto a la afectación pleural, lo más frecuente son los engrosamientos pleurales, que constituyen un hallazgo tardío, visualizado a partir de la tercera semana26,28,30, hasta en el 52% de casos29 (fig. 5C). El derrame pleural es un hallazgo infrecuente, sobre todo al inicio de la enfermedad23. Se describe en una proporción variable de casos, entre el 1% y el 7%, en las series que valoran pacientes con afectación leve-moderada16,22,26,29. Suele aumentar con el tiempo de evolución y es más frecuente a partir de la segunda semana, con un pico en la tercera28.
Afectación grave. Síndrome de distrés respiratorio y patrón radiológico de daño alveolar difusoLos pacientes con afectación grave generalmente presentan SDRA11, que se caracteriza, desde el punto de vista histológico, por daño alveolar difuso36. En los estudios post mortem de pacientes con COVID-19 se han encontrado patrones histológicos de las fases exudativa y proliferativa del daño alveolar difuso19,20 y de neumonía organizada fibrinosa aguda13, cuya presentación clínica y radiológica puede ser indistinguible del SDRA y del patrón radiológico de daño alveolar difuso, respectivamente15.
En la radiografía de tórax, se observan opacidades pulmonares más difusas18, incluso con opacificación completa de ambos pulmones5, imitando el patrón radiológico del daño alveolar difuso18 (fig. 6A).
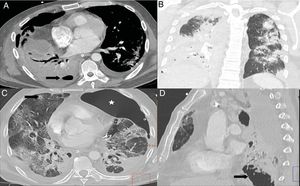
Patrón radiológico de daño alveolar difuso en pacientes con COVID-19. A) Opacificación completa de ambos pulmones con broncograma aéreo. B) Extenso patrón “en empedrado” con pequeños focos consolidativos de predominio posterior en paciente con 10 días de síntomas, que requiere ingreso en la unidad de cuidados intensivos. C) Reconstrucción sagital donde se identifica el típico gradiente gravitacional con consolidaciones en zonas declives, opacidades “en vidrio deslustrado” y patrón “en empedrado” en zonas intermedias, con áreas relativamente respetadas en las zonas no declives. D) Imagen axial con gradiente gravitacional, consolidaciones de predominio en zonas dependientes y extenso patrón “en empedrado” anterior. Se observa derrame pleural bilateral, mucho más frecuente en pacientes con enfermedad grave.
En la TC de los pacientes con afectación grave, las opacidades pulmonares continúan aumentando después del decimoquinto día desde el inicio de los síntomas24, con un pico entre los días 22 y 2823, a diferencia de lo que ocurre en los pacientes con afectación moderada, que muestran una mayor extensión de las opacidades en la segunda semana24. Se visualizan opacidades difusas en el 95% de casos31, siendo las áreas de consolidación significativamente más extensas31,37 respecto a pacientes con afectación leve-moderada. El patrón “en empedrado” también es significativamente más frecuente37 (fig. 6B). Además, los pacientes con enfermedad grave presentan volúmenes pulmonares globales más bajos, volúmenes de pulmón no afectado más bajos24 y opacidades más extensas que los pacientes con menor grado de afectación24,31.
En TC, el patrón de daño alveolar difuso se caracteriza por un gradiente de densidad gravitacional, con áreas consolidativas densas en regiones dependientes, opacidades “en vidrio deslustrado” difusas con engrosamiento de septos (patrón “en empedrado”) en las zonas intermedias y algunas áreas de parénquima de apariencia normal o hiperinsuflado en las zonas no dependientes, generalmente con bordes lineales de apariencia geográfica entre las áreas respetadas y las afectadas15,36 (fig. 6C y D). Las consolidaciones posteriores parecen deberse a la atelectasia compresiva causada por el peso del parénquima pulmonar suprayacente. Los volúmenes pulmonares están reducidos15,33,36. Con la evolución, suelen aparecer opacidades reticulares y con frecuencia dilataciones bronquiales y bronquiolares15,33,36. No obstante, ni las bronquiectasias ni el patrón reticular indican necesariamente fibrosis, y ambos hallazgos pueden ser reversibles36. Es frecuente el desarrollo de quistes aéreos33,36.
Otros hallazgos presentes en pacientes con afectación grave son:
- •
Derrame pleural, observado en el 40% de los pacientes31,37 y considerado un factor de mal pronóstico37.
- •
Derrame pericárdico, descrito en un 16% de pacientes37.
- •
Adenopatías torácicas, que no suelen apreciarse en pacientes con afectación leve16,37, son infrecuentes en pacientes con afectación moderada26,29, pero se observan en un tercio de los casos con enfermedad grave31,37.
- •
Engrosamiento de paredes bronquiales, descrito en dos tercios de los pacientes con enfermedad grave37.
Se postula que las adenopatías y el derrame pericárdico y pleural podrían ser secundarios al grave proceso inflamatorio37, aunque otros autores consideran más probable un origen congestivo secundario a sobrecarga fluida por el compromiso renal o cardiovascular subyacente31.
Complicaciones torácicasLos pacientes con infección por SARS-CoV-2 presentan diferentes complicaciones torácicas a corto plazo.
Tromboembolismo pulmonarLos pacientes con infección con COVID-19 presentan un alto riesgo trombótico debido al estado inflamatorio sistémico. Sin embargo, apenas hay información sobre cómo abordar el riesgo trombótico, la coagulopatía y el tratamiento anticoagulante de estos pacientes. Se ha identificado un aumento del riesgo de enfermedad tromboembólica venosa en pacientes hospitalizados con COVID-19, especialmente en aquellos ingresados en unidades de cuidados intensivos38. Estos pacientes presentan una reducción del flujo venoso debido al encamamiento prolongado, los cambios protrombóticos y el daño endotelial secundario a la unión del virus al receptor de la ECA-II. La elevación del dímero D se ha asociado con un peor pronóstico y es predictor de la mortalidad39,40. Estos pacientes son candidatos a tromboprofilaxis con heparina de bajo peso molecular.
La International Society of Thrombosis and Haemostasis (ISTH) propone la determinación y la monitorización de cuatro parámetros: dímero D, tiempo de protrombina, cifra de plaquetas y fibrinógeno para identificar los pacientes con mal pronóstico que precisan monitorización más intensiva38. Si se establece el diagnóstico de enfermedad tromboembólica venosa, se debe cambiar la heparina de bajo peso molecular a dosis terapéuticas. Las hemorragias en estos pacientes son frecuentes y el tratamiento debe ser sustitutivo, manteniendo cifras de plaquetas superiores a 50×109/L, fibrinógeno>2g/L y un cociente del tiempo de protrombina<1,541.
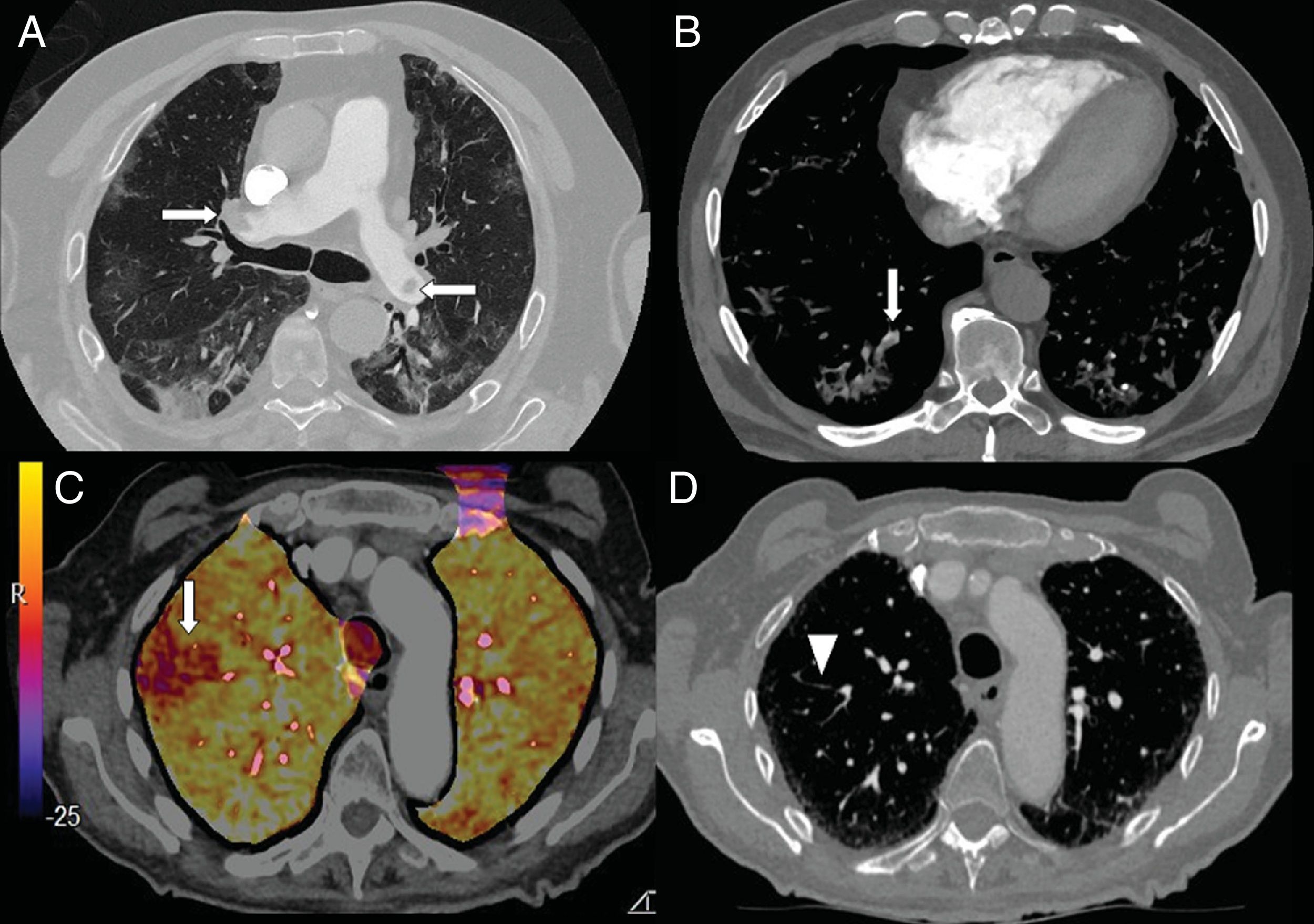
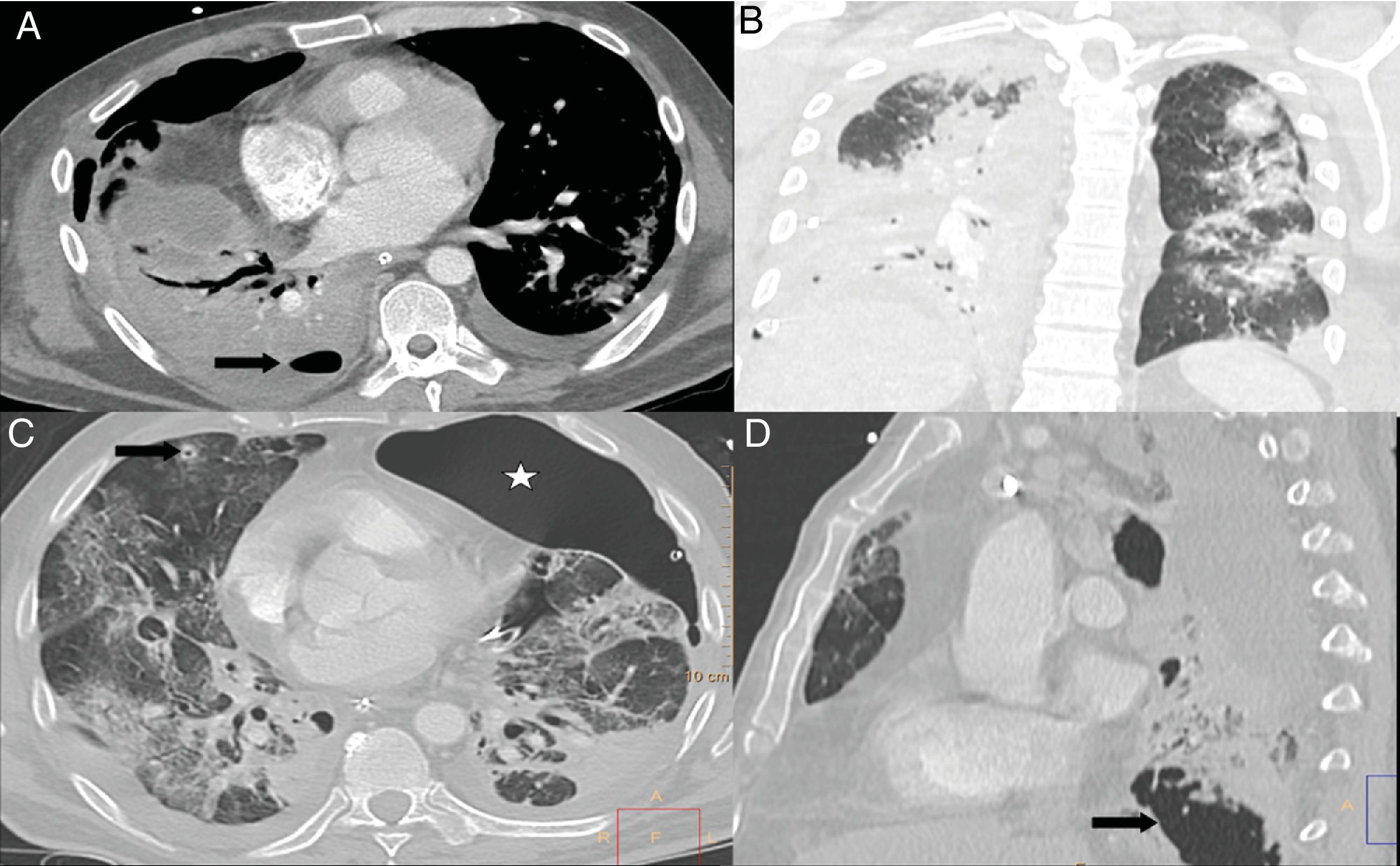
Los niveles elevados de dímero D se han utilizado, en los servicios de urgencias hospitalarias, para seleccionar a los pacientes con neumonía COVID-19 que precisan una angio-TC de arterias pulmonares que descarte el embolismo pulmonar (fig. 7). En una serie de 72 angio-TC pulmonares de pacientes con neumonía COVID-19, el 18% presentó embolia pulmonar aguda, con una distribución segmentaria en el 55% de los casos, lobar en el 30% y en las arterias principales en el 15%. La gravedad y los hallazgos radiológicos de la neumonía COVID-19 no presentaban diferencias estadísticamente significativas entre los pacientes con y sin embolismo pulmonar42.
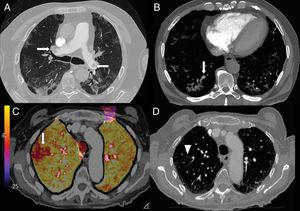
A) Varón de 73 años con embolia pulmonar central bilateral (flechas). B) Varón de 77 años con COVID-19 y embolia pulmonar segmentaria en relación con consolidación en lóbulo inferior derecho, que sugiere trombosis vascular (flecha). C y D) Mujer de 89 años con COVID-19 y elevación del dímero D. Se realizó una angio-TC con mapa de yodo por sustracción, que mostraba un defecto de perfusión periférico (flecha) que se correlaciona con sutil defecto de repleción segmentario y subsegmentario en lóbulo superior derecho (punta de flecha).
En los pacientes ingresados por neumonía COVID-19, la prevalencia de embolia pulmonar aguda es alta (23%), con un diagnóstico a los 12 días de media desde el inicio de los síntomas. Estos pacientes precisaron ingreso en unidades de cuidados intensivos y ventilación mecánica con más frecuencia que aquellos sin embolia pulmonar43.
En un estudio retrospectivo que incluyó 101 pacientes hospitalizados con COVID-19 y una angio-TC pulmonar entre marzo y mayo de 2020 en Rimini (Italia), se diagnosticó embolia pulmonar en el 40,6% de los enfermos, con más frecuencia en hombres que en mujeres (35 vs. 6%). En cuanto a la distribución, fue bilateral en el 48,7%, solo derecho en el 41,5% e izquierdo en el 9,8%. La afectación del tronco de la arteria pulmonar se detectó en el 2,4%, en las arterias pulmonares principales en el 22% y en las arterias lobares en el 51,2% de los casos. La afectación de las arterias segmentarias fue del 90,2% y subsegmentarias del 61%. La embolia pulmonar fue más frecuente en los lóbulos inferiores (73,2%) que en el lóbulo medio y la língula (14,6%) o en las arterias de los lóbulos superiores (12,2%). Se encontraron lesiones parenquimatosas asociadas a la embolia pulmonar segmentaria: consolidaciones pulmonares en el 67,6% de los casos, un patrón “en vidrio deslustrado” en el 29,7%, y en el 2,7% de los casos no se vieron opacidades pulmonares. Fueron poco frecuentes la dilatación de la arteria pulmonar (17%) y del ventrículo derecho (4,9%). Estos pacientes presentaron valores más elevados y con diferencias estadísticamente significativas de dímero D (p<0,001), lactato deshidrogenasa (p<0,001) y proteína C reactiva (p=0,0420). En resumen, los pacientes con afectación pulmonar más grave con COVID-19 tienden a un mayor riesgo de embolia segmentaria y subsegmentaria44.
Los émbolos pulmonares en pacientes con embolia pulmonar asociada a COVID-19 están más localizados en arterias pulmonares de tamaño pequeño a mediano y son menos extensos en comparación con la embolia pulmonar en pacientes sin COVID-19. La ausencia de signos clínicos de trombosis venosa profunda en los pacientes con COVID-19 también puede respaldar el concepto de inmunotrombosis in situ en lugar de tromboembolismo venoso, aunque el origen de las lesiones trombóticas en pacientes con COVID-19 sigue siendo desconocido45.
En la actualidad, pocas publicaciones evalúan si existe un punto de corte de los niveles de dímero D de los pacientes con neumonía por coronavirus que sugiera el diagnóstico de embolia pulmonar46.
Neumotórax y neumomediastino espontáneoEn pacientes con infección por COVID-19 y empeoramiento progresivo de la función respiratoria se ha descrito la presencia de neumomediastino y neumotórax espontáneos, de forma aislada47–49, o asociados50, sin antecedentes de ventilación mecánica.
El neumomediastino se produce por un aumento de la presión intraalveolar, rotura alveolar y migración del aire que diseca las vainas peribronquiales y perivasculares del hilio pulmonar (efecto Maclin)49. Una vez que alcanza el mediastino, el gas se extiende al tejido subcutáneo, pleura, peritoneo y canal raquídeo (fig. 8). La tos pronunciada que se produce en respuesta al virus es una de las causas del neumomediastino espontáneo; es una complicación que tiene buen pronóstico y su tratamiento es la analgesia y la oxigenoterapia48.
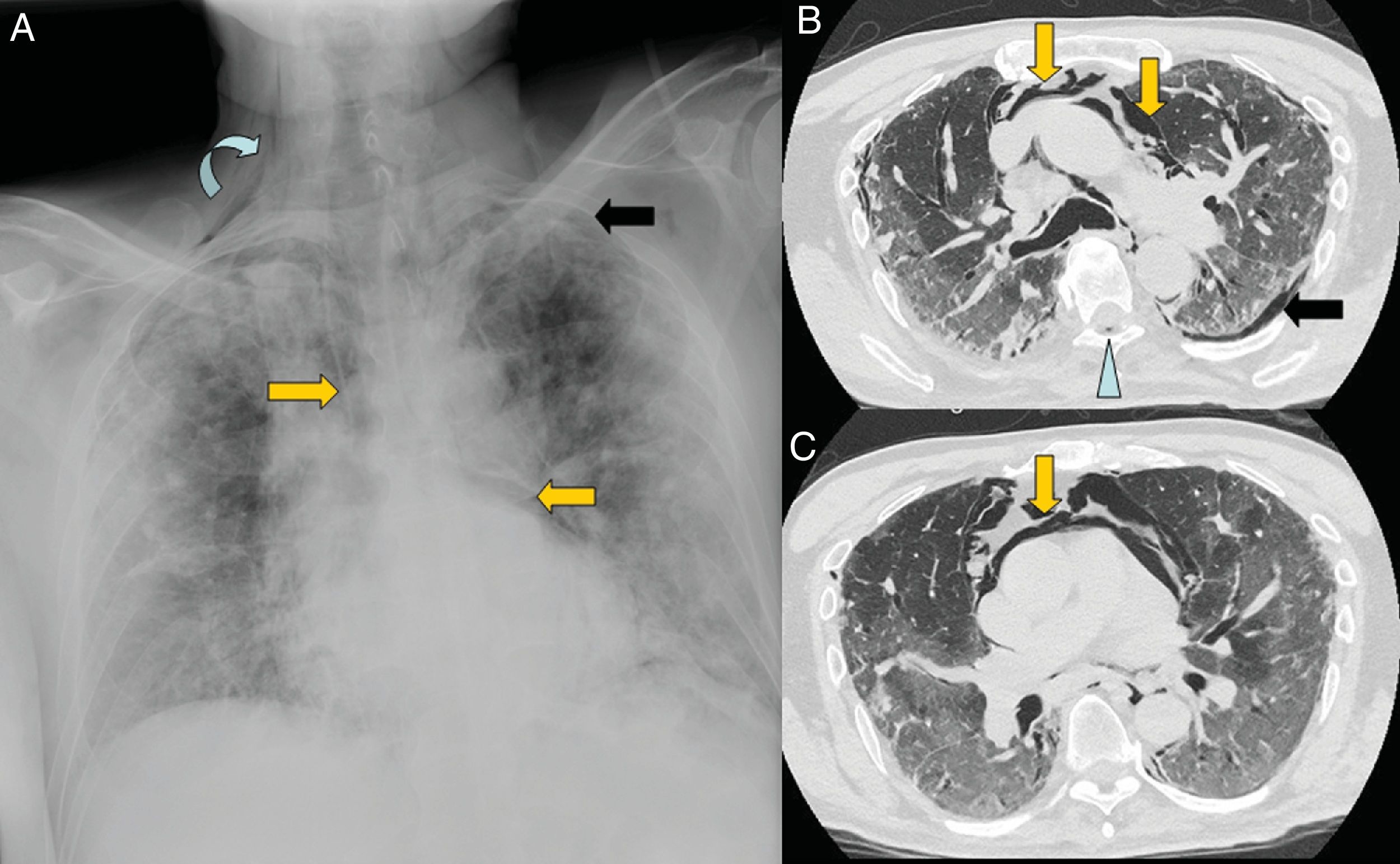
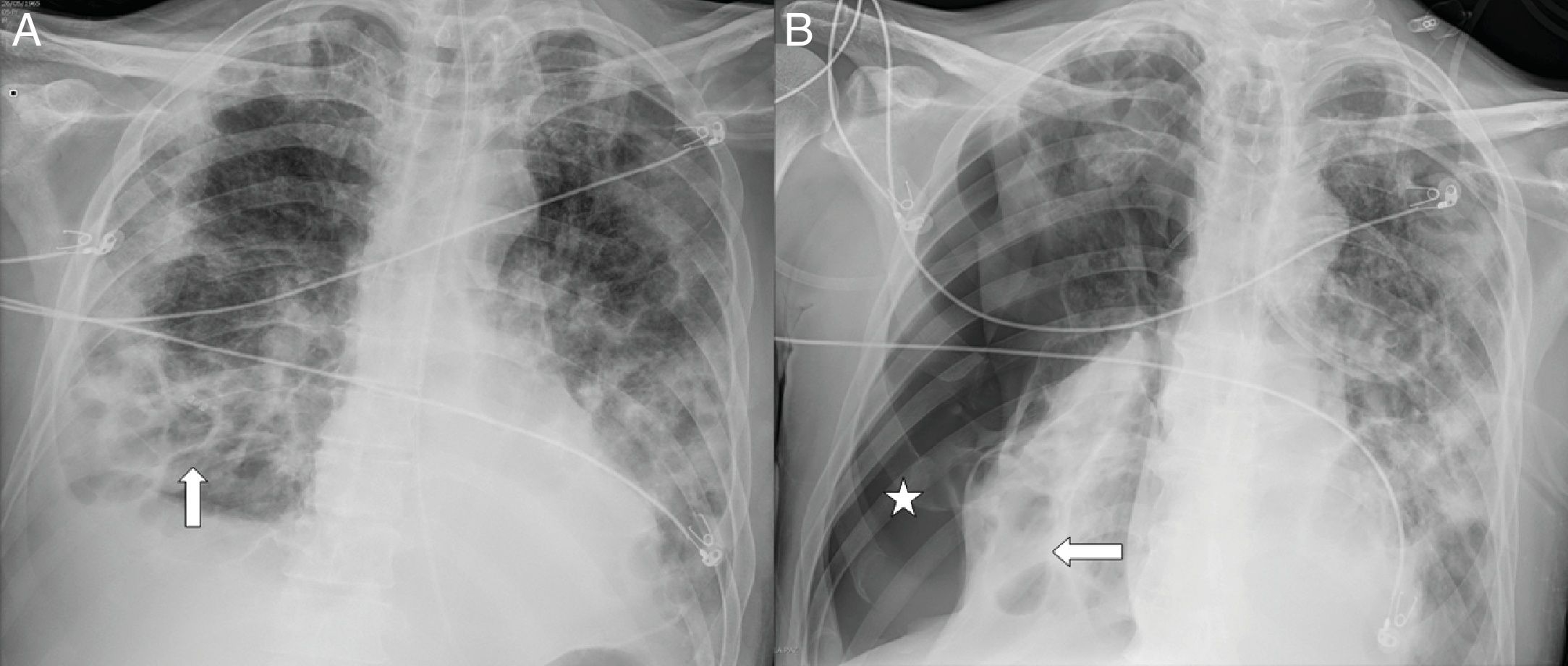
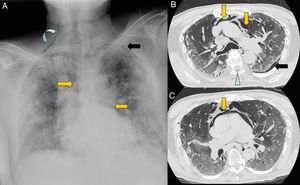
Varón de 67 años con extensa afectación bilateral por COVID-19 y grave insuficiencia respiratoria. Llama la atención en la radiografía de tórax portátil (A) un enfisema subcutáneo supraclavicular derecho (flecha curva), neumomediastino (flechas naranjas) y neumotórax apical izquierdo (flecha negra). En las imágenes B y C de la tomografía computarizada torácica se confirman todos los hallazgos y se visualiza adicionalmente neumorraquis (punta de flecha azul).
El neumopericardio y el neumotórax a tensión como complicación del neumomediastino se consideran complicaciones graves y con necesidad de drenaje de urgencia. López-Vega et al. asocian la presencia de neumotórax y neumomediastino con mayor gravedad y desenlace fatal de los pacientes, aunque se precisará de un mayor número de casos para evaluar la causalidad o asociación50.
En pacientes con infección pulmonar grave por SARS-CoV-2 y daño alveolar difuso, la presencia de neumotórax y enfisema mediastínico espontáneo se ha asociado a la aparición de neumatoceles y bullas relacionadas con la neumonía, que no aparecían en las fases iniciales de la infección51.
Sobreinfección bacterianaSe estima que alrededor del 15% de los enfermos hospitalizados con COVID-19 desarrollan infecciones secundarias, principalmente por bacterias y, más raramente por hongos. Esta sobreinfección puede afectar a hasta un 50% de los pacientes fallecidos. La infección secundaria se diagnostica cuando los pacientes muestran síntomas clínicos o signos de neumonía o bacteriemia y se obtiene un cultivo positivo de un nuevo patógeno a partir de muestras del tracto respiratorio inferior (esputo, aspirado endotraqueal o líquido de lavado broncoalveolar) o hemocultivos positivos después del ingreso52.
En el estudio multicéntrico de Xing et al.53, se incluyeron 68 pacientes con un diagnóstico confirmado de infección por SARS-CoV-2, reclutados en dos centros hospitalarios con pacientes de diferentes características. Los pacientes de Qingdao tenían una edad media de 50 años (rango de 37 a 59 años) y los de Wuhan de 31 años (rango 28 a 38 años). El estudio muestra que el 80% de los pacientes de Qingdao presentaban anticuerpos IgM específicos contra al menos un patógeno respiratorio común, mientras que este porcentaje fue solo del 2,63% en los pacientes de Wuhan. Los patógenos respiratorios más comunes detectados fueron el virus de la gripe A (60%), el virus de la gripe B (53%), Mycoplasma pneumoniae (23%) y Legionella pneumophila (20%).
Los pacientes con SDRA desencadenado por una infección viral, especialmente gripe, y que precisan ventilación mecánica invasiva pueden desarrollar una coinfección por Aspergillus, incluso en ausencia de inmunodeficiencia previa54.
Existe evidencia creciente que esta situación puede ocurrir en pacientes con COVID-19, especialmente en pacientes tratados con corticoides, con desarrollo de una aspergilosis pulmonar invasiva centrada en bronquios y tejido alveolar55–57. El patrón radiológico es de bronconeumonía con consolidaciones del espacio aéreo. Pero, a diferencia de lo descrito en la afectación pulmonar por COVID-19, son frecuentes las áreas de cavitación (fig. 9). También pueden verse imágenes nodulares con signo del halo o signo del halo invertido55,57.
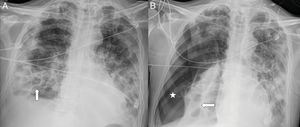
A y B) Paciente con COVID-19 y enfermedad moderada que presenta empeoramiento a los 10 días del ingreso, con leucocitosis, aumento de procalcitonina, consolidación completa del lóbulo inferior derecho, opacificación parcial del lóbulo superior y medio derechos e hidroneumotórax (flecha) en el contexto de sobreinfección bacteriana. C) Paciente con COVID-19 y enfermedad grave, con diagnóstico de aspergilosis pulmonar invasiva. Mostraba un nódulo pulmonar en lóbulo superior derecho con un área de cavitación central (flecha) y presencia de neumotórax izquierdo (estrella). D) El mismo paciente presenta extensas lesiones cavitadas (flecha) en base pulmonar derecha.
Los resultados del análisis de las características clínicas en una cohorte seleccionada de 1099 enfermos de COVID-19 en toda China39 han mostrado que hasta el 15% (173/1099) desarrollaron enfermedad grave según los criterios clínicos de neumonía comunitaria grave de la American Thoracic Society58. De estos pacientes con enfermedad grave, el 19% (33/173) precisó ingreso en unidades de cuidados intensivos, o el uso de ventilación mecánica en un 46%, tanto invasiva como no invasiva (81/173).
Un número alto de pacientes con infección COVID-19 han desarrollado múltiples episodios de barotrauma separados en el tiempo como neumotórax (fig. 10), neumomediastino, neumopericardio y enfisema subcutáneo, tanto en la radiografía como en la TC de tórax.
Varón de 54 años con neumonía COVID-19 que precisó intubación e ingreso en la unidad de cuidados intensivos, una semana después del inicio de los síntomas, por marcado empeoramiento clínico y radiológico. En un control al mes (A) se identificaron neumatoceles en base pulmonar derecha (flechas) secundarios a COVID-19. B) Cuatro días después, el paciente se desaturó bruscamente con importante neumotórax derecho (asterisco).
En el estudio retrospectivo realizado en New York University Langone Health durante el pico de la pandemia59 se observó una incidencia alta de barotrauma en pacientes con COVID-19 y ventilación mecánica invasiva con una incidencia total del 24%. El tiempo entre la ventilación mecánica invasiva y el primer episodio documentado de barotrauma fue de 5,3 días, con un rango entre 0 y 25 días. Durante el mismo período, la tasa de barotrauma en el grupo de pacientes con ventilación mecánica invasiva por otras causas y sin infección COVID-19 fue del 0,5%. En este estudio, los enfermos con barotrauma y coronavirus eran más jóvenes que los que no presentaron esta complicación. No hubo diferencias significativas en la mortalidad en los pacientes con infección COVID-19 con y sin barotrauma. Aunque la edad avanzada es un factor de riesgo de mayor mortalidad, el barotrauma fue menos frecuente en estos enfermos. En pacientes con infección COVID-19, el barotrauma se asoció con una mayor estancia hospitalaria frente a los enfermos que no presentaron esta complicación (25 versus 18 días, p<0,001).
Complicaciones cardíacasSe han descrito diferentes mecanismos para la lesión miocárdica aguda por SARS-CoV-260:
- 1.
La lesión miocárdica directa por el virus al unirse al receptor de la ECA-II, que se expresa en las células del corazón y los pulmones.
- 2.
La alteración de la demanda y el suministro de oxígeno del miocardio debido a la infección sistémica, la insuficiencia respiratoria y la hipoxia.
- 3.
La respuesta inflamatoria sistémica aguda y la tormenta de citoquinas.
- 4.
El aumento del flujo sanguíneo coronario puede producir rotura de las placas de ateroma, mientras que el estado protrombótico puede inducir la formación de trombos intracoronarios.
- 5.
Los efectos adversos de medicamentos antivirales, corticoides y cloroquina que pueden producir arritmias y fibrosis miocárdica.
La elevación de troponina es un marcador de mal pronóstico junto al dímero D y el fibrinógeno. La acción vascular directa del SARS-CoV-2 es responsable de infartos de miocardio de inicio tardío y del aumento de muertes súbitas extrahospitalarias, especialmente en Lombardía (Italia) y en Nueva York (Estados Unidos). En otras ocasiones, se observa una marcada elevación de troponina, sin afectación coronaria, en relación con el sufrimiento miocárdico de origen extracoronario, como la miopericarditis61, el taponamiento cardíaco, la sepsis, la embolia pulmonar y la insuficiencia cardíaca.
En una publicación sobre 138 pacientes con COVID-19 hospitalizados, la lesión cardíaca aguda, el shock y la arritmia estuvieron presentes en el 7,2%, el 8,7% y el 16,7% de los pacientes, respectivamente, con una mayor prevalencia entre los pacientes que precisaron cuidados intensivos6.
Se ha publicado un aumento de la incidencia de miocardiopatía por estrés o síndrome de Tako-Tsubo por el estrés psicológico, social y económico asociado con la pandemia de COVID-19. La miocardiopatía fue significativamente más frecuente (incidencia del 7,8%) en los pacientes con síndrome coronario agudo entre el 1 de marzo y el 30 de abril de 2020, en comparación con cuatro grupos de control en líneas de tiempo prepandémicas. La incidencia de la miocardiopatía por estrés en los grupos de control fue del 1,5-1,8%. No hubo diferencias con respecto a la mortalidad y la rehospitalización a los 30 días. Sin embargo, los pacientes con miocardiopatía por estrés hospitalizados durante la pandemia tuvieron un tiempo significativamente mayor de la duración de la estancia hospitalaria. La angustia psicológica, social y económica que acompaña a la pandemia son los factores más probablemente asociados al aumento de casos de miocardiopatía por estrés, en lugar de la participación viral directa y las secuelas de la infección, como apoyan los resultados negativos de la prueba COVID-19 en todos los pacientes diagnosticados62.
La ecocardiografía está indicada para el diagnóstico de la lesión cardíaca aguda relacionada con COVID-1918, identificando la miocardiopatía y el shock cardiogénico como causa de descompensación, la presencia de derrame pericárdico y el taponamiento cardíaco63. Las anormalidades en la ecocardiografía se asocian con una enfermedad más grave y un peor pronóstico. Además, puede identificar los signos ecocardiográficos altamente específicos de embolia pulmonar aguda que incluyen el trombo cardíaco derecho, el signo de McConnell (acinesia de la pared libre del ventrículo derecho y la hipercontractilidad de su pared apical) y el movimiento septal interventricular paradójico, como principal diagnóstico diferencial.
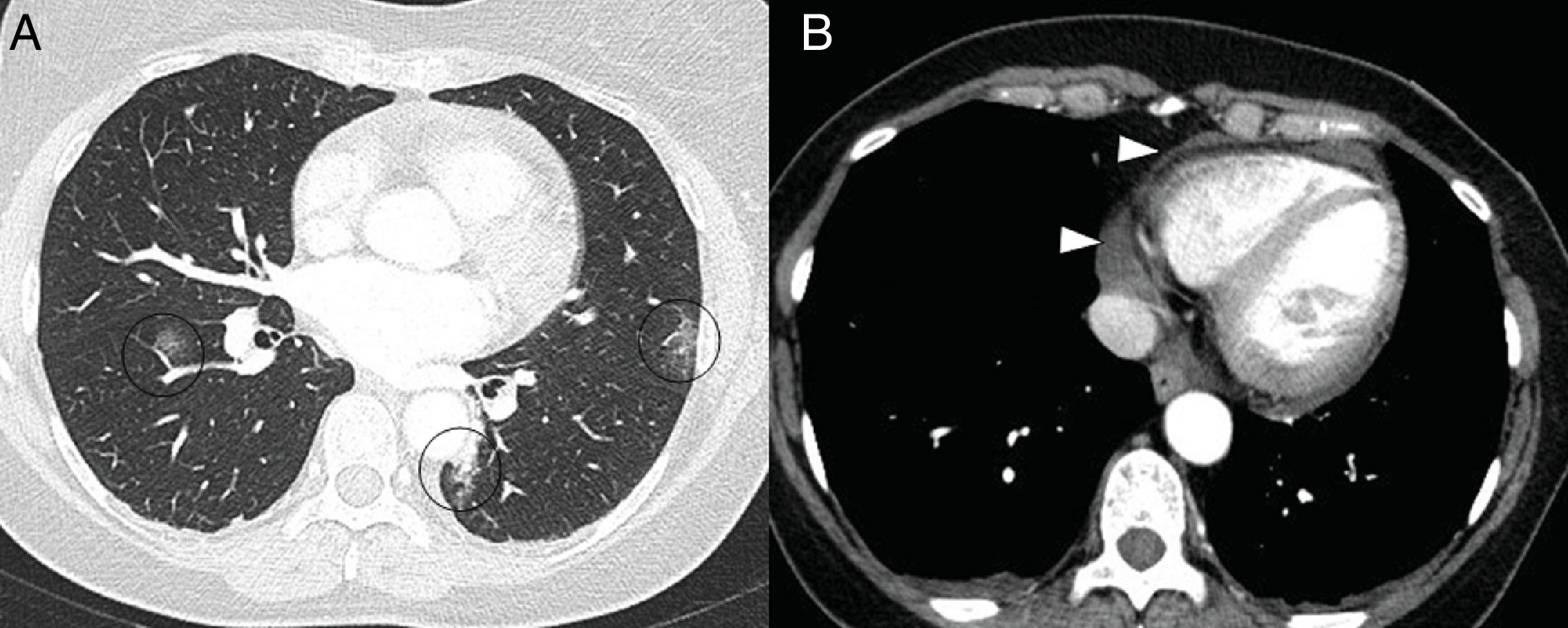
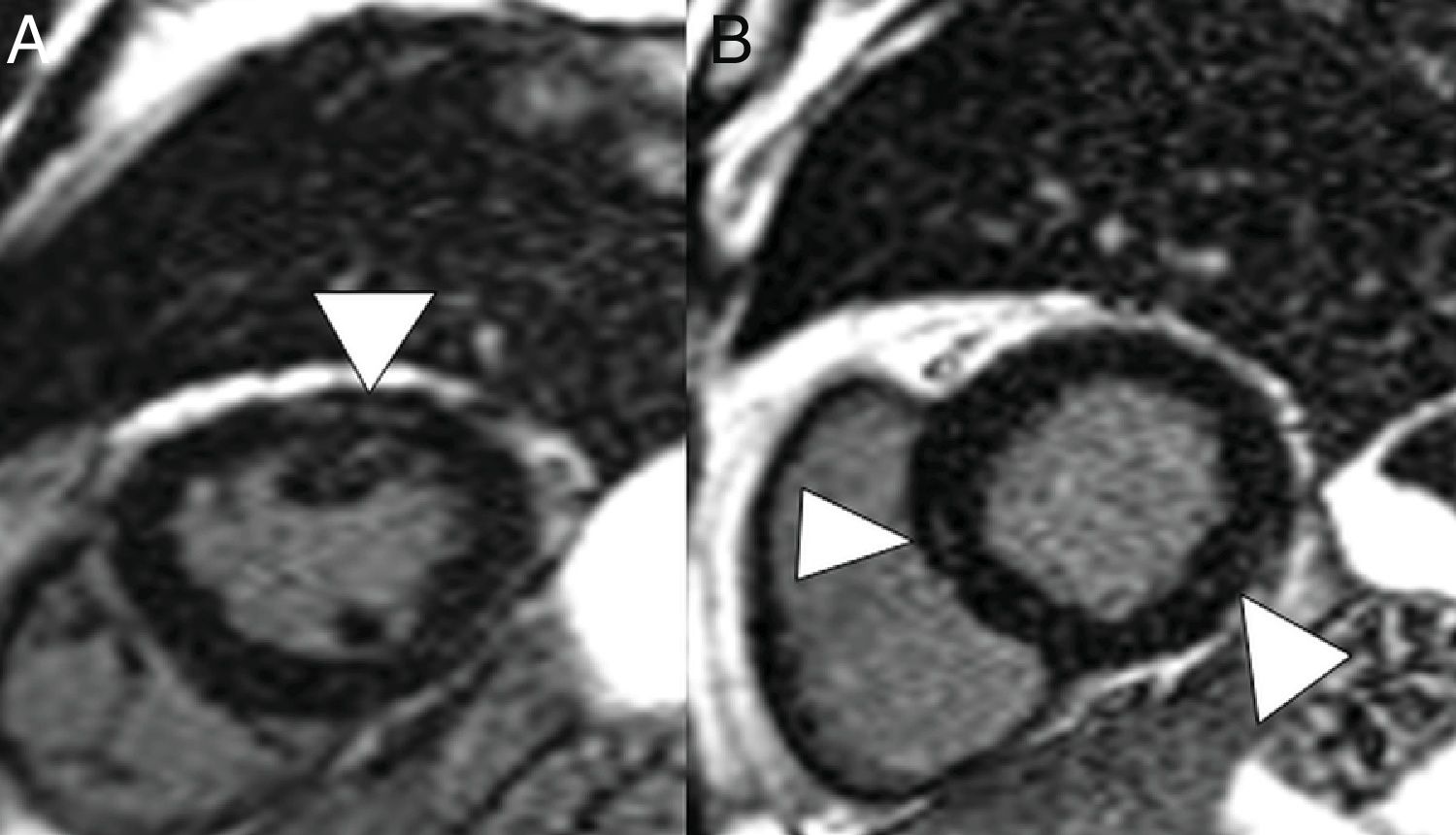
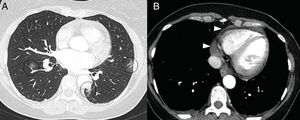
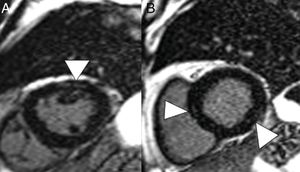
En la TC, la pericarditis se manifiesta con la presencia de líquido pericárdico acompañando a las opacidades “en vidrio deslustrado” típicas de la infección COVID-19 (fig. 11). La resonancia magnética cardíaca también puede tener algunas aplicaciones útiles, ya que la miocarditis (fig. 12) y la miocardiopatía se han descrito en pacientes con COVID-1964,65.
Mujer de 50 años con clínica febril y dolor retroesternal con roce pericárdico en auscultación. En la tomografía computarizada se aprecian opacidades “en vidrio deslustrado” (A) en relación con afectación leve por COVID-19 (círculos) y derrame pericárdico leve (puntas de flecha en B).
Varón de 59 años, sin ningún antecedente personal de interés, con neumonía leve por COVID-19. Presenta dolor torácico y elevación de troponinas seriadas, con sospecha de acinesia inferior en ecocardiografía. En reconstrucciones en eje corto y secuencia de realce tardío se identifican imágenes lineales hiperintensas en el espesor del miocardio (puntas de flecha en A y B) compatible con miocarditis.
En este capítulo, hemos repasado la evolución de los pacientes con COVID-19, con énfasis en los que desarrollan una enfermedad grave con ingresos prolongados en las unidades de cuidados intensivos, y los patrones radiológicos asociados de neumonía organizada y daño alveolar difuso, así como las características de las complicaciones torácicas más frecuentes.
Autoría- 1.
Responsable de la integridad del estudio: MLPG, GBW
- 2.
Concepción del estudio: MLPG, GBW, MGG, GAC.
- 3.
Diseño del estudio: MLPG, GBW, MGG, GAC.
- 4.
Obtención de los datos: MLPG, GBW, MGG, GAC.
- 5.
Análisis e interpretación de los datos: MLPG, GBW, MGG, GAC.
- 6.
Tratamiento estadístico: N/A.
- 7.
Búsqueda bibliográfica: MLPG, GBW, MGG, GAC
- 8.
Redacción del trabajo: MLPG, GBW, MGG, GAC.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: MLPG, GBW, MGG, GAC.
- 10.
Aprobación de la versión final: MLPG, GBW, MGG, GAC.
Todos los autores declaran no tener ningún conflicto de intereses.