La obstrucción intestinal maligna es una patología compleja que, a pesar de la baja prevalencia, produce un alto grado de incomodidad, debido a síntomas secundarios producidos por alteraciones mecánicas y funcionales en los diferentes mecanismos fisiopatológicos; entre estos mecanismos se encuentran la oclusión del lumen intestinal, las alteraciones en la motilidad y la acumulación de secreciones. En el tratamiento de la obstrucción intestinal maligna se debe individualizar cada paciente para definir la mejor estrategia, ya sea una intervención quirúrgica —gastrostomía o yeyunostomía descompresiva, realización de ostomías y endoprótesis vasculares (stents)— o un tratamiento médico —opioides, anticolinérgicos, antieméticos y esteroides—. En general, se recomienda una estrategia que de manera sinérgica combine diferentes opciones para logar un control adecuado de los síntomas.
Malignant intestinal obstruction is a complex disease that, despite the low prevalence, causes a high level of discomfort, due to the secondary symptoms produced by various mechanical and functional alterations in the different pathophysiological mechanisms. These symptoms include occlusion of the intestinal lumen, changes in motility, and accumulation of secretions. The treatment of the malignant intestinal obstruction must be individualized to each patient in order to establish the best strategy, either surgical intervention — decompressive gastrostomy or jejunostomy, performing of ostomies and vascular stents — or a medical treatment — opioids, anticholinergics, antiemetics, and steroids. A strategy that synergically combines the different options is generally recommended, in order to achieve suitable control of the symptoms.
Introducción
La obstrucción intestinal maligna es uno de los problemas más difíciles de manejar en los pacientes con cáncer. La ausencia de estudios de buena calidad que ayuden a guiar la toma de decisiones, la pobre respuesta a los tratamientos utilizados y el mal pronóstico, con un rápido deterioro del estado general, son factores que hacen de esta patología uno de los mayores retos para el equipo de salud, con un alto impacto sobre la calidad de vida del paciente y sus cuidadores1-4.
Esta revisión se propone hacer una actualización de todos los factores epidemiológicos, clínicos y diagnósticos de esta compleja patología, además de nuevas estrategias recomendadas en su manejo y su impacto, mediante una revisión extensa de la literatura de artículos en inglés y en español, en bases de datos adscritas a Pubmed acerca de obstrucción intestinal maligna, manejo quirúrgico, manejo médico y manejo paliativo.
Definición
Una conferencia internacional de obstrucción intestinal maligna propuso ciertos criterios diagnósticos, descritos en la tabla 1, con el fin de estandarizar la definición. Tales criterios se basan en confirmar el compromiso intestinal debajo del ángulo de Treitz, asociado a neoplasia maligna5.
Epidemiología
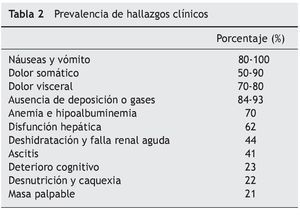
La prevalencia de la obstrucción intestinal maligna en el mundo varía entre el 3 y el 15%, dependiendo de las series revisadas. Entre el 5 y el 51% se presentan en pacientes con tumores de ovario, y del 10-28%, en pacientes con tumores gastrointestinales. Otros tumores relacionados incluyen: gástrico (6-19%), de páncreas (6-13%), de vejiga (3-10%) y de endometrio (3-11%). Por otra parte, los tumores extraabdominales son, principalmente, los de mama y el melanoma; cada uno, con el 3%.
Puede presentarse en cualquier edad y en cualquier momento durante la evolución de la neoplasia, la mayoría en fases avanzadas. La edad media de aparición es 61 años, 64% corresponde a mujeres, probablemente por la mayor prevalencia en pacientes con cáncer de ovario.
El tiempo medio entre el diagnóstico del cáncer y la obstrucción intestinal maligna es de 14 meses, pero puede ser la primera manifestación de la enfermedad tumoral en el 2% de los casos, y hasta en el 22%, en series quirúrgicas. Esta enfermedad compromete el intestino delgado en el 61% de los casos; el intestino grueso, en el 33%, y en el 20%, ambos sitios, simultáneamente. Pueden observarse múltiples niveles de obstrucción hasta en el 80% de los casos. El 25% de los casos ya han presentado episodios previos de obstrucción intestinal, y el 65% tienen diagnóstico previo de carcinomatosis peritoneal1,4,6,7.
Fisiopatología
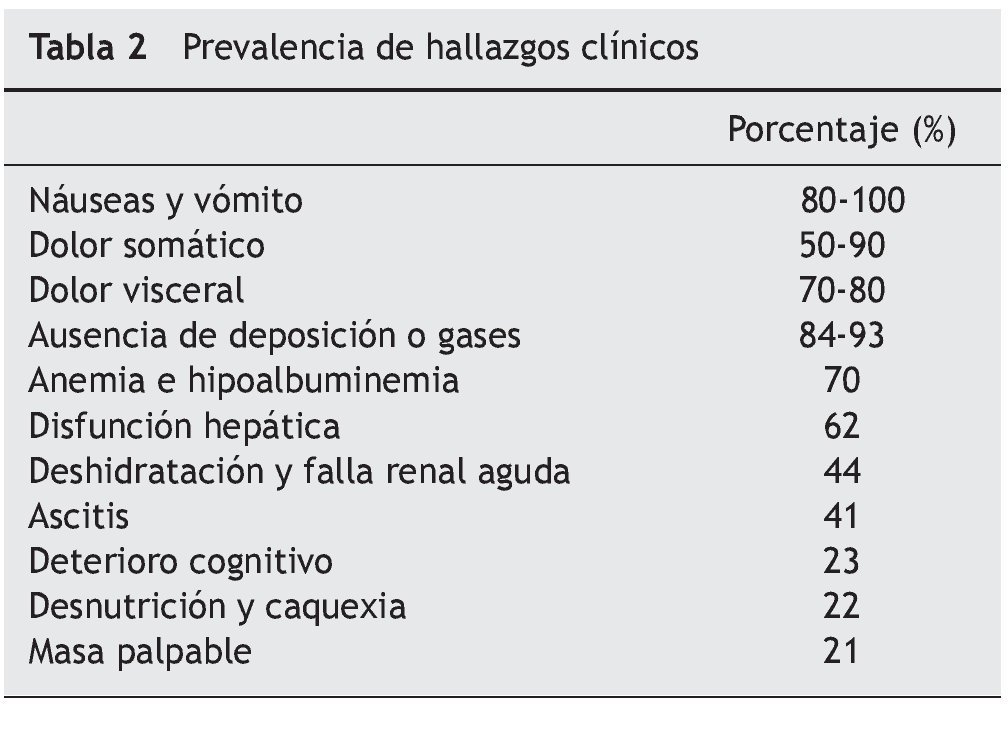
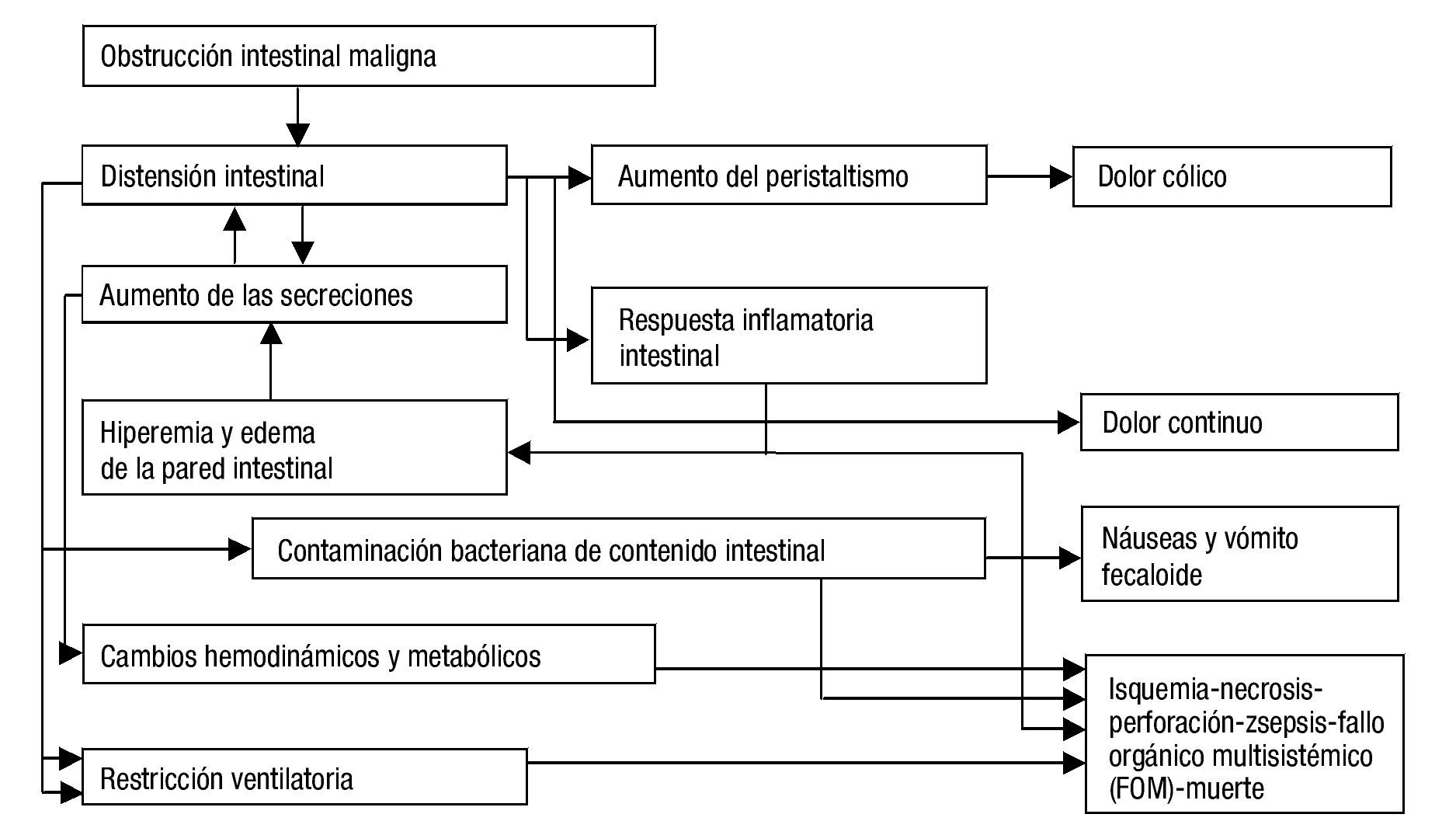
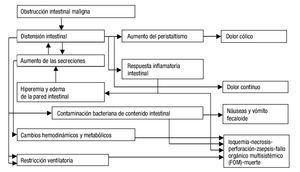
La oclusión del lumen en la obstrucción intestinal maligna altera la propulsión de su contenido, con acumulación de líquidos, secreciones no absorbidas y gases proximales al nivel de obstrucción, lo que genera distensión abdominal y dolor cólico por actividad peristáltica aumentada e incoordinada, en busca de superar el obstáculo. Como consecuencia, aumentan las secreciones intestinales biliares y pancreáticas y la secreción de cloruro de sodio y de agua, y disminuye su reabsorción, mediante liberación de 5HT3 por células enterocromafines intestinales que activan el sistema interneuronal entérico, a través de mediadores como la acetilcolina, la sustancia P, el óxido nítrico, la somatostatina, las prostaglandinas y el péptido intestinal vasoactivo. Esto genera mayor volumen y distensión luminales, vasodilatación esplácnica, con edema y mayor secreción de líquidos y activación del peristaltismo, lo que produce más péptidos nociceptivos e inflamatorios (especialmente, péptido intestinal vasoactivo), lo cual convierte este último factor en uno de los más importantes, pues mantiene este círculo vicioso de secreción, distensión y contracción, por lo que se ha convertido en un blanco terapéutico.
Las alteraciones de los mecanismos neurohumorales reguladores locales y la vasodilatación esplácnica están asociadas al secuestro de líquidos y electrolitos, y en un tercer espacio generan alteraciones orgánicas y compromiso hemodinámico. Hay, además, incremento de la flora intestinal, y ello empeora la acumulación de líquido y gases y puede originar procesos infecciosos por translocación bacteriana.
Los eventos descritos buscan, inicialmente, resolver el problema fisiológico; al no lograrse tal resolución, desencadenan un estado hipertensivo luminal, con edema, hiperemia, inflamación, daño epitelial y acumulación de líquido intestinal y de gases, que llevan a isquemia, gangrena y perforación. Todos, a su vez, se perpetúan y empeoran, y ello explica los múltiples síntomas secundarios, las alteraciones hemodinámicas, respiratorias, metabólicas, e, incluso, la muerte1,7,8. La figura 1 resume los principales eventos fisiopatológicos de la obstrucción intestinal maligna.
Figura 1. Fisiopatología de la obstrucción intestinal maligna. Fuente: Modificado de Tuca et al.6.
Clasificación
Fisiopatológicamente, la obstrucción intestinal maligna se puede clasificar así1:
1. Según su localización:
a) Proximal: colangiocarcinoma y cáncer de páncreas.
b) Distal: cáncer de ovario y de colon.
2. Según el grado de obstrucción:
a) Parcial.
b) Completa.
3. Según la alteración de la motilidad:
a) Mecánica: tumor intraluminal o intramural.
b) Funcional: compromiso del mesenterio, muscular o de los nervios de la pared intestinal.
4. Según su relación con el tratamiento:
a) Radioterapia: adherencias y daño de neuronas entéricas.
b) Quimioterapia: quimioterapia intratecal, que produce adherencias y daño del plexo mientérico.
c) Medicamentos: anticolinérgicos y simpaticomiméticos, que alteran el tránsito intestinal.
d) Cirugía: predispone a adherencias, dehiscencias y hernias incisionales.
Manifestaciones clínicas
Inician, generalmente, de forma subaguda; son determinadas por el nivel de obstrucción y pueden explicarse por los diferentes fenómenos fisiopatológicos que se desarrollan:
• Dolor nociceptivo visceral tipo cólico: debido al aumento del peristaltismo inefectivo por acumulación de líquido y de gases.
• Dolor nociceptivo somático continuo: por liberación de péptidos nociceptivos, secundaria a distensión intestinal e infiltración tumoral.
• Náuseas y vómitos: secundarios a la acumulación de líquido.
• Vómito fecaloide: generalmente, asociado al compromiso distal donde hay mayor tolerancia a la acumulación de líquido y licuefacción bacteriana de este.
• Sequedad de la boca: debida a la deshidratación y a alteraciones metabólicas.
• Ausencia de flatos y de deposiciones: síntoma típico de la obstrucción.
• Alteraciones metabólicas: asociadas a pérdida de agua y de electrolitos.
• Alteraciones hemodinámicas: por alteración del retorno venoso.
• Alteraciones respiratorias: restricción ventilatoria por elevación diafragmática.
Algunos hallazgos clínicos hacen sospechar que la afectación es, predominantemente, proximal, como el vómito abundante y poco fétido, la aparición temprana de los síntomas y la mayor intolerancia a la vía oral. Lo contrario ocurre en el compromiso distal1,4,6,7. La tabla 2 muestra la prevalencia de las principales manifestaciones clínicas.
Diagnóstico
El diagnóstico de la obstrucción intestinal parte de la evaluación clínica con la presencia de signos y síntomas altamente sensibles1.
En imágenes diagnósticas se dispone de múltiples posibilidades que requieren una evaluación cuidadosa. Los rayos X simples de abdomen muestran niveles hidroaéreos; especialmente, en obstrucciones distales. Estos recursos imagenológicos siguen siendo los más usados, debido a su disponibilidad y a su bajo costo; sin embargo, rara vez identifican el sitio de obstrucción y presentan una gran variabilidad interobservador, así como una sensibilidad y especificidad que oscila entre menos del 50 y más del 75%.
El tránsito intestinal, por otra parte, es útil en casos de pseudoobstrucción, con una sensibilidad y especificidad del 96% y el 98%, respectivamente, pero la poca tolerancia a la vía oral en estos pacientes y el riesgo de impactación del medio de contraste limitan su uso.
Una perspectiva semejante al tránsito intestinal es la que ofrece el estudio de enteroclisis. Una alternativa es el uso de gastrografin (amidotrizoato meglumina), un agente hiperosmótico; incluso, ha mostrado mejorar la obstrucción intestinal y reducir la necesidad de cirugía.
La tomografía axial computarizada (TAC) y la resonancia nuclear magnética (RNM) tienen una sensibilidad y especificidad que alcanzan el 93 y el 100%, y el 93 y el 63-100%, respectivamente. La tomografía es de elección en pacientes con historia de neoplasia o de una masa palpable, cuando la extensión es desconocida y se la considera potencialmente operable, ya que permite una buena caracterización de la lesión y aporta elementos para una adecuada planeación terapéutica1. Lesiones menores que 0,5 cm o localizadas en la pelvis, el mesenterio o el intestino delgado disminuyen su rendimiento, con un valor predictivo menor que el 20%1,4,6,9.
Los estudios endoscópicos permiten una estrategia diagnóstica con información acerca de la etiología de la obstrucción. También tienen utilidad terapéutica mediante la colocación de prótesis metálicas autoexpandibles1,9.
Manejo
En la mayoría de los casos el manejo de la obstrucción intestinal maligna no requiere una intervención emergente, y debe ser planeado con base en objetivos y expectativas claros sobre el cuidado, las posibles respuestas de los tratamientos disponibles, el estado actual, la evolución y el pronóstico de la enfermedad. De ahí la importancia de una amplia discusión de las opciones con participación del paciente y su familia en la toma de decisiones, evitando la instauración de medidas fútiles10. La terapia puede ser enfocada con intención curativa o paliativa, y ambos objetivos pueden requerir terapias tanto invasivas como no invasivas. La terapia paliativa no exime al paciente de terapias invasivas que pueden ayudar al control de los síntomas.
El manejo se basa en dos frentes principales: el manejo quirúrgico, que busca resolver el fenómeno obstructivo o descomprimir el tracto intestinal, y el manejo médico, cuyo fin es el manejo de síntomas, la nutrición, la hidratación, el dolor y la inflamación. De ahí la importancia del manejo interdisciplinario.
Siempre se debe valorar la posibilidad de un manejo quirúrgico, pues ofrece una buena respuesta inicial y una leve mejoría en la supervivencia; sin embargo, la asociación frecuente a enfermedad avanzada con gran volumen tumoral, la presencia de ascitis y de carcinomatosis peritoneal, la baja clase funcional, la edad avanzada, el deterioro nutricional, el uso de quimioterapia y de radioterapia previas, los síntomas extraabdominales y múltiples niveles de obstrucción son factores que hacen de estos pacientes pobres candidatos a cirugía, con incremento en la morbimortalidad, aun cuando sea técnicamente posible realizarla (tabla 3). Las principales complicaciones de la cirugía son: infecciones, dehiscencia, fístulas, obstrucción recurrente, sangrado gastrointestinal y eventos trombóticos7.
La evidencia disponible acerca del beneficio que ofrece la cirugía es muy baja a favor de la calidad de vida y de la supervivencia a largo plazo; incluso, la literatura muestra efectos deletéreos, comparados con los casos de pacientes no sometidos a manejo quirúrgico, y sin diferencias significativas en cuanto a la mortalidad. La cirugía debe ser recomendada para pacientes bien seleccionados, con enfermedad de lenta progresión y buen estado funcional1,3,4,6,11.
Procedimientos e intervenciones quirúrgicas
Sonda nasogástrica
La sonda nasogástrica es una medida inicial, que busca descomprimir la cavidad abdominal; en muchos casos disminuye el dolor, la distensión abdominal y el vómito, y estaría indicada en casos de supervivencia menor que un mes, enfermedad rápidamente progresiva, ascitis severa o múltiples niveles de obstrucción. Se la debe considerar una medida transitoria, pues los estudios reportan que la mayoría de los casos de resolución espontánea ocurren durante los primeros ocho días, y es una medida causante de una gran incomodidad. La sinusitis, la disfagia, la erosión mucosa, la esofagitis y la aspiración son complicaciones derivadas de su uso prolongado. Debido a la incomodidad que genera y a las tasas de respuesta obtenidas durante el control de síntomas con la terapia farmacológica e invasiva, la sonda nasogástrica es una estrategia que pasa a ser viable cuando han fallado otras opciones4,6.
Gastrostomía descompresiva
Es poco utilizada en Colombia; sin embargo, la literatura reporta tasas de éxito técnico y en control de síntomas hasta en el 90% de los casos. Se la prefiere en presencia de obstrucción proximal. La carcinomatosis peritoneal y las ascitis de grandes volúmenes son contraindicaciones relativas, pues aumentan el riesgo de complicaciones como infecciones, fístula de alto débito o ascítica, y sangrado1,11-13.
Un estudio retrospectivo por Shaw et al. evaluó los desenlaces de la gastrostomía descompresiva en pacientes con ascitis. Se realizaron 93 procedimientos en 89 pacientes. La tasa de éxito técnico fue del 72-77%, y las complicaciones, del 13,9%. Los autores concluyeron que la ascitis no es una contraindicación para realizar gastrostomía descompresiva, si bien lo ideal es manejar previamente la ascitis por medio de paracentesis14.
Yeyunostomía
Es otra alternativa para los pacientes con indicación de descompresión donde la gastrostomía no es posible. Requiere una adecuada selección de los pacientes, pues en ellos hay una mayor cantidad de secreciones, y el proceso puede generar una importante pérdida de líquidos a través de la derivación1.
Prótesis metálica autoexpandible en el tracto digestivo
Es la medida más empleada y costoefectiva cuando se busca mantener la permeabilidad del tracto digestivo; además hay facilidad y experiencia por parte de los endoscopistas en su colocación. En muchas ocasiones es eminentemente paliativa; en otras, sirve como puente previo a una estrategia invasiva para recuperar nutricionalmente a un paciente, completar una estadificación o diferir la realización de un estoma. Su principal contraindicación es la presencia de múltiples niveles de obstrucción y la sospecha de perforación y de peritonitis1,4,6,11. Las principales complicaciones de las ubicadas en el tracto digestivo superior son: reobstrucción (18% de los casos), migración (5%) y hemorragia o perforación4 (1,2%).
En el colon se observa un mayor beneficio a la altura del colon descendente, con tasas de éxito de entre el 88 y el 93%, y mejoría de los síntomas, en más del 75%; además, evita ostomías hasta en el 91%, y ofrece una menor estancia hospitalaria y bajo de riesgo de complicaciones tales como: migración (10%); obstrucción recurrente (7-10%), con una media de 24 semanas; sangrado (5%), perforación (4%; especialmente, rectosigmoides), y una mortalidad menor que el 1%. Las lesiones estenosantes a menos de 5 cm del canal anal se consideran contraindicadas, por la aparición de tenesmo e incontinencia fecal, espasmo doloroso y alta tasa de migración1,3,9,13.
Actualmente nuevas prótesis metálicas autoexpandibles con membrana recubierta han mostrado, por ejemplo, en un metaanálisis hecho por Zhang et al., disminución del crecimiento tumoral intraprótesis, pero también, una mayor migración y un menor tiempo de permeabilidad, comparado con los no recubiertos15. El láser, el argón plasma, la colocación de un nuevo estent en el mismo sitio y la cirugía son estrategias para manejar la reobstrucción1,3,4,6,11,12.
Jeurnik el al. hicieron una revisión sistemática comparando gastroyeyunostomía vs. colocación de prótesis metálica autoexpandible. De los pacientes estudiados, 1046 tuvieron prótesis duodenal, y 297, gastroyeyunostomía. El éxito técnico fue del 96 y el 100%, respectivamente. Las complicaciones tempranas y tardías fueron similares, así como la persistencia de síntomas. El éxito clínico inicial fue mayor en los pacientes con prótesis autoexpandible (89 vs. 72%), y la estancia hospitalaria, menor (7 días vs. 13 días), pero la recurrencia de síntomas obstructivos fue más común (18 vs. 1%), y la supervivencia fue menor (105 días vs. 164 días). No se descarta sesgo en cuanto al hecho de que mientras más enfermos los pacientes, son menos candidatos a cirugía16.
Bypass quirúrgico y ostomías
Intervenciones como el bypass quirúrgico y las ostomías han mostrado tasas de morbimortalidad comparables. Ambas requieren condiciones adecuadas por parte de los pacientes, dada la posibilidad de riesgos asociados a cirugías mayores, y se las reserva para pacientes con buen estado funcional, enfermedad de lenta progresión y supervivencia mayor que dos meses5,17.
Terapia con láser
La terapia con láser ha sido utilizada en lesiones colorrectales; requiere tecnología y experiencia, además de condiciones adecuadas por parte de los pacientes y procedimientos repetidos para mantener la permeabilidad. Dos estudios evaluaron la terapia laser; del 52-89% de ellos obtuvieron paliación completa/buena y una supervivencia media de 8,5 meses18,19.
Cirugía laparoscópica
Ha ido convirtiéndose en una buena alternativa, dependiendo de la experiencia del cirujano, y del enfoque diagnóstico y terapéutico para estos pacientes, con menos dolor, menor estancia hospitalaria y menor deterioro funcional. Tiene las mismas indicaciones para llevar un paciente a una cirugía abierta, pero puede ofrecer menos morbimortalidad en pacientes seleccionados. La carcinomatosis extensa y las adherencias, muy comunes en estos pacientes, los hace pobres candidatos y con alto riesgo de evolucionar a un procedimiento abierto. Hay pocos reportes sobre cirugía laparoscópica paliativa20.
Intervenciones farmacológicas
Los medicamentos utilizados para manejar la obstrucción intestinal maligna se basan en los principales fenómenos fisiopatológicos. La tabla 4 muestra los medicamentos recomendados para las principales manifestaciones en pacientes con obstrucción intestinal maligna.
Hay dos tipos de dolor en el paciente con obstrucción intestinal maligna: uno es el dolor de tipo nociceptivo somático continuo, que se maneja con opioides potentes como morfina, hidromorfona o fentanilo, titulados individualmente hasta obtener un control adecuado; se utilizan las rutas intravenosa, subcutánea, sublingual y transdérmica. Los estudios no han mostrado que el uso de opioides impacte negativamente la tasa de resolución de la obstrucción intestinal; sin embargo, el fentanilo y la metadona tienen un mejor perfil sobre los receptores intestinales, y algunos autores los recomiendan. Un segundo tipo de dolor es el dolor visceral de tipo cólico intermitente; requiere medicamentos anticolinérgicos como butilbromuro de hioscina o butilbromuro de escopolamina, con efecto periférico y central y periférico, respectivamente1; esta última medicina no se encuentra disponible en el medio colombiano.
Las náuseas y los vómitos son síntomas que causan una marcada incomodidad. El medicamento ideal para este tipo de pacientes es el haloperidol, que tiene un efecto antidopaminérgico D2 central y menos efectos anticolinérgicos, y disminuye la incidencia de delirium.
La metoclopramida tiene efectos antidopaminérgicos centrales y periféricos; es un agonista 5HT4, lo que le da propiedades proquinéticas, y se la debe evitar en pacientes con obstrucción intestinal completa. Tiene potencial deliriogénico y efectos en el sistema nervioso central (efectos extrapiramidales, como parkinsonismo, rigidez, temblor y distonía)
Otras opciones viables en pacientes que no responden a las otras terapias antieméticas mencionadas incluyen: fenotiazinas, con efecto antidopaminérgico central; antagonistas 5HT3: ondansetrón y granisetrón (este último, con mejores tasas de respuesta), bien tolerados, y con la cefalea, el vértigo y la constipación como sus efectos adversos más comunes; y Olanzapina, que tiene efectos anti-dopaminérgicos D2, antihistamínicos H1, anticolinérgicos y antiserotoninérgicos HT3, y puede ser utilizada por vía sublingual1,4,6.
El aumento de secreciones intestinales contribuye al dolor y la persistencia de náuseas y vómitos. Anticolinérgicos como los mencionados para el manejo del dolor tipo cólico también desempeñan un papel en disminuir las secreciones intestinales, al ligarse a receptores muscarínicos de neuronas entéricas en los plexos mientérico y submucoso.
El glicopirrolato es un anticolinérgico amonio cuaternario con mínimos efectos deliriogénicos y cardíacos, y escasa penetración al sistema nervioso central, comparado con otros medicamentos del mismo tipo; además, se lo considera de elección en estos casos, pero no está disponible en Colombia. La Ranitidina y los inhibidores de bomba de protones son útiles a la hora de reducir las secreciones gástricas; la ranitidina, además, mostró una calidad superior en un metaanálisis reciente4,6.
Octreotide es un análogo de la somatostatina. Bloquea la liberación del péptido intestinal vasoactivo, de secretina, de gastrina, de motilina y de polipéptido pancreático; además, inhibe la neurotransmisión de fibras nerviosas del tracto intestinal. Por otra parte, reduce la secreción de cloruro de sodio y de agua hacia el lumen y aumenta su absorción; también reduce la secreción de enzimas pancreáticas y el flujo sanguíneo esplácnico, lo cual disminuye el contenido del lumen intestinal, la motilidad y la congestión vascular de la pared intestinal1,9,11. Igualmente, tiene efectos endocrinos, inhibe la secreción de prolactina, de insulina, de glucagón, de ACTH y de tirotropina20.
En un metaanálisis, Mercadante et al. (2009) evaluaron la eficacia del uso de octreotide en comparación con hioscina butilbromuro. Se demostró una respuesta superior con octreotide en control de secreciones gastrointestinales y síntomas como náuseas, vómito y dolor abdominal8. Recientemente, en un nuevo metaanálisis con 15 estudios, los mismos autores hallaron tasas de respuesta total de entre el 60% y el 90%, así como una mayor y más rápida eficacia con el uso de octreotide, comparado con escopolamina butilbromuro, y efectividad en disminuir el drenaje por sonda nasogástrica, e, incluso, en diferir su utilización21.
Estudios con octreotide de liberación prolongada (octreotide LAR) fase II y fase III reportaron superioridad de este respecto al placebo en pacientes con obstrucción intestinal maligna y carcinomatosis peritoneal22,23. Sin embargo, Mercadante anota que faltan estudios comparativos con octreotide convencional y claridad en cuanto a las dosis21.
Un metaanálisis de Cochrane compara el tratamiento médico vs. el tratamiento quirúrgico en pacientes con obstrucción intestinal maligna y cáncer de ovario. Solo hubo un estudio relevante con 47 pacientes. El 76% de los que recibieron manejo quirúrgico toleraron la vía oral posteriormente, comparados con el 30% de los pacientes en el grupo de octreotide. Todos los pacientes con octreotide, excepto uno, mejoraron el síntoma, en episodios de vómito. La supervivencia fue significativamente mejor en los pacientes con manejo quirúrgico, pero la magnitud de este efecto no fue reportado, lo cual hace difícil asegurar que el beneficio se relacione directamente con la intervención realizada, y no con otros factores, como el estado funcional24.
Dos estudios japoneses prospectivos evaluaron la efectividad de octreotide en la obstrucción intestinal maligna en pacientes con malignidad ginecológica. La tasa de respuesta total fue del 81%, con base en el control del vómito total o parcial. En pacientes en quienes no se utilizó sonda nasogástrica la respuesta fue del 92%, comparada con el 62% en quienes sí se utilizó. Se logró disminuir el drenaje por la sonda nasogástrica en todos los pacientes. Hubo mejoría en la calidad de vida del 56%; un beneficio que se mantiene, independientemente de factores como el sexo, la escala Karnofsky, la presencia de ascitis, la ruta de infusión, la medicación coadministrada o el estado de hidratación. Los autores concluyen que la respuesta con octreotide es mayor en las neoplasias ginecológicas que en las gastrointestinales, y debe ser una medida de primera línea en estos pacientes25,26.
Los esteroides son otra medida terapéutica; disminuyen el edema de la pared intestinal y el peritumoral, y evidencian efectos antieméticos y analgésicos adyuvantes. Algunos estudios han mostrado respuesta favorable en cuanto a mejorar la obstrucción intestinal y la supervivencia, comparados con el placebo, pero hay muchos factores de confusión al evaluarse los resultados. La recomendación es mantener esquemas de 5-7 días y evaluar la respuesta; estos son de buena tolerancia y de mínimos efectos adversos cuando se los usa por cortos periodos1,4,6,8.
Los autores de un metaanálisis de Cochrane acerca del uso de esteroides para resolver la obstrucción intestinal maligna en cáncer avanzado ginecológico y gastrointestinal concluyen que hay una tendencia a favor del uso de esteroides para mejorar la obstrucción intestinal maligna. No se demostró impacto en la mortalidad27.
El amidotrizoato, un medio de contraste hiperosmolar soluble en agua, y utilizado en Europa, promueve la salida de líquido hacia el lumen intestinal, diluye el contenido intestinal, disminuye el edema de pared y aumenta la presión en el sitio obstruido, lo cual, a su vez, facilita el paso a través de un lumen más estrecho. Al contrario del bario, su uso no es riesgoso2.
Definitivamente, se requiere el uso combinado de medicamentos con distintos mecanismos de acción y sinergismo para un adecuado control de síntomas, con reporte de tasas de éxito hasta del 80%4,6,28.
Es importante una vía adecuada de administración. La ruta subcutánea es una excelente alternativa para administrar líquidos y medicamentos cuando hay intolerancia oral1,2. En un estudio prospectivo de Mercadante et al. 15 pacientes, considerados no candidatos a cirugía, recibieron terapia farmacológica agresiva temprana, metoclopramida 60 mg/ día, dexametasona 12 mg/día, octreotide 0,3 mg/día en infusión continua, y amidotrizoato 50 ml en un bolo oral. Los analgésicos utilizados fueron morfina o fentanilo. Todos los pacientes, excepto uno, mejoraron el tránsito intestinal al cabo de entre 1 y 5 días, sin efectos adversos relacionados con la medicación. La estancia hospitalaria media fue de 6,4 días, y la supervivencia, de 44,9 días2.
Porzio et al. evaluaron la posibilidad de manejo médico en casa. En 11 pacientes se aplicó el esquema utilizado por Mercadante, exceptuando el amidotrizoato. Todos alcanzaron un buen control de síntomas y resolución de la obstrucción entre uno y cinco días, en promedio. Ninguno requirió sonda nasogástrica ni nutrición parenteral29.
Hidratación
Es importante tener en cuenta el alto índice de deshidratación y de alteraciones electrolíticas asociadas al aumento de secreciones, el vómito, las pérdidas insensibles y la formación de tercer espacio en estos pacientes, y siempre deben mantenerse buenos cuidados de la cavidad oral y una hidratación adecuada, pero sobrehidratar al paciente puede generar sobrecarga de volumen y aumentar la producción de secreciones intestinales. Se recomienda entre 1,5-2 litros/día1,7.
Nutrición
Debe definirse la mejor vía de alimentación, según las condiciones del paciente y su enfermedad neoplásica. La nutrición parenteral total es una intervención invasiva; existe mucha discusión sobre su impacto en la supervivencia y la calidad de vida, incluyendo el punto de vista ético. No hay estudios de alta calidad metodológica que permitan resolver plenamente tal duda; por lo tanto, se requiere una valoración estrecha del paciente, de sus condiciones clínicas y de su expectativa de vida, así como objetivos de manejo claros, antes de tomar una decisión para su uso en pacientes con neoplasias avanzadas1,6.
Algunos estudios no han mostrado impacto en la supervivencia, la clase funcional ni la calidad de vida de estos pacientes. Objetivamente, a través de medir parámetros de control nutricional solo han demostrado que se mantiene la estabilidad nutricional hasta los tres meses previos a la muerte. Por el contrario, se adicionan morbilidad por infecciones, alteraciones electrolíticas y metabólicas, y riesgo de trombosis1.
Chermest et al. compararon el curso de pacientes con alteraciones gastrointestinales de origen maligno que recibieron nutrición parenteral vs. alteraciones de origen no maligno. El 82% de los pacientes con nutrición parenteral sobrevivieron más de un mes, pero con una tasa mayor de complicaciones (25%) que los pacientes con alteraciones de origen no maligno30. Duerksen, en cambio, reportó una mejoría en la supervivencia de 26 hasta 433 días en dos pacientes, y una mejor respuesta a regímenes de quimioterapia y cirugía31.
Orrevall et al. también hallaron que la nutrición parenteral proporciona una sensación de seguridad y alivio para el paciente y su familia, pues sienten que se están cubriendo las necesidades nutricionales, y ello redundó en una mejor evaluación de la calidad de vida, el peso, el nivel de energía y la actividad. Desventajas: restricción de la movilidad y del contacto social, pero el riesgo/beneficio favoreció la nutrición parenteral32.
La Sociedad Europea de Nutrición Clínica y Metabolismo definió que los pacientes con patología oncológica no quirúrgica que se benefician de la nutrición parenteral son los de expectativa de vida superior a tres meses33.
El uso rutinario de la nutrición parenteral no es recomendado, y se lo reserva para pacientes sometidos a cirugías mayores, con estado funcional y posibilidades de terapia sistémica, y expectativa de supervivencia superior a tres meses3,4,6.
No hay ningún substituto para medidas como el juicio clínico e interrogarse sobre la relación riesgo/beneficio, la expectativa de vida y los objetivos terapéuticos; además, es muy importante la comunicación con el paciente y su familia32, y entender la decisión de instaurar la nutrición parenteral total (NPT) como una conducta médica con las mismas implicaciones de otra intervención, una estrategia ante una pregunta casi infaltable: «¿No podré volver a comer?»34.
Desde el punto de vista ético, «la nutrición y la hidratación son consideradas siempre medidas proporcionadas, aun en pacientes con enfermedades terminales»; está reportado que no afectan la supervivencia de los pacientes, aunque ello debe ser definido de manera individualizada1.
Pronóstico
Puede presentarse resolución espontánea en el 38% de los casos (la mayoría, durante los primeros 8 días), pero la tasa de recurrencia alcanza el 60%. No hay evidencia sobre la utilidad de recomendaciones para mantener la permeabilidad intestinal y evitar la recurrencia; algunos sugieren la utilidad de una dieta baja en residuos, evitar los laxantes osmóticos y el uso de octreotide a largo plazo4,6.
Un estudio prospectivo, conducido por el Instituto Catalán de Cáncer, siguió a 100 pacientes con obstrucción intestinal maligna inoperable, para identificar factores relacionados con la posibilidad o no de resolución espontánea. Se halló una supervivencia media de 12 días para pacientes que no tienen resolución espontánea, en comparación con 57 días para los que tienen resolución completa.
La intolerancia completa a la dieta confiere un peor pronóstico. Un análisis multivariado reveló que los factores más relevantes que influyen en la no resolución de la obstrucción intestinal maligna son: alteración cognitiva, caquexia, disnea en reposo, tumor abdominal palpable, falla hepática, obstrucción superior y deshidratación4.
La edad superior a los 65 años, el ASA mayor que 2 y la desnutrición son factores de mal pronóstico, con un OR para mortalidad quirúrgica en pacientes con cáncer de colon de 1,8 por cada diez años arriba de este límite de edad, 3,3 y 3 respectivamente. La ascitis superior a 3 litros, las masas palpables, la quimioterapia y la radioterapia previas se asocian a una mayor tasa de complicaciones y mortalidad quirúrgica3,4,6. Wing-Chi et al. encontraron que la experiencia del cirujano también tiene influencia pronóstica en los desenlaces postoperatorios35.
En general, la supervivencia oscila entre los 30 y los 90 días. En series quirúrgicas la supervivencia es del 50% a 6 meses (3-8 meses), incluyendo a pacientes con cirugía paliativa. Comparativamente, mediante el manejo médico, la mediana de supervivencia en casos de obstrucción intestinal maligna inoperables es de un mes, y la supervivencia a 6 meses, del 8%. Sin embargo, debe tenerse en cuenta que la mejor supervivencia en pacientes quirúrgicos puede estar influenciada por un diagnóstico más temprano y un mejor estado funcional que permita una intervención4,6.
Henry et al. realizaron entre 2000 y 2007 un estudio retrospectivo en 523 pacientes con obstrucción intestinal maligna, para identificar factores asociados a una mayor mortalidad y factores que pudieran identificar a los pacientes que se beneficiaran del manejo quirúrgico. En los análisis multivariados, la ascitis, la carcinomatosis y la hipoalbuminemia fueron predictores de mortalidad a 30 días, y de pobre supervivencia global. El tumor de origen neuroendocrino y la cirugía fueron asociados a una mejor supervivencia. Con base en dichos factores, se elaboró un score pronóstico con 5 factores: ascitis, carcinomatosis, hipo albuminemia, obstrucción completa del intestino delgado y leucocitosis. La presencia de 4-5 factores hace aconsejables estrategias eminentemente paliativas. En cuanto a la decisión de cirugía, se elaboró otro score con 4 factores: albumina, carcinomatosis, cáncer no ginecológico y leucocitosis. Mientras menos factores hubo de por medio, mayor fue el beneficio de la cirugía36.
Conclusión
Ante la obstrucción intestinal maligna, la ciencia médica sigue enfrentado una patología de severidad compleja, que exige constantemente al equipo médico, y que genera angustia, malestar y alteraciones en la calidad de vida para el paciente y su núcleo familiar, con un pronóstico muy sombrío. Aún no hay estudios contundentes que permitan protocolos para el manejo de esta dolencia con base en la respuesta clínica y el impacto en calidad de vida.
Es realmente difícil hacer estudios de buena calidad en este tipo de pacientes, dada la dificultad de un reclutamiento adecuado, una esperanza de vida corta y las dificultades éticas para el uso de grupos control8. Sin embargo, cabe reconocer que medicamentos como el octreotide, cuyo alto costo lo mantiene como medicación de segunda o de tercera línea, cada día gana mayor importancia, y debe ser tenido en cuenta de manera más temprana en el manejo de estos pacientes.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Recibido el 31 de enero de 2013;
aceptado el 21 de mayo de 2013
* Autor para correspondencia.
Correo electrónico:
jolica@hotmail.com (J. Cárdenas).